|
|
(21), (22) Заявка: 2006121111/13, 16.06.2006
(24) Дата начала отсчета срока действия патента:
16.06.2006
(46) Опубликовано: 10.02.2008
(56) Список документов, цитированных в отчете о
поиске:
RU 2261866, 10.10.2005..
Адрес для переписки:
117997, Москва, ГСП-7, В-437, ул. Миклухо-Маклая, 16/10, ИБХ РАН, патентный отдел
|
(72) Автор(ы):
Баландин Сергей Владимирович (RU),
Кокряков Владимир Николаевич (RU),
Овчинникова Татьяна Владимировна (RU)
(73) Патентообладатель(и):
Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова Российской Академии Наук (RU)
|
(54) СПОСОБ ПОЛУЧЕНИЯ АНТИМИКРОБНОГО ПЕПТИДА АРЕНИЦИНА
(57) Реферат:
Способ по изобретению касается получения пептида ареницина, обладающего антимикробной активностью. Полученный пептид аналогичен пептиду, выделенному из кольчатого червя Arenicola marina, и может найти применение в медицинской и ветеринарной практике в качестве антибиотика широкого спектра действия. Способ предусматривает культивирование рекомбинантного штамма-продуцента Escherichia coli BL21(DE3)/pE-His8-TrxL-Ar2 в питательной среде, с последующим разрушением полученных клеток, выделением телец включения, содержащих гибридный белок His8-TrxL-Ar2. Затем полученный гибридный белок очищают методом металло-хелатной хроматографии, солюбилизируют и расщепляют бромцианом в кислой среде по остатку метионина. Далее продукты реакции разделяют и подвергают окончательной очистке ареницина методом обращенно-фазовой ВЭЖХ. Использование изобретения позволит расширить арсенал антимикробных препаратов широкого спектра действия и сделать производство ареницина более высокотехнологичным. 1 табл., 1 ил.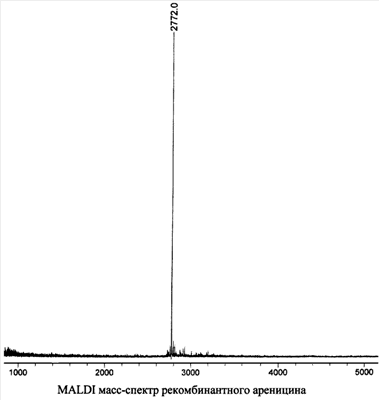
Изобретение относится к области биотехнологии, а именно к получению генно-инженерного ареницина – антимикробного пептида кольчатого червя Arenicola marina, который может найти применение в медицинской и ветеринарной практике в качестве антибиотика широкого спектра действия.
Ареницин является эндогенным антибиотиком беспозвоночного Arenicola marina (пескожил морской), относящегося к классу Polychaeta (многощетинковые) типа Annelida (кольчатые черви) [пат. РФ №2261866, С07К 14/435, А61Р 31/04, 2005]. Молекула ареницина представляет собой немодифицированную пептидную цепь, содержащую 21 аминокислотный остаток и стабилизированную одной дисульфидной связью, замыкающей цикл из 18 аминокислотных остатков. Ареницин вырабатывается целомоцитами (фагоцитирующими клетками целома червя) и обладает антибактериальной и противогрибковой активностью. Механизм действия ареницина предположительно состоит в избирательном нарушении барьерной функции клеточных мембран патогенных микроорганизмов, не затрагивающем мембраны клеток организма-хозяина. Ареницин является представителем принципиально нового семейства антимикробных пептидов и может найти применение в качестве антибиотика широкого спектра действия.
Изобретение решает задачу расширения ассортимента антимикробных пептидов и получения антимикробного пептида ареницина.
Поставленная задача решается за счет культивирования штамма-продуцента, индукции синтеза рекомбинантного белка, разрушения клеток, отделения нерастворимой фракции клеточного белка, аффинной очистки гибридного белка His8-TrxL-Ar2 с помощью металло-хелатной хроматографии, его солюбилизации и расщепления бромцианом в кислой среде по остатку метионина, разделения продуктов реакции и окончательной очистки ареницина методом обращенно-фазовой ВЭЖХ.
Для получения гибридного белка, содержащего ареницин, используют новый штамм бактерии Escherichia coli BL21(DE3)/pE-His8-TrxL-Ar2. Данный штамм-продуцент получают путем трансформации компетентных клеток Escherichia coli штамма BL-21(DE3) плазмидой pE-His8-TrxL-Ar2, состоящей из BglII/XhoI-фрагмента ДНК, содержащего промотор транскрипции Т7-РНК-полимеразы, участок связывания рибосомы и последовательность гибридного полипептида His8-TrxL-Ar2, содержащего гистидиновый октамер, модифицированный тиоредоксин A (M37L) и ареницин, и BglII/XhoI-фрагмента ДНК плазмиды рЕТ20b(+), содержащего терминатор транскрипции Т7-РНК-полимеразы, сайт инициации репликации и ген  -лактамазы, детерминирующий устойчивость трансформированных плазмидой pE-His8-TrxL-Ar2 клеток Escherichia coli к ампициллину. Биосинтез продукта проводят следующим образом: клетки штамма BL21(DE3)/pE-His8-TrxL-Ar2 выращивают в богатой среде (например, LB) с добавлением 100-200 мкг/мл ампициллина до достижения культурой оптической плотности OD600 0,5-1,0 при температуре 37°С, ступенчато увеличивая объем культуральной жидкости путем последовательных пересевов материала, после чего индуцируют синтез белка изопропил- -лактамазы, детерминирующий устойчивость трансформированных плазмидой pE-His8-TrxL-Ar2 клеток Escherichia coli к ампициллину. Биосинтез продукта проводят следующим образом: клетки штамма BL21(DE3)/pE-His8-TrxL-Ar2 выращивают в богатой среде (например, LB) с добавлением 100-200 мкг/мл ампициллина до достижения культурой оптической плотности OD600 0,5-1,0 при температуре 37°С, ступенчато увеличивая объем культуральной жидкости путем последовательных пересевов материала, после чего индуцируют синтез белка изопропил- -D-галактозидом в концентрации 0,1-1,0 мМ или лактозой и растят еще 5-6 часов при температуре 25-30°С. Увеличение выхода рекомбинантного белка может быть достигнуто с помощью принудительной аэрации культуральной жидкости и использования обогащенных питательных сред (например, с добавлением глюкозы). -D-галактозидом в концентрации 0,1-1,0 мМ или лактозой и растят еще 5-6 часов при температуре 25-30°С. Увеличение выхода рекомбинантного белка может быть достигнуто с помощью принудительной аэрации культуральной жидкости и использования обогащенных питательных сред (например, с добавлением глюкозы).
Получение из клеток продуцента гибридного белка His8-TrxL-Ar2 включает следующие стадии: отделение бактерий от культуральной среды с помощью центрифугирования, их разрушение одним из обычно применяемых способов (ультразвуковой дезинтеграцией, химическим лизисом с использованием детергентов и хаотропных агентов), отмывку буферными растворами телец включения от водорастворимых компонентов клетки, солюбилизацию телец включения и очистку гибридного белка с помощью металло-хелатной хроматографии в денатурирующих условиях.
Тельца включения, полученные после дезинтеграции биомассы, обрабатывают по следующей схеме:
1. Тельца включения подвергают двукратной отмывке 50 мМ фосфатным буфером (рН 7,8) или 25 мМ трис-HCl буфером (рН 8,1).
2. Отмытые тельца включения растворяют в 100 мМ фосфатном буфере (рН 7,8) или 50 мМ трис-HCl буфере (рН 8,1), содержащем 6 М гуанидин-HCl и 10 мМ имидазол. Осадок отделяют центрифугированием.
3. Раствор, содержащий целевой гибридный белок, подвергают аффинной хроматографии на смоле с хелатированными ионами Ni2+ или Со2+. В качестве промывочного раствора используют 100 мМ фосфатный буфер (рН 7,8) или 50 мМ трисовый буфер (рН 8,1), содержащий 6 М гуанидин-HCl и 10 мМ имидазол. В качестве элюирующего раствора используют буфер, содержащий 6 М гуанидин-HCl и 0,5 М имидазол.
4. Фракцию элюата, содержащую гибридный белок His8-TrxL-Ar2, подвергают диализу против деионизированной воды при температуре 4°С в течение 12-18 ч. Выпавший осадок собирают и лиофильно высушивают.
5. Навеску очищенного His8-TrxL-Ar2 растворяют в 80% трифторуксусной кислоте, либо в 70% муравьиной кислоте, либо в 6 М гуанидине-HCl с добавлением 0.1 М HCl и добавляют равную массу бромциана. Реакционную смесь инкубируют в темноте 16-20 ч при температуре 20-25°С. Реакцию останавливают добавлением трех-пятикратного объема воды, после чего упаривают образец под вакуумом при температуре 37°С. Процедуру добавления воды и упаривания повторяют не менее трех раз.
6. Навеску продуктов реакции растворяют в 10% ацетонитриле с добавлением 0,1% трифторуксусной кислоты и подвергают очистке методом обращенно-фазовой ВЭЖХ в градиенте концентрации ацетонитрила. Фракцию, содержащую ареницин, лиофильно высушивают.
7. При необходимости может быть проведена дополнительная очистка целевого продукта методом ВЭЖХ.
8. Идентичность рекомбинантного ареницина природному пептиду устанавливают методами ПААГ-электрофореза в трис-трициновой системе, MALDI-времяпролетной масс-спектрометрии, секвенированием N-концевой аминокислотной последовательности по методу Эдмана, а также сравнительным тестированием антимикробной активности методом серийных разведении в жидкой питательной среде. Степень очистки ареницина определяют методами ПААГ-электрофореза в трис-трициновой системе и MALDI-времяпролетной масс-спектрометрии.
Изобретение иллюстрирует пример.
Пример.
Получение ареницина.
Культивирование клеток штамма-продуцента Escherichia coli BL21(DE3)/pE-His8-TrxL-Аr2 проводят следующим образом.
Клетки штамма BL21(DE3)/pE-His8-TrxL-Ar2 выращивают в жидкой среде LB с добавлением 150 мкг/мл ампициллина и 1% глюкозы до достижения культурой оптической плотности OD600 1,0 при температуре 37°С. Индукцию синтеза белка проводят с помощью изопропил- -D-галактозида в концентрации 1,0 мМ, после чего инкубируют 5 часов при температуре 30°С. -D-галактозида в концентрации 1,0 мМ, после чего инкубируют 5 часов при температуре 30°С.
После окончания ферментации клетки продуцента гибридного белка (биомассу) отделяют центрифугированием при 4000 g в течение 10 мин, ресуспендируют в лизирующем буфере (100 мМ Na2HPO4/NaH2PO4 (рН 7,8), 0,5 М NaCl, 1% Triton X-100) и разрушают с помощью ультразвукового гомогенизатора. Все работы по выделению гибридного белка проводят при температуре 4°С. Нерастворимую фракцию клеточного белка (тельца включения), содержащую гибридный белок, отделяют центрифугированием. Тельца включения дважды ресуспендируют в 50 мМ фосфатном буфере (рН 7,8) и центрифугируют.
Отмытые тельца включения растворяют в концентрации 20 мг/мл в 100 мМ фосфатном буфере (рН 7,8), содержащем 6 М гуанидин-HCl и 10 мМ имидазол. Осадок отделяют центрифугированием. Супернатант наносят на предварительно уравновешенную колонку с Ni-NTA агарозой (Qiagen) из расчета 1 г суммарного белка на 100 мл смолы. Колонку промывают 100 мМ фосфатным буфером (рН 7,8), содержащим 6 М гуанидин-HCl и 10 мМ имидазол. Фракцию, обогащенную рекомбинантным белком, элюируют 100 мМ фосфатным буфером (рН 7,8), содержащим 6 М гуанидин-HCl и 0,5 мМ имидазол, и подвергают диализу против 100 объемов деионизированной воды при температуре 4°С в течение 18 ч через диализную мембрану, удерживающую молекулы с массой более 1 кДа. Выпавший осадок собирают и лиофильно высушивают.
Анализ фракций, а также степень чистоты гибридного белка на разных стадиях выделения определяют с помощью ПААГ-электрофореза в трис-трициновой буферной системе и методом MALDI-времяпролетной масс-спектрометрии.
Навеску очищенного гибридного белка растворяют в 80% трифторуксусной кислоте в концентрации 2%, добавляют равную массу бромциана (1 г бромциана на 1 г белка) и выдерживают при температуре 25°С в защищенном от света месте при постоянном встряхивании в течение 20 ч. Реакцию останавливают добавлением пятикратного объема деионизированной воды, после чего упаривают образец при 37°С. Процедуру добавления воды и упаривания повторяют трижды.
Навеску продуктов реакции растворяют в концентрации 10 мг/мл в 10% ацетонитриле с добавлением 0,1% трифторуксусной кислоты. В данных условиях полностью растворяются как искомый пептид, так и нерасщепленный гибридный белок и белок-носитель. Нерастворимый осадок отделяют центрифугированием и отбрасывают. Разделение продуктов реакции расщепления и очистку ареницина проводят с помощью обращенно-фазовой ВЭЖХ на препаративных колонках в системе, состоящей из буфера А (5% ацетонитрил, 0,1% ТФУ) и буфера В (80% ацетонитрил, 0,1% ТФУ). Ареницин элюируют линейным градиентом буфера В от 10 до 40%. Детектирование ведут при длине волны 214 нм. Фракцию элюата, соответствующую ареницину, собирают и лиофильно упаривают. Выход ареницина с чистотой не менее 99%, полученного заявленным способом (без использования ферментера), составляет не менее 5 мг/л культуры.
Аминокислотная последовательность полученного пептида идентична природному ареницину (Arg1-Trp2-Cys3-Val4-Tyr5-Ala6-Tyr7-Val8-Arg9-Ile10-Arg11-Gly12-Val13-Leu14-Val15-Arg16-Tyr17-Arg18-Arg19-Cys20-Trp21). Для определения N-концевой аминокислотной последовательности ареницина применяют автоматическое микросеквенирование на приборе Precise 491 cLC Protein Sequencing System (Applied Biosystems, США). Идентификацию фенилтиогидантоин-производных аминокислот проводят на анализаторе 120А РТН Analyzer (Applied Biosystems, США). В основе методики автоматического определения аминокислотной последовательности пептидов и белков лежит метод химической деградации полипептидной цепи по методу Эдмана, позволяющему последовательно отщеплять N-концевые аминокислотные остатки в виде фенилтиогидантоинов и идентифицировать отщепленные производные аминокислот методом обращенно-фазовой высокоэффективной жидкостной хроматографии. В результате автоматического микросеквенирования установлена полная идентичность аминокислотных последовательностей генно-инженерного и природного ареницина.
Для определения молекулярной массы ареницина используют MALDI (matrix-assisted lazer desorption ionization) масс-спектрометрический анализ на приборе VISION 2000 (ThermoBioAnalysis, OK). В качестве матрицы используют 0,15 М 2,5-дигидроксибензойную кислоту в смеси, содержащей 25% метанол и 0,1% трифторуксусную кислоту. Образец облучают УФ-лазером с длиной волны 337 нм и максимальной энергией 250 мкДж в импульсном режиме с частотой 3 нс. При масс-спектрометрическом исследовании ареницина (мощность лазера – 45%, число лазерных ударов – 69) получен пик с m/z 2772 (см. чертеж), соответствующий молекулярному иону природного ареницина (расчетная молекулярная масса составляет 2772,35 Да).
Антимикробную активность ареницина определяют методом радиальной диффузии пептидов в агарозном геле с тест-культурой микроорганизма, позволяющим оценивать микробицидную активность, расходуя минимальное количество препарата. Для определения антимикробной активности отдельных фракций полипептидов используют культуры следующих микроорганизмов: Escherichia coli, штамм ML-35p (грамотрицательная бактерия); Listeria monocytogenes, штамм EGD (грамположительная бактерия); Candida albicans (гриб класса аскомицетов). Антимикробное действие выделенных пептидов фиксируют через 24 часа по наличию зон ингибирования роста тест-культуры (таблица 1). Показано, что генно-инженерный и природный ареницины в количестве 1 мкг проявляют микробицидную активность в отношении всех трех микробов. Действие обоих пептидов в отношении грамположительных и грамотрицательных бактерий, а также их противогрибковая активность практически одинаковы. Так, например, минимальная ингибирующая концентрация как природного, так и рекомбинантного пептида в отношении E.coli составляет 25 мкг/мл.
| Таблица 1. |
| Антимикробное действие генно-инженерного и природного ареницина |
| Тест-микроорганизмы |
Ареницин |
| генно-инженерный |
природный |
| Грамположительная бактерия Listeria monocytogenes, штамм EGD |
+ |
+ |
| Грамотрицательная бактерия Escherichia coli, штамм ML-35p |
+ |
+ |
| Гриб класса аскомицетов Candida albicans |
+ |
+ |
Формула изобретения
Способ получения антимикробного пептида ареницина, включающий культивирование рекомбинантного штамма-продуцента Escherichia coli BL21(DE3)/pE-His8-TrxL-Ar2 в питательной среде, разрушение полученных клеток, выделение телец включения, содержащих гибридный белок His8-TrxL-Аr2, очистку гибридного белка методом аффинной хроматографии, его солюбилизацию и расщепление бромцианом в кислой среде по остатку метионина, разделение полученных продуктов реакции и очистку целевого продукта методом обращенно-фазовой ВЭЖХ.
РИСУНКИ
|
|