Патент на изобретение №2316557
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
(54) 6,6-ДИМЕТИЛ-8-ОКСО-5,6,8,9-ТЕТРАГИДРОБЕНЗО[F]-ПИРРОЛО[2,1-АЛЬФА]ИЗОХИНОЛИН-9-СПИРО-2-(3-АРОИЛ-4-ГИДРОКСИ-1-О-ГИДРОКСИФЕНИЛ-5-ОКСО-2,5-ДИГИДРО-1Н-ПИРРОЛЫ), 6,6-ДИМЕТИЛ-8-ОКСО-5,6,8,9-ТЕТРАГИДРОБЕНЗО[F]ПИРРОЛО[2,1-АЛЬФА]ИЗОХИНОЛИН-9-СПИРО-2-(3-БЕНЗОИЛ-4-ГИДРОКСИ-1-О-ГИДРОКСИФЕНИЛ-5-ОКСО-2,5-ДИГИДРО-1Н-ПИРРОЛ), ПРОЯВЛЯЮЩИЙ АНАЛЬГЕТИЧЕСКУЮ АКТИВНОСТЬ И СПОСОБ ИХ ПОЛУЧЕНИЯ
(57) Реферат:
Изобретение относится к области органической химии. Описываются 6,6-диметил-8-оксо-5,6,8,9-тетрагидробензо [f]пирроло[2,1-а]изохинолин-9-спиро-2-(3-ароил-4-гидрокси-1-о-гидроксифенил-5-оксо-2,5-дигидро-7Н-пирролы) и 6,6-диметил-8-оксо-5,6,8,9-тетрагидробензо[f]пирроло[2,1-а]изохинолин-9-спиро-2-(3-бензоил-4-гидрокси-1-о-гидроксифенил-5-оксо-2,5-дигидро-1H-пиррол), проявляющий анальгетическую активность, являющиеся замещенными 13-аза-аналоги стероидов и способ их получения.
Ar=С6Н5 (а), С6Н4OMe-n (б), С6Н4Br-n (в). Технический результат: разработка простого способа синтеза неописанных в литературе 6,6-диметил-8-оксо-5,6,8,9-тетрагидробензо[f]пирроло[2,1-а]изохинолин-9-спиро-2-(3-ароил-4-гидрокси-1-о-гидроксифенил-5-оксо-2,5-дигидро-1H-пирролов), являющихся 13-азагонанами – гетероциклическими аналогами стероидов, содержащими спиро-гетероциклический заместитель в положении 16 тетрациклической системы, среди которых соединение 6,6-диметил-8-оксо-5,6,8,9-тетрагидробензо[f]пирроло[2,1-а]изохинолин-9-спиро-2-(3-бензоил-4-гидрокси-1-о-гидроксифенил-5-оксо-2,5-дигидро-1Н-пиррол) проявляет анальгетическую активность. Предлагаемая реакция является новым подходом к синтезу гетероциклических аналогов стероидов. 3 н. и 1 з.п. ф-лы, 2 табл.
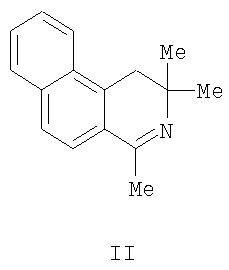
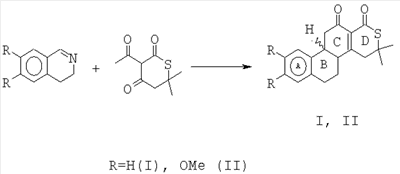
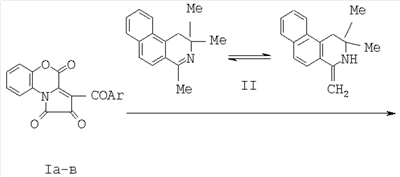
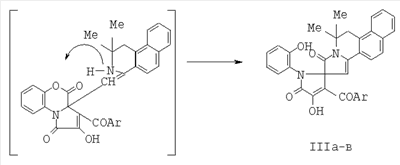
Область техники Изобретение относится к области органической химии, а именно к новому способу синтеза индивидуальных соединений класса бензо[f]пирроло[2,1-а]изохинолин-9-спиро-2-пирролов, а именно 6,6-диметил-8-оксо-5,6,8,9-тетрагидробензо[f]пирроло[2,1-a]изохинолин-9-спиро-2-(3-ароил-4-гидрокси-1-о-гидроксифенил-5-оксо-2,5-дигидро-1H-пирролов)-13-азагонанов, являющимися замещенными 13-аза-аналогами стероидов, содержащими спиро-гетероциклический заместитель в положении 16 тетрациклической системы. Уровень техники Известны структурные аналоги заявленных соединений – тиопирано[3,4:5,6]пиридо[2,1-а]изохинолины (I, II), которые являются замещенными 8-аза-16-тиааналогами стероидов, получаемые взаимодействием 3,4-дигидроизохинолинов с 3-ацетил-6,6-диметилтиопиран-2,4-дионом (Журнал органической химии. 2001. Т.37. Вып.2. С. 306). Синтез структурных аналогов осуществляется по следующей схеме: К недостаткам данного способа относится невозможность получения 6,6-диметил-8-оксо-5,6,8,9-тетрагидробензо[f]пирроло[2,1-a]изохинолин-9-спиро-2-(3-ароил-4-гидрокси-1-о-гидроксифенил-5-оксо-2,5-дигидро-1H-пирролов)-13-азагонанов. Структурные аналоги не обладают анальгетической активностью. Раскрытие изобретения Задачей изобретения является разработка простого способа синтеза неописанных в литературе 6,6-диметил-8-оксо-5,6,8,9-тетрагидробензо[f]пирроло[2,1-a]изохинолин-9-спиро-2-(3-ароил-4-гидрокси-1-о-гидроксифенил-5-оксо-2,5-дигидро-1H-пирролов)-13-азагонанов, являющихся замещенными 13-аза-аналогами стероидов, содержащими спиро-гетероциклический заместитель в положении 16 тетрациклической системы. Поставленная задача осуществляется путем кипячения 3-ароил-2,4-дигидро-1H-пирроло[2,1-с][1,4]бензоксазин-1,2,4-трионов с 2,2,4-триметил-1,2-дигидробензо[f]изохинолином, взятыми в соотношении 1:1, в инертном апротонном растворителе по схеме: Ar=C6H5 (Ia, IIIa), C6H4OMe-n (Iб, IIIб), C6H4Br-n (Iв, IIIв) Процесс ведут при температуре 79-80°С, а в качестве растворителя используют абсолютный бензол. Из патентной и технической литературы не были выявлены способы получения 6,6-диметил-8-оксо-5,6,8,9-тетрагидробензо[f]пирроло[2,1-а]изохинолин-9-спиро-2-(3-ароил-4-гидрокси-1-о-гидроксифенил-5-оксо-2,5-дигидро-1H-пирролов), имеющие сходные признаки с заявляемым способом, а именно, не использовались исходные продукты, растворители, в которых проходит реакция, и интервал температур, на основании чего можно сделать вывод о соответствии заявленного технического решения критерию «новизна» и «изобретательский уровень». Изобретение иллюстрируется следующими примерами. Пример 1. 6,6-Диметил-8-оксо-5,6,8,9-тетрагидробензо[f]пирроло[2,1-a]изохинолин-9-спиро-2-(3-бензоил-4-гидрокси-1-о-гидроксифенил-5-оксо-2,5-дигидро-1H-пиррол)(III а). К раствору 1 ммоль 2,4-дигидро-3-бензоил-1Н-пирроло[2,1-с][1,4]бензоксазин-1,2,4-триона в 2 мл абсолютного бензола добавили 1 ммоль 2,2,4-триметил-1,2-дигидробензо[f]изохинолина, кипятили при температуре 79°С в течении 4 минут, охлаждали, выпавший осадок отфильтровывали. Выход 90%, т.пл. 209-211°С (из этилацетата). Соединение (III а) С34Н26N2O5. Найдено, %: С 75.26; Н 4.83; N 5.16. Вычислено, %: С 75.25; Н 4.84; N 5.15. Пример 2. 6,6-Диметил-8-оксо-5,6,8,9-тетрагидробензо[f]пирроло[2,1-a]изохинолин-9-спиро-2-(4-гидрокси-1-о-гидроксифенил-3-n-метоксибензоил-5-оксо-2,5-дигидро-1H-пиррол) (III б). К раствору 1 ммоль 2,4-дигидро-3-п-метоксибензоил-1Н-пирроло[2,1-с][1,4]бензоксазин-1,2,4-триона в 2 мл абсолютного бензола добавили 1 ммоль 2,2,4-триметил-1,2-дигидробензо[f]изохинолина, кипятили при температуре 79°С в течение 4 минут, охлаждали, выпавший осадок отфильтровывали. Выход 93%, т.пл. 235-237°С (из этилацетата). Соединение (III б) С35Н28N2O6. Найдено, %: С 73.41; Н 4.93; N 4.89. Вычислено, %: С 73.40; Н 4.94; N 4.88. Пример 3. 6,6-Диметил-8-оксо-5,6,8,9-тетрагидробензо[f]пирроло[2,1-а]изохинолин-9-спиро-2-(3-n-бромбензоил-4-гидрокси-1-о-гидроксфенил-5-оксо-2,5-дигидро-1H-пиррол) (III в). К раствору 1 ммоль 3-п-бромфенил-2,4-дигидро-1Н-пирроло[2,1-с][1,4]бензоксазин-1,2,4-триона в 2 мл абсолютного бензола добавили 1 ммоль 2,2,4-триметил-1,2-дигидробензо[f]изохинолина, кипятили при температуре 80°С в течение 4 минут, охлаждали, выпавший осадок отфильтровывали. Выход 89%, т.пл. 216-218°С (из этилацетата). Соединение (III в) C34H25BrN2O5. Найдено, %: С 65.71; Н 4.05; BrN 4.51. Вычислено, %: С 65.70; Н 4.06; BrN 4.50. Соединения (III а-в) – светло-желтые кристаллические вещества с высокими температурами плавления, легкорастворимые в ДМСО и ДМФА, труднорастворимые в обычных органических растворителях, нерастворимые в воде и алканах, дающие положительную пробу (вишневое окрашивание) на наличие енольного гидроксила со спиртовым раствором хлорида железа (III). Устойчивы при хранении в обычных условиях. В ИК-спектрах соединений (III а-в), снятых в виде пасты в вазелиновом масле, присутствуют полосы валентных колебаний групп ОН в виде широкой полосы в области 3200-3280 см-1, двух лактамных карбонильных групп в виде одного или двух пиков в области 1692-1706 см-1, ароильной карбонильной группы в области 1625-1645 см-1. В спектрах ЯМР 1Н растворов соединений (IIIa-в) в ДМСО-d6 кроме сигналов протонов ароматических колец и связанных с ними групп присутствуют два синглета метальных групп изохинолинового фрагмента в области 1.46-1.58 м.д., дублет дублетов диастереотопных протонов метиленовой группы изохинолинового фрагмента в области 2.99-3.33 м.д., расщепленных вследствие соседства с хиральным центром, синглет винильного протона в области 5.81-5.83 м.д., синглет протона фенольной группы ОН в области 9.65-9.67 м.д., уширенный синглет протона енольной группы ОН в области 12.02-12.46 м.д. Предлагаемый способ достаточно прост в осуществлении, одностадиен и позволяет получить неописанные в литературе 6,6-диметил-8-оксо-5,6,8,9-тетрагидробензо[f]пирроло[2,1-a]изохинолин-9-спиро-2-(3-ароил-4-гидрокси-1-о-гидроксифенил-5-оксо-2,5-дигидро- 1H-пирролы)-13-азагонаны, являющиеся замещенными 13-аза-аналогами стероидов, содержащие спиро-гетероциклический заместитель в положении 16 тетрациклической системы, практически с количественными выходами. Описанный способ можно использовать как новый подход к синтезу замещенных 13-аза-аналогов стероидов. Пример 4. Исследование анальгетической активности 6,6-диметил-8-оксо-5,6,8,9-тетрагидробензо[f]пирроло[2,1-а]изохинолин-9-спиро-2-(3-бензоил-4-гидрокси-1-о-гидроксифенил-5-оксо-2,5-дигидро-1H-пиррола) проводили методом «горячей пластинки» и методом «уксусных корчей», в соответствии с методиками [«горячая пластинка» – Eddi N.B., Leimbach D. Studies of anastetics. J. Pharmacol. Exp.Ther., 1953, 107 (3). Р.385-393; «уксусные корчи» – Koster R., Anderson M., De Beer E.J. Acetic acid for analgetic screening. Fed. Proc., 1959,18(1). P.412]. Анальгетическая активность вышеописанного соединения изучалась методом «горячей пластинки», для чего соединение вводили мышам массой 20-22 г в дозе 50 мг/кг внутрибрюшинно, препарат сравнения – анальгин в дозе ЕД50 93 мг/кг. Определяли латентный период наступления оборонительного рефлекса облизывания задней лапы при помещении мыши на металлическую пластинку, нагретую до 55°С.
Анальгетическая активность вышеописанного соединения изучалась методом «уксусных корчей». Соединение вводили мышам массой 20-22 г в дозе 50 мг/кг перорально, анальгин в дозе ЕД50 55 мг/кг. Раздражающий агент – 0,75% уксусная кислота в дозе 0,25 мг на 10 г мыши вводили внутрибрюшинно через 1 час после введения соединения. Определяли количество корчей в течение 10 минут.
Проведенные исследования показали (см. Таблицу 1 и 2), что вышеописанное соединение проявляет центральное анальгетическое действие на 2 часа после введения в тесте «горячей пластинки», и более выраженный анальгетический эффект в тесте «уксусные корчи», следовательно оно может найти применение в практической медицине.
Формула изобретения
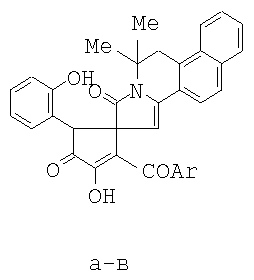
1. 6,6-Диметил-8-оксо-5,6,8,9-тетрагидробензо[f]пирроло[2,1-а]изохинолин-9-спиро-2-(3-ароил-4-гидрокси-1-о-гидроксифенил-5-оксо-2,5-дигидро-1Н-пирролы) – 13-аза-аналоги стероидов общая формула
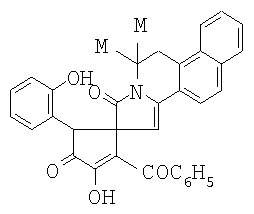
где Ar=С6Н5 (а), С6ОМе-n (б), С6Н4Br-n (в), 2. 6,6-Диметил-8-оксо-5,6,8,9-тетрагидробензо[f]пирроло[2,1-а]изохинолин-9-спиро-2-(3-бензоил-4-гидрокси-1-о-гидроксифенил-5-оксо-2,5-дигидро-1H-пиррол) формулы
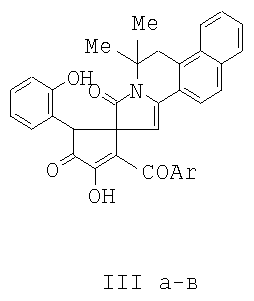
проявляющий анальгетическую активность. 3. Способ получения 6,6-Диметил-8-оксо-5,6,8,9-тетрагидробензо-[f]пирроло[2,1-а]изохинолин-9-спиро-2-(3-ароил-4-гидрокси-1-о-гидроксифенил-5-оксо-2,5-дигидро-1Н-пирролов) формулы III а-в
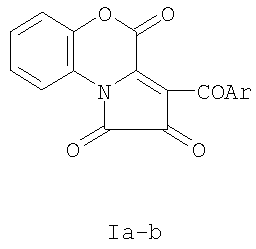
где Ar=С6Н5 (IIIa), С6Н4ОМе-n (IIIб), С6Н4Br-n (IIIв), отличающийся тем, что 3-ароил-2,4-дигидро-1Н-пирроло[2,1-c] [1,4]бензоксазин-1,2,4-трионы формула 1а-в
где Ar=С6Н5 (Ia), С6Н4OMe-n (Iб), С6Н4Br-n (Iв), подвергают взаимодействию с 2,2,4-триметил-1,2-дигидробензо[f]изохинолином формула II
в среде инертного апротонного растворителя при температуре 79-80°С, с последующим выделением целевых продуктов. 4. Способ по п.3, отличающийся тем, что в качестве инертного растворителя используют абсолютный бензол.
MM4A – Досрочное прекращение действия патента СССР или патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 07.10.2008
Извещение опубликовано: 20.09.2010 БИ: 26/2010
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

 0,05 по отношению к исходным данным.
0,05 по отношению к исходным данным.