Патент на изобретение №2316551
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
(54) ПРОИЗВОДНЫЕ 3-МЕТИЛ-7-(ТИЕТАНИЛ-3)КСАНТИНА, ОБЛАДАЮЩИЕ ГЕМОРЕОЛОГИЧЕСКОЙ АКТИВНОСТЬЮ
(57) Реферат:
Изобретение относится к фармацевтической химии и фармакологии и касается новых производных 3-метил-7-(тиетанил-3)ксантина формул Ia, b, с, d. Соединения по изобретению обладают большей гемореологической активностью, чем пентоксифиллин, являясь менее токсичными. Технический результат – получение новых, неописанных ранее производных 3-метил-7-(тиетанил-3)ксантина формул Ia, b, с, d, обладающих гемореологической активностью. 2 табл.
где R=C2H5, R1=
(56) (продолжение): CLASS=”b560m”Ф.А., «Синтезы биологически активных производных ксантина и бензимидазола». Башкирский химический журнал, т.4, №4, 59-62. US 5710272, 20.01.1998.
Изобретение относится к медицине, а именно к фармацевтической химии и фармакологии, и может быть использовано для создания новых корректоров гемореологических нарушений. Задачей изобретения является расширение арсенала биологически активных веществ, обладающих гемореологической активностью. Технический результат – получение веществ, обладающих выраженной гемореологической активностью. Сущность изобретения: производные 3-метил-7-(тиетанил-3)-ксантина (Ia, b, с, d) формулы
где R=С2Н5, Заявляемые соединения синтезируют следующим образом. Соединение Ib образуется при алкилировании 8-бром-3-метил-7-(тиетанил-3)ксантина йодистым пропилом и окислении полученного 8-бром-3-метил-1-пропил-7-(тиетанил-3)ксантина под действием 2-кратного мольного избытка перекиси водорода в среде ледяной уксусной кислоты. Соединение Ic синтезировали в 3 стадии. Взаимодействием 8-бром-3-метил-7-(тиетанил-3)ксантина с тиогликолевой кислотой получали 2-[3-метил-7-(тиетанил-3)ксантинил-8-тио]уксусную кислоту, из которой синтезировали этиловый эфир 2-[3-метил-7-(тиетанил-3)ксантинил-8-тио]уксусной кислоты при кипячении в среде этанола в присутствии концентрированной серной кислоты. При взаимодействии последнего с 10-кратным мольным избытком гидразин-гидрата образуется гидразид 2-[3-метил-7-(тиетанил-3)ксантинил-8-тио]уксусной кислоты. Соединение Id образуется в 4 стадии. Окислением 8-бром-3-метил-7-(тиетанил-3)ксантина 10-кратным мольным избытком перекиси водорода получали 8-бром-3-метил-7-(1,1-диоксотиетанил-3)ксантин, при взаимодействии которого с тиогликолевой кислотой образуется 2-[3-метил-7-(1,1-диоксотиетанил-3)ксантинил-8-тио]уксусная кислота. При кипячении последней в среде этанола в присутствии концентрированной серной кислоты получали этиловый эфир 2-[3-метил-7-(1,1-диоксотиетанил-3)-ксантинил-8-тио]уксусной кислоты. Взаимодействием полученного эфира с 5-кратным мольным избытком гидразин-гидрата синтезировали гидразид 2-[3-метил-7-(1,1-диоксотиетанил-3)ксантинил-8-тио]уксусной кислоты. Пример 1. Синтез соединения Ia К раствору 0,67 г (12 ммоль) гидроксида калия в 4 мл воды добавляют 3,17 г (10 ммоль) 8-бром-3-метил-7-(тиетанил-3)ксантина. В полученную смесь добавляют 80 мл диметилформамида и 1,87 г (12 ммоль) йодистого этила. Перемешивают при комнатной температуре в течение 4 часов. Осадок отфильтровывают, промывают водой, сушат. Фильтрат разбавляют водой до выпадения осадка, выпавший осадок отфильтровывают, промывают водой, сушат. Осадки соединяют, получают 3,05 г (88%) 8-бром-3-метил-7-(тиетанил-3)-1-этилксантина. Очищают кристаллизацией из этанола. Белое кристаллическое вещество, растворяется в хлороформе, диметилформамиде, при нагревании в этаноле. Тпл. 223-225°С. Элементный анализ. Найдено, %: С 38,2 Н 3,7 N 16,3 – C11H13BrN4O2S Вычислено, %: С 38,3 Н 3,8 N 16,2 Спектр ЯМР 1Н (CDCl3), Спектр ЯМР 13С (CDCl3), Раствор 1,73 г (5 ммоль) 8-бром-3-метил-7-(тиетанил-3)-1-этилксантина и 1,13 г (10 ммоль) 30%-ного раствора перекиси водорода в 40 мл ледяной уксусной кислоты выдерживают при комнатной температуре в течение 1,5 часов. Нейтрализуют концентрированным раствором аммиака при температуре не выше 15°С до рН 7. Выпавший осадок отфильтровывают, промывают водой, сушат. Получают 0,88 г (49%) 8-бром-3-метил-7-(1-оксотиетанил-3)-1-этилксантина. Очищают кристаллизацией из этанола. Белое кристаллическое вещество, растворяется в хлороформе, диметилформамиде, этаноле, при нагревании в воде. Тпл. 233-234°С. Элементный анализ. Найдено, %: С 36,5 Н 3,5 N 15,8 – С11Н13BRN4O3S Вычислено, %: С 36,6 Н 3,6 N 15,5 Спектр ЯМР 1Н (CDCl3), Раствор 1,08 г (3 ммоль) 8-бром-3-метил-7-(1-оксотиетанил-3)-1-этилксантина и 0,77 г (9 ммоль) пиперидина в 30 мл этанола кипятят в течение 5 часов. Охлаждают, выпавший осадок отфильтровывают, промывают этанолом, водой, сушат. Получают 0,75 г (68%) соединения Ia. Очищают кристаллизацией из этанола. Тпл. 209-210°С. Элементный анализ. Найдено, %: С 52,2 Н 6,4 N 19,2 – С16Н23N5O3S Вычислено, %: С 52,6 Н 6,3 N 19,2 ИК-спектр (вазелиновое масло), Заявляемое соединение представляет собой белое кристаллическое вещество, растворимое в разведенной хлористо-водородной кислоте, хлороформе, диметилформамиде, этаноле, при нагревании в воде. Пример 2. Синтез соединения Ib К раствору 0,67 г (12 ммоль) гидроксида калия в 4 мл воды добавляют 3,17 г (10 ммоль) 8-бром-3-метил-7-(тиетанил-3)ксантина. В полученную смесь добавляют 80 мл диметилформамида и 2,04 г (12 ммоль) йодистого пропила. Перемешивают при комнатной температуре в течение 4 часов. Разбавляют водой до выпадения осадка. Выпавший осадок отфильтровывают, промывают водой, сушат. Получают 3,02 г (84%) 8-бром-3-метил-1-пропил-7-(тиетанил-3)ксантина. Очищают кристаллизацией из этанола. Белое кристаллическое вещество, растворяется в хлороформе, диметилформамиде, при нагревании в этаноле. Тпл. 223-225°С. Элементный анализ. Найдено, %: С 40,3 Н 4,3 N 15,5 – C12H15BrN4O2S Вычислено, %: С 40,1 Н 4,2 N 15,6 Спектр ЯМР 1Н (CDCl3), Раствор 1,80 г (5 ммоль) 8-бром-3-метил-1-пропил-7-(тиетанил-3)-ксантина и 1,13 г (10 ммоль) 30%-ного раствора перекиси водорода в 30 мл ледяной уксусной кислоты выдерживают при комнатной температуре в течение 1,5 часов. Нейтрализуют концентрированным раствором аммиака при температуре не выше 15°С до рН 7. Выпавший осадок отфильтровывают, промывают водой, сушат. Получают 0,97 г (52%) соединения Ib. Очищают кристаллизацией из этанола. Тпл. 215-216°С. Элементный анализ. Найдено, %: С 38,4 Н 3,7 N 14,8 – C12H15BrN4O3S Вычислено, %: С 38,4 Н 4,0 N 14,9 Спектр ЯМР 1Н (CDCl3), Заявляемое соединение представляет собой белое кристаллическое вещество, растворимое в воде, хлороформе, диметилформамиде, при нагревании в этаноле. Пример 3. Синтез соединения Ic К 100 мл воды добавляют 1,68 г (30 ммоль) гидроксида калия, приливают 1,84 г (20 ммоль) тиогликолевой кислоты, к полученному раствору прибавляют 3,17 г (10 ммоль) 8-бром-3-метил-7-(тиетанил-3)ксантина, кипятят 1,5 часа. Затем раствор охлаждают до комнатной температуры, добавляют разведенную хлористо-водородную кислоту до рН 3, выпавший осадок отфильтровывают, промывают водой, сушат. Получают 2,75 г (84%) 2-[3-метил-7-(тиетанил-3)ксантинил-8-тио]уксусной кислоты. Очищают кристаллизацией из воды. Белое кристаллическое вещество, растворимое в диметилсульфоксиде, диметилформамиде, растворе гидроксида калия, при нагревании в воде. Тпл. 236-238°С с разложением. Элементный анализ. Найдено, %: С 40,1 Н 3,6 N 17,2 – C11H12N4O4S2 Вычислено, %: С 40,2 Н 3,7 N 17,1 Спектр ЯМР 1H (DMSO-D6), К суспензии 1,64 г (5 ммоль) 2-[3-метил-7-(тиетанил-3)ксантинил-8-тио]уксусной кислоты в 80 мл безводного этанола добавляют 3,0 мл концентрированной серной кислоты в 20 мл безводного этанола. Полученную суспензию кипятят в течение 3 часов. Осадок отфильтровывают, промывают водой, сушат. Получают 1,37 г (77%) этилового эфира 2-[3-метил-7-(тиетанил-3)ксантинил-8-тио]уксусной кислоты. Очищают кристаллизацией из этанола. Белое кристаллическое вещество, растворимое в этаноле, хлороформе, растворе гидроксида калия, диметилсульфоксиде, диметилформамиде. Тпл. 226-228°С. Элементный анализ. Найдено, %: С 43,7 Н 4,4 N 15,8 – C13H16N4O4S2 Вычислено, %: С 43,8 Н 4,5 N 15,7 Спектр ЯМР 1Н (DMSO-D6), К суспензии 0,89 г (2,5 ммоль) этилового эфира 2-[3-метил-7-(тиетанил-3)ксантинил-8-тио]уксусной кислоты в 90 мл этанола добавляют 1,46 г (25 ммоль) 55%-ного раствора гидразин-гидрата в 10 мл этанола. Полученную суспензию кипятят 7 часов. Осадок отфильтровывают, промывают этанолом, сушат. Получают 0,70 г (82%) соединения 1с. Очищают кристаллизацией из воды. Тпл. 221-223°С. Элементный анализ. Найдено, %: С 38,5 Н 4,0 N 24,3 – C11H14N6O3S2 Вычислено, %: С 38,6 Н 4,1 N 24,5 Спектр ЯМР 1Н (DMSO-D6), Заявляемое соединение представляет собой белое кристаллическое вещество, растворимое в воде, растворе гидроксида калия, диметилсульфоксиде, диметилформамиде. Пример 4. Синтез соединения Id При нагревании растворяют 3,17 г (10 ммоль) 8-бром-3-метил-7-(тиетанил-3)ксантина в 50 мл ледяной уксусной кислоты. Затем добавляют 11,34 г (100 ммоль) 30%-ного раствора перекиси водорода небольшими порциями. Смесь кипятят 0,5 часа. Выпавший осадок отфильтровывают, промывают водой, сушат. Получают 2,05 г (59%) 8-бром-3-метил-7-(1,1-диоксотиетанил-3)ксантина. Очищают кристаллизацией из диметилформамида. Белое кристаллическое вещество, растворяется в диметилсульфоксиде, растворе гидроксида калия, при нагревании в диметилформамиде. Тпл.>280°С с разложением. Элементный анализ. Найдено, %: С 30,9 Н 2,5 N 16,2 – C9H9BrN4O4S Вычислено, %: С 31,0 Н 2,6 N 16,1 ИК-спектр (вазелиновое масло), К 100 мл воды добавляют 1,68 г (30 ммоль) гидроксида калия, приливают 1,84 г (20 ммоль) тиогликолевой кислоты, к полученному раствору прибавляют 3,49 г (10 ммоль) 8-бром-3-метил-7-(1,1-диоксотиетанил-3)-ксантина, кипятят 1 час. Затем раствор охлаждают до комнатной температуры, добавляют разведенную хлористо-водородную кислоту до рН 3, выпавший осадок отфильтровывают, промывают водой, сушат. Получают 3,2 г (92%) 2-[3-метил-7-(1,1-диоксотиетанил-3)ксантинил-8-тио]уксусной кислоты. Очищают кристаллизацией из смеси этанол-вода (объемное соотношение 1:1). Белое кристаллическое вещество, растворимое в диметилсульфоксиде, диметилформамиде, растворе гидроксида калия, при нагревании в воде. Тпл. 276-278°С с разложением. Элементный анализ. Найдено, %: С 36,6 Н 3,5 N 15,7 – С11Н12N4O6S2 Вычислено, %: С 36,7 Н 3,4 N 15,6 ИК-спектр (вазелиновое масло), К суспензии 1,80 г (5 ммоль) 2-[3-метил-7-(1,1-диоксотиетанил-3)-ксантинил-8-тио]уксусной кислоты в 80 мл безводного этанола добавляют 4,5 мл концентрированной серной кислоты в 30 мл безводного этанола. Полученную суспензию кипятят в течение 7 часов. Осадок отфильтровывают, промывают этанолом, водой, сушат. Получают 1,70 г (88%) этилового эфира 2-[3-метил-7-(1,1-диоксотиетанил-3)ксантинил-8-тио]уксусной кислоты. Очищают кристаллизацией из этанола. Белое кристаллическое вещество, растворимое в этаноле, хлороформе, растворе гидроксида калия, диметилсульфоксиде, диметилформамиде. Тпл. 266-268°С с разложением. Элементный анализ. Найдено, %: С 40,1 Н 4,1 N 14,3 – C13H16N4O6S2 Вычислено, %: С 40,2 Н 4,2 N 14,4 Спектр ЯМР 1H (DMSO-D6), К суспензии 1,94 г (5 ммоль) этилового эфира 2-[3-метил-7-(1,1-диоксотиетанил-3)ксантинил-8-тио]уксусной кислоты в 90 мл этанола добавляют 1,46 г (25 ммоль) 55%-ного раствора гидразингидрата в 10 мл этанола. Полученную суспензию кипятят 7 часов. Осадок отфильтровывают, промывают этанолом, сушат. Получают 1,81 г (97%) соединения Id. Очищают кристаллизацией из воды. Тпл. 247-248°С с разложением. Элементный анализ. Найдено, %: С 35,2 Н 3,6 N 22,4 – С11Н14N6O5S2 Вычислено, %: С 35,3 Н 3,8 N 22,5 Спектр ЯМР 1Н (DMSO-D6), Заявляемое соединение представляет собой белое кристаллическое вещество, растворимое в воде, растворе гидроксида калия, диметилсульфоксиде, диметилформамиде. Острая токсичность заявляемых соединений. Острую токсичность определяли на крысах при внутривенном введении. Гибель животных регистрировали в течение двух недель. Расчет величины LD50 Гемореологическая активность. -1 к вязкости крови при 100 с-1 ИнАЭ=100-(В/А)·100%, где ИнАЭ – индекс ингибирования агрегации эритроцитов; А – индекс агрегации эритроцитов без изучаемого соединения; В – индекс агрегации эритроцитов после инкубации суспензии с изучаемым соединением. Заявляемые соединения в исследуемых концентрациях вызывали статистически значимое по сравнению с контролем снижение индекса ингибирования агрегации эритроцитов (табл.2). Для соединений Ia, Ib, Ic, Id величина гемореологического эффекта превышает активность препарата сравнения. Наибольшая величина эффекта наблюдается для соединения Id в концентрации 100 мкмоль/л. При определении величины эффективной концентрации (ЕС20 В качестве объективного показателя условной широты терапевтического действия использовали условный терапевтический индекс (УТИ), который рассчитывали делением показателя острой токсичности LD50 на показатель эффективной концентрации ЕС20. УТИ для соединения Ia равен 4,45, соединения Ib – 6,22, Ic – 5,84, Id -8,23, пентоксифиллина – 1,92. По величине УТИ заявляемые соединения Ia, Ib, Ic и Id превосходят препарат сравнения в 2,32, 3,24, 3,04 и 4,29 раза соответственно. Таким образом, представленные химические соединения (Ia, b, с, d) обладают большей гемореологической активностью, чем пентоксифиллин, являясь менее токсичными веществами. ПРОИЗВОДНЫЕ 3-МЕТИЛ-7-(ТИЕТАНИЛ-3)КСАНТИНА, ОБЛАДАЮЩИЕ ГЕМОРЕОЛОГИЧЕСКОЙ АКТИВНОСТЬЮ
Формула изобретения
1. Производные 3-метил-7-(тиетанил-3)ксантина формулы
где R=C2H5, R1= 2. Соединение по п.1, представляющее собой 3-метил-7-(1-оксо-тиетанил-3)-8-пиперидино-1-этилксантин. 3. Соединение по п.1, представляющее собой 8-бром-3-метил-7-(1-оксотиетанил-3)-1-пропилксантин. 4. Соединение по п.1, представляющее собой гидразид 2-[3-метил-7-(тиетанил-3)ксантинил-8-тио]уксусной кислоты. 5. Соединение по п.1, представляющее собой гидразид 2-[3-метил-7-(1,1-диоксотиетанил-3)ксантинил-8-тио]уксусной кислоты. 6. Производные по п.1, обладающие гемореологической активностью.
MM4A – Досрочное прекращение действия патента СССР или патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 27.12.2008
Извещение опубликовано: 20.09.2010 БИ: 26/2010
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

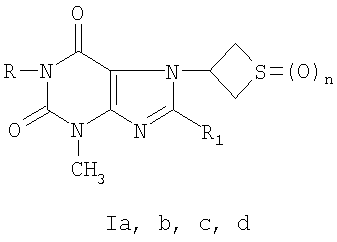
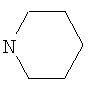 , n=1(Ia); R=С3Н7-н, R1=Br, n=1(Ib); R=H, R1=SCH2CONHNH2, n=0(Ic); R=H, R1=SCH2CONHNH2, n=2(Id).
, n=1(Ia); R=С3Н7-н, R1=Br, n=1(Ib); R=H, R1=SCH2CONHNH2, n=0(Ic); R=H, R1=SCH2CONHNH2, n=2(Id).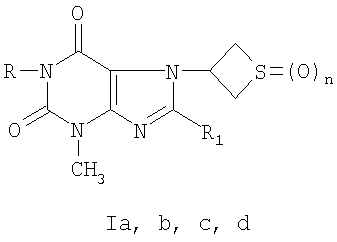
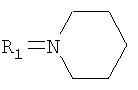 , n=1(Ia); R=С3Н7-н, R1=Br, n=1(Ib); R=Н, R1=SCH2CONHNH2, n=0(Ic); R=Н, R1=SCH2CONHNH2, n=2(Id), обладающие гемореологической активностью.
, n=1(Ia); R=С3Н7-н, R1=Br, n=1(Ib); R=Н, R1=SCH2CONHNH2, n=0(Ic); R=Н, R1=SCH2CONHNH2, n=2(Id), обладающие гемореологической активностью. , м.д.: 1,24 (3Н, т, J 7,02 Гц, СН3), 3,23-3,34 (2Н, м, S(CH)2), 3,51 (3Н, с, 3-NCH3), 4,10 (2Н, кв, J 7,02 Гц, 1-NCH2), 4,31-4,42 (2Н, м, S(CH)2), 5,90-6,06 (1Н, м, NCH).
, м.д.: 1,24 (3Н, т, J 7,02 Гц, СН3), 3,23-3,34 (2Н, м, S(CH)2), 3,51 (3Н, с, 3-NCH3), 4,10 (2Н, кв, J 7,02 Гц, 1-NCH2), 4,31-4,42 (2Н, м, S(CH)2), 5,90-6,06 (1Н, м, NCH). , см-1: 1064,8 (S=O вал.), 1612,3; 1648,8; 1690,0 (С=С вал., C=N вал., СО вал.).
, см-1: 1064,8 (S=O вал.), 1612,3; 1648,8; 1690,0 (С=С вал., C=N вал., СО вал.).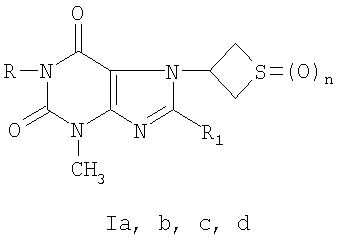
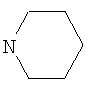 , n=1(Ia); R=С3Н7-н, R1=Br, n=1(Ib); R=H, R1=SCH2CONHNH2, n=0(Ic); R=H, R1=SCH2CONHNH2, n=2(Id).
, n=1(Ia); R=С3Н7-н, R1=Br, n=1(Ib); R=H, R1=SCH2CONHNH2, n=0(Ic); R=H, R1=SCH2CONHNH2, n=2(Id).