Патент на изобретение №2159610
|
||||||||||||||||||||||||||
(54) ФИЗИОЛОГИЧЕСКИ ПРИЕМЛЕМЫЕ ЭМУЛЬСИИ, СОДЕРЖАЩИЕ ГИДРИДЫ ПЕРФТОРУГЛЕРОДНОГО ЭФИРА, И СПОСОБЫ ИХ ИСПОЛЬЗОВАНИЯ
(57) Реферат: Изобретение относится к области химико-фармацевтической промышленности и касается физиологически совместимых эмульсий, содержащих гидриды перфторуглеводородных эфиров. Изобретение заключается в том, что эмульсии имеют различные медицинские применения. В особенности они полезны как контрастная среда для таких способов медико-биологических исследований, как способы ядерного и 19F-магнитного резонансов, ультразвукового и рентгеновского способов, способа компьютерной томографии, в качестве переносчиков кислорода или “искусственной” крови при лечении болезней сердца и сосудистых заболеваний, в качестве адьювантов при коронарной ангиопластике и в лучевой и химиотерапии рака. Изобретение обеспечивает желаемый уровень переноса кислорода, достаточно стабильно в жидком или незамороженном состоянии, быстро выводится из организма, чтобы избежать токсикации. 13 з.п. ф-лы, 1 табл. Настоящее изобретение относится к водным физиологически приемлемым эмульсиям гидридов перфторуглеродного эфира, имеющим от 8 до 12 атомов углерода. Рассматриваемые эмульсии имеют различное медицинское применение. С медицинской точки зрения они особенно перспективны в качестве контрастной среды в различных методах биологических исследований, таких как ядерный магнитный резонанс, 19F-магнитный резонанс, ультразвуковой, рентгеновский, компьютерной томографии, в качестве переносчика кислорода или заменителя крови – “искусственная кровь” при лечении сердечной недостаточности, сердечных приступов и других сосудистых заболеваний, в качестве адъювантов при коронарной ангиопластике и в лучевой и химиотерапии рака. Хорошо известно, что сильно фторированные органические соединения и в особенности фторированные углеродные соединения, являются стабильными и химически инертными. В последние 25 лет особое внимание уделялось использованию таких соединений в биологических системах вследствие их способности растворять и транспортировать большое количество кислорода. Эти свойства обусловливают перспективность использования таких соединений в качестве контрастной среды, агентов по переносу кислорода или “искусственной крови” при лечении сердечных приступов, инсульта и других сосудистых заболеваний, в качестве адъювантов при коронарной ангиопластике и в лучевой и химиотерапии рака. Сильно фторированными органическими соединениями, которые, как отмечалось, полезны в таких приложениях, являются перфторуглеродные соединения, например перфтордекалин, перфториндан, перфтортриметилбицикло [3.3.1]нонан, перфторметиладамантан, перфтордиметиладамантан, перфтор-2,2,4,4-тетраметилпентан; C9-C12 перфторамины, например перфтортрипропиламин, перфтортрибутиламин, перфтор-1- азатрициклические амины; бромфторуглеродные соединения, например перфтороктилбромид и перфтороктилдибромид; А-4- метилоктагидрохинолидизин и перфторэфиры, включая хлорированные полифторциклические эфиры. Подобные соединения описываются, например, в патентах США N 3, 962, 439; N 3, 493, 581; N 4, 110, 474; N 4, 186, 253; N 4, 187, 252; N 4, 252, 827; N 4, 423, 077; N 4, 443, 480; N 4, 534, 978; N 4. 686, 024; N 4, 865, 836; N 4, 866, 096; N 4, 868,318, в Европейских заявках N 80710 и N 158, 996, в описании к патенту Великобритании N 1, 549, 038 и в описании к выложенной заявке Германии N 2, 650, 586. В публикации ЕР-А-307-087 приводятся эмульсии, включающие перфторуглерод, эмульгатор, преимущественно лецитин, и воду. В публикации описывается использование различных перфторуглеродов в эмульсии, включающей F[CF(CF3)CF2O] 2CHFCF3. В публикациях FR-A-2620445 и W092/02560 приводятся сведения об использовании для транспортировки газов различных сильно фторированных соединений, включая F[CF(CF3)CF2O] 2CHFCF3 и F[CF(CF3)CF2O] 3CHFCF3. В публикации W0 93/01798 описываются эмульсии, содержащие фторуглерод, поверхностно-активное вещество, лиофильное/фторофильное органическое соединение и водную фазу, в которых фторуглерод выбирается из различных соединений, включая F[CF(CF3)CF2O]2CHFCF3. При внутривенном использовании высокофторированные органические соединения должны быть предварительно диспергированы как эмульсии. См., например, L. С. Clark, Jr. et al, “Emulsion Of Perfluorinated Solvents For Intravascular Gas Transport”, Ped.Proc., 34(6), pp. 1468-77 (1975); К. Yokoyama et al. “A Perfluorochemical Emulsion As An Oxygen Carrier,” Artif. Organs (Cleve). 8(1), pp. 34-40 (1984); и United States patents 4,110,474 и 4,177,252. Вкратце отметим, что высокофторированные органические соединения не смешиваются в крови. В патенте США N 3, 991, 138 сообщается об использовании в качестве искусственной крови перфторуглеродных эмульсий, содержащих фторуглероды, которые могут быть выведены из организма животного в течение клинически допустимого периода времени. В патенте США N 3, 991, 138, например, было описано, что перфторциклоуглероды выводятся из организма животного быстрее, чем перфторуглероды. В противоположность этому было обнаружено, что когда в живой организм вводились перфторуглеродные простые эфиры, они оставались в печени и селезенке довольно долго. Совсем недавно в качестве синтетической кровяной эмульсии тестировался гидрофторалкиловый простой эфир F[CF(CF3)CF2O] 4CHFCF3, однако и он обнаружил тенденцию оставаться в организме, см. Chem. Pharm. Bull., 33, 1221 (1985). В общем считалось, что из-за тенденции слишком долго задерживаться в живом организме перфторуглеродные эфиры непригодны для использования их в качестве переносчиков кислорода и для медицинских целей. Вследствие вышеизложенного, для эмульсий, содержащих перфторуглероды, продолжаются исследования эффективности их использования в качестве переносчиков кислорода и способов их выведения из организма в течение клинически допустимого периода времени. Такие эмульсии должны не только содержать достаточно высокую концентрацию высокофторированного органического соединения для того, чтобы обеспечить желаемый уровень переноса кислорода, но и быть восприимчивыми к стерилизации, преимущественно тепловой, должны быть достаточно стабильными в жидком или незамороженном состоянии, должны быть химически стойкими в потоке крови в течение достаточно длительного периода времени для того, чтобы доставлять необходимое количество кислорода, и должны достаточно быстро выводиться из организма с тем, чтобы избежать токсикации и задерживания в органах и частях тела. Настоящая заявка относится к водным физиологически приемлемым водным эмульсиям гидридов перфторуглеродного эфира, в особенности к гидроперфторалифатически простым эфирам или к таким простым эфирам, замещенным перфторалициклической группой (“гидриды ПФУ эфира”). Было обнаружено, что эти гидриды ПФУ эфира очень эффективны в качестве носителей кислорода, кроме того, они отличаются удивительно коротким временем пребывания в организме. В действительности, было обнаружено, что эти гидриды ПФУ эфира оказываются химически стойкими в потоке крови в течение времени, достаточного для переноса необходимого количества кислорода, и быстро выводятся из организма, так что никаких следов в жизненно важных органах не наблюдается даже в течение нескольких дней после их введения. Эти гидриды ПФУ эфира являются превосходными кандидатами для использования в заменителях крови и в эмульсиях, применяемых для переноса кислорода. Эмульсии в соответствии с настоящим изобретением могут быть использованы в различных медицинских целях, например в качестве контрастного вещества в различных способах биологических исследований, включая способ ядерного магнитного резонанса, 19F-магнитного резонанса, ультразвуковые, рентгеновские способы, способ компьютерной томографии, в качестве носителей кислорода или заменителей крови при лечении сердечной недостаточности, приступов и других сосудистых заболеваний, в качестве адъювантов в коронарной ангиопластике и в противораковой радиационной и химиотерапии. Физиологически приемлемые эмульсии в соответствии с настоящим изобретением содержат C8-C12 насыщенный гидроперфторалифатический простой эфир или такой же простой эфир, имеющий в качестве заместителя перфторалициклическую группу, или смесь обоих эфиров. Алифатический простой эфир представляет прямую или разветвленную цепь атомов углерода. Другие компоненты эмульсии включают воду и поверхностно-активное вещество, причем количественное содержание таких компонентов в эмульсиях соответствует приемлемому физиологическому приему. Особенно предпочтительными являются эмульсии, содержащие гидриды C9-C11 ПФУ эфира, которые, как было обнаружено, выводятся из таких жизненно важных органов, как печень, в течение исключительно короткого времени. Гидриды ПФУ эфира представляют новую возможность гибкого изменения при составлении рецептуры физиологически приемлемых эмульсий. Эти гидриды ПФУ эфира легко могут быть приготовлены и имеют более низкие плотности и точки кипения, что делает их очень удобными для приготовления, переноса кислорода и выведения из организма животного. Эти гидриды ПФУ эфира не оказывают никаких неблагоприятных воздействий на легкие при очистке организма. Кроме того, их летучесть, молекулярный вес, растворимость и озонные характеристики обусловливают их предпочтительность в медицинских приложениях. Сущность настоящего изобретения, его достоинства и возможности дальнейшего совершенствования станут понятны из последующего детального описания и примеров. В настоящем описании термин “перфтор”, так же как и термины “перфторалифатический”, “перфторалициклический”, “перфторалкиловый” или “перфтороалкиленовый” означают, что, за исключением случая, специально отмеченного префиксом “гидро”, нет каких-либо связанных углеродов атомов водорода, замещенных фтором, нет никакой ненасыщенности. Так, термин “гидроперфторалифатический эфир” означает, что имеется по крайней мере один атом водорода, связанный с углеродом, а остальные атомы углерода в алифатической группе этого соединения связаны со фтором или кислородом. Такое соединение может также называться “гидрид перфторалифатического эфира”. Префиксы “дигидро” и “тригидро” означают, что в соединении имеются, соответственно, два или три атома водорода, связанных с углеродом. Для упрощения, фраза “гидрид ПФУ эфира” иногда будет означать, что рассматриваются все формы соединений в соответствии с настоящим изобретением, в которых содержится от одного до трех атомов водорода, один или более атомов кислорода в простом эфире или углеродная группа является алифатической, алициклической или алициклическизамещенной алифатической либо с прямой, либо с разветвленной цепью. Также “1o водород” или 2o водород” далее означает, что атом водорода связан с первичным или вторичным атомом углерода соответственно. Физиологически приемлемые водные эмульсии в соответствии с настоящим изобретением содержат гидриды С8-С12 ПФУ эфира, воду и поверхностно-активное вещество, причем эти компоненты содержатся в эмульсии в количествах, соответствующих приемлемому физиологическому приему. Гидрид ПФУ эфира выбирается из группы насыщенного С8-С12 гидроперфторалифатического эфира, гидроперфторалифатического эфира, замещенного насыщенной перфторалициклической группой и гидроперфторциклоалифатического эфира и смесей таких простых эфиров. Эти алифатические простые эфиры имеют прямые или разветвленные цепи атомов углерода. Термин “насыщенный” означает, что эти соединения не имеют ни одной двойной связи или не являются насыщенными в молекуле. Предпочтительно эмульсии содержат гидриды С9-С11 ПФУ эфира, так как такие соединения, как было обнаружено, наиболее эффективно выполняют в эмульсиях функцию переносчиков кислорода и одновременно лишь ненадолго задерживаются в организме. Как класс гидриды ПФУ эфира имеют точку кипения около 120oC, что делает их нетоксичными с удовлетворительной способностью выведения из организма. Предпочтительный класс гидридов ПФУ эфира может быть представлен формулой I X-Rf-O(R’f)nR”f-H, где H – первичный атом водорода или 2o атом водорода на атоме углерода, смежном с атомом кислорода в простом эфире; X – атом фтора, первичный атом водорода или 2o атом водорода на атоме углерода, смежном с атомом кислорода в простом эфире; n – целое число от 0 до 4; Rf, R’f, R”f – независимо выбранные из неразветвленных или разветвленных групп, состоящих из перфторалкилена, перфторциклоалкилена или перфторциклоалкилена, содержащего один или более атомов кислорода в простом эфире. Соединения по формуле 1, в которых атомы водорода являются либо первичными, либо вторичными и присоединены к атому углерода, смежному с атомом кислорода в простом эфире, являются предпочтительными, потому что они легко приготовляются и являются более стабильными по отношению к нагреву, условиям окисления и щелочному воздействию. Следовательно, они более пригодны для того, чтобы противостоять тепловой стерилизации, и одновременно не являются биологически активными и не склонны к метаболизму. Первая предпочтительная группа гидридов ПФУ эфира в соответствии с формулой 1 состоит из C9-C10 дигидроперфторуглеродных эфиров, в которых атомы водорода могут быть 1o или 2o на атоме углерода, смежном с атомом кислорода в простом эфире. Они могут быть представлены следующими соединениями, которые покидают организм либо в течение нескольких дни, либо в течение очень короткого времени. Далее следуют ” цикло-C6F11” или “цикло-C6F10“, которые представляют перфторциклогексиловую группу или перфторциклогексиленовую соответственно. Н-С3F6OC4F8OC3F6-H; H-C2F4OCF2C(CF3)2CF2OC2 F2-H; HC2F4-O-(CF2)5-O-C2F4-H; H-C2F4-O-(CF2)6-O-C2F4-H; H-CF2O-(C2F4O)3CF2-H; H-CF2O-(C2F4O)4CF2-H; H-C2F4-O-cyclo-C6F10-O-C2F4-H Вторая группа предпочтительных гидридов ПФУ эфира в соответствии с формулой 1 состоит из гидридов C9-C11 перфторциклоалкил- или перфторциклоалкилзамещенных перфторалкиленовых эфиров, представляемых следующими соединениями, которые покидают организм в течение нескольких дней. cyclo -C6F11-CF2OC2F4H; cyclo-C6F11-OC4F8H; cyclo-C6F11-C2F4OCF2-H; p-CF3O-cyclo-C6F10-C2F4-H; 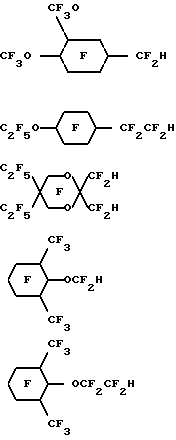 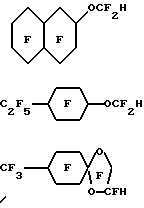 Третий класс гидридов ПФУ эфира предпочтительно включат C9-C10 гидроперфторалкиловые эфиры, в которых атом водорода является 1o или 2o, связанным с атомом углерода, смежным с атомом кислорода в простом эфире, либо связанным с конечным атомом углерода или промежуточным атомом углерода, смежным с простым эфиром; как представлено в следующих соединениях: C4F9OCF(CF3)CF2O-CFH-CF3; CF3(CF2)6O-CF2CF2-H; C8F17OCF2H; CF3(CF2)5– O-(CF2)2-O-CF2-H; C6F13-O- C4F8-H; C5F11-O-C5F10-H; C4F9-O-C2F4-O-C3F6-H; 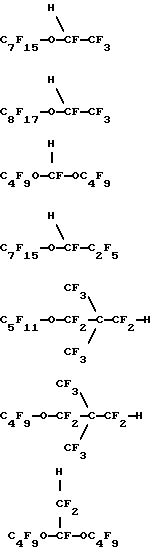 CF3O-C8F16-CF2H; C9F19-O-CF2-H. Гидриды ПФУ эфира в соответствии с настоящим изобретением обычно содержат от одного до пяти атомов кислорода в простом эфире. Преимущественно один или два атомов кислорода в простом эфире входят в моногидриды и до пяти атомов кислорода входят в дигидриды. Хотя атом водорода может быть в принципе расположен на любом атоме углерода в соединении, мы считаем предпочтительным, когда имеется более чем один такой атом водорода, так что они находятся на различных атомах углерода (т.е. нет спаривания). В одной из наиболее предпочтительных форм гидридов ПФУ эфиров в соответствии с настоящим изобретением атом водорода располагается на противоположных концах углеродной цепи. Поэтому иногда они рассматриваются как “ди-омега-гидро” перфторалкиловые эфиры. Следует особо подчеркнуть, что в соответствии с настоящим изобретением любые гидриды ПФУ эфиров могут смешиваться между собой и с другими хорошо известными высокофторированными органическими соединениями и использоваться в эмульсиях согласно данной заявке. При внутривенном использовании такие эмульсии могут содержать от 10% до 75% гидрида ПФУ эфира. В соответствии с настоящим изобретением эмульсии предпочтительно содержат от 10% до 50% (по объему) гидрида ПФУ эфира, а наиболее предпочтительное содержание – примерно 40% (по объему). Если такие эмульсии используются как искусственная кровь или заменители красных кровяных телец, ПФУ присутствуют в них в наиболее высокой допустимой объемной концентрации, например часто предпочтительной оказывается 40% по объему, так как такая концентрация соответствует примерному содержанию кислорода во всем организме. Эмульсии в соответствии с настоящим изобретением приготовляются общепринятыми способами и включают компоненты, общие для хорошо известных эмульсий высокофторированных органических соединений. Поверхностно-активными веществами, успешно используемыми в эмульсиях в соответствии с настоящим изобретением, являются любые из известных анионных, катионных, неионных и амфионных поверхностно-активных веществ. Предпочтительными являются неионные поверхностно-активные вещества, такие как алкиловые и ариловые соединения, гидрофильная часть которых состоит из полиоксиэтиленовых цепей, молекул сахаров, полиспиртовых производных или других гидрофильных групп, например любая из рецептур BASF Wyandotte оксидов полиоксиэтилена и полиоксипропилена, продаваемых под товарным знаком “Pluronic”, например Pluronic F-68 или F-108 или амфионные поверхностно-активные вещества. В эмульсиях в соответствии с настоящим изобретением могут быть использованы фторированные поверхностно-активные вещества, например ATSURR  F-31 (ICI, Wilmington, DE). См., например, Riess et al. , “Design, Synthesis And Evaluation Of Fluorocarbons And Surfactans For In Vivo Applications, New Perfluoroalkylated Polyhydrohylated Surfactans”, Artif. Cells Artif. Organs. 16, pp.421-30 (1988). Комбинации этих поверхностно-активных веществ могут, конечно, использоваться в эмульсиях в соответствии с настоящим изобретением. Кроме того, смеси соединений, одно или более из которых не являются поверхностно-активными веществами, но совместные соединения которых действуют как поверхностно-активные вещества, также могут быть использованы в качестве поверхностно-активного компонента в эмульсиях в соответствии с настоящим изобретением.
Хотя подобные композиции могут в общем рассматриваться как эмульсии, необходимо отдавать себе отчет в том, что они могут быть растворами, мицеллярными растворами, микроэмульсиями, везикулярными суспензиями или смесями всех этих физических состояний. Соответственно, используемый здесь термин “эмульсия” включает все эти состояния и поверхностно-активное вещество или растворяющий агент используется для того, чтобы повысить стабильность смесей этих состояний и увеличить стабильность их водной и масляной фаз.
Поверхностно-активные вещества, используемые в эмульсиях в соответствии с настоящим изобретением, являются физиологически приемлемыми, например преимущественно используются одно или несколько из следующих веществ: яичный или соевый фосфатиды, лецитин, алкиловые соли олеиновой кислоты, такие как олеат натрия. Наиболее предпочтительным является лецитин. Хотя количество конкретного поверхностно-активного вещества, используемого в эмульсиях в соответствии с настоящим изобретением, зависит от количества и свойств других компонентов эмульсии, обычно мы используем от 0.5 до 10% поверхностно-активного вещества (от веса всей эмульсии). Преимущественно мы используем примерно от 1 до 4% (по весу).
Эмульсии в соответствии с настоящим изобретением могут также содержать масло, которое не обладает существенной поверхностной активностью и растворимостью в воде. Такие масла описаны, например, в ЕР 231, 091, WO 89/10118 и в U. S. Pat. 4,866,096. Они включают жидкие жирные масла, углеводороды, парафины, такие как сложные моноэфиры жирной кислоты и моногидроксид спирта, простые эфиры с длинными цепями, ди- и триглицериды, силиконовые масла и нитрилы. Наиболее полезными в этих классах маслами являются пальметиновый олеат, октилнитрил, додецилнитрил, соевое масло, сафлоровое масло, минеральное масло, гексадекан, ди- и триглицериды, имеющие C12-C18 углеродную цепь. Конечно, может быть использована любая смесь триглицеридов и/или масел, подобных триглицеридам в композициях с жирными кислотами. Эти масла могут использоваться в эмульсиях и способах в соответствии с настоящим изобретением как самостоятельно, так и в различных комбинациях. В тех случаях, когда наши эмульсии должны использоваться в медицинских целях, такое масло или их комбинация должны быть, конечно, биологически приемлемыми жидкими жирными маслами, такими как соевое и сафлоровое масла.
Количество масла или масел, если они присутствуют, в эмульсиях в соответствии с настоящим изобретением может варьироваться в достаточно широких пределах в зависимости от концентрации и свойств других компонентов эмульсии, причем принципиально оно определяется характеристиками эмульсии гидрида ПФУ эфира. Концентрацию масла, необходимую для приготовления эмульсии при любом заданном составе ее компонентов, легко определить в соответствии с настоящим изобретением, используя достаточно несложную технику приготовления эмульсий при различных концентрациях масла. В соответствии с нашими рекомендациями, мы обычно используем от 0.5 до 20% по объему масла или смеси масел. Преимущественно, мы используем от 1 до 5% по объему.
Кроме гидридов ПФУ эфиров, масел, поверхностно-активных веществ и воды, эмульсии в соответствии с настоящим изобретением могут также содержать другие компоненты, обычно используемые в искусственной крови или в заменителях крови, в носителях кислорода или в контрастных средах. Например, эмульсии в соответствии с настоящим изобретением содержат обычно изотонический агент, как правило, сахара, такие как глюкоза, манноза и фруктоза, глицерин или другие полигидридные спирты, позволяющие регулировать осмотическое давление в эмульсии приблизительно до уровня осмотического давления в крови. Осмотичность может также регулироваться после стерилизации с помощью буферов, таких как хлорид натрия, двууглекислый натрий, хлорид магния и им подобные, для того, чтобы уменьшить вероятность повреждения красных кровяных телец. Например, мы обычно используем примерно от 1% до 2,5% (по весу эмульсии) таких агентов. Однако могут быть также использованы другие количества и другое осмотическое давление контролирующих агентов, например раствора Tyrode. Кроме того, эти эмульсии могут смешиваться с 0.9% раствором поваренной соли, раствором лактата Рингера и сывороткой или ее продуктами, не оказывающими неблагоприятного действия на размер частиц эмульсии и ее стабильность. Эмульсии в соответствии с настоящим изобретением могут также включать другие компоненты, такие как осмотические агенты, например декстран или гидроксиэтиловый крахмал (HES), и антиоксиданты.
В эмульсиях в соответствии с настоящим изобретением наиболее предпочтительно используются гидрид C9-C10– эфира, лецитин яичного желтка как поверхностно-активное вещество и сафлоровое масло, если масло включается в состав эмульсии. Для регулирования изотоничности в эмульсию добавляют глицерин. Наиболее предпочтительно в эмульсиях в соответствии с настоящим изобретением гидриды ПФУ эфира составляют примерно 40% по объему, лецитин – примерно 2% по весу или объему и сафлоровое масло, если оно присутствует в эмульсии, составляет примерно 2% от объема эмульсии.
Как уже отмечалось, эмульсии в соответствии с настоящим изобретением могут успешно использоваться в качестве контрастного вещества при различных биологических визуально воспринимаемых способах воздействия, таких, например, как ядерный магнитный резонанс, 19F-магнитный резонанс, ультразвуковые и рентгеновские методы, способ компьютерной томографии. Кроме того, как контрастные агенты эмульсии полезны и для прямой визуализации в 19F-магнитном резонансе. При использовании в качестве контрастной среды эмульсии в соответствии с настоящим изобретением могут приниматься в виде пилюль, орально, подкожно, внутрибрюшинно, через синовиальное влагалище сухожилия или иными медицински допустимыми методами приема, например с помощью катетера, лишь бы эмульсии обеспечивали достаточно четкое выделение желаемой части или частей организма.
Эмульсии в соответствии с настоящим изобретением могут использоваться в качестве искусственной крови и вводиться внутривенно животным или человеку при малокровии или при недостатке кислорода в крови. Кроме этого, эти эмульсии могут использоваться в консервантах для сохранения внутренних органов вне организма при трансплантациях. Эффективность использования высокофторированных органических соединений, содержащих эмульсии, для сохранения органов вне организма человека или животного демонстрируется в публикациях Kawamura et al., “A New Simple Two Lauer (Euro-Collins’ Solution/Perfluorochemical) Cold Storage Method For Pancreas Preservation”, Transplantation Proc., pp. 1376-77 (1989); Segel and Ensunsa, “Albumin Improves Stability And Longevity Of Perfluorochemical-Perfused Hearts”, Am. J. Physiol 254, pp.H1105-12 (1988); Segel et al. “Prolonged Support Of Working Rabbit Hearts Using Flusol-43 Or Erithrocyte Media”, Am J. Physol. 252, pp. H349-59 (1987); Segal and Rending, “Isolated Working Rat Heart Perfusion With Perfluorochemical Fluosol-43”, Am J. Physol 242, pp. H485-89 (1982). Эмульсии в соответствии с настоящим изобретением подобны по своим свойствам упоминаемым в этих публикациях.
Способность гидридов ПФУ эфиров, диспергированных как эмульсии, переносить кислород делают их полезными в лучевой и химиотерапии рака, в коронарной ангиопластике, при лечении сердечного приступа, мозгового удара и других сосудистых заболеваний. Публикации, демонстрирующие полезность таких эмульсий в лучевой и химиотерапии рака, включают работы Teicher and Rose, “Oxyden-Carrying Perfluorochamical Emulsion As An Adjuvant To Radiation Therapy In Mice”, Cancer Res. 44, pp. 4285-88 (1984); Teicher and Rose, “Effects Of Dose And Scheduling On Growth Delay Of The Lewis Lung Carcinoma Produced By The Perfluorochemical Emulsion, Fluodol-DA”, Int. J. Radiation Oncology Biol. Phys. 12, pp. 1311-13 (1986); Rockwell et al., “Reactions Of Tumors And Normal Tissues In Mice To Irradiation In The Presence And Absence Of A Perfluoerochemical Emulsion”, Int. J. Radiation Oncology Biol Phys. 12, pp. 1315-18 (1986); Teicher and Rose, “Perfluorochemical Emulsions Can Increase Tumor Radiosensivity”, Science, 223, pp. 934-36 (1984); Teicher et al., “Effect Of Various Oxygenation Conditions And Fluosol-DA on Cytotoxicity And Antitumor Activity Of Bleomycin In Mice”, J. Nail. Cancer Inst. 80, pp. 599-603 (1988). Эмульсии в соответствии с настоящим изобретением подобны по своим свойствам, упоминаемым в этих публикациях. Эффективность использования эмульсий, содержащих высокофторированные органические соединения, для минимизации нежелательных эффектов при коронарной ангиопластике демонстрируется в публикациях “Virmani et al., “Myocardial Protection By Perfluorochamical Infusion During Transient Ischemia Produced By Balloon Coronary Occlusion”, Am. Heart J. 116, pp. 421-31 (1988); Jaffe et al., “Preservation Of Left Ventricular Ejection Fraction During Percutanious Coronary Angioplasty By Distal Transcatheter Coronary Perfusion Of Oxygenated Fluosol DA 20%”, Am. Heart J., 115, pp. 1156-64 (1988); Cleman et al., “Prevention Of Inchemia During Percutaneous Transluminal Coronary Angioplasty By Transcatheter Infusion Of Oxygenated Fluosol DA 20%”, Circulation. 74, pp. 555-62 (1986); Anderson et al. “Distal Coronary Artery Perfusion During Percutaneous Transluminal Coronary Angioplasty”, Am. Heart J., 110, pp. 720-26 (1984). Эмульсии в соответствии с настоящим изобретением применимы для аналогичных целей.
Эффективность использования эмульсий, содержащих высокофторированные органические соединения, при лечении сердечного приступа, мозгового удара и сосудистых заболеваний демонстрируется в публикациях Peerless et al. “Modification Of Cerebral Ischemia With Fluosol”, Stroke, 16, pp. 38-43 (1985); Osterholm et al. “Severe Perfusion With An Oxygenated Fluorocarbon Emulsion”, Neurosura, 13, pp. 381-87 (1983); Peerless et al. “Protective Effect Of Fluosol-DA In Acute Cerebral Ischemia”, Stroke. 12, pp. 558-63 (1981); Forman et al. “Reduction Of Infarct Size With Intracoronary Perfluorochemical In A Canine Preparation Of Reperfusion”, Circulation. 71, pp. 1060-68 (1985). Эмульсии в соответствии с настоящим изобретением также полезны для подобных целей.
Эмульсии в соответствии с настоящим изобретением могут быть приготовлены путем обычного смешивания фторированных компонентов гидридов перфторалкиловых эфиров (дисперсная фаза) с водной (непрерывной) фазой и поверхностно-активным веществом. Кроме того, эмульсии в соответствии с настоящим изобретением могут быть приготовлены смешением водной фазы с любым поверхностно-активным веществом и, по выбору, с осмотическими агентами, буферными агентами, электролитами, если необходимо другими эмульгаторами, дополнительными антиоксидантами и прочими компонентами, подобными им, в водную дисперсию. Гидриды перфторалкиловых эфиров могут быть затем смешаны с водной дисперсией так, чтобы получить эмульсию в соответствии с настоящим изобретением.
Эмульсии в соответствии с настоящим изобретением могут быть получены путем предварительного смешивания водной дисперсии с любым подходящим поверхностно- активным веществом (веществами) и по выбору с известными компонентами искусственной крови, например осмотическими агентами и им подобными. Масло, если оно присутствует, также может быть введено в определенном количестве в описанную выше водную дисперсию. Затем в эту водную дисперсию для получения эмульсии в соответствии с настоящим изобретением могут быть введены гидриды перфторалкиловых эфиров, F-31 (ICI, Wilmington, DE). См., например, Riess et al. , “Design, Synthesis And Evaluation Of Fluorocarbons And Surfactans For In Vivo Applications, New Perfluoroalkylated Polyhydrohylated Surfactans”, Artif. Cells Artif. Organs. 16, pp.421-30 (1988). Комбинации этих поверхностно-активных веществ могут, конечно, использоваться в эмульсиях в соответствии с настоящим изобретением. Кроме того, смеси соединений, одно или более из которых не являются поверхностно-активными веществами, но совместные соединения которых действуют как поверхностно-активные вещества, также могут быть использованы в качестве поверхностно-активного компонента в эмульсиях в соответствии с настоящим изобретением.
Хотя подобные композиции могут в общем рассматриваться как эмульсии, необходимо отдавать себе отчет в том, что они могут быть растворами, мицеллярными растворами, микроэмульсиями, везикулярными суспензиями или смесями всех этих физических состояний. Соответственно, используемый здесь термин “эмульсия” включает все эти состояния и поверхностно-активное вещество или растворяющий агент используется для того, чтобы повысить стабильность смесей этих состояний и увеличить стабильность их водной и масляной фаз.
Поверхностно-активные вещества, используемые в эмульсиях в соответствии с настоящим изобретением, являются физиологически приемлемыми, например преимущественно используются одно или несколько из следующих веществ: яичный или соевый фосфатиды, лецитин, алкиловые соли олеиновой кислоты, такие как олеат натрия. Наиболее предпочтительным является лецитин. Хотя количество конкретного поверхностно-активного вещества, используемого в эмульсиях в соответствии с настоящим изобретением, зависит от количества и свойств других компонентов эмульсии, обычно мы используем от 0.5 до 10% поверхностно-активного вещества (от веса всей эмульсии). Преимущественно мы используем примерно от 1 до 4% (по весу).
Эмульсии в соответствии с настоящим изобретением могут также содержать масло, которое не обладает существенной поверхностной активностью и растворимостью в воде. Такие масла описаны, например, в ЕР 231, 091, WO 89/10118 и в U. S. Pat. 4,866,096. Они включают жидкие жирные масла, углеводороды, парафины, такие как сложные моноэфиры жирной кислоты и моногидроксид спирта, простые эфиры с длинными цепями, ди- и триглицериды, силиконовые масла и нитрилы. Наиболее полезными в этих классах маслами являются пальметиновый олеат, октилнитрил, додецилнитрил, соевое масло, сафлоровое масло, минеральное масло, гексадекан, ди- и триглицериды, имеющие C12-C18 углеродную цепь. Конечно, может быть использована любая смесь триглицеридов и/или масел, подобных триглицеридам в композициях с жирными кислотами. Эти масла могут использоваться в эмульсиях и способах в соответствии с настоящим изобретением как самостоятельно, так и в различных комбинациях. В тех случаях, когда наши эмульсии должны использоваться в медицинских целях, такое масло или их комбинация должны быть, конечно, биологически приемлемыми жидкими жирными маслами, такими как соевое и сафлоровое масла.
Количество масла или масел, если они присутствуют, в эмульсиях в соответствии с настоящим изобретением может варьироваться в достаточно широких пределах в зависимости от концентрации и свойств других компонентов эмульсии, причем принципиально оно определяется характеристиками эмульсии гидрида ПФУ эфира. Концентрацию масла, необходимую для приготовления эмульсии при любом заданном составе ее компонентов, легко определить в соответствии с настоящим изобретением, используя достаточно несложную технику приготовления эмульсий при различных концентрациях масла. В соответствии с нашими рекомендациями, мы обычно используем от 0.5 до 20% по объему масла или смеси масел. Преимущественно, мы используем от 1 до 5% по объему.
Кроме гидридов ПФУ эфиров, масел, поверхностно-активных веществ и воды, эмульсии в соответствии с настоящим изобретением могут также содержать другие компоненты, обычно используемые в искусственной крови или в заменителях крови, в носителях кислорода или в контрастных средах. Например, эмульсии в соответствии с настоящим изобретением содержат обычно изотонический агент, как правило, сахара, такие как глюкоза, манноза и фруктоза, глицерин или другие полигидридные спирты, позволяющие регулировать осмотическое давление в эмульсии приблизительно до уровня осмотического давления в крови. Осмотичность может также регулироваться после стерилизации с помощью буферов, таких как хлорид натрия, двууглекислый натрий, хлорид магния и им подобные, для того, чтобы уменьшить вероятность повреждения красных кровяных телец. Например, мы обычно используем примерно от 1% до 2,5% (по весу эмульсии) таких агентов. Однако могут быть также использованы другие количества и другое осмотическое давление контролирующих агентов, например раствора Tyrode. Кроме того, эти эмульсии могут смешиваться с 0.9% раствором поваренной соли, раствором лактата Рингера и сывороткой или ее продуктами, не оказывающими неблагоприятного действия на размер частиц эмульсии и ее стабильность. Эмульсии в соответствии с настоящим изобретением могут также включать другие компоненты, такие как осмотические агенты, например декстран или гидроксиэтиловый крахмал (HES), и антиоксиданты.
В эмульсиях в соответствии с настоящим изобретением наиболее предпочтительно используются гидрид C9-C10– эфира, лецитин яичного желтка как поверхностно-активное вещество и сафлоровое масло, если масло включается в состав эмульсии. Для регулирования изотоничности в эмульсию добавляют глицерин. Наиболее предпочтительно в эмульсиях в соответствии с настоящим изобретением гидриды ПФУ эфира составляют примерно 40% по объему, лецитин – примерно 2% по весу или объему и сафлоровое масло, если оно присутствует в эмульсии, составляет примерно 2% от объема эмульсии.
Как уже отмечалось, эмульсии в соответствии с настоящим изобретением могут успешно использоваться в качестве контрастного вещества при различных биологических визуально воспринимаемых способах воздействия, таких, например, как ядерный магнитный резонанс, 19F-магнитный резонанс, ультразвуковые и рентгеновские методы, способ компьютерной томографии. Кроме того, как контрастные агенты эмульсии полезны и для прямой визуализации в 19F-магнитном резонансе. При использовании в качестве контрастной среды эмульсии в соответствии с настоящим изобретением могут приниматься в виде пилюль, орально, подкожно, внутрибрюшинно, через синовиальное влагалище сухожилия или иными медицински допустимыми методами приема, например с помощью катетера, лишь бы эмульсии обеспечивали достаточно четкое выделение желаемой части или частей организма.
Эмульсии в соответствии с настоящим изобретением могут использоваться в качестве искусственной крови и вводиться внутривенно животным или человеку при малокровии или при недостатке кислорода в крови. Кроме этого, эти эмульсии могут использоваться в консервантах для сохранения внутренних органов вне организма при трансплантациях. Эффективность использования высокофторированных органических соединений, содержащих эмульсии, для сохранения органов вне организма человека или животного демонстрируется в публикациях Kawamura et al., “A New Simple Two Lauer (Euro-Collins’ Solution/Perfluorochemical) Cold Storage Method For Pancreas Preservation”, Transplantation Proc., pp. 1376-77 (1989); Segel and Ensunsa, “Albumin Improves Stability And Longevity Of Perfluorochemical-Perfused Hearts”, Am. J. Physiol 254, pp.H1105-12 (1988); Segel et al. “Prolonged Support Of Working Rabbit Hearts Using Flusol-43 Or Erithrocyte Media”, Am J. Physol. 252, pp. H349-59 (1987); Segal and Rending, “Isolated Working Rat Heart Perfusion With Perfluorochemical Fluosol-43”, Am J. Physol 242, pp. H485-89 (1982). Эмульсии в соответствии с настоящим изобретением подобны по своим свойствам упоминаемым в этих публикациях.
Способность гидридов ПФУ эфиров, диспергированных как эмульсии, переносить кислород делают их полезными в лучевой и химиотерапии рака, в коронарной ангиопластике, при лечении сердечного приступа, мозгового удара и других сосудистых заболеваний. Публикации, демонстрирующие полезность таких эмульсий в лучевой и химиотерапии рака, включают работы Teicher and Rose, “Oxyden-Carrying Perfluorochamical Emulsion As An Adjuvant To Radiation Therapy In Mice”, Cancer Res. 44, pp. 4285-88 (1984); Teicher and Rose, “Effects Of Dose And Scheduling On Growth Delay Of The Lewis Lung Carcinoma Produced By The Perfluorochemical Emulsion, Fluodol-DA”, Int. J. Radiation Oncology Biol. Phys. 12, pp. 1311-13 (1986); Rockwell et al., “Reactions Of Tumors And Normal Tissues In Mice To Irradiation In The Presence And Absence Of A Perfluoerochemical Emulsion”, Int. J. Radiation Oncology Biol Phys. 12, pp. 1315-18 (1986); Teicher and Rose, “Perfluorochemical Emulsions Can Increase Tumor Radiosensivity”, Science, 223, pp. 934-36 (1984); Teicher et al., “Effect Of Various Oxygenation Conditions And Fluosol-DA on Cytotoxicity And Antitumor Activity Of Bleomycin In Mice”, J. Nail. Cancer Inst. 80, pp. 599-603 (1988). Эмульсии в соответствии с настоящим изобретением подобны по своим свойствам, упоминаемым в этих публикациях. Эффективность использования эмульсий, содержащих высокофторированные органические соединения, для минимизации нежелательных эффектов при коронарной ангиопластике демонстрируется в публикациях “Virmani et al., “Myocardial Protection By Perfluorochamical Infusion During Transient Ischemia Produced By Balloon Coronary Occlusion”, Am. Heart J. 116, pp. 421-31 (1988); Jaffe et al., “Preservation Of Left Ventricular Ejection Fraction During Percutanious Coronary Angioplasty By Distal Transcatheter Coronary Perfusion Of Oxygenated Fluosol DA 20%”, Am. Heart J., 115, pp. 1156-64 (1988); Cleman et al., “Prevention Of Inchemia During Percutaneous Transluminal Coronary Angioplasty By Transcatheter Infusion Of Oxygenated Fluosol DA 20%”, Circulation. 74, pp. 555-62 (1986); Anderson et al. “Distal Coronary Artery Perfusion During Percutaneous Transluminal Coronary Angioplasty”, Am. Heart J., 110, pp. 720-26 (1984). Эмульсии в соответствии с настоящим изобретением применимы для аналогичных целей.
Эффективность использования эмульсий, содержащих высокофторированные органические соединения, при лечении сердечного приступа, мозгового удара и сосудистых заболеваний демонстрируется в публикациях Peerless et al. “Modification Of Cerebral Ischemia With Fluosol”, Stroke, 16, pp. 38-43 (1985); Osterholm et al. “Severe Perfusion With An Oxygenated Fluorocarbon Emulsion”, Neurosura, 13, pp. 381-87 (1983); Peerless et al. “Protective Effect Of Fluosol-DA In Acute Cerebral Ischemia”, Stroke. 12, pp. 558-63 (1981); Forman et al. “Reduction Of Infarct Size With Intracoronary Perfluorochemical In A Canine Preparation Of Reperfusion”, Circulation. 71, pp. 1060-68 (1985). Эмульсии в соответствии с настоящим изобретением также полезны для подобных целей.
Эмульсии в соответствии с настоящим изобретением могут быть приготовлены путем обычного смешивания фторированных компонентов гидридов перфторалкиловых эфиров (дисперсная фаза) с водной (непрерывной) фазой и поверхностно-активным веществом. Кроме того, эмульсии в соответствии с настоящим изобретением могут быть приготовлены смешением водной фазы с любым поверхностно-активным веществом и, по выбору, с осмотическими агентами, буферными агентами, электролитами, если необходимо другими эмульгаторами, дополнительными антиоксидантами и прочими компонентами, подобными им, в водную дисперсию. Гидриды перфторалкиловых эфиров могут быть затем смешаны с водной дисперсией так, чтобы получить эмульсию в соответствии с настоящим изобретением.
Эмульсии в соответствии с настоящим изобретением могут быть получены путем предварительного смешивания водной дисперсии с любым подходящим поверхностно- активным веществом (веществами) и по выбору с известными компонентами искусственной крови, например осмотическими агентами и им подобными. Масло, если оно присутствует, также может быть введено в определенном количестве в описанную выше водную дисперсию. Затем в эту водную дисперсию для получения эмульсии в соответствии с настоящим изобретением могут быть введены гидриды перфторалкиловых эфиров,Приготовленную эмульсию стерилизуют преимущественно при температурах выше 115oC, более предпочтительно при 121oC, и направляют для дальнейшего хранения и использования. Смешение, предварительное смешение при желании и эмульгирование компонентов может быть выполнено с помощью любых стандартных смесителей, гомогенизаторов и диспергаторов, Например, могут быть использованы миксеры и диспергаторы фирмы Fisher и гомогенизаторы фирмы Gaulin. При приготовлении эмульсий в соответствии с настоящим изобретением мы предпочитаем использовать инертную атмосферу, например N2, для предотвращения распада поверхностно-активных веществ и жирных масел, при их наличии, при этом поддерживают температуру в пределах 45o-55oС. Изобретение иллюстрируется далее следующими примерами, однако, конкретные материалы и их количество, а также конкретные условия и детали, приведенные в этих примерах, не должны сужать настоящее изобретение. 1. ПРИГОТОВЛЕНИЕ ГИДРИДОВ ПФУ ЭФИРОВ Пример 1. Приготовление C8F17-O-C2F4H из C8F12-O-C2F4CO2CH3 Исходный органический материал, C8H17-O-C2H4CO2CH3, был приготовлен по щелочному каталитическому способу Мишеля добавлением n-октанола к акрилонитрилу, после чего следовал кислотно-каталитический метанолиз. Метиловый сложный эфир был непосредственно фторирован F2 с получением фторированного сложного эфира C8F17-O-C2F4CO2CH3. Это фторирование проводили в 2-литровом реакционном сосуде из металла MonelTM с рубашкой, мешалкой с магнитным приводом, линиями подачи газа и органического реагента и парциальным конденсатором горячего орошения. Линия подачи газа представляла собой трубку диаметром 0.3 см, которая располагалась под крыльчаткой мешалки. Линия подачи реагента была выполнена в виде трубки диаметром 0.15 см, соединенной с впрыскивающим насосом. Парциальный конденсатор горячего орошения состоял из двух 6-метровых спиральных концентрических труб, причем диаметр внутренней трубы был 1.27 см, диаметр внешней трубы 2.54 см. Газы из реактора охлаждались во внутренней трубе хладагентом, водой с добавкой этиленгликоля, протекающим между двумя трубами. Реактор заполняли примерно 1.8 литрами хлорфторуглерода FreonTM 113 и очищали потоком азота со скоростью 650 мл/мин в течение 20 минут. Газовый поток заменяли затем потоком смеси 310 мл/мин фтора и 1100 мл/мин азота. Через 12 минут 100 г C8H17-O-C2H4CO2CH3, разбавленные до 260 мл хлорфторуглеродом FreonTM 113, подавали в реактор со скоростью 13 мл/ч (5 г/ч). В процессе фторирования в реакторе поддерживали температуру примерно 16-18oC. Температура конденсации составляла около -22oC. Подача фтора продолжалась еще в течение 10 минут после завершения подачи органического реагента. Затем реактор очищали азотом в течение одного часа. Раствор сырого перфорированного сложного эфира в FreonTM 113 обрабатывали 150 мл 14% BF3 в метаноле при интенсивном перемешивании в течение 24 часов. Смесь промывали водой, высушивали MgSO4 и перегоняли (точка кипения 40oC и давление 0,2 Торр. (2,2 мм рт. ст.)) до получения C8F17-O-C2F4CO2CH3 (47% выход). Для декарбоксилирования 39 г 85% КОН растворяли примерно в 300 мл этиленгликоля и в этот раствор добавляли при комнатной температуре по каплям при помешивании вышеописанный фторированный метиловый сложный эфир. После этого реакционная смесь имела pH от 8 до 9. Смесь медленно нагревали при помешивании и продукт декарбоксилирования, C8F17-O-C2F4H, перегоняли вместе с метанолом для предотвращения омыления его метиловым эфиром, водой из КОН и небольшим количеством этиленгликоля. Когда температура реакционной смеси достигала 170oC, нагревание прекращали. Более низкую фторированную фазу дистиллята отделяли, промывали водой, сушили и перегоняли на Snyder колонне, снабженной тремя тарелками. Основная фракция, кипящая при 146-150oC, давала выход 122 г конечного продукта. Газовая хроматография и масс-спектрометрия образца продукта показали, что чистота продукта составляет 94% и он соответствует структурной формуле C8F17-O-C2F4H. Пример 2. Приготовление C8F17-O-C2F4H из C8F17-O-C2F4CO2H C8F17-O-C2-H4CO2CH3 был приготовлен по щелочному каталитическому способу Мишеля добавлением n-октанола к акрилонитрилу, после чего следовал кислотно-каталитический метанолиз. Сложный эфир карбоновой кислоты напрямую фторировали по существу тем же, описанным в примере 1 способом для получения при гидролизе соответствующей кислоты простого эфира, C8F17-O-C2F4COOH. Раствор 116 г 85% КОН в 800 мл этиленгликоля получали в 3 л колбе с круглым дном. 1000 г C8F17-O-C2F4CO2H добавляли по каплям в раствор КОН. После этого добавляли дополнительно 10 г КОН и смесь нагревали. Фторированный продукт декарбоксилирования перегоняли совместно с небольшим количеством воды, чтобы предотвратить нейтрализацию кислоты. Более низкую фторированную фракцию дистиллята отделяли, промывали подсоленной водой, сушили с помощью Na2SO4 и перегоняли аналогично примеру 1 с получением 817 г C8F17-O-C2F4H. Пример 3. Получение C7F15-C2F4H из C7F15-O-C2F4CO2CH3 C7H15-O-C2H4CO2CH3 был приготовлен по щелочному каталитическому способу Мишеля добавлением n-гептанола к акрилонитрилу, после чего следовал кислотно-каталитический метанолиз. 550 г соответствующего метилового эфира, C7F15-O-C2F4COOCH3, полученного аналогично примеру 1, добавляли по каплям в раствор, содержащий 166.5 г КОН и 880 мл этиленгликоля. Фторированный продукт (выход 440 г) получали аналогично, перегоняли на Snyder колонне с шестью тарелками и фракцию с температурой кипения от 130 до 131oC отбирали. Эту фракцию смешивали с 8.5 г MnO4 и с примерно 350 г ацетона и нагревали. Через 4 часа добавляли дополнительно 5 г MnO4, и полученную смесь нагревали в течение 3 часов. Затем смесь фильтровали, осадок промывали ацетоном и к фильтрату добавляли воду для образования более низкой фторированной фазы, которую затем промывали водой, концентрированной H2SO4, снова водой и затем фильтровали через двуокись кремния. Исследования способами 1H и 19F-ядерного магнитного резонанса подтвердили, что продукт реакции имеет соответствующую структуру, C7F15-O-C2F2H. Газожидкостная хроматография образца показала, что он имеет чистоту 98.7%. Пример 4. Получение C6F13-O-C2F4-O-CF2H из C6F13-O-C2F4-OCF2CO2CH3 Исходный материал, C6H13-O-C2H4-O-C2H4-O-COCH3, получили с помощью ацетилирования гексилоксиэтоксиэтанола с ацетилхлоридом. Ацетат затем превратили в C6F13-O-C2F4-OCF2CO2CH3 с помощью по существу тех же процессов фторирования и метанолиза, что и в примере 1. Затем 548 г этого фторированного соединения смешали с 144.2 г КОН и 600 г этиленгликоля. Результирующую смесь нагрели, перегнали и получили готовый продукт, C6F13-O-C2F4-OCF2H, как в примере 1. Полный выход продукта составляет 433 г. Затем продукт снова перегоняют (точка кипения 131oC) на 12” (30,5 см) колонне при атмосферном давлении. Исследования с помощью 1H и 19F-ЯМР показали, что продукт имеет структуру, соответствующую формуле C6F13-O-C2F4-OCF2H. GC/MS исследования показали, что образец имеет чистоту 99.6%. Пример 5. Приготовление C8F17-O-CF2H из C8F17-O-CF2-CO2CH3 C8-H17-O-C2H4-O-(CO)CF3 получили с помощью ацетилирования октилоксиэтанола трифторуксусным ангидридом. 100 г трифторацетата напрямую фторировали в соответствии по существу с той же процедурой фторирования, что и в примере 1, и полученный продукт охлаждали раствором BF3 в метаноле с получением C8H17-O-CF2-CO2CH3, который в дальнейшем был очищен перегонкой при точке кипения 92-97oC и 20 мм рт. ст. 58 г образец последнего метилового сложного эфира декарбоксилируют, используя 10.8 г КОН в этиленгликоле, и получают продукт, C8F17-O-CF2H. Структура этого продукта подтверждается 19F-ЯМР. Газожидкостная хроматография показала, что продукт имеет чистоту 99.6%, точка кипения 134-136oC. Пример 6. Приготовление C4F9-O-(CF2)5H из C4F9-O(CF2)5-CO2H 118.2 г (1.0 моль) гексан-1,6-диола, 4.4 г AdogenTM 464 соли четвертичного аммония, 80.0 г (2.0 моля) NaOH и 250 мл тетрагидрофурана перемешали при орошении. Для улучшения смешивания добавили 80 мл воды. Через 20 мин в течение 0.5 часа добавляли 137 г (1 моль) бутилбромида и смесь перемешивали в течение ночи. Полученную реакционную смесь охладили в 1 л H2O, верхний слой соединили с экстрактом простого эфира нижнего слоя, высушили с помощью MgSO4 и перемешали на ротационном испарителе. Обработка полученного слоя в 100 мл CHCl3 с добавлением по капле 150 мл ацетилхлорида, последующее 4-часовое нагревание при орошении и удаление растворителя дали 225.4 г жидкого продукта. Перегонка этой жидкости дала 176.0 г дистиллята (точка кипения 100-104oC/0.9 мм рт. ст. ). Газожидкостная хроматография показала, что необходимый 6-бутоксигексилацетат вместе с гександиолдиацетатом и дибутоксигексаном составили 56% полученного продукта. 100 г этой смеси фторировали в соответствии по существу с процедурой фторирования примера 1. В результате обработки полученного фторированного продукта 30 мл 10 вес.% раствора H2SO4 в H2О, встряхивания в течение 2 часов при комнатной температуре, фильтрации твердой фторированной адипиновой кислоты, выделения слоя F-113, высушивания с помощью MnSO4 и перегонки получили основную фракцию из 73.4 г C4F9-O-(CF2)5COOH 96% чистоты (точка кипения 116oC/20 мм рт. ст.). Последний добавили в раствор, состоящий из 10.0 г (0.25 моль) NaOH и 100 мл этиленгликоля, и смесь нагрели до 120oC вместе с побочным продуктом процесса фторирования C4F9-O(CF2)6-O-C4F9, собирающимся в Dean-Stark ловушке. При дальнейшем нагревании началось выделение газа и жидкая фракция, C4H9-O(CF)5-H (44.6 г), которая была собрана в ловушке, полностью испарилась при 170oC. Полученную жидкость высушили с помощью силикагеля и перегнали на 4-дюймовой (10.2 см) Vigreux колонне до получения 38.8 г продукта с точкой кипения 131oC. 19F-ЯМР подтвердил, что полученный продукт имеет структуру C4F9-O-(CF2)5H. Пример 7. Приготовление C5F11-O-(CF2)5H из C5F11-O-(CF2)5COOH Аналогично примеру 6 гександиол алкилирован n-пентилбромидом, продукт ацетилировали, а сырой ацетат С5H11-O- (CH2)6ОС(O)CH3 перегнали (точка кипения 125oC/3 мм рт. ст.) и дистиллят фторировали в соответствии с аналогичной процедурой в примере 1. Фторированный сложный эфир гидролизовали до соответствующей соли. Декарбоксилирование фторированной кислоты, C5F11O(CF2)5COOH, щелочью NaOH дало 829 г продукта. Этот продукт был промыт водой, высушен с помощью MgSO4 и его перегнали до получения 555 г C5F11-O-(CF2)5H (точка кипения 145-149oC). Пример 8. Приготовление C4F9-O-CF2C(CF3)2CF2H с помощью C4F9-O-CF2C(CF3)2CF2Cl Алкилирование 2,2-диметил-1,3-пропандиола n-бутилбромидом, выполненное аналогично примеру 8, дает сырой моноалкилированный продукт, который обработали SOCl2 и получили С4H9-O-СН2С(CH3)2CH2Cl, точка кипения 80-90oC/20-30 мм рт. ст. Это соединение затем фторировали аналогично примеру 1 для получения С4F9-O-CF2C(CF3)2CF2Cl. 20 г последнего хлорида смешали с 5.3 г смоченного в воде Raney Ni и 50 мл NH3-насыщенного метанола. Эту смесь удаляют встряхиванием на Parr аппарате гидрирования в течение 3 дней при 25oC с максимальным перепадом давления водорода в первый день 21 кПа (3 psig). Продукт в количестве 7.9 г с некоторыми механическими потерями получили путем фильтрации и охлаждения водой. 19F-ЯМР способ подтвердил, что продукт имеет структуру С4F9-O-СF2C(CF3)2CF2H. Пример 9. Приготовление H(CF2)4-O-(CF2)4H с помощью Cl(CF2)4-O-(CF2)4Cl Для получения CI(CF2)4-O-(CF2)4Cl фильтровали Cl(CH2)4-O-(CH2)4Cl. Смесь 30.3 г CI(CF2)4-O-(CF2)4Cl, 11.3 г смоченного в свежей воде Raney Ni и 200 мл метанола продували в течение нескольких минут NH3 и обработали водородом при давлении 310 кПа на Parr аппаратуре гидрирования при температуре около 25oC. Через 17 часов давление понизили до 255 кПа, и смесь стала кислой с хорошо заметным травлением стекла. Добавили снова аммоний и продолжили снижение давления с перепадом 62 кПа. Продукт реакции отфильтровали и охладили водой до получения 15.4 г боле низкой фазы. Газожидкостная хроматография показала, что 68% чистого продукта составляет H(CF2)4-O-(CF2)4H. После перегонки, точка кипения 121-124oC, получают 27.0 г продукта чистотой 87%. Пример 10. Приготовление H(CF2)4-O-(CF2)4H и Cl(CF2)4-O-(CF2)4H из Cl(CF2)4-O-(CF2)4CI Смесь 50.0 г CI(CF2)4-O-(CF2)4CI и 30 r Zn в бутаноле перемешивали при 110oC в течение 2 дней. Газожидкостная хроматография образца конечного продукта реакции показала частичное перемешивание. Добавили дополнительно 21 г Zn, и смесь нагревали в течение еще одного дня. После фильтрации и охлаждения конечного продукта в воде получили 27,0 бесцветной жидкости. Этот продукт состоял из 35% H(CF2)4-O-(CF2)4H, 42% моногидрида и 16% невосстановленного дихлорида. Пример 11. Приготовление C6F13-O-СF2CF2H из С6F13-O-С2F4СО2H Исходный материал, C6F13-O-C2H4-CO2CH3, получили по способу Michael добавлением гексанола к акрилонитрилу с последующей кислотно-каталитической этерификацией метанолом. После фторирования и гидролизации образованного сложного эфира получили C6F13-O-C2F4CO2H. 500 r кислоты, C6F13-O-C2F4CO2H, медленно добавляли в раствор 68.7 г КОН в 700 г этиленгликоля. В конце этой процедуры в гомогенный раствор дополнительно добавили 5 г КОН для получения pH, равного 9. После декарбоксилирования, выполняемого аналогично примеру 1, и перегонки получили 327 r продукта, точка кипения 104-107oC. Этот продукт обработали перманганатом калия аналогично по существу примеру 3. Газовая хроматография, масс-спектрометрия 19F-ЯМР, 1H-ЯМР и инфракрасная спектроскопия показали, что продукт имел структуру С6F13-O-СF2-CF2Н. Пример 13. Приготовление С4F9-O-(CF2)4-O-(CF2)3H из C4F9-O-C4F8-O-(CF2)3CO2CH3 Для получения C4F9-O-C4F8-O-(CF2)3CO2CH3 исходный материал, C4H9-O-С4H8-O-(CH2)3CH2OCOCH3, непосредственно фторировали и метанолизировали аналогично соответствующим процедурам примера 1. 56 г полученного продукта быстро добавили в раствор 5.6 г КОН в 250 мл этиленгликоля. Выполнили декарбоксилирование и после разделения фаз, промывки рассолом и перегонки получили продукт (точка кипения 155-158oC) 100% чистоты по газожидкостной хроматографии. Газовая хроматография, асс-спектрометрия 1H- и 19F-ЯМР исследования показали, что полученным продуктом является C4F9-O-C4F8-O-(CF2)3H. Пример 13. Приготовление C6F11CF2 -O-C2F4H из cyclo-С6F11CF2-O-С2F4C(O)OCH3 Исходный материал cyclo-С6F11CF2-O- C2F4C(O)OCH3, получили реакцией циклогексилметанола с акрилонитрилом с последующей кислотно-каталитической этерификацией с метанолом, затем его фторировали и метанолизировали BF3 в метаноле в соответствии с аналогичными по существу процедурами примера 1 и получили 65% выход cyclo-С6F11CF2OC2F4CO2CH3. 224 г последнего фторированного сложного эфира добавили в раствор 28.8 г 85% КОН и 466 г этиленгликоля при 60oC. Полученную смесь затем нагрели до 100oC и ее pH довели до pH больше 7 добавлением 5 г 45 вес.% водного КОН. Декарбоксилирование выполняли с помощью перегонки результирующей смеси. Более низкую фторированную фазу дистиллята отделили, промыли в равном объеме воды и перегнали при 123-126oC для получения 155 г продукта чистотой 99.7%. Этот продукт обработали KMnO4 в ацетоне и получили cycly-С6F11CF2-O-С2F4Н. Пример 14. Приготовление С4F9-O-С2F4-O-С3F6H из С4F9-O-C2F4-O-C3F6С(O)OCH3 C4H9-O-C2 H4-O-C4H8OCOCH3 был фторирован и метанолизировали в соответствии с аналогичными по существу процедурами примера 1. Результирующий продукт, С4F9-O-С2F4-O-С3F6C(O)OCH3, в количестве 419 г быстро добавили по капле в смесь 49.4 г КОН в этиленгликоле. Полученную смесь затем медленно нагрели до конечной температуры сосуда 190oC. В процессе такого нагрева метанол из омыления сложного эфира, воду и C4F9-O-С2F4-O-С3F6H перегнали из реакционной смеси. В дистиллят добавили воду, выделили и перегнали более низкую фторированную фазу (355 г) до получения 308 г С4F9-O-С2F4-ОС3F6H (выход 82%). Пример 15. Приготовление С6F13-O-С4F8-H из C6F13-O-C4F8-CO2CH3 Исходный материал, С6F13-O-С5 H10-ОС(O)CH3, получили моноалкилированием 1,5-пентадиола с гексилбромидом с последующим ацетилированием ацетилхлоридом. Это соединение фторировали и метанолизировали по существу в соответствии с аналогичными процедурами примера 1 для получения С6F13-O-С4F8-CO2CH3, точка кипения 100oC/13 мм рт. ст. Этот сложный эфир декарбоксилировали нагреванием раствора 200 граммов эфира в 250 мл этиленгликоля с 30 г КОН до тех пор, пока не перегнали гибрид. Эту жидкость промыли водой, осушили с помощью MgSO4 и получили 128 г C6F13-O-C4F8-H 82% чистоты. Затем продукт еще очистили перегонкой, используя двенадцатитарельчатую стеклянную колонну, точка кипения 146oC. Структуру полученного продукта подтверждают 19F-ЯМР. Пример 16. Приготовление С6F13-O-С3F6-H из С6F13-O-C3F6-CO2K Исходный материал, С6F13-O-С4H8-ОС(O)CH3, получили моноалкилированием 1,4-бутандиола с гексилбромидом с последующим ацетилированием ангидридом уксусной кислоты. Это соединение фторировали и метанолизировали в соответствии по существу с аналогичными процедурами примера 1 для получения С6F13-O-С3F6-CO2CH3. Сложный этиловый эфир омылили, используя избыток КОН, и затем осушили в вакуумной печи, чтобы получить соль калия. 575 г этой соли нагрели при помешивании в 250 мл этиленгликоля и из дистиллята получили гидридный продукт, точка кипения 129oC. Его структура была подтверждена с помощью 19F-ЯМР. Пример 17. Приготовление С5F11-O-С4F8H из C4F11-O-C4F8-CO2-Na Исходный материал, С5H11-O-С5H10-O-С(O)CH3, получили моноалкилированием 1,5-пентадиола с гексилбромидом с последующим ацетилированием ацетилхлоридом. Это соединение фторировали и метанолизировали по существу в соответствии с аналогичными процедурами примера 1 для получения С5F11-O-C4F8-СО2CH3. Сложный этиловый эфир омылили, используя избыток NaOH, декарбоксилировали и перегнали по существу, как в примере 16. Перегонка через двенадцатитарелочную стеклянную колонну дала чистый C5F11-O-C4F8-H, точка кипения 125oC. Его структура была подтверждена с помощью 19F-ЯМР. Пример 18. Приготовление С8F17OCF2OC3F6H из C8F17OCF2OC3F6CO2CH3 Исходный материал, C8H17OCH2OC4H8OH, получили моноалкилированием бутандиола с октилхлорметиловым эфиром. Этот материал сначала ацетилировали с ацетилхлоридом в метиленхлориде, содержащем триэтиламинЭ и затем фторировали. Часть сырых перфорированных продуктов метанолизировали по существу, как в примере 1, для получения C8F17OCF2OC3F6CO2CH3, имеющего температуру кипения 124-130oC при 25 мм рт. ст. Последний метиловый сложный эфир затем декарбоксилировали, используя процедуру примера 1, для получения C8F17OCF2OC3F6H, имеющего температуру кипения 178-183oC; структуры этого гидрида и промежуточного фторированного сложного эфира были подтверждены 19F-ЯМР. Пример 19. Приготовление 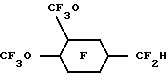 Исходный материал, метил 2-(3,4-диметоксифенил) ацетат фторировали по существу, как в примере 1, для получения после гидролиза перфтор-2-(3,4-диметоксициклогексил)уксусной кислоты. Затем продукт декарбоксилировали, как описано в примере 1, в перфторированный эфиргидрид. Пример 20. Приготовление 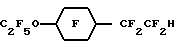 Исходный материал, метил 3-(4-этоксифенил)-транс- 2-пропеноат, получили путем конденсации 4-этоксибензальдегида и малоновой кислоты с последующей эстерификацией. Этот метиловый сложный эфир фторировали, метанолизировали и декарбоксилировали по существу, как в примере 1, для получения перфорированного эфиргидрида. Пример 21. Приготовление 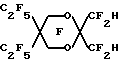 Исходный материал получили путем конденсации 2,2-диэтилпропандиола с диметил 3-оксоглютаратом. Этот диметиловый сложный эфир фторировали, метанолизировали в сложный эфир двухосновной кислоты и декарбоксилировали, как в примере 1, для получения перфторированного эфиргидрида. Пример 22. Приготовление 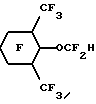 Исходный материал получили реакцией 2,6-диметилфенола с этиленкарбонатом и последующего ацетилирования с ацетилхлоридом. Этот ацетат фторировали, метанолизировали и декарбоксилировали, как в примере 1, для получения перфторированного эфиргидрида, точка кипения 132oC. Пример 23. Приготовление 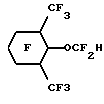 Исходный материал получили путем обработки 2-(2,6- диметилфенилокси)этанола тионилхлоридом. Его фторировали, как в примере 1, с последующим восстановлением Raney Ni хлорида, как описано в примере S, для получения перфторированного эфиргидрида, который перегнали при 145-150oC. Пример 24. Приготовление 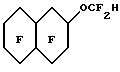 Исходный материал получили, добавляя  -нафтол к этиленкарбонату, с последующим ацетилированием ацетилхлоридом. Этот ацетат фторировали, мeтaнoлизиpoвaли и декарбоксилировали, как в примере 1, для получения перфторированного эфиргидрида, точка кипения 171oC.
Пример 25. Приготовление С7F15OCHFCF3 из С7H15OCH(CH3)CO2CH3 -нафтол к этиленкарбонату, с последующим ацетилированием ацетилхлоридом. Этот ацетат фторировали, мeтaнoлизиpoвaли и декарбоксилировали, как в примере 1, для получения перфторированного эфиргидрида, точка кипения 171oC.
Пример 25. Приготовление С7F15OCHFCF3 из С7H15OCH(CH3)CO2CH3Исходный материал получили, добавляя 2-хлорпропионовую кислоту к n-гептанолу и водному раствору гидрида натрия с последующей эстерификацией в метиловый сложный эфир. Этот сложный эфир фторировали и декарболизировали, как в примере 1, для получения перфторированного эфиргидрида, точка кипения 130oC. Пример 26. Приготовление C4F9OCHFC4F9 из (С4H9O)2CHCO2C4H9 Исходный материал получили добавлением дихлоруксусной кислоты к бутоксиду натрия в n-бутаноле и последующим окислением в бутаноле. Этот сложный эфир фторировали, метанолизировали и декарбоксилировали, как в примере 1, для получения перфторированного эфиргидрида. Пример 27. Приготовление C7F15OCHFC2F5 из C8H15OCH(C2H5)CO2CH3 Исходный материал получили, добавляя 2-бром-бутировую кислоту к n-гептанолу и гидроксиду натрия с последующей эстерификацией с метанольной HCl. Этот сложный эфир фторировали, метанолизировали и декарбоксилировали, как в примере 1, для получения перфторированного эфиргидрида. Пример 28. Приготовление С5F11OCF2C(CF3)2CF2H из С5H11OCH2C(CH3)2CH2Cl Исходный материал получили в соответствии с описанием U.S. 08/246962, регистрация 5/20/94 (ЗМ). Эфирхлорид фторировали, как в примере 1, с последующим восстановлением хлорида с помощью Raney Ni, описанным в примере 8, для получения перфторированного эфиргидрида, точка кипения 148oC. Пример 29. Приготовление (C4F9O)2CFCF2H из (С4H2O)2CHCH2Cl Исходный материал получили добавлением n-бутанола к 2-хлоруксусному альдегиду и фторировали, как в примере 1, с последующим восстановлением хлорида с помощью Raney Ni, описанным в примере 8, для получения перфторированного эфиргидрида. Пример 30. Приготовление CF3O(CF2)9H из CH3O(CH2)10OAc Исходный материал получили моноалкилированием 1,10-декандиола с помощью диметилсульфата с последующим ацетилированием ацетилхлоридом. Этот ацетат фторировали, гидролизировали и декарбоксилировали, как в примере 1, для получения перфторированного эфиргидрида. Пример 31. Приготовление C9F19OCF2H из C9H19OC2H4OAc Исходный материал получили моноалкилированием этиленгликоля с помощью n-нонил бромида с последующим ацетилированием ацетилхлоридом. Этот ацетат фторировали, гидролизировали и декарбоксилировали, как в примере 1, для получения перфторированного эфиргидрида, дистиллирующего при 153-155oC. Пример 32. Приготовление (iso-C3F7)2CFOC2F4H из (ico-C3H7)2CHOC2H4СО2CH3 Исходный материал получили, добавляя по способу Michael 2,4-диметил-3-пентанол в акрилонитрил с последующим метанолизом в метиловый сложный эфир. Этот эфир фторировали, гидролизировали и декарбоксилировали, как в примере 1, для получения перфторированного эфиргидрида. Пример 33. Приготовление C7F15OCHFCF3 из C7H15OCH(CH3)CO2CH3 Исходный материал получили, добавляя 2-хлорпропионовую кислоту в n-гептанол и гидроксид натрия с последующей эстерификацией с метанольной HCl. Этот эфир фторировали, как в примере 1, затем нагревали с пиридином для получения C7H15OCF(CF3)CO2F с потерей COF2. Этот фторангидрид декарбоксилировали, как в примере 1, добавлением в КОН в этиленгликоле и последующим нагреванием. Продукт был образован при температуре 126oC и отобран перегонкой при точке кипения 130oC. Пример 34. Приготовление 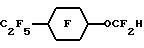 Исходный материал получили, алкилируя 4-этилфенол с метилхлорацетатом. Этот сложный эфир фторировали, гидролизировали и декарбоксилировали, как в примере 1, для получения перфорированного эфиргидрида, точка кипения 131oC. Пример 35. Приготовление 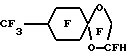 Исходный материал получили, добавляя глицерол в 4-метилциклогексанон с последующим ацетилированием ацетилхлоридом. Этот ацетат фторировали, гидролизировали и декарбоксилировали, как в примере 1, для получения перфторированного эфиргидрида, точка кипения 138oC. II. ПРИГОТОВЛЕНИЕ ЭМУЛЬСИЙ И ИХ СВОЙСТВА Эмульсии получают, используя упомянутые выше гидриды ПФУ эфиров (ГПФУЭ). В соответствии с общей процедурой сырую эмульсию, состоящую из 2 вес. или об. % лецитина яичного желтка, 2 об.% сафлорового масла, 40 об.% ГПФУЭ и воды, получают смешивая эти компоненты в инертной атмосфере (N2) при большой скорости в течение двух минут в Waring смесителе. Сырую эмульсию помещают в резервуар в инертной атмосфере, создаваемой с помощью аппарата гомогенизации MICROFLOUIDIZERTM Model N 110. Затем в течение 15 минут эту сырую эмульсию подвергают циклическому процессу через гомогенизатор при давлении примерно 562 кг/см2 и при скорости 350 мл/мин, используя давление воздуха 4,2 кг/см2, чтобы запустить поршневой насос. Температуру поддерживают ниже 50oC и pH контролируют от 7,5 до 8,5. После приготовления каждую эмульсию, содержащую 2 вес. или об.% лецитина яичного желтка, 2 об.% сафлорового масла, 40 об.% ГПФУЭ, помещают в атмосфере азота в 100 мл стеклянную колбу, эту колбу закупоривают с помощью мембран из бутилового каучука из серии TeflonTM и алюминиевыми пробками. Помещенные в колбы эмульсии стерилизуют во вращающемся стерилизаторе нагреванием во влажном тепловом потоке примерно до 121oC в течение 15 минут. Для сравнения физиологических характеристик соединений, приготовленных в виде эмульсий, оценивают последствия выведения содержащихся в них ГПФУЭ из органов крыс в течение периода до семидесяти дней или более. Как отмечалось выше, физиологически полезная эмульсия должна сохраняться в потоке крови достаточно долгое время для того, чтобы обеспечить перенос необходимого количества кислорода. С другой стороны, фторсоединение должно достаточно быстро выводиться из организма для того, чтобы избежать его удерживания частями тела и/или токсичности. Выведение ГПФУЭ, содержащегося в различных эмульсиях, из органов исследовали следующим образом. Sprague-Dawley крысам вводят дозу каждой эмульсии (10 см3/кг веса). Затем крыс умерщвляют и исследуют в дискретные моменты периода исследований. Количество фторсоединения в органах исследуют, экстрагируя его с помощью четыреххлористого углерода, содержащего 0,1-1% n-октан или n-гептан как внутренние стандарты из измельченных в TissuemizerTM тканей и анализируя экстракт органа с помощью газовой хроматографии. Полученные данные приведены в таблице в виде процентной дозы, присутствующей в печени, в течение периода в несколько дней, например запись “2-16-30” в столбце “время(дни)” означает процент дозы, присутствующей в печени через два дня, 16 дней и 30 дней после введения эмульсии. Процент дозы равен проценту полного количества ПФГУЭГ, введенного крысе. Из таблицы следует, что C9-C10-диомегагидрофторуглеродные диэфиры как группа обладают исключительными свойствами по очистке жизненно важных органов, таких как печень, очень быстро, в течение нескольких дней. Например, в соединениях 1 и 2 С9-диомегагидрофторуглеродный диэфир выводился из печени немедленно или через два для было обнаружено лишь 2.3% дозы. В случае С10-диомегагидрофторуглеродного диэфира, представленного в таблице соединением 17, через два дня было обнаружено 30.4% дозу, а через 16 дней в печени обнаружили лишь его след. Доза в печени С10-диомегагидрофторуглеродного диэфира, как показано соединением 3 в таблице, в течение 30 дней уменьшилась с 45.1% примерно до 5.6%. Исключительные свойства цикло-C9-С10 эфиргидридов демонстрируются в таблице соединениями 4-7. Например, С10 перфторциклоалкиловый моноэфиргидрид, соединение 7 в таблице, полностью покидает печень в течение 16 дней. Замечательно, что в случае С9-перфторциклоалкилового моноэфиргидрида или перфторциклоалкилзамещенного перфторциклоалкиленового моноэфиргидрида, соединения 4-6 в таблице, в печени не обнаруживают никаких следов ПФУ эфиргидрида. Таким образом, в соответствии с принципами настоящего изобретения эти соединения как класс представляют великолепные примеры физиологически приемлемых эмульсий. Активность С9-С10 моногидроперфторалкилового моно- или диэфирных соединений представлены в таблице остальными соединениями, например соединениями 8-16. В случае С9 моногидроперфторалкилового моноэфира, соединение 9 в таблице, в печени через 16 дней остается лишь 10.5% дозы ПФУ эфиргидрида. С10 моногидроперфторалкиловый моноэфир, представленный в таблице соединениями 10-12, обнаруживает тенденцию задерживаться в печени в течение более длительного периода времени, чем С9 ПФУ эфиргидрид. На основании ограниченного экспериментального материала было обнаружено, что С8 моногидроперфторалкиловый моноэфир, представленный в таблице соединением 13, является токсичным. Однако со ссылкой на смесь соединений 16 таблицы С8 диомега-гидроперфторуглеродный тетраэфир даже в сочетании с С10 диомегагидроперфторуглеродный пентаэфиром обеспечивает 100% выживание животного и выведение ее из печени происходит так же быстро, как и других диомегагидро ПФУ эфиров. Таким образом, на данный момент исключенный из более широкого класса соединений конкретный гидрид ПФУ эфира может быть приемлемым в смесях с другими соединениями. Те смеси ПФУ эфиров, которые входят в объем настоящего изобретения, называются “физиологически приемлемыми”, для того, чтобы исключить непригодные соединения. Как описано выше, атом водорода гидрида ПФУ эфира может быть связан на конце или на омега-атоме углерода углеродной цепи или на промежуточном атоме, как в случае соединения 14 в таблице, где атом водорода связан на вторичном атоме углерода, смежном с эфирной группой. В случае соединения 14 выведение этого С9 моногидрофторуглеродного моноэфира из печени был по существу аналогичен другим гидридам ПФУ эфиров в этой группе. В то время, как выше были описаны различные примеры осуществления изобретения, должно быть очевидно, что в пределах объема изобретения существуют также и другие примеры его осуществления. Поэтому следует понимать, что объем настоящего изобретения должен определяться формулой изобретения, а не представленными конкретными примерами осуществления изобретения, которые были приведены выше в качестве именно примеров. Формула изобретения
X – Rf – O(R’f -O)nR”f – H, где Н – первичный или вторичный атом водорода на атоме углерода, смежном с атомом кислорода в простом эфире; Х – атом фтора, или первичный атом водорода, или вторичный атом водорода на атоме углерода, смежном с атомом кислорода в простом эфире; n = 0 – 4, целое число; Rf, R’f и R”f – независимо выбранные из неразветвленных или разветвленных групп, состоящих из перфторалкилена, перфторциклоалкилена и перфторциклоалкилена, содержащего один или более атомов кислорода в простом эфире, при этом группы могут быть замещены атомом кислорода в простом эфире. 4. Эмульсия по любому из предыдущих пунктов, отличающаяся тем, что указанный простой эфир выбран из С9-С10дигидроперфторуглеродного эфира, гидрида С9-С10перфторциклоалкилового эфира или гидрида С9-С10перфторциклоалкилзамещенного перфторалкиленового эфира и С9-С10гидроперфторалкиловых эфиров, в которых атом водорода является первичным или вторичным атомом водорода, связанным с атомом углерода, смежным с атомом кислорода в простом эфире либо связанным с конечным или промежуточным атомом углерода, смежным с простым эфиром. 5. Эмульсия по п.4, отличающаяся тем, что указанный простой эфир выбран из H-C3F6OC4F8OC3F6-H; H-C2F4OCF2C(CF3)2CF2OC2F4-H; H-C2F4-O-(CF2)5-O-C2F4-H; H-C2F4-O-(CF2)6-O-C2F4-H; H-CF2O-(C2F4O)4CF2-H; H-C2F4-O-cyclo-C6F10-O-C2F4-H; cyclo-C6F11-CF2OC2F4H; cyclo-C6F11-OC4F8H; cyclo-C6F11-C2F4OCF2-H; p-CF3O-cyclo-C6F10-C2F4-H; 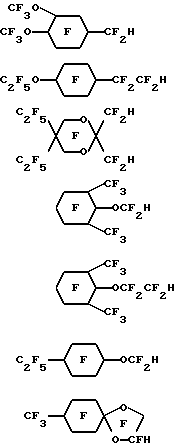 C4F9OCF(CF3)CF2O-CFH-CF3; CF3(CF2)6-O-CF2CF2-H; C8F17OCF2H; CF3(CF2)5-O-(CF2)2-O-CF2-H; C6F13-O-C4F8-H; C5F11-O-C5F10-H; C4F9-O-C2F4-O-C3F6-H; 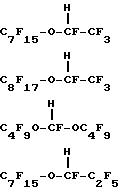 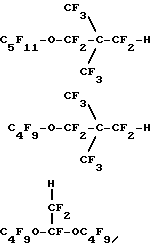 CF3O-C8F16-CF2H; C9F19-O-CF2-H и их смесей. 6. Эмульсия по любому из предыдущих пунктов, отличающаяся тем, что поверхностно-активное вещество взято в количестве приблизительно 0,5 – 10,0% от веса эмульсии. 7. Эмульсия по п.6, отличающаяся тем, что поверхностно-активное вещество взято в количестве приблизительно 1 – 4% от веса эмульсии. 8. Эмульсия по любому из предыдущих пунктов, отличающаяся тем, что простой эфир взят в количестве 10 – 75% от объема эмульсии. 9. Эмульсия по п.8, отличающаяся тем, что указанный простой эфир взят в количестве по крайней мере 40% от объема эмульсии. 10. Эмульсия по любому из предыдущих пунктов, отличающаяся тем, что в качестве поверхностно-активного вещества она содержит лецитин. 11. Эмульсия по любому из предыдущих пунктов, отличающаяся тем, что она дополнительно содержит физиологически приемлемое масло, которое не является по существу поверхностно-активным и не растворяется значительно в воде. 12. Эмульсия по п.11, отличающаяся тем, что масло выбрано из сафлорового и соевого масла. 13. Эмульсия по любому из предыдущих пунктов, отличающаяся тем, что она дополнительно содержит по крайней мере одно соединение, выбранное из изотонических агентов, агентов, контролирующих осмотическое давление, агентов, вытягивающих сыворотку, и антиоксидантов. 14. Эмульсия по любому из предыдущих пунктов, отличающаяся тем, что она представляет собой искусственную кровь, композицию для уменьшения нежелательных последствий при коронарной ангиопластике, контрастный агент для биологической визуализации, который является клинически эффективным для визуализации в методах ядерного магнитного резонанса, 19F-магнитного резонанса, ультразвукового и рентгеновского исследований и в методе компьютерной томографии, композицию для повышения эффективности лучевой и химиотерапии рака, композицию для консервации органов, содержащую эффективное для целей консервации количество эмульсии, или композицию для лечения сердечного приступа, мозгового удара и сосудистых заболеваний. Приоритет по пунктам и признакам: 17.05.95 по пп.1, 2, 4, 6 – 13; 20.05.94 по пп.3 и 5; 20.05.94 по п.14 с признаком “искусственная кровь”; 17.05.95 по п.14 с остальными признаками. РИСУНКИ
MM4A – Досрочное прекращение действия патента СССР или патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 20.05.2009
Извещение опубликовано: 20.07.2010 БИ: 20/2010
|
||||||||||||||||||||||||||
