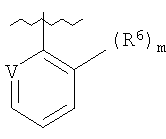Патент на изобретение №2315765
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
(54) ХИНАЗОЛИН(ДИ)ОНЫ, КОМПОЗИЦИЯ ДЛЯ БОРЬБЫ С НАСЕКОМЫМИ-ВРЕДИТЕЛЯМИ, СПОСОБ БОРЬБЫ С НАСЕКОМЫМИ-ВРЕДИТЕЛЯМИ, ПРОМЕЖУТОЧНОЕ СОЕДИНЕНИЕ
(57) Реферат:
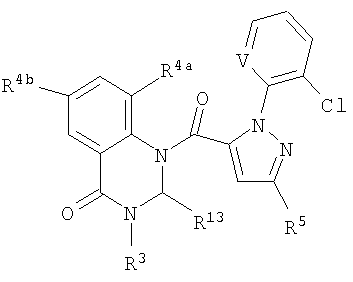
Описываются соединения формулы (1), где А и В являются 0; J является пиразольным кольцом, замещенным 2 заместителями, независимо выбранным из R5; К вместе с двумя прилегающими связывающими атомами углерода представляет фенильное кольцо, замещенное от 1 до 2 заместителями, независимо выбранными из R4; L является связующей цепью, содержащей от 1 до 2 членов, выбранных из углерода, необязательно замещенной одним R13; или L является С(=Е); Е является 0; R3 является Н или С1-С6алкилом; каждый R4 независимо является С1-С6алкилом, галогеном или CN; каждый R5 независимо является C1-С6галогеналкилом, галогеном или С1-С4-галогеналкокси; или каждый R5 независимо является фенильным или пиридильным кольцом, где каждое кольцо замещено R6; каждый R6 является галогеном; каждый R13 независимо является СООН, С2-С6алкоксикарбонилом или С2-С6алкоксикарбонилалкилом; или каждый R13 является фенилом, замещенным С2-С6алкоксикарбонилом; пиридинильным или имидазольным кольцом; п равно 1 или 2. Соединения обладают инсектицидной активностью. Описываются также композиция для борьбы с насекомыми-вредителями и способ борьбы с насекомыми-вредителями и соединения формулы (6), где R3 является Н или С1-С4-алкилом, один R4 присоединен к фенильному кольцу в положении 2 и является СН3 или галогеном, необязательно второй R4 является F, Cl, Br, J или CN. 4 н. и 12 з.п. ф-лы, 15 табл.
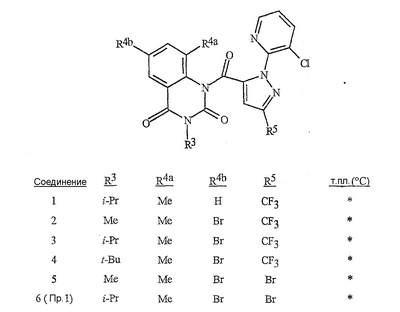
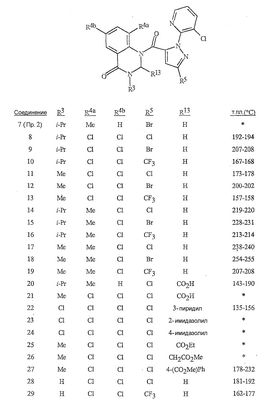
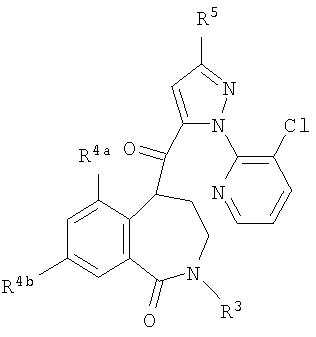
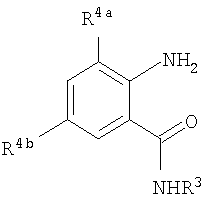
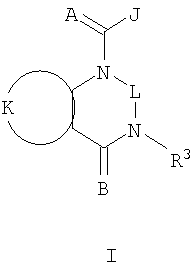
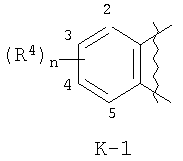
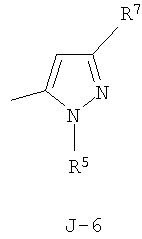
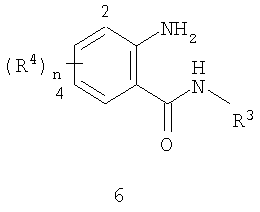
Данное изобретение относится к определенным хиназолин(ди)онам, их N-оксидам, приемлемым в сельском хозяйстве солям и композициям, и способу борьбы с беспозвоночными вредителями как в агрономии, так и в областях, отличных от агрономии. Борьба с беспозвоночными вредителями является крайне важной для достижения высокой урожайности. Повреждения, наносимые беспозвоночными вредителями при выращивании и хранении сельскохозяйственных культур, могут значительно снижать производительность и тем самым приводить к повышенным затратам потребителя. Подавление беспозвоночных вредителей в лесных, тепличных, декоративных культурах и в питомниках, в хранящихся продуктах питания и волокнах, в животноводстве, домашнем хозяйстве, здравоохранении и ветеринарии также очень важен. Для этих целей существует множество коммерчески доступных продуктов, но все еще существует необходимость в новых соединениях, которые являются более эффективными, менее дорогими, менее токсичными, более безопасными для окружающей среды и имеют различные механизмы действия. В WO 01/070671 описаны N-ациловые производные антраниловой кислоты формулы I в качестве артроподицидов где, кроме прочего, А и В независимо являются О или S; J является необязательно замещенным фенильным кольцом, 5- или 6-членным гетероароматическим кольцом, нафтильной кольцевой системой или ароматической 8-, 9- или 10-членной сконденсированной гетеробициклической кольцевой системой; R1 и R3 независимо являются Н или необязательно замещенным С1-С6алкилом; R2 является Н или С1-С6алкилом; каждый R4 независимо является Н, С1-С6алкилом, С1-С6галогеналкилом, галогеном или CN; и n равно от 1 до 4. Данное изобретение относится к соединениям формулы I, включающей все геометрические изомеры и стереоизомеры, их N-оксидам и подходящим солям. где А и В независимо являются O или S; J является фенильным кольцом, нафтильной кольцевой системой, 5- или 6-членным гетероароматическим кольцом или ароматической 8-, 9- или 10-членной сконденсированной гетеробициклической кольцевой системой, где каждое кольцо или кольцевая система необязательно замещена от 1 до 4 заместителями, независимо выбранными из R5; К вместе с двумя прилегающими связывающими атомами углерода представляет сконденсированное фенильное, сконденсированное пиридинильное или сконденсированное пиримидинильное кольцо, выбранное из группы, включающей К-1, К-2, К-3, К-4, К-5 или К-6, каждое из которых необязательно замещено от 1 до 4 заместителями, независимо выбранными из R4 L является связью или связывающей цепью, содержащей от 1 до 3 членов, выбранных из углерода, азота, кислорода и серы, необязательно включающей один или два члена цепи как С(=Е), SO или S(O)2 и необязательно замещенной от 1 до 3 заместителями, независимо выбранными из R13; Е является О, S или NR8; R3 является Н; G; С1-С6алкилом, С2-С6алкенилом, С2-С6алкинилом, С3-С6циклоалкилом, каждый из которых необязательно замещено от 1 до 5 заместителями, независимо выбранными из группы, включающей G, галоген, CN, NO2, гидрокси, С1-С4алкокси, С1-С4галогеналкокси, С1-С4алкилтио, С1-С4алкилсульфинил, С1-С4алкилсульфонил, С2-С6алкоксикарбонил, С2-С6алкилкарбонил, С3-С6триалкилсилил, фенил, фенокси и 5- или 6-членное гетероароматическое кольцо, где каждый фенил, фенокси или 5- или 6-членное гетероароматическое кольцо необязательно замещено от 1 до 3 заместителями, независимо выбранными из R6; или фенилом необязательно замещенным от 1 до 3 заместителями, независимо выбранными из R6; G является 5- или 6-членным неароматическим карбоциклическим или гетероциклическим кольцом, необязательно включающим один или два кольца, выбранных из группы, включающей С(=О), SO и S(O)2, и необязательно замещенным от 1 до 4 заместителями, независимо выбранными из R12; каждый R4 независимо является С1-С6алкилом, С2-С6алкенилом, С2-С6алкинилом, С3-С6циклоалкилом, С1-С6галогеналкилом, С2-С6галогеналкенилом, С2-С6галогеналкинилом, С3-С6галогенциклоалкилом, галогеном, CN, NO2, гидрокси, С1-С4алкокси, С1-С4галогеналкокси, С1-С4алкилтио, С1-С4алкилсульфинилом, С1-С4алкилсульфонилом, С1-С4галогеналкилтио, С1-С4галогеналкилсульфинилом, С1-С4галогеналкилсульфонилом, С1-С4алкиламино, С2-С8диалкиламино, С3-С6циклоалкиламино, С1-С4алкоксиалкилом, С1-С4 гидроксиалкилом, C(O)R10, CO2R10, C(O)NR10R11, NR10R11, N(R11)CO2R10 или С3-С6триалкилсилилом; или каждый R4 независимо является фенилом, бензилом, фенокси или 5- или 6-членным гетероароматическим кольцом, где каждое кольцо необязательно замещено от 1 до 3 заместителями, независимо выбранными из R6; каждый R5 независимо является С1-С6алкилом, С2-С6алкенилом, С2-С6алкинилом, С3-С6циклоалкилом, С1-С6галогеналкилом, С2-С6галогеналкенилом, С2-С6галогеналкинилом, С3-С6галогенциклоалкилом, галогеном, CN, CO2H, CONH2, NO2, гидрокси, С1-С4алкокси, С1-С4галогеналкокси, С1-С4алкилтио, С1-С4алкилсульфинилом, С1-С4алкилсульфонилом, С1-С4алкилсульфонилокси, С1-С4галогеналкилтио, С1-С4галогеналкилсульфинилом, С1-С4галогеналкилсульфонилом, С1-С4галогеналкилсульфонилокси, С1-С4алкиламино, С2-С8диалкиламино, С3-С6циклоалкиламино, С2-С6алкилкарбонилом, С2-С6алкоксикарбонилом, С2-С6алкиламинокарбонилом, С3-С8диалкиламинокарбонилом или С3-С6триалкилсилилом; или каждый R5 независимо является фенилом, бензилом, бензоилом, фенокси или 5- или 6-членным гетероароматическим кольцом или ароматической 8-, 9- или 10-членной сконденсированной гетеробициклической кольцевой системой, где каждое кольцо или кольцевая система необязательно замещено от 1 до 3 заместителями, независимо выбранными из R6; или две R5 группы, присоединенные к соседним атомам углерода, вместе образуют -OCF2O-, -CF2CF2O- или OCF2CF2O-; каждый R6 независимо является С1-С4алкилом, С2-С4алкенилом, С2-С4алкинилом, С3-С6циклоалкилом, С1-С4галогеналкилом, С2-С4галогеналкенилом, С2-С4галогеналкинилом, С3-С6галогенциклоалкилом, галогеном, CN, NO2, С1-С4алкокси, С1-С4галогеналкокси, С1-С4алкилтио, С1-С4алкилсульфинилом, С1-С4алкилсульфонилом, С1-С4галогеналкилтио, С1-С4галогеналкилсульфинилом, С1-С4галогеналкилсульфонилом, С1-С4алкиламино, С2-С8диалкиламино, С3-С6циклоалкиламино, С3-С6(алкил)циклоалкиламино, С2-С4алкилкарбонилом, С2-С6алкоксикарбонилом, С2-С6алкиламинокарбонилом, С3-С8диалкиламинокарбонилом или С3-С6триалкилсилилом; R8 является Н; С1-С6алкилом, С2-С6алкенилом, С2-С6алкинилом или С3-С6циклоалкилом, каждый из которых необязательно замещен от 1 до 5 заместителями, независимо выбранными из группы, включающей галоген, CN, NO2, гидрокси, С1-С4алкокси, С1-С4галогеналкокси, С1-С4алкилтио, С1-С4алкилсульфинил, С1-С4алкилсульфонил, С2-С6алкоксикарбонил, С2-С6алкилкарбонил, С3-С6триалкилсилил, фенильное кольцо и 5- или 6-членное гетероароматическое кольцо, каждое кольцо необязательно замещено от 1 до 3 заместителями, независимо выбранными из R6, где каждый фенил, фенокси или 5- или 6-членное гетероароматическое кольцо необязательно замещено от 1 до 3 заместителями, независимо выбранными из R6; CN, NO2; С2-С6алкоксикарбонилом; С1-С4алкилсульфонилом; или фенилом или фенилсульфонилом, необязательно замещенным от 1 до 3 заместителями, независимо выбранными из R6; каждый R10 независимо является Н, С1-С4алкилом или С1-С4галогеналкилом; каждый R11 независимо является Н или С1-С4алкилом; каждый R12 независимо является С1-С2алкилом, галогеном, CN, NO2 или С1-С2алкокси; каждый R13 независимо является С1-С4алкилом, С1-С4галогеналкилом, галогеном, CN, COOH, С1-С4алкокси, С1-С4галогеналкокси, С2-С6алкоксикарбонилом, С2-С6алкоксикарбонилалкилом; или каждый R13 является фенилом или 5- или 6-членным гетероароматическим кольцом, где каждое кольцо независимо замещено от 1 до 3 заместителями, независимо выбранными из R6; и n равно 0, 1, 2, 3 или 4. Данное изобретение также относится к способу борьбы с беспозвоночными вредителями, включающему контактирование беспозвоночного вредителя или его окружающей среды с биологически эффективным количеством соединения формулы I, его N-оксидами или подходящими солями соединения (например, в виде описанных ниже композиций). Данное изобретение также относится к такому способу, в котором беспозвоночный вредитель или его окружающая среда контактирует с биологически эффективным количеством соединения формулы I или композицией, содержащей соединение формулы I, и биологически эффективным количеством, по крайней мере, одного дополнительного соединения или агента, используемого для подавления беспозвоночных вредителей. Данное изобретение также относится к композиции для борьбы с беспозвоночными вредителями, содержащей биологически эффективное количество соединения формулы I, его N-оксида или подходящей соли соединения и, по крайней мере, один дополнительный компонент, выбранные из группы, включающей поверхностно-активные вещества, твердые разбавители и жидкие разбавители. Данное изобретение также относится к композиции, включающей биологически эффективное количество соединения формулы I, его N-оксида или подходящей соли соединения и эффективное количество, по крайней мере, одного дополнительного биологически активного соединения или агента. В представленных выше перечнях термин «алкил», используемый отдельно или в сочетаниях, таких как «алкилтио» или «галогеналкил», включает прямой или разветвленный алкил, такой как метил, этил, н-пропил, изо-пропил или различные изомеры бутила, пентила или гексила. «Алкенил» включает прямые или разветвленные алкены, такие как этенил, 1-пропенил, 2-пропенил и различные изомеры бутенила, пентенила и гексенила. «Алкенил» также включает полиены, такие как 1,2-пропадиенил и 2,4-гексадиенил. «Алкинил» включает прямые или разветвленные алкины, такие как этинил, 1-пропинил, 2-пропинил и различные изомеры бутинила, пентинила и гексинила. «Алкинил» также может включать группы, включающие множественные тройные связи, такие как 2,5-гексадинил. «Алкокси» включает, например, метокси, этокси, н-пропилокси, изо-пропилокси и различные изомеры бутокси, пентокси и гексилокси. «Алкоксиалкил» означает алкокси замещение на алкиле. Примеры «алкоксиалкила» включают CH3OCH2, CH3OCH2CH2, CH3CH2OCH2, CH3CH2CH2CH2OCH2 и CH3CH2OCH2CH2. «Алкилтио» включает разветвленные или прямые алкилтиогруппы, такие как метилтио, этилтио и различные изомеры пропилтио, бутилтио, пентилтио и гексилтио. «Алкилсульфинил» включает оба энантиомера алкилсульфинильной группы. Примеры «алкилсульфинила» включают CH3S(O), CH3CH2S(O), CH3CH2CH2S(O), (CH3)2CHS(O) и различные изомеры бутилсульфинила, пентилсульфинила и гексилсульфинила. Примеры «алкилсульфонила» включают CH3S(O)2, CH3CH2S(O)2, CH3CH2CH2S(O)2, (CH3)2CHS(O)2 и различные изомеры бутилсульфонила, пентилсульфонила и гексилсульфонила. Примеры «алкилсульфонилокси» включают CH3S(O)2O, CH3CH2S(O)2O, CH3CH2CH2S(O)2O, (CH3)2CHS(O)2O и различные изомеры бутилсульфонилокси, пентилсульфонилокси и гексилсульфонилокси. «Алкиламино», «диалкиламино», «алкенилтио», «алкенилсульфинил», «алкенилсульфонил», «алкинилтио», «алкинилсульфинил», «алкинилсульфонил» и подобные определяются аналогично представленным выше примерам. «Циклоалкил» включает, например, циклопропил, циклобутил, циклопентил и циклогексил. «Ароматическое» означает, что каждый из атомов кольца по существу находится в одной плоскости и имеет р-орбитальный перпендикуляр к плоскости кольца, и где (4n + 2) электроны, если n равно 0 или положительному целому числу, связаны с кольцом с выполнением правила Хюккеля. Термин «ароматическая кольцевая система» означает полностью ненасыщенные карбоциклы и гетероциклы, в которых, по крайней мере, одно кольцо полициклической кольцевой системы является ароматическим. Термин «ароматическое карбоциклическое кольцо или кольцевая система» включает полностью ароматические карбоциклы и карбоциклы, в которых, по крайней мере, одно кольцо полициклической кольцевой системы является ароматическим (например, фенил и нафтил). термин «арил» относится к любому необязательно замещенному ароматическому кольцу или кольцевой системе. Термин «неароматическое карбоциклическое кольцо или кольцевая система» означает полностью насыщенные карбоциклы, а также частично или полностью ненасыщенные карбоциклы, в которых правило Хюккеля не выполняется в любом из колец кольцевой системы. Термин «гетеро» при использовании применительно к кольцам или кольцевым системам относится к кольцу или кольцевой системе, в которой, по крайней мере, один атом кольца не является углеродом и которое может содержать от 1 до 4 гетероатомов, независимо выбранных из группы, включающей азот, кислород и серу, при условии, что каждое кольцо содержит не более 4 атомов азота, не более 2 атомов кислорода и не более 2 атомов серы. Термин «гетероароматическое кольцо или кольцевая система» включает полностью ароматические гетероциклы и гетероциклы, в которых, по крайней мере, одно кольцо полициклической кольцевой системы является ароматическим (где «ароматическое» означает выполнение правила Хюккеля). Термин «неароматическое гетероциклическое кольцо или кольцевая система» означает полностью насыщенные гетероциклы, а также частично или полностью ненасыщенные гетероциклы, в которых правило Хюккеля не выполняется любым из колец кольцевой системы. Гетероциклическое кольцо или кольцевая система может быть присоединена через любой доступный атом углерода или азота замещением водорода на указанном атоме азота или углерода. Термин «галоген», используемый либо отдельно либо в сложных названиях, таких как «галогеналкил», включает фтор, хлор, бром или йод. Также при использовании в сложных словах, таких как «галогеналкил», указанный алкил может быть полностью или частично замещен атомами галогена, которые могут быть одинаковыми или разными. Примеры «галогеналкила» включают F3C, ClCH2, CF3CH2 и CF3CCl2. Термины «галогеналкенил», «галогеналкинил», «галогеналкокси», «галогеналкилтио» и подобные определяются аналогично термину «галогеналкил». Примеры «галогеналкенила» включают (Cl)2C=CHCH2 и CF3CH2CH=CHCH2. Примеры «галогеналкинила» включают HC Примеры «алкилкарбонила» включают C(O)CH3, C(O)CH2CH2CH3 и C(O)CH(CH3)2. Примеры «алкоксикарбонила» включают CH3OC(=O), CH3CH2OC(=O), CH3CH2CH2OC(=O), (CH3)2CHOC(=O) и различные изомеры бутокси- или пентоксикарбонила. Примеры «алкоксикарбонилалкила» включают CH3OC(=O)CH2, CH3CH2OC(=O)CH2, CH3CH2CH2OC(=O)CH2CH2 и (CH3)2CHOC(=O)CH2. Примеры «алкиламинокарбонила» включают CH3NHC(=O), CH3CH2NHC(=O), CH3CH2CH2NHC(=O), (CH3)2CHNHC(=O) и различные изомеры бутиламино- или пентиламинокарбонила. Примеры «диалкиламинокарбонила» включают (CH3)2NC(=O), (CH3CH2)2NC(=O), CH3CH2(CH3)NC(=O), CH3CH2CH2(CH3)NC(=O) и (CH3)2CHN(CH3)C(=O). Общее количество атомов углерода в замещающей группе обозначено как «Ci-Cj», где i и j равны числам от 1 до 6. Например, С1-С3алкилсульфонил означает метилсульфонил – пропилсульфонил; С2 алкоксиалкил означает CH3OCH2; С3 алкоксиалкил означает, например, CH3CH(OCH3), CH3OCH2CH2 или CH3CH2OCH2; и С4 алкоксиалкил означает различные изомеры алкильной группы, замещенной алкоксигруппой, содержащей всего четыре атома углерода, примерами которой являются CH3CH2CH2OCH2 и CH3CH2OCH2CH2. В представленных выше ссылках, если соединение формулы I содержит одно или более гетероциклическое кольцо, все заместители присоединены к указанным кольцам через любой доступный атом углерода или азота замещением атома водорода на указанном атоме углерода или азота. Если соединение замещено заместителем, имеющим нижний индекс, который показывает, что количество таких заместителей может превышать 1, указанные заместители (если они превышают 1) независимо выбирают из группы определенных заместителей. Также если нижний индекс показывает интервал, например, (R)i-j, то количество заместителей может быть выбрано из целого числа от i до j включительно. Термин «необязательно замещенный от 1 до 3 заместителями» и подобные указывают на то, что от одной до трех доступных положений группы может быть замещено. Если группа содержит заместитель, который может быть водородом, например, R3 или R8, то, если указанный заместитель является водородом, признается, что это эквивалентно тому, что указанная группа не замещена. Соединения в соответствии с данным изобретением могут существовать в виде одного или более стереоизомеров. Различные стереоизомеры включают энантиомеры, диастереомеры, атропизомеры и геометрические изомеры. Для специалиста в данной области техники будет понятно, что один стереоизомер может быть более активным и/или может обладать предпочтительными свойствами, когда он обогащен по сравнению с другими стереоизомерами или когда отделен от других стереоизомеров. Кроме того, специалист в данной области техники знает, как отделять, обогащать и/или селективно получать указанные стереоизомеры. Следовательно, данное изобретение включает соединения, выбранные из формулы I, N-оксидов и приемлемых в сельском хозяйстве солей. Соединения в соответствии с данным изобретением могут существовать в виде смеси стереоизомеров, отдельных стереоизомеров или в виде оптически активной формы. Для специалиста в данной области техники будет понятно, что не все гетероциклы, содержащие атомы азота, могут образовывать N-оксиды, поскольку азот требует наличие доступной неподеленной пары для окисления до оксида; специалист в данной области техники сможет распознать такие гетероциклы, содержащие атомы азота, которые могут образовывать N-оксиды. Для специалиста в данной области техники также будет понятно, что третичные амины могут образовывать N-оксиды. Методы синтеза для получения N-оксидов гетероциклов и третичных аминов хорошо известны специалистам в данной области техники и включают окисление гетероциклов и третичных аминов надкислотами, такими как надуксусная и м-хлорпербензойная кислота (МХПБК), перекисью водорода, гидроперекисями алкила, такими как гидроперекись трет-бутила, перборатом натрия и диоксанами, такими как диметилдиоксиран. Способы получения N-оксидов широко описаны и представлены в литературе, см., например: T.L. Gilchrist в Comprehensive Organic Synthesis, том 7, стр. 748-750, S.V. Ley, изд., Pergamon Press; M. Tisler и B. Stanovnik в Comprehensive Heterocyclic Chemistry, том 3, стр. 18-20, A.J. Boulton и A. McKillop, изд., Pergamon Press; M.R. Grimmett и B.R.T. Keene в Advances in Heterocyclic Chemistry, том 43, стр. 149-161, A.R. Katritzky, изд., Academic Press; M. Tisler и B. Stanovnik в Advances in Heterocyclic Chemistry, том 9, стр. 285-291, A.R. Katritzky и A.J. Boulton, изд., Academic Press; и G.W.H. Cheeseman и E.S.G. Werstiuk в Advances in Heterocyclic Chemistry, том 22, стр. 390-392, A.R. Katritzky и A.J. Boulton, изд., Academic Press. Соли соединений в соответствии с данным изобретением включают кислотно-аддитивные соли с неорганическими или органическими кислотами, такими как бромистоводородная, хлористоводородная, азотная, фосфорная, серная, уксусная, масляная, фумаровая, молочная, малеиновая, малоновая, щавелевая, пропионовая, салициловая, винная, 4-толуолсульфоновая или валериановая кислоты. Соли соединений в соответствии с данным изобретением также включают соли, полученные с органическими основаниями (например, пиридином, аммиаком или триэтиламином) или неорганическими основаниями (например, гидридами, гидроксидами или карбонатами натрия, калия, лития, кальция, магния или бария), где соединение содержит кислотную группу, такую как карбоксильная группа или фенол. Как отмечено выше, J является фенильным кольцом, нафтильной кольцевой системой или 5- или 6-членным гетероароматическим кольцом или ароматической 8-, 9- или 10-членной сконденсированной гетеробициклической кольцевой системой, где каждый атом кольца или кольцевой системы необязательно замещено от 1 до 4 заместителями, независимо выбранными из R5. Термин «необязательно замещено» при применении к указанным J группам относится к группам, которые не замещены или имеют, по крайней мере, один отличный от водорода заместитель, который не снижает биологической активности, присущей незамещенному аналогу. Примером фенила, необязательно замещенного от 1 до 4 R5, является кольцо, показанное как U-1 в перечне 1, где Rv является R5 и r равно целому числу от 0 до 4. Примером нафтильной группы, необязательно замещенной от 1 до 4 R5, является кольцо, показанное как U-85 в перечне 1, где Rv является R5 и r равно целому числу от 0 до 4. Примеры 5- или 6-членных гетероароматических колец, необязательно замещенных от 1 до 4 R5, включают кольца U-2 – U-53, показанные в перечне 1, где Rv является R5 и r равно целому числу от 0 до 4. Необходимо отметить, что J-1 – J-13, представленные ниже, также означают 5- или 6-членные гетероароматические кольца. Необходимо отметить, что U-2 – U-20 являются примерами J-1, U-21 – U-35 и U-40 являются примерами J-2, U-36 – U-39 являются примерами J-3, U-41 – U-48 являются примерами J-4 и U-49 – U-53 являются примерами J-5. Необходимо отметить, что U-11 эквивалентно J-6, U-26 эквивалентно J-7 или J-10, U-42 эквивалентно J-8, U-45 эквивалентно J-9, U-4 эквивалентно J-11 и U-24 эквивалентно J-12 или J-13. Также необходимо отметить, что в J-6 – J-13 R7 и R9 являются подмножеством R5 в формуле I. Примеры ароматических 8-, 9- или 10-членных сконденсированных гетеробициклических кольцевых систем, необязательно замещенных от 1 до 4 заместителями, независимо выбранными из R5, включают U-54 – U-84, показанные в перечне 1, где Rv является R5 формулы I и r равно целому числу от 0 до 4. Rv присоединен к указанным кольцам через любой доступный атом углерода или азота замещением атома водорода на указанном атоме углерода или азота. Необходимо отметить, что некоторые группы U могут быть замещены только менее чем 4 Rv группами (например, U-16 – U-21 и U-32 – U34 могут быть замещены только одним Rv). Необходимо отметить, что место присоединения между (Rv)r и группой U показано как плавающее, (Rv)r может быть присоединен к любому доступному атому углерода или азота группы U. Необходимо отметить, что если место присоединения на группе U показано как плавающее, группа U может быть присоединена к остальной формуле I через любой доступный атом углерода или азота группы U замещением атома водорода. Перечень 1 Как отмечено выше, К вместе с двумя прилегающими связывающими атомами углерода является сконденсированным фенилом, сконденсированным пиридинильным кольцом или сконденсированным пиримидинильным кольцом, необязательно замещенным от 1 до 4 заместителями, независимо выбранными из R4. Термин «необязательно замещенным» при применении к указанным К группам относится к группам, которые не замещены или имеют, по крайней мере, один отличный от водорода заместитель, который не снижает биологической активности, присущей незамещенному аналогу. Примеры таких групп К включают кольца, показанные как К-1 – К-6 в перечне 2. Необходимо отметить, что К-2 – К-5 могут быть необязательно замещены от 1 до 3 заместителями, независимо выбранными из R4. Также необходимо отметить, что К-6 может быть необязательно замещен от 1 до 2 заместителями, независимо выбранными из R4. В представленных группах К верхняя правая связь присоединена через доступный связывающий атом углерода к атому азота N(L)-C(=A)J группы формулы I, и нижняя правая связь присоединена через доступный связывающий атом углерода к атому углерода C(=B)N(L)R3 группы формулы I. Волнистая линия означает, что кольцо К присоединено к остальной формуле I как показано ниже. Перечень 2 Предпочтительными кольцами К являются К-1, К-2, К-5 и К-6. Наиболее предпочтительным является К-1. Как отмечено выше, L является прямой связью или связывающей цепью, содержащей от 1 до 3 членов, выбранных из углерода, азота, кислорода и серы, необязательно включающей один или два члена цепи в виде C(=E), SO или S(O)2 и необязательно замещенной от 1 до 3 заместителями, независимо выбранными из R13. Термин «необязательно замещенной» при применении к указанным L группам относится к группам, которые не замещены или имеют, по крайней мере, один отличный от водорода заместитель, который не снижает биологической активности, присущей незамещенному аналогу. Примеры группы L включают группы L-1 – L-17, показанные в перечне 3. В L-17 t равно целому числу от 1 до 3. Хотя R6 группы показаны в структуре L-17, необходимо отметить, что они не обязательно должны присутствовать, так как они являются необязательными заместителями. Предпочтительными группами L являются L-1, L-6, L-7, L-9 и L-10. Перечень 3 Как отмечено выше, R3 может быть (среди прочих) С1-С6алкилом, С2-С6алкенилом, С2-С6алкинилом, С3-С6циклоалкилом, каждый из которых необязательно замещен от 1 до 5 заместителями, независимо выбранными из группы, включающей 5- или 6-членное гетероароматическое кольцо, где каждое кольцо необязательно замещено от 1 до 3 заместителями, независимо выбранными из R6. Примеры таких колец, включенных в указанные R3 группы, включают кольца U-1 – U-53 и U-86, показанные в перечне 1, за исключением того, что такие кольца необязательно замещены от 1 до 3 заместителями, независимо выбранными из R6, в отличие от (Rv)r, и присоединены к R3 группе, выбранной из представленного в этом абзаце списка. Как отмечено выше, R3 может быть (среди прочих) G; С1-С6алкилом, С2-С6алкенилом, С2-С6алкинилом, С3-С6циклоалкилом, каждый из которых необязательно замещен G; где G является 5- или 6-членным не ароматическим карбоциклическим или гетероциклическим кольцом, необязательно включающим 1 или 2 члена кольца, выбранных из группы, включающей C(=O), SO или S(O)2, и необязательно замещенным от 1 до 4 заместителями, независимо выбранными из R12. Термин «необязательно замещенные» при применении к указанным G группам относится к группам, которые не замещены или имеют, по крайней мере, один отличный от водорода заместитель, который не снижает биологической активности, присущей незамещенному аналогу. Необязательные заместители могут быть присоединены к любому доступному атому углерода путем замещения атома водорода. Примеры 5- или 6-членных неароматических карбоциклических колец в качестве G включают кольца, показанные как G-1 – G-8 в перечне 3. Примеры 5- или 6-членных неароматических гетероциклических колец в качестве G включают кольца, показанные как G-9 – G-38 в перечне 4. Необходимо отметить, что если G включает кольца, выбранные из G-31 – G-34 и G-38, то Q1 выбирают из О, S или N. Необходимо отметить, что если G является G-11, G-13, G-14, G-16, G-23, G-24, G-30 – G-34, G-37 и G-38 и Q1 является N, атом азота может дополнять свою валентность замещением либо Н, либо C1-C2алкилом. Необходимо отметить, что если место присоединения группы G показано как плавающее, группа G может быть присоединена к остальной формуле I на любом доступном атоме углерода группы G путем замещения атома водорода. Перечень 4 Как отмечено выше, каждый R4 независимо может быть (среди прочих) фенилом, бензилом, фенокси или 5- или 6-членным гетероароматическим кольцом, где каждое кольцо необязательно замещено от 1 до 3 заместителями, независимо выбранными из R6. Примеры таких R4 групп включают кольца или кольцевые системы, показанные как U-1 – U-53, U-86 и U-87 в перечне 1, за исключением того, что такие кольца необязательно замещены от 1 до 3 заместителями, независимо выбранными из R6, а не из (Rv)r. Как отмечено выше, каждый R5 независимо может быть (среди прочих) фенилом, бензилом, бензоилом, фенокси, 5- или 6-членным гетероароматическим кольцом или ароматической 8-, 9- или 10-членной сконденсированной гетеробициклической кольцевой системой, где каждое кольцо необязательно замещено от 1 до 3 заместителями, независимо выбранными из R6. Примеры таких R5 групп включают кольца или кольцевые системы, показанные как U-1 – U-88 в перечне 1, за исключением того, что такие кольца необязательно замещены от 1 до 3 заместителями, независимо выбранными из R6, а не из (Rv)r. Предпочтительными соединениями с точки зрения лучшей активности и/или простоты синтеза являются: Предпочтительные соединения 1. Соединения формулы I, представленной выше, их N-оксиды и пригодные в сельском хозяйстве соли, где А и В оба являются О и J является фенильной группой, необязательно замещенной от 1 до 4 R5. Предпочтительные соединения 2. Предпочтительные соединения 1, в которых одна R4 группа присоединена к кольцу К либо в положении 2, либо в положении 5, и указанный R4 является С1-С4алкилом, С1-С4галогеналкилом, галогеном, CN, NO2, С1-С4алкокси, С1-С4галогеналкокси, С1-С4алкилтио, С1-С4алкилсульфинилом, С1-С4алкилсульфонилом, С1-С4галогеналкилтио, С1-С4галогеналкилсульфинилом или С1-С4галогеналкилсульфонилом; и каждый R5 независимо является галогеном,С1-С4алкилом, С1-С4алкокси, С1-С4галогеналкилом, CN, NO2, С1-С4галогеналкокси, С1-С4алкилтио, С1-С4алкилсульфинилом, С1-С4алкилсульфонилом, С1-С4галогеналкилтио, С1-С4галогеналкилсульфинилом, С1-С4галогеналкилсульфонилом или С2-С4алкоксикарбонилом; или каждый R5 независимо является фенилом или 5- или 6-членным гетероароматическим кольцом, где каждое кольцо необязательно замещено от 1 до 3 заместителями, независимо выбранными из R6; или две группы R5, присоединенные к соседним атомам углерода, вместе образуют -OCF2O-, -CF2CF2O- или OCF2CF2O-; Предпочтительные соединения 3. Предпочтительные соединения 2 в которых R3 является С1-С4алкилом, необязательно замещенным от 1 до 5 заместителями, независимо выбранными из группы, включающей галоген, CN, OCH3 и S(O)pCH3; одна R4 группа присоединена к кольцу К в положении 2, и указанный R4 является CH3, CF3, OCF3, OCHF2, S(O)pCF3, S(O)pCHF2, CN или галогеном; необязательно второй R4 является F, Cl, Br, I, CN или CF3; каждый R5 независимо является галогеном, метилом, CF3, OCF3, OCHF2, S(O)pCF3, S(O)pCHF2, OCH2CF3, OCF2CHF2, S(O)pCH2CF3 или S(O)pCF2CHF2; или фенильным, пиразольным, имидазольным, триазольным, пиридиновым или пиримидиновым кольцом, где каждое кольцо необязательно замещено от 1 до 3 заместителями, независимо выбранными из С1-С4алкила, С1-С4галогеналкила и CN; и р равно 0, 1 или 2. Предпочтительные соединения 4. Предпочтительные соединения 3 в которых R3 является С1-С4алкилом. Предпочтительные соединения 5. Соединения формулы I, представленной выше, их N-оксиды и пригодные в сельском хозяйстве соли, где А и В оба являются О; J является 5- или 6-членным гетероароматическим кольцом, выбранным из группы, включающей J-1, J-2, J-3, J-4 и J-5, где каждый J необязательно замещен от 1 до 3 заместителями, независимо выбранными из R5 Q является О, S, NH или NR5; и W, X, Y и Z независимо являются N, CH или CR5 при условии, что в J-4 и J-5, по крайней мере, один из W, X, Y и Z является N. Предпочтительные соединения 6. Предпочтительные соединения 5, в которых одна R4 группа присоединена к кольцу К либо в положении 2, либо в положении 5, и указанный R4 является С1-С4алкилом, С1-С4галогеналкилом, галогеном, CN, NO2, С1-С4алкокси, С1-С4галогеналкокси, С1-С4алкилтио, С1-С4алкилсульфинилом, С1-С4алкилсульфонилом, С1-С4галогеналкилтио, С1-С4галогеналкилсульфинилом или С1-С4галогеналкилсульфонилом; и каждый R5 независимо является С1-С4алкилом, С1-С4галогеналкилом, CN, NO2, С1-С4галогеналкокси, С1-С4алкилтио, С1-С4алкилсульфинилом, С1-С4алкилсульфонилом, С1-С4галогеналкилтио, С1-С4галогеналкилсульфинилом, С1-С4галогеналкилсульфонилом или С2-С4алкоксикарбонилом; или каждый R5 независимо является фенилом или 5- или 6-членным гетероароматическим кольцом, где каждое кольцо необязательно замещено от 1 до 3 заместителями, независимо выбранными из R6. Предпочтительные соединения 7. Предпочтительные соединения 6, в которых J выбирают из группы, включающей R5 является C1-C4алкилом, С1-С4галогеналкилом, или V является N, CH, CF, CCl, CBr или CI; R6 является С1-С6алкилом, С3-С6циклоалкилом, С1-С4галогеналкилом, галогеном, CN, С1-С4алкокси, С1-С4галогеналкокси или С1-С4галогеналкилтио; R7 является Н, С1-С6алкилом, С3-С6циклоалкилом, С1-С4галогеналкилом, галогеном, CN, С1-С4алкокси, С1-С4галогеналкокси или С1-С4галогеналкилтио; R9 является Н, С1-С6алкилом, С1-С6галогеналкилом, С3-С6алкенилом, С3-С6галогеналкенилом, С3-С6алкинилом или С3-С6галогеналкинилом; при условии что R7 и R9 оба не являются Н; и m равно о или 1. Предпочтительные соединения 8. Предпочтительные соединения 7, в которых V является N. Предпочтительные соединения 9. Предпочтительные соединения 7 в которых V является CH, CF, CCl или CBr. Предпочтительные соединения 10. Предпочтительные соединения 8 или предпочтительные соединения 9 в которых R3 является Н; или С1-С4алкилом, необязательно замещенным от 1 до 5 заместителями, независимо выбранными из группы, включающей галоген, CN, OCH3 и S(O)pCH3; одна R4 группа присоединена к кольцу К в положении 2, и указанный R4 является CH3, CF3, OCF3, OCHF2, S(O)pCF3, S(O)pCHF2, CN или галогеном; необязательно второй R4 является F, Cl, Br, I, CN или CF3; R6 является С1-С4алкилом, С1-С4галогеналкилом, галогеном или CN; R7 является Н, CH3, CF3, OCHF2, OCH2CF3 или галогеном; и р равно 0, 1 или 2. Предпочтительные соединения 11. Предпочтительные соединения 10, в которых R3 является Н; или С1-С4алкилом; и одна R4 группа присоединена в положении 2, и указанный R4 является CH3, Cl, Br или I. Предпочтительные соединения 12. Предпочтительные соединения 11, в которых J является J-6; R6 является галогеном; и R7 является галогеном или CF3. Предпочтительные соединения 13. Предпочтительные соединения 12, в которых V является N; R3 является Н или метилом, этилом, изопропилом или третичным бутилом; и R7 является Br, Cl или CF3. Предпочтительные соединения 14. Предпочтительные соединения 11, в которых J является J-7; R6 является галогеном; и R9 является CF3, CHF2, CH2CF3 или CF2CHF2. Предпочтительные соединения 15. Предпочтительные соединения 11, в которых J является J-8; R6 является галогеном; и R7 является галогеном или CF3. Предпочтительные соединения 16. Предпочтительные соединения 11, в которых J является J-9; R6 является галогеном; и R7 является CF3. Предпочтительные соединения 17. Предпочтительные соединения 11, в которых J является J-10; R6 является галогеном; и R9 является CF3, CHF2, CH2CF3 или CF2CHF2. Предпочтительные соединения 18. Предпочтительные соединения 11, в которых J является J-11; R6 является галогеном; и R7 является галогеном или CF3. Предпочтительные соединения 19. Предпочтительные соединения 11, в которых J является J-12; R6 является галогеном; R7 является Н, галогеном или CF3; и R9 является Н, CF3, CHF2, CH2CF3 или CF2CHF2. Предпочтительные соединения 20. Предпочтительные соединения 11, в которых J является J-13; R6 является галогеном; R7 является Н, галогеном или CF3; и R9 является Н, CF3, CHF2, CH2CF3 или CF2CHF2. Наиболее предпочтительными являются предпочтительные соединения 13, выбранные из группы: 6-бром-1-[[3-бром-1-(3-хлор-2-пиридинил)-1Н-пиразол-5-ил]карбонил]-8-метил-3-(1-метилэтил)-2,4(1Н,3Н)-хиназолиндион, 6-бром-1-[[1-(3-хлор-2-пиридинил)-3-(трифторметил)-1Н-пиразол-5-ил]карбонил]-3,8-диметил-2,4(1Н,3Н)-хиназолиндион, 6-бром-1-[[3-бром-1-(3-хлор-2-пиридинил)-1Н-пиразол-5-ил]карбонил]-3,8-диметил-2,4(1Н,3Н)-хиназолиндион, 1-[[3-бром-1-(3-хлор-2-пиридинил)-1Н-пиразол-5-ил]карбонил]-2,3-дигидро-8-метил-3-(1-метилэтил)-4(1Н)-хиназолинон, 6,8-дихлор-1-[[3-хлор-1-(3-хлор-2-пиридинил)-1Н-пиразол-5-ил]карбонил]-2,3-дигидро-3-(1-метилэтил)-4(1Н)-хиназолинон, 1-[[3-бром-1-(3-хлор-2-пиридинил)-1Н-пиразол-5-ил]карбонил]-6,8-дихлор-2,3-дигидро-3-(1-метилэтил)-4(1Н)-хиназолинон, 6,8-дихлор-1-[[1-(3-хлор-2-пиридинил)-3-(трифторметил)-1Н-пиразол-5-ил]карбонил]-2,3-дигидро-3-метил-4(1Н)-хиназолинон, 6-хлор-1-[[3-хлор-1-(3-хлор-2-пиридинил)-1Н-пиразол-5-ил]карбонил]-2,3-дигидро-8-метил-3-(1-метилэтил)-4(1Н)-хиназолинон, 1-[[3-бром-1-(3-хлор-2-пиридинил)-1Н-пиразол-5-ил]карбонил]-6-хлор-2,3-дигидро-8-метил-3-(1-метилэтил)-4(1Н)-хиназолинон, 6,8-дихлор-1-[[1-(3-хлор-2-пиридинил)-3-(трифторметил)-1Н-пиразол-5-ил]карбонил]-2,3-дигидро-3-(1-метилэтил)-4(1Н)-хиназолинон, 6,8-дихлор-1-[[3-хлор-1-(3-хлор-2-пиридинил)-1Н-пиразол-5-ил]карбонил]-2,3-дигидро-3-метил-4(1Н)-хиназолинон, 1-[[3-бром-1-(3-хлор-2-пиридинил)-1Н-пиразол-5-ил]карбонил]-6,8-дихлор-2,3-дигидро-3-метил-4(1Н)-хиназолинон, 6-хлор-1-[[1-(3-хлор-2-пиридинил)-3-(трифторметил)-1Н-пиразол-5-ил]карбонил]-2,3-дигидро-8-метил-3-(1-метилэтил)-4(1Н)-хиназолинон, 6-хлор-1-[[3-хлор-1-(3-хлор-2-пиридинил)-1Н-пиразол-5-ил]карбонил]-2,3-дигидро-3,8-диметил-4(1Н)-хиназолинон, 1-[[3-бром-1-(3-хлор-2-пиридинил)-1Н-пиразол-5-ил]карбонил]-6-хлор-2,3-дигидро-3,8-диметил-4(1Н)-хиназолинон, 6-хлор-1-[[1-(3-хлор-2-пиридинил)-3-(трифторметил)-1Н-пиразол-5-ил]карбонил]-2,3-дигидро-3,8-диметил-4(1Н)-хиназолинон, 6,8-дихлор-1-[[1-(3-хлор-2-пиридинил)-3-(трифторметил)-1Н-пиразол-5-ил]карбонил]-2,3-дигидро-4(1Н)-хиназолинон и 6,8-дихлор-1-[[3-хлор-1-(3-хлор-2-пиридинил)-1Н-пиразол-5-ил]карбонил]-2,3-дигидро-4(1Н)-хиназолинон. Данное изобретение также относится к композициям для борьбы с беспозвоночными вредителями, включающим биологически эффективное количество соединения формулы I и, по крайней мере, один дополнительный компонент, выбранный из группы, включающей поверхностно-активные вещества, их N-оксиды или подходящие соли, твердые разбавители и жидкие разбавители. Данное изобретение также относится к композиции, содержащей биологически эффективное количество соединения формулы I и эффективное количество, по крайней мере, одного дополнительного биологически активного соединения или агента. Предпочтительные композиции в соответствии с данным изобретением включают указанные выше предпочтительные соединения. Настоящее изобретение также относится к способу борьбы с беспозвоночными вредителями, включающему контакт беспозвоночного вредителя или среды его обитания с биологически эффективным количеством соединения формулы I (например, в виде описанной далее композиции). Данное изобретение также относится к таким способам, в которых беспозвоночный вредитель или среда его обитания подвергается контакту с биологически эффективным количеством соединения формулы I или композиции, включающей соединение формулы I и биологически эффективное количество, по крайней мере, одного дополнительного биологически активного соединения или агента. Предпочтительные способы включают применение указанных выше предпочтительных соединений. Соединения формулы I могут быть получены одним или более из представленных ниже способов и вариантов, описанных на схемах 1-1. Определения для A, B, J, K, L, R3, R4, R5 и n для соединений формулы I и 2-23, представленных ниже, такие, как определены в разделе «краткое описание изобретения». Соединения формул Ia-Ic, If, 2a-c, 9a-i и 10а-с представляют собой различные подвиды соединений формулы I, 2, 9 и 10, соответственно и все заместители для формул Ia-If такие, как определены выше для формулы I. Как показано на схеме 1, соединения формулы I могут быть получены взаимодействием арильных или гетероарильных аминов формулы 2 с хлорангидридами формулы 3 в присутствии основания с получением соединения формулы Ia. Реакция может проводиться в чистом виде или в различных подходящих растворителях, включающих тетрагидрофуран, толуол, метиленхлорид и хлороформ, при оптимальных температурах, варьирующихся от комнатной температуры до температуры кипения с обратным холодильником растворителя. Типовые основания, применяемые в реакции, включают амины, такие как триэтиламин и пиридин, карбонаты, такие как карбонат калия и натрия, и гидриды, такие как гидрид калия и натрия. На последующей стадии соединения формулы Ia могут быть превращены в соединения формулы Ib с помощью множества различных тиопревращающих реагентов, включая пентасульфид фосфора и (2,4-бис(4-метоксифенил)-1,3-дитиа-2,4-дифосфетан-2,4-дисульфид). Схема 1 Получение соединений формулы Ic, т.е. соединений формулы I, в которых К является К-1, показано на схеме 2. Взаимодействие хиназолиндиона формулы 2а (где L является СО) или производного формулы 2b (где L является С1-С3алкилом, необязательно замещенным от 1 до 3 заместителями, независимо выбранными из R13), с хлорангидридом формулы 3 дает соединение формулы Ic. Эти методы также могут применяться для получения соединений формулы I в которых К выбирают из К-2 – К-6. Схема 2 Как показано на схеме 3, соединения формулы 2а могут быть получены в две стадии из известных изатоических ангидридов. На первой стадии изатоический ангидрид формулы 4 подвергают взаимодействию непосредственно с амином формулы 5, либо в чистом виде, либо в подходящем растворителе с получением амида формулы 6. Обработка амида формулы 6 фосгеном или эквивалентном фосгена дает хиназолиндион формулы 2а. Схема 3 Как показано на схема 4, соединения формулы 2b, в которых Rx и Ry независимо являются Н и подвидами R13, могут быть получены из соединений формулы 6 взаимодействием с альдегидом или кетоном, обычно в присутствии кислого катализатора, такого как п-толуолсульфокислота (п-ТСК). Азеотропное удаление воды при ее образовании, или другие методы сушки могут применяться при завершении реакции. Схема 4 Rx и Ry независимо являются H, алкилом или арилом Как показано на схеме 5, соединения формулы 2с могут быть получены реакцией Шмидта из тетрагидрохинолинонов формулы 8 и азида натрия (J. Het. Chem. 1971, 8, 231-236). Взаимодействие соединения формулы 2с с хлорангидридом 3 в присутствии основания, такого как триэтиламин, дает продукт формулы If. Схема 5 Хлорангидриды формулы 3 хорошо описаны в химической литературе и обычно их получают из соответствующих известных арильных и гетероарильных карбоновых кислот формулы 9. Множество карбоновых кислот формулы 9 описано в литературе. Методы получения определенных предпочтительных кислот формул 9а-9f и получаемых из них хлорангидридов описаны в WO 01/70671. Схема 6 Пиридилпиразолкарбоновые кислоты формул 9g-9i являются особенно предпочтительными кислотами формулы 9 (схема 7). Взаимодействие пиразола формулы 10 с 2,3-дихлорпиридином формулы 11 дает хороший выход 1-пиридилпиразола формулы 12 с хорошей специфичностью для желаемой региохимии. Металлирование соединений формулы 12 диизопропиламидом лития (ДАЛ) с последующим гашением литиевой соли двуокисью углерода дает кислоты пиразола формул 9g-9i. Дополнительные подробности синтеза формулы 9i показаны в примере 1. Схема 7 Исходные пиразолы формулы 10 являются известными соединениями или могут быть получены известными методами. Пиразол 10а может быть получен описанными в литературе методами (J. Fluorine Chem. 1991, 53(1), 61-70). Пиразолы формул 10b и 10с также могут быть получены методами, описанными в литературе (Chem. Ber. 1966, 99(10), 3350-7). Полезный альтернативный метод получения 10b и 10с показан на схеме 8. Металлирование сульфамоилпиразола формулы 13 н-бутиллитием (n-BuLi) с последующим непосредственным галогенированием аниона либо гексахлорэтаном, либо 1,2-дибромтетрахлорэтаном дает галогенированные производные формулы 14. Удаление сульфамоильной группы трифторуксусной кислотой (ТФК) при комнатной температуре проходит чисто и с хорошим выходом и дает пиразолы 10b и 10с соответственно. Дальнейшие подробности эксперимента для указанных методов описаны в примере 1. Схема 8 В качестве альтернативы методу, представленному на схеме 7, пиразолкарбоновые кислоты формул 9h и 9i могут быть получены методом, показанным на схеме 9. Взаимодействие гидразинпиридина 15 с диэтилмалеатом дает пиразолон 16. Хлорирование или бромирование оксихлоридом фосфора или оксибромидом фосфора дает галогенпроизводные формулы 17. Окисление соединения формулы 17, необязательно в присутствии кислоты, дает сложный эфир пиразола с последующим превращением функциональной группы простого эфира в карбоновую кислоту дает соединение формулы 9h или 9i. Окисляющим агентом может быть перекись водорода, органические перекиси, персульфат калия, персульфат натрия, персульфат аммония, моноперсульфат калия (например, Oxone®) или перманганат калия. Схема 9 В качестве альтернативы методу, показанному на схеме 7, пиразолкарбоновые кислоты формулы 9g, в которых R5 является CF3 можно получить методом, показанным на схеме 10. Схема 10 Взаимодействие соединения формулы 18 с подходящим основанием в подходящем органическом растворителе дает циклизованный продукт формулы 19 после нейтрализации кислотой, такой как уксусная кислота. Подходящим основанием может быть, например, гидрид натрия, трет-бутоксид калия, димсил натрия (CH3S(O)CH2Na+), карбонаты или гидроксиды щелочного металла (такого как литий, натрий или калий), фториды или гидроксиды тетраалкил(такой как метил, этил или бутил)аммония, или 2-трет-бутилимино-2-диэтиламино-1,3-диметил-пергидро-1,2,3-диазафосфонин. Подходящим органическим растворителем может быть, например, ацетон, ацетонитрил, тетрагидрофуран, дихлорметан, диметилсульфоксид или N,N-диметилформамид. Дегидрирование соединения формулы 19 с получением соединения формулы 20 с последующим превращением функциональной группы карбонового эфира в карбоновую кислоту дает кислоты формулы 9g. Дегидрирование проводят обработкой каталитическим количеством подходящей кислоты, такой как серная кислота. Соединения формулы 18 могут быть получены методом, показанным на схеме 11. Схема 11 где R5 является CF3. Обработка соединения гидразина формулы 21 кетоном формулы 22 в растворителе, таком как вода, метанол или уксусная кислота, дает гидразон формулы 23. Взаимодействие гидразона формулы 23 этилоксалилхлоридом в подходящем органическом растворителе, таком как дихлорметан или тетрагидрофуран, в присутствии акцептора кислоты, такого как триэтиламин, дает соединение формулы 18. Соединения гидразина формулы 21 могут быть получены стандартными методами, такими как взаимодействие соответствующего галогенсоединения формулы 11 с гидразином. Понятно, что некоторые реагенты и условия реакции, описанные выше для получения соединений формулы I, могут быть несовместимы с определенными функциональными группами, присутствующими в промежуточных соединениях. В таких случаях введение защиты/снятие защиты или взаимное превращение функциональных групп в процессе синтеза поможет получить желаемые продукты. Применение и выбор защитных групп очевидны специалисту в области химического синтеза (см., например, Greene, T.W.; Wuts, P.G.M. Protective Groups in Organic Synthesis, 2nd Ed.; Wiley: New York, 1991). Специалист в данной области техники поймет что, в некоторых случаях после введения данного реагента, как показано на любой конкретной схеме, может быть необходимо провести дополнительные рутинные стадии синтеза, не описанные подробно, для завершения синтеза соединений формулы I. Для специалиста в данной области техники будет понятно, что может быть необходимо осуществить стадии, показанные на приведенных выше схемах, в порядке, отличном от того, который указан в последовательности, представленной для получения соединений формулы I. Специалист в данной области техники также поймет, что соединения формулы I и промежуточные соединения, описанные выше, могут быть подвергнуты электрофильной, нуклеофильной, радикальной, металлорганической, окислительной и восстановительной реакциям для добавления заместителей или модификации существующих заместителей. Без дальнейшего уточнения понятно, что специалист в данной области техники при применении представленного выше описания сможет использовать данное изобретение в полном объеме. Поэтому представленные ниже примеры даны как иллюстрирующие, а не ограничивающие описание каким-либо образом. Проценты даны к весу за исключением хроматографических смесей растворителей, если не указано иначе. Части и проценты для хроматографических смесей растворителей даны к объему, если не указано иначе. 1Н ЯМР спектры даны в ч/млн по убывающей от тетраметилсилана; с означает синглет, д означает дублет, т означает триплет, кв означает квартет, м означает мультиплет, дд означает дублет дублетов, дт означает дублет триплетов, шс означает широкий синглет. Пример 1 6-бром-1-[[3-бром-1-(3-хлор-2-пиридинил)-1Н-пиразол-5-ил]карбонил]-8-метил-3-(1-метилэтил)-2,4(1Н,3Н)-хиназолиндион Стадия А: Получение 3-бром-N,N-диметил-1Н-пиразол-1-сульфонамида К раствору N-диметилсульфамоилпиразола (44,0 г, 0,251 моль) в сухом тетрагидрофуране (500 мл) при температуре -78°С по каплям добавляют раствор н-бутиллития (2,5 М в гексане, 105,5 мл, 0,264 моль), сохраняя температуру ниже -60°С. Во время добавления образуется густое твердое вещество. После завершения добавления реакционную смесь выдерживают в течение еще 15 минут, после чего по каплям добавляют раствор 1,2-дибромтетрахлорэтана (90 г, 0,276 моль) в тетрагидрофуране (150 мл), сохраняя температуру ниже -70°С. Реакционная смесь становится прозрачной и принимает оранжевый цвет; перемешивание продолжают в течение еще 15 минут. Баню с температурой -78°С удаляют и реакцию гасят водой (600 мл). Реакционную смесь экстрагируют дихлорметаном (4х) и органические экстракты сушат над сульфатом магния и концентрируют. Неочищенный продукт очищают хроматографией на силикагеле с применением дихлорметана/гексана (50:50) в качестве элюента с получением указанного в заголовке соединения в виде прозрачного бесцветного масла (57,04 г). 1Н ЯМР (CDCl3) Стадия В: Получение 3-бромпиразола К трифторуксусной кислоте (70 мл) медленно добавляют продукт бромпиразола (57,04 г) со стадии А. Реакционную смесь перемешивают при комнатной температуре в течение 30 минут и затем концентрируют при пониженном давлении. Остаток берут в гексане, нерастворимые твердые вещества отфильтровывают и гексан выпаривают с получением неочищенного продукта в виде масла. Неочищенный продукт очищают хроматографией на силикагеле с применением этилацетата/дихлорметана (10:90) в качестве элюента с получением масла. Масло берут в дихлорметане, нейтрализуют водным раствором бикарбоната натрия, экстрагируют дихлорметаном (3х), сушат над сульфатом магния и концентрируют с получением указанного в заголовке соединения в виде белого твердого вещества (25,9 г), т. пл. 61-64°С. 1Н ЯМР (CDCl3) Стадия С: Получение 2-(3-бром-1Н-пиразол-1-ил)-3-хлорпиридина К смеси 2,3-дихлорпиридина (27,4 г, 185 ммоль) и 3-бромпиразола (25,4 г, 176 ммоль) в сухом N,N-диметилформамиде (88 мл) добавляют карбонат калия (48,6 г, 352 ммоль) и реакционную смесь нагревают до температуры 125оС в течение 18 часов. Реакционную смесь охлаждают до комнатной температуры и выливают в ледяную воду (800 мл). Образуется осадок. Осевшие твердые вещества перемешивают в течение 1,5 часов, фильтруют и промывают водой (2х100 мл). Твердую фильтровальную лепешку помещают в дихлорметан и промывают последовательно водой, 1N хлористоводородной кислотой, насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли. Органические экстракты сушат над сульфатом магния и концентрируют с получением 39,9 г розового твердого вещества. Неочищенное твердое вещество суспендируют в гексане и энергично перемешивают в течение 1 часа. Твердые вещества отфильтровывают, промывают гексаном и сушат с получением указанного в заголовке соединения в виде беловатого порошка (30,4 г), который является > 94% чистым по ЯМР. Этот материал применяют без дальнейшей очистки на стадии D. 1Н ЯМР (CDCl3) Стадия D: Получение 3-бром-1-(3-хлор-2-пиридинил)-1Н-пиразол-5-карбоновой кислоты К раствору продукта пиразола со стадии С (30,4 г, 118 ммоль) в сухом тетрагидрофуране (250 мл) при температуре -76°С по каплям добавляют раствор литий диизопропиламида (118 ммоль) в тетрагидрофуране с такой скоростью, чтобы сохранять температуру ниже -71°С. Реакционную смесь перемешивают в течение 15 минут при температуре -76°С, и затем двуокись углерода барботируют через смесь в течение 10 минут, что дает нагревание до температуры -57оС. Реакционную смесь нагревают до температуры -20°С и гасят водой. Реакционную смесь концентрируют и затем помещают в воду (1 л) и простой эфир (500 мл) и затем добавляют водный раствор гидроксида натрия (1N, 20 мл). Водные экстракты промывают простым эфиром и подкисляют хлористоводородной кислотой. Осевшие твердые вещества фильтруют, промывают водой и сушат с получением указанного в заголовке соединения в виде рыжевато-коричневого твердого вещества (27,7 г). (Продукт из другой партии, полученный указанным методом, плавится при температуре 200-201°С.) 1Н ЯМР (ДМСО-d6) Стадия Е: Получение 6-бром-8-метил-2Н-3,1-бензоксазин-2,4(1Н)-диона К раствору 8-метил-2Н-3,1-бензоксазин-2,4(1Н)-диона (10,0 г, 56,5 ммоль) и йодида калия (0,36 г, 1,8 ммоль) в хлорсульфокислоте (12 мл) добавляют бром (4,6 г, 28,7 ммоль) и реакционную смесь перемешивают в течение ночи при комнатной температуре. Затем реакционную смесь медленно выливают в ледяную воду и нейтрализуют порошком бикарбоната натрия до рН 7. Твердые вещества фильтруют, промывают водой с получением желаемого промежуточного соединения в виде белого твердого вещества (11,4 г). 1Н ЯМР (ДМСО) Стадия F: Получение 2-амино-5-бром-3-метил-N-(1-метилэтил)бензамида К суспензии бензоксазиндиона со стадии Е (4,0 г, 15,56 ммоль) в пиридине (20 мл) добавляют изопропиламин (1,2 г, 20,23 ммоль) и реакционную смесь нагревают до температуры кипения с обратным холодильником в течение 2 часов. Затем реакционную смесь охлаждают, концентрируют из толуола на роторном испарителе и затем сушат в вакууме с получением твердого вещества (5,01 г). 1Н ЯМР (ДМСО) Стадия G: Получение 6-бром-8-метил-3-(1-метилэтил)-2,4(1Н,3Н)-хиназолиндиона К раствору антраниламида со стадии F (1,11 г, 4,1 ммоль) в диоксане (20 мл) добавляют 2,0М раствор фосгена в толуоле (2,3 мл, 4,6 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 1 часа, затем нагревают до кипения с обратным холодильником в течение 4 часов и охлаждают до комнатной температуры. Белые твердые вещества фильтруют и сушат с получением указанного в заголовке соединения (0,89 г). 1Н ЯМР (ДМСО) Стадия Н: Получение 6-бром-1-[[3-бром-1-(3-хлор-2-пиридинил)-1Н-пиразол-5-ил]карбонил]-8-метил-3-(1-метилэтил)-2,4(1Н,3Н)-хиназолиндиона К раствору хиназолиндиона со стадии G (245 мг, 0,825 ммоль) в диметилформамиде (5 мл) добавляют гидрид натрия (60% дисперсия в масле, 36 мг, 0,90 ммоль) и реакционную смесь перемешивают при комнатной температуре. В отдельной реакционной колбе, содержащей раствор кислоты пиразола со стадии D (500 мг, 1,65 ммоль) в дихлорметане, (10 мл) добавляют оксалилхлорид (0,17 мл, 1,95 ммоль) и одну каплю ДМФ. Эту смесь перемешивают в течение 2 часов, затем концентрируют и помещают в вакуум. Хлорангидрид разделяют на две равные порции. Одну из этих порций помещают в 5 мл ДМФ и добавляют к реакционной смеси хиназолиндион/NaH и полученную смесь перемешивают при комнатной температуре в течение 3 часов. Реакционную смесь разделяют между этилацетатом и водой, дважды промывают водой, затем насыщенным раствором соли и сушат над сульфатом натрия. Неочищенный продукт очищают хроматографией на силикагеле с применением 99:1 хлороформа/ацетона в качестве элюента с получением указанного в заголовке соединения, соединения в соответствии с данным изобретением. 1Н ЯМР (CDCl3) Пример 2 Получение 1-[[3-бром-1-(3-хлор-2-пиридинил)-1Н-пиразол-5-ил]карбонил]-2,3-дигидро-8-метил-3-(1-метилэтил)-4(1Н)-хиназолинона Стадия А: Получение 2,3-дигидро-8-метил-3-(1-метилэтил)-4(1Н)-хиназолинона К раствору 2-амино-3-метил-N-(1-метилэтил)бензамида (0,5 г, 2,6 ммоль) в этаноле (10 мл) добавляют параформальдегид (78 мг, 2,6 ммоль) и п-толуолсульфокислоту (18 мг, 95 мкмоль) и смесь нагревают до температуры кипения с обратным холодильником до тех пор, пока она не станет прозрачной (приблизительно 4 часа). Растворитель удаляют при пониженном давлении с получением указанного в заголовке соединения (95% чистота), который применяют без дальнейшей очистки. 1Н ЯМР (CDCl3) Стадия В: получение 1-[[3-бром-1-(3-хлор-2-пиридинил)-1Н-пиразол-5-ил]карбонил]-2,3-дигидро-8-метил-3-(1-метилэтил)-4(1Н)-хиназолинона К раствору 3-бром-1-(3-хлор-2-пиридинил)-1Н-пиразол-5-карбоновой кислоты (787 мг, 2,45 ммоль) (т.е. продукта примера 1, стадия D) в дихлорметане (10 мл) добавляют диметилформамид (20 мкл) и оксалилхлорид (235 мкл). Смесь перемешивают в течение 1 часа, когда она становится прозрачной. После удаления летучих соединений при пониженном давлении остаток растворяют в дихлорметане (5 мл) и одну половину раствора добавляют к смеси продукта стадии А (0,25 г, 1,2 ммоль) и пиридина (148 мкл, 1,8 ммоль) в метиленхлориде (10 мл). После перемешивания при температуре окружающей среды в течение ночи добавляют 1,5,7-триазабицикло[4.4.0]дец-5-ен, связанный с полистиролом, поперечно сшитым с 2% DVB (1 г) (Fluka Chemie AG № по каталогу 90603) и смесь перемешивают в течение еще 15 минут. Затем смесь фильтруют и концентрируют при пониженном давлении. Полученный остаток очищают хроматографией на силикагеле с получением указанного в заголовке соединения, соединения в соответствии с данным изобретением в виде белого твердого вещества (0,18 г). 1Н ЯМР (CDCl3) Представленный ниже пример 3 иллюстрирует альтернативное получение 3-бром-1-(3-хлор-2-пиридинил)-1Н-пиразол-5-карбоновой кислоты, которая может применяться для получения, например, 6-бром-1-[[3-бром-1-(3-хлор-2-пиридинил)-1Н-пиразол-5-ил]карбонил]-8-метил-3-(1-метилэтил)-2,4(1Н,3Н)-хиназолиндиона и 1-[[3-бром-1-(3-хлор-2-пиридинил)-1Н-пиразол-5-ил]карбонил]-2,3-дигидро-8-метил-3-(1-метилэтил)-4(1Н)-хиназолинона на последующих стадиях, показанных в примерах 1 и 2. Пример 3 Получение 3-бром-1-(3-хлор-2-пиридинил)-1Н-пиразол-5-карбоновой кислоты Стадия А: получение этил 2-(3-хлор-2-пиридинил)-5-оксо-3-пиразолидинкарбоксилата В 2-литровую четырехгорлую колбу, оборудованную механической мешалкой, термометром, капельной воронкой, парциальным конденсатором и входом для азота, загружают абсолютный этанол (250 мл) и этанольный раствор этоксида натрия (21%, 190 мл, 0,504 моль). Смесь нагревают при температуре кипения с обратным холодильником при приблизительно 83оС. Затем ее обрабатывают 3-хлор-2(1Н)-пиридинон гидразоном (68,0 г, 0,474 моль). Смесь повторно нагревают до температуры кипения с обратным холодильником в течение 5 минут. Желтую суспензию затем обрабатывают по каплям диэтилмалеатом (88,0 мл, 0,544 моль) в течение 5 минут. Скорость кипения с обратным холодильником значительно понижается при добавлении. Под конец добавления все исходные материалы растворяются. Полученный оранжево-красный раствор выдерживают при температуре кипения с обратным холодильником в течение 10 минут. После охлаждения до температуры 65°С реакционную смесь обрабатывают ледяной уксусной кислотой (50,0 мл, 0,873 моль). Образуется осадок. Смесь разбавляют водой (650 мл), что растворяет осадок. Оранжевый раствор охлаждают на ледяной бане. Продукт начинает осаждаться при температуре 28°С. Суспензию выдерживают при температуре 2°С в течение 2 часов. Продукт выделяют фильтрацией, промывают водным этанолом (40%, 3 х 50 мл) и затем сушат на воздухе на фильтре в течение около 1 часа. Указанное в заголовке соединение получают в виде высоко кристаллического светло-оранжевого порошка (70,3 г, 55% выход). 1Н ЯМР не показал существенных примесей. 1Н ЯМР (ДМСО-d6) Стадия В: Получение этил 3-бром-1-(3-хлор-2-пиридинил)-4,5-дигидро-1Н-пиразол-5-карбоксилата В 1-литровую четырехгорлую колбу, оборудованную механической мешалкой, термометром, парциальным конденсатором и входом для азота, загружают ацетонитрил (400 мл), этил 2-(3-хлор-2-пиридинил)-5-оксо-3-пиразолидинкарбоксилат (т.е. продукт со стадии А) (50,0 г, 0,185 моль) и оксибромид фосфора (34,0 г, 0,119 ммоль). Оранжевую суспензию нагревают до температуры кипения с обратным холодильником при температуре 83°С в течение 20 минут. Полученный взмученный оранжевый раствор выдерживают при температуре кипения с обратным холодильником в течение 75 минут, в течение которых образуется плотный рыжевато-коричневый кристаллический осадок. Парциальный конденсатор заменяют дистилляционной насадкой и собирают мутный бесцветный дистиллят (300 мл). Вторую 1-литровую четырехгорлую колбу, оборудованную механической мешалкой, загружают бикарбонатом натрия (45 г, 0,54 моль) и водой (200 мл). Концентрированную реакционную смесь добавляют к суспензии бикарбоната в течение 5 минут. Полученную двухфазную смесь энергично перемешивают в течение 5 минут, в течение которых прекращается выделение газа. Смесь разбавляют дихлорметаном (200 мл) и затем перемешивают в течение 75 минут. Смесь обрабатывают 5 г Celite® 545 диатомовым фильтром и затем фильтруют для удаления коричневого смолистого вещества. Фильтрат переносят в делительную воронку. Коричневый органический слой (400 мл) отделяют и затем обрабатывают сульфатом магния (15 г) и Darco® G60 активированным углем (2,0 г). Полученную суспензию перемешивают магнитной мешалкой в течение 15 минут и затем фильтруют для удаления сульфата магния и угля. Зеленый фильтрат обрабатывают силикагелем (3 г) и перемешивают несколько минут. Яркий зелено-голубой силикагель удаляют фильтрацией и фильтрат концентрируют на роторном испарителе. Продукт представляет собой светло-янтарное масло (58,6 г, 95% выход), которое кристаллизуется при выстаивании. Единственной приемлемой примесью, выявленной 1Н ЯМР является 0,3% ацетонитрила. 1Н ЯМР (ДМСО-d6) Стадия С: Получение этил 3-бром-1-(3-хлор-2-пиридинил)-1Н-пиразол-5-карбоксилата В 1-литровую четырехгорлую колбу, оборудованную механической мешалкой, термометром, парциальным конденсатором и входом для азота, загружают этил 3-бром-1-(3-хлор-2-пиридинил)-4,5-дигидро-1Н-пиразол-5-карбоксилат (т.е. продукт со стадии В) (40,2 г, 0,121 моль), ацетонитрил (300 мл) и серную кислоту (98%, 13,0 мл, 0,245 моль). Смесь самонагревается от 22 до 36°С при добавлении серной кислоты. После перемешивания в течение нескольких минут смесь обрабатывают персульфатом калия (48,0 г, 0,178 моль). Суспензию нагревают до кипения с обратным холодильником при температуре 84°С в течение 2 часов. Полученную оранжевую суспензию при перемешивании в теплом состоянии (50-65°С) фильтруют для удаления белого осадка. Фильтровальную лепешку промывают ацетонитрилом (2 х 50 мл). Фильтрат концентрируют до около 200 мл на роторном испарителе. Вторую 1-литровую четырехгорлую колбу, оборудованную механической мешалкой, загружают водой (400 мл). Концентрированную реакционную массу добавляют в воду в течение около 5 минут. Продукт выделяют фильтрацией, последовательно промывают водным ацетонитрилом (20%, 100 мл) и водой (75 мл) и сушат на воздухе на фильтре в течение 1 часа. Продукт представляет собой кристаллический оранжевый порошок (36,6 г, 90% выход). Единственным приемлемыми примесями, выявленными 1Н ЯМР, являются 1% неизвестной и 0,5% ацетонитрила. 1H ЯМР (ДМСО-d6) Стадия D: получение 3-бром-1-(3-хлор-2-пиридинил)-1Н-пиразол-5-карбоновой кислоты В 300-мл четырехгорлую колбу, оборудованную механической мешалкой, термометром и входом для азота, загружают этил 3-бром-1-(3-хлор-2-пиридинил)-1Н-пиразол-5-карбоксилат (т.е. продукт со стадии С) (98,5% чистота, 25,0 г, 0,0756 моль), метанол (75 мл), воду (50 мл) и гранулы гидроксида натрия (3,30 г, 0,0825 моль). При добавлении гидроксида натрия смесь самонагревается от 29 до 34°С и исходные материалы начинают растворяться. После перемешивания смеси в течение 90 минут при температуре окружающей среды все исходные продукты растворяются. Полученный темно-оранжевый раствор концентрируют до около 90 мл на роторном испарителе. Концентрированную реакционную смесь разбавляют водой (160 мл). Водный раствор экстрагируют простым эфиром (100 мл). Затем водный слой переносят в 500-мл колбу Эрленмейера, оборудованную магнитной мешалкой. Раствор по каплям обрабатывают концентрированной хлористоводородной кислотой (8,50 г, 0,0839 моль) в течение около 10 минут. Продукт выделяют фильтрацией, повторно суспендируют в воде (2×40 мл), промывают однократно водой (25 мл) и затем сушат на воздухе на фильтре в течение 2 часов. Продукт представляет собой кристаллический рыжевато-коричневый порошок (20,9 г, 91% выход). Единственными приемлемыми примесями, выявленными 1Н ЯМР, являются 0,8% неизвестной и 0,7% простого эфира. 1Н ЯМР (ДМСО-d6) ПРИМЕР 4 Получение 2-амино-5-циано-N,3-диметилбензамида Стадия А: Получение 2-амино-N,3-диметилбензамида Смесь 8-метил-2Н-3,1-бензоксазин-2,4(1Н)-диона (Патентная публикация РСТ WO 00/27831) (18 г, 0,1 моль) и уксусной кислоты (1,2 г, 0,02 моль) в этилацетате (200 мл) нагревали до 35°С и добавляли по каплям водный раствор метиламина (40%, 9,0 г, 0,12 моль) в течение 50 минут при 35-37°С. Затем снова добавляли водный раствор метиламина (40%, 0,9 г, 12 ммоль) и смесь перемешивали еще в течение 2,5 часов при З6°С. Затем добавляли воду (20 мл), слои разделяли и органический слой промывали водой, сушили (MgSO4) и упаривали с получением указанного в заголовке соединения, 15,45 г (92%). 1Н ЯМР (CDCl3) Стадия В: Получение 2-амино-5-бром-N,3-диметилбензамида Смесь 2-амино-N,3-диметилбензамида (т.е. продукт Стадии А ПРИМЕРА 4) (14 г, 85 ммоль), уксусной кислоты (50 мл) и воды (50 мл) охлаждали до 12°С и при этой температуре в течение 10 минут добавляли концентрированную бромистоводородную кислоту (28,5 г, 0,34 моль). Затем в течение 5 минут при 10-11°С добавляли 30% водный раствор перекиси водорода (9 г, 0,08 моль) и смеси давали медленно нагреться до комнатной температуры при перемешивании в течение 2,5 часов. Затем снова добавляли концентрированную бромистоводородную кислоту (2,9 г) и смесь перемешивали в течение ночи при комнатной температуре. К смеси затем добавляли воду (50 мл) и бисульфит натрия (1,5 г) и затем рН доводили до значения 5-6 добавлением 50% водного раствора гидроксида натрия (15 мл). Смесь фильтровали и твердые частицы промывали водой и сушили в вакууме с получением указанного в заголовке соединения, 19,5 г (94%). 1H ЯМР (CDCl3) Стадия С: Получение 2-амино-5-циано-N,3-диметилбензамида В колбу, которую перед этим продували сухим азотом, загружали ацетат палладия (II) (370 мг, 1,64 ммоль), 1,4-бис(дифенилфосфино)бутан (850 мг, 2 ммоль), активированный порошок цинка (500 мг, 7,64 ммоль), цианид цинка (II) (51 г, 434 ммоль) и 2-амино-5-бром-N,3-диметилбензамид (т.е. продукт Стадии А) (200 г, 820 ммоль). Затем добавляли только что дегазированный диметилформамид (500 мл) и смесь нагревали при 130°С в течение 25,5 часов. Затем температуру снижали до 95°С и добавляли уксусную кислоту (200 мл). Смесь барботировали азотом для удаления цианистоводородного соединения через скрубберы, загруженные водными растворами гидроксида натрия и гипохлорита натрия, при охлаждении до комнатной температуры. Затем добавляли воду (1500 мл) в течение 1,5 часа и барботирование азотом продолжали в течение ночи. Затем смесь фильтровали и твердые частицы промывали водой и сушили в вакуумной печи с получением указанного в заголовке соединения в виде пушистых твердых частиц светло-желтого цвета, 141,5 г (выход 90,9%). 1Н ЯМР (CDCl3) С помощью описанных здесь методов и методов, известных в данной области техники, могут быть получены соединения, представленные в таблицах 1-10. В таблицах применяют следующие аббревиатуры: t – третичный, s – вторичный, n – нормальный, I – изо, с – цикло, Me является метилом, Et является этилом, Pr является пропилом, i-Pr является изопропилом, Bu является бутилом и t-Bu является третичным бутилом.
Композиции/применение Соединения в соответствии с данным изобретением в основном применяют в виде составов или композиций с приемлемым в сельском хозяйстве носителем, содержащих, по крайней мере, один жидкий разбавитель, твердый разбавитель или поверхностно-активное вещество. Ингредиенты состава или композиции выбирают таким образом, чтобы они были совместимы с физическими свойствами активного ингредиента, способом нанесения и факторами окружающей среды, такими как тип почвы, влажность и температура. Пригодные составы включают жидкости, такие как растворы (включая эмульгируемые концентраты, суспензии, эмульсии (включая микроэмульсии и/или суспоэмульсии) и подобные, которые необязательно могут быть загущены до гелей. Полезные составы также включают твердые вещества, такие как дусты, порошки, гранулы, брикеты, таблетки, пленки и подобные, которые могут быть диспергируемыми в воде («смачиваемыми») или растворимыми в воде. Активный ингредиент может быть (микро)инкапсулирован и далее превращен в суспензию или твердый состав; альтернативно весь состав активного ингредиента может быть инкапсулирован (или «покрыт оболочкой»). Инкапсулирование помогает контролировать или задерживать выделение активного ингредиента. Распыляемые составы могут быть в подходящей среде и применяться в объемах для распыления от одного до нескольких сотен литров на гектар. Высокопрочные композиции прежде всего применяются в качестве промежуточных для получения составов. Составы обычно содержат эффективные количества активного ингредиента, разбавителя и поверхностно-активного вещества в следующих приблизительных пределах, которые добавляют до 100 мас.%.
Типовые твердые разбавители описаны в Watkins, et al., Handbook of Insecticide Dust Diluents and Carriers, 2nd Ed., Dorland Books, Caldwell, New Jersey. Типовые жидкие разбавители описаны в Marsden, Solvents Guide, 2nd Ed., Interscience, New York, 1950. В McCutcheon’s Detergents and Emulsifiers Annual, Allured Publ. Corp., Ridgewood, New Jarsey, а также в Sisley and Wood, Encyclopedia of Surface Active Agents, Chemical Publ. Co., Inc., New York, 1964 перечислены поверхностно-активные вещества и рекомендации по их применению. Все составы могут содержать незначительное количество добавок для снижения пенообразования, слеживаемости, коррозии, роста микробов и подобных, или загустители для повышения вязкости. Поверхностно-активные вещества включают, например, полиэтоксилированные спирты, полиэтоксилированные алкилфенолы, полиэтоксилированные сорбитоловые эфиры жирных кислот, диалкилсульфосукцинаты, алкилсульфаты, алкилбензолсульфонаты, кремнийорганические соединения, N,N-диалкилтаураты, лигнинсульфонаты, конденсаты нафталинсульфонатов и формальдегида, поликарбоксилаты и полиоксиэтилен/полиоксипропиленовые блок-сополимеры. Твердые разбавители включают, например, глины, такие как бентонит, монтмориллонит, аттапульгит и каолин, крахмал, сахар, двуокись кремния, тальк, диатомовую землю, мочевину, карбонат кальция, карбонат и бикарбонат натрия и сульфат натрия. Жидкие разбавители включают, например, воду, N,N-диметилформамид, диметилсульфоксид, N-алкилпирролидон, этиленгликоль, пропиленгликоль, парафины, алкилбензолы, алкилнафталины, масла: оливковое, касторовое, льняное, тунговое, конопляное, кукурузное, арахисовое, хлопковое, соевое, рапсовое и кокосовое, сложные эфиры жирных кислот, кетоны, такие как циклогексанон, 2-гептанон, изофорон и 4-гидрокси-4-метил-2-пентанон, и спирты, такие как метанол, циклогексанол, деканол и тетрагидрофурфуриловый спирт. Растворы, включая эмульгируемые концентраты, могут быть получены простым смешиванием ингредиентов. Дусты и порошки могут быть получены смешиванием и обычно измельчением на молотковой мельнице или водяной мельнице. Суспензии обычно получают измельчением во влажном состоянии; см., например, US 3060084. Гранулы и брикеты могут быть получены распылением активного ингредиента на предварительно полученные гранулированные носители или методом агломерации. См. Browning, “Agglomeration”, Chemical Engineering, December 4, 1967, стр. 147-48, Perry’s Chemical Engineer’s Handbook, 4th Ed., McGraw-Hill, New York, 1963, стр. 8-57 и далее, и публикация РСТ WO 91/13546. Брикеты могут быть получены, как описано в US 4172714. Диспергируемые в воде и растворимые в воде гранулы могут быть получены, как описано в US 4144050, US 3920442 и DE 3246493. Таблетки могут быть получены, как описано в US 5180587, US 5232701 и US 5208030. Пленки могут быть получены, как описано в GB 2095558 и US 3299566. Более подробную информацию относительно составов можно найти в T.S. Woods, “The Formulator’s Toolbox – Product Forms for Modern Agriculture” в Pesticide Chemistry and Bioscience, The Food-Environment Challenge, T. Brooks and T.R. Roberts, Eds., Proceeding of the 9th International Congress on Pesticide Chemistry, The Royal Society of Chemistry, Cambridge, 1999, стр. 120-133. См. также US 3235361, столбец 6, строка 16 – столбец 7, строка 19 и примеры 10-41; US 3309192, столбец 5, строка 43 – столбец 7, строка 62 и примеры 8, 12, 15, 39, 41, 52, 53, 58, 132, 138-140, 162-164, 166, 167 и 169-182; US 2891855, столбец 3, строка 66 – столбец 5, строка 17 и примеры 1-4; Klingman, Weed Control as a Science, John Wiley and Sons, Inc., New York, 1961, стр. 81-96; и Hance et al., Weed Control Handbook, 8th Ed., Blackwell Scientific Publications, Oxford, 1989. В представленных ниже примерах все проценты даны по отношению к массе и все составы получены обычными методами. Номера соединений относятся к соединениям в индекс-таблице А.
Соединения в соответствии с данным изобретением характеризуются благоприятными метаболическими и/или остаточным в почве профилем и демонстрируют действие, направленное на подавление ряда сельскохозяйственных и несельскохозяйственных беспозвоночных вредителей. (В контексте данного изобретения «борьба с беспозвоночными вредителями» означает ингибирование развития беспозвоночных вредителей (включая уничтожение), которое дает значительное снижение поедания или другого ущерба или повреждений, причиняемых вредителями; подобные этому выражения определяются аналогично.) В контексте данного описания термин «беспозвоночный вредитель» включает членистоногих, брюхоногих моллюсков и нематод, которые имеют экономическое значение как вредители. Термин «членистоногие» включает насекомых, клещей, пауков, скорпионов, многоножек, двупароногих, мокриц и симфилан. Термин «брюхоногие моллюски» включает улиток, слизней и других Styllommatophora. Термин «нематоды» включает всех гельминтов, таких как: круглые черви, сердцевидных червей и фитофаговые нематоды (Nematoda), трематоды (Tematoda), Acanthocephala и ленточные черви (Cestoda). Специалист в данной области техники поймет, что не все соединения одинаково эффективны против всех вредителей. Соединения в соответствии с данным изобретением обладают активностью против экономически важных сельскохозяйственных и несельскохозяйственных вредителей. Термин «сельскохозяйственный» относится к производству культур для получения продуктов питания или волокон и включает выращивание злаков (например, пшеницы, овса, ячменя, ржи, риса, маиса), сои, овощных культур (например, салата-латука, капусты, томатов, бобов), картофеля, сладкого картофеля, винограда, хлопка и фруктовых деревьев (например, яблок, косточковых плодов и цитрусовых). Термин «несельскохозяйственный» относится к другим садоводческим областям (например, лесоводству, теплицам, саженцам или декоративным культурам, не растущим на полях), здравоохранению (человека) и ветеринарии, бытовым и коммерческим структурам, домашнему хозяйству и хранению продуктов, и соответствующим вредителям. Предпочтительные варианты данного изобретения выбирают исходя из спектра контроля беспозвоночных вредителей и экономической важности, защиты (от ущерба или повреждения, наносимого беспозвоночными вредителями) сельскохозяйственных культур, таких как хлопок, маис, соя, рис, овощные культуры, картофель, сладкий картофель, виноград и фруктовые деревья путем контроля беспозвоночных вредителей. Сельскохозяйственные и несельскохозяйственные вредители включают личинок отряда Lepidoptera, таких как «походные черви», подгрызающие совки, пяденицы и гелиотины семейства Noctuidae (например, осенние «походные черви» (Spodoptera fugiperda J.E. Smith), свекольные «походные черви» (Spodoptera exigua Hübner), черные подгрызающие совки (Agrotis ipsilon Hufnagel), капустная пяденица (Trichoplusia ni Hübner), совки (Heliothis virescens Fabricius)); сверлильщики, чехлоноски, бабочки, строящие паутинные гнезда, конусные бабочки, мермитиды и вредители, скелетирующие листья из семейства Pyralidae (например, мотылек кукурузный (Ostrinia nubilalis Hübner), гусеницы, повреждающие рубчики цитрусовых (Amyelois transitella Walker), бабочки, огневки (Crambus caliginosellus Clemens), луговые мотыльки (Herpetogramma licarsisalis Walker)); листовертки, листовертки-почкоеды, плодожорки и гусеницы-вредители плодов семейства Tortricidae (например, плодожорка яблонная (Cydia pomonella Linnaeus), листовертка виноградная (Endopiza viteana Clemens), листовертка восточная персиковая (Grapholita molesta Busck)); и много других экономически важных Lepidoptera (например, моль капустная (Plutella xylostella Linnaeus), розовый коробочный червь хлопчатника (Pectinophora gossypiella Saunders), шелкопряд непарный (Lymanthria dispar Linnaeus)); нимфы и взрослые особи отряда Blattodea, включая тараканов семейств Blattellidae и Blattidae (например, таракан черный (Blatta orientalis Linnaeus), таракан азиатский (Blatella asahinai Mizukubo), таракан рыжий (Blatella germanica Linnaeus), таракан полосатый (Supella longipalpa Fabricius), таракан американский (Periplaneta Americana Linnaeus), таракан коричневый (Periplaneta brunnea Burmeister), таракан мадейрский (Leucophaea maderae Fabricius)); питающиеся листьями личинки и взрослые особи отряда Coleoptera, включая долгоносиков, семейств Anthribidae, Bruchidae и Curculionidae (например, долгоносик хлопковый (Anthonomus grandis Boheman), долгоносик рисовый водяной (Lissorhoptrus oryzophilus Kushel), долгоносик амбарный (Sitophilus granarius Linnaeus), долгоносик рисовый (Sitophilus oryzae Linnaeus)); земляных блошек, картофельных жуков-блошек, корнеедов, листоедов, колорадских жуков и молей-минеров узкокрылых семейства Chrysomelidae (например, колорадский жук (Leptinotarsa decemlineata Say), листоед-корнежил (Diabrotica virgifera virgifera LeConte)); хрущей и других жуков семейства Scaribaeidae (например, хрущик японский (Popillia japonica Newman) и хрущ обыкновенный (Rhizotrogus majalis Razoumowsky)); антренусов семейства Dermestidae; проволочников семейства Elateridae; короедов семейства Scolytidae и хрущаков малых мучных семейства Tenebrionidae. Кроме того: взрослых особей и личинок отряда Dermaptera, включая уховерток семейства Forficulidae (например, уховертка обыкновенная (Forficula auricularia Linnaeus), уховертка черная (Chelisoches morio Fabricius)); взрослых особей и нимф отряда Hemiptera и Homoptera, таких как клопы-слепняки семейства Miridae, цикады семейства Cicadidae, цикадки (например, виды Empoasca) семейства Cicadellidae, дельфациды семейств Fulgoroidae и Delphacidae, горбатки семейства Membracidae, листоблошки семейства Psyllidae, белокрылки семейства Aleyrodidae, тля семейства Aphididae, филлоксеры семейства Phylloxeridae, червецы семейства Pseudococcidae, щитовки семейств Coccidae, Diaspididae и Margarodidae, клопы-кружевницы семейства Tingidae, клопы-щитники семейства Pentatomidae, клопы белокрылые (например, виды Blissus) и другие плодовые клопы семейства Lygaeidae, пенницы семейства Cercopidae, тыквенные клопы семейства Coreidae и красноклопы семейства Pyrrhocoridae. Также включены взрослые особи и личинки отряда Acari (клещи), такие как паутинный клещик и красный клещ семейства Tetranychidae (например, паутинный клещик (Panonuchus ulmi Koch), клещик паутинный двупятнистый (Tetranychus urticae Koch), клещик МакДаниэла (Tetranychus mcdanieli McGregor)), плоские клещи семейства Tenuipalpidae (например, клещик плоский цитрусовый (Brevipalpus lewisi McGregor)), ржавчинные и почковые клещи семейства Eriophyidae и другие поедающие листья клещи и клещи, причиняющие вред здоровью человека и животных, например, пылевые клещи семейства Epidermoptidae, железницы семейства Demodicidae, зерновые клещи семейства Glycyphagidae, клещи отряда Ixodidae (например, олений клещ (Ixodes scapularis Say), австралийский парализующий клещ (Ixodes holocyclus Neumann), иксодовый клещ изменчивый (Dermacentor variabilis Say), клещ американский (Amblyomma anericanum Linnaeus) и конский клещ и чесоточный зудень семейств Psoroptidae, Pyemotidae и Sarcoptidae; взрослые особи и недоразвитые особи отряда Orthoptera, включая саранчу, цикад и сверчков (например, кобылки (например, Melanoplus sanguinipes Fabricius, M. differentialis Thomas), саранча американская (например, Schistocerca americana Drury), саранча пустынная (Schistocerca gregaria Forskal), мигрирующая саранча (Locusta migratoria Linnaeus), сверчок домовый (Acheta domesticus Linnaeus), медведка (виды Gryllotalpa)); взрослые особи и недоразвитые особи отряда Diptera, включая минирующих мушек, мелких двукрылых насекомых, дрозофил (Tephritidae), мушек шведских (например, Oscinella frit Linnaeus), живущих в почве личинок насекомых, домашних мух (например, Musca domestica Linnaeus), журчалок домашних (например, Fannia canicularis Linnaeus, F. femoralis Stein), жигалок осенних (например, Stomoxys calcitrans Linnaeus), мух, жигалок коровьих малых, падальных мух (например, виды Chrysomya, виды Phormia) и других мухообразных летающих вредителей, слепней (например, виды Tabanus), оводов (например, виды Gastrophilus, виды Oestrus), личинок бычьего полосатого овода (например, виды Hypoderma), оленьих мух (например, виды Chrysops), рунца овечьего (например, Melophagus ovinus Linnaeus) и других Brachycera, комаров (например, виды Aedes, виды Anopheles, виды Culex), мошек (например, виды Prosimulium, виды Simulium), мокрецов, мошек, сциарид и других Nematocera; взрослые особи и недоразвитые особи отряда Thysanoptera, включая трипсов табачных (Thrips tabaci Lindeman) и других поедающих листья трипсов; насекомых вредителей отряда Hymenoptera, включая муравьев (например, муравей-древоточец (Camponotus ferrugineus Fabricius), муравей-древоточец пенсильванский (Camponotus pennsylvanicus De Geer), фараонов муравей (Monomorium pharaonis Linnaeus), васмания (Wasmannia auropunctata Roger), муравей Рихтера (Solenopsis geminate Fabricius), красный муравей Рихтера (Solenopsis invicta Buren), муравей аргентинский (Iridomyrmex humilis Mayr), паратрехина (Paratrechina longicornis Latreille), муравей дерновый (Tetramorium caespitum Linnaeus), кукурузный муравей (Lasius alienus Förster), муравей (Tapinoma sessile Say)); пчелы (включая пчел-плотников), шершни, настоящие осы и осы; насекомые вредители отряда Isoptera, включая термита желтоногого (Reticulitermes flavipes Kollar), термита (Reticulitermes Hesperus Banks), термита (Coptotermes formosanus Shiraki), термита (Incisitermes immigrans Snyder) и других термитов, имеющих экономическое значение; насекомые вредители отряда Thysanura, такие как чешуйницы (Lepisma saccharina Linnaeus) и чешуйницы домашние (Thermobia domestica Packard); насекомые вредители отряда Mallophaga, включающие головных вшей (Pediculus humanus capitis De Geer), нательных вшей (Pediculus humanis Linnaeus), пухоедов (Menacanthus stramineus Nitzsch), власоеда собачьего (Trichodectes canis De Geer), пухоеда куриного пестробрюхого (Goniocotes gallinae De Geer), вшей овечьих (Bovicola ovis Schrank), коротконосых вшей крупного рогатого скота (Haematopinus eurysternus Nitzsch), долгоносых вшей крупного рогатого скота (Linognathus vituli Linnaeus) и других кровососущих и кусающих паразитов, атакующих человека и животных; насекомых вредителей отряда Siphonoptera, включая восточную крысиную блоху (Xenopsylla cheopis Rothschild), блоху кошачью (Ctenocephalides felis Bouche), блоху собачью (Ctenocephalides canis Curtis), блоху куриную (Ceratophyllus gallinae Schrank), блоху присасывающуюся (Echidnophaga gallinacea Westwood), блоху человеческую (Pulex irritans Linnaeus) и других блох, поражающих млекопитающих и птиц. Другие членистоногие вредители включают: пауков отряда Araenae, таких как коричневый паук-затворник (Loxosceles reclusa Gertsch & Mulaik) и паук-ткач черный (Latrodectus mactans Fabricius), и многоножек отряда Scutigeromorpha, таких как мухоловка обыкновенная (Scutigera coleoptrata Linnaeus). Действие также направлено на членов классов Nematoda, Cestoda, Trematoda и Acanthocephala, включая экономически важных членов отрядов Strongylida, Ascaridida, Oxyurida, Rhabditida, Spirurida и Enoplida, таких как, но не ограниченных ими, экономически важные сельскохозяйственные вредители (например, нематоды корневых наростов рода Meloidogyne, повреждающие нематоды рода Pratylenchus, корневые нематоды рода Trichodorus, и т.д.) и вредители здоровья человека и животных (например, все экономически важные виды трематод, ленточных червей и круглых червей, такие как Strongylus vulgaris у лошадей, Toxocara canis у собак, Haemonchus contortus у овец, Dirofilaria immitis у собак, Anoplocephala perfoliata у лошадей, Fasciola hepatica Linnaeus у жвачных животных, и т.д.). Соединения в соответствии с данным изобретением демонстрируют особенно сильное действие против вредителей отряда Lepidoptera (например, Alabama argillacea Hübner (гусеница совки хлопковой американской), Archips argyrospila Walker (листовертка), A. rosana Linnaeus (листовертка) и другие виды Archips, Chilo suppressalis Walker (огневка), Cnaphalocrosis medinalis Guenee (листовертка рисовая), Crambus caliginosellus Clemens (огневка), Crambus teterrellus Zincken (огневка), Cydia pomonella Linnaeus (плодожорка яблонная), Earias insulana Boisduval (совка хлопковая), Earias vittella Fabricius (совка хлопковая пятнистая), Helicoverpa armigera Hübner (совка американская), Helicoverpa zea Boddie (совка хлопковая), Heliothis virescens Fabricius (совка), Herpetogramma licarsisalis Walker (луговой мотылек), Lobesia botrana Denis & Schiffermüller (листовертка виноградная), Pectinophora gossypiella Saunders (розовый коробочный червь хлопчатника), Phyllocnistis cotrella Stainton (минирующая мушка цитрусовая), Pieris brassicae Linnaeus (большая белянка), Pieris rapae Linnaeus (малая белянка), Plutella xylostella Linnaeus (моль капустная), Spodoptera exigua Hübner (свекольный походный червь), Spodoptera litura Fabricius (табачная совка, гусеница, пожирающая соцветия), Spodoptera frugiperda J.E. Smith (осенний походный червь), Trichoplusia ni Hübner (совка ни) и Tuta absoluta Meyrick (минирующая мушка томатная)). Соединения в соответствии с данным изобретением также обладают коммерчески значимым действием на членов отряда Homoptera, включая: Acyrthisiphon pisum Harris (тля гороховая), Aphis craccivora Koch (тля черная люцерновая), Aphis fabae Scopoli (тля бобовая), Aphis gossypii Glover (тля хлопковая), Aphis pomi De Geer (тля яблонная), Aphis spiraecola Patch (тля таволговая), Aulacorthum solani Kaltenbach (тля вьюнковая), Chaetosiphon fragaefolii Cockerell (тля земляничная), Diuraphis noxia Kurdjumov/Mordvilko (тля пшеничная русская), Dysaphis plantaginea Paaserini (тля розовая), Eriosoma lanigerum Hausmann (тля кровяная яблонная), Hyalopterus pruni Geoffroy (тля мучнистая сливовая), Lipaphis erysimi Kaltenbach (тля ложнокапустная), Metopolophium dirrhodum Walker (тля злаковая), Macrosipum euphorbidae Thomas (тля картофельная листовая), Myzus persicae Sulzer (тля персиковая), Nasonovia ribisnigri Mosley (тля латуковая), виды Pemphigus (корневая тля и галлообразующая тля), Rhopalosiphum maidis Fitch (тля кукурузная листовая), Rhopalosiphum padi Linnaeus (тля овсовая), Schizaphis graminum Rondani (тля злаковая обыкновенная), Sitobion avenae Fabricius (тля злаковая), Therioaphis maculate Buckton (тля люцерновая пятнистая), Toxoptera aurantii Boyer de Fonscolombe (тля чайная) и Toxoptera citricida Kirkaldy (тля цитрусовая); виды Adelges (хермесы); Phylloxera devastatrix Pergande (филлоксера гикори); Bemisia tabaci Gennadius (белокрылка табачная), Bemisia argentifolii Bellows & Perrig (белокрылка), Dialeurodes citri Ashmead (белокрылка цитрусовая и Trialeurodes vaporariorum Westwood (белокрылка тепличная); Empoasca fabae Harris (цикадка картофельная), Laodelphax striatellus Fallen (малая коричневая цикадка), Macrolestes quadrilineatus Forbes (цикадка), Nephotettix cinticeps Uhler (цикадка зеленая), Nephotettix nigropictus Stel (цикадка рисовая), Nilapravata lugens Stel (цикадка коричневая), Peregrinus maidis Ashmead (цикадка кукурузная), Sogatella furcifera Horvath (цикадка белоспинная), Sogatodes orizicola Muir (дельфацида рисовая), Typhlocyba pomaria McAtee (цикадка яблонная), виды Erythroneoura (цикадки виноградные); Magicidada septendecim Linnaeus (цикада); Icerya purchasi Maskell (червец австралийский желобчатый), Quadraspidiotus perniciosus Comstock (щитовка); Planococcus citri Risso (червец виноградный мучнистый); виды Pseudococcus (другие червецы); Cacopsylla pyricola Foerster (медяница грушевая), Trioza diospyri Ashmead (листоблошка хурмовая). Эти соединения также обладают действием против членов отряда Hemiptera, включая: Acrosternum hilare Say (зеленый клоп-щитник), Anasa tristis De Green (тыквенный клоп), Blissus leucopterus leucopterus Say (cyinch bug), (Corythuca gossypii Fabricius (клоп хлопковый), Cyrtopeltis modesta Distant (клоп томатный), Dysdercus suturellus Herrich-Schäffer (красноклоп хлопковый), Euchistus servus Say (коричневый клоп-щитник), Euchistus variolarius Palisot de Beauvois (пятнистый клоп-щитник), виды Graptosthetus (некоторые виды клопов), Leptoglossus corculus Say (клоп-краевик сосновый), Lygus lineolaris Palisot de Beauvois (клопик луговой), Nezara viridula Linnaeus (клоп хлопково-огородный), Oebalus pugnax Fabricius (клоп-щитник рисовый), Oncopeltus fasciatus Dallas (большой клоп молочайный), Pseudatomoscelis seriatus Reuter (блошка хлопковая). Другие отряды насекомых, контролируемые соединениями в соответствии с данным изобретением включают Thysanoptera (например, Francliniella occidentalis Pergande (трипс пшеничный восточный), Scirthothrips citri Moulton (трипс цитрусовый), Sericothrips variabilis Beach (трипс соевый) и Thrips tabaci Lindeman (трипс табачный); и отряд Coleoptera (например, Leptinotarsa decemlineata Say (колорадский жук), Epilachna varivestis Mulsant (жук мексиканский бобовый) и проволочники рода Agriotes, Athous и Limonius). Соединения в соответствии с данным изобретением также могут быть смешаны с одним или более биологически активными соединениями или агентами, включая инсектициды, фунгициды, нематоциды, бактерициды, акарициды, регуляторы роста, такие как стимуляторы укоренения, хемостерилизаторы, полухимикаты, репелленты, аттрактанты, феромоны, стимуляторы питания, другие биологически активные соединения или энтомопатогенные бактерии, вирусы или грибы, с получением многокомпонентного пестицида, имеющего более широкий спектр применения в сельском хозяйстве. Таким образом, композиции в соответствии с данным изобретением могут также содержать биологически эффективное количество, по крайней мере, одного дополнительного биологически активного соединения или агента. Примеры таких биологически активных соединений или агентов, в которыми могут быть смешаны соединения в соответствии с данным изобретением включают: инсектициды, такие как абамектин, ацефат, ацетамиприд, авермецин, азадирахтин, азинфос-метил, бифентрин, бинфеназат, бупрофезин, карбофуран, хлорфенапир, хлорфлуазурон, хлорпирифос, хлорпирифос-метил, хромафенозид, клотианидин, цифлутрин, бета-цифлутрин, цигалотрин, лямбда-цигалотрин, циперметрин, циромазин, дельтаметрин, диафентиурон, диазинон, дифлубензурон, диметоат, диофенолан, эмамектин, эндосульфан, эсфенвалерат, этипрол, фенотикарб, феноксикарб, фенпропатрин, фенпроксимат, фенвалерат, фипронил, флоникамид, флуцитринат, тау-флувалинат, флуфеноксурон, фонофос, галофенозид, гексафлумурон, имидаклоприд, индоксакарб, изофенфос, луфенурон, малатион, метальдегид, метамидофос, метидатион, метомил, метопрен, метоксихлор, монокротофос, метоксифенозид, нитиазин, новалурон, оксамил, паратион, паратион-метил, перметрин, форат, фозалон, фосмет, фосфамидон, пиримикарб, профенофос, пиметрозин, пиридалил, пирипроксифен, ротенон, спиносад, сульпрофос, тебуфенозид, тефлубензурон, тефлутрин, тербуфос, тетрахлорвинфос, тиахлоприд, тиаметоксам, тиодикарб, тиосультап-натрий, тралометрин, трихлорфон и трифлумурон; фунгициды, такие как ацибензолар, азоксистробин, беномил, бластицидин-S, бордоская смесь (триосновной сульфат меди), бромуконазол, карпропамид, каптафол, каптан, карбендазим, хлоронеб, хлороталонил, оксихлорид меди, соли меди, цифлуфенамид, цимоксанил, ципроконазол, ципродинил, (S)-3,5-дихлор-N-(3-хлор-1-этил-1-метил-2-оксопропил)-4-метилбензамид (RH 7281), диклоцимет (S-2900), дикломезин, диклоран, дифеноконазол, (S)-3,5-дигидро-5-метил-2-(метилтио)-5-фенил-3-(фениламино)-4Н-имидазол-4-он (RP 407213), диметоморф, димоксистробин, диниконазол, диниконазол-М, додин, эдифенпос, эпоксиконазол, фамоксадон, фенамидон, фенаримол, фенбуконазол, фенкарамид (SZX0722), фенпиклонил, фенпропидин, фенпропиморф, фентин ацетат, фентин гидроксид, флуазинам, флудиоксонил, флуметовер (RPA 403397), флуквинконазол, флусилазол, флутоланил, флутриафол, фолпет, фозетил-алюминий, фуралаксил, фураметапир (S-82658), гексаконазол, ипконазол, ипробенфос, ипродион, изопротиолан, казугамицин, крезоксим-метил, манкозеб, манеб, мефеноксам, мепронил, металаксил, метконазол, метоминостробин/феноминостробин (SSF-126), миклобутанил, нео-азозин (железный метанарсонат), оксадиксил, пенконазол, пенцикурон, пробеназол, проклораз, пропамокарб, пропиконазол, пирифенокс, пираклостробин, пириметанил, пироквилон, хиноксифен, спироксамин, сера, тебуконазол, тетраконазол, тиабендазол, тифлузамид, тиофанат-метил, тирам, тиадинил, триадимефон, триадименол, трициклазол, трифлоксистробин, тритиконазол, валидамицин и винклозолин; нематоциды, такие как альдикарб, оксамил и фенамифос; бактерициды, такие как стрептомицин; акарициды, такие как амитраз, хинометионат, хлоробензилат, цигексатин, дикофол, диенохлор, этоксазол, феназаквин, фенбутатин оксид, фенпропатрин, фенпироксимат, гекситиазокс, пропаргит, пиридабен и тебуфенпирад; и биологические агенты, такие как Bacillus thuringiensis, включая виды aizawai и kurstaki, Bacillus thuringiensis дельта эндотоксин, бакуловирус и энтомопатогенные бактерии, вирусы и грибы. Общая ссылка на указанные сельскохозяйственные защитные агенты содержится в The Pesticide Manual, 12th Edition, C. D. S. Tomlin, Ed., British Crop Protection Council, Farnham, Surrey, U.K., 2000. Предпочтительными инсектицидами и акарицидами для смешивания с соединениями в соответствии с данным изобретением являются пиретроиды, такие как циперметрин, цигалотрин, цифлутрин, бета-цифлутрин, эсфенвалерат, фенвалерат и тралометрин; карбаматы, такие как фенотикарб, метомил, оксамил и тиодикарб; неоникотиноиды, такие как клотианидин, имидаклоприд и тиаклоприд; блокаторы нейронных натриевых каналов, такие как индоксакарб; инсектицидные макроциклические лактоны, такие как спиносад, абамектин, авермектин и эмамектин; антагонисты Наиболее предпочтительные смеси включают смесь соединения в соответствии с данным изобретением с цигалотрином; смесь соединения в соответствии с данным изобретением бета-цифлутрином; смесь соединения в соответствии с данным изобретением с эсфенвалератом; смесь соединения в соответствии с данным изобретением с метомилом; смесь соединения в соответствии с данным изобретением имидаклопридом; смесь соединения в соответствии с данным изобретением с тиаклопридом; смесь соединения в соответствии с данным изобретением с индоксакарбом; смесь соединения в соответствии с данным изобретением с абамектином; смесь соединения в соответствии с данным изобретением с эндосульфаном; смесь соединения в соответствии с данным изобретением с этипролом; смесь соединения в соответствии с данным изобретением с фипронилом; смесь соединения в соответствии с данным изобретением с флуфеноксуроном; смесь соединения в соответствии с данным изобретением с пирипроксифеном; смесь соединения в соответствии с данным изобретением с пиметрозином; смесь соединения в соответствии с данным изобретением с амитразом; смесь соединения в соответствии с данным изобретением с Bacillus thuringiensis и смесь соединения в соответствии с данным изобретением с Bacillus thuringiensis дельта эндотоксином. В конкретных случаях сочетания с другими соединениями или агентами, подавляющими беспозвоночных вредителей, имеющими подобный спектр подавления, но другой способ воздействия, являются особенно преимущественными для управления устойчивостью. Таким образом, композиции в соответствии с данным изобретением могут также включать биологически эффективное количество, по крайней мере, одного дополнительного соединения или агента для борьбы с беспозвоночными вредителями, имеющего подобный спектр подавления, но другой способ воздействия. Взаимодействие растения, генетически модифицированного таким образом, чтобы экпрессировать соединение, защищающее растение (например, белок), или места произрастания растения с биологически эффективным количеством соединения в соответствии с данным изобретением, также может обеспечивать более широкий спектр защиты растения и быть благоприятным для управления устойчивостью. Беспозвоночные вредители подавляются в сельскохозяйственных и несельскохозяйственных областях нанесением одного или более соединений в соответствии с данным изобретением в эффективном количестве на среду обитания вредителей, включая сельскохозяйственные и/или несельскохозяйственное место поражения, на защищаемую площадь или непосредственно на подавляемых вредителей. Таким образом, данное изобретение также включает способ борьбы с беспозвоночными в сельскохозяйственных и/или несельскохозяйственных областях, включающий взаимодействие беспозвоночных или среды из обитания с биологически эффективным количеством одного или более соединения в соответствии с данным изобретением, или с композицией, содержащей, по крайней мере, одно такое соединений, или композицией, содержащей, по крайней мере, одно такое соединение и эффективное количество, по крайней мере, одного дополнительного биологически активного соединения или агента. Предпочтительным способом нанесения является распыление. Альтернативно, гранулированная композиция, содержащая соединение в соответствии с данным изобретением, может быть нанесена на листву растений или почву. Соединения в соответствии с данным изобретением также эффективно доставляются через поглощение растениями посредством контакта растения с композицией, содержащей соединение в соответствии с данным изобретением, вносимой в виде пропитки почвы жидкой композицией, гранулированной композиции в почву, обработкой ящиков с рассадой или погружением саженцев. Соединения также эффективны при местном нанесении композиции, содержащей соединение в соответствии с данным изобретением, на область поражения. Другие методы контакта включают нанесение соединения или композиции в соответствии с данным изобретением непосредственным или остаточным распылением, авиаопрыскиванием, нанесением оболочки на семена, микроинкапсулированием, системной пропиткой, приманками, метками, болюсами, аэрозольными генераторами, фумигантами, аэрозолями, дустами и другими. Соединения в соответствии с данным изобретением могут быть добавлены в приманки, которые поедаются беспозвоночными, или в устройства, такие как ловушки и подобные. Гранулы или приманки, содержащие 0,01-5% активного ингредиента, 0,05-10% агента(ов), удерживающего влагу и 40-99% растительной муки являются эффективными для подавления почвенных насекомых при очень низком расходе, особенно при дозах активного ингредиента, которые являются летальными скорее при всасывании, чем при непосредственном контакте. Соединения в соответствии с данным изобретением могут наноситься в чистом виде, но наиболее часто для нанесения применяют композицию, содержащую одно или более соединение с подходящими носителями, разбавителями и поверхностно-активными веществами, и, по возможности, в сочетании с кормом, в зависимости от предполагаемого конечного применения. Предпочтительным способом нанесения является распыление водной дисперсии соединений или раствора соединений в рафинированном масле. Композиции с распыляемыми маслами, концентрации распыляемых масел, насадки для распыления, адъюванты, другие растворители и синергические агенты, такие как пиперонил бутоксид, улучшают эффективность соединения. Объем нанесения, требуемый для эффективного контроля (т.е. «биологически эффективное количество»), зависит от таких факторов, как виды подавляемых беспозвоночных, жизненный цикл вредителя, стадия развития, размер, расположение, время года, пораженное растение или животное, привычки питания, размножение, влажность окружающей среды, температура и подобные. При нормальных условиях расход от около 0,01 до 2 кг активного ингредиента на гектар является достаточным для контроля вредителей в сельскохозяйственных экосистемах, но может быть достаточным 0,0001 кг/гектар или может потребоваться 8 кг/гектар. Для несельскохозяйственных областей эффективный расход составляет от около 1,0 до 50 мг/квадратный метр, но может быть достаточным 0,1 мг/квадратный метр или может потребоваться 150 мг/квадратный метр. Специалист в данной области техники легко определит биологически эффективное количество, необходимое для достижения желаемого уровня подавления беспозвоночных вредителей. Представленные ниже тесты в биологических примерах данного изобретения демонстрируют эффективность способов данного изобретения для защиты растений от определенных членистоногих вредителей. «Эффективность борьбы» представляет ингибирование развития членистоногих (включая гибель), которое дает значительное снижение повреждений. Однако подавление вредителей, предлагаемый соединениями в соответствии с данным изобретением, не ограничен данными видами. См. таблицы-индексы A-D с описаниями соединений. В таблицах-индексах применяются следующие аббревиатуры: t – третичный, n – нормальный, i – изо, s – вторичный, с – цикло, Ме – метил, Et – этил, Pr – пропил и Bu – бутил; соответственно i-Pr является изопропилом, s-Bu является вторичным бутилом и т.д. Аббревиатура «Пр.» относится к примеру и после нее следует номер, указывающий на то, в каком примере получено соединение. Таблица-индекс А * данные 1Н ЯМР см. в таблице-индексе D. Таблица-индекс В * данные 1Н ЯМР см. в таблице-индексе D.
Биологические примеры настоящего изобретения Тест А Для оценки борьбы с молью капустной (Plutella xylostella) тестируемый образец представляет собой небольшой открытый контейнер с 12-14-дневными растениями редьки. Растения заранее инфицированы 10-15 новорожденными личинками на куске питательной среды для насекомых, используя сердцевинный пробоотборник для взятия куска с отвержденной питательной среды для насекомых, имеющей множество личинок, выросших на ней, и перенесения куска, содержащего личинки и питательную среду на тестируемый образец. Личинки переползают на тестируемое растение по мере высыхания куска питательной среды. Тестируемые соединения смешивают в композицию, используя раствор, содержащий 10% ацетона, 90% воды и 300 ч/млн Х-77® Spreader Lo-Foam Formula неионного поверхностно-активного вещества, содержащего алкиларилполиоксиэтилен, свободные жирные кислоты, гликоли и изопропанол (Loveland Industries, Inc.). Соединения в композиции наносят в объеме 1 мл жидкости через SUJ2 распылитель с аппаратом 1/8 JJ (Spraying Systems Co.), расположенный на расстоянии 1,27 см (0,5 дюйма) над верхней частью каждого тестируемого образца. Все экспериментальные соединения в данном исследовании распыляют при 50 ч./млн и обработку повторяют три раза. После распыления композиции тестируемого соединения каждый тестируемый образец сушат в течение 1 часа и затем на верхнюю часть кладут черную экранированную крышку. Тестируемые образцы хранят в течение 6 дней в камере для выращивания при температуре 25°С и относительно влажности 70%. Повреждение растений оценивают визуально. Из тестируемых соединений следующие демонстрируют превосходные уровни защиты растений (повреждения 20% или менее): 1, 2, 3, 5, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 22, 23, 24, 26, 28 29, 50, 51 и 52. Тест В Для оценки борьбы с осенними походными червями (Spodoptera frugiperda) тестируемый образец представляет собой небольшой открытый контейнер с 4-5-дневными растениями кукурузы (маиса). Растения заранее инфицированы 10-15 1-дневными личинками на куске питательной среды для насекомых, используя сердцевинный пробоотборник, как описано в тесте А. Тестируемые соединения смешивают в композицию и распыляют при 50 ч./млн, как описано в тесте А. Нанесение повторяют 3 раза. После распыления тестируемые образцы выдерживают в камере для роста и затем оценивают визуально, как описано в тесте А. Из тестируемых соединений следующие демонстрируют превосходные уровни защиты растений (повреждения 20% или менее): 5, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 23, 24, 28, 29, 50, 51 и 52. Тест С Для оценки борьбы с совкой (Heliothis virescens) тестируемый образец представляет собой небольшой открытый контейнер с 6-7-дневными растениями хлопка. Растения заранее инфицированы 8 2-дневными новорожденными личинками на куске питательной среды для насекомых, используя сердцевинный пробоотборник, как описано в тесте А. Тестируемые соединения смешивают в композицию и распыляют при 50 ч./млн, как описано в тесте А, нанесение повторяют 3 раза. После распыления тестируемые образцы выдерживают в камере для листа. После предварительного инфицирования почву в тестируемом образце покрывают слоем песка. Тестируемые соединения смешивают в композицию, используя раствор, содержащий 10% ацетона, 90% воды и 300 ч/млн Х-77® Spreader Lo-Foam Formula неионного поверхностно-активного вещества, содержащего алкиларилполиоксиэтилен, свободные жирные кислоты, гликоли и изопропанол (Loveland Industries, Inc.). Соединения в композиции наносят в объеме 1 мл жидкости через SUJ2 распылитель с аппаратом 1/8 JJ (Spraying Systems Co.), расположенный на расстоянии 1,27 см (0,5 дюйма) над верхней частью каждого тестируемого образца. Все экспериментальные соединения в данном исследовании распыляют при 250 ч./млн и обработку повторяют три раза. После распыления композиции тестируемого соединения каждый тестируемый образец сушат в течение 1 часа и затем на верхнюю часть кладут черную экранированную крышку. Тестируемые образцы хранят в течение 6 дней в камере для выращивания при температуре 19-21°С и относительно влажности 50-70%. Гибель насекомых в каждом образце оценивают визуально. Из тестируемых соединений следующие демонстрируют, по крайней мере, 80% умерщвление: 8, 9, 11, 12, 13, 19, 28, 29 50. Тест F Для оценки борьбы с тлей хлопковой (Aphis gossypii) посредством контакта и/или системных средств тестируемый образец представляет собой небольшой открытый контейнер с 6-7-дневными растениями хлопка. Растения заранее инфицированы 30-40 тлями на куске листа в соответствии с методом отсечения листа, как описано в тесте Е, и почву тестируемого образца покрывают слоем песка. Тестируемые соединения смешивают в композицию и распыляют при 250 ч./млн, как описано в тесте Е. Нанесение повторяют 3 раза. После распыления тестируемые образцы выдерживают в камере для роста и затем оценивают визуально, как описано в тесте Е. Из тестируемых соединений следующие демонстрируют, по крайней мере, 80% умерщвление: 8, 9, 11, 12, 13, 15, 16, 19, 29, 50 и 52. Тест G Для оценки борьбы с цикадой кукурузной (Peregrinus maidis) посредством контакта и/или системных средств, тестируемый образец представляет собой небольшой открытый контейнер с 3-4-дневными растениями (стрелками) кукурузы (маиса). Перед нанесением на верхний слой почвы насыпают белый песок. Тестируемые соединения смешивают в композицию и распыляют при 250 ч/млн, повторяя 3 раза, как описано в тесте Е. После распыления тестируемые образцы высушивают в течение 1 часа перед тем, как инфицировать их 10-20 цикадами кукурузными (18-20-дневные нимфы), высыпая их на песок с помощью солонки. На верхнюю часть цилиндра кладут черную экранированную крышку. Тестируемые образцы хранят в течение 6 дней в камере для выращивания при температуре 19-21°С и относительно влажности 50-7 0%. Гибель насекомых в каждом образце оценивают визуально. Из тестируемых соединений следующие демонстрируют, по крайней мере, 80% умерщвление: 12, 13, 50 и 52. Тест Н Для оценки борьбы с цикадками картофельными (Empoasca fabae Harris) посредством контакта и/или системных средств, тестируемый образец представляет собой небольшой открытый контейнер с 5-6-дневными растениями бобов Longio (с появившимися первыми листьями). Перед нанесением на верхний слой почвы насыпают белый песок и один из первых листьев вырезают. Тестируемые соединения смешивают в композицию и распыляют при 250 ч/млн, повторяя 3 раза, как описано в тесте Е. После распыления тестируемые образцы высушивают в течение 1 часа перед тем, как инфицировать их 5 цикадками картофельными (18-21-дневные взрослые особи). На верхнюю часть цилиндра кладут черную экранированную крышку. Тестируемые образцы хранят в течение 6 дней в камере для выращивания при температуре 19-21°С и относительно влажности 50-70%. Гибель насекомых в каждом образце оценивают визуально. Из тестируемых соединений следующие демонстрируют, по крайней мере, 80% умерщвление: 8, 9, 10, 11, 12, 13, 15, 16, 19, 24, 29, 50, 51 и 52.
Формула изобретения
1. Соединения формулы I
где А и В являются О; J является пиразольным кольцом, замещенным 2 заместителями, независимо выбранными из R5; К вместе с двумя прилегающими связывающими атомами углерода представляет фенильное кольцо, представленное К-1, замещенное от 1 до 2 заместителями, независимо выбранными из R4
L является связующей цепью, содержащей от 1 до 2 членов, выбранных из углерода, необязательно замещенной одним R13; или L является С(=Е); Е является О; R3 является Н или С1-С6алкилом; каждый R4 независимо является С1-С6алкилом, галогеном или CN; каждый R5 независимо является С1-С6галогеналкилом, галогеном или С1-С4галогеналкокси; или каждый R5 независимо является фенильным или пиридинильным кольцом, где каждое кольцо замещено R6; каждый R6 независимо является галогеном; каждый R13 независимо является СООН, С2-С6алкоксикарбонилом или С2-С6алкоксикарбонилалкилом; или каждый R13 является фенилом, замещенным С2-С6алкоксикарбонилом; пиридинильным или имидазолильным кольцом; и n равно 1 или 2. 2. Соединение по п.1, в котором одна R4 группа присоединена к кольцу К либо в положении 2, либо в положении 4 К-1, и указанный R4 является Сг-С4алкилом, галогеном или CN; и каждый R5 независимо является С1-С4галогеналкилом, галогеном или С1-С4галогеналкокси; или каждый R5 независимо является фенильным или пиридинильным кольцом, где каждое кольцо замещено R6. 3. Соединение по п.2, в котором J выбирают из группы, состоящей из
R5 является
V является N или СН; R6 является галогеном; R7 является С1-С4галогеналкилом или галогеном; 4. Соединение по п.3, в котором V является N. 5. Соединение по п.3, в котором V является СН. 6. Соединение по п.4 или 5, в котором R3 является Н; или С1-С4алкилом; одна R4 группа присоединена к кольцу К в положении 2 К-1, и указанный R4 является СН3, CN или галогеном; необязательно второй R4 является F, Cl, Br, I или CN; R6 является галогеном; и R7 является CF3 или галогеном. 7. Соединение по п.6, в котором R3 является Н; или С1-С4алкилом; и одна R4 группа присоединена в положении 2 К-1, и указанный R4 является СН3, Cl, Br или I. 8. Соединение по п.7, в котором V является N; R3 является Н или метилом, этилом, изопропилом или третичным бутилом; и R7 является Br, Cl или CF3. 9. Соединение по п.1, которое выбирают из группы, включающей 6-бром-1-[[3-бром-1-(3-хлор-2-пиридинил)-1Н-пиразол-5-ил]карбонил]-8-метил-3-(1-метилэтил)-2,4(1Н,3Н)-хиназолиндион, 6-бром-1-[[1-(3-хлор-2-пиридинил)-3-(трифторметил)-1Н-пиразол-5-ил]карбонил]-3,8-диметил-2,4(1Н,3Н)-хиназолиндион, 6-бром-1-[[3-бром-1-(3-хлор-2-пиридинил)-1Н-пиразол-5-ил]карбонил]-3,8-диметил-2,4(1Н,3Н)-хиназолиндион, 1-[[3-бром-1-(3-хлор-2-пиридинил)-1Н-пиразол-5-ил]карбонил]2,3-дигидро-8-метил-3-(1-метилэтил)-4(1Н)-хиназолинон, 6,8-дихлор-1-[[3-хлор-1-(3-хлор-2-пиридинил)-1Н-пиразол-5-ил]карбонил]-2,3-дигидро-3-(1-метилэтил)-4(1Н)-хиназолинон, 1-[[3-бром-1-(3-хлор-2-пиридинил)-1H-пиразол-5-ил]карбонил]-6,8-дихлор-2,3-дигидро-3-(1-метилэтил)-4(1Н)-хиназолинон, 6,8-дихлор-1-[[1-(3-хлор-2-пиридинил)-3-(трифторметил)-1Н-пиразол-5-ил]карбонил]-2,3- дигидро-3-метил-4(1Н)-хиназолинон, 6-хлор-1-[[3-хлор-1-(3-хлор-2-пиридинил)-1Н-пиразол-5-ил]карбонил]-2,3-дигидро-8-метил-3-(1-метилэтил)-4(1Н)-хиназолинон, 1-[[3-бром-1-(3-хлор-2-пиридинил)-1Н-пиразол-5-ил]карбонил]-6-хлор-2,3-дигидро-8-метил-3-(1-метилэтил)-4(1Н)-хиназолинон, 6,8-дихлор-1-[[1-(3-хлор-2-пиридинил)-3-(трифторметил)-1Н-пиразол-5-ил]карбонил]-2,3-дигидро-3-(1-метилэтил)-4(1Н)-хиназолинон, 6,8-дихлор-1-[[3-хлор-1-(3-хлор-2-пиридинил)-1Н-пиразол-5-ил]карбонил]-2,3-дигидро-3-метил-4(1Н)-хиназолинон, 1-[[3-бром-1-(3-хлор-2-пиридинил)-1Н-пиразол-5-ил]карбонил]-6,8-дихлор-2,3-дигидро-3-метил-4(1Н)-хиназолинон, 6-хлор-1-[[1-(3-хлор-2-пиридинил)-3-(трифторметил)-1Н-пиразол-5-ил]карбонил]-2,3-дигидро-8-метил-3-(1-метилэтил)-4(1Н)-хиназолинон, 6-хлор-1-[[3-хлор-1-(3-хлор-2-пиридинил)-1Н-пиразол-5-ил]карбонил]-2,3-дигидро-3,8-диметил-4(1Н)-хиназолинон, 1-[[3-бром-1-(3-хлор-2-пиридинил)-1Н-пиразол-5-ил]карбонил]-6-хлор-2,3-дигидро-3,8-диметил-4(1Н)-хиназолинон, 6-хлор-1-[[1-(3-хлор-2-пиридинил)-3-(трифторметил)-1Н-пиразол-5-ил]карбонил]-2,3-дигидро-3,8-диметил-4(1Н)-хиназолинон, 6,8-дихлор-1-[[1-(3-хлор-2-пиридинил)-3-(трифторметил)-1Н-пиразол-5-ил]карбонил]-2,3-дигидро-4(1Н)-хиназолинон и 6,8-дихлор-1-[[3-хлор-1-(3-хлор-2-пиридинил)-1Н-пиразол-5-ил]карбонил]-2,3-дигидро-4(1Н)-хиназолинон. 10. Композиция для борьбы с насекомыми-вредителями, включающая биологически эффективное количество соединения по п.1 и, по крайней мере, один дополнительный компонент, выбранный из группы, включающей поверхностно-активные вещества, твердые разбавители и жидкие разбавители. 11. Способ борьбы с насекомыми-вредителями, включающий контакт насекомого-вредителя или среды его обитания с биологически эффективным количеством соединения по п.1. 12. Соединение формулы 6:
где R3 является Н; или С1-С4алкилом; один R4 присоединен к фенильному кольцу в положении 2 и указанный R4 является СН3 или галогеном; необязательно второй R4 является F, Cl, Br, I или CN; и n равен 1 или 2; при условии, что (a) когда один R4, присоединенный к фенильному кольцу в положении 2, и второй R4, присоединенный к фенильному кольцу в положении 4, являются Cl, тогда R3 не является Н, СН2СН3 СН(СН3)СН2СН3; (b) когда один R4, присоединенный к фенильному кольцу в положении 2, является СН3 или Cl и второй R4, присоединенный к фенильному кольцу в положении 4, является Н, Cl или Br, тогда R3 не является СН3 или СН(СН3)2; и (c) когда один R4, присоединенный к фенильному кольцу в положении 2, является СН3 и второй R4, присоединенный к фенильному кольцу в положении 4, является Н, тогда R3 не является Н или н-пропилом. (d) когда один R4, присоединенный к фенильному кольцу в положении 2, является Cl и n равно 1, тогда R3 не является Н, СН2СН3 или СН2СН2СН3; (e) когда один R4, присоединенный к фенильному кольцу в положении 2, и второй R4, присоединенный к фенильному кольцу в положении 4, являются Br, тогда R3 не является Н или СН2СН3; (f) когда один R4, присоединенный к фенильному кольцу в положении 2, является F или I и n равно 1, тогда R3 не является Н; (g) когда R3 является Н и один R4, присоединенный к фенильному кольцу в положении 2, является Cl, тогда второй R4, присоединенный к фенильному кольцу, не является 3-Cl, 5-Cl или 4-Br; (h) когда один R4, присоединенный к фенильному кольцу в положении 2, является Br, а второй R4, присоединенный к фенильному кольцу в положении 4, является Cl, тогда R3 не является Н; и (i) когда один R4, присоединенный к фенильному кольцу в положении 2, и второй R4, присоединенный к фенильному кольцу в положении 4, являются I, тогда R3 не является Н или СН2СН3. 13. Соединение по п.12, в котором один R4, присоединенный к фенильному кольцу в положении 2, является СН3, Cl, Br, I. 14. Соединение по п.13, в котором необязательно второй R4 присоединен к фенильному кольцу в положении 4. 15. Соединение по п.14, в котором R3 является Н, метилом, этилом, изопропилом или трет-бутилом. 16. Соединение по п.15, в котором R3 является Н, метилом или изопропилом, R4, присоединенный к фенильному кольцу в положении 2, является СН3, и необязательно второй R4 является CN.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

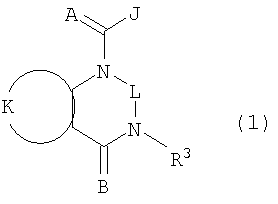
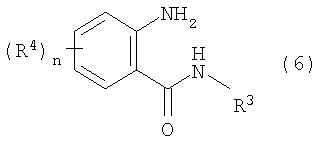
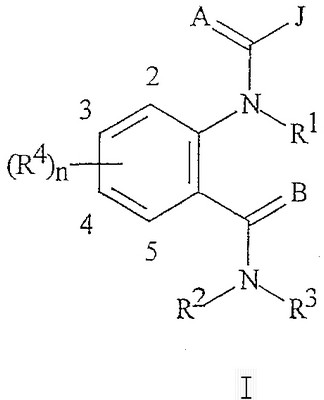
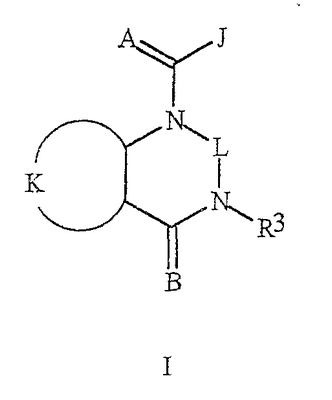
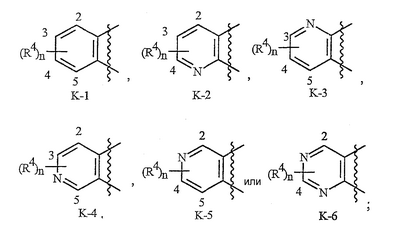
 CCHCl, CF3C
CCHCl, CF3C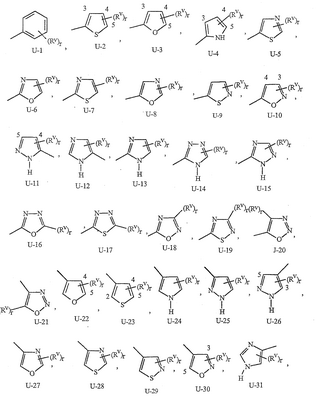
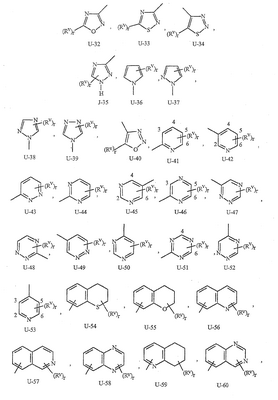
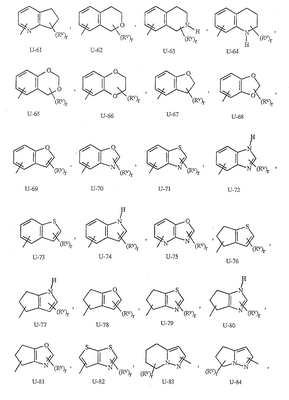
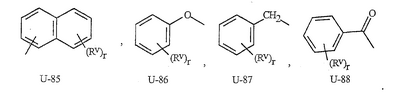
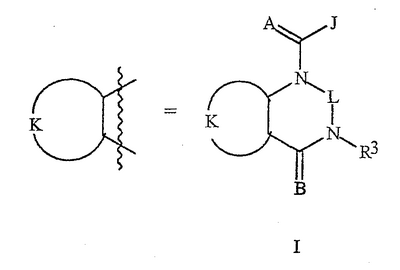
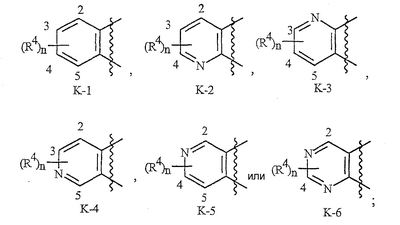
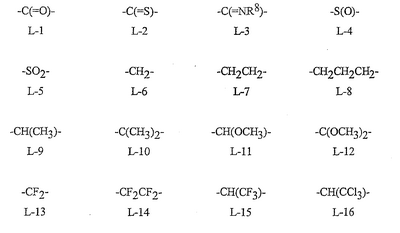
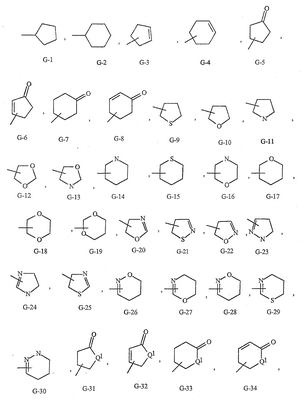
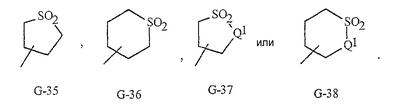
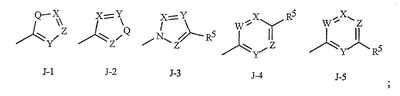
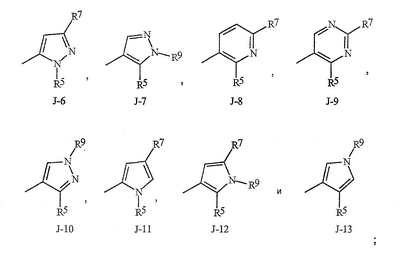
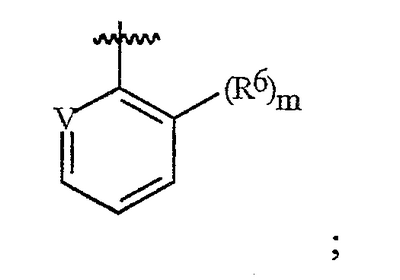
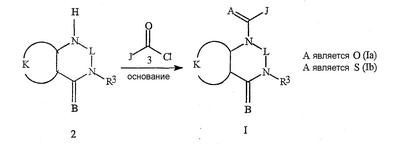
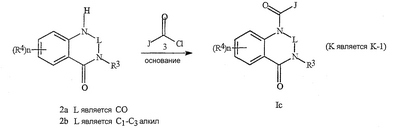
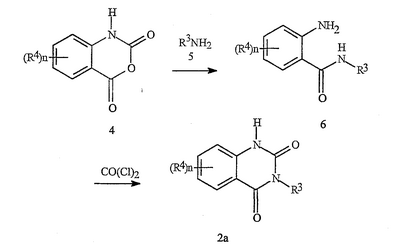
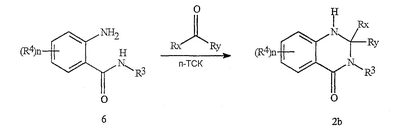
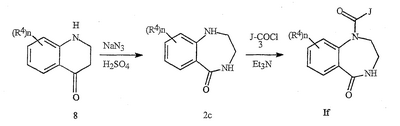
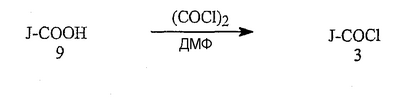
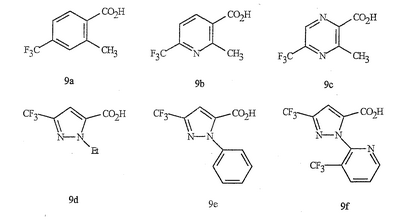
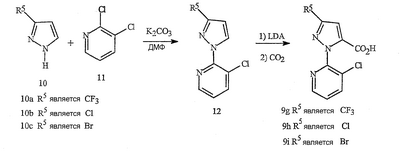
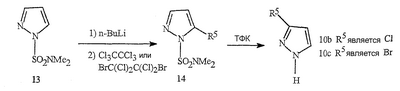
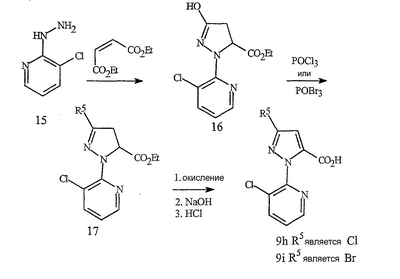
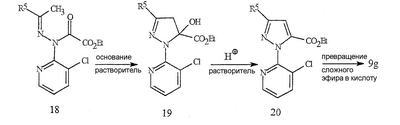
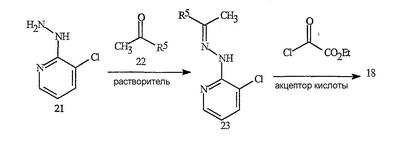
 3,07 (д, 6H), 6,44 (м, 1Н), 7,62 (м, 1Н).
3,07 (д, 6H), 6,44 (м, 1Н), 7,62 (м, 1Н).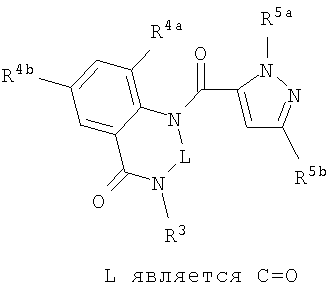
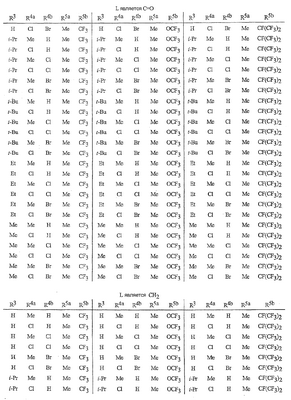
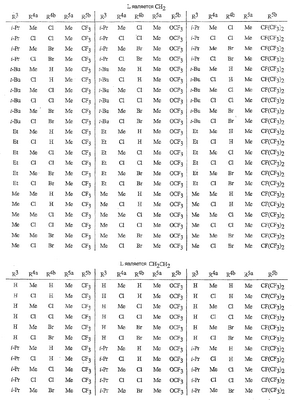
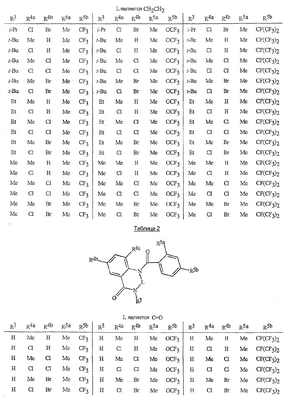
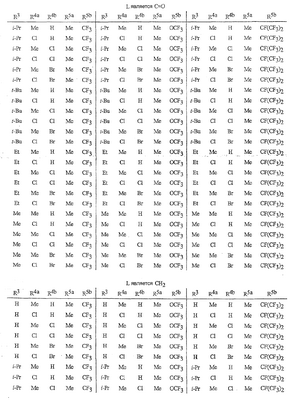
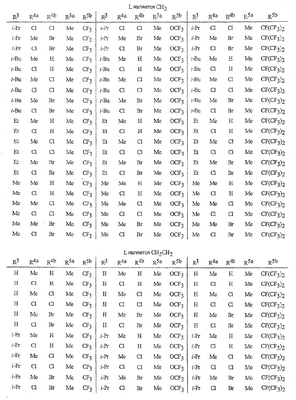
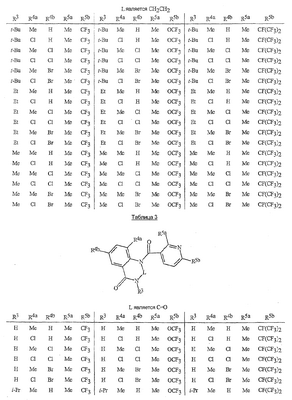
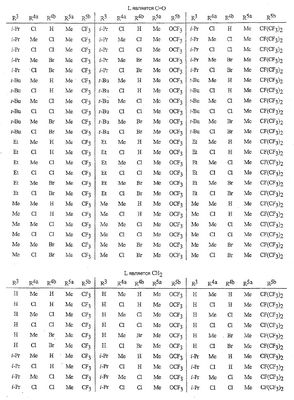
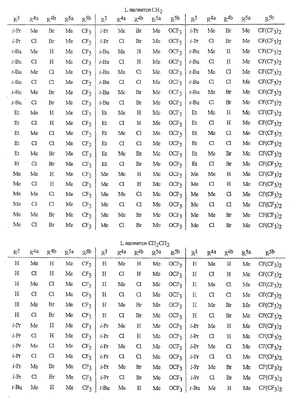
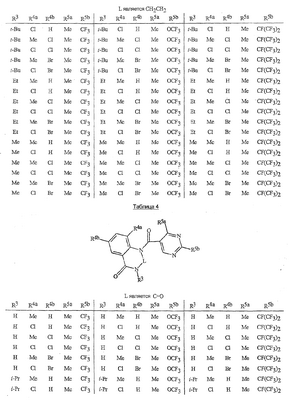
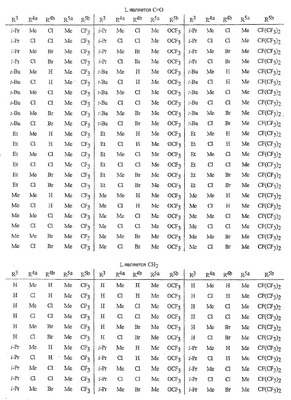
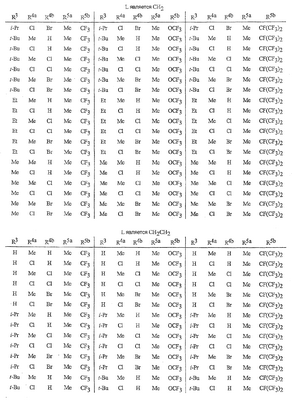
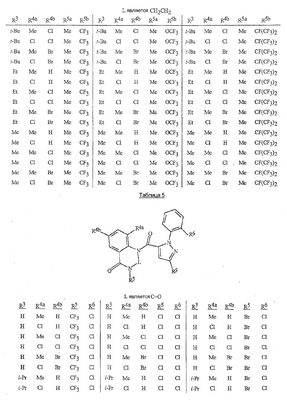
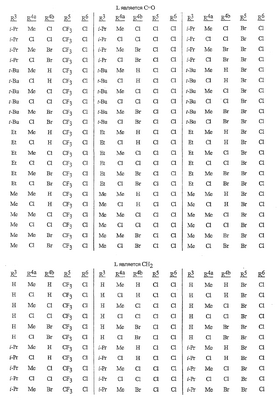
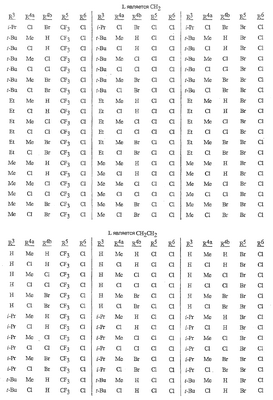
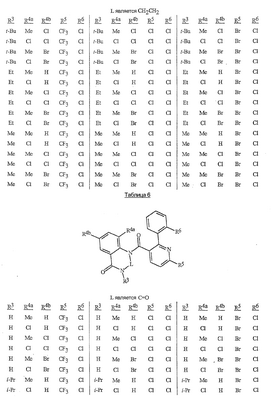
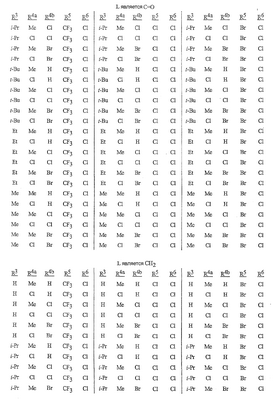
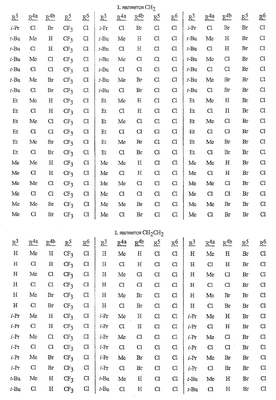
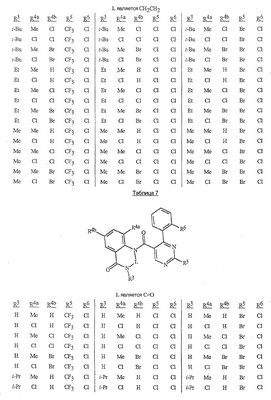
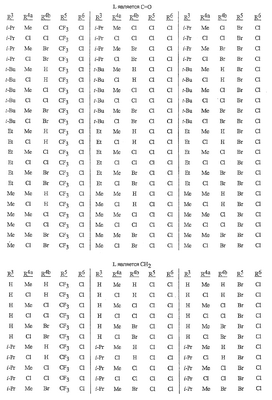
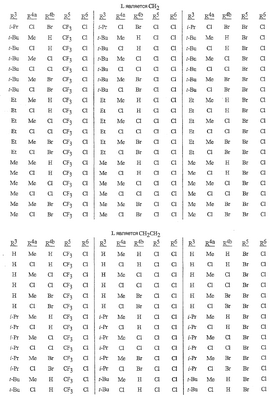
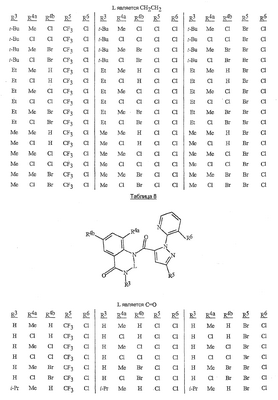
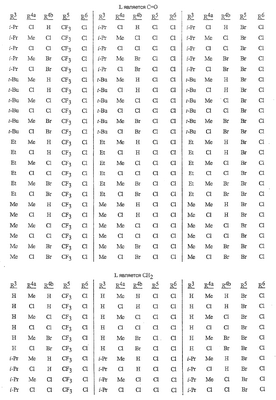
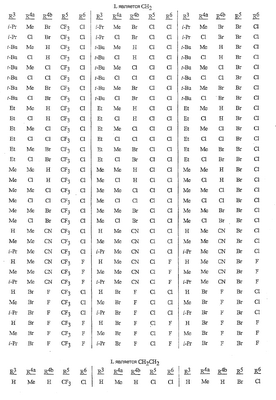
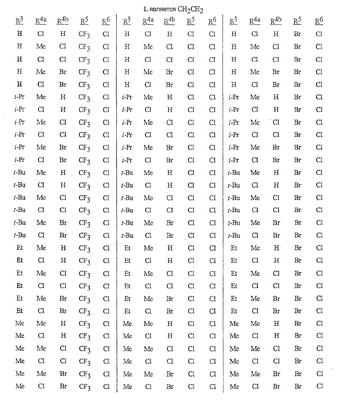
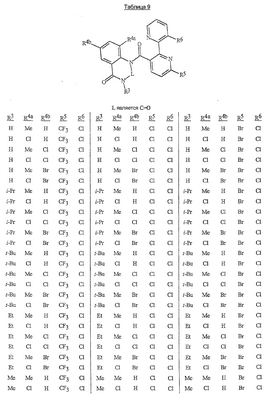
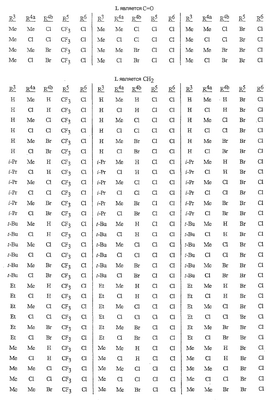
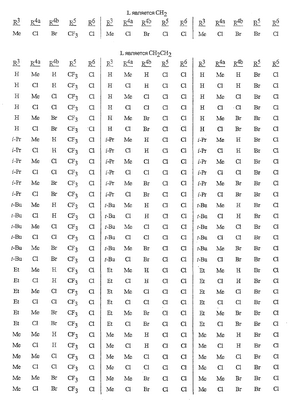
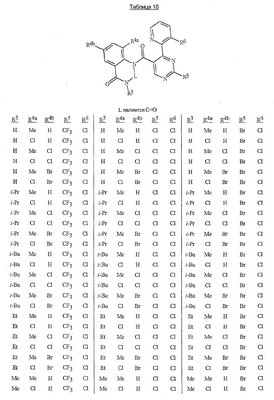
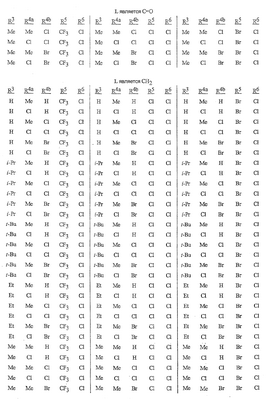
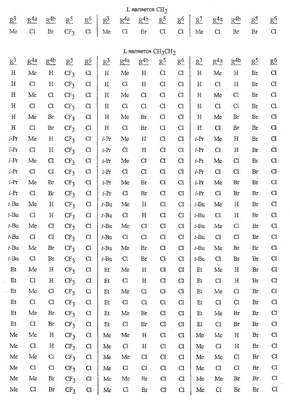
 -аминомасляной кислоты (GABA), такие как эндосульфан, этипрол и фипронил; инсектицидные мочевины, такие как флуфеноксурон и трифлумурон; мимики ювенильного гормона, такие как диофенолан и пирипроксифен; пиметрозин; и амитраз. Предпочтительными биологическими агентами для смешивания с соединениями в соответствии с данным изобретением являются Bacillus thuringiensis и Bacillus thuringiensis дельта эндотоксин, а также природные и генетически модифицированные вирусные инсектициды, включая членов семейства Baculoviridae, а также энтомофаговые грибы.
-аминомасляной кислоты (GABA), такие как эндосульфан, этипрол и фипронил; инсектицидные мочевины, такие как флуфеноксурон и трифлумурон; мимики ювенильного гормона, такие как диофенолан и пирипроксифен; пиметрозин; и амитраз. Предпочтительными биологическими агентами для смешивания с соединениями в соответствии с данным изобретением являются Bacillus thuringiensis и Bacillus thuringiensis дельта эндотоксин, а также природные и генетически модифицированные вирусные инсектициды, включая членов семейства Baculoviridae, а также энтомофаговые грибы.