|
|
(21), (22) Заявка: 2004121161/04, 28.11.2002
(24) Дата начала отсчета срока действия патента:
28.11.2002
(30) Конвенционный приоритет:
11.12.2001 (пп.1-7) DE 10160661.3
(43) Дата публикации заявки: 10.01.2006
(46) Опубликовано: 27.01.2008
(15) Информация о коррекции:
Версия коррекции № 1 (W1 C2)
(48) Коррекция опубликована:
27.10.2008 Бюл. № 30/2008
(56) Список документов, цитированных в отчете о
поиске:
RU 2154635 С2, 20.08.2000. WO 01 25210 А2, 12.04.2001. POULSEN-S-A et al. “ADENOSINE RECEPTORS”, BIOORGANIC & MEDICINAL CHEMISTRY, ELSEVIER SCIENCE LTD, 1998, vol.6, p.619-641.
(85) Дата перевода заявки PCT на национальную фазу:
12.07.2004
(86) Заявка PCT:
EP 02/13432 (28.11.2002)
(87) Публикация PCT:
WO 03/053441 (03.07.2003)
Адрес для переписки:
103064, Москва, ул. Казакова,16, НИИР Канцелярия “Патентные поверенные Квашнин, Сапельников и партнеры”, В.П.Квашнину
|
(72) Автор(ы):
РОЗЕНТРЕТЕР Ульрих (DE),
КРЕМЕР Томас (DE),
ШИМАДА Митсуюки (JP),
ХЮБШ Вальтер (DE),
ДИДРИХС Николе (DE),
КРАН Томас (DE),
ХЕННИНГЕР Керстин (DE),
СТАШ Йоханнес-Петер (DE),
ВИШНАТ Ральф (DE)
(73) Патентообладатель(и):
Байер ХельсКер АГ (DE)
|
(54) ЗАМЕЩЕННЫЕ 2-ТИО-3,5-ДИЦИАНО-4-ФЕНИЛ-6-АМИНОПИРИДИНЫ И ЛЕКАРСТВЕННОЕ СРЕДСТВО НА ИХ ОСНОВЕ
(57) Реферат:
Изобретение относится к замещенным 2-тио-3,5-дициано-4-фенил-6-аминопиридинам, представленным структурой формулы (I)
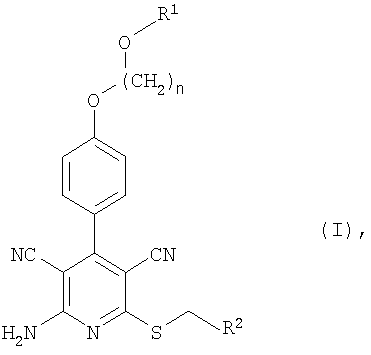
в которой n означает 2, 3 или 4, R1 означает водород или алкил с 1-4 атомами углерода и R2 означает пиридил или тиазолил, который может быть замещен алкилом с 1-4 атомами углерода, галогеном, амино, диметиламино, ацетиламино, гуанидино, пиридиламино, тиенилом, пиридилом, морфолинилом, а также тиазолилом, при необходимости замещенным алкилом с 1-4 атомами углерода, или фенилом, при необходимости содержащим до трех заместителей в виде галогена, алкила с 1-4 атомами углерода или алкокси с 1-4 атомами углерода, и к их солям, гидратам, гидратам солей и сольватам, а также к замещенным 2-тио-3,5-дициано-4-фенил-6-аминопиридина формулы (I), обладающим свойствами агониста рецептора А1 аденозина. Также данное изобретение описывает лекарственное средство, обладающее свойствами агониста рецептора А1 аденозина. Технический результат – получены новые соединения, обладающие полезными биологическими свойствами. 3 н. и 4 з.п. ф-лы, 4 табл.
Настоящее изобретение касается замещенных 2-тио-3,5-дициано-4-фенил-6-аминопиридинов, способа их получения и их применения в качестве лекарственных средств.
Аденозин, нуклеозид из аденина и D-рибозы, является эндогенным фактором, обладающим направленной на защиту клеток эффективностью, особенно при их повреждении в условиях ограниченного снабжения кислородом и субстратом, например, при ишемии самых разных органов (в частности, сердца и головного мозга).
Аденозин образуется внутри клеток в качестве промежуточного продукта деструкции аденозин-5′-монофосфата (АМФ) и S-аденозилгомоцистеина, может выделяться из клеток в свободном состоянии и затем благодаря присоединению к специфическим рецепторам выполнять функции гормоноподобного вещества или медиатора.
В условиях нормального обеспечения кислородом концентрация свободного аденозина во внеклеточном пространстве чрезвычайно низка. Однако при ишемии или кислородной недостаточности происходит резкое увеличение его внеклеточной концентрации в пораженных органах. Например, известно, что аденозин ингибирует агрегацию тромбоцитов и усиливает кровоснабжение венечных сосудов сердца. Кроме того, он оказывает воздействие на частоту сердечных сокращений, распределение медиаторов и дифференцировку лимфоцитов.
Указанные воздействия аденозина направлены на усиление обеспечения пораженных органов кислородом и подавление происходящего в них обмена веществ, чтобы при ишемии или кислородной недостаточности было обеспечено соответствие обмена веществ кровоснабжению пораженных органов.
Воздействие аденозина передается посредством специфических рецепторов. В настоящее время известны рецепторы подтипов А1, А2а, А2b и A3. Внутриклеточные воздействия этих рецепторов аденозина передаются посредством циклического аденозинмонофосфата (цАМФ) в качестве транспортного вещества. Если аденозин присоединяется к рецепторам подтипа А2а или А2b, то благодаря активированию мембранной аденилатциклазы происходит увеличение внутриклеточного содержания цАМФ, в то время как присоединение аденозина к рецепторам подтипа А1 или A3 приводит к снижению внутриклеточного содержания цАМФ вследствие подавления аденилатциклазы.
В соответствии с настоящим изобретением «селективными лигандами рецепторов аденозина» обозначают такие вещества, которые способны селективно присоединяться к рецепторам аденозина одного или нескольких подтипов, при этом либо подражая воздействию аденозина (агонисты аденозина), либо блокируя это воздействие (антагонисты аденозина).
В соответствии с настоящим изобретением «селективными» называют такие лиганды рецепторов аденозина, которые, с одной стороны, оказывают явное воздействие на один или несколько подтипов рецепторов аденозина, а, с другой стороны, характеризуются полным отсутствием воздействия на один или несколько других подтипов рецепторов аденозина или это воздействие является гораздо более слабым (коэффициент 10 или менее), причем методы испытания селективного воздействия приводятся в разделе A.II настоящего изобретения.
Селективные лиганды рецепторов аденозина в зависимости от степени их селективности по отношению к рецепторам могут быть отнесены к разным классам, например, к лигандам, селективно присоединяемым к рецепторам аденозина подтипа А1 или А2, причем лиганды, селективно присоединяемые к рецепторам аденозина подтипа А2, в свою очередь, селективно присоединяются, например, к рецепторам аденозина подтипа А2а или А2b. Возможны также лиганды рецепторов аденозина, которые селективно присоединяются к рецепторам нескольких подтипов, например лиганды, которые селективно присоединяются к рецепторам аденозина подтипов А1 и А2, но не присоединяются к рецепторам аденозина подтипа A3.
Указанная выше селективность по отношению к рецепторам может быть определена по воздействию веществ на клеточные линии, которые экспримируют соответствующие подтипы рецепторов после стабильной трансфекции соответствующей комплементарной ДНК (кДНК) (смотри публикацию М. Е. Olah, H. Ren, J. Ostrowski, К. A. Jacobson, G. L. Stiles, “Cloning, expression, and characterization of the unique bovine A1 adenosine receptor. Studies on the ligand binding site by site-directed mutagenesis” в J. Biol. Chem. 267 (1992), Seiten 10764-10770, содержание которой в полном объеме включено в настоящее изобретение в качестве ссылки).
Воздействие веществ на такие клеточные линии может быть определено путем биохимического измерения содержания цАМФ в качестве внутриклеточного транспортного вещества (смотри публикацию К. N. Klotz, J. Hessling, J. Hegler, С. Owman, В. Kull, В. В. Fredholm, M. J. Lohse, “Comparative pharmacology of human adenosine receptor subtypes – characterization of stably transfected receptors in CHO cells” в Naunyn Schmiedebergs Arch. Pharmacol. 357 (1998), Seiten 1-9, содержание которой в полном объеме включено в настоящее изобретение в качестве ссылки).
При этом в случае агонистов рецепторов подтипа A1 (предпочтительное присоединение посредством Gi-белков) наблюдается снижение внутриклеточного содержания цАМФ (предпочтительно после прямой предварительной стимуляции форсколином), а в случае антагонистов рецепторов подтипа A1 происходит увеличение внутриклеточного содержания цАМФ (предпочтительно после предварительной стимуляции аденозином или аналогичными аденозину веществами в сочетании с прямой предварительной стимуляцией аденилатциклазы форсколином). Соответственно, агонисты рецепторов подтипов А2а и А2b (предпочтительное присоединение посредством Gs-белков) обеспечивают увеличение содержания цАМФ в клетках, а антагонисты рецепторов подтипов А2а и А2b – его снижение. В случае рецепторов подтипа А2 прямая предварительная стимуляция аденилатциклазы форсколином не всегда оказывается полезной.
Под известными из уровня техники «специфичными по отношению к рецепторам аденозина» лигандами преимущественно подразумевают производные природного аденозина (S.-A. Poulsen, R. J. Quinn, “Adenosine receptors: new opportunities for future drugs” в Bioorganic and Medicinal Chemistry 6 (1998), Seiten 619 – 641). Однако недостатком большинства этих известных из уровня техники лигандов аденозина является то, что они не обладают действительно специфичным по отношению к рецепторам воздействием, проявляют меньшую активность по сравнению с природным аденозином или обладают очень низкой эффективностью при оральном применении. В связи с этим такие лиганды преимущественно используют лишь в экспериментальных целях.
Кроме того, из международной заявки WO 00/125210 известны 2-тио-3,5-дициано-4-арил-6-аминопиридины, структура которых подобна структуре соединений согласно настоящему изобретению. Однако описанные в этой заявке соединения обладают менее благоприятными фармакокинетическими свойствами, в частности низкой биологической готовностью после орального применения.
Задачей настоящего изобретения является отыскание и получение таких соединений, которые не обладают присущими уровню техники недостатками и характеризуются более высокой биологической готовностью.
Итак, настоящее изобретение касается соединений формулы (I)
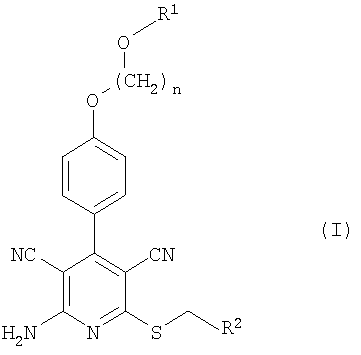
в которой n означает 2, 3 или 4,
R1 означает водород или алкил с 1-4 атомами углерода и
R2 означает пиридил или тиазолил, которые, в свою очередь, могут быть замещены алкилом с 1-4 атомами углерода, галогеном, амино, диметиламино, ацетиламино, гуанидино, пиридиламино, тиенилом, фурилом, имидазолилом, пиридилом, морфолинилом, тиоморфолинилом, пиперидинилом, пиперазинилом, N-алкилпиперазинилом с 1-4 атомами углерода в алкиле, пирролидинилом, оксазолилом, изоксазолилом, пиримидинилом, пиразинилом, а также тиазолилом, при необходимости замещенным алкилом с 1-4 атомами углерода, или фенилом, при необходимости содержащим до трех заместителей в виде галогена, алкила с 1-4 атомами углерода или алкокси с 1-4 атомами углерода,
и соответствующих солей, гидратов, гидратов солей и сольватов.
В зависимости от типа заместителей соединения формулы (I) могут существовать в виде стереоизомеров, являющихся прямым и зеркальным отображением (энантиомеров) или не являющихся прямым и зеркальным отображением (диастереомеров). Изобретение касается как энантиомеров или диастереомеров, так и соответствующих смесей. Рацемические формы аналогично диастереомерам могут быть разделены известными способами на индивидуальные стереоизомеры. Настоящее изобретение равным образом касается и прочих таутомеров соединений формулы (I) и соответствующих солей.
Соли соединений формулы (I) могут быть солями веществ согласно изобретению, образованными с минеральными и карбоновыми кислотами или сульфокислотами и не вызывающими опасений с физиологической точки зрения. Особенно предпочтительными являются, в частности, соли, образованные с хлорводородной кислотой, бромводородной кислотой, серной и фосфорной кислотами, метансульфокислотой, этансульфокислотой, то-луолсульфокислотой, бензолсульфокислотой, нафталиндисульфокислотой, трифторуксусной, уксусной, пропионовой, молочной, винной, лимонной, фумаровой, малеиновой или бензойной кислотами.
В качестве пригодных солей следует упомянуть также соли, образованные с обычными основаниями, в частности соли щелочных металлов (например, соли натрия или калия), соли щелочноземельных металлов (например, соли кальция или магния) или соли аммония, являющиеся производными аммиака или органических аминов, например диэтиламина, триэтиламина, этилдиизопропиламина, новокаина, дибензиламина, N-метилморфолина, дигидроабиетиламина, 1-эфенамина или метилпиперидина.
Гидратами и сольватами согласно изобретению обозначают такие формы соединений формулы (I), которые в твердом или жидком состоянии путем гидратации водой или координации с молекулами растворителя образуют молекулярное соединение или комплекс. Примерами гидратов являются сесквигидраты, моногидраты, дигидраты или тригидраты. В равной степени пригодными являются также гидраты и сольваты солей соединений согласно изобретению.
Кроме того, изобретение касается пролекарств соединений согласно изобретению. Пролекарствами согласно изобретению обозначают такие формы соединений формулы (I), которые сами по себе могут быть биологически активными или неактивными, однако в физиологических условиях могут перейти в соответствующую биологически активную форму (например, метаболическую или сольволитическую).
Если отсутствуют особые указания, заместители согласно настоящему изобретению означают следующее.
Галоген в общем случае означает фтор, хлор, бром или йод. Предпочтительными галогенами являются фтор, хлор или бром. Еще более предпочтительными галогенами являются фтор или хлор.
Алкил с 1-4 атомами углерода в общем случае означает неразветвленный или разветвленный алкильный остаток с 1-4 атомами углерода. Примерами алкила являются метил, этил, н-пропил, изопропил, н-бутил, втор-бутил, изобутил и трет-бутил.
Алкокси с 1-4 атомами углерода в общем случае означает неразветвленный или разветвленный алкоксильный остаток с 1-4 атомами углерода. Примерами алкокси являются метокси, этокси, н-пропокси, изопропокси, н-бутокси, втор-бутокси, изобутокси и трет-бутокси.
Предпочтительными являются соединения формулы (I),
в которой n означает 2,
R1 означает водород, метил или этил и
R2 означает пиридил или тиазолил, которые, в свою очередь, могут быть замещены метилом, этилом, фтором, хлором, амино, диметиламино, ацетиламино, гуанидино, 2-пиридиламино, 4-пиридиламино, тиенилом, пиридилом, морфолинилом, пиперидинилом, а также тиазолилом, при необходимости замещенным метилом, или фенилом, при необходимости содержащим до трех заместителей в виде хлора или метокси,
и соответствующие соли, гидраты, гидраты солей и сольваты.
Особенно предпочтительными являются соединения формулы (I), в которой R1 означает водород или метил.
Особенно предпочтительными являются соединения формулы (I),
в которой n означает 2,
R1 означает водород или метил и
R2 означает пиридил или тиазолил, которые, в свою очередь, могут быть замещены метилом, хлором, амино, диметиламино, ацетиламино, гуанидино, 2-пиридиламино, 4-пиридиламино, тиенилом, пиридилом, морфолинилом, 2-метилтиазол-5-илом, фенилом, 4-хлорфенилом или 3,4,5-триметоксифенилом,
и соответствующие соли, гидраты, гидраты солей и сольваты.
Еще более предпочтительным является соединение из примера 6, обладающее структурой
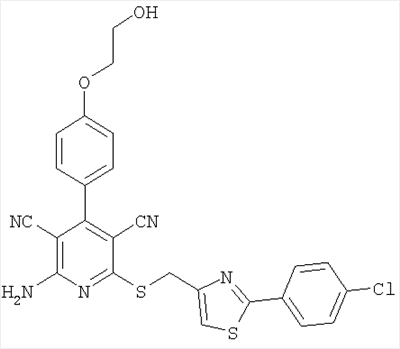
и соответствующие соли, гидраты, гидраты солей и сольваты.
Объектом настоящего изобретения является также способ получения соединений формулы (I), отличающийся тем, что соединения формулы (II)
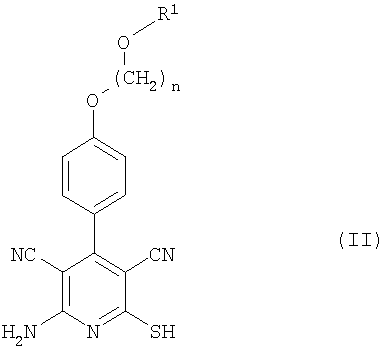
в которой n и R1 такие, как указано выше,
при необходимости, в присутствии основания подвергают взаимодействию с соединениями формулы (III)

в которой R2 такой, как указано выше, а Х означает соответствующую отщепляемую группу, например предпочтительно галоген, в частности хлор, бром или йод, или мезилат, тозилат, трифлат или 1-имидазолил.
Описанный выше способ может быть проиллюстрирован следующей, приведенной в качестве примера реакционной схемой:
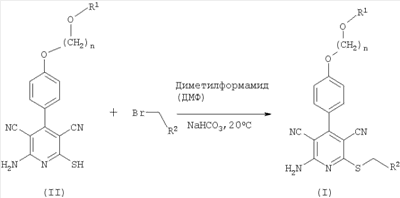
В качестве растворителей для осуществления способа согласно изобретению пригодны любые, инертные в реакционных условиях органические растворители. К ним относятся спирты, например метанол, этанол и изопропанол, кетоны, например ацетон и метилэтилкетон, простые ациклические и циклические эфиры, например диэтиловый эфир и тетрагидрофуран, сложные эфиры, например этилацетат или бутилацетат, углеводороды, например бензол, ксилол, толуол, гексан или циклогексан, хлорированные углеводороды, например дихлорметан, хлорбензол или дихлорэтан, а также другие растворители, например диметилформамид, ацетонитрил, пиридин или диметилсульфоксид (ДМСО). Кроме того, в качестве растворителя пригодна вода. Предпочтительным растворителем является диметилформамид. Кроме того, можно использовать смеси указанных выше растворителей.
В качестве оснований пригодны обычные неорганические или органические основания. К ним предпочтительно относятся гидроксиды щелочных металлов, например гидроксид натрия или калия, карбонаты щелочных металлов, например карбонат натрия или калия, гидрокарбонаты щелочных металлов, например гидрокарбонат натрия или калия, алкоголяты щелочных металлов, например метанолят натрия или калия, этанолят натрия или калия, трет-бутилат калия, амиды, например амид натрия, бис(триметилсилил)амид лития или диизопропиламид лития, металлорганические соединения, например бутиллитий или фениллитий, 1,8-диазабицикло[5.4.0]ундец-7-ен, 1,5-диазабицикло[4.3.0]нон-5-ен, а также амины, например триэтиламин и пиридин. Предпочтительными основаниями являются карбонаты и гидрокарбонаты щелочных металлов.
При этом основание может быть использовано в количестве от 1 до 10 молей, предпочтительно от 1 до 5 молей, в частности от 1 до 4 молей, в расчете на 1 моль соединения формулы (II).
В общем случае реакцию проводят в интервале температур от -78 до +140°С, предпочтительно от -78 до +40°С, в частности при комнатной температуре.
Реакция может протекать при нормальном, повышенном или пониженном давлении (например, в интервале от 0,5 до 5 бар). В общем случае реакцию проводят при нормальном давлении.
Соединения формулы (II) известны специалистам или могут быть синтезированы обычными, описанными в литературе способами, например путем взаимодействия соответствующих бензальдегидов с циантиоацетамидом.
В частности, можно сослаться на следующие публикации, содержание которых включено в настоящее изобретение в качестве ссылок:
– Dyachenko et al., Russian Journal of Chemistry, Vol.33, No.7, 1997, страницы 1014-1017, и Vol.34, No.4, 1998, Seiten, 557-563;
– Dyachenko et al., Chemistry of Heterocyclic Compounds, Vol.34, No.2, 1998, Seiten, 188-194;
– Qintela et al., European Journal of Medicinal Chemistry, Vol.33, 1998, Seiten 887-897;
– Kandeel et al., Zeitschrift für Naturforschung 42b, Seiten 107-111 (1987).
Соединения формулы (II) могут быть также синтезированы, например, путем взаимодействия соединений формулы (IV) с сульфидом щелочного металла. Данный способ может быть проиллюстрирован следующей, приведенной в качестве примера реакционной схемой:
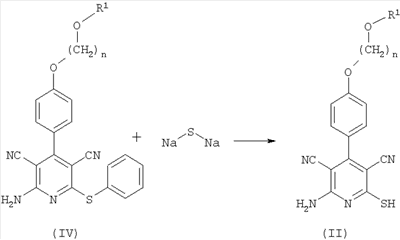
В качестве сульфида щелочного металла предпочтительно используют сульфид натрия в количестве от 1 до 10 молей, предпочтительно от 1 до 5 молей, в частности от 1 до 4 молей, в расчете на 1 моль соединения формулы (IV).
В качестве растворителей пригодны любые, инертные в реакционных условиях органические растворители. К ним относятся, например, N,N-диметилформамид, N-метилпирролидинон, пиридин и ацетонитрил. Предпочтительным растворителем является N,N-диметилформамид. Кроме того, можно использовать смеси указанных выше растворителей.
В общем случае реакцию проводят в интервале температур от +20 до +140°С, предпочтительно от +20 до +120°С, в частности от +60 до +100°С.
Реакция может протекать при нормальном, повышенном или пониженном давлении (например, в интервале от 0,5 до 5 бар). В общем случае реакцию проводят при нормальном давлении.
Соединения формулы (III) являются коммерчески доступными, известными специалистам продуктами или могут быть синтезированы обычными способами.
Соединения формулы (IV) являются коммерчески доступными, известными специалистам продуктами или могут быть синтезированы обычными способами. Можно сослаться, в частности, на следующие публикации, содержание которых включено в настоящее изобретение в качестве ссылок:
– Kambe et al., Synthesis, 531-533 (1981);
– EInagdi et al., Z. Naturforsch. 47b, 572-578 (1991).
Фармацевтическую эффективность соединений формулы (I) можно объяснить их воздействием на рецепторы аденозина подтипа А1 в качестве селективных лигандов. При этом они играют роль агонистов этих рецепторов аденозина.
Соединения формулы (I) неожиданно обнаруживают спектр ценных непредсказуемых фармакологических воздействий, в связи с чем они особенно пригодны для профилактики и/или лечения заболеваний.
Соединения формулы (I) согласно изобретению по сравнению с уровнем техники обладают улучшенными фармакологическими свойствами, в частности более высокой биологической готовностью после орального применения.
Соединения формулы (I) одни или в сочетании с одним или несколькими другими биологически активными веществами пригодны для профилактики и/или лечения различных заболеваний, в частности заболеваний сердечно-сосудистой системы (сердечно-сосудистых болезней). Пригодными комбинированными биологически активными веществами являются, в частности, комбинации, предназначенные для лечения коронарных болезней сердца и включающие, например, нитраты, бета-блокаторы, антагонисты кальция или мочегонные средства.
В соответствии с настоящим изобретением под заболеваниями сердечнососудистой системы (сердечно-сосудистыми болезнями) следует подразумевать, например, следующие заболевания: коронарный рестеноз, в частности рестеноз после дилатации баллонным катетером периферических кровеносных сосудов, тахикардия, аритмия, заболевания периферических и сердечных сосудов, постоянная и непостоянная стенокардия и мерцание предсердий и желудочков.
Кроме того, соединения формулы (I) пригодны, например, для восстановления области миокарда, пораженной в результате инфаркта.
Кроме того, соединения формулы (I) пригодны, например, для профилактики и/или лечения тромбоэмболических заболеваний и ишемий, в частности инфаркта миокарда, кровоизлияния в мозг и транзиторных ишемических приступов.
Другими областями показаний, для которых пригодны соединения формулы (I), являются, например, профилактика и/или лечение заболеваний урогенитальной сферы, в частности, гиперестезии мочевого пузыря, эректильной и женской сексуальной дисфункций, а также для профилактики и/или лечения воспалительных заболеваний, например астмы и воспалительных дерматозов, нейровоспалительных заболеваний центральной нервной системы, в частности состояний после инфаркта головного мозга, болезни Альцгеймера, нейродегенеративных заболеваний, а также постоянных болей и рака.
Другой областью показаний является, например, профилактика и/или лечение заболеваний дыхательных путей, в частности астмы, хронического бронхита, эмфиземы легких, бронхоэктазии, кистозного фиброза (муковисцидоза) и легочной гипертонии.
Наконец, соединения формулы (I) пригодны, например, для профилактики и/или лечения диабета, в частности сахарного диабета.
Настоящее изобретение касается также применения соединений формулы (I) для получения лекарственных средств, предназначенных для профилактики и/или лечения указанных выше заболеваний.
Кроме того, настоящее изобретение касается способа профилактики и/или лечения указанных выше заболеваний с использованием соединений формулы (I).
Другим объектом настоящего изобретения являются лекарственные средства, содержащие, по меньшей мере, одно соединение формулы (I), предпочтительно в сочетании с одним или несколькими вспомогательными веществами или наполнителями, не вызывающими опасений с фармакологической точки зрения, а также применение этих лекарственных средств для указанных выше целей.
Соединения формулы (I) можно использовать в любой традиционной форме применения, включая оральное, парентеральное, ингаляционное, носовое, подъязычное, ректальное, местное (например, имплантаты или стенты) или наружное, например чрескожное, применение. Под чрескожным применением подразумевается, в частности, внутривенное, внутримышечное, подкожное применение, например, в виде подкожного препарата пролонгированного действия. Предпочтительным является оральное или парентеральное применение. Особенно предпочтительным является оральное применение.
При этом можно применять как сами биологически активные вещества, так и содержащие их лекарственные формы. Для орального применения пригодны лекарственные формы, например, в виде таблеток, капсул, гранул, драже, пилюль, крошки, твердых и жидких аэрозолей, сиропов, эмульсий, суспензий и растворов. Содержание биологически активного вещества в перечисленных выше лекарственных формах должно быть таким, чтобы был достигнут необходимый терапевтический эффект. Концентрация биологически активного вещества в лекарственных формах в общем случае может составлять от 0,1 до 100 мас.%, в частности от 0,5 до 90 мас.%, предпочтительно от 5 до 80 мас.%. Концентрация биологически активного вещества, в частности, должна составлять от 0,5 до 90 мас.%, то есть количество биологически активного вещества должно быть достаточным, чтобы обеспечить требуемый интервал дозировок.
С этой целью биологически активные вещества известными способами могут быть переведены в обычные лекарственные формы. Этот процесс осуществляют, используя инертные, нетоксичные, фармацевтически пригодные наполнители, вспомогательные вещества, растворители, лекарственные основы, эмульгирующие и/или диспергирующие средства.
В качестве вспомогательных веществ можно использовать, например, воду, нетоксичные органические растворители, в частности парафины, растительные масла (например, кунжутное масло), спирты (например, этанол, глицерин), гликоли (например, полиэтиленгликоль), твердые наполнители, в частности измельченные природные или синтетические горные породы (например, тальк или силикаты), сахара (например, лактозу), эмульгирующие и диспергирующие средства (например, поливинилпирролидон) и технологические добавки (например, сульфат магния).
В случае орального применения таблетки, разумеется, могут содержать также добавки, например цитрат натрия в сочетании с заполнителями, в частности, крахмалом, желатиной и подобными веществами. В состав предназначенных для орального применения лекарственных форм на водной основе могут быть дополнительно введены улучшающие вкус вещества или красители.
В общем случае для достижения эффективного фармацевтического действия предпочтительным оказалось парентеральное применение в количестве от 0,1 до 10.000 мкг/кг, предпочтительно от 1 до 1.000 мкг/кг, в частности от 1 до 100 мкг/кг массы тела. При оральном применении это количество составляет от 0,05 до 5 мг/кг, предпочтительно от 0,1 до 5 мг/кг, в частности от 0,1 до 1 мг/кг массы тела.
Однако при необходимости, а именно в зависимости от массы тела, способа применения, индивидуального восприятия биологически активного вещества, вида лекарственной формы, момента времени и периодичности применения может потребоваться отклонение от указанных выше дозировок.
Для пояснения настоящего изобретения служат следующие примеры его предпочтительного осуществления, ни в коей степени не ограничивающие объем изобретения.
Если в нижеследующих примерах отсутствуют особые указания, процентные данные приведены в расчете на массу (мас.%), а части означают массовые части.
А. Оценка физиологической эффективности
I. Подтверждение воздействия на сердечно-сосудистую систему
Вскрывают грудную клетку наркотизированной крысы, быстро извлекают сердце и помещают его в обычную аппаратуру Лангендорфа. При постоянном объеме (10 мл/мин) проводят перфузию коронарных артерий сердца и соответствующим датчиком регистрируют возникающее при этом перфузионное давление. Снижение перфузионного давления в данном эксперименте соответствует релаксации коронарных артерий. Одновременно посредством баллона, введенного в левый желудочек сердца, и другого датчика давления измеряют давление, создаваемое при каждом сокращении сердца. Частоту сокращений изолированно бьющегося сердца выражают в виде числа сокращений в единицу времени.
В данном эксперименте были установлены следующие показатели снижения частоты сердечных сокращений (указанные в процентах показатели характеризуют процентное снижение частоты сердечных сокращений для каждой концентрации).
| Соединение из примера |
Процентное снижение частоты сердечных сокращений для концентрации |
| 10-7 г/мл |
10-6 г/мл |
| 1 |
15,0% |
17,5% |
| 6 |
15,5% |
20,0% |
II. Определение агонизма А1-, А2а-, А2b- и А3-рецепторов аденозина
а) Косвенное определение агонизма путем экспрессии генов
Клетки перманентной линии СНО (яичника китайского хомячка) подвергают стабильной трансфекции посредством комплементарной ДНК (кДНК) для рецепторов аденозина подтипов А1, А2а, А2b. Рецепторы аденозина подтипа А1 связаны с аденилатциклазой посредством Gi-белков, а рецеторы аденозина подтипов А2а и А2b посредством Gs-белков. Образование цАМФ в клетках, соответственно, подавляется или стимулируется. Далее посредством зависящего от цАМФ промотора модулируют экспрессию люциферазы. Для повышения чувствительности испытания и воспроизводимости его результатов, уменьшения дисперсии и улучшения пригодности для выполнения на автоматизированной системе условия испытания с люциферазой оптимизируют путем варьирования параметров, в частности сомкнутости клеток, длительности фазы выращивания и инкубации, концентрации форсколина и состава среды. Определение фармакологических характеристик клеток и автоматизированное отсеивающее испытание осуществляют следующим образом.
Исходные культуры выращивают в модифицированной по способу Дульбекко среде Игла (DMEM)/F12 с 10% фетальной телячьей сыворотки (FCS) под диоксидом углерода (5%) при 37°С, и по истечении 2-3 дней расщепляют, соответственно, 1:10. Тестируемые культуры высевают на планшеты с 384 лунками по 1000-3000 клеток в каждую и выращивают в течение 48 часов при 37°С. Затем среду заменяют на физиологический раствор поваренной соли (130 ммоль хлорида натрия, 5 ммоль хлорида калия, 2 ммоль хлорида кальция, 20 ммоль 2-[4-(2-гидроксиэтил)пиперазино]этансульфокислоты (ГЭПЭС), 1 ммоль хлорида магния × 6Н2O, 5 ммоль гидрокарбоната натрия NaHCO3, рН = 7,4). Растворенные в ДМСО вещества трижды разбавляют указанным физиологическим раствором поваренной соли в соотношении 1:10 и пипетируют к тестируемым культурам (максимальная конечная концентрация ДМСО в тестируемом составе 0,5%). Таким образом, получают конечные концентрации веществ, составляющие, например, от 5 мкмоль до 5 нмоль. Через 10 минут к клеткам А1 добавляют форсколин, после чего все культуры инкубируют в течение четырех часов при 37°С. Затем к тестируемым культурам добавляют 35 мкл раствора, содержащего 50% лизирующего реагента (30 ммоль двунатриевой соли фосфорной кислоты, 10% глицерина, 3% продукта TritonX100, 25 ммоль трис-HCl, 2 ммоль дитиотреитола, рН=7,8) и 50% раствора субстрата люцеферазы (2,5 ммоль аденозинтрифосфата (АТФ), 0,5 ммоль люцеферина, 0,1 ммоль кофермента А, 10 ммоль трицина, 1,35 ммоль сульфата магния, 15 ммоль дитиотреитола, рН=7,8), перемешивают около 1 минуты и измеряют активность люциферазы с помощью системы фотоаппаратов. Сравнительным соединением в данных экспериментах служит 5-N-этилкарбоксиамидоаденозин, являющийся аналогом аденозина и обладающий высокой степенью сродства при присоединении ко всем подтипам рецепторов аденозина, а также агонистическим воздействием (Klotz, K.N., Hessling, J., Hegler, J., Owman, C., Kull, В., Fredholm, B.B., Lohse, M.J., Comparative pharmacology of human adenosine receptor subtypes – characterization of stably transfected receptors in CHO cells, Naunyn Schmiedebergs Arch Pharmacol, 357 (1998), 1-9).
В таблице 1 приведены показатели стимуляции подтипов рецепторов аденозина используемыми в варьируемых концентрациях соединениями из примеров 1 и 6.
| Таблица 1 |
| Стимуляция рецепторов аденозина используемыми в варьируемых концентрациях соединениями из примеров 1 и 6 |
| Подтип рецепторов |
Пример 1 |
Пример 6 |
| 10 нмоль |
1 нмоль |
0,3 нмоль |
10 нмоль |
1 нмоль |
0,3 нмоль |
| А1 |
4% |
11% |
56% |
7% |
25% |
45% |
| А2а |
-2% |
2% |
-1% |
2% |
4% |
0% |
| А2b |
8% |
6% |
2% |
29% |
3% |
0 |
Данные указаны в процентах от показателя стимуляции соответствующим сравнительным соединением. Результаты измерений для рецепторов подтипов А2а и А2b указаны в процентах от максимального значения показателя стимуляции 5-N-этилкарбоксиамидоаденозином; результаты измерений для рецептора подтипа А1 в процентах определены после прямой предварительной стимуляции аденилатциклазы 1 мкмолем форсколина (соответствует показателю 100%). Агонисты А1, соответственно, обнаруживают уменьшение активности люциферазы (результат измерения составляет менее 100%).
b) Прямое определение агонизма аденозина по содержанию цАМФ
Клетки перманентной линии СНО подвергают стабильной трансфекции посредством кДНК для рецепторов аденозина подтипов А1, А2а, А2b. Присоединение веществ к рецепторам подтипов А2а и А2b определяют, измеряя внутриклеточное содержание цАМФ путем обычного радиоиммунологического испытания (cAMP-RIA, IBL GmbH, Hamburg, Deutschland).
Если вещества воздействуют как агонисты, их присоединение проявляется в виде повышения содержания внутриклеточной цАМФ. В качестве сравнительного соединения в соответствующих экспериментах используют 5-N-этилкарбоксиамидоаденозин: аналог аденозина, который не обладает селективностью, но характеризуется высокой степенью сродства при присоединении ко всем подтипам рецепторов аденозина, а также агонистиче-ским воздействием (Klotz, K.N., Hessling, J., Hegler, J., Owman, C., Kull, В., Fredholm, B.B., Lohse, M.J., Comparative pharmacology of human adenosine receptor subtypes – characterization of stably transfected receptors in CHO cells, Naunyn Schmiedebergs Arch Pharmacol, 357 (1998), 1-9).
Рецепторы аденозина А1 и A3 связаны с Gi-белком, то есть стимуляция рецепторов этих подтипов приводит к подавлению аденилатциклазы и, следовательно, к снижению внутриклеточного содержания цАМФ. Для идентификации агонистов рецепторов А1/А3 аденилатциклазу стимулируют форсколином. Однако дополнительная стимуляция рецепторов А1/А3 угнетает аденилатциклазу, поэтому агонисты рецепторов А1/А3 могут быть обнаружены по сравнительно небольшому содержанию цАМФ в клетках.
Для обнаружения антагонистического воздействия на рецепторы аденозина трансфицированные соответствующим рецептором рекомбинантные клетки подвергают предварительной стимуляции 5-N-этилкарбоксиамидоаденозином и исследуют воздействие веществ на уменьшение внутриклеточного содержания цАМФ, обусловленное этой предварительной стимуляцией. В качестве сравнительного соединения в соответствующих экспериментах используют вещество ХАС (представитель ксантинаминов), которое обладает высоким сродством при присоединении к рецепторам аденозина всех подтипов и анатагонистическим воздействием (Müller, C.E., Stein, В., Adenosine receptor antagonists: Structures and potential therapeutic applications, Current Pharmaceutical Design, 2 (1996), 501-530).
III. Фармакокинетические исследования
Фармакокинетические характеристики определяли на мышах, крысах и собаках после внутривенного, а также после перорального применения растворов различных веществ. С этой целью по истечении 24 часов после применения брали на исследование кровь. Из образцов крови выделяли плазму и, используя методы биоанализа (высокоэффективную жидкостную хроматографию и ее сочетание с масс-спектрометрией), определяли концентрацию не претерпевшего изменений вещества. Затем на основании зависимостей концентрации в плазме от времени рассчитывали фармакокинетические параметры. В таблице 2 приведены показатели биоготовности различных соединений.
| Таблица 2 |
| Биоготовность после орального приема |
| |
Мышь |
Крыса |
Собака |
| Пример 22 из международной заявки WO 00/125210 |
Не определима* (пероральный прием, 3 мг/кг) |
Не определима* (пероральный прием, 10 мг/кг) |
1,47% (пероральный прием, 1 мг/кг) |
| Соединение из примера 1 |
31,5% (пероральный прием, 1 мг/кг) |
5,0% (пероральный прием, 3 мг/кг) |
32,6% (пероральный прием, 3 мг/кг) |
| Соединение из примера 6 |
41,3% (пероральный прием, 3 мг/кг) |
42,3% (пероральный прием, 3 мг/кг) |
28,5% (пероральный прием, 1 мг/кг) |
| * Уровень плазмы в любой момент времени измерения находится ниже границы определения (менее 1 мкг/л) |
В. Примеры осуществления изобретения
Принятые сокращения:
| ДБУ |
1,8-Диазабицикло[5.4.0]ундец-7-ен |
| ДМФ |
Диметилформамид |
| ESI |
Ионизация потока (масс-спектроскопия) |
| ГЭПЭС |
2-[4-(2-Гидроксиэтил)пиперазино]этансульфокислота |
| HPLC |
Высокоэффективная жидкостная хроматография (при высоком давлении) |
| Кр. |
Температура кипения |
| MS |
Масс-спектроскопия |
| ЯМР |
Ядерный магнитный резонанс |
| ч.д.а. |
Чистый для анализа |
| RT |
Комнатная температура |
| i.V. |
Под вакуумом |
| d.Th. |
Выход от теоретического |
| Tris |
2-Амино-2-(гидроксиметил)-1,3-пропандиол |
Примеры получения
Пример 1
2-Амино-4-[4-(2-метоксиэтокси)фенил]-6-[(3-пиридинилметил)сульфанил]-3,5-пиридиндикарбонитрил
1-я стадия:
4-(2-метоксиэтокси)бензальдегид
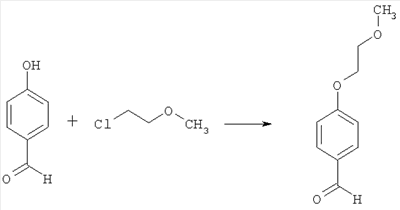
146,5 г (1,2 моль) 4-гидроксибензальдегида растворяют в ДМФ и смешивают с 20 г (0,12 моль) йодида калия, 134,6 г (1,2 моль) трет-бутилата калия и 170,2 г (1,8 моль) (2-хлорэтил)метилового эфира. Реакционную смесь перемешивают в течение 16 часов при 80°С. Для последующей переработки реакционную смесь концентрируют под вакуумом. Остаток помещают в 1 л этилацетата и экстрагируют, используя 0,5 л 1 н. раствора едкого натра. Этилацетатную фазу сушат над сульфатом магния и упаривают под вакуумом. Остаток после упаривания перегоняют под вакуумом (температура кипения 100°С при 0,45 мбар). Получают 184,2 г продукта (выход 85% от теоретического).
Масс-спектроскопия (ESIpos): m/z =181 (М+Н)+.
1H-ЯМР (300 МГц, CDCl3):  =3.5 (s, 3Н); 3,8 (tr, 2Н); 4,2 (tr, 2H); 7,0 (d, 2H); 7,8 (d, 1H); 9,9 (s, 1H). =3.5 (s, 3Н); 3,8 (tr, 2Н); 4,2 (tr, 2H); 7,0 (d, 2H); 7,8 (d, 1H); 9,9 (s, 1H).
2-я стадия:
2-амино-4-[4-(2-метоксиэтокси)фенил]-6-сульфанил-3,5-пиридиндикарбонитрил
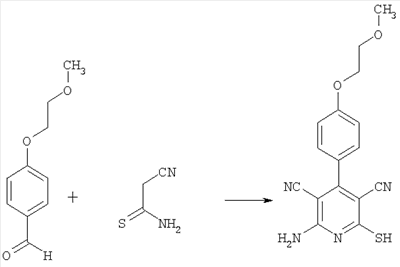
18 г (100 ммоль) 4-(2-метоксиэтокси)бензальдегида, 10 г (200 ммоль) циантиоацетамида и 20,2 г (200 ммоль) N-метилморфолина в 100 мл этанола нагревают в течение 3 часов с обратным холодильником. Выпавший после охлаждения кристаллический осадок отсасывают, промывают небольшим количеством этанола и сушат под вакуумом. Получают 12 г продукта (выход 31% от теоретического), содержащего 0,5 мольных эквивалента N-метилморфолина.
Масс-спектроскопия (ESIpos): m/z=327 (М+Н)+.
1H-ЯМР (300 МГц, ДМСО-d6):  =2,8 (tr, 4H, сигнал N-метилморфолина); 3,3 (s, 3Н); 3,7 (m, 2H, + 4H, сигнал N-метилморфолина); 4,2 (tr, 2H); 7,1 (d, 2H); 7,4 (d, 2H); 7,6 (s, широкий сигнал, 2Н). =2,8 (tr, 4H, сигнал N-метилморфолина); 3,3 (s, 3Н); 3,7 (m, 2H, + 4H, сигнал N-метилморфолина); 4,2 (tr, 2H); 7,1 (d, 2H); 7,4 (d, 2H); 7,6 (s, широкий сигнал, 2Н).
3-я стадия:
2-амино-4-[4-(2-метоксиэтокси)фенил]-6-[(3-пиридинилметил)сульфанил]-3,5-пиридиндикарбонитрил
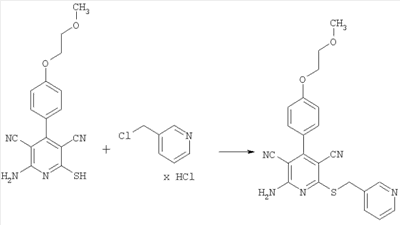
4,28 г (11,36 ммоль; эдукт содержит 0,5 мольных эквивалента N-метилморфолина, поэтому его чистота составляет 86,6%) 2-амино-4-[4-(2-метоксиэтокси)фенил]-6-сульфанил-3,5-пиридинкарбонилнитрила растворяют в 40 мл ДМФ (ч.д.а.). Затем добавляют 3,34 г (39,75 ммоль) гидрокарбоната натрия и 2,48 г (15,1 ммоль) гидрохлорида 3-пиколилхлорида. Суспензию перемешивают в течение ночи при комнатной температуре, смешивают с 40 мл этанола и нагревают примерно до 40°С. Затем по каплям добавляют 19 мл воды. Осадок отсасывают и сушат под вакуумом. Получают 3,70 г продукта (выход 78% от теоретического).
Масс-спектроскопия (ESIpos): m/z=418 (М+Н)+.
1H-ЯМР (300 МГц, ДМСО-d6):  =3,3 (s, 3Н); 3,7 (tr, 2H); 4,2 (tr, 2H); 4,5 (s, 2H); 7,1 (d, 2H); 7,35 (dd, 1Н); 7,45 (d, 2H); 7,9 (d tr, 1H); 8,1 (s, широкий сигнал, 2H); 8,45 (dd, 1H); 8,75 (d, 1H). =3,3 (s, 3Н); 3,7 (tr, 2H); 4,2 (tr, 2H); 4,5 (s, 2H); 7,1 (d, 2H); 7,35 (dd, 1Н); 7,45 (d, 2H); 7,9 (d tr, 1H); 8,1 (s, широкий сигнал, 2H); 8,45 (dd, 1H); 8,75 (d, 1H).
Пример 2
2-Амино-6-[(2-хлор-1,3-тиазол-4-ил)метилсульфанил]-[4-(2-метоксиэтокси)фенил]-3,5-пиридиндикарбонитрил
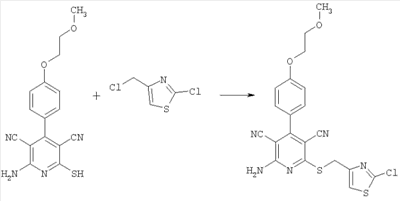
100 мг (0,31 ммоль) 2-амино-4-[4-(2-метоксиэтокси)фенил]-6-сульфанил-3,5-пиридиндикарбонитрила растворяют в 1 мл ДМФ. Затем добавляют 103 мг (1,23 ммоль) гидрокарбоната натрия и 77,2 мг (0,46 ммоль) 4-хлорметил-2-хлор-1,3-тиазола. Суспензию в течение ночи при комнатной температуре перемешивают встряхиванием и добавляют воду. Осадок отсасывают, промывают этанолом и диэтиловым эфиром и сушат при 40°С под вакуумом. Получают 123 мг продукта (выход 88% от теоретического). Масс-спектроскопия (ESIpos): m/z=458 (M+H)+.
1H-ЯМР (300 МГц, ДМСО-d6):  =3,3 (s, 3Н); 3,7 (tr, 2Н); 4,2 (tr, 2H); 4,5 (s, 2Н); 7,1 (d, 2H); 7,45 (d, 2H); 7,8 (s, 1H); 8,05 (s, широкий сигнал, 2H). =3,3 (s, 3Н); 3,7 (tr, 2Н); 4,2 (tr, 2H); 4,5 (s, 2Н); 7,1 (d, 2H); 7,45 (d, 2H); 7,8 (s, 1H); 8,05 (s, широкий сигнал, 2H).
Пример 3
2-Амино-4-[4-(2-метоксиэтокси)фенил]-6-[(2-фенил-1,3-тиазол-4-ил)метилсульфанил]-3,5-пиридиндикарбонитрил
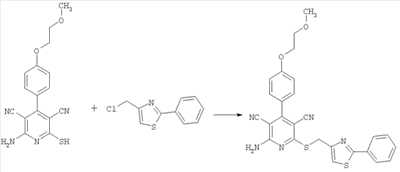
100 мг (0,31 ммоль) 2-амино-4-[4-(2-метоксиэтокси)фенил]-6-сульфанил-3,5-пиридиндикарбонитрила растворяют в 1 мл ДМФ. Затем добавляют 103 мг (1,23 ммоль) гидрокарбоната натрия и 96,4 мг (0,46 ммоль) 4-хлорметил-2-фенил-1,3-тиазола. Суспензию в течение ночи при комнатной температуре перемешивают встряхиванием и добавляют воду. Осадок отсасывают, промывают этанолом и диэтиловым эфиром и сушат при 40°С под вакуумом. Получают 149 мг продукта (выход 97% от теоретического). Масс-спектроскопия (ESIpos): m/z=500 (М+Н)+.
1H-ЯМР (300 МГц, ДМСО-d6):  = 3,3 (s, 3Н); 3,7 (tr, 2Н); 4,2 (tr, 2H); 4,5 (s, 2Н); 7,1 (d, 2H); 7,5 (m, 5H); 7,8 (s, 1H); 7,9 (m, 2H); 8,05 (s, широкий сигнал, 2H). = 3,3 (s, 3Н); 3,7 (tr, 2Н); 4,2 (tr, 2H); 4,5 (s, 2Н); 7,1 (d, 2H); 7,5 (m, 5H); 7,8 (s, 1H); 7,9 (m, 2H); 8,05 (s, широкий сигнал, 2H).
Пример 4
2-Амино-4-[4-(2-метоксиэтокси)фенил]-6-[(2-(тиофен-2-ил)-1,3-тиазол-4-ил)метилсульфанил]-3,5-пиридиндикарбонитрил
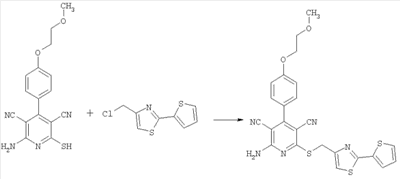
100 мг (0,31 ммоль) 2-амино-4-[4-(2-метоксиэтокси)фенил]-6-сульфанил-3,5-пиридиндикарбонитрила растворяют в 1 мл ДМФ. Затем добавляют 103 мг (1,23 ммоль) гидрокарбоната натрия и 96,4 мг (0,46 ммоль) 4-хлорметил-2-(тиофен-2-ил)-1,3-тиазола. Суспензию в течение ночи при комнатной температуре перемешивают встряхиванием и добавляют воду. Осадок отсасывают, промывают этанолом и диэтиловым эфиром и сушат при 40°С под вакуумом. Получают 146 мг продукта (выход 84% от теоретического).
Масс-спектроскопия (ESIpos): m/z=506 (M+H)+.
1H-ЯМР (300 МГц, ДМСО-d6):  =3,3 (s, 3Н); 3,7 (tr, 2H); 4,2 (tr, 2H); 4,6 (s, 2H); 7,15 (m, 3Н); 7,5 (d, 2H); 7,65 (d, 1H); 7,75 (d, 1H); 7,8 (s, 1H); 8,1 (s, широкий сигнал, 2H). =3,3 (s, 3Н); 3,7 (tr, 2H); 4,2 (tr, 2H); 4,6 (s, 2H); 7,15 (m, 3Н); 7,5 (d, 2H); 7,65 (d, 1H); 7,75 (d, 1H); 7,8 (s, 1H); 8,1 (s, широкий сигнал, 2H).
Пример 5
2-Амино-4-[4-(2-метоксиэтокси)фенил]-6-[(2-(тиофен-3-ил)-1,3-тиазол-4-ил)метилсульфанил]-3,5-пиридиндикарбонитрил
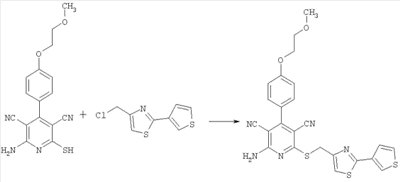
100 мг (0,31 ммоль) 2-амино-4-[4-(2-метоксиэтокси)фенил]-6-сульфанил-3,5-пиридиндикарбонитрила растворяют в 1 мл ДМФ. Затем добавляют 103 мг (1,23 ммоль) гидрокарбоната натрия и 96,4 мг (0,46 ммоль) 4-хлорметил-2-(тиофен-3-ил)-1,3-тиазола. Суспензию в течение ночи при комнатной температуре перемешивают встряхиванием и добавляют воду. Осадок отсасывают, промывают этанолом и диэтиловым эфиром и сушат при 40°С под вакуумом. Получают 141 мг продукта (выход 82% от теоретического).
Масс-спектроскопия (ESIpos): m/z=506 (М+Н)+.
1H-ЯМР (300 МГц, ДМСО-d6):  =3,3 (s, 3Н); 3,7 (tr, 2Н); 4,2 (tr, 2H); 4,6 (s, 2Н); 7,15 (d, 2H); 7,5 (d, 2H); 7,55 (d, 1H); 7,7 (dd, 1H); 7,8 (s, 1H); 8,1 (s, широкий сигнал, 2H); 8,15 (d, 1H). =3,3 (s, 3Н); 3,7 (tr, 2Н); 4,2 (tr, 2H); 4,6 (s, 2Н); 7,15 (d, 2H); 7,5 (d, 2H); 7,55 (d, 1H); 7,7 (dd, 1H); 7,8 (s, 1H); 8,1 (s, широкий сигнал, 2H); 8,15 (d, 1H).
Пример 6
2-Амино-6-({[2-(4-хлорфенил)-1,3-тиазол-4-ил]метил}сульфанил)-4-[4-(2-гидроксиэтокси)фенил]-3,5-пиридиндикарбонитрил
Методика 1
1-я стадия:
2-амино-4-[4-(2-гидроксиэтокси)фенил]-6-сульфанил-3,5-пиридиндикарбонитрил
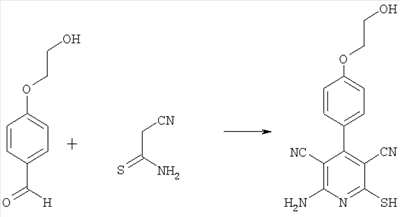
12,46 г (75 ммоль) 4-(2-гидроксиэтокси)бензальдегида, 15,02 г (150 ммоль) циантиоацетамида и 15,15 г (150 ммоль) N-метилморфолина вводят в 75 мл этанола и в течение трех часов нагревают с обратным холодильником. После охлаждения реакционный раствор упаривают под вакуумом. Остаток растворяют в 1 н. растворе едкого натра и дважды промывают этилацетатом. Щелочную фазу подкисляют 1 н. соляной кислотой, выпавший кристаллический осадок отсасывают и сушат при 45°С под вакуумом. Получают 12,05 г продукта (выход 51% от теоретического).
Масс-спектроскопия (ESIpos): m/z=313 (М+Н)+, 330 (M+NH4)+.
1H-ЯМР (300 МГц, ДМСО-d6):  =3,7 (t, 2Н); 4,1 (t, 2H); 7,1 (d, 2H); 7,4 (d, 2H); 8,0 (широкий сигнал s, 2H). =3,7 (t, 2Н); 4,1 (t, 2H); 7,1 (d, 2H); 7,4 (d, 2H); 8,0 (широкий сигнал s, 2H).
2-я стадия:
2-амино-6-({[2-(4-хлорфенил)-1,3-тиазол-4-ил]метил}сульфанил)-4-[4-(2-гидроксиэтокси)фенил]-3,5-пиридинкарбонитрил
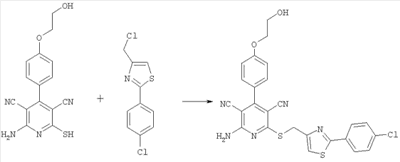
6,91 г (22,12 ммоль) 2-амино-4-[4-(2-гидроксиэтокси)фенил]-6-сульфанил-3,5-пиридинкарбонитрила растворяют в 150 мл ДМФ. Затем добавляют 7,44 г (66,35 ммоль) 1,8-диазабицикло[5.4.0]ундец-7-ена и 10,8 г (44,24 ммоль) 4-хлорметил-2-(4-хлорфенил)-1,3-тиазола. Суспензию в течение ночи перемешивают при комнатной температуре, добавляют 50 г силикагеля и упаривают под вакуумом. Поглощенную силикагелем смесь веществ подвергают хроматографической очистке на силикагеле (элюирование толуолом/смесью толуола и этилацетата с соотношением 1:1). Получают 5,5 г продукта (выход 47% от теоретического).
Масс-спектроскопия (ESIpos): m/z=521 (M+H)+.
1H-ЯМР (300 МГц, ДМСО-d6):  =3,7 (dt, 2H); 4,1 (t, 2H); 4,6 (s, 2H); 4,9 (t, 1Н); 7,1 (d, 2H); 7,4 (d, 2H); 7,5 (d, 2H); 7,9 (m, ЗН); 8,1 (широкий сигнал s, 2H). =3,7 (dt, 2H); 4,1 (t, 2H); 4,6 (s, 2H); 4,9 (t, 1Н); 7,1 (d, 2H); 7,4 (d, 2H); 7,5 (d, 2H); 7,9 (m, ЗН); 8,1 (широкий сигнал s, 2H).
Методика 2
Возможен альтернативный способ синтеза без выделения 2-амино-4-[4-(2-гидроксиэтокси)фенил]-6-сульфанил-3,5-пиридиндикарбонитрила, предусматривающий взаимодействие 2-[4-(2-гидроксиэтокси)бензилиден]малононитрила с 2-циантиоацетамидом и 4-хлорметил-2-(4-хлорфенил)-1,3-тиазолом.
1-я стадия:
2-[4-(2-гидроксиэтокси)бензилиден]малононитрил
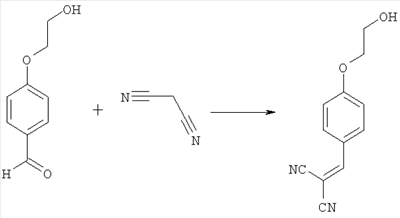
1000 г (5,85 моль) 4-(2-гидроксиэтокси)бензальдегида и 425 г (6,43 моль) малондинитрила растворяют в 5000 мл изопропилового спирта и смешивают с 5 г (0,059 моль) пиперидина. Смесь в течение 16 часов нагревают при 80°С, после чего для последующего выделения продукта охлаждают до 3°С. Продукт выделяют фильтрованием и промывают, используя 400 мл охлажденного льдом изопропилового спирта. В заключение продукт в течение 45 часов сушат под вакуумом при 50°С.
Выход желтоватого кристаллического продукта составляет 1206 г (94,6% от теоретического).
1H-ЯМР (400 МГц, CDCl3): 3,95-4,32 (m, 4 Н); 6,95-7,15 (m, 2H); 7,61 (s, 1Н); 7,85-7,95 (m, 1Н).
2-я стадия:
4-хлорметил-2-(4-хлорфенил)-1,3-тиазол
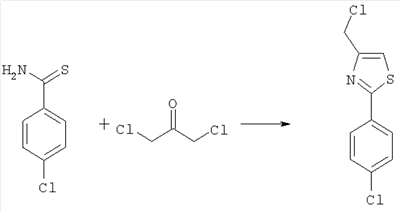
171,65 г (1,0 моль) 4-хлортиобензамида растворяют в 550 мл изопропилового спирта и в течение трех часов при температуре не выше 30°С совмещают с 133,3 г (1,05 моль) 1,3-дихлорацетона. Смесь в течение 5,5 часов перемешивают при 40°С, после чего перемешивают еще 10 часов при 20°С. Для полного завершения реакции смесь дополнительно нагревают при 55°С в течение 7,5 часов. Для последующего выделения продукта реакционную смесь охлаждают до 10°С и смешивают с 950 мл воды. Используя раствор едкого натра, устанавливают рН в интервале 4-5 и отсасывают продукт.
Выход белого или желтоватого кристаллического продукта составляет 220,9 г (91% от теоретического).
1H-ЯМР (400 МГц, CDCl3): 4,90 (s, 2H, CH2); 7,5-7,55 (m, 2H); 7,85 (s, 1H, тиазол); 7,9-7,95 (m, 2H).
3-я стадия:
2-амино-6-({[2-(4-хлорфенил)-1,3-тиазол-4-ил]метил}сульфанил)-4-[4-(2-гидроксиэтокси)фенил]-3,5-пиридиндикарбонитрил
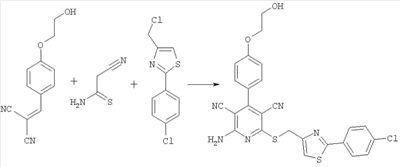
428,4 г (2,0 моль) 2-[4-(2-гидроксиэтокси)бензилиден]малононитрила, 108,4 г (1,05 моль) 2-циантиоацетамида и 244,1 г (1,0 моль) 4-хлорметил-2-(4-хлорфенил)-1,3-тиазола суспендируют в 3,4 литрах метанола и в течение 60 минут совмещают с 556,1 г (3,0 моль) трибутиламина. Смесь перемешивают в течение 20 часов при комнатной температуре и выделяют продукт фильтрованием. После сушки под вакуумом сырой продукт (360,8 г, выход 70% от теоретического) суспендируют в 3 литрах дихлорметана и в течение двух часов перемешивают при 35°С. Продукт выделяют фильтрованием и сушат под высоким вакуумом. Полученные белые кристаллы могут быть подвергнуты дополнительной очистке путем перекристаллизации из смеси тетрагидрофурана с водой (1:1).
Выход белого кристаллического продукта составляет 353,5 г (68% от теоретического).
Масс-спектроскопия (El): m/z = 520.00.
Пример 7
2-Амино-4-[4-(2-метоксиэтокси)фенил]-6-[(2-пиридинилметил)сульфанил]-3,5-пиридиндикарбонитрил
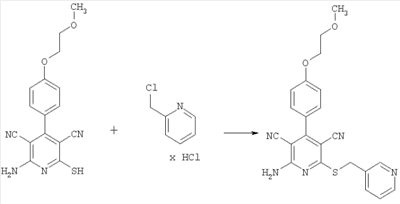
100 мг (0,31 ммоль) 2-амино-4-[4-(2-метоксиэтокси)фенил]-6-сульфанил-3,5-пиридиндикарбонитрила растворяют в 1 мл ДМФ. Затем добавляют 103 мг (1,23 ммоль) гидрокарбоната натрия и 75,4 мг (0,46 ммоль) гидрохлорида 2-пиколилхлорида. Суспензию в течение ночи перемешивают встряхиванием при комнатной температуре и смешивают с водой. Осадок отсасывают, промывают этанолом и диэтиловым эфиром и сушат под вакуумом при 40°С. Получают 104 мг продукта (выход 81% от теоретического).
Масс-спектроскопия (ESIpos): m/z=418 (М+Н)+.
1H-ЯМР (300 МГц, ДМСО-d6):  =3,3 (s, 3Н); 3,7 (tr, 2H); 4,2 (tr, 2H); 4,6 (s, 2H); 7,1 (d, 2H); 7,4 (dd, 1Н); 7,45 (d, 2H); 7,65 (d, 1H); 7,75 (tr, 1H); 8,0 (s, широкий сигнал, 2H); 8,5 (d, 1H). =3,3 (s, 3Н); 3,7 (tr, 2H); 4,2 (tr, 2H); 4,6 (s, 2H); 7,1 (d, 2H); 7,4 (dd, 1Н); 7,45 (d, 2H); 7,65 (d, 1H); 7,75 (tr, 1H); 8,0 (s, широкий сигнал, 2H); 8,5 (d, 1H).
Пример 8
2-Амино-4-[4-(2-метоксиэтокси)фенил]-6-[(2-метил-1,3-тиазол-4-ил)метилсульфанил]-3,5-пиридиндикарбонитрил
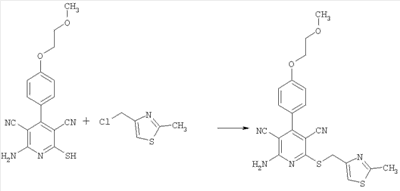
100 мг (0,31 ммоль) 2-амино-4-[4-(2-метоксиэтокси)фенил]-6-сульфанил-3,5-пиридиндикарбонитрила растворяют в 1 мл ДМФ. Затем добавляют 103 мг (1,23 ммоль) гидрокарбоната натрия и 90,5 мг (0,61 ммоль) 4-хлорметил-2-метил-1,3-тиазола. Суспензию в течение ночи перемешивают встряхиванием при комнатной температуре и смешивают с водой. Осадок отсасывают и сушат под вакуумом при 40°С. Получают 88,8 мг продукта (выход 66,2% от теоретического).
Масс-спектроскопия (ESIpos): m/z=438 (М+Н)+.
Пример 9
2-Амино-4-[4-(2-метоксиэтокси)фенил]-6-[(2-амино-1,3-тиазол-4-ил)метилсульфанил]-3,5-пиридиндикарбонитрил
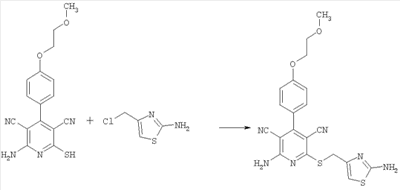
100 мг (0,31 ммоль) 2-амино-4-[4-(2-метоксиэтокси)фенил]-6-сульфанил-3,5-пиридиндикарбонитрила растворяют в 1 мл ДМФ. Затем добавляют 103 мг (1,23 ммоль) гидрокарбоната натрия и 68,3 мг (0,46 ммоль) 4-хлорметил-2-амино-1,3-тиазола. Суспензию в течение ночи перемешивают встряхиванием при комнатной температуре и смешивают с водой. Осадок отсасывают, промывают этанолом и диэтиловым эфиром и сушат под вакуумом при 40°С. Получают 115,9 мг продукта (выход 86,2% от теоретического).
Масс-спектроскопия (ESIpos): m/z=439 (М+Н)+.
Пример 10
2-Амино-4-[4-(2-метоксиэтокси)фенил]-6-[(2-(2-пиридил)-1,3-тиазол-4-ил)-метилсульфанил]-3,5-пиридиндикарбонитрил
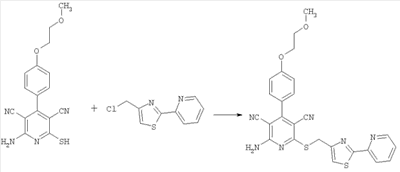
50 мг (0,15 ммоль) 2-амино-4-[4-(2-метоксиэтокси)фенил]-6-сульфанил-3,5-пиридиндикарбонитрила растворяют в 1 мл ДМФ. Затем добавляют 51,5 мг (0,61 ммоль) гидрокарбоната натрия и 58,6 мг (0,23 ммоль) 4-хлорметил-2-(2-пиридил)-1,3-тиазола. Суспензию в течение ночи перемешивают встряхиванием при комнатной температуре и смешивают с водой. Осадок отсасывают, промывают этанолом и диэтиловым эфиром и сушат под вакуумом при 40°С. Получают 67,4 мг продукта (выход 87,9% от теоретического).
Масс-спектроскопия (ESIpos): m/z=501 (M+H)+.
Пример 11
2-Амино-4-[4-(2-гидроксиэтокси)фенил]-6-{[(2-метил-1,3-тиазол-4-ил)метил]сульфанил}-3,5-пиридиндикарбонитрил
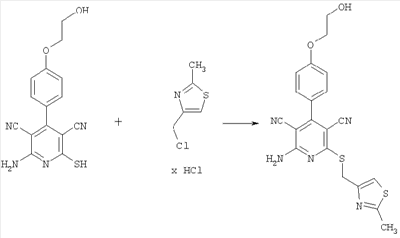
31,2 мг (0,1 ммоль) 2-амино-4-[4-(2-гидроксиэтокси)фенил]-6-сульфанил-3,5-пиридиндикарбонитрила растворяют в 0,3 мл ДМф. Затем добавляют 33,6 мг (0,4 ммоль) гидрокарбоната натрия и 27,6 мг (0,15 ммоль) гидрохлорида 4-метил-2-хлор-1,3-тиазола. Суспензию в течение ночи перемешивают встряхиванием при комнатной температуре, фильтруют и подвергают очистке методом препаративной HPLC-хроматографии [колонка: Macherey-Nagel VP 50/21 Nucleosil 100-5 С18 Nautilus, 20×50 мм; скорость элюирования 25 мл/мин; градиент элюирования (А = ацетонитрил, В = вода + 0,3% трифторуксусной кислоты): 0 мин – 10% А; 2,0 мин – 10% А; 6,0 мин – 90% А; 7,0 мин – 90% А; 7,1 мин – 10% А; 8,0 мин – 10% А; детектирование: 220 нм]. После упаривания соответствующей фракции получают 20,2 мг продукта (выход 47,7% от теоретического).
Масс-спектроскопия (ESIpos): m/z=424 (М+Н)+.
Пример 12
2-Амино-6-{[(2-амино-1,3-тиазол-4-ил)метил]сульфанил}-4-[4-(2-гидроксиэтокси)фенил]-3,5-пиридиндикарбонитрил
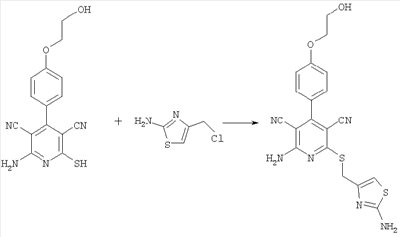
31,2 мг (0,1 ммоль) 2-амино-4-[4-(2-гидроксиэтокси)фенил]-6-сульфанил-3,5-пиридиндикарбонитрила растворяют в 0,3 мл ДМФ. Затем добавляют 33,6 мг (0,4 ммоль) гидрокарбоната натрия и 22,3 мг (0,15 ммоль) 4-амино-2-хлор-1,3-тиазола. Суспензию в течение ночи перемешивают встряхиванием при комнатной температуре, фильтруют и подвергают очистке методом препаративной HPLC-хроматографии [колонка: Macherey-Nagel VP 50/21 Nucleosil 100-5 С18 Nautilus, 20 х 50 мм; скорость элюирования 25 мл/мин; градиент элюирования (А = ацетонитрил, В = вода + 0,3% трифторуксусной кислоты): 0 мин – 10% А; 2,0 мин – 10% А; 6,0 мин – 90% А; 7,0 мин – 90% А; 7,1 мин – 10% А; 8,0 мин – 10% А; детектирование: 220 нм]. После упаривания соответствующей фракции получают 35,7 мг продукта (выход 84,1% от теоретического).
Масс-спектроскопия (ESIpos): m/z=425 (М+Н)+.
Пример 13
2-Амино-4-[4-(2-метоксиэтокси)фенил]-6-({[2-(4-морфолинил)-1,3-тиазол-4-ил]метил}сульфанил)-3,5-пиридиндикарбонитрил
1-я стадия:
4-[4-(хлорметил)-1,3-тиазол-2-ил]морфолин
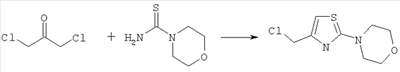
11,51 г (78,76 ммоль) 4-морфолинкарботиоамида и 10,00 г (78,76 ммоль) дихлорацетона в 100 мл этанола нагревают в течение часа с обратным холодильником. Бесцветный осадок, выпавший из окрашенного в розовый цвет раствора, охлаждают, отсасывают и дважды промывают этанолом. Получают 12,96 г продукта (выход 75% от теоретического).
Масс-спектроскопия (ESIpos): m/z=219 (М+Н)+.
2-я стадия:
2-амино-4-[4-(2-метоксиэтокси)фенил]-6-({[2-(4-морфолинил)-1,3-тиазол-4-ил]метил}сульфанил)-3,5-пиридиндикарбонитрил
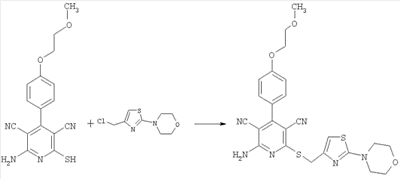
2 г (6,13 ммоль) 2-амино-4-[4-(2-метоксиэтокси)фенил]-6-сульфанил-3,5-пиридиндикарбонитрила и 2,68 г (12,26 ммоль) 4-[4-(хлорметил)-1,3-тиазол-2-ил]морфолина растворяют в 50 мл сухого ДМФ и смешивают с 1,83 мл (12,26 ммоль) ДБУ. После трехчасового перемешивания при комнатной температуре растворитель удаляют на ротационном испарителе и остаток подвергают очистке методом препаративной HPLC-хроматографии (колонка: Kromasil 100 С18, 250×20 мм, 10 мкм; градиент элюирования: смесь ацетонитрила с водой: 3 минуты – 10% ацетонитрила, затем в течение 30 минут – до 80% ацетонитрила; скорость элюирования 25 мл/мин). Получают 1,70 г продукта (выход 55% от теоретического).
Масс-спектроскопия (ESIpos): m/z=509 (М+Н)+.
1H-ЯМР (300 МГц, ДМСО-d6):  =3,3 (m, 7H); 3,7 (m, 6Н); 4,2 (tr, 2H); 4,4 (s, 2Н); 6,95 (s, 1Н); 7,15 (d, 2H); 7,45 (d, 2H); 8,0 (s, широкий сигнал, 2H). =3,3 (m, 7H); 3,7 (m, 6Н); 4,2 (tr, 2H); 4,4 (s, 2Н); 6,95 (s, 1Н); 7,15 (d, 2H); 7,45 (d, 2H); 8,0 (s, широкий сигнал, 2H).
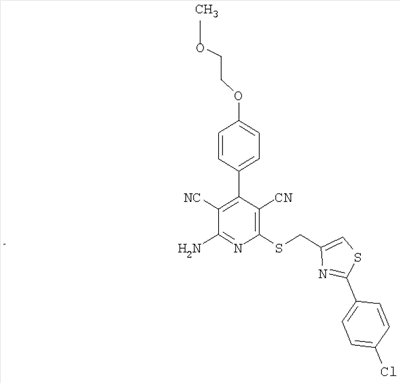
Соединения согласно представленным в таблице 3 примерам синтезировали аналогично примеру 13. Используемые для синтеза хлорметилтиазолы можно приобрести в торговле или получить способом, описанным в примере 13 (стадия 1).
| Таблица 3 |
| Номер примера |
Структура |
Расчетная молекулярная масса |
Найденное значение [М+Н]+ |
| 14 |
 |
467 |
468 |
| 15 |
 |
492 |
493 |
| Номер примера |
Структура |
Расчетная молекулярная масса |
Найденное значение [M+H]+ |
| 16 |
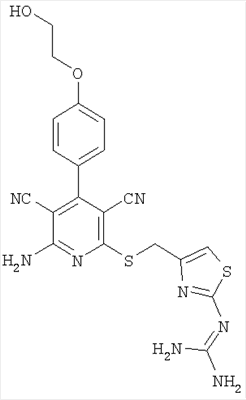 |
467 |
468 |
| 17 |
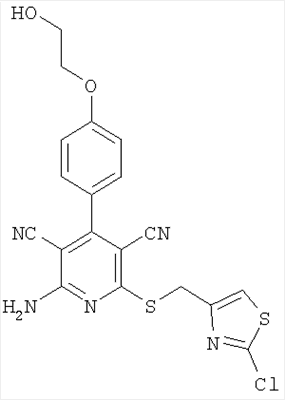 |
444 |
445 |
| Номер примера |
Структура |
Расчетная молекулярная масса |
Найденное значение [М+H]+ |
| 18 |
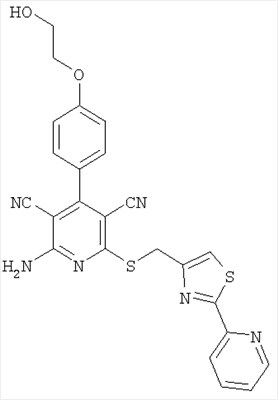 |
487 |
488 |
| 19 |
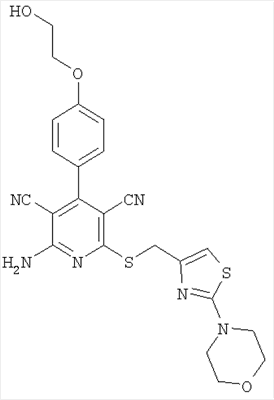 |
495 |
496 |
| Номер примера |
Структура |
Расчетная молекулярная масса |
Найденное значение [М+Н]+ |
| 20 |
 |
534 |
535 |
| 21 |
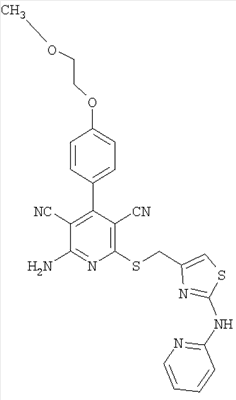 |
516 |
517 |
| Номер примера |
Структура |
Расчетная молекулярная масса |
Найденное значение [М+Н]+ |
| 22 |
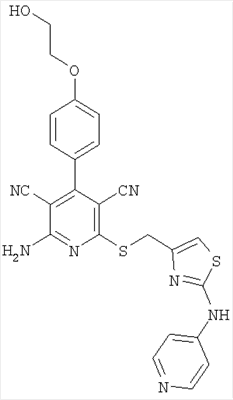 |
502 |
503 |
| 23 |
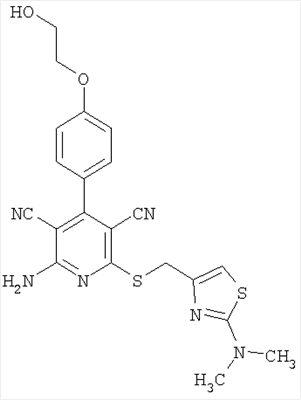 |
453 |
454 |
| Номер примера |
Структура |
Расчетная молекулярная масса |
Найденное значение [М+Н]+ |
| 24 |
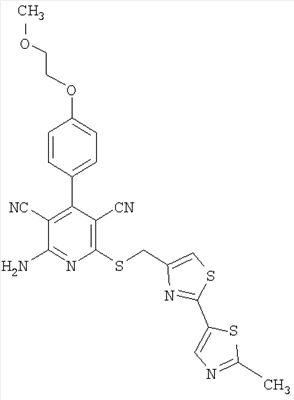 |
521 |
522 |
| 25 |
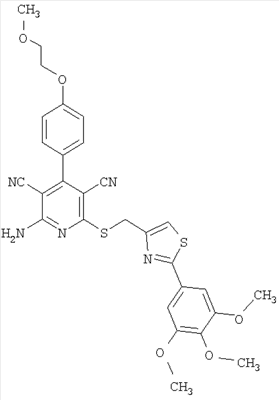 |
590 |
591 |
| Номер примера |
Структура |
Расчетная молекулярная масса |
Найденное значение [М+Н]+ |
| 26 |
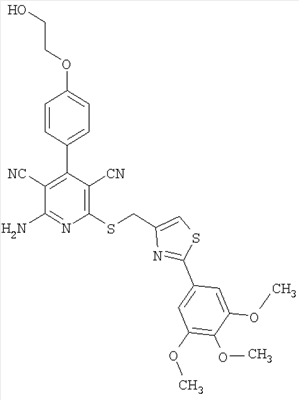 |
576 |
577 |
| 27 |
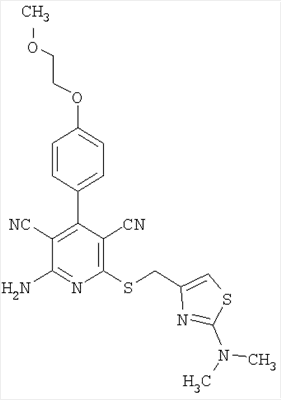 |
467 |
468 |
Формула изобретения
1. Замещенные 2-тио-3,5-дициано-4-фенил-6-аминопиридины формулы (I)
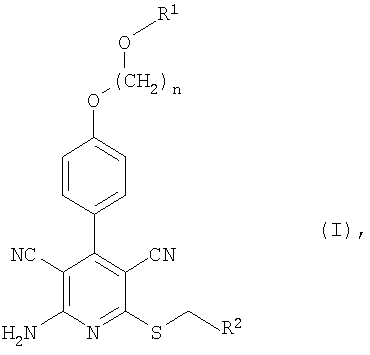
в которой n означает 2, 3 или 4,
R1 означает водород или алкил с 1-4 атомами углерода и
R2 означает пиридил или тиазолил, который может быть замещен алкилом с 1-4 атомами углерода, галогеном, амино, диметиламино, ацетиламино, гуанидино, пиридиламино, тиенилом, пиридилом, морфолинилом, а также тиазолилом, при необходимости замещенным алкилом с 1-4 атомами углерода, или фенилом, при необходимости содержащим до трех заместителей в виде галогена, алкила с 1-4 атомами углерода или алкокси с 1-4 атомами углерода,
и их соли, гидраты, гидраты солей и сольваты.
2. Замещенные 2-тио-3,5-дициано-4-фенил-6-аминопиридины формулы (I) по п.1, в которой n означает 2,
R1 означает водород, метил или этил и
R2 означает пиридил или тиазолил, который может быть замещен метилом, этилом, фтором, хлором, амино, диметиламино, ацетиламино, гуанидино, 2-пиридиламино, 4-пиридиламино, тиенилом, пиридилом, морфолинилом, а также тиазолилом, при необходимости замещенным метилом, или фенилом, при необходимости содержащим до трех заместителей в виде хлора или метокси,
и их соли, гидраты, гидраты солей и сольваты.
3. Замещенные 2-тио-3,5-дициано-4-фенил-6-аминопиридины формулы (I) по п.1, в которой n означает 2,
R1 означает водород или метил и
R2 означает пиридил или тиазолил, который может быть замещен метилом, хлором, амино, диметиламино, ацетиламино, гуанидино, 2-пиридиламино, 4-пиридиламино, тиенилом, пиридилом, морфолинилом, 2-метилтиазол-5-илом, фенилом, 4-хлорфенилом или 3,4,5-триметоксифенилом,
и их соли, гидраты, гидраты солей и сольваты.
4. Замещенный 2-тио-3,5-дициано-4-фенил-6-аминопиридин формулы (I) по п.1, имеющие следующую структуру
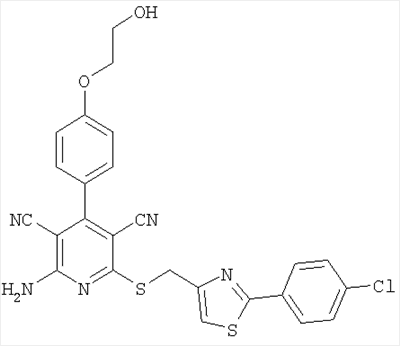
и его соли, гидраты, гидраты солей и сольваты.
5. Замещенные 2-тио-3,5-дициано-4-фенил-6-аминопиридины формулы (I) по п.1, обладающие свойствами агониста рецептора А1 аденозина.
6. Лекарственное средство, обладающие свойствами агониста рецептора А1 аденозина, содержащее, по меньшей мере, один замещенный 2-тио-3,5-дициано-4-фенил-6-аминопиридин формулы (I) по п.1 и, по меньшей мере, одно вспомогательное вещество.
7. Лекарственное средство по п.6, отличающееся тем, что оно дополнительно содержит, по меньшей мере, одно биологически активное вещество, предназначенное для лечения коронарных болезней сердца, выбранное из группы, включающей нитраты, бета-блокаторы, антагонисты кальция и мочегонные средства.
TH4A – Переиздание описания изобретения к патенту Российской Федерации
Причина переиздания: Коррекция в текстах формулы и описания изобретения
Извещение опубликовано: 27.10.2008 БИ: 30/2008
Другие изменения, связанные с зарегистрированными изобретениями
Изменения:
Зарегистрирован переход исключительного права без заключения договора
Дата и номер государственной регистрации перехода исключительного права: РП0000055 от 22.09.2009
Патентообладатель: Байер Шеринг Фарма Акциенгезельшафт (DE)
Прежний патентообладатель: Байер Хельскер АГ (DE)
Номер и год публикации бюллетеня: 10-2008
Извещение опубликовано: 10.11.2009 БИ: 31/2009
|
|