Патент на изобретение №2315752
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
(54) ПЕНТАФТОРСУЛЬФАНИЛБЕНЗОИЛГУАНИДИНЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ, ИХ ПРИМЕНЕНИЕ И ЛЕКАРСТВЕННОЕ СРЕДСТВО
(57) Реферат:
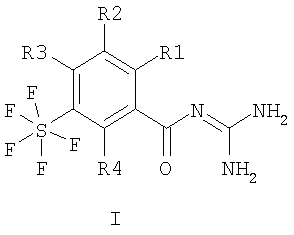
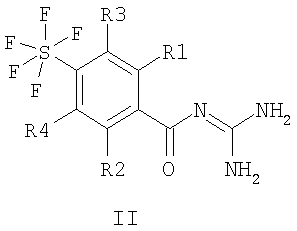
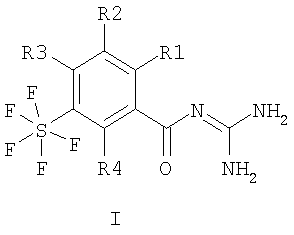
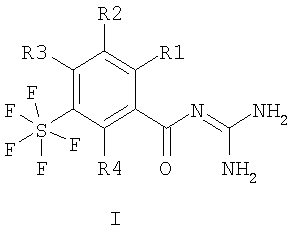
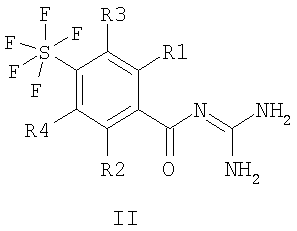
Настоящее изобретение относится к пентафторсульфанилбензоилгуанидинам формулы I или II
где R1 – водород, алкил с 1-4 С-атомами, F, Cl, Br или I; R2 – водород или -O-фенил, который является незамещенным или замещенным F, Cl, Br или I; R3 и R4 каждый означают водород, а также их фармацевтически приемлемым солям. Соединения I и II проявляют свойство ингибировать клеточный натрий-протонный обмен и могут быть использованы в качестве антиаритмических лекарственных средств с кардиопротекторным компонентом для профилактики и лечения инфаркта и стенокардии. Описан способ получения соединений, лекарственное средство на их основе и применение при изготовлении лекарственных средств. 4 н. и 6 з.п. ф-лы.
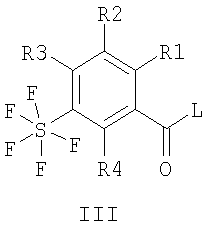
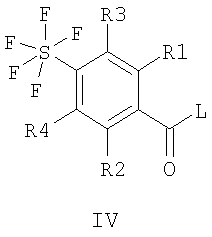
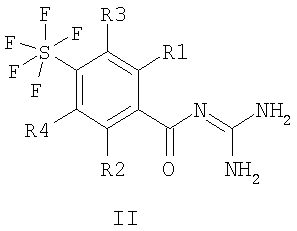
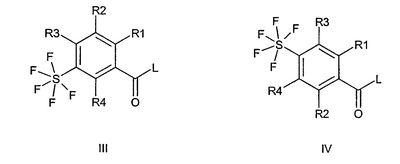
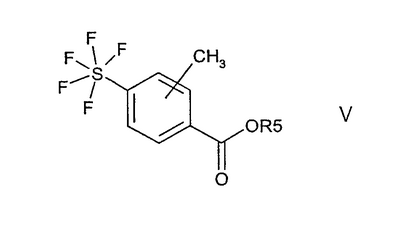
Изобретение относится к пентафторсульфанилбензоилгуанидинам формул I и II
где R1 означает водород, алкил с 1, 2, 3 или 4 С-атомами, алкоксигруппу с 1, 2, 3 или 4 С-атомами, F, Cl, Br, I, CN, NR10R11, -Op-(CH2)n-(CF2)o-CF3 или -(SOm)q-(CH2)r-(CF2)s-CF3; R10 и R11 независимо друг от друга означают водород, алкил с 1, 2, 3 или 4 С-атомами или СН2-CF3; m равно нулю, 1 или 2; n, о, р, q, r и s независимо друг от друга равны нулю или 1; R2 означает водород, F, Cl, Br, I, -CN, -SO2СН3, -(SOh)z-(CH2)k-(CF2)1-CF3, алкил с 1, 2, 3, 4, 5 или 6 С-атомами, циклоалкил с 3, 4, 5, 6, 7 или 8 С-атомами, в котором 1, 2, 3 или 4 атома водорода могут быть заменены на атомы фтора; h равно нулю, 1 или 2; z равно нулю или 1; k равно нулю, 1, 2, 3 или 4; l равно нулю или 1; или R2 означает -(СН2)t-фенил или -О-фенил, который является незамещенным или замещенным 1, 2 или 3 остатками, выбранными из группы, состоящей из F, Cl, Br, I, -Ou-(CH2)v-CF3, алкоксигруппы с 1, 2, 3 или 4 С-атомами, алкила с 1, 2, 3 или 4 С-атомами и -SO2CH3; t равно нулю, 1, 2, 3 или 4; u равно нулю или 1; v равно нулю, 1, 2 или 3; или R2 означает -(СН2)w-гетероарил, который является незамещенным или замещенным 1, 2 или 3 остатками, выбранными из группы, состоящей из F, Cl, Br, I, -Ox-(CH2)y-CF3, алкоксигруппы с 1, 2, 3 или 4 С-атомами и алкила с 1, 2, 3 или 4 С-атомами, -SO2CH3; w равно 1, 2, 3 или 4; x равно нулю или 1; y равно нулю, 1, 2 или 3; R3 и R4 независимо друг от друга означают водород или F; а также их фармацевтически приемлемые соли. Предпочтительны соединения формул I и II, где: R1 означает водород, алкил с 1, 2, 3 или 4 С-атомами, алкоксигруппу с 1, 2, 3 или 4 С-атомами, F, Cl, NR10R11, -O-CH2-CF3 или -SOm-(CH2)r-CF3; R10 и R11 независимо друг от друга означают водород, алкил с 1, 2, 3 или 4 С-атомами или -СН2-CF3; m равно нулю, 1 или 2; r равно нулю или 1; R2 означает водород, F, Cl, -SO2CH3, -(SOh)z-(CH2)k-CF3, алкил с 1, 2, 3 или 4 С-атомами, циклоалкил с 3, 4, 5, 6 или 7 С-атомами, в котором 1, 2, 3 или 4 атома водорода могут быть заменены на атомы фтора; h равно нулю, 1 или 2; z равно нулю или 1; k равно нулю, 1, 2, 3 или 4; или R2 означает фенил или -О-фенил, который является незамещенным или замещенным 1 или 2 остатками, выбранными из группы, состоящей из F, Cl, -Ou-(CH2)v-CF3, метоксигруппы, этоксигруппы, алкила с 1, 2, 3 или 4 С-атомами и -SO2CH3; u равно нулю или 1; v равно нулю, 1, 2 или 3; или R2 означает гетероарил, который является незамещенным или замещенным 1 или 2 остатками, выбранными из группы, состоящей из F, Cl, -Ox-(CH2)y-CF3, метоксигруппы, этоксигруппы, алкила с 1, 2, 3 или 4 С-атомами и -SO2CH3; x равно нулю или 1; y равно нулю, 1, 2 или 3; R3 и R4 независимо друг от друга означают водород или F; а также их фармацевтически приемлемые соли. Особенно предпочтительны соединения формул I и II, где: R1 означает водород, алкил с 1, 2, 3 или 4 С-атомами, метоксигруппу, этоксигруппу, F, Cl, NR10R11, -O-CH2-CF3 или -SOm-(CH2)r-CF3; R10 и R11 независимо друг от друга означают водород, алкил с 1, 2, 3 или 4 С-атомами или -СН2-CF3; m равно нулю, 1 или 2; r равно нулю или 1; R2 означает водород, F, Cl, -SO2CH3, -(SOh)z-(CH2)k-CF3, алкил с 1, 2, 3 или 4 С-атомами, циклоалкил с 3, 4, 5, 6 или 7 С-атомами, в котором 1, 2, 3 или 4 атома водорода могут быть заменены на атомы фтора; h равно нулю или 2; z равно нулю или 1; k равно нулю или 1; или R2 означает фенил или -О-фенил, который является незамещенным или замещенным 1 или 2 остатками, выбранными из группы, состоящей из F, Cl, -O-(CH2)v-CF3, метоксигруппы, этоксигруппы, алкила с 1, 2, 3 или 4 С-атомами и -SO2CH3; v равно нулю, 1, 2 или 3; или R2 означает гетероарил, который является незамещенным или замещенным 1 или 2 остатками, выбранными из группы, состоящей из F, Cl, -O-(CH2)y-CF3, метоксигруппы, этоксигруппы, алкила с 1, 2, 3 или 4 С-атомами и -SO2CH3; y равно нулю, 1, 2 или 3; R3 и R4 означают водород; а также их фармацевтически приемлемые соли. Особенно предпочтительно, если в соединениях формул I и/или II R1 означает водород, алкил с 1, 2, 3 или 4 С-атомами, F или Cl. Особенно предпочтительно также, если в соединениях формул I и/или II R2 означает водород, алкил с 1, 2, 3 или 4 С-атомами, F, Cl или -О-фенил, который не замещен или замещен, как указано выше. Если заместители с R1 по R4 содержат один или более центров асимметрии, то они независимо друг от друга могут находиться как в S, так и в R-конфигурации. Соединения могут также быть представлены в виде оптических изомеров, в виде диастереомеров, в виде рацематов или в виде их смесей. Предлагаемые соединения включают все таутомерные формы соединений формул I и II. Алкильные остатки могут быть линейными или разветвленными. Это относится также к таким случаям, когда они содержат заместители или в качестве заместителей выступают другие остатки, например, к фторалкильным остаткам или алкоксигруппам. Примерами алкильных остатков являются метил, этил, н-пропил, изопропил (=1-метилэтил), н-бутил, изобутил (=2-метилпропил), втор-бутил (=1-метилпропил), трет-бутил (=1,1-диметилэтил), н-пентил, изопентил, трет-пентил, неопентил и гексил. Предпочтительными алкильными остатками являются метил, этил, н-пропил и изопропил. В алкильных остатках один или более, например 1, 2, 3, 4 или 5 атомов водорода, могут быть замещены атомами фтора. Примерами таких фторалкильных остатков являются трифторметил, 2,2,2-трифторэтил и пентафторэтил. Замещенные алкильные остатки могут быть замещены в любых положениях. Примерами циклоалкильных остатков являются циклопропил, циклобутил, циклопентил, циклогексил, циклогептил или циклооктил. В циклоалкильных остатках один или более, например 1, 2, 3 или 4 атома водорода, могут быть замещены атомами фтора. Замещенные циклоалкильные остатки могут быть замещены в любых положениях. Фенильные остатки могут быть незамещенными или однократно или многократно, например, моно-, ди- или тризамещенными одинаковыми или различными остатками. Если фенильный остаток замещен, он предпочтительно содержит один или два одинаковых или различных эаместителя. Это относится также к замещенным фенильным остаткам в таких группах, как, например, фенилалкильная или фенилоксигруппа. В монозамещенных фенильных остатках заместители могут находиться во 2-положении, 3-положении или 4-положении. Дизамещенный фенил может быть замещен в 2,3-положениях, 2,4-положениях, 2,5-положениях, 2,6-положениях, 3,4-положениях или 3,5-положениях. Тризамещенные фенильные остатки содержат заместители в 2,3,4-положениях, 2,3,5-положениях, 2,4,5-положениях, 2,4,6-положениях, 2,3,6-положениях или 3,4,5-положениях. Гетероарильные остатки являются ароматическими соединениями, в которых один или более атомов в цикле являются атомами кислорода, атомами серы или атомами азота, например, 1, 2 или 3 атомами азота, 1 или 2 атомами кислорода, 1 или 2 атомами серы или комбинациями различных гетероатомов. Гетероарильные остатки могут быть присоединены через все положения, например, через 1-положение, 2-положение, 3-положение, 4-положение, 5-положение, 6-положение, 7-положение или 8-положение. Гетероарильные остатки могут быть незамещенными или однократно или многократно, например, моно-, ди- или тризамещенными одинаковыми или различными остатками. Это относится также к гетероарильным остаткам, таким как, например, гетероарилалкильный остаток. Гетероарил означает, например, фуранил, тиенил, пирролил, имидазолил, пиразолил, триазолил, тетразолил, оксазолил, изоксазолил, тиазолил, изотиазолил, пиридил, пиразинил, пиримидинил, пиридазинил, индолил, индазолил, хинолил, изохинолил, фталазинил, хиноксалинил, хиназолинил и циннолинил. К гетероарильным остаткам относятся, в частности, 2- или 3-тиенил, 2- или 3-фурил, 1-, 2- или 3-пирролил, 1-, 2-, 4- или 5-имидазолил, 1-, 3-, 4- или 5-пиразолил, 1,2,3-триазол-1-, -4- или -5-ил, 1,2,4-триазол-1-, -3- или -5-ил, 1- или 5-тетразолил, 2-, 4- или 5-оксазолил, 3-, 4- или 5-изоксазолил, 1,2,3-оксадиазол-4- или -5-ил, 1,2,4-оксадиазол-3- или -5-ил, 1,3,4-оксадиазол-2-ил или -5-ил, 2-, 4- или 5-тиазолил, 3-, 4- или 5-изотиазолил, 1,3,4-тиадиазол-2- или -5-ил, 1,2,4-тиадиазол-3- или -5-ил, 1,2,3-тиадиазол-4- или -5-ил, 2-, 3- или 4-пиридил, 2-, 4-, 5- или 6-пиримидинил, 3- или 4-пиридазинил, пиразинил, 1-, 2-, 3-, 4-, 5-, 6- или 7-индолил, 1-, 2-, 4- или 5-бензимидазолил, 1-, 3-, 4-, 5-, 6- или 7-индазолил, 2-, 3-, 4-, 5-, 6-, 7- или 8-хинолил, 1-, 3-, 4-, 5-, 6-, 7- или 8-изохинолил, 2-, 4-, 5-, 6-, 7- или 8-хиназолил, 3-, 4-, 5-, 6-, 7- или 8-циннолинил, 2-, 3-, 5-, 6-, 7- или 8-хиноксалинил, 1-, 4-, 5-, 6-, 7- или 8-фталазинил. Дополнительно охвачены соответствующие N-оксиды указанных соединений, то есть, например, 1-окси-2-, 3- или 4-пиридил. Особенно предпочтительными гетероароматическими остатками являются 2- или 3-тиенил, 2- или 3-фурил, 1-, 2- или 3-пирролил, 1-, 2-, 4- или 5-имидазолил, 2-, 3-, 4-, 5-, 6-, 7- или 8-хинолил, 1-, 3-, 4- или 5-пиразолил, 2-, 3- или 4-пиридил, 2- или 3-пиразинил, 2, 4, 5- или 6-пиримидинил и 3- или 4-пиридазинил. Далее изобретение относится к способу получения соединения формулы I и II или его фармацевтически приемлемой соли, отличающемуся тем, что соединение формулы III или IV где R1-R4 имеют указанные значения и L означает легко нуклеофильно замещаемую удаляемую группу, подвергают взаимодействию с гуанидином. Активированные кислотные производные формул III и IV, где L означает алкоксигруппу, предпочтительно метоксигруппу, феноксгруппу, фенилтио-, метилтио-, 2-пиридилтиогруппу, азотсодержащий гетероцикл, предпочтительно 1-имидазолил, получают предпочтительно известным образом из исходных хлорангидридов карбоновых кислот (формулы III, IV; L = Cl), которые, в свою очередь, могут быть получены известным образом из исходных карбоновых кислот (формулы III, IV; L = OH), (взаимодействием) с тионилхлоридом. Наряду с хлорангидридами карбоновых кислот формул III и IV (L = Cl) удается также получить другие активированные кислотные производные формул III и IV известным способом непосредственно из исходных бензойных кислот (формулы III, IV; L = OH), такие как метиловые эфиры формул III и IV с L = OCH3 обработкой газообразным HCl в метаноле, имидазолиды формул III и IV обработкой карбонилдиимидазолом [L=1-имидазолил, Staab, Angew. Chem. Int. Ed. Engl. 1, 351-367 (1962)], смешанные ангидриды формул III и IV путем взаимодействия c Cl-COOC2H5 или тозилхлоридом в присутствии триэтиламина в инертном растворителе; возможно также активирование бензойных кислот дициклогексилкарбодиимидом (DCC) или тетрафторборатом [(циано(этоксикарбонил)метилен)амино]-1,1,3,3-тетраметилурония («TOTU») [Proceedings of the 21. European Peptide Symposium, Peptides 1990, Editors E.Girait and D.Andreu, Escom, Leiden, 1991]. Ряд подходящих способов получения активированных производных карбоновых кислот формул III и IV приведен в литературных источниках, указанных в J. March, Advanced Organic Chemistry, третье издание (John Wiley & Sons, 1985, стр.350). Взаимодействие активированного производного карбоновой кислоты формулы III и IV с гуанидином предпочтительно осуществляют известным образом в протонном или апротонном полярном или инертном органическом растворителе. Причем при взаимодействии метилового эфира бензойной кислоты (III, IV; L = OCH3) с гуанидином метанол, изопропанол или ТГФ поддерживают при (температуре) от 20°С до температуры кипения указанного растворителя. В большинстве случаев взаимодействие соединений III и IV со свободным от кислоты гуанидином предпочтительно осуществляют в апротонных инертных растворителях, таких как ТГФ, диметоксиэтан, диоксан. Но в качестве растворителя при взаимодействии III и IV с гуанидином может быть также использована вода с добавленным основанием, таким, как например, NaOH. Если L имеет значение Cl, то предпочтительно добавляют улавливатель кислоты, например, в виде избытка гуанидина, для связывания галогеноводородной кислоты. К изобретению относится также промежуточный продукт формулы V где R5 означает водород или (С1-С4)-алкил и в котором метильная группа может находиться во 2-положении или в 3-положении ароматического кольца. Пентафторсульфанилбензоилгуанидины I и II вообще являются слабыми основаниями и могут связывать кислоту с образованием солей. В качестве кислотно-аддитивных солей речь идет обо всех фармакологически приемлемых солях, например, галогенидах, в частности, гидрохлоридах, лактатах, сульфатах, цитратах, тартратах, ацетатах, фосфатах, метилсульфонатах, пара-толуолсульфонатах. Соединения I и II являются замещенными ацилгуанидинами и ингибируют клеточный натрий-протонный обмен (Na+/H+-обмен, NHE). В противоположность известным соединениям предлагаемые соединения проявляют исключительно высокую активность в отношении ингибирования Na+/H+-обмена, а также улучшенные ADMET-свойства. Благодаря ксенобиотической структуре (в частности, благодаря введению скорее «неприродных/чуждых природе» заместителей SF5) затрудняется метаболическая возможность воздействия. Это ведет, кроме всего прочего, к более длительной S9-стабильности (стабильность печени, стабильность по отношению к ферментативному воздействию) и к более длительному периоду полураспада in vivo. При этом не оказывается существенного влияния на условия всасывания и сохраняется высокая биодоступность ацилгуанидина. В противоположность некоторым описанным в литературе ацилгуанидинам предлагаемые соединения формул I и/или II и/или их фармацевтически приемлемые соли не проявляют нежелательных и вредных салиуретических свойств. Благодаря NHE-ингибирующим свойствам соединения формул I и/или II и/или их фармацевтически приемлемые соли применимы для профилактики и лечения заболеваний, которые вызваны активированием или активированным NHE, а также заболеваний, которые вызваны вторичными, обусловленными NHE повреждениями. Так как NHE-ингибиторы преимущественно действуют путем влияния на клеточное регулирование рН, они могут быть скомбинированы с другими соединениями, регулирующими внутриклеточное значение рН, при этом речь идет об ингибиторах группы ферментов карбоксигидраз, ингибиторах системы, транспортирующей бикарбонатные ионы, такие как натрий-бикарбонат-котранспортеры (NBC) или регуляторы натрий-зависимого хлорид-бикарбонатного обмена (NCBE), а также NHE-ингибиторы с ингибирующим действием в отношении других NHE-подтипов, в качестве компонента комбинации, благодаря чему фармакологически релевантный рН-регулирующий эффект предлагаемых NHE-ингибиторов может быть усилен или модифицирован. Применение соединений согласно изобретению касается предупреждения и лечения острых и хронических заболеваний в ветеринарии и медицине. Так предлагаемые ингибиторы NHE пригодны для лечения заболеваний, вызванных ишемией и реперфузией. Описанные здесь соединения благодаря их фармакологическим свойствам пригодны в качестве антиаритмических лекарственных средств. Благодаря их кардиопротекторным компонентам NHE-ингибиторы формул I и/или II и/или их фармацевтически приемлемые соли широко применимы для профилактики и лечения инфаркта, а также для лечения стенокардии, причем они также превентивно ингибируют или сильно уменьшают патофизиологические процессы при возникновении индуцированных ишемией повреждений, в частности, при возникновении обусловленной ишемией сердечной аритмии. Благодаря их защитному действию в отношении патологических гипоксических и ишемических состояний соединения формул I и/или II согласно изобретению и/или их фармацевтически приемлемые соли вследствие ингибирования клеточного механизма Na+/H+-обмена могут быть использованы в качестве лекарственных средств для лечения всех острых или хронических вызванных ишемией повреждений или обусловленных ими первичных или вторичных заболеваний. Это относится также к их применению в качестве лекарственных средств при хирургических вмешательствах. Так, соединения могут применяться при трансплантациях органов, причем соединения могут быть использованы как для защиты органов у донора перед и во время извлечения, для защиты извлеченного органа, например, при его обработке или хранении в ванне с физиологической жидкостью, так и при введении в организм реципиента. Предложенные соединения равным образом являются ценными протективно действующими лекарственными средствами при проведении ангиопластических оперативных вмешательств, например, на сердце, а также на периферических органах и сосудах. Указано, что предложенные соединения являются отлично действующими лекарственными средствами при опасных для жизни аритмий. Прекращается мерцание желудочков и восстанавливается физиологический синусовый ритм сердца. Поскольку NHE1-ингибиторы тканей и органов человека, в частности сердца, не только эффективно защищают против повреждений, вызванных ишемией и реперфузией, а также против цитотоксического действия лекарственных средств, которые, в частности, находят применение в противораковой терапии и в терапии аутоиммунных заболеваний, применяется комбинированное введение их с соединениями формул I и/или II и/или их фармацевтически приемлемыми солями, которые ингибируют цитотоксические, в частности кардиотоксические, побочные действия названных соединений. Благодаря уменьшению цитотоксического эффекта, в частности кардиотоксичности, вследствие совместного медикаментозного лечения с NHE1-ингибиторами могут быть к тому же увеличены дозы цитотоксических лекарственных средств и/или увеличена продолжительность медикаментозного лечения указанными лекарственными средствами. Терапевтическая эффективность указанной цитотоксической терапии может быть значительно повышена путем комбинации с NHE-ингибиторами. Кроме того, предложенные NHE1-ингибиторы формул I и/или II и/или их фармацевтически приемлемые соли могут найти применение при повреждающих сердце гиперпродуцировании гормонов щитовидной железы, тиреотоксикозе или при внешнем притоке гормонов щитовидной железы. Соединения формул I и/или II и/или их фармацевтически приемлемые соли пригодны при этом для улучшения терапии кардиотоксическими лекарственными средствами. Благодаря их защитному действию против индуцированных ишемией повреждений предложенные соединения применимы также в качестве лекарственных средств для лечения ишемий нервной системы, в частности центральной нервной системы, причем они применимы, например, для лечения инсульта или отека мозга. Соединения формул I и/или II и/или их фармацевтически приемлемые соли применимы также для лечения и профилактики заболеваний и нарушений, которые провоцируются повышенной возбудимостью центральной нервной системы, в частности, для лечения эпилептических заболеваний, провоцируемых центральной нервной системой клонических и тонических судорог, психических депрессивных состояний, страхов и психозов. Причем описанные здесь NHE-ингибиторы могут применяться индивидуально или в комбинации с другими противоэпилептически действующими веществами или антипсихотическими активными веществами или ингибиторами карбоангидразы, например, с ацетазоламидом, а также с другими ингибиторами NHE или регуляторами натрий-зависимого хлорид-бикарбонатного обмена (NCBE). Сверх того, предложенные согласно изобретению соединения формул I и/или II и/или их фармацевтически приемлемые соли равным образом применимы для лечения различных форм шоков, как, например, аллергический, кардиогенный, гиповолемический и бактериальный шоки. Соединения формул I и/или II и/или их фармацевтически приемлемые соли равным образом могут быть использованы для предупреждения и лечения тромботических заболеваний, так как они в качестве NHE-ингибиторов способны ингибировать агрегацию тромбоцитов. Сверх того, они могут ингибировать или замедлять возникающее после ишемии и реперфузии высвобождение медиаторов воспаления и свертывания, в частности, фактора Виллебрандта и тромбогенного белка селектина. Этим патогенное действие значительных тромбогенных факторов может быть снижено и исключено. Поэтому NHE-ингибиторы предлагаемого изобретения могут быть скомбинированы с другими противосвертывающими и/или тромболитическими активными веществами, как, например, плазминогенными активаторами рекомбинантных или природных тканей, стрептокиназой, урокиназой, ацетилсалициловой кислотой, антагонистами тромбина, антагонистами фактора Ха, фибринолитически действующими лекарственными веществами, антагонистами тромбоксанового рецептора, ингибиторами фосфодиэстеразы, антагонистами фактора VIIa, клопидогрелем, тиколопидином и т.д. Комбинированное применение предлагаемых NHE-ингибиторов с NCBE-ингибиторами и/или с ингибиторами карбоангидразы, как, например, с ацетазоламидом, особенно благоприятно. Сверх того, предложенные согласно изобретению соединения формул I и/или II и/или их фармацевтически приемлемые соли отличаются сильным ингибирующим действием в отношении пролиферации клеток, например, пролиферации клеток-фибробластов и клеток гладких мышц сосудов. Поэтому речь идет о соединениях формул I и/или II и/или их фармацевтически приемлемых солях как о ценных лекарственных средствах при заболеваниях, при которых пролиферация клеток представляет собой первичную или вторичную причину, и поэтому применимы в качестве антиатеросклеротических средств, средств против хронической почечной недостаточности, раковых заболеваний. Смогли показать, что соединения согласно изобретению ингибируют миграцию клеток. Поэтому речь идет о соединениях формул I и/или II и/или их фармацевтически приемлемых солях как о ценных лекарственных средствах при заболеваниях, в случае которых миграция клеток представляет собой первичную или вторичную причину, как, например, раковые заболевания с выраженной склонностью к метастазированию. Соединения формул I и/или II и/или их фармацевтически приемлемые соли далее отличаются ингибированием или предотвращением фиброзных заболеваний. Таким образом они пригодны в качестве отличных средств для лечения фиброзов сердца, а также фиброза легких, фиброза печени, фиброза почек и других фиброзных заболеваний. Таким образом, они могут быть использованы для лечения гипертрофий и гиперплазий органов, например, сердца и простаты. Поэтому соединения применимы для предупреждения и лечения сердечной недостаточности (застойной сердечной недостаточности = CHF), также как при лечении и предупреждении гиперплазии простаты или гипертрофии простаты. Поскольку при эссенциальной гипертонии NHE заметно повышен, соединения формул I и/или II и/или их фармацевтически приемлемые соли применимы для предупреждения и лечения повышенного кровяного давления и сердечно-сосудистых заболеваний. При этом они могут быть использованы индивидуально или с подходящими компонентами препаратов и композиций для лечения повышенного кровяного давления и сердечно-сосудистых заболеваний. Так могут быть, например, скомбинированы один или более диуретиков, действующих по типу тиазида, Loop (петлевые) диуретики, антагонисты альдостерона и псевдоальдостерона, такие как гидрохлортиазид, индапамид, политиазид, фуросемид, пиретанид, торасемид, буметанид, амилорид, триамтерен, спиронолактон или эплерон. Дополнительно NHE-ингибиторы предлагаемого изобретения могут быть использованы в комбинации с антагонистами кальция, такими как верапамил, дилтиазем, амлодипин или нифедипин, а также с АСЕ-ингибиторами, как, например, рамиприл, эналаприл, лизиноприл, фосиноприл или каптоприл. Дополнительными благоприятными компонентами комбинаций являются также Обнаружено, что NHE1-ингибиторы формул I и/или II и/или их фармацевтически приемлемые соли обладают заметной противовоспалительной активностью и таким образом могут быть использованы в качестве противовоспалительных средств. При этом обнаружено ингибирование высвобождения медиаторов воспаления. Соединения таким образом могут быть использованы, индивидуально или в комбинации с противовоспалительным средством, для предупреждения или лечения хронических и острых воспалительных заболеваний. В качестве компонентов комбинаций предпочтительно используют стероидные и нестероидные противовоспалительные средства. Кроме того, обнаружено, что соединения формул I и/или II и/или их фармацевтически приемлемые соли оказывают благоприятное влияние на сывороточный липопротеин. Вообще признано, что для возникновения атеросклеротических изменений сосудов, в частности, коронарной болезни сердца, значительный фактор риска представляет слишком высокий уровень липидов в крови, так называемая гиперлипопротеинемия. Поэтому для профилактики и регрессии атеросклеротических изменений снижение повышенного сывороточного липопротеина имеет исключительно важное значение. Наряду со снижением уровня общего сывороточного холестерина особое значение имеет уменьшение доли специфической атерогенной липидной фракции указанного общего холестерина, в частности, липипротеина низкой плотности (LDL) и липопротеина очень низкой плотности (VLDL), так как указанные липидные фракции представляют собой атерогенный фактор риска. Липопротеинам высокой плотности приписывают защитные функции против коронарной болезни сердца. Соответственно этому гиполипидемические средства должны быть в состоянии снижать не только общий холестерин, а в частности VLDL- и LDL-фракции сывороточного холестерина. Ныне обнаружно, что NHE1-ингибиторы проявляют ценные применимые терапевтические свойства относительно влияния на уровень сывороточных липидов. Так, они заметно снижают повышенные концентрации LDL и VLDL, которые наблюдаются, например, при увеличенном введении в диету обогащенной холестерином и липидами пищи или при патологическом изменении обмена веществ, например, генетически обусловленной гиперлипидемии. Поэтому они могут привлекаться для профилактики и для регрессии атеросклеротических изменений, исключая при этом причинный фактор риска. При этом рассчитывают не только на первичную гиперлипидемию, но также на известные вторичные гиперлипидемии, как, например, появляющиеся при диабете. Сверх того, соединения формул I и/или II и/или их фармацивтически приемлемые соли приводят к заметному сокращению инфарктов, вызванных аномалиями обмена веществ, и, в частности, к заметному уменьшению размера индуцированного инфаркта и степени его тяжести. Названные соединения поэтому предпочтительно находят применение для получения лекарственного средства для лечения гиперхолестеринемии; для получения лекарственного средства для предупреждения атерогенеза; для получения лекарственного средства для предупреждения и лечения атеросклероза, для получения лекарственного средства для предупреждения и лечения заболеваний, обусловленных повышенным уровнем холестерина, для получения лекарственного средства для предупреждения и лечения заболеваний, обусловленных эндотелиальной дисфункцией, для получения лекарственного средства для предупреждения и лечения обусловленной атеросклерозом гипертонии, для получения лекарственного средства для предупреждения и лечения обусловленных атеросклерозом тромбозов, для получения лекарственного средства для предупреждения и лечения ишемических повреждений и постишемических реперфузионных повреждений, обусловленных гиперхолестеринемией и эндотелиальной дисфункцией, для получения лекарственного средства для предупреждения и лечения кардиальной гипертрофии и кардиомиопатии и застойной сердечной недостаточности (CHF), обусловленных гиперхолестеринемией и эндотелиальной дисфункцией, для получения лекарственного средства для предупреждения и лечения спазмов коронарных сосудов и инфаркта миокарда, обусловленных гиперхолестеринемией и эндотелиальной дисфункцией, для получения лекарственного средства для лечения названных болезней в комбинациях с веществами, снижающими кровяное давление, предпочтительно с ингибиторами ангиотензинпревращающих ферментов (АСЕ) и антагонистами ангиотензиновых рецепторов. Комбинация NHE-ингибитора формулы I и/или II и/или его фармацевтически приемлемой соли с активным веществом, снижающим уровень липидов в крови, предпочтительно с ингибитором HMG-CoA-редуктазы (например, ловастатином или правастатином), причем последний приводит к гиполипидемическому действию и таким образом повышает гиполипидемическое действие NHE-ингибиторов формул I и/или II и/или их фармацевтически приемлемых солей, оказывается благоприятной комбинацией с усиленным действием и уменьшенным введением активного вещества. Таким образом, соединения формул I и/или II и/или их фармацевтически приемлемые соли ведут к действенной защите в отношении эндотелиальных повреждений различного происхождения. С указанной защитой сосудов от синдрома эндотелиальной дисфункции соединения формул I и/или II и/или их фармацевтически приемлемые соли являются ценными лекарственными средствами для предупреждения и для лечения спазмов коронарных сосудов, болезней периферических сосудов, в частности, перемежающейся хромоты, атерогенеза и атеросклероза, левовентрикулярной гипертонии и дилатационной кардиомиопатии и тромботических заболеваний. Кроме того, было обнаружено, что бензоилгуанидины формул I и/или I и/или их фармацевтически приемлемые соли пригодны при лечении инсулиннезависимого диабета (NIDDM), причем резистентность к инсулину оттесняется. При этом для усиления противодиабетической активности и обеспечения благоприятного действия предложенных соединений они могут быть скомбинированы с бигуанидами, такими как метформин, с противодиабетическими сульфонилмочевинами, такими как глубурид, глимепирид, толбутамид и т.д., ингибитором глюкозидазы, агонистом PPAR, таким как росиглитазон, пиоглитазон и т.д., с препаратами инсулина различных форм применения, с ингибитором DB4, с инсулиновым сенсибилизатором или с меглитинидом. Наряду с острым противодиабетическим эффектом соединения формул I и/или II и/или их фармацевтически приемлемые соли проявляют активность в отношении возникновения поздних диабетических осложнений и поэтому могут быть использованы в качестве лекарственных средств для предупреждения и лечения поздних диабетических осложнений, таких как диабетическая нефропатия, диабетическая нейропатия, диабетическая ретинопатия, диабетическая кардиомиопатия и другие заболевания, наступающие как следствие диабета. Причем они предпочтительно могут быть скомбинированы с только что описанными при лечении NIDDM противодиабетическими лекарственными средствами. Комбинация с благоприятными формами применения инсулина при этом может приобретать особое значение. Предложенные NHE-игибиторы формул I и/или II и/или их фармацевтически приемлемые соли наряду с защитным действием против острых ишемических случаев и равным образом последующих острых отягощенных случаев реперфузии оказывают также непосредственное терапевтически реализуемое действие против заболеваний и нарушений в организме млекопитающего, которые связаны с симптомами хронически протекающих процессов старения и не зависят от острых состояний недостаточного кровоснабжения и наступают при нормальных, неишемических состояниях. При указанных патологических симптомах, обусловленных длительным процессом старения, таких как заболевания, болезни, ведущие к полному истощению и смерти, в последнее время стало доступным лечение NHE-ингибиторами; речь идет о заболеваниях и нарушениях, которые вызваны в основном старческими изменениями жизненно необходимых органов и приобретают дополнительное значение в стареющем организме. Заболеваниями, которые связаны с нарушением функций в условиях старения, с симптомами изнашивания органов в условиях старения, являются, например, недостаточная способность ответа и реакции кровеносных сосудов на реакции сокращения и релаксации. Указанное обусловленное старением понижение сосудистой реакции и расслабляющего раздражения, которые являются незаменимыми процессами сердечно-сосудистой системы и, таким образом, жизни и здоровья, могут быть заметно подняты или снижены NHE-ингибиторами. Важной функцией и мерой поддержания реактивности сосудов является блокада или замедление наступающей в условиях старения эндотелиальной дисфункции, которая может быть поднята NHE-ингибиторами. Соединения формул I и/или II и/или их фармацевтически приемлемые соли таким образом широко применимы для лечения и предупреждения наступающей в условиях старения эндотелиальной дисфункции, в частности, перемежающейся хромоты. Примером дополнительной характеристики, характеризующей процесс старения, является понижение сокращений сердца и понижение адаптации сердца к повышенной насосной функции сердца. Указанная пониженная способность в работе сердца как следствие процесса старения в большинстве случаев связана с дисфункцией сердца, которая вызвана, кроме прочего, включением соединительной ткани в сердечную ткань. Указанное включение соединительной ткани характеризуется увеличением массы сердца, увеличением размеров сердца и ограниченной сердечной функцией. Поразительно, что такого рода старение сердечного органа может быть полностью ингибировано. Соединения формул I и/или II и/или их фармацевтически приемлемые соли таким образом широко применимы для лечения и предупреждения сердечной недостаточности, застойной сердечной недостаточности (CHF). В то время как предшествующие патенты и патентные заявки относились к лечению различных, уже начавшихся форм раковых заболеваний, неожиданно было обнаружено, что не только уже начавшиеся раковые заболевания могут быть излечены путем ингибирования пролиферации, но что также обусловленная старением частота возникновения рака предупреждается и в значительной степени замедляется NHE-ингибиторами. Особенно интересно, что ингибируется или наступает значительное замедление вызванных старением начавшихся заболеваний всех органов, а не только определенных форм рака. Соединения формул I и/или II и/или их фармацевтически приемлемые соли, таким образом, широко применимы для лечения, и в частности, предупреждения обусловленных старением форм рака. Теперь установлено не только на основании статистических данных временное весьма заметно отсроченное замедление наступления обусловленных старением заболеваний всех изученных органов, включая сердце, сосуды, печень и т.д., а также весьма заметное замедление старческого рака. Неожиданно это приводит к продлению жизни в такой степени, которая ранее не могла быть достигнута никакими другими группами лекарственных препаратов или каких-либо природных веществ. Указанное единственное в своем роде действие NHE-ингибиторов позволяет наряду с индивидуальным применением активного вещества в случае человека и животного комбинировать указанные NHE-ингибиторы с другими применимыми в геронтологии принципами действия, мероприятиями, веществами и природными веществами, в основе которых лежит другой механизм действия. Такого рода классами активных веществ, применимыми в геронтологической терапии, являются, в частности, витамины и противоокислительно действующие вещества. Так как между калорийной нагрузкой или приемом пищи и процессом старения существует корреляция, можно осуществлять комбинацию с диетическими мероприятиями, например, с изучением аппетита. Равным образом возможна комбинация с лекарственными средствами, снижающими кровяное давление, такими как АСЕ-ингибиторы, антагонисты рецепторов ангиотензина, диуретики, антагонисты Са+2 и т.д. или с лекарственными средствами, нормализующими обмен веществ, такими как снижающими уровень холестерина. Соединения формул I и/или II и/или их фармацевтически приемлемые соли, таким образом, широко применимы для предупреждения обусловленных старением изменений тканей и для продления жизни с обеспечением высокого качества жизни. Предложенные соединения являются эффективными ингибиторами клеточного натрий-протонного обмена (Na/H-обмена), который при многих заболеваниях (эссенциальная гипертония, атеросклероз, диабет и т.д.) в таких клетках также увеличен; (причем) измерения легко доступны, например, в эритроцитах, тромбоцитах или лейкоцитах. Соединения согласно изобретению пригодны поэтому в качестве эффективных и простых научных средств, например, при использовании в качестве диагностических средств для определения и изучения определенных форм гипертонии, а также атеросклероза, диабета и поздних диабетических осложнений, пролиферативных заболеваний и т.д. Далее требовалось лекарственное средство для медицинского, ветеринарного или фитозащитного применения, содержащее эффективное количество соединения формулы I и/или II и/или его фармацевтически приемлемой соли, вместе с фармацевтически приемлемыми носителями и добавками, индивидуально или в комбинации с другими фармакологически активными веществами или лекарственными средствами. Лекарственное средство, которое содержит соединение формулы I и/или II и/или его фармацевтически приемлемую соль, может при этом вводится, например, перорально, парентерально, внутривенно, ректально, подкожно или путем ингаляции, причем предпочтительное введение зависит от конкретной картины заболевания. Соединения I и/или II при этом могут быть использованы индивидуально или вместе с галеновыми вспомогательными веществами и при том как в ветеринарии, так и в медицине. Лекарственное средство обычно содержит активное вещество формулы I и/или II и/или его фармацевтически приемлемую соль в количестве от 0,01 мг до 1 г на разовую дозу. Какие из вспомогательных веществ использовать для желаемой лекарственной формы, известно специалисту на основе его профессиональных знаний. Наряду с растворителями, гелеобразователями, основами суппозиториев, вспомогательными таблетирующими веществами и другими носителями активных веществ могут быть использованы, например, антиоксиданты, диспергаторы, эмульгаторы, вспениватели, корректоры вкуса, консерванты, солюбилизаторы или красители. Для пероральной формы введения активные вещества смешивают с подходящими добавками, такими как носители, стабилизаторы или инертные разбавители, и обычными способами переводят в пригодные формы применения, такие как таблетки, драже, капсулы, водные, спиртовые или масляные растворы. В качестве инертного носителя могут быть использованы, например, гуммиарабик, магнезия, карбонат магния, фосфат калия, молочный сахар, глюкоза или крахмал, в частности, кукурузный крахмал. При этом приготовление осуществляют как в виде сухого, так и в виде влажного гранулята. В качестве масляного носителя или в качестве растворителя используют, например, растительные или животные масла, такие как подсолнечное масло или рыбий жир. Для подкожного, внутримышечного или внутривенного применения активные соединения при желании используют с подходящими веществами, такими как солюбилизаторы, эмульгаторы или другие вспомогательные вещества, в виде раствора, суспензии или эмульсии. В качестве растворителя речь идет, например, о воде, физиологическом растворе поваренной соли или спирте, например, этаноле, пропаноле, глицерине, а также о растворах сахаров, таких как растворы глюкозы или маннозы, или также о смеси различных названных растворителей. В качестве фармацевтических композиций в форме аэрозолей или спреев применимы, например, растворы, суспензии или эмульсии активного вещества формулы I и/или II и/или его фармацевтически приемлемой соли в фармацевтически приемлемом растворителе, таком как, в частности, этанол или вода, или в смеси указанных растворителей. Композиция по мере надобности может содержать также другие фармацевтические вспомогательные вещества, такие как поверхностно-активные вещества, эмульгаторы и стабилизаторы, а также газ-носитель. Указанная композиция обычно содержит активное вещество в концентрации от примерно 0,1 до 10, в частности, от примерно 0,3 до 3 мас.%. Дозирование вводимых активных веществ формулы I и/или II и частота введения зависит от силы и длительности действия используемого соединения; кроме того, от типа и тяжести излечиваемого заболевания, а также от пола, возраста, веса и индивидуальной переносимости излечиваемого млекопитающего. В среднем дневная доза соединения формулы I и/или II и/или его фармацевтически приемлемой соли при массе пациента примерно 75 кг составляет от по меньшей мере 0,001 мг/кг, например 0,01 мг/кг до самое большее 10 мг/кг, например 1 мг/кг массы тела. При острых приступах болезни, например сразу после перенесения инфаркта миокарда, могут также быть необходимы еще более высокие и прежде всего более частые дозировки, например до 4 отдельных доз в день. В частности, при внутривенном применении у инфарктных пациентов на стадии интенсивной терапии могут быть необходимы, например, до 700 мг в день и предложенные соединения могут вводиться путем инфузий. Список сокращений:
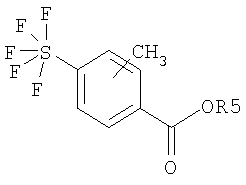
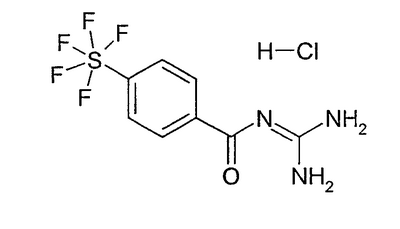
Экспериментальная часть Пример 1 Гидрохлорид 3-пентафторсульфанилбензоилгуанидина а) 3-пентафторсульфанилбензойная кислота 700 мг пентафторида (3-иодфенил)серы (Tetrahedron 56, (2000) 3399) и 300 мг метилйодида растворяли в 20 мл диэтилового эфира (безводного) и раствор медленно прибавляли по каплям к 155 мг магния в 10 мл диэтилового эфира. Перемешивали один час при кипячении с обратным холодильником, затем охлаждали до -10°С и реакционную смесь газировали СО2 при нормальном давлении. В течение 16 часов перемешивали при RT, затем доводили рН реакционной смеси до 1 разбавленным водным раствором HCl и 3 раза экстрагировали по 50 мл ЭА. Сушили над MgSO4 и растворитель удаляли в вакууме. Хроматография на силикагеле со смесью DIP/2% HOAc давала 200 мг бесцветного аморфного порошка.
b) гидрохлорид 3-пентафторсульфанилбензоилгуанидина 30 мг 3-пентафторсульфанилбензойной кислоты перемешивали вместе с 24 г CDI в 5 мл ДМФА (безводного) в течение 3 часов при RT. Тут же 69 мг хлорида гуанидиния вместе с 68 г KOtBu в 5 мл ДМФА (безводного) перемешивали в течение 30 минут при RT. Затем оба раствора объединяли и выдерживали 18 часов при RT. Реакционную смесь разбавляли 20 мл ЭА и 3 раза промывали по 5 мл полуконцентрированного водного раствора NaHCO3. Сушили над MgSO4, растворитель удаляли в вакууме и извлекали избыточным 5%-ным водным раствором HCl. Летучие компоненты удаляли в вакууме и получали 33 мг аморфного твердого вещества.
Пример 2: гидрохлорид 4-пентафторсульфанилбензоилгуанидина а) 4-пентафторсульфанилбензойная кислота 2,7 г пентафторида (4-иодфенил)серы (Tetrahedron 56, (2000) 3399) превращали аналогично примеру 1а) и получали 630 мг бесцветного аморфного твердого вещества.
b) гидрохлорид 4-пентафторсульфанилбензоилгуанидина 50 мг 4-пентафторсульфанилбензойной кислоты превращали аналогично примеру 1b) и получали 33 мг целевого соединения в виде аморфного порошка.
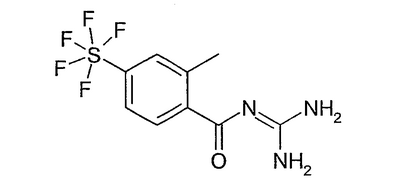
Пример 3: 4-пентафторсульфанил-2-метилбензоилгуанидин а) 4-пентафторсульфанил-2-метилбензойная кислота 3,09 г TMEDA растворяли в 30 мл ТГФ (безводного) и при -90°С прибавляли по каплям 20,5 мл 1,3М раствора втор-бутиллития в циклогексане. Затем прибавляли по каплям раствор 3,0 г 4-пентафторсульфанилбензойной кислоты в 20 мл ТГФ (безводного) при -90°С. Перемешивали в течение одного часа при -90°С, затем прибавляли по каплям раствор 5,15 г метилйодида в 20 мл ТГФ (безводного). При этом поддерживали температуру при -80°С. Затем дополнительно перемешивали в течение 20 минут при -78°С, впрыскивали 100 мл воды, доводили разбавленным водным раствором HCl до рН 1 и трижды экстрагировали по 100 мл МТВ. Сушили над MgSO4 и растворитель удаляли в вакууме. Остаток прежде всего хроматографировали на силикагеле со смесью DIP/2% HOAc и получали 1,60 г смеси 4-пентафторсульфанилбензойной кислоты и 4-пентафторсульфанил-2-метилбензойной кислоты. Указанную смесь снова хроматографировали в следующих условиях: Колонка: Waters X-terra 250×50 мм + Vorsaeule 50×50 мм Упаковка: С18 10 мкм Скорость потока: 150 мл/мин Градиент (линейное элюирование): Растворитель А вода + 2% трифторуксусной кислоты Растворитель В ацетонитрил
Получали 900 мг указанного в заголовке соединения в виде бесцветного твердого вещества с временем удерживания 21,14 минуты наряду с 360 мг 4-пентафторсульфанилбензойной кислоты с временем удерживания 20,18 минуты (определено при длине волны 220 нм).
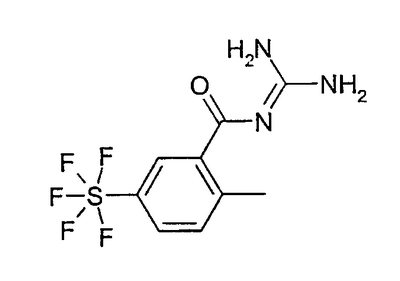
b) 4-пентафторсульфанил-2-метилбензоилгуанидин 910 мг 4-пентафторсульфанил-2-метилбензойной кислоты растворяли в 25 мл ДМФА (безводного), прибавляли при RT 844 мг CDI и перемешивали 6 часов при RT (раствор 1). Кроме того, 1,988 г хлорида гуанидиния и 1,947 г KotBu в 10 мл ДМФА (безводного) перемешивали в течение 30 минут при RT (раствор 2). Затем раствор 2 прибавляли к раствору 1 и перемешивали 17 часов при RT. Затем реакционную смесь разбавляли 200 мл МТВ и 1 раз промывали 100 мл воды. Эту воду затем экстрагировали 100 мл МТВ. Объединенные органические фазы затем снова 3 раза промывали по 50 мл воды и сушили над MgSO4. Растворитель удаляли в вакууме и остаток хроматографировали на силикагеле с ЭА. Получали 600 мг белых кристаллов, т.пл. 185°С.
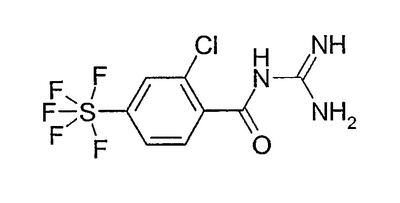
Пример 4: N-[2-хлор-4-пентафторсульфанилбензоил]гуанидин а) 2-хлор-4-пентафторсульфанилбензойная кислота 20,0 мл TMEDA растворяли в 150 мл ТГФ (безводного) и при температуре между -80°С и -90°С прибавляли 93,0 мл 1,25М раствора втор-BuLi в циклогексане. Затем при температуре между -87°С и -93°С прибавляли по каплям в течение 35 минут раствор 4-пентафторсульфанилбензойной кислоты (пример 2а) в 50 мл ТГФ (безводного). Дополнительно перемешивали 2 часа при -90°С и, наконец, прибавляли по каплям при -90°С 38,2 г 1,1,1,2,2,2-гексахлорэтана в 60 мл ТГФ (безводного). Оставляли нагреваться до -70°С и затем прибавляли по каплям 100 мл воды. Растворитель удаляли в вакууме и остаток хроматографировали на силикагеле со смесью DIP/2% HOAc. Получали 5,0 г желаемого продукта в виде частично кристаллизующегося масла.
b) N-[2-хлор-4-пентафтосульфанилбензоил]гуанидин 170 мг 2-хлор-4-пентафторсульфанилбензойной кислоты растворяли в 3 мл ДМФА (безводного) и при RT прибавляли 127 мг CDI. Дополнительно перемешивали 2 часа при RT и получали промежуточный имидазолид. При этом 337 мг KOt-Bu растворяли в 5 мл ДМФА (безводного) и прибавляли по каплям раствор 344 мг гидрохлорида гуанидиния в 5 мл ДМФА (безводного). Раствор дополнительно перемешивали 30 минут при RT и затем прибавляли по каплям раствор имидазолида при RT. Реакционную смесь выдерживали 16 часов при RT и затем растворитель удаляли в вакууме. Остаток извлекали смесью 50 мл ЭА/20 мл воды и промывали дважды, используя по 20 мл воды, а затем 2 раза по 20 мл насыщенного водного раствора NaCl. Сушили над MgSO4 и растворитель удаляли в вакууме. Остаток хроматографировали на силикагеле с ЭА и получали 90 мг продукта (аморфного).
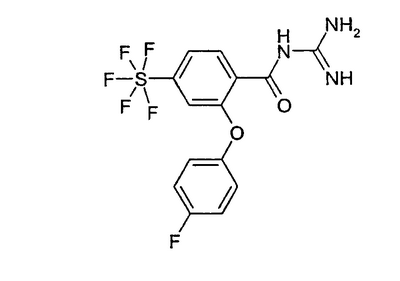
Пример 5: N-[2-(-4-фторфенокси)-4-пентафторсульфанилбензоил]гуанидин а) метиловый эфир 2-хлор-4-пентафторсульфанилбензойной кислоты 4,3 г 2-хлор-4-пентафторсульфанилбензойной кислоты растворяли в 50 мл метанола и при RT медленно прибавляли по каплям 5,6 мл SOCl2. Кипятили 6 часов с обратным холодильником, летучие компоненты удаляли в вакууме, остаток извлекали 100 мл толуола и снова удаляли в вакууме летучие компоненты. Получали 4,1 г бесцветного масла. Rf (HEP/DIP 1:1)=0,44 b) метиловый эфир 2-(4-фторфенокси)-4-пентафторсульфанилбензойной кислоты 300 мг метилового эфира 2-хлор-4-пентафторсульфанилбензойной кислоты, 113 мг 4-фторфенола, а также 659 мг Cs2CO3 растворяли в 1,5 мл ДМФА (безводного) и перемешивали при 120°С. Затем оставляли охлаждаться, разбавляли 10 мл ЭА и трижды промывали, используя по 5 мл воды. Сушили над MgSO4 и растворитель удаляли в вакууме. Получали 120 мг аморфного твердого вещества, которое хроматографировали с обращенной фазой на силикагеле: Скорость потока: 30 мл/мин Градиент: ACN = A; вода + 0,2% TFA = B 0-3 мин 5% А; -14 мин 95% А; 15-18 мин 95% А; -20 мин 5% А Колонка: Xterra C18 5 мкм 30×100 мм Получали 20 мг аморфного твердого вещества. Rf силикагель (HEP/DIP 1:1)=0,44 c) N-[2-(4-фторфенокси)-4-пентафторсульфанилбензоил]гуанидин 270 мг KOt-Bu, а также 324 мг гидрохлорида гуанидина перемешивали в течение 30 минут при RT в 1 мл ДМФА (безводного). Затем прибавляли раствор 54 мг метилового эфира 2-(4-фторфенокси)-4-пентафторсульфанилбензойной кислоты в 1 мл ДМФА (безводного). Затем перемешивали в течение 2 часов при RT и выливали в 10 мл воды, устанавливали водным раствором HCl рН 8 и 3 раза экстрагировали по 5 мл МТВ. Органическую фазу еще раз промывали 10 мл воды, затем сушили над MgSO4 и, наконец, растворитель удаляли в вакууме. Получали 20 мг аморфного твердого вещества.
Пример 6: N-(2-метил-5-пентафторсульфанилбензоил)гуанидин а) 5,4 г KotBu растворяли в 25 мл ДМФА (безводного) и охлаждали до -73°С. Затем прибавляли по каплям раствор 3,0 г 1-нитро-3-пентафторсульфанилбензола и 1,1 мл CHCl3 в 15 мл ДМФА (безводного) как можно быстрее (примерно за 20 минут), при этом температуру поддерживали ниже -67°С. Дополнительно перемешивали в течение одной минуты при -70°С, затем впрыскивали 15 мл ледяной уксусной кислоты в 15 мл метанола и нагревали до RT. Реакционную смесь выливали в 200 мл воды и 3 раза экстрагировали по 100 мл CH2Cl2. Органическую фазу затем промывали еще трижды, используя по 50 мл насыщеного водного раствора Na2CO3. Сушили над MgSO4 и, наконец, растворитель удаляли в вакууме. Остаток хроматографировали на силикагеле со смесью ЭА/НЕР 1:10 и получали 3,0 г бесцветного масла. Rf (ЭА/НЕР 1:10)=0,78 b) 2-метил-5-пентафторсульфаниланилин 2,0 г 1-дихлорметил-2-нитро-4-пентафторсульфанилбензола растворяли в 25 мл DME, прибавляли 200 мг Pd/C (5%), а также 100 мл насыщенного водного раствора NaHCO3 и гидрировали в течение 54 часов при 5 барах. Затем катализатор отфильтровывали и реакционный раствор 3 раза экстрагировали по 50 мл МТВ. Сушили над MgSO4 и растворитель удаляли в вакууме. Получали 1,1 г бесцветного масла. Rf (DIP)=0,42 c) 2-бром-1-метил-4-пентафторсульфанилбензол 1,6 г 2-метил-5-пентафторсульфаниланилина растворяли в 15 мл ледяной уксусной кислоты и при 5°С прибавляли 3 мл 48%-ного водного раствора HBr. При этом образовывался осадок. Затем при температуре между 0°С и 5°С прибавляли по каплям в течение 10 минут раствор 0,52 г NaNO2 в 3 мл воды. Указанный раствор соли диазония затем выливали в суспензию 1,2 г CuBr в 10 мл 48%-ного водного раствора HBr и 10 мл воды. Дополнительно перемешивали 30 минут при RT, затем разбавляли 50 мл воды и 3 раза экстрагировали по 50 мл DIP. Органическую фазу промывали еще 2 раза по 50 мл насыщенного водного раствора Na2CO3. Сушили над MgSO4 и затем растворитель удаляли в вакууме. Получали 1,6 г легкоподвижного масла. Rf (MTB/н-пентан 1:5)=0,67 d) 2-метил-5-пентафторсульфанилбензойная кислота 200 мг 2-бром-1-метил-4-пентафтосульфанилбензола растворяли в 6 мл ДМФА, 3 мл три-н-бутиламина и 0,5 мл воды и прибавляли 129 мг Cs2CO3. Затем прибавляли 15,1 мг Pd(OAc)2, а также 35,3 мг трифенилфосфина и кипятили 6 часов с обратным холодильником в атмосфере СО при нормальном давлении. Реакционную смесь разбавляли 100 мл ЭА и 30 мл воды, устанавливали рН 2-3 водным раствором HCl и 2 раза экстрагировали по 30 мл ЭА. Сушили над MgSO4 и затем растворитель удаляли в вакууме. Хроматографией с обращенной фазой получено 17 мг аморфного твердого вещества. Способ хроматографирования: трижды ВЭЖХ; 1 раз с градиентом 1, 2 раза с градиентом 2. ВЭЖХ: градиент 1 и градиент 2, оба времени протекания 20 мин Растворитель: вода (бидистиллят)+0,2% TFA, ацетонитрил (растворитель хроматографии); скорость потока: 30 мл/мин Колонка: Waters XterraTM MS C18, 5 мкм, 30×100 мм MS: стандарт 20 мин, фракционирование: после (указанного) времени
LCMS (жидкостная хроматография с масс-спектрометрией)(ES-): 261 (M-1)– e) N-(2-метил-5-пентафторсульфанилбензоил)гуанидин 17,0 мг 2-метил-5-пентафторсульфанилбензойной кислоты растворяли в 2 мл ДМФА (безводного), прибавляли 15 мг CDI и перемешивали 4 часа. Сразу 36,5 мг KotBu и 37,3 мг гидрохлорида гуанидина растворяли в 2 мл безводного ДМФА и перемешивали 30 минут при RT. Указанный раствор гуанидинового основания затем прибавляли по каплям к вышеупомянутому имидазолиду и выдерживали 16 часов при RT. Растворитель удаляли в вакууме, остаток извлекали 5 мл воды и устанавливали рН 9 водным раствором HCl. Затем 3 раза экстрагировали по 10 мл ЭА. Сушили над MgSO4 и, наконец, растворитель удаляли в вакууме. Хроматографированием на силикагеле с ЭА получено 7,0 мг продукта в виде аморфного твердого вещества.
Способ NHE-ингибирования Концентрацию IC50[нМ] NHE1-ингибирования определяли следующим образом: FLIPR-анализ для определения ингибиторов NHE-1 путем измерения повышения рНi в трансфицированных клеточных линиях, которые экспрессируют NHE-1 человека Анализ проводили в FLIPR (пластинчатом считывателе флуоресцентного изображения) с помощью 96-луночного микротитрационного планшета с черными стенками и прозрачным дном. Трансфицированные клеточные линии, которые экспрессируют различные подтипы NHE (родительская клеточная линия LAP-1 вследствие мутагенеза и последующей селекции не имеет эндогенной NHE-активности), высевают в предыдущий день с плотностью Собственно анализ начинают с удаления питательной среды и прибавления 100 мкл на лунку нагруженного буферного раствора (5 мкм BCECF-AM [сложного ацетоксиметилового эфира 2′,7′-бис(карбоксиэтил)-5-(и -6)-карбоксифлуоресцеина] в 20 мМ NH4Cl, 115 мМ холинхлорида, 1 мМ MgCl2, 1 мМ CaCl2, 5 мМ KCl, 20 мМ HEPES, 5 мМ глюкозы; рН 7,4 [установлен с помощью КОН]). Клетки затем инкубировали 20 минут при 37°С. Указанное инкубирование приводило к загрузке клеток флуоресцирующим красителем, интенсивность флуоресценции которого зависела от рНi, и при помощи NH4Cl клетки слегка подщелачивали. [Нефлуоресцирующий полупродукт красителя BCECF-AM в виде сложного эфира проникает в мембрану. Внутриклеточно эстеразами высвобождается собственно краситель BCECF, который не проникает через мембраны.] После указанного 20-минутного инкубирования нагруженный буферный раствор, который содержит NH4Cl и свободный BCECF, удаляли трехкратной промывкой в устройстве для промывки клеток (Tecan Columbus) по 400 мл промывного буферного раствора (133,8 мМ холинхлорида, 4,7 мМ KCl, 1,25 мМ MgCl2, 1,25 мМ CaCl2, 0,97 мМ K2HPO4, 0,23 мМ KH2PO4, 5 мМ HEPES, 5 мМ глюкозы; рН 7,4 [установлено КОН]. Объемы остатков в лунках составляли 90 мкл (возможно 50-125 мкл). Указанная стадия промывки удаляет свободный BCECF-AM и вследствие удаления внешних ионов NH4 + приводит к внутриклеточному подкислению (рНi примерно 6,3-6,4). Поскольку нарушалось равновесие внутриклеточного NH4 + посредством NH3 и Н+ путем удаления внеклеточного NH4 + и последующего мгновенно прекращающегося проницания NH3 через клеточную мембрану, процесс роста приводил к тому, что внутриклеточный Н+ оставался и являлся причиной внутриклеточного подкисления. Это может легко привести к гибели клетки, если задерживается достаточно долго. В этот момент важно, чтобы промывной буферный раствор не содержал натрия (<1 мМ), поскольку внеклеточные ионы натрия приводят к моментальному повышению рНi благодаря активности клонированных изоформ NHE. Равным образом важно, чтобы все использованные буферные растворы (нагруженный буферный раствор, промывной буферный раствор, регенерированный буферный раствор) не содержали ионов HCO3 –, так как присутствие бикарбоната приводит к активированию повреждающих бикарбонатзависимых систем регулирования рНi, которые содержатся в родительской LAP-1 клеточной линии. Микротитрационные планшеты с подкисленными клетками затем (до 20 минут после подкисления) трансфицировали для FLIPR. В FLIPR флуоресцирующий краситель инициировали светом с длиной волны 488 нм, который испускал аргоновый лазер, и параметры измерений (энергия лазера, время освещения и диафрагма встроенной в FLIPR CDD-камеры) выбирали таким образом, чтобы средний сигнал флуоресценции на лунку составлял между 30000 и 35000 относительной флуоресцентной единицы. Непосредственное измерение в FLIPR начинали с тем, чтобы программное обеспечение обеспечивало каждые две секунды снимок CDD-камерой. Через 10 секунд повышали внутриклеточный pHs путем прибавления 90 мкл регенерированного буферного раствора (133,8 мМ NaCl, 4,7 мМ KCl, 1,25 мМ MgCl2, 1,25 мМ CaCl2, 0,97 мМ K2HPO4, 0,23 мМ KH2PO4, 10 мМ HEPES, 5 мМ глюкозы; рН 7,7 [установлено NaOH]) при помощи встроенного в FLIPR 96-луночного пипетирующего устройства. В качестве позитивного контроля (100% NHE-активности) служили лунки, наполненные чистым регенерирующим буферным раствором, негативный контроль (0% NHE-активности) получали промывным буферным раствором. Во все другие лунки прибавляли регенерированный буферный раствор с удвоенной концентрацией тестируемого вещества. Измерение в FLIPR заканчивали после получения 60 точек измерения (две минуты). Необработанные данные вводили в программу ActivityBase. С помощью указанной программы вычисляли сначала NHE-активности для каждой протестированной концентрации вещества и исходя из этого рассчитывали значения IC50 для веществ. Так как повышение рНi не является линейным на протяжении всего эксперимента, а в конце убывает из-за уменьшающейся NHE-активности при более высоких значениях рНi, для подведения итогов измерений важно выбирать время, когда увеличение флуоресценции позитивных контролей является линейным.
Формула изобретения
1. Пентафторсульфанилбензоилгуанидины формулы I или II
где R1 означает водород, алкил с 1, 2, 3 или 4 С-атомами, F, Cl, Br или I; R2 означает водород или -O-фенил, который является незамещенным или замещенным F, Cl, Br или I; R3 и R4 каждый означают водород, а также их фармацевтически приемлемые соли. 2. Способ получения соединения формулы I или II, или его фармацевтически приемлемой соли, отличающийся тем, что соединение формулы III или IV
где R1-R4 имеют значения, приведенные в п.1, и L означает нуклеофильно замещаемую удаляемую группу, подвергают взаимодействию с гуанидином. 3. Соединение формулы I или II, или его фармацевтически приемлемая соль по п.1, предназначенное для применения в качестве лекарственного средства, обладающего NHE ингибирующим действием. 4. Применение соединения формулы I или II, или его фармацевтически приемлемой соли по п.1 для получения лекарственного средства для лечения или профилактики острых или хронических повреждений, заболеваний или опосредованных последующих заболеваний органов и тканей, вызванных ишемическими или реперфузионными состояниями, для лечения или профилактики аритмий, угрожающего жизни мерцания желудочков сердца, инфаркта миокарда, стенокардии, для лечения или профилактики ишемических состояний сердца, ишемических состояний периферической и центральной нервной системы или инсультов или ишемических состояний периферических органов и тканей, для лечения или профилактики шоковых состояний, заболеваний, при которых пролиферация клеток представляет собой первичную или вторичную причину, рака, метастазирования, гипертрофии простаты или гиперплазии простаты, атеросклероза или нарушений жирового обмена, повышенного кровяного давления, в частности, эссенциальной гипертонии, заболеваний центральной нервной системы, в частности, заболеваний, вызванных сверхвозбудимостью ЦНС, таких как эпилепсия или судороги, вызванные центральной нервной системой, заболеваний центральной нервной системы, в частности, состояний страха, депрессий или психозов, для лечения или профилактики инсулин-независимого сахарного диабета (NIDDM) или поздних диабетических осложнений, тромбозов, заболеваний вследствие эндотелиальной дисфункции, перемежающейся хромоты, для лечения или профилактики фиброзных заболеваний внутренних органов, фиброзных заболеваний печени, фиброзных заболеваний почек, фиброзных заболеваний сосудов и фиброзных заболеваний сердца, для лечения или профилактики сердечной недостаточности или застойной сердечной недостаточности, острых или хронических воспалительных заболеваний, заболеваний, вызванных простейшими, малярии и куриного кокцидиоза, и для использования при хирургических операциях и трансплантации органов, для консервирования и хранения трансплантатов для хирургических мероприятий, для предотвращения обусловленных старением изменений тканей, для получения лекарственного средства, направленного против старения или для продления жизни, для лечения и уменьшения кардиотоксических действий при тиреотоксикозе или для получения диагностического средства. 5. Применение по п.4 для получения лекарственного средства для лечения или профилактики острых или хронических повреждений, заболеваний или опосредованных последующих заболеваний органов и тканей, вызванных ишемическими или реперфузионными состояниями. 6. Применение по п.4 для получения лекарственного средства для лечения угрожающего для жизни мерцания желудочков сердца. 7. Применение по п.4 для получения лекарственного средства для лечения или профилактики метастазирования. 8. Применение по п.4 для получения лекарственного средства для лечения или профилактики фиброзных заболеваний сердца, сердечной недостаточности или застойной сердечной недостаточности. 9. Лекарственное средство, обладающее NHE ингибирующим действием для медицинского, ветеринарного и/или фитозащитного применения, содержащее эффективное количество соединения формулы I или II, или его фармацевтически приемлемой соли по п.1 вместе с фармацевтически приемлемыми носителями и добавками. 10. Соединения формулы V
где R5 означает водород или (С1-С4)-алкил.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

 -блокаторы, такие как метопролол, альбутерол и т.д., антагонисты ангиотензиновых рецепторов и подтипов рецепторов, такие как лосартан, ирбесартан, вальсартан, омапатрилат, гемопатрилат, антагонисты эндотеллина, ингибиторы ренина, агонисты аденозинового рецептора, ингибиторы и активаторы калиевых каналов, такие как глибенкламид, глимепирид, диазоксид, кромокалим, миноксидил и его производные, активаторы митохондриальных АТР-чувствительных калиевых каналов, ингибиторы Kv1,5 и т.д.
-блокаторы, такие как метопролол, альбутерол и т.д., антагонисты ангиотензиновых рецепторов и подтипов рецепторов, такие как лосартан, ирбесартан, вальсартан, омапатрилат, гемопатрилат, антагонисты эндотеллина, ингибиторы ренина, агонисты аденозинового рецептора, ингибиторы и активаторы калиевых каналов, такие как глибенкламид, глимепирид, диазоксид, кромокалим, миноксидил и его производные, активаторы митохондриальных АТР-чувствительных калиевых каналов, ингибиторы Kv1,5 и т.д.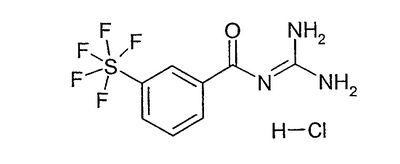
 25000 клеток на лунку. [Питательная среда трансфицированных клеток (Iscove+10% foetales Kaelbeserum) дополнительно содержит G418 в качестве селективного антибиотика, чтобы обеспечить присутствие трансфицированных последовательностей.]
25000 клеток на лунку. [Питательная среда трансфицированных клеток (Iscove+10% foetales Kaelbeserum) дополнительно содержит G418 в качестве селективного антибиотика, чтобы обеспечить присутствие трансфицированных последовательностей.]