Патент на изобретение №2315750
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
(54) ЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ 4-АМИНОЦИКЛОГЕКСАНОЛА, СПОСОБ ИХ ПОЛУЧЕНИЯ И ИХ ПРИМЕНЕНИЕ, ЛЕКАРСТВЕННОЕ СРЕДСТВО, ОБЛАДАЮЩЕЕ СВОЙСТВАМИ СВЯЗЫВАНИЯ С ORL1-РЕЦЕПТОРОМ
(57) Реферат:
Изобретение относится к новым замещенным производным 4-аминоциклогексанола общей формулы I, необязательно в виде их физиологически приемлемых солей, прежде всего физиологически совместимых кислот, которые могут быть использованы для получения лекарственного средства, предназначенного для лечения боли, прежде всего острой, висцеральной, невропатической или хронической боли, а также лекарственного средства, предназначенного для лечения заболеваний, опосредованных функционированием OPL1-рецептора, например, таких как состояние страха, эпилепсия, сердечно-сосудистые заболевания. В общей формуле I
R1 и R2 независимо друг от друга обозначают Н или С1-8алкил, который является насыщенным либо ненасыщенным, при этом R1 и R2 оба не могут одновременно означать Н, или остатки R’ и R2 совместно образуют кольцо и обозначают (СН2)3-6, где R3 обозначает присоединенный через насыщенную либо ненасыщенную, разветвленную либо неразветвленную С1-4алкильную группу фенил, незамещенный или замещенный галогеном, и R4 обозначает гетероарил, выбранный из 5-членного гетероарила, в котором гетероатомы выбраны из атомов азота, кислорода или серы, каждый из которых конденсирован с бензольным кольцом и является незамещенным или однозамещенным С1-8алкилом; -CHR6R7, -CHR6CH2R7, -CHR6-CH2-CH2R7, -CHR6-CH2-CH2-CH2R7, где R6 представляет собой Н, R7 представляет собой фенил, который может быть незамещенным или одно- либо многозамещенным атомами галогена. Изобретение также относится к способу получения соединений формулы I и лекарственному средству на их основе. 5 н. и 5 з.п. ф-лы,1 табл.
(56) (продолжение): CLASS=”b560m”KAWAMOTO H. et al. “Synthesis of J-l 13397, the first potent and selective ORL1 antagonist” “TETRAHEDRON, 2001, bd.57, nr.6, s.981-986.
Настоящее изобретение относится к замещенным производным 4-аминоциклогексанола, к способу их получения, к лекарственным средствам, содержащим эти соединения, и к применению замещенных производных 4-аминоциклогексанола для получения лекарственных средств, предназначенных для лечения различных заболеваний и болезненных состояний, прежде всего боли. Гептадекапептид ноцицептин является эндогенным лигандом ORL1-рецептора (от англ. “opioid receptor like” receptor”, подобный опиоидному рецептору рецептор) (Meunier и др. Nature 377, 1995, сс.532-535), который принадлежит к семейству опиоидных рецепторов и который можно обнаружить во многих отделах головного мозга и спинного мозга (Mollereau и др., FEBS Letters, 341, 1994, сс.33-38; Darland и др., Trends in Neurosciences, 21, 1998, сс.215-221). Этот пептид отличается высокой аффинностью со значением Кd-показателя, равным 56пМ (Ardati и др., Mol. Pharmacol. 51, сс.816-824), и высокой избирательностью в отношении ORL1-рецептора. ORL1-рецептор гомологичен опиоидным В различных экспериментах на животных пептид ноцицептин проявляет после его введения в межжелудочковую область головного мозга проноцицептивную и гипералгезивную активность (Reinscheid и др., Science 270, 1995, cc.792-794; Нага и др., Br. J. Pharmacol. 121, 1997, cc.401-408). Подобный эффект можно объяснить ингибированием индуцированной стрессом аналгезии (Mogil и др., Neurosci. Letters 214, 1996, cc.131-134, а также Neuroscience 75, 1996, cc.333-337). В этом отношении удалось также выявить анксиолитическую активность ноцицептина (Jenck и др., Proc. Natl. Acad. Sci. USA 94, 1997, cc.14854-14858). С другой стороны, результаты различных экспериментов на животных свидетельствуют о том, что ноцицептин, прежде всего после его подоболочечного введения, проявляет также антиноцицептивное действие. Ноцицептин ингибирует активность стимулированных каинатом или глутаматом нейронов ганглия заднего спинномозгового корешка (Shu и др., Neuropeptides, 32, 1998, 567-571) или стимулированных глутаматом нейронов спинного мозга (Faber и др., Br. J. Pharmacol., 119, 1996, cc.189-190), а также проявляет антиноцицептивное действие в опыте с отдергиванием хвоста на мышах (King и др., Neurosci. Lett., 223, 1997, 113-116), в опыте с моделированием сгибательного рефлекса на крысах (Xu и др., NeuroReport, 7, 1996, 2092-2094) и в опыте с формалином на крысах (Yamamoto и др., Neuroscience, 81, 1997, cc.249-254). При моделировании невропатических болей также удалось выявить антиноцицептивное действие ноцицептина (Yamamoto и Nozaki-Taguchi, Anesthesiology, 87, 1997), которое представляет особый интерес постольку, поскольку эффективность ноцицептина повышается после аксотомии спинномозговых нервов. В этом состоит отличие от классических опиоидов, эффективность которых при тех же условиях уменьшается (Abdulla и Smith, J. Neurosci., 18, 1998, cc.9685-9694). ORL1-рецептор участвует, кроме того, и в регуляции других физиологических и патофизиологических процессов. К таковым среди прочего относятся обучаемость и формирование памяти (Sandin и др., Eur. J. Neurosci., 9, 1997, cc.194-197; Manabe и др., Nature, 394, 1997, cc.577-581), слуховое восприятие (Nishi и др., ЕМВО J., 16, 1997, cc.1858-1864), усвоение пищи (Pomonis и др., NeuroReport, 8, 1996, cc.369-371), регуляция кровяного давления (Gumusel и др.. Life Sci, 60, 1997, cc.141-145; Campion и Kadowitz, Biochem. Biophys. Res. Comm., 234, 1997, cc.309-312), эпилепсия (Gutiérrez и др., Abstract 536.18, Society for Neuroscience, т. 24, Материалы 28-й ежегодной конференции, Лос-Анджелес, 7-12 ноября 1998) и диурез (Kapista и др., Life Sciences, 60, 1997, PL 15-21). В статье Calo и др. (Br. J. Pharmacol., 129, 2000, cc.1261-1283) приводится обзорная информация о симптомах или биологических процессах, при которых ORL1-рецептор играет или с высокой вероятностью мог бы играть определенную роль. При этом называются, в частности, аналгезия, стимуляция и регуляция усвоения пищи, влияние на В соответствии с этим соединения, которые связываются с ORL1-рецептором и активируют либо ингибируют его, обладают самыми разнообразными возможностями их применения. В основу настоящего изобретения была положена задача предложить соединения, которые позволяли бы воздействовать на систему ноцицептин/ORL1-рецептор и тем самым были бы пригодны для применения в качестве или в составе лекарственных средств, предназначенных прежде всего для лечения различных заболеваний, которые согласно уровню техники так или иначе связаны с этой системой, соответственно для применения при указанных в описанном выше уровне техники показаниях. В соответствии с этим объектом настоящего изобретения являются замещенные производные 4-аминоциклогексанола общей формулы I
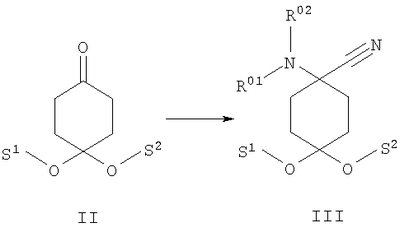
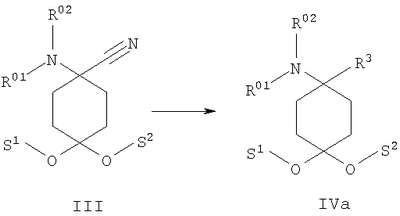
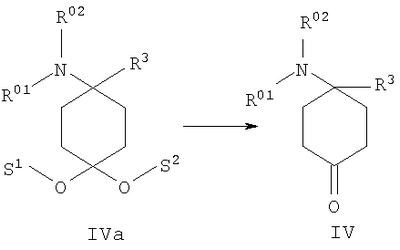
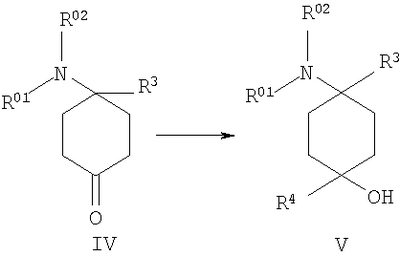
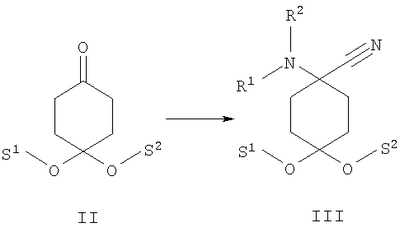
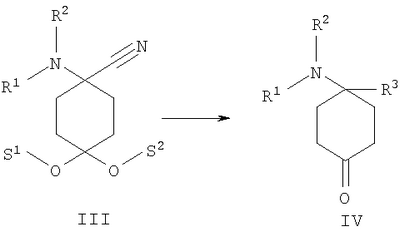
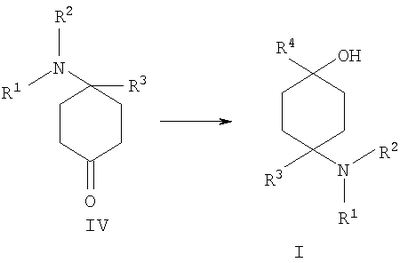
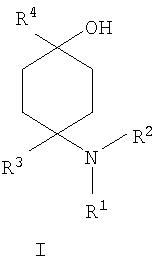
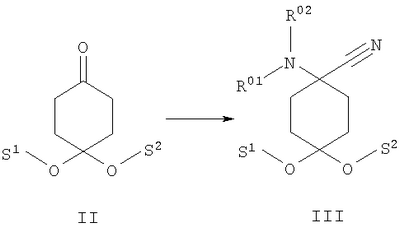
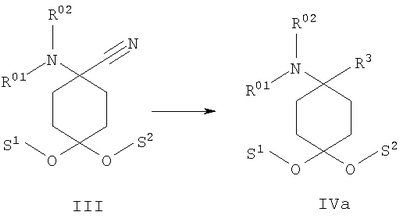
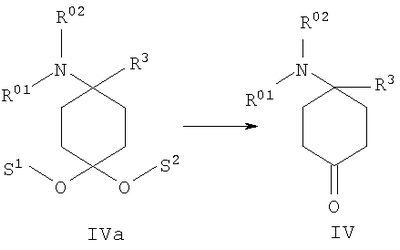
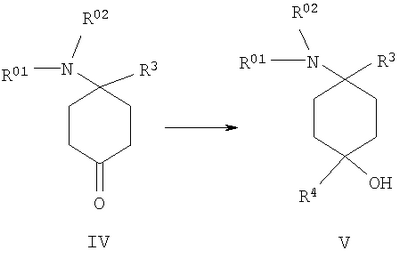
в которой R1 и R2 независимо друг от друга обозначают Н или С1-8алкил либо С3-8циклоалкил, каждый из которых является насыщенным либо ненасыщенным, разветвленным либо неразветвленным, одно- либо многозамещенным или незамещенным, арил либо гетероарил, каждый из которых является одно- либо многозамещенным или незамещенным, или присоединенный через C1-3алкилен арил, С3-8циклоалкил либо гетероарил, каждый из которых является одно- либо многозамещенным или незамещенным, при этом R1 и R2 оба не могут одновременно обозначать Н, или остатки R1 и R2 совместно образуют кольцо и обозначают CH2CH2OCH2CH2, CH2CH2NR5CH2CH2 или (CH2)3-6, где R5 обозначает Н или С1-8алкил либо С3-8циклоалкил, каждый из которых является насыщенным либо ненасыщенным, разветвленным либо неразветвленным, одно- либо многозамещенным или незамещенным, арил либо гетероарил, каждый из которых является одно- либо многозамещенным или незамещенным, или присоединенный через С1-3алкилен арил, С3-8циклоалкил либо гетероарил, каждый из которых является одно- либо многозамещенным или незамещенным, R3 обозначает С1-8алкил либо С3-8циклоалкил, каждый из которых является насыщенным либо ненасыщенным, разветвленным либо неразветвленным, одно- либо многозамещенным или незамещенным, или присоединенный через насыщенную либо ненасыщенную, разветвленную либо неразветвленную, замещенную либо незамещенную С1-4алкильную группу арил, С3-8циклоалкил либо гетероарил, каждый из которых является незамещенным или одно- либо многозамещенным, и R4 обозначает С3-8циклоалкил, арил либо гетероарил, каждый из которых является незамещенным или одно- либо многозамещенным, -CHR6R7, -CHR6-CH2R7, -CHR6-CH2-CH2R7, -CHR6-CH2-CH2-CH2R7, -C(Y)R7, -C(Y)-CH2R7, -C(Y)-CH2-CH2R7, -C(Y)-CH2-CH2-CH2R7 или -R8-L-R9, где Y представляет собой О, S или Н2, R6 представляет собой Н, С1-7алкил, который является насыщенным либо ненасыщенным, разветвленным либо неразветвленным, одно- либо многозамещенным или незамещенным, или С(O)O-С1-6алкил, который является насыщенным либо ненасыщенным, разветвленным либо неразветвленным, одно- либо многозамещенным или незамещенным, R7 представляет собой Н или С3-8циклоалкил, арил либо гетероарил, каждый из которых является незамещенным или одно- либо многозамещенным, R8 представляет собой арил либо гетероарил, каждый из которых является незамещенным или одно- либо многозамещенным, L представляет собой -C(O)-NH-, -NH-C(O)-, -C(O)-O-, -О-С(О)-, -O-, -S- или -S(O)2– и R9 представляет собой арил либо гетероарил, каждый из которых является незамещенным или одно- либо многозамещенным, необязательно в виде их рацематов, их чистых стереоизомеров, прежде всего энантиомеров или диастереомеров, либо в виде смесей стереоизомеров, прежде всего энантиомеров или диастереомеров, в любом их соотношении в смеси, в представленном виде или в виде их кислот или их оснований либо в виде их солей, прежде всего физиологически совместимых кислот, или в виде их сольватов, прежде всего гидратов. Все эти предлагаемые в изобретении соединения, соответственно группы соединений проявляют исключительно высокую степень связывания с ORL1-рецептором. Соединения, которые обладают некоторым отдаленным структурным сходством с предлагаемыми в изобретении соединениями, известны из следующих патентных публикаций: – из DE-OS-2839891, соответственно из параллельного патента US 4366172 (Lednicer и др.), в которых указанные соединения описаны в качестве обладающих анальгетическим действием, но безотносительно к ORL1-рецептору, а также из следующих посвященных этой же тематике статей: – D.Lednicer и P.F. von Voightlander, J. Med. Chem. 22, 1979, с.1157, – D.Lednicer, P.F. von Voightlander и D.E.Emmert, J. Med. Chem. 23, 1980, с.424, – D.Lednicer, P.F. von Voightlander и D.E.Emmert, J. Med. Chem. 24, 1981, с.404, – D.Lednicer, P.F. von Voightlander и D.E.Emmert, J. Med. Chem. 24, 1981, с.340, – P.F. von Voightlander, D.Lednicer, R.A.Lewis и D.D.Gay, “Endogenous and Exogenous Opiate Agonists and Antagonists”, материалы конференции Proc. Int. Narc. Res. Club Conf. (1980), состоявшейся в 1979 г., под ред. Way E.Long, изд-во Pergamon, Elmsford, N.Y. International, Pergamon, 1980, cc.17-21, – Kamenka и др., Eur. J. Med. Chem. Chim. Ther.; FR; 19, 3, 1984, cc.255-260, – Rao M.N.A. и Rao S.C., Indian Drugs, 22(5), 1985, cc. 252-257. В контексте настоящего изобретения под алкильными, соответственно циклоалкильными остатками подразумеваются насыщенные и ненасыщенные (но не ароматические), разветвленные, неразветвленные и циклические углеводороды, которые могут быть незамещенными или одно- либо многозамещенными. При этом С1-2алкил представляет собой С1– или С2-алкил, C1-3алкил представляет собой С1-, С2– или С3-алкил, С1-4алкил представляет собой C1-, C2-, С3– или С4-алкил, С1-5алкил представляет собой C1-, C2-, С3-, C4– или С5-алкил, С1-6алкил представляет собой C1-, С2-, С3-, С4-, C5– или С6-алкил, С1-7алкил представляет собой C1-, С2-, С3-, С4-, С5-, С6– или С7-алкил, С1-8алкил представляет собой C1-, С2-, С3-, С4-, C5-, С6-, C7– или C8-алкил, С1-10алкил представляет собой C1-, C2-, С3-, С4-, С5-, С6-, C7-, C8,- C9– или С10-алкил, а C1-18алкил представляет собой C1, С2-, С3-, C4-, С5-, С6-, С7-, C8,- С9-, С10-, С11-, С12-, C13-, C14-, C15-, C16-, C17– или C18-алкил. Помимо этого С3-4циклоалкил представляет собой С3– или С4-циклоалкил, С3-5циклоалкил представляет собой С3-, С4– или С5-циклоалкил, С3-6циклоалкил представляет собой С3-, С4-, C5– или С6-циклоалкил, С3-7циклоалкил представляет собой С3-, С4-, С5-, С6– или С7-циклоалкил, С3-8циклоалкил представляет собой С3-, С4-, С5-, С6-, С7– или C8-циклоалкил, С4-5циклоалкил представляет собой С4– или С3-циклоалкил, С4-6циклоалкил представляет собой С4-, С5– или С6-циклоалкил, С4-7циклоалкил представляет собой C4-, С5-, С6– или С7-циклоалкил, С5-6циклоалкил представляет собой C5– или С6-циклоалкил, а С5-7циклоалкил представляет собой С5-, С6– или С7-циклоалкил. Под понятием “циклоалкил” подразумеваются также насыщенные циклоалкильные группы, в которых 1 или 2 атома углерода заменены на гетероатом – S, N или О. Однако в понятие “циклоалкил” прежде всего включены также одно- либо многократно, предпочтительно однократно, ненасыщенные циклоалкильные группы без гетероатома в кольце, если циклоалкил не является ароматической системой. Предпочтительными алкильными, соответственно циклоалкильными остатками являются метил, этил, винил (этенил), пропил, аллил (2-пропенил), 1-пропинил, метилэтил, бутил, 1-метилпропил, 2-метилпропил, 1,1-диметилэтил, пентил, 1,1-диметилпропил, 1,2-диметилпропил, 2,2-диметилпропил, гексил, 1-метилпентил, циклопропил, 2-метилциклопропил, циклопропилметил, циклобутил, циклопентил, циклопентилметил, циклогексил, циклогептил, циклооктил, а также адамантил, CHF2, CF3 или СН2ОН и пиразолинон, оксопиразолинон, [1,4]диоксан или диоксолан. При этом в контексте настоящего изобретения под термином “замещенный”, используемым в отношении алкила и циклоалкила, подразумевается, если конкретно не указано иное, замещение по меньшей мере одного (и необязательно также нескольких) атома(ов) водорода атомом F, Cl, Br, I, группой NH2, SH или ОН, при этом под понятием “многозамещенные” остатки, соответственно “замещенные” остатки, в случае их многократного замещения имеется в виду многократное замещение и по различным, и по одним и тем же атомам идентичными либо различными заместителями, например трехкратное замещение по одному и тому же С-атому, как в случае CF3, либо по находящимся в различных положениях атомам, как в случае -CH(OH)-CH=CH-CHCl2. Наиболее предпочтительными заместителями при этом являются F, Cl и ОН. В циклоалкиле водородный остаток может быть также заменен ОС1-3алкилом или C1-3алкилом (каждый из которых является одно- либо многозамещенным или незамещенным), прежде всего метилом, этилом, н-пропилом, изопропилом, группой CF3, метоксигруппой или этоксигруппой. Под остатком “(СН2)3-6” подразумеваются группы -СН2-СН2-СН2-, -СН2-СН2-СН2-СН2-, -СН2-СН2-СН2-СН2-СН2– и СН2-СН2-СН2-СН2-СН2-СН2-, под остатком “(CH2)1-4” подразумеваются группы -СН2-, -СН2-СН2-, -СН2-СН2-СН2– и -СН2-СН2-СН2-СН2-, под остатком “(СН2)4-5” подразумеваются группы -СН2-СН2-СН2-СН2– и -СН2-СН2-СН2-СН2-СН2– и т.д. Под арильным остатком подразумеваются циклические системы по меньшей мере с одним ароматическим кольцом, но без гетероатомов в том числе и только в одном из колец. В качестве примера при этом можно назвать фенильные, нафтильные, флуорантенильные, флуоренильные, тетралинильные или инданильные, прежде всего 9Н-флуоренильные или антраценильные остатки, которые могут быть незамещенными или одно- либо многозамещенными. Под гетероарильным остатком подразумеваются гетероциклические системы по меньшей мере с одним ненасыщенным кольцом, которые содержат один или несколько гетероатомов из группы, включающей азот, кислород и/или серу, и которые также могут быть одно- либо многозамещенными. В качестве примера относящихся к группе гетероарилов остатков при этом можно назвать фуран, бензофуран, тиофен, бензотиофен, пиррол, пиридин, пиримидин, пиразин, хинолин, изохинолин, фталазин, бензо[1,2,5]тиадиазол, бензотиазол, индол, бензотриазол, бензодиоксолан, бензодиоксан, карбазол, индол и хиназолин. Под термином “замещенный”, используемым в отношении арила и гетероарила, имеется в виду замещение арила или гетероарила группой R82, группой OR82, галогеном, предпочтительно атомом F и/или Cl, группой CF3, группой CN, группой NO2, группой NR83R84, С1-6алкилом (насыщенным), C1-6алкоксигруппой, С3-8циклоалкоксигруппой, С3-8циклоалкилом или С2-6алкиленом. При этом остаток R82 представляет собой Н, С1-10алкильный, предпочтительно C1-6алкильный, арильный либо гетероарильный или присоединенный через насыщенный или ненасыщенный С1-3алкил либо через С1-3алкиленовую группу арильный либо гетероарильный остаток, причем такие арильные и гетероарильные остатки сами не могут быть замещены арильными или гетероарильными группами, остатки R83 и R84 могут иметь идентичные или различные значения и представляют собой Н, C1-10алкильный, предпочтительно С1-6алкильный, арильный, гетероарильный или присоединенный через насыщенный или ненасыщенный С1-3алкил либо через C1-3алкиленовую группу арильный либо гетероарильный остаток, причем такие арильные и гетероарильные остатки сами не могут быть замещены арильными или гетероарильными группами, или остатки R83 и R84 совместно представляют собой СН2СН2OCH2СН2, CH2CH2NR85CH2CH2 или (СН2)3-6 и остаток R85 представляет собой Н, C1-С10алкильный, предпочтительно C1-С6алкильный, арильный либо гетероарильный остаток или присоединенный через насыщенный или ненасыщенный С1-3алкил либо через С1-С3алкиленовую группу арильный либо гетероарильный остаток, причем такие арильные и гетероарильные остатки сами не могут быть замещены арильными или гетероарильными группами. Под понятием “соль” подразумевается каждая из форм предлагаемого в изобретении действующего вещества, в которой он принимает ионную форму, соответственно имеет заряд того или иного знака и связан с противоионом (катионом или анионом), соответственно находится в растворе. Сюда же включены также комплексы действующего вещества с другими молекулами и ионами, прежде всего комплексы, образованные за счет ионных взаимодействий. При этом под понятием “соль” имеются в виду в первую очередь (что соответствует также предпочтительному варианту осуществления настоящего изобретения) физиологически совместимые соли, прежде всего физиологически совместимые соли с катионами или основаниями и физиологически совместимые соли с анионами или кислотами или же образованная с физиологически совместимой кислотой либо с физиологически совместимым катионом соль. Выражение “физиологически совместимый” означает, что вещество и прежде всего соль как таковая обладает при введении в организм человека или млекопитающего соответствующей переносимостью им, т.е., например, не оказывает на организм нежелательного с точки зрения физиологии (например токсичного) действия. Под понятием “физиологически совместимая соль с анионами или кислотами” в контексте настоящего изобретения подразумеваются соли по меньшей мере одного из предлагаемых в изобретении соединений, преимущественно в протонированном, например по азоту, виде, в качестве катиона по меньшей мере с одним анионом, которые являются физиологически совместимыми, прежде всего при введении в организм человека и/или млекопитающего. К таким солям в контексте настоящего изобретения относятся прежде всего образованная с физиологически совместимой кислотой соль, а именно, соли соответствующего действующего вещества с неорганическими, соответственно органическими кислотами, которые являются физиологически совместимыми, прежде всего при введении в организм человека и/или млекопитающего. В качестве примера физиологически совместимых солей определенных кислот можно назвать соли соляной кислоты, бромистоводородной кислоты, серной кислоты, метансульфоновой кислоты, муравьиной кислоты, уксусной кислоты, щавелевой кислоты, янтарной кислоты, яблочной кислоты, винной кислоты, миндальной кислоты, фумаровой кислоты, молочной кислоты, лимонной кислоты, глутаминовой кислоты, 1,1-диоксо-1,2-дигидро-1 Под понятием “образованная с физиологически совместимой кислотой соль” в контексте настоящего изобретения подразумеваются соли соответствующего действующего вещества с неорганическими, соответственно органическими кислотами, которые являются физиологически совместимыми, прежде всего при введении в организм человека и/или млекопитающего. Наиболее предпочтительным при этом является гидрохлорид. В качестве примера физиологически совместимых кислот можно назвать соляную кислоту, бромистоводородную кислоту, серную кислоту, метансульфоновую кислоту, муравьиную кислоту, уксусную кислоту, щавелевую кислоту, янтарную кислоту, винную кислоту, миндальную кислоту, фумаровую кислоту, молочную кислоту, лимонную кислоту, глутаминовую кислоту, 1,1-диоксо-1,2-дигидро-1 Под понятием “физиологически совместимая соль с катионами или основаниями” в контексте настоящего изобретения имеются в виду соли по меньшей мере одного из предлагаемых в изобретении соединений, преимущественно (депротонированной) кислоты, в качестве аниона по меньшей мере с одним, предпочтительно неорганическим, катионом, которые являются физиологически совместимыми, прежде всего при введении в организм человека и/или млекопитающего. Наиболее предпочтительны соли щелочных и щелочноземельных металлов, а также соли с NH4 +, но прежде всего моно- либо динатриевые, моно- либо дикалиевые, магниевые или кальциевые соли. Под понятием “образованная с физиологически совместимым катионом соль” в контексте настоящего изобретения подразумеваются соли по меньшей мере одного из соответствующих соединений в качестве аниона по меньшей мере с одним неорганическим катионом, который является физиологически совместимым, прежде всего при введении в организм человека и/или млекопитающего. Наиболее предпочтительны соли щелочных и щелочноземельных металлов, а также соли с NH4 +, но прежде всего моно- либо динатриевые, моно- либо дикалиевые, магниевые или кальциевые соли. В одном из вариантов осуществления изобретения среди описанных выше предлагаемых в нем замещенных производных 4-аминоциклогексанола предпочтительны те из них, в которых R1 и R2 независимо друг от друга обозначают Н или С1-8алкил, который является насыщенным либо ненасыщенным, разветвленным либо неразветвленным, одно- либо многозамещенным или незамещенным, при этом R1 и R2 оба не могут одновременно обозначать Н, или остатки R1 и R2 совместно образуют кольцо и обозначают CH2СН2ОСН2СН2, CH2CH2NR5CH2CH2 или (СН2)3-6, где R5 обозначает Н или С1-8алкил, который является насыщенным либо ненасыщенным, разветвленным либо неразветвленным, одно- либо многозамещенным или незамещенным, предпочтительно R1 и R2 независимо друг от друга обозначают Н или С1-4алкил, который является насыщенным либо ненасыщенным, разветвленным либо неразветвленным, одно- либо многозамещенным или незамещенным, при этом R1 и R2 оба не могут одновременно обозначать Н, или остатки R1 и R2 совместно образуют кольцо и обозначают(СН2)4-5, прежде всего R1 и R2 независимо друг от друга обозначают метил или этил или остатки R1 и R2 совместно образуют кольцо и обозначают (СН2)5. В другом варианте осуществления изобретения среди описанных выше предлагаемых в нем замещенных производных 4-аминоциклогексанола предпочтительны те из них, в которых R3 обозначает незамещенный или одно- либо многозамещенный С3-8циклоалкил или присоединенный через насыщенную либо ненасыщенную, неразветвленную, замещенную либо незамещенную С1-4алкильную группу арил, С3-8циклоалкил либо гетероарил, каждый из которых является незамещенным или одно- либо многозамещенным, предпочтительно R3 обозначает незамещенный или одно- либо многозамещенный С3-6циклоалкил или присоединенный через насыщенную неразветвленную С1-2алкильную группу С5-6циклоалкил, фенил, нафтил, антраценил, тиофенил, бензотиофенил, пиридил, фурил, бензофуранил, бензодиоксоланил, индолил, инданил, бензодиоксанил, пирролил, пиримидил либо пиразинил, каждый из которых является незамещенным или одно- либо многозамещенным, прежде всего R3 обозначает присоединенный через насыщенную неразветвленную С1-2алкильную группу фенил, пиридил, фурил либо тиофенил, каждый из которых является незамещенным или одно- либо многозамещенным. В следующем варианте осуществления изобретения среди описанных выше предлагаемых в нем замещенных производных 4-аминоциклогексанола предпочтительны те из них, в которых R4 обозначает С3-8циклоалкил, арил либо гетероарил, каждый из которых является незамещенным или одно- либо многозамещенным, или -R8-L-R9, предпочтительно R4 обозначает циклобутил, циклопропил, циклопентил, циклогексил, циклогептил, циклооктил, антраценил, индолил, нафтил, бензофуранил, бензотиофенил, инданил, бензодиоксанил, бензодиоксоланил, аценафтил, карбазолил, фенил, тиофенил, фурил, пиридил, пирролил, пиразинил, пиримидил, флуоренил, флуорантенил, бензотиазолил, бензотриазолил, бензо[1,2,5]тиазолил, 1,2-дигидроаценафтенил, пиридинил, фуранил, бензофуранил, пиразолинонил, оксопиразолинонил, диоксоланил, адамантил, пиримидинил, хинолинил, изохинолинил, фталазинил либо хиназолинил, каждый из которых является незамещенным или одно- либо многозамещенным, или -R8-L-R9, прежде всего R4 обозначает циклопентил, циклогексил, циклогептил, циклооктил, антраценил, индолил, нафтил, бензотиазолил, бензофуранил, бензотиофенил, инданил, бензодиоксанил, бензодиоксоланил, аценафтил, карбазолил, фенил, тиофенил, фурил, пиридил, пирролил, пиразинил либо пиримидил, каждый из которых является незамещенным или одно- либо многозамещенным, или -R8-L-R9. В описанном непосредственно выше варианте осуществления изобретения, относящемся к предпочтительным значениям R4, предпочтительны далее соединения, в которых R8 обозначает индолил, нафтил, бензофуранил, бензотиофенил, инданил, бензодиоксанил, бензодиоксоланил, аценафтил, карбазолил, фенил, тиофенил, фурил, пиридил, пирролил, пиразинил, пиримидил, флуоренил, флуорантенил, бензотиазолил, бензотриазолил, бензо[1,2,5]тиазолил или 1,2-дигидроаценафтенил, пиридинил, фуранил, бензофуранил, пиразолинонил, оксопиразолинонил, пиримидинил, хинолинил, изохинолинил, фталазинил либо хиназолинил, каждый из которых является незамещенным или одно- либо многозамещенным, L представляет собой -C(O)-NH-, -NH-C(O)-, -C(O)-O-, -О-С(О)-, -O-, -S- или -S(O)2– и/или R9 обозначает индолил, нафтил, бензофуранил, бензотиофенил, инданил, бензодиоксанил, бензодиоксоланил, аценафтил, карбазолил, фенил, тиофенил, фурил, пиридил, пирролил, пиразинил, пиримидил, флуоренил, флуорантенил, бензотиазолил, бензотриазолил, бензо[1,2,5]тиазолил, 1,2-дигидроаценафтенил, пиридинил, фуранил, бензофуранил, пиразолинонил, оксопиразолинонил, пиримидинил, хинолинил, изохинолинил, фталазинил либо хиназолинил, каждый из которых является незамещенным или одно-либо многозамещенным, предпочтительно R8 обозначает индолил, бензотиофенил, фенил, тиофенил, фурил, пиридил, пирролил, пиразинил либо пиримидил, каждый из которых является незамещенным или одно- либо многозамещенным, L представляет собой -C(O)-NH-, -NH-C(O)-, -C(O)-O-, -О-С(О)- или -S(O)2– и/или R9 обозначает индолил, бензотиофенил, фенил, тиофенил, фурил, пиридил, пирролил, пиразинил или пиримидил, каждый из которых является незамещенным или одно- либо многозамещенным, прежде всего R8 обозначает незамещенный индолил, L представляет собой -S(O)2– и R9 обозначает незамещенный фенил. В соответствии еще с одним вариантом осуществления изобретения среди предлагаемых в нем замещенных производных 4-аминоциклогексанола предпочтительны те из них, в которых R4 обозначает -CHR6R7, -CHR6-CH2R7, -CHR6-CH2-CH2R7, -CHR6-CH2-CH2-CH2R7, -C(Y)R7, -C(Y)-CH2R7, -C(Y)-CH2-CH2R7 или -C(Y)-CH2-CH2-CH2R7, где Y представляет собой О, S или Н2, предпочтительно R4 обозначает -CHR6R7, -CHR6– CH2R7, -CHR6-CH2-CH2R7, -C(Y)R7, -C(Y)-CH2R7 или -C(Y)-CH2-CH2R7, где Y представляет собой О или S, прежде всего R4 обозначает -CHR6R7, -CHR6– CH2R7, -C(Y)R7 или -C(Y)-CH2R7, где Y представляет собой О. В описанном непосредственно выше варианте осуществления изобретения, относящемся к предпочтительным значениям R4, предпочтительны далее соединения, в которых R6 обозначает Н, С1-4алкил, который является насыщенным либо ненасыщенным, разветвленным либо неразветвленным, одно- либо многозамещенным или незамещенным, или С(O)O-С1-4алкил, который является насыщенным либо ненасыщенным, разветвленным либо неразветвленным, одно- либо многозамещенным или незамещенным, предпочтительно обозначает Н или С1-4алкил, который является насыщенным либо ненасыщенным, разветвленным либо неразветвленным, одно- либо многозамещенным или незамещенным, прежде всего обозначает Н, СН3 или С2Н5. В описанном непосредственно выше варианте осуществления изобретения, относящемся к предпочтительным значениям R4, предпочтительны далее соединения, в которых R7 обозначает С3-8циклоалкил, арил либо гетероарил, каждый из которых является незамещенным или одно- либо многозамещенным, предпочтительно R7 обозначает циклобутил, циклопропил, циклопентил, циклогексил, циклогептил, циклооктил, антраценил, индолил, нафтил, бензофуранил, бензотиофенил, инданил, бензодиоксанил, бензодиоксоланил, аценафтил, карбазолил, фенил, тиофенил, фурил, пиридил, пирролил, пиразинил, пиримидил, флуоренил, флуорантенил, бензотиазолил, бензотриазолил, бензо[1,2,5]тиазолил, 1,2-дигидроаценафтенил, пиридинил, фуранил, бензофуранил, пиразолинонил, оксопиразолинонил, диоксоланил, адамантил, пиримидинил, хинолинил, изохинолинил, фталазинил либо хиназолинил, каждый из которых является незамещенным или одно- либо многозамещенным, прежде всего R7 обозначает циклопентил, циклогексил, циклогептил, циклооктил, антраценил, индолил, нафтил, бензофуранил, бензотиофенил, инданил, бензодиоксанил, бензодиоксоланил, аценафтил, карбазолил, фенил, тиофенил, фурил, пиридил, пирролил, пиразинил либо пиримидил, каждый из которых является незамещенным или одно- либо многозамещенным. В соответствии со следующим вариантом осуществления изобретения среди предлагаемых в нем замещенных производных 4-аминоциклогексанола предпочтительны соединения, выбранные из группы, включающей 4-бензил-4-диметиламино-1-фенетилциклогексанол, а также его соответствующий гидрохлорид, 4-диметиламино-1,4-дифенетилциклогексанол, а также его соответствующий гидрохлорид, 4-бензил-4-диметиламино-1-[2-(2-фторфенил)этил]циклогексанол, а также его соответствующий гидрохлорид, 4-бензил-4-диметиламино-1-[2-(4-фторфенил)этил]циклогексанол, а также его соответствующий гидрохлорид, 4-диметиламино-4-(2-фторбензил)-1-фенетилциклогексанол, а также его соответствующий гидрохлорид, 4-диметиламино-4-(3-фторбензил)-1-фенетилциклогексанол, а также его соответствующий гидрохлорид, 4-диметиламино-4-(4-фторбензил)-1-фенетилциклогексанол, а также его соответствующий гидрохлорид, 4-бензил-4-диметиламино-1-[2-(3-фторфенил)этил]циклогексанол, а также его соответствующий гидрохлорид, 4-бензил-4-диметиламино-1-(2-фторбензил)циклогексанол, а также его соответствующий гидрохлорид, 4-(аллилметиламино)-4-бензил-1-фенетилциклогексанол, а также его соответствующий гидрохлорид, 4-бензил-4-диметиламино-1-(3-фторбензил)циклогексанол, а также его соответствующий гидрохлорид, 4-бензил-4-диметиламино-1-(4-фторбензил)циклогексанол, а также его соответствующий гидрохлорид, 1-бензил-4-диметиламино-4-(3-фторбензил)циклогексанол, а также его соответствующий гидрохлорид, 4-бензил-1-фенетил-4-пирролидин-1-илциклогексанол, а также его соответствующий гидрохлорид, 4-бензил-4-диметиламино-1-(1-метил-1Н-индол-2-ил)циклогексанол, 1-бензо[b]тиофен-2-ил-4-бензил-4-диметиламиноциклогексанол, 1-бензо[b]тиофен-3-ил-4-бензил-4-диметиламиноциклогексанол, 1-бензофуран-2-ил-4-бензил-4-диметиламиноциклогексанол, необязательно в виде их рацематов, их чистых стереоизомеров, прежде всего энантиомеров или диастереомеров, либо в виде смесей стереоизомеров, прежде всего энантиомеров или диастереомеров, в любом их соотношении в смеси, в представленном виде или в виде их кислот или их оснований либо в виде их солей, прежде всего физиологически совместимых кислот, или в виде их сольватов, прежде всего гидратов. Предлагаемые в изобретении соединения являются токсикологически безвредными и поэтому пригодны для применения в качестве фармацевтического действующего вещества в лекарственных средствах. В соответствии с этим еще одним объектом настоящего изобретения являются лекарственные средства, содержащие по меньшей мере одно предлагаемое в нем замещенное производное 4-аминоциклогексанола, необязательно в виде его рацемата, чистых стереоизомеров, прежде всего энантиомеров или диастереомеров, либо в виде смесей стереоизомеров, прежде всего энантиомеров или диастереомеров, в любом их соотношении в смеси, в представленном виде или в виде кислот или оснований либо в виде солей, прежде всего физиологически совместимых солей, или в виде сольватов, прежде всего гидратов, а также необязательно содержащие приемлемые добавки и/или вспомогательные вещества и/или необязательно другие действующие вещества. Предлагаемые в изобретении лекарственные средства помимо по меньшей мере одного предлагаемого в нем замещенного производного 4-аминоциклогексанола необязательно содержат приемлемые добавки и/или вспомогательные вещества, в том числе носители, наполнители, растворители, разбавители, красители и/или связующие, и их можно применять в качестве жидких лекарственных форм в виде растворов для инъекций, капель или микстур, а также в качестве полутвердых лекарственных форм в виде гранулятов, таблеток, пилюль, бляшек, капсул, пластырей или аэрозолей. Выбор вспомогательных и иных веществ, а также применяемое их количество зависят от того, предназначено ли лекарственное средство для орального, перорального, парентерального, внутривенного, внутрибрюшинного, интрадермального, внутримышечного, интраназального, трансбуккального, ректального или местного применения, например для нанесения на кожу, на слизистые оболочки или введения в глаза. Для орального применения пригодны композиции в виде таблеток, драже, капсул, гранулятов, капель, микстур и сиропов, а для парентерального, местного и ингаляционного применения пригодны растворы, суспензии, легко восстанавливаемые сухие композиции, а также спреи. Предлагаемые в изобретении замещенные производные 4-аминоциклогексанола в депо-форме в растворенном виде или в заделанном в пластырь виде, необязательно с добавлением способствующих проникновению через кожу средств, пригодны также для чрескожного введения. Предназначенные для перорального или чрескожного введения лекарственные формы могут представлять собой ретард-формы, которые обеспечивают замедленное высвобождение предлагаемых в изобретении замещенных производных 4-аминоциклогексанола. В принципе в состав предлагаемых в изобретении лекарственных средств можно включать и иные, известные специалистам действующие вещества. Назначаемое пациенту количество действующего вещества варьируется в зависимости от веса пациента, пути введения, показаний к применению и степени тяжести заболевания. Обычно по меньшей мере одно предлагаемое в изобретении замещенное производное 4-аминоциклогексанола вводят в организм в дозировке, составляющей от 0,005 до 1000 мг/кг, предпочтительно от 0,05 до 5 мг/кг веса тела. В состав предлагаемых в изобретении лекарственных средств во всех их описанных выше формах наиболее предпочтительно помимо по меньшей мере одного замещенного производного 4-аминоциклогексанола включать также опиоид, предпочтительно сильнодействующий опиоид, прежде всего морфин, либо анестетик, предпочтительно гексобарбитал или галотан. В одном из предпочтительных вариантов содержащееся в лекарственном средстве замещенное производное 4-аминоциклогексанола по изобретению представлено в виде чистого диастереомера и/или энантиомера, в виде рацемата или в виде неэквимолярной либо эквимолярной смеси диастереомеров и/или энантиомеров. Как уже указывалось выше при описании уровня техники, ORL1-рецептор был идентифицирован прежде всего при проявлении болевых ощущений. Поэтому предлагаемые в изобретении замещенные производные 4-аминоциклогексанола могут использоваться для получения лекарственного средства, предназначенного для лечения боли, прежде всего острой, висцеральной, невропатической или хронической боли. В соответствии с этим еще одним объектом изобретения является применение одного из предлагаемых в нем замещенных производных 4-аминоциклогексанола, необязательно в виде его рацематов, его чистых стереоизомеров, прежде всего энантиомеров или диастереомеров, либо в виде смесей стереоизомеров, прежде всего энантиомеров или диастереомеров, в любом их соотношении в смеси, в представленном виде или в виде его кислот или его оснований либо в виде его солей, прежде всего физиологически совместимых солей, или в виде его сольватов, прежде всего гидратов, для получения лекарственного средства, предназначенного для лечения боли, прежде всего острой, висцеральной, невропатической или хронической боли. Как уже указывалось во вводной части описания, ORL1-рецептор наряду с функцией, которую он выполняет при проявлении болевых ощущений, играет также определенную роль во многих других физиологических процессах, имеющих важное значение прежде всего с медицинской точки зрения. В соответствии с этим еще одним объектом изобретения является применение одного из предлагаемых в нем замещенных производных 4-аминоциклогексанола, необязательно в виде его рацематов, его чистых стереоизомеров, прежде всего энантиомеров или диастереомеров, либо в виде смесей стереоизомеров, прежде всего энантиомеров или диастереомеров, в любом их соотношении в смеси, в представленном виде или в виде его кислот или его оснований либо в виде его солей, прежде всего физиологически совместимых солей, или в виде его сольватов, прежде всего гидратов, для получения лекарственного средства, предназначенного для лечения состояний страха, стресса и связанных с ним синдромов, депрессий, эпилепсии, болезни Альцгеймера, старческого слабоумия, общих нарушений познавательной способности (когнитивных дисфункций), нарушений обучаемости и памяти (в качестве ноотропного средства), абстиненции (синдрома отмены), злоупотребления алкоголем, и/или наркотиками, и/или медикаментами, и/или алкогольной, и/или наркотической, и/или медикаментозной зависимости, половых расстройств, сердечно-сосудистых заболеваний, гипотензии, гипертензии, ощущения шума в ушах, зуда, мигрени, тугоухости, недостаточной перистальтики кишечника, нарушений усвояемости пищи, анорексии, ожирения, нарушений локомоторных функций, диареи, кахексии, недержания мочи, соответственно в качестве миорелаксанта, противосудорожного средства, противокашлевого средства или анестетика, соответственно для совместного введения в организм при лечении опиодным анальгетиком или анестетиком, для диуреза или антинатрийуреза и/или анксиолиза. При этом в одном из вариантов рассмотренного выше применения может оказаться предпочтительным использовать замещенное производное 4-аминоциклогексанола в виде чистого диастереомера и/или энантиомера, в виде рацемата или в виде неэквимолярной либо эквимолярной смеси диастереомеров и/или энантиомеров и/или наряду с замещенным производным 4-аминоциклогексанола использовать также опиоид, предпочтительно сильнодействующий опиоид, прежде всего морфин, либо анестетик, предпочтительно гексобарбитал или галотан. Еще одним объектом настоящего изобретения является способ лечения, прежде всего при наличии симптомов одного из описанных выше заболеваний или болезненных состояний, млекопитающего или человека, которое, соответственно который нуждается в лечении болей, прежде всего хронических болей, заключающийся во введении в организм в терапевтически эффективной дозе предлагаемого в изобретении замещенного производного 4-аминоциклогексанола или предлагаемого в изобретении лекарственного средства. Следующим объектом изобретения является способ получения предлагаемых в нем замещенных производных 4-аминоциклогексанола, более подробно рассмотренный в последующем описании и примерах. При этом предлагаемые в изобретении соединения наиболее целесообразно получать способом, который заключается в том, что а) защищенный группами S1 и S2 циклогексан-1,4-дион формулы II подвергают в присутствии соединения формулы HNR01R02 взаимодействию с цианидом, предпочтительно цианидом калия, с получением защищенного N-замещенного производного 1-амино-4-оксоциклогексанкарбонитрила формулы III после чего при необходимости в любой последовательности и при необходимости неоднократно проводят ацилирование, алкилирование или сульфирование и/или в случае соединений, в которых R01, и/или R02, и/или R06 обозначают защищенный защитной группой Н, по меньшей мере однократно отщепляют защитную группу и при необходимости проводят ацилирование, алкилирование или сульфирование и/или в случае соединений, в которых R01, и/или R02, и/или R06 обозначают Н, по меньшей мере однократно вводят защитную группу и при необходимости проводят ацилирование, алкилирование или сульфирование, б) аминонитрил формулы III подвергают взаимодействию с металлоорганическими реагентами, предпочтительно с реактивом Гриньяра или литийорганическими реагентами, формулы металл-R3 с образованием соединения формулы IVa после чего при необходимости в любой последовательности и при необходимости неоднократно проводят ацилирование, алкилирование или сульфирование и/или в случае соединений, в которых R01, и/или R02, и/или R06 обозначают защищенный защитной группой Н, по меньшей мере однократно отщепляют защитную группу и при необходимости проводят ацилирование, алкилирование или сульфирование и/или в случае соединений, в которых R01, и/или R02, и/или R06 обозначают Н, по меньшей мере однократно вводят защитную группу и при необходимости проводят ацилирование, алкилирование или сульфирование, в) в соединении формулы IVa, полученном из соединения формулы III, отщепляют защитные группы S1 и S2 с образованием 4-замещенного производного 4-аминоциклогексанона формулы IV после чего при необходимости в любой последовательности и при необходимости неоднократно проводят ацилирование, алкилирование или сульфирование и/или в случае соединений, в которых R01, и/или R02, и/или R06 обозначают защищенный защитной группой Н, по меньшей мере однократно отщепляют защитную группу и при необходимости проводят ацилирование, алкилирование или сульфирование и/или в случае соединений, в которых R01, и/или R02, и/или R06 обозначают Н, по меньшей мере однократно вводят защитную группу и при необходимости проводят ацилирование, алкилирование или сульфирование, г) 4-замещенное производное 4-аминоциклогексанона формулы IV подвергают взаимодействию с металлоорганическими реагентами, предпочтительно с реактивом Гриньяра или литийорганическими реагентами, формулы металл-R4 с образованием соединения формулы V после чего при необходимости в любой последовательности и при необходимости неоднократно проводят ацилирование, алкилирование или сульфирование и/или в случае соединений, в которых R01, и/или R02, и/или R04, и/или R05, и/или R06 обозначают защищенный защитной группой Н, по меньшей мере однократно отщепляют защитную группу и при необходимости проводят ацилирование, алкилирование или сульфирование и/или в случае соединений, в которых R01, и/или R02, и/или R04, и/или R05, и/или R06 обозначают Н, по меньшей мере однократно вводят защитную группу и при необходимости проводят ацилирование, алкилирование или сульфирование до образования соединения формулы I, при этом R1, R2, R3, R4 и R5 имеют указанные выше значения, а R01 и R02 независимо друг от друга обозначают Н, защищенный защитной группой Н или С1-8алкил либо С3-8циклоалкил, каждый из которых является насыщенным либо ненасыщенным, разветвленным либо неразветвленным, одно- либо многозамещенным или незамещенным, арил либо гетероарил, каждый из которых является одно- либо многозамещенным или незамещенным, или присоединенный через C1-3алкилен арил, С3-8циклоалкил либо гетероарил, каждый из которых является одно- либо многозамещенным или незамещенным, или остатки R01 и R02 совместно образуют кольцо и обозначают СН2СН2ОСН2СН2, CH2CH2NR05CH2CH2 или (СН2)3-6, где R05 обозначает Н, защищенный защитной группой Н или С1-8алкил либо С3-8циклоалкил, каждый из которых является насыщенным либо ненасыщенным, разветвленным либо неразветвленным, одно- либо многозамещенным или незамещенным, арил либо гетероарил, каждый из которых является одно- либо многозамещенным или незамещенным, или присоединенный через C1-3алкилен арил, С3-8циклоалкил либо гетероарил, каждый из которых является одно- либо многозамещенным или незамещенным, R04 обозначает Н, защищенный защитной группой Н или С3-8циклоалкил, арил либо гетероарил, каждый из которых является незамещенным или одно- либо многозамещенным, -CHR6R7, -CHR6-CH2R7, -CHR6-CH2-CH2R7, -CHR6-CH2-СН2-СН2R7, -C(Y)R7, -C(Y)-CH2R7, -C(Y)-CH2-CH2R7, -C(Y)-CH2-CH2-CH2R7 или -R8-L-R9, где Y представляет собой О, S или Н2, R6 представляет собой Н, С1-7алкил, который является насыщенным либо ненасыщенным, разветвленным либо неразветвленным, одно- либо многозамещенным или незамещенным, или С(O)O-С1-6алкил, который является насыщенным либо ненасыщенным, разветвленным либо неразветвленным, одно- либо многозамещенным или незамещенным, R7 представляет собой Н или С3-8циклоалкил, арил либо гетероарил, каждый из которых является незамещенным или одно- либо многозамещенным, R8 представляет собой арил либо гетероарил, каждый из которых является незамещенным или одно- либо многозамещенным, L представляет собой -C(O)-NH-, -NH-C(O)-, -C(O)-O-, -О-С(О)-, -O-, -S- или -S(O)2– и R9 представляет собой арил либо гетероарил, каждый из которых является незамещенным или одно- либо многозамещенным, и S1 и S2 независимо друг от друга представляют собой защитные группы или совместно представляют собой защитную группу, предпочтительно моноацеталь. В описанном выше наиболее целесообразном способе получения предлагаемых в изобретении соединений защитные группы у атома Н, значения которого имеют R01, R02, R04, R05 и/или R06, предпочтительно выбирать из алкила, бензила и карбаматов, например FMOC, Z и Boc. Ниже изобретение проиллюстрировано на примерах, которые не ограничивают его объем. Примеры В приведенных ниже примерах представлены предлагаемые в изобретении соединения, а также описано их получение и рассмотрены проводимые с их использованием исследования по определению их эффективности. Для всех примеров справедливы следующие общие пояснения. Используемые химикаты и растворители приобретали у традиционно предлагающих их к продаже производителей (Acros, Avocado, Aldrich, Fluka, Lancaster, Maybridge, Merck, Sigma, TCI и т.п.) или же их синтезировали собственными силами. Характеристики соединений определяли путем их анализа ЯМР-спектроскопией, необязательно в сочетании с другими аналитическими методами, такими как тонкослойная хроматография, масс-спектроскопия или ЖХВР. Пример 1 Общий возможный способ получения предлагаемых в изобретении соединений Предлагаемые в изобретении соединения получают исходя из соответствующим образом защищенного, например моноацеталем, циклогексан-1,4-диона формулы II. Его взаимодействием с цианидом калия в присутствии вторичного амина получают защищенное N-замещенное производное 1 -амино-4-оксоциклогексанкарбонитрила формулы III При взаимодействии аминонитрила формулы III с металлоорганическими реагентами, предпочтительно с реактивом Гриньяра или литийорганическими реагентами, происходит замещение нитрильной функции, в результате чего при последующем отщеплении карбонильной защитной группы получают 4-замещенное производное 4-аминоциклогексанона формулы IV Промежуточные соединения формулы IV можно затем их взаимодействием с металлоорганическими реагентами, предпочтительно с реактивом Гриньяра или литийорганическими реагентами, перевести в предлагаемые в изобретении производные 4-аминоциклогексанола формулы I Пример 2: Определение связывания с ORL1-рецептором Производные 4-аминоциклогексанола общей формулы I исследовали в опыте по связыванию с рецептором с использованием 3Н-ноцицептина/орфанина FQ и мембран рекомбинантных клеток CHO-ORL1. Этот эксперимент проводили по методу, описанному у Ardati и др. (Mol. Pharmacol., 51, 1997, cc.816-824). 3Н-ноцицептин/орфанин FQ использовали в этих опытах в концентрации 0,5нМ. При проведении анализов по связыванию с рецептором протеин клеточной мембраны использовали из расчета по 20 мкг на 200 мкл смеси, содержавшей 50 мМ Hepes (N-2-гидроксиэтилпиперазин-N’-2-этансульфоновая кислота) с рН 7,4, 10 мМ MgCl2 и 1 мМ ЭДТК. Связывание с ORL1-рецептором определяли добавлением к каждому анализируемому образцу по 1 мг покрытых агглютинином из проростков пшеницы шариков для SPA-анализа (Scintillation Proximity Assay) (фирма Amersham-Pharmacia, Фрейбург), инкубацией смеси в течение часа при комнатной температуре и проведением последующих измерений в сцинтилляционном счетчике типа Trilux (фирма Wallac, Финляндия). Мерой аффинности служит значение Ki (константа ингибирования).
Пример 3: Проверка анальгетического действия в опыте с отдергиванием хвоста на мышах Анальгетическую эффективность предлагаемых в изобретении соединений исследовали в опыте со сфокусированным лучом (с отдергиванием хвоста) на мышах по методу, описанному у D’Amour и Smith (J. Pharm. Exp. Ther. 72, 1941, cc.74-79). В исследованиях использовали мышей линии NMRI весом 20-24 г. Каждое из животных по отдельности помещали в специальные клетки для опытов и на основание хвоста направляли сфокусированный тепловой луч от электрической лампы (Tail-flick-Typ 50/08/1.be, Labtec, Dr. Hess). Интенсивность испускаемого лампой излучения настраивали с таким расчетом, чтобы промежуток времени, проходящего с момента включения лампы до момента внезапного отдергивания хвоста (латентный период развития боли), составлял у необработанных животных от 3 до 5 с. Подобные предварительные опыты с мышами проводили дважды в течение пяти минут до введения им предлагаемого в изобретении соединения и полученное при этих измерениях среднее значение рассчитывали как среднее значение предварительного опыта. Измерения по определению периода времени, проходящего до момента появления реакции (отдергивание хвоста) на болевой раздражитель (тепловой луч), проводили соответственно через 20, 40 и 60 мин после внутривенного введения мышам исследуемого соединения. Анальгетическое действие рассчитывали как увеличение продолжительности латентного периода развития боли (% максимально допустимой продолжительности облучения (МДПО)) по следующей формуле: [(T1-T0)/(T2-T0)]×100. В этой формуле время Т0 обозначает длительность латентного периода до введения исследуемого вещества, время T1 обозначает длительность латентного периода после введения исследуемого вещества, а время Т2 обозначает максимальную длительность воздействия тепловым лучом (равную 12 с). Для определения зависимости действия от дозы каждое из исследуемых предлагаемых в изобретении соединений вводили животным в 3-5-ти логарифмически возрастающих дозах, включая в каждом случае пороговую и максимальную эффективную дозы, и с помощью регрессионного анализа определяли значения ED50. Значения ED50 рассчитывали в момент максимального действия, наступающего через 20 мин после внутривенного введения исследуемого вещества. Предлагаемые в изобретении соединения, которые использовали в этих исследованиях, проявляли выраженное анальгетическое действие. Полученные результаты представлены в приведенной ниже таблице.
Пример 4: Гидрохлорид 4-бензил-4-диметиламино-1-фенетилциклогексанола К 200 г 1,4-диоксаспиро[4.5]декан-8-она последовательно добавляли 1,68 л водного раствора диметиламина (40 об.%), 200 мл метанола, 200 г цианида калия и 303 г гидрохлорида диметиламина и реакционную смесь в течение 65 ч перемешивали при комнатной температуре. Полученную белую суспензию четырежды экстрагировали диэтиловым эфиром порциями по 800 мл, объединенные экстракты сначала концентрировали, а затем растворяли в 500 мл дихлорметана, органическую фазу отделяли, сушили над сульфатом натрия, фильтровали, концентрировали и остаточное количество растворителя практически полностью удаляли в вакууме. Таким путем получили 265 г 8-диметиламино-1,4-диоксаспиро[4.5]декан-8-карбонитрила в виде белого твердого вещества. 50 г 8-диметиламино-1,4-диоксаспиро[4.5]декан-8-карбонитрила растворяли в 400 мл тетрагидрофурана (ТГФ) аналитической степени чистоты (а.с.ч.), в атмосфере азота добавляли 214 мл 2,0-молярного раствора бензилмагнийхлорида в ТГФ и перемешивали в течение ночи при комнатной температуре. Для переработки при охлаждении льдом добавляли 200 мл насыщенного раствора хлорида аммония, фазы разделяли, водную фазу дважды экстрагировали диэтиловым эфиром порциями по 250 мл, объединенные органические фазы сушили над сульфатом натрия, фильтровали, концентрировали и остаточное количество растворителя практически полностью удаляли в вакууме. Полученный сырой (8-бензил-1,4-диоксаспиро[4.5]дец-8-ил)диметиламин (78,4 г) без последующей очистки перемешивали в течение 24 ч при комнатной температуре в смеси из 200 мл конц. соляной кислоты (32 мас.%) и 120 мл воды. После этого реакционную смесь сначала трижды промывали диэтиловым эфиром порциями по 100 мл, затем при охлаждении льдом подщелачивали добавлением раствора едкого натра (32 мас.%), трижды экстрагировали дихлорметаном порциями по 100 мл, объединенные дихлорметановые экстракты сушили над сульфатом натрия, фильтровали, концентрировали и остаточное количество растворителя практически полностью удаляли в вакууме. Таким путем получили 50,4 г 4-бензил-4-диметиламиноциклогексанона в виде коричневатого твердого вещества. 25,0 г 4-бензил-4-диметиламиноциклогексанона растворяли в 150 мл тетрагидрофурана а.с.ч., при охлаждении на ледяной бане добавляли в атмосфере азота 151 мл 1,0-молярного раствора фенетилмагнийхлорида в ТГФ и перемешивали в течение ночи при комнатной температуре. Для переработки при охлаждении льдом добавляли 150 мл раствора хлорида аммония (20 мас.%), фазы разделяли, водную фазу трижды экстрагировали диэтиловым эфиром порциями по 80 мл, объединенные органические фазы трижды экстрагировали разбавленной соляной кислотой (5 мас.%) порциями по 70 мл, объединенные водные экстракты промывали 50 мл диэтилового эфира, значение рН устанавливали на 9 с помощью раствора аммиака (25 мас.%), трижды экстрагировали дихлорметаном порциями по 80 мл, объединенные дихлорметановые экстракты сушили над сульфатом натрия, фильтровали, концентрировали и остаточное количество растворителя практически полностью удаляли в вакууме. Полученный сырой продукт (32,6 г) хроматографировали на силикагеле с использованием смеси диэтиловый эфир/гексан (в объемном соотношении 1:1). 3,5 г полученного неполярного диастереомера 4-бензил-4-диметиламино-1-фенетилциклогексанола растворяли в 28 мл 2-бутанона, после чего при комнатной температуре добавляли 103 мкл воды, а затем 1,44 мл триметилхлорсилана и перемешивали в течение ночи при комнатной температуре. Выпавшее в осадок белое твердое вещество отделяли вакуум-фильтрацией, промывали диэтиловым эфиром и сушили в вакууме, создаваемом масляным насосом. Таким путем получили 2,47 г гидрохлорида неполярного диастереомера 4-бензил-4-диметиламино-1 -фенетилциклогексанола. Пример 5: Гидрохлорид 4-диметиламино-1,4-дифенетилциклогексанола 45 г 8-диметиламино-1,4-диоксаспиро[4.5]декан-8-карбонитрила растворяли в 250 мл тетрагидрофурана а.с.ч., в атмосфере азота добавляли 238 мл 1,0-молярного раствора фенетилмагнийхлорида в ТГФ и перемешивали в течение ночи при комнатной температуре. Для переработки при охлаждении льдом добавляли 100 мл раствора хлорида аммония (20 мас.%), фазы разделяли, водную фазу дважды экстрагировали диэтиловым эфиром порциями по 200 мл, объединенные органические фазы последовательно промывали 100 мл воды и 100 мл насыщенного раствора хлорида натрия, сушили над сульфатом натрия, фильтровали, концентрировали и остаточное количество растворителя практически полностью удаляли в вакууме. Полученный в виде желтого масла сырой диметил(8-фенетил-1,4-диоксаспиро[4.5]дец-8-ил)амин (54,1 г) без последующей очистки в течение 24 ч перемешивали при комнатной температуре в смеси из 120 мл конц. соляной кислоты (32 мас.%) и 70 мл воды. После этого реакционную смесь сначала трижды промывали диэтиловым эфиром порциями по 50 мл, а затем при охлаждении льдом подщелачивали добавлением раствора едкого натра (32 мас.%), трижды экстрагировали дихлорметаном порциями по 100 мл, объединенные дихлорметановые экстракты сушили над сульфатом натрия, фильтровали, концентрировали и остаточное количество растворителя практически полностью удаляли в вакууме. Таким путем получили 35,7 г сырого 4-диметиламино-4-фенетилциклогексанона в виде медленно кристаллизующегося коричневого масла. 7,58 г 4-диметиламино-4-фенетилциклогексанона растворяли в 45 мл тетрагидрофурана а.с.ч., при охлаждении на ледяной бане в атмосфере азота добавляли 43 мл 1,0-молярного раствора фенетилмагнийхлорида в ТГФ и перемешивали в течение ночи при комнатной температуре. Для переработки при охлаждении льдом добавляли 43 мл раствора хлорида аммония (20 мас.%) и трижды экстрагировали диэтиловым эфиром порциями по 80 мл, после чего объединенные органические фазы трижды экстрагировали разбавленной соляной кислотой (5 мас.%) порциями по 70 мл, объединенные водные экстракты промывали 50 мл диэтилового эфира, значение рН устанавливали на 9 с помощью раствора аммиака (25 мас.%), трижды экстрагировали дихлорметаном порциями по 80 мл, объединенные дихлорметановые экстракты сушили над сульфатом натрия, фильтровали, концентрировали и остаточное количество растворителя практически полностью удаляли в вакууме. Полученный сырой продукт (9,57 г) хроматографировали на силикагеле с использованием смеси диэтиловый эфир/гексан (в объемном соотношении 1:1). 938 мг полученного неполярного диастереомера 4-диметиламино-1,4-дифенетилциклогексанола растворяли в 7,5 мл 2-бутанона, при комнатной температуре добавляли 26 мкл воды, а затем 371 мкл триметилхлорсилана и перемешивали в течение ночи при комнатной температуре. Выпавшее в осадок белое твердое вещество отделяли вакуум-фильтрацией, промывали диэтиловым эфиром и сушили в вакууме, создаваемом масляным насосом. Таким путем получили 1,00 г гидрохлорида неполярного диастереомера 4-диметиламино-1,4-дифенетилциклогексанола. Пример 6: Гидрохлорид 4-бензил-4-диметиламино-1-[2-(2-фторфенил)этил]циклогексанола 11,4 г алюмогидрида лития добавляли к 100 мл тетрагидрофурана а.с.ч., в атмосфере азота нагревали с обратным холодильником, по каплям добавляли 50 г 2-фторфенилуксусной кислоты, растворенной в 400 мл тетрагидрофурана а.с.ч., и реакционную смесь нагревали в течение последующих двух часов. Для переработки при охлаждении на ледяной бане по каплям при перемешивании добавляли 72 мл воды, а затем 250 мл полуконцентрированной соляной кислоты (16 мас.%). Далее реакционную смесь дважды экстрагировали диэтиловым эфиром порциями по 250 мл, объединенные экстракты дважды промывали раствором гидрокарбоната натрия (5 мас.%) порциями по 100 мл, сушили над сульфатом натрия, фильтровали, концентрировали и остаточное количество растворителя практически полностью удаляли в вакууме. Таким путем получили 40,2 г 2-(2-фторфенил)этанола. 50 г 2-(2-фторфенил)этанола, 19 мл концентрированной серной кислоты и 58 мл водной бромистоводородной кислоты (47 мас.%) нагревали в автоклаве из нержавеющей стали до 100°С и выдерживали при этой температуре в течение ночи. После охлаждения разбавляли 500 мл воды, дважды экстрагировали дихлорметаном порциями по 250 мл, объединенные экстракты сушили над карбонатом калия, фильтровали, концентрировали и остаточное количество растворителя практически полностью удаляли в вакууме. Таким путем получили 61,8 г 1-(2-бромэтил)-2-фторбензола. 624 мг магния перемешивали в атмосфере азота в 13 мл тетрагидрофурана а.с.ч. и затем добавляли примерно треть раствора 4,69 г 1-(2-бромэтил)-2-фторбензола в 13 мл тетрагидрофурана а.с.ч. Остальной раствор непрерывно добавляли по каплям после начала образования реактива Гриньяра, по завершении добавления перемешивали в течение часа, после чего по каплям добавляли 2,97 г 4-бензил-4-диметиламиноциклогексанона, растворенного в 13 мл тетрагидрофурана а.с.ч., и реакционную смесь перемешивали в течение ночи. Для переработки при охлаждении льдом добавляли 26 мл раствора хлорида аммония (20 мас.%), фазы разделяли, водную фазу дважды экстрагировали диэтиловым эфиром порциями по 40 мл, объединенные органические фазы промывали 50 мл воды, трижды экстрагировали разбавленной соляной кислотой (5 мас.%) порциями по 40 мл, объединенные водные экстракты промывали 30 мл диэтилового эфира, значение рН устанавливали на 9 с помощью раствора аммиака (25 мас.%), трижды экстрагировали дихлорметаном порциями по 40 мл, объединенные дихлорметановые экстракты сушили над сульфатом натрия, фильтровали, концентрировали и остаточное количество растворителя практически полностью удаляли в вакууме. Полученный сырой продукт (4,39 г) хроматографировали на силикагеле с использованием смеси диэтиловый эфир/гексан (в объемном соотношении 1:1). Таким путем получили 1,50 г неполярного диастереомера 4-бензил-4-диметиламино-1-[2-(2-фторфенил)этил]циклогексанола, из которого аналогично примеру 4 получили 1,56 г соответствующего гидрохлорида. Пример 7: Гидрохлорид 4-бензил-4-диметиламино-1-[2-(4-фторфенил)этил]циклогексанола Аналогично 1-(2-бромэтил)-2-фторбензолу из 4-фторфенилуксусной кислоты получали 1-(2-бромэтил)-4-фторбензол. 841 мг магния перемешивали в атмосфере азота в 17 мл тетрагидрофурана а.с.ч. и добавляли примерно треть раствора 6,32 г 1-(2-бромэтил)-2-фторбензола в 17 мл тетрагидрофурана а.с.ч. Остальной раствор непрерывно добавляли по каплям после начала образования реактива Гриньяра, по завершении добавления перемешивали в течение часа, после чего по каплям добавляли 4,00 г 4-бензил-4-диметиламиноциклогексанона, растворенного в 17 мл тетрагидрофурана а.с.ч., и реакционную смесь перемешивали в течение ночи. Для переработки при охлаждении льдом добавляли 35 мл раствора хлорида аммония (20 мас.%), фазы разделяли, водную фазу дважды экстрагировали диэтиловым эфиром порциями по 40 мл, объединенные органические фазы промывали 50 мл воды, трижды экстрагировали разбавленной соляной кислотой (5 мас.%) порциями по 40 мл, объединенные водные экстракты промывали 30 мл диэтилового эфира, значение рН устанавливали на 9 с помощью раствора аммиака (25 мас.%), трижды экстрагировали дихлорметаном порциями по 40 мл, объединенные дихлорметановые экстракты сушили над сульфатом натрия, фильтровали, концентрировали и остаточное количество растворителя практически полностью удаляли в вакууме. Полученный сырой продукт (4,39 г) хроматографировали на силикагеле. Таким путем получили 1,08 г неполярного диастереомера 4-бензил-4-диметиламино-1 -[2-(4-фторфенил)этил]циклогексанола, из которого аналогично примеру 4 получили 1,10 г соответствующего гидрохлорида. Пример 8: Гидрохлорид 4-диметиламино-4-(2-фторбензил)-1-фенетилциклогексанола 1,16 г магния перемешивали в атмосфере азота в 20 мл диэтилового эфира а.с.ч. и добавляли примерно треть раствора 6,19 г 2-фторбензилхлорида в 25 мл диэтилового эфира а.с.ч. Остальной раствор непрерывно добавляли по каплям после начала образования реактива Гриньяра, по завершении добавления перемешивали в течение часа, после чего по каплям добавляли раствор 5,00 г 8-диметиламино-1,4-диоксаспиро[4.5]декан-8-карбонитрила в 25 мл диэтилового эфира а.с.ч. и реакционную смесь перемешивали в течение ночи. Для переработки при охлаждении льдом добавляли 36 мл раствора хлорида аммония (20 мас.%), фазы разделяли, водную фазу дважды экстрагировали диэтиловым эфиром порциями по 50 мл и объединенные органические фазы последовательно промывали 20 мл воды и 20 мл насыщенного раствора хлорида натрия. Полученный сырой [8-(2-фторбензил)-1,4-диоксаспиро[4.5]дец-8-ил]диметиламин (7,34 г) без последующей очистки при комнатной температуре перемешивали в течение 24 ч в смеси из 18 мл конц. соляной кислоты (32 мас.%) и 10 мл воды. После этого реакционную смесь сначала трижды промывали диэтиловым эфиром порциями по 50 мл, а затем при охлаждении льдом значение рН устанавливали на 9 добавлением водного аммиака (25 мас.%), трижды экстрагировали дихлорметаном порциями по 50 мл, объединенные дихлорметановые экстракты сушили над сульфатом натрия, фильтровали, концентрировали и остаточное количество растворителя практически полностью удаляли в вакууме. Таким путем получили 5,80 г 4-диметиламино-4-(2-фторбензил)циклогексанона в виде желтого твердого вещества. 5,79 г 4-диметиламино-4-(2-фторбензил)циклогексанона растворяли в 35 мл тетрагидрофурана а.с.ч., при охлаждении на ледяной бане в атмосфере азота добавляли 42 мл 1,0-молярного раствора фенетилмагнийхлорида в ТГФ и перемешивали в течение ночи при комнатной температуре. Для переработки при охлаждении льдом добавляли 42 мл раствора хлорида аммония (20 мас.%), фазы разделяли, водную фазу трижды экстрагировали диэтиловым эфиром порциями по 50 мл, объединенные органические фазы промывали 30 мл воды, трижды экстрагировали разбавленной соляной кислотой (5 мас.%) порциями по 50 мл, объединенные водные экстракты промывали 50 мл диэтилового эфира, значение рН устанавливали на 9 с помощью раствора аммиака (25 мас.%), трижды экстрагировали дихлорметаном порциями по 50 мл, объединенные дихлорметановые экстракты сушили над сульфатом натрия, фильтровали, концентрировали и остаточное количество растворителя практически полностью удаляли в вакууме. Полученный сырой продукт (7,76 г) хроматографировали на силикагеле с использованием смеси диэтиловый эфир/гексан (в объемном соотношении 1:1). Таким путем получили 1,33 г неполярного диастереомера 4-диметиламино-4-(2-фторбензил)-1 -фенетилциклогексанола, из которого аналогично примеру 4 получили 536 мг соответствующего гидрохлорида. Пример 9: Гидрохлорид 4-диметиламино-4-(3-фторбензил)-1-фенетилциклогексанола 925 мг магния перемешивали в атмосфере азота в 19 мл диэтилового эфира а.с.ч. и добавляли примерно треть раствора 4,95 г 3-фторбензилхлорида в 19 мл диэтилового эфира а.с.ч. Остальной раствор непрерывно добавляли по каплям после начала образования реактива Гриньяра, по завершении добавления перемешивали в течение часа, после чего по каплям добавляли раствор 4,00 г 8-диметиламино-1,4-диоксаспиро[4.5]декан-8-карбонитрила в 25 мл диэтилового эфира а.с.ч. и реакционную смесь перемешивали в течение ночи. Для переработки при охлаждении льдом добавляли 29 мл раствора хлорида аммония (20 мас.%), фазы разделяли, водную фазу дважды экстрагировали диэтиловым эфиром порциями по 50 мл и объединенные органические фазы последовательно промывали 20 мл воды и 20 мл насыщенного раствора хлорида натрия. Полученный сырой [8-(3-фторбензил)-1,4-диоксаспиро[4.5]дец-8-ил]диметиламин (5,75 г желтого твердого вещества) без последующей очистки при комнатной температуре перемешивали в течение 24 ч в смеси из 14 мл конц. соляной кислоты (32 мас.%) и 8 мл воды. После этого реакционную смесь сначала трижды промывали диэтиловым эфиром порциями по 30 мл, а затем при охлаждении льдом значение рН устанавливали на 9 добавлением водного аммиака (25 мас.%), трижды экстрагировали дихлорметаном порциями по 40 мл, объединенные дихлорметановые экстракты сушили над сульфатом натрия, фильтровали, концентрировали и остаточное количество растворителя практически полностью удаляли в вакууме. Таким путем получили 4,71 г 4-диметиламино-4-(3-фторбензил)циклогексанона в виде желтого твердого вещества. 4,67 г 4-диметиламино-4-(3-фторбензил)циклогексанона растворяли в 28 мл тетрагидрофурана а.с.ч., при охлаждении на ледяной бане в атмосфере азота добавляли 34 мл 1,0-молярного раствора фенетилмагнийхлорида в ТГФ и перемешивали в течение ночи при комнатной температуре. Для переработки при охлаждении льдом добавляли 34 мл раствора хлорида аммония (20 мас.%), фазы разделяли, водную фазу трижды экстрагировали диэтиловым эфиром порциями по 40 мл, объединенные органические фазы промывали 25 мл воды, трижды экстрагировали разбавленной соляной кислотой (5 мас.%) порциями по 40 мл, объединенные водные экстракты промывали 25 мл диэтилового эфира, значение рН устанавливали на 9 с помощью раствора аммиака (25 мас.%), трижды экстрагировали дихлорметаном порциями по 40 мл, объединенные дихлорметановые экстракты сушили над сульфатом натрия, фильтровали, концентрировали и остаточное количество растворителя практически полностью удаляли в вакууме. Полученный сырой продукт (6,12 г желтой смолы) хроматографировали на силикагеле с использованием смеси диэтиловый эфир/гексан (в объемном соотношении 1:1). Таким путем получили 1,28 г неполярного диастереомера 4-диметиламино-4-(3-фторбензил)-1-фенетилциклогексанола, из которого аналогично примеру 4 получили 1,30 г соответствующего гидрохлорида. Пример 10: Гидрохлорид 4-диметиламино-4-(4-фторбензил)-1-фенетилциклогексанола 925 мг магния перемешивали в атмосфере азота в 19 мл диэтилового эфира а.с.ч. и добавляли примерно треть раствора 4,95 г 4-фторбензилхлорида в 19 мл диэтилового эфира а.с.ч. Остальной раствор непрерывно добавляли по каплям после начала образования реактива Гриньяра, по завершении добавления перемешивали в течение часа, после чего по каплям добавляли раствор 4,00 г 8-диметиламино-1,4-диоксаспиро[4.5]декан-8-карбонитрила в 25 мл диэтилового эфира а.с.ч. и реакционную смесь перемешивали в течение ночи. Для переработки при охлаждении льдом добавляли 29 мл раствора хлорида аммония (20 мас.%), фазы разделяли, водную фазу дважды экстрагировали диэтиловым эфиром порциями по 50 мл и объединенные органические фазы последовательно промывали 20 мл воды и 20 мл насыщенного раствора хлорида натрия. Полученный сырой [8-(4-фторбензил)-1,4-диоксаспиро[4.5]дец-8-ил]диметиламин (5,76 г желтого твердого вещества) без последующей очистки при комнатной температуре перемешивали в течение 24 ч в смеси из 14 мл конц. соляной кислоты (32 мас.%) и 8 мл воды. После этого реакционную смесь сначала трижды промывали диэтиловым эфиром порциями по 30 мл, а затем при охлаждении льдом значение рН устанавливали на 9 добавлением водного аммиака (25 мас.%), трижды экстрагировали дихлорметаном порциями по 40 мл, объединенные дихлорметановые экстракты сушили над сульфатом натрия, фильтровали, концентрировали и остаточное количество растворителя практически полностью удаляли в вакууме. Таким путем получили 4,70 г 4-диметиламино-4-(4-фторбензил)циклогексанона в виде желтого твердого вещества. 4,69 г 4-диметиламино-4-(4-фторбензил)циклогексанона растворяли в 28 мл тетрагидрофурана а.с.ч., при охлаждении на ледяной бане в атмосфере азота добавляли 34 мл 1,0-молярного раствора фенетилмагнийхлорида в ТГФ и в течение ночи перемешивали при комнатной температуре. Для переработки при охлаждении льдом добавляли 34 мл раствора хлорида аммония (20 мас.%), фазы разделяли, водную фазу трижды экстрагировали диэтиловым эфиром порциями по 40 мл, объединенные органические фазы промывали 25 мл воды, трижды экстрагировали разбавленной соляной кислотой (5 мас.%) порциями по 40 мл, объединенные водные экстракты промывали 25 мл диэтилового эфира, значение рН устанавливали на 9 с помощью раствора аммиака (25 мас.%), трижды экстрагировали дихлорметаном порциями по 40 мл, объединенные дихлорметановые экстракты сушили над сульфатом натрия, фильтровали, концентрировали и остаточное количество растворителя практически полностью удаляли в вакууме. Полученный сырой продукт (6,40 г желтой смолы) хроматографировали на силикагеле с использованием смеси диэтиловый эфир/гексан (в объемном соотношении 1:1). Таким путем получили 1,45 г неполярного диастереомера 4-диметиламино-4-(4-фторбензил)-1-фенетилциклогексанола, из которого аналогично примеру 4 получили 1,44 г соответствующего гидрохлорида. Пример 11: Гидрохлорид 4-бензил-4-диметиламино-1-[2-(4-фторфенил)этил]циклогексанола Аналогично 1-(2-бромэтил)-2-фторбензолу из 3-фторфенилуксусной кислоты получали 1-(2-бромэтил)-3-фторбензол. 757 мг магния перемешивали в атмосфере азота в 15 мл тетрагидрофурана а.с.ч. и добавляли примерно треть раствора 5,69 г 1-(2-бромэтил)-3-фторбензола в 16 мл тетрагидрофурана а.с.ч. Остальной раствор непрерывно добавляли по каплям после начала образования реактива Гриньяра, по завершении добавления перемешивали в течение часа, после чего по каплям добавляли 3,60 г 4-бензил-4-диметиламиноциклогексанона, растворенного в 16 мл тетрагидрофурана а.с.ч., и реакционную смесь перемешивали в течение ночи. Для переработки при охлаждении льдом добавляли 31 мл раствора хлорида аммония (20 мас.%), фазы разделяли, водную фазу дважды экстрагировали диэтиловым эфиром порциями по 40 мл, объединенные органические фазы промывали 30 мл воды, трижды экстрагировали разбавленной соляной кислотой (5 мас.%) порциями по 40 мл, объединенные водные экстракты промывали 30 мл диэтилового эфира, значение рН устанавливали на 9 с помощью раствора аммиака (25 мас.%), трижды экстрагировали дихлорметаном порциями по 40 мл, объединенные дихлорметановые экстракты сушили над сульфатом натрия, фильтровали, концентрировали и остаточное количество растворителя практически полностью удаляли в вакууме. Полученный сырой продукт (3,96 г) хроматографировали на силикагеле с использованием смеси диэтиловый эфир/гексан (в объемном соотношении 1:1). Таким путем получили 301 мг неполярного диастереомера 4-бензил-4-диметиламино-1-[2-(4-фторфенил)этил]циклогексанола, из которого аналогично примеру 4 получили 254 мг соответствующего гидрохлорида. Пример 12: Гидрохлорид 4-бензил-4-диметиламино-1-(2-фторбензил)циклогексанола 757 мг магния перемешивали в атмосфере азота в 15 мл диэтилового эфира а.с.ч. и добавляли примерно треть раствора 4,05 г 2-фторбензилхлорида в 15 мл диэтилового эфира а.с.ч. Остальной раствор непрерывно добавляли по каплям после начала образования реактива Гриньяра, по завершении добавления перемешивали в течение часа, после чего по каплям добавляли 3,60 г 4-бензил-4-диметиламиноциклогексанона, растворенного в 40 мл диэтилового эфира а.с.ч., и реакционную смесь перемешивали в течение ночи. Для переработки при охлаждении льдом добавляли 31 мл раствора хлорида аммония (20 мас.%), фазы разделяли, водную фазу дважды экстрагировали диэтиловым эфиром порциями по 40 мл, объединенные органические фазы промывали 30 мл воды, трижды экстрагировали разбавленной соляной кислотой (5 мас.%) порциями по 40 мл, объединенные водные экстракты промывали 30 мл диэтилового эфира, значение рН устанавливали на 9 с помощью раствора аммиака (25 мас.%), трижды экстрагировали дихлорметаном порциями по 40 мл, объединенные дихлорметановые экстракты сушили над сульфатом натрия, фильтровали, концентрировали и остаточное количество растворителя практически полностью удаляли в вакууме. Полученный сырой продукт (5,02 г) хроматографировали на силикагеле с использованием смеси диэтиловый эфир/гексан (в объемном соотношении 1:1). Таким путем получили 2,44 г неполярного диастереомера 4-бензил-4-диметиламино-1-(2-фторбензил)циклогексанола, из которого аналогично примеру 4 получили 2,53 г соответствующего гидрохлорида. Пример 13: Гидрохлорид 4-(аллилметиламино)-4-бензил-1-фенетилциклогексанола Смесь из 9 мл воды, 5,3 мл соляной кислоты (32 мас.%), 8 мл метанола, 17,5 г аллилметиламина, 8,00 г 1,4-диоксаспиро[4.5]декан-8-она и 8,0 г цианида калия перемешивали при комнатной температуре в течение 65 ч. Полученную желтовато-белую суспензию четырежды экстрагировали диэтиловым эфиром порциями по 25 мл, объединенные экстракты сушили над сульфатом натрия, фильтровали, концентрировали и остаточное количество растворителя практически полностью удаляли в вакууме. Таким путем получили 11,3 г 8-(аллилметиламино)-1,4-диоксаспиро[4.5]декан-8-карбонитрила в виде светло-коричневой жидкости. К 14,8 мл 2,0-молярного раствора бензилмагнийхлорида в ТГФ в атмосфере азота по каплям добавляли раствор 3,50 г 8-(аллилметиламино)-1,4-диоксаспиро[4.5]декан-8-карбонитрила в 35 мл тетрагидрофурана а.с.ч. и в течение ночи перемешивали при комнатной температуре. Для переработки при охлаждении льдом добавляли 25 мл насыщенного раствора хлорида аммония, фазы разделяли, водную фазу трижды экстрагировали диэтиловым эфиром порциями по 25 мл, объединенные органические фазы сушили над сульфатом натрия, фильтровали, концентрировали и остаточное количество растворителя практически полностью удаляли в вакууме. Полученный сырой аллил(8-бензил-1,4-диоксаспиро[4.5]дец-8-ил)метиламин (5,41 г) без последующей очистки при комнатной температуре перемешивали в течение 24 ч в смеси из 13 мл конц. соляной кислоты (32 мас.%) и 7,5 мл воды. После этого реакционную смесь сначала трижды промывали диэтиловым эфиром порциями по 50 мл, а затем при охлаждении льдом подщелачивали добавлением раствора едкого натра (32 мас.%), трижды экстрагировали дихлорметаном порциями по 100 мл, объединенные дихлорметановые экстракты сушили над сульфатом натрия, фильтровали, концентрировали и остаточное количество растворителя практически полностью удаляли в вакууме. Таким путем получили 3,55 г 4-(аллилметиламино)-4-бензилциклогексанона. К 14,8 мл 1,0-молярного раствора фенетилмагнийхлорида в ТГФ в атмосфере азота по каплям добавляли раствор 3,50 г 4-(аллилметиламино)-4-бензилциклогексанона в 21 мл тетрагидрофурана а.с.ч. и в течение ночи перемешивали при комнатной температуре. Для переработки при охлаждении льдом добавляли 19 мл раствора хлорида аммония (20 мас.%), фазы разделяли, водную фазу трижды экстрагировали диэтиловым эфиром порциями по 20 мл, объединенные органические фазы промывали 20 мл воды, трижды экстрагировали разбавленной соляной кислотой (5 мас.%) порциями по 20 мл, объединенные водные экстракты промывали 20 мл диэтилового эфира, значение рН устанавливали на 9 с помощью раствора аммиака (25 мас.%), трижды экстрагировали дихлорметаном порциями по 50 мл, объединенные дихлорметановые экстракты сушили над сульфатом натрия, фильтровали, концентрировали и остаточное количество растворителя практически полностью удаляли в вакууме. Полученный сырой продукт (4,00 г коричневой смолы) хроматографировали на силикагеле с использованием смеси диэтиловый эфир/гексан (в объемном соотношении 1:1). Таким путем получили 2,04 г неполярного диастереомера 4-(аллилметиламино)-4-бензил-1-фенетилциклогексанола, из которого аналогично примеру 4 получили 807 мг соответствующего гидрохлорида. Пример 14: Гидрохлорид 4-бензил-4-диметиламино-1-(3-фторбензил)циклогексанола 757 мг магния перемешивали в атмосфере азота в 15 мл диэтилового эфира а.с.ч. и добавляли примерно треть раствора 4,05 г 3-фторбензилхлорида в 15 мл диэтилового эфира а.с.ч. Остальной раствор непрерывно добавляли по каплям после начала образования реактива Гриньяра, по завершении добавления перемешивали в течение часа, после чего по каплям добавляли 3,60 г 4-бензил-4-диметиламиноциклогексанона, растворенного в 30 мл диэтилового эфира а.с.ч., и реакционную смесь перемешивали в течение ночи. Для переработки при охлаждении льдом добавляли 31 мл раствора хлорида аммония (20 мас.%), фазы разделяли, водную фазу дважды экстрагировали диэтиловым эфиром порциями по 40 мл, объединенные органические фазы промывали 20 мл воды, трижды экстрагировали разбавленной соляной кислотой (5 мас.%) порциями по 40 мл, объединенные водные экстракты промывали 30 мл диэтилового эфира, значение рН устанавливали на 9 с помощью раствора аммиака (25 мас.%), трижды экстрагировали дихлорметаном порциями по 40 мл, объединенные дихлорметановые экстракты сушили над сульфатом натрия, фильтровали, концентрировали и остаточное количество растворителя практически полностью удаляли в вакууме. Полученный сырой продукт (4,91 г желтой смолы) хроматографировали на силикагеле с использованием смеси диэтиловый эфир/гексан (в объемном соотношении 1:1). Таким путем получили 1,93 г неполярного диастереомера 4-бензил-4-диметиламино-1-(3-фторбензил)циклогексанола в виде белого твердого вещества, из которого аналогично примеру 4 получили 2,09 г соответствующего гидрохлорида. Пример 15: Гидрохлорид 4-бензил-4-диметиламино-1-(4-фторбензил)циклогексанола 757 мг магния перемешивали в атмосфере азота в 15 мл диэтилового эфира а.с.ч. и добавляли примерно треть раствора 4,05 г 4-фторбензилхлорида в 15 мл диэтилового эфира а.с.ч. Остальной раствор непрерывно добавляли по каплям после начала образования реактива Гриньяра, по завершении добавления перемешивали в течение часа, после чего по каплям добавляли 3,60 г 4-бензил-4-диметиламиноциклогексанона, растворенного в 30 мл диэтилового эфира а.с.ч., и реакционную смесь перемешивали в течение ночи. Для переработки при охлаждении льдом добавляли 31 мл раствора хлорида аммония (20 мас.%), фазы разделяли, водную фазу дважды экстрагировали диэтиловым эфиром порциями по 40 мл, объединенные органические фазы промывали 20 мл воды, трижды экстрагировали разбавленной соляной кислотой (5 мас.%) порциями по 40 мл, объединенные водные экстракты промывали 30 мл диэтилового эфира, значение рН устанавливали на 9 с помощью раствора аммиака (25 мас.%), трижды экстрагировали дихлорметаном порциями по 40 мл, объединенные дихлорметановые экстракты сушили над сульфатом натрия, фильтровали, концентрировали и остаточное количество растворителя практически полностью удаляли в вакууме. Полученный сырой продукт (5,08 г желтой смолы) хроматографировали на силикагеле с использованием смеси диэтиловый эфир/гексан (в объемном соотношении 1:1). Таким путем получили 2,24 г неполярного диастереомера 4-бензил-4-диметиламино-1-(4-фторбензил)циклогексанола в виде белого твердого вещества, из которого аналогично примеру 4 получили 2,32 г соответствующего гидрохлорида. Пример 16: Гидрохлорид 1-бензил-4-диметиламино-4-(3-фторбензил)циклогексанола 925 мг магния перемешивали в атмосфере азота в 19 мл диэтилового эфира а.с.ч. и добавляли примерно треть раствора 4,95 г 3-фторбензилхлорида в 19 мл диэтилового эфира а.с.ч. Остальной раствор непрерывно добавляли по каплям после начала образования реактива Гриньяра, по завершении добавления перемешивали в течение часа, после чего по каплям добавляли раствор 4,00 г 8-диметиламино-1,4-диоксаспиро[4.5]декан-8-карбонитрила в 25 мл диэтилового эфира а.с.ч. и реакционную смесь перемешивали в течение ночи. Для переработки при охлаждении льдом добавляли 29 мл раствора хлорида аммония (20 мас.%), фазы разделяли, водную фазу дважды экстрагировали диэтиловым эфиром порциями по 50 мл и объединенные органические фазы последовательно промывали 20 мл воды и 20 мл насыщенного раствора хлорида натрия. Полученный сырой [8-(3-фторбензил)-1,4-диоксаспиро[4.5]дец-8-ил]диметиламин (5,75 г желтого твердого вещества) без последующей очистки при комнатной температуре перемешивали в течение 24 ч в смеси из 14 мл конц. соляной кислоты (32 мас.%) и 8 мл воды. После этого реакционную смесь сначала трижды промывали диэтиловым эфиром порциями по 30 мл, а затем при охлаждении льдом значение рН устанавливали на 9 добавлением водного аммиака (25 мас.%), трижды экстрагировали дихлорметаном порциями по 40 мл, объединенные дихлорметановые экстракты сушили над сульфатом натрия, фильтровали, концентрировали и остаточное количество растворителя практически полностью удаляли в вакууме. Таким путем получили 4,71 г 4-диметиламино-4-(3-фторбензил)циклогексанона в виде желтого твердого вещества. 4,67 г 4-диметиламино-4-(3-фторбензил)циклогексанона аналогично получению 4-диметиламино-4-(4-фторбензил)-1 -фенетилциклогексанола подвергали взаимодействию с 1,0-молярным раствором бензилмагнийхлорида в ТГФ. После хроматографии на силикагеле полученный неполярный диастереомер 1-бензил-4-диметиламино-4-(3-фторбензил)циклогексанола аналогично примеру 4 переводили в соответствующий гидрохлорид с выходом 261 мг. Пример 17: Гидрохлорид 4-бензил-1-фенетил-4-пирролидин-1-илциклогексанола Смесь из 55 мл воды, 33 мл соляной кислоты (32 мас.%), 50 мл метанола, 127 мл пирролидина, 50,0 г 1,4-диоксаспиро[4.5]декан-8-она и 50,0 г цианида калия перемешивали в течение 65 ч при комнатной температуре. Полученную светло-коричневую суспензию четырежды экстрагировали диэтиловым эфиром порциями по 50 мл, объединенные экстракты сушили над сульфатом натрия, фильтровали, концентрировали и остаточное количество растворителя практически полностью удаляли в вакууме. Таким путем получили 76,7 г 8-пирролидин-1-ил-1,4-диоксаспиро[4.5]декан-8-карбонитрила в виде светло-коричневой жидкости. К 127 мл 2,0-молярного раствора бензилмагнийхлорида в ТГФ в атмосфере азота по каплям добавляли раствор 40,0 г 8-пирролидин-1-ил-1,4-диоксаспиро[4.5]декан-8-карбонитрила в 150 мл тетрагидрофурана а.с.ч. и в течение ночи перемешивали при комнатной температуре. Для переработки при охлаждении льдом добавляли 50 мл насыщенного раствора хлорида аммония, фазы разделяли, водную фазу трижды экстрагировали диэтиловым эфиром порциями по 50 мл, объединенные органические фазы сушили над сульфатом натрия, фильтровали, концентрировали и остаточное количество растворителя практически полностью удаляли в вакууме. Полученный сырой 1-(8-бензил-1,4-диоксаспиро[4.5]дец-8-ил)пирролидин (54,0 г желтого твердого вещества) без последующей очистки при комнатной температуре перемешивали в течение 24 ч в смеси из 128 мл конц, соляной кислоты (32 мас.%) и 74 мл воды. После этого реакционную смесь сначала дважды промывали диэтиловым эфиром порциями по 50 мл, а затем при охлаждении льдом подщелачивали добавлением раствора едкого натра (32 мас.%), трижды экстрагировали дихлорметаном порциями по 100 мл, объединенные дихлорметановые экстракты сушили над сульфатом натрия, фильтровали, концентрировали и остаточное количество растворителя практически полностью удаляли в вакууме. Таким путем получили 40,3 г 4-бензил-4-пирролидин-1-илциклогексанона. К 23,3 мл 1,0-молярного раствора фенетилмагнийхлорида в ТГФ в атмосфере азота и при охлаждении на ледяной бане по каплям добавляли раствор 4,00 г 4-бензил-4-пирролидин-1-илциклогексанона в 40 мл тетрагидрофурана а.с.ч. и в течение ночи перемешивали при комнатной температуре. Для переработки при охлаждении льдом добавляли 25 мл раствора хлорида аммония (20 мас.%), фазы разделяли, водную фазу трижды экстрагировали диэтиловым эфиром порциями по 50 мл, объединенные органические фазы сушили над сульфатом натрия, фильтровали, концентрировали и остаточное количество растворителя практически полностью удаляли в вакууме. Полученный сырой продукт (6,26 г коричневого масла) хроматографировали на силикагеле с использованием смеси метанол/этилацетат (в объемном соотношении 1:1). Таким путем получили 2,48 г неполярного диастереомера 4-бензил-1-фенетил-4-пирролидин-1-илциклогексанола, из которого аналогично примеру 4 получили 1,98 г соответствующего гидрохлорида. Пример 18: 4-бензил-4-диметиламино-1-(1-метил-1Н-индол-2-ил)циклогексанол Раствор N-метилиндола (1,50 мг, 3,81 ммоля) в сухом ТГФ (20 мл) охлаждали в токе аргона до -5°С. После этого по каплям добавляли трет-бутиллитий (4,19 ммоля, 2,47 мл 1,7-молярного раствора в пентане) таким образом, чтобы температура реакции при этом не превышала 0°С. По завершении добавления реакционную смесь перемешивали в течение последующих двух часов при 0°С. После этого при 0°С по каплям добавляли раствор 4-бензил-4-диметиламиноциклогексанона (3,88 мг, 3,81 ммоля) в сухом ТГФ (7 мл). Смесь перемешивали в течение 15 мин при 0°С, а затем в течение четырех часов при комнатной температуре. Затем реакцию прекращали добавлением к реакционной смеси насыщенного раствора хлорида аммония (20 мл), органическую фазу отделяли, а водную фазу четырежды экстрагировали дихлорметаном (20 мл). Объединенные органические фазы сушили над сульфатом натрия, фильтровали и растворитель удаляли в вакууме. Очистку проводили экспресс-хроматографией на силикагеле с использованием смеси циклогексан/этилацетат (в объемном соотношении 4:1). Таким путем получили 456 мг 4-бензил-4-диметиламино-1-(1-метил-1Н-индол-2-ил)циклогексанола с температурой плавления 105-107°°С. Пример 19: 1-бензо[b]тиофен-2-ил-4-бензил-4-диметиламиноциклогексанол Раствор бензо[b]тиофена (1,50 мг, 3,73 ммоля) в 20 мл сухого ТГФ охлаждали в токе аргона до -5°С. После этого по каплям добавляли трет-бутиллитий (4,47 ммоля, 2,63 мл 1,7-молярного раствора в пентане) таким образом, чтобы температура реакции при этом не превышала 0°С. По завершении добавления реакционную смесь перемешивали в течение двух часов при 0°С. После этого при 0°С по каплям добавляли раствор 4-бензил-4-диметиламиноциклогексанона (3,86 мг, 3,73 ммоля) в сухом ТГФ (8 мл). Смесь перемешивали в течение 15 мин при 0°С, а затем в течение пяти часов при комнатной температуре. Затем реакцию прекращали добавлением к реакционной смеси насыщенного раствора хлорида аммония (30 мл), органическую фазу отделяли, а водную фазу четырежды экстрагировали дихлорметаном (25 мл). Объединенные органические фазы сушили над сульфатом натрия, фильтровали и растворитель удаляли в вакууме. Очистку проводили экспресс-хроматографией на силикагеле с использованием смеси циклогексан/этилацетат (в объемном соотношении 9:1). Таким путем получили 517 мг 1-бензо[b]тиофен-2-ил-4-бензил-4-диметиламиноциклогексанола с температурой плавления 128-131°С. Пример 20: 1-бензо[b]тиофен-3-ил-4-бензил-4-диметиламиноциклогексанол Раствор 3-бром-1-бензо[b]тиофена (1,90 мг, 4,22 ммоля) в 30 мл сухого диэтилового эфира в токе аргона охлаждали до -78°С. После этого по каплям осторожно добавляли н-бутиллитий (5,07 ммоля, 3,17 мл 15%-ного по массе раствора в гексане) таким образом, чтобы температура реакции при этом не превышала -75°С. По завершении добавления реакционную смесь перемешивали в течение двух часов при -78°С. Затем при -78°С по каплям добавляли раствор 4-бензил-4-диметиламиноциклогексанона (977 мг, 4,22 ммоля) в сухом диэтиловом эфире (10 мл). Смесь перемешивали в течение четырех часов при -78°С, после чего медленно нагревали до комнатной температуры (примерно двенадцать часов). Затем реакцию прекращали добавлением к реакционной смеси насыщенного раствора хлорида аммония (30 мл), органическую фазу отделяли, а водную фазу четырежды экстрагировали дихлорметаном (25 мл). Объединенные органические фазы сушили над сульфатом натрия, фильтровали и растворитель удаляли в вакууме. Очистку проводили экспресс-хроматографией на силикагеле с использованием смеси циклогексан/этилацетат (в объемном соотношении 7:3). Таким путем получили 324 мг 1-бензо[b]тиофен-3-ил-4-бензил-4-диметиламиноциклогексанола с температурой плавления 158-160°С. Пример 21: 1-бензофуран-2-ил-4-бензил-4-диметиламиноциклогексанол Раствор бензо[b]фурана (612 мг, 5,12 ммоля) в сухом ТГФ (40 мл) охлаждали в токе аргона до -8°С. После этого по каплям добавляли трет-бутиллитий (6,22 ммоля, 4,14 мл 1,5-молярного раствора в пентане) таким образом, чтобы температура реакции при этом не превышала -5°С. По завершении добавления реакционную смесь перемешивали в течение двух часов при -5°С. Затем при 0°С по каплям добавляли раствор 4-бензил-4-диметиламиноциклогексанона (1,20 г, 5,18 ммоля) в сухом ТГФ (10 мл). Смесь перемешивали в течение часа при 0°С, а затем в течение четырех дней при комнатной температуре. Затем реакцию прекращали добавлением к реакционной смеси насыщенного раствора хлорида аммония (20 мл), органическую фазу отделяли, а водную фазу четырежды экстрагировали дихлорметаном порциями по 30 мл. Объединенные органические фазы сушили над сульфатом натрия, фильтровали и растворитель удаляли в вакууме. Очистку проводили экспресс-хроматографией на силикагеле с использованием смеси циклогексан/этилацетат (в объемном соотношении 8:2). Таким путем получили 380 мг 1-бензофуран-2-ил-4-бензил-4-диметиламиноциклогексанола с температурой плавления 121-124°С.
Формула изобретения
1. Замещенные производные 4-аминоциклогексанола общей формулы I
в которой R1 и R2 независимо друг от друга обозначают Н или С1-8алкил, который является насыщенным либо ненасыщенным и незамещенным, при этом R1 и R2 оба не могут одновременно означать Н, или остатки R1 и R2 совместно образуют кольцо и обозначают (СН2)3-6, R3 обозначает присоединенный через насыщенную либо ненасыщенную, разветвленную либо неразветвленную и незамещенную С1-4алкильную группу фенил, незамещенный или замещенный галогеном, и R4 обозначает гетероарил, выбранный из 5-членного гетероарила, в котором гетероатомы выбраны из атомов азота, кислорода или серы, каждый из которых конденсирован с бензольным кольцом и является незамещенным или однозамещенным С1-8алкилом; CHR6R7, -CHR6-CH2R7, -CHR6-CH2-CH2R7, -CHR6-CH2-CH2-CH2R7, где, R6 представляет собой Н, R7 представляет собой фенил, который может быть незамещенным или одно- либо многозамещенным атомами галогена, необязательно в виде их физиологически приемлемых солей, прежде всего физиологически совместимых кислот. 2. Замещенные производные 4-аминоциклогексанола по п.1, отличающиеся тем, что R1 и R2 независимо друг от друга обозначают Н или С1-4алкил, при этом R1 и R2 оба не могут одновременно обозначать Н, или остатки R1 и R2 совместно образуют кольцо и обозначают (СН2)4-5, прежде всего R1 и R2 независимо друг от друга обозначают метил или этил или остатки R1 и R2 совместно образуют кольцо и обозначают (CH2)5. 3. Замещенные производные 4-аминоциклогексанола по п.1, отличающиеся тем, что R3 обозначает присоединенный через насыщенную неразветвленную C1-2алкильную группу фенил, незамещенный или одно- либо многозамещенный, галогеном. 4. Замещенные производные 4-аминоциклогексанола по п.1, отличающиеся тем, что R4 обозначает индолил, бензотиофенил, бензофуранил, бензотиазолил, бензотриазолил, бензо[1,2,5]тиазолил, каждый из которых является незамещенньм или однозамещенным C1-8-алкилом, прежде всего R4 обозначает индолил, бензотиазолил, бензофуранил, бензотиофенил, каждый из которых является незамещенным или однозамещенньм C1-8-алкилом. 5. Замещенные производные 4-аминоциклогексанола по п.1, отличающиеся тем, что R4 обозначает -CHR6R7, -CHR6-CH2R7, -CHR6-CH2-CH2R7, предпочтительно R4 обозначает -CHR6R7, -CHR6-CH2R7. 6. Замещенные производные 4-аминоциклогексанола по п.1, отличающиеся тем, что они выбраны из группы, включающей 4-бензил-4-диметиламино-1-фенетилциклогексанол, а также его соответствующий гидрохлорид, 4-диметиламино-1,4-дифенетилциклогексанол, а также его соответствующий гидрохлорид, 4-бензил-4-диметаламино-1-[2-(2-фторфенил)этил]циклогексанол, а также его соответствующий гидрохлорид, 4-бензил-4-диметиламино-1-[2-(4-фторфенил)этил]циклогексанол, а также его соответствующий гидрохлорид, 4-диметиламино-4-(2-фторбензил)-1-фенетилциклогексанол, а также его соответствующий гидрохлорид, 4-диметиламино-4-(3-фторбензил)-1-фенетилциклогексанол, а также его соответствующий гидрохлорид, 4-диметиламино-4-(4-фторбензил)-1-фенетилциклогексанол, а также его соответствующий гидрохлорид, 4-бензил-4-диметиламино-1-[2-(3-фторфенил)этил]циклогексанол, а также его соответствующий гидрохлорид, 4-бензил-4-диметиламино-1-(2-фторбензил)циклогексанол, а также его соответствующий гидрохлорид, 4-(аллилметиламино)-4-бензил-1-фенетилциклогексанол, а также его соответствующий гидрохлорид, 4-бензил-4-диметиламино-1-(3-фторбензил)циклогексанол, а также его соответствующий гидрохлорид, 4-бензил-4-диметиламино-1-(4-фторбензил)циклогексанол, а также его соответствующий гидрохлорид, 1-бензил-4-диметиламино-4-(3-фторбензил)циклогексанол, а также его соответствующий гидрохлорид, 4-бензил-1-фенетил-4-пирролидин-1-илциклогексанол, а также его соответствующий гидрохлорид 4-бензил-4-диметиламино-1 -(1 -метил-1Н-индол-2-ил)циклогексанол, 1 -бензо [b]тиофен-2-ил-4-бензил-4-диметиламиноциклогексанол, 1 -бензо[b]тиофен-3-ил-4-бензил-4-диметиламиноциклогексанол и 1-бензофуран-2-ил-4-бензил-4-диметиламиноциклогексанол, необязательно в виде их физиологически приемлемых солей, прежде всего физиологически совместимых кислот. 7. Лекарственное средство, обладающее свойствами связывания с OPL1-рецептором, содержащее по меньшей мере одно замещенное производное 4-аминоциклогексанола по п.1, необязательно в виде его физиологически приемлемых солей, а также необязательно содержащее приемлемые добавки и/или вспомогательные вещества. 8. Применение замещенного производного 4-аминоциклогексанола по одному из пп.1-6, необязательно в виде его физиологически приемлемых солей, для получения лекарственного средства, предназначенного для лечения боли, прежде всего острой, висцеральной, невропатической или хронической боли. 9. Применение замещенного производного 4-аминоциклогексанола по п.1, необязательно в виде его физиологически приемлемых солей, для получения лекарственного средства, предназначенного для лечения заболеваний, опосредованных функционированием OPL1-рецептора, например, таких как состояние страха, эпилепсия, сердечно-сосудистые заболевания. 10. Способ получения замещенного производного 4-аминоциклогексанола по п.1, заключающийся в том, что а) защищенный группами S1 и S2 циклогексан-1,4-дион формулы II подвергают в присутствии соединения формулы HNR01R02 взаимодействию с цианидом, предпочтительно цианидом калия, с получением защищенного N-замещенного производного 1-амино-4-оксоциклогексанкарбонитрила формулы III б) аминонитрил формулы III подвергают взаимодействию с металлоорганическими реагентами, предпочтительно, с соответствующим реактивом Гриньяра или литийорганическими реагентами формулы металл-R3 с образованием соединения формулы IVa в) в соединении формулы IVa, полученном из соединения формулы III, отщепляют защитные группы S1 и S2 с образованием 4-замещенного производного 4-аминоциклогексанона формулы IV г) 4-замещенное производное 4-аминоциклогексанона формулы IV подвергают взаимодействию с металлоорганическими реагентами, предпочтительно с реактивом Гриньяра или литийорганическими реагентами формулы металл-R4 с образованием соединения формулы V где R3 и R4 имеют указанные в п.1 значения, а R01 и R02 независимо друг от друга обозначают С1-8алкил, который является насыщенным неразветвленным и незамещенным, или остатки R01 и R02 совместно образуют кольцо и обозначают (СН2)3-6, а остатки S1 и S2 независимо друг от друга представляют собой защитные группы или совместно представляют собой защитную группу, предпочтительно моноацеталь.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

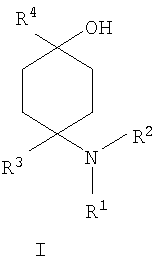
 -,
-,  – и
– и  -рецепторам, а аминокислотная последовательность пептида – ноцицептина – обладает высоким сходством с аминокислотными последовательностями известных пептидов – опиоидов. Индуцируемая ноцицептином активация такого рецептора приводит через связь с Gi/o-протеинами к ингибированию аденилатциклазы (Meunier и др. Nature 377, 1995, cc.532-535). На клеточном уровне также имеются функциональные сходства между опиоидными
-рецепторам, а аминокислотная последовательность пептида – ноцицептина – обладает высоким сходством с аминокислотными последовательностями известных пептидов – опиоидов. Индуцируемая ноцицептином активация такого рецептора приводит через связь с Gi/o-протеинами к ингибированию аденилатциклазы (Meunier и др. Nature 377, 1995, cc.532-535). На клеточном уровне также имеются функциональные сходства между опиоидными 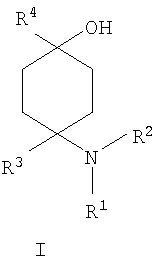
 6, -бензо[d]изотиазол-3-она (сахариновой кислоты), монометилсебациновой кислоты, 5-оксопролина, гексан-1-сульфоновой кислоты, никотиновой кислоты, 2-, 3- либо 4-аминобензойной кислоты, 2,4,6-триметилбензойной кислоты,
6, -бензо[d]изотиазол-3-она (сахариновой кислоты), монометилсебациновой кислоты, 5-оксопролина, гексан-1-сульфоновой кислоты, никотиновой кислоты, 2-, 3- либо 4-аминобензойной кислоты, 2,4,6-триметилбензойной кислоты,  -липоевой кислоты, ацетилглицина, ацетилсалициловой кислоты, гиппуровой кислоты и/или аспарагиновой кислоты. Наиболее предпочтительной солью является гидрохлорид.
-липоевой кислоты, ацетилглицина, ацетилсалициловой кислоты, гиппуровой кислоты и/или аспарагиновой кислоты. Наиболее предпочтительной солью является гидрохлорид.