|
|
(21), (22) Заявка: 2005126756/13, 20.01.2004
(24) Дата начала отсчета срока действия патента:
20.01.2004
(30) Конвенционный приоритет:
27.01.2003 CN 03102038.0
27.01.2003 CN 03102039.9
27.01.2003 CN 03102040.2
27.01.2003 CN 03102041.0
27.01.2003 CN 03236855.0
27.01.2003 CN 03236856.9
27.01.2003 CN 03236857.7
27.01.2003 CN 03236858.5
(43) Дата публикации заявки: 27.02.2006
(46) Опубликовано: 20.01.2008
(15) Информация о коррекции:
Версия коррекции № 1 (W1 C2)
(48) Коррекция опубликована:
27.03.2008 Бюл. № 20089
(56) Список документов, цитированных в отчете о
поиске:
US 5358858 A, 25.10,1994. FR 2690452 A, 29.10.1993. RU 2052962 C, 20.01.1996.
(85) Дата перевода заявки PCT на национальную фазу:
24.08.2005
(86) Заявка PCT:
CN 2004/000075 (20.01.2004)
(87) Публикация PCT:
WO 2004/067695 (12.08.2004)
Адрес для переписки:
119296, Москва, а/я 113, пат.пов. Э.П.Песикову, рег.№ 204
|
(72) Автор(ы):
ЧАН Юнмэн (TW),
ДЖОУ Хуннун (TW),
ДЖЕНЬ Джунмин (TW),
ЛЮ Джихи (TW)
(73) Патентообладатель(и):
ЖЕНЬ-У БАЙОТЕКНОЛОДЖИ КО., ЛТД (TW),
ЛЮ ДЖИХИ (TW)
|
(54) СПОСОБ И УСТРОЙСТВО ДЛЯ ПОЛУЧЕНИЯ ФИКОЭРИТРИНА С ВЫСОКОЙ ОПТИЧЕСКОЙ ПЛОТНОСТЬЮ
(57) Реферат:
Изобретение относится к области биохимии, в частности к способам и устройствам для получения окрашивающих веществ, и может быть использовано в пищевой и косметической промышленности, а также при проведении различного рода биологических исследований. Белковый пигмент фикоэритрин получают экстрагированием из водорослей. Экстрагированный из водорослей, выбранных из группы, включающей Galaxaura oblongata, Halymenia ceylanica, Helminthocladia australis и Porphyra dentate, фикоэритрин обладает высокой оптической плотностью (ОП). 2 н. и 23 з.п. ф-лы, 15 ил., 2 табл.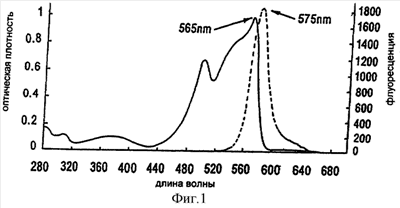
Предпосылки создания изобретения
Область техники
Настоящее изобретение относится к способу и устройству для получения фикоэритрина с высокой оптической плотностью (ОП), более точно к способу и устройству для получения фикоэритрина с высокой оптической плотностью из группы растений, включающей Galaxaura oblongata, Halymenia ceylanica, Helminthocladia australis и Porphyra dentata.
Известный уровень техники
Полученные из растений природные белковые пигменты безопасны для применения в пище и напитках. Они отличаются устойчивостью при умеренном нагреве и представляют собой кислые или щелочные растворы. Благодаря этому они могут применяться в пищевой и косметической промышленности в качестве окрашивающих веществ. Кроме того, пигменты в чистом виде могут применяться для мечения флуоресцином антител, используемых в качестве диагностических средств в иммунологических, клинических, цитологических и биохимических исследованиях.
Фикоцианин и фикоэритрин являются двумя природными белковыми пигментами, которые в настоящее время имеют широкое применение во множестве областей. Поскольку основным сырьем для получения фикоцианина являются сине-зеленые водоросли, такие как Spirulina и Microcystis, которые легко выращивать, и разработано множество способов выращивания водорослей и получения фикоцианина, поставки фикоцианина не являются проблемой. Тем не менее, по-прежнему ощущается дефицит фикоэритрина, в связи с чем его цена остается высокой. Такой дефицит объясняется нехваткой сырья и технологическими сложностями производства фикоэритрина в промышленных масштабах.
Большую часть фикоэритрина получают методом экстрагирования из талломных структур красных водорослей, таких как Porphyra и Ceramium и лишь в незначительной мере Porphyridium, которую теперь получают методом выращивания в резервуарах.
Несмотря на то, что дикие красные водоросли и искусственно выращиваемая Porphyra во все больших количествах используются в качестве сырья для фикоэритрина, большая часть такого сырья имеет высокое содержание геля, что делает экстрагирование фикоэритрина из таких растений крайне сложным, в особенности если речь идет о сушеных водорослях. Кроме того, количество и качество диких водорослей зависит от времени года и температуры окружающей среды. Данные обстоятельства делают получение фикоэритрина из диких и искусственно выращиваемых водорослей Porphyra еще более затруднительным.
Экстрагирование фикоэритрина из Porphyridium также связано со сложностями, поскольку сбор одноклеточных растений обычно требует больших затрат времени и труда, а растворимый полисахарид, который выделяется в процессе выращивания водорослей, замедляет сбор и влияет на экстрагирование фикоэритрина.
В патенте США US 5,358,858 предложено решение названных выше задач при помощи способа получения фикоэритрина из Bangia atropurpurea и Porphyra angusta. Поскольку данные нитчатые растения не содержат гель, они могут сохраняться в условиях, таких как питательные среды с контролируемой температурой, степенью и длительностью освещенности. Фикоэритрин может быть легко экстрагирован из нитчатых растений. В ходе осуществления предложенного в названном изобретении способа:
1. В море осуществляют сбор талломных структур зрелых Bangia atropurpurea или Porphyra angusta и промывают их стерилизованной морской водой. После непродолжительной сушки на воздухе их помещают в питательную среду (среду SWM-III, см. таблицу 1). Через несколько часов из талломных структур Bangia atropurpurea или Porphyra angusta выделяются споры. Затем выделившиеся споры извлекают из исходной питательной среды и помещают в камеру для проращивания, в которой температура соответствует комнатной температуре, степень освещенности составляет 1000-4000 люкс, а длительность освещенности составляет 10-16 часов в сутки.
| Таблица 1 |
| NaNO3 |
8.5 г/100 мл |
взять 2 мл |
| Na2HPO4 |
0.595 г/100 мл |
взять 2 мл |
| Na2EDTA |
0.5 г/100 мл |
взять 2 мл |
| |
0.01625 г/100 мл |
взять 2 мл |
| FeCl3 (или FeCl3·7Н2O) |
0.02885 г/100 мл |
2 мл |
| *металл 1РI |
|
2 мл |
| *Витамины 2S-3 |
|
2 мл |
| Почвенная вытяжка |
|
50 мл |
| Трисахариды |
(10 куб.см/л) |
500 мг |
| Печеночный экстракт |
|
10 мг |
| Морская вода |
до рН 7.5 |
1 л |
(Получить HCl с более высокой плотностью и начальным уровнем рН менее 7, затем добавить раствор NaOH, чтобы довести рН до уровня около 7,5. Это позволяет избежать образования осадка.)
| *металл 1PI |
|
| Н3ВО3 |
12.368 г |
| MnCl2 |
1.385 г |
| ZnCl2 |
0.109 г добавить 2 л дистиллированной воды |
| CoCl2·6H2O |
4.479 мг |
| CuCl2·2H2O |
0.034 мг |
| *Витамины 2S-3 |
|
| Тиамин НС |
0.5 г |
| Капантотенат |
0.1 г |
| Никотиновая кислота |
0.1 г |
| Парааминобензойная кислота |
10 мг |
| Витамин Н (Биотин) |
1 мг добавить 2 л дистиллированной воды |
| Витамин В8 (Иноситол) |
5 г |
| Фолиевая кислота |
2 мг |
| Тимин |
3 мг |
| В12 |
1 мг |
2. После того, как из пор прорастут разветвленные нити, их переносят в колбы с питательной средой SWM-III и выращивают в указанных выше условиях до образования колоний. Затем нитчатые колонии измельчают в стерилизованной мельнице на небольшие отрезки и помещают в емкость большего объема, такую как резервуар, чтобы способствовать их дальнейшему росту. Затем нитчатые колонии переносят в более объемное помещение, где продолжают их выращивание. Затем их снова измельчают для дальнейшего выращивания до необходимого количества. Важно, что при выращивании нитчатых колоний в резервуарах в них необходимо подавать приточный воздух (300 мл/мин). Затем колонии собирают и фильтруют через сеть с числом ячеек от 100 до 400. Питательную среду извлекают и используют повторно.
3. Затем собранные и профильтрованные нити Bangia atropurpurea или Porphyra angusta быстро сушат в вакууме или нагретым воздухом и измельчают их в порошок. Порошок добавляют в раствор фосфата или воду и тщательно перемешивают. Методом центрифугирования удаляют инородные вещества и получают красный прозрачный раствор пигмента. Чтобы получить неочищенный фикоэритрин, в раствор добавляют (NH4)2SO4 и получают 20%-30% насыщенный раствор, из которого удалены ненужные белки, после чего раствор отстаивают с использованием 60%-65% насыщенного раствора (NH4)2SO4. Полученный фикоэритрин имеет отношение ОП565/ОП280 в пределах 1,4-1,6 и может использоваться для производства пигментов, применимых в пищевой и косметической промышленности.
4. Неочищенный осажденный фикоэритрин дополнительно очищают методом гель-хроматографии. Например, после однократной очистки методом сефадексовой хроматографии G200 отношение ОП565/ОП280 полученного фикоэритрина может достигать 5,1-5,2. Степень чистоты фикоэритрина, измеренная методом электрофореза в присутствии додецилсульфата натрия, составляет около 99%. Это является показателем того, что фикоэритрин, полученный способом по изобретению, может использоваться в качестве реагента для проведения иммуноанализа.
С учетом того, что фикоэритрин с отношением ОП565/ОП280 в пределах 5,1-5,2 получают в результате сложных процессов очистки, дважды осуществляемых на стадии 4, стоимость и продолжительность производства возрастают. В связи с этим необходимо создать способ с использованием нитей других растений, в котором фикоэритрин с высокой оптической плотностью может быть получен непосредственно из первого красного прозрачного раствора пигмента, который получают на стадии 3.
Краткое изложение сущности изобретения
С учетом описанного выше известного уровня техники задачей настоящего изобретения является создание способа получения фикоэритрина с высокой оптической плотностью, которому не присущи проблемы описанного выше обычного способа получения фикоэритрина из Bangia atropurpurea и Porphyra angusta.
Другой задачей настоящего изобретения является создание способа получения фикоэритрина с высокой оптической плотностью, обеспечивающего высокий весовой выход фикоэритрина в пересчете на единицу веса водорослей, выбранных из группы, включающей Galaxaura oblongata, Halymenia ceylanica, Helminthocladia australis и Porphyra dentata, с целью снижения стоимости производства.
Дополнительной задачей настоящего изобретения является создание способа получения фикоэритрина с высокой оптической плотностью, обеспечивающего получение фикоэритрина с высокой оптической плотностью из первого красного прозрачного раствора пигмента водорослей, выбранных из группы, включающей Galaxaura oblongata, Halymenia ceylanica, Helminthocladia australis и Porphyra dentate, с целью уменьшения числа стадий производственного процесса.
С учетом изложенных выше и других аргументов, которые станут очевидными из описания, в соответствии с общими принципами настоящего изобретения предложен способ получения фикоэритрина с высокой оптической плотностью (ОП), в ходе осуществления которого в питательной среде выращивают гаметофит со зрелыми споровместилищами для тетраспор, из которых получают тетраспоры, выращивают тетраспоры при температуре 15-30°С, освещенности 500-6000 люкс и отношении свет/темнота свыше 10:14, чтобы прорастить нити, собирают выращенные нити, добавляют выращенные нити в жидкий раствор с уровнем рН в пределах 5-10, методом центрифугирования жидкого раствора со скоростью 6000 об/мин в течение 10 минут при температуре 4°С получают красный прозрачный раствор белкового пигмента, содержащий фикоэритрин, и высаливают из красного прозрачного раствора белкового пигмента концентрат фикоэритрина в гелеобразной форме, при этом гаметофит выбирают из группы водорослей, жизненный цикл которых включает гамогенез, бесполое размножение и вегетативное размножение.
В соответствии с поставленной выше задачей водоросли выбирают из группы, включающей Galaxaura oblongata, Halymenia ceylanica, Helminthocladia australis и Porphyra dentata.
В соответствии с поставленной выше задачей на фиг.7В проиллюстрирована спектрограмма хроматографического анализа фикоэритрина, экстрагированного из выращенных нитей спор красных водорослей Galaxaura oblongata, осуществленного на волне 565 нм методом жидкостной хроматографии высокого разрешения.
В соответствии с поставленной выше задачей на фиг.8В проиллюстрирована спектрограмма хроматографического анализа фикоэритрина, экстрагированного из выращенных нитей спор красных водорослей Halymenia ceylanica, осуществленного на волне 565 нм методом жидкостной хроматографии высокого разрешения.
В соответствии с поставленной выше задачей на фиг.9В проиллюстрирована спектрограмма хроматографического анализа фикоэритрина, экстрагированного из выращенных нитей спор красных водорослей Helminthocladia australis, осуществленного на волне 565 нм методом жидкостной хроматографии высокого разрешения.
В соответствии с поставленной выше задачей на фиг.10В проиллюстрирована спектрограмма хроматографического анализа фикоэритрина, экстрагированного из выращенных нитей спор красных водорослей Porphyra dentata, осуществленного на волне 565 нм методом жидкостной хроматографии высокого разрешения.
В соответствии с поставленной выше задачей в качестве питательной среды используется среда SWM-III.
В соответствии с поставленной выше задачей среда SWM-III представляет собой неорганическую среду SWM-III
В соответствии с поставленной выше задачей в процессе выращивания тетраспор с целью проращивания нитей нити дополнительно измельчают на небольшие отрезки и в таких же условиях выращивают их емкости большего объема до тех пор, пока они не вырастут до необходимых размеров, при этом в емкость подают приточный воздух, чтобы небольшие отрезки нитей находились во взвешенном состоянии.
В соответствии с поставленной выше задачей выращивание происходит в улучшенных условиях при температуре 20°С, освещенности 2000 люкс и отношении свет/темнота 12:12.
В соответствии с поставленной выше задачей на стадии сбора выращенных нитей дополнительно осуществляют сбор выращенных нитей с использованием сети с числом ячеек от 20 до 400, высушивают выращенные нити и измельчают их в порошок.
В соответствии с поставленной выше задачей способ сушки выращенных нитей выбирают из группы, включающей метод вакуумной сушки или метод сушки нагретым воздухом.
В соответствии с поставленной выше задачей жидкий раствор состоит из воды и фосфата калия.
В соответствии с поставленной выше задачей на стадии высаливания фикоэритрина в гелеобразной форме в красный прозрачный белковый раствор пигмента дополнительно добавляют 20% раствор (NH4)2SO4 и центрифугируют красный прозрачный белковый раствор пигмента со скоростью 6000 об/мин в течение 10 минут при температуре 4°С, чтобы удалить нежелательные белки и получить раствор белкового пигмента с более высокой степенью чистоты.
В соответствии с поставленной выше задачей на стадии высаливания фикоэритрина в гелеобразной форме в красный прозрачный белковый раствор пигмента с более высокой степенью чистоты дополнительно добавляют 60-65% раствор (NH4)2SO4 и центрифугируют красный прозрачный белковый раствор пигмента с более высокой степенью чистоты со скоростью 6000 об/мин в течение 10 минут при температуре 4°С, чтобы получить концентрат фикоэритрина в гелеобразной форме.
В соответствии с поставленной выше задачей на стадии высаливания фикоэритрина в гелеобразной форме концентрат фикоэритрина в гелеобразной форме дополнительно подвергают диализу и очищают фикоэритрин методом гель-хроматографии.
В соответствии с поставленной выше задачей гель-хроматография представляет собой сефадексовую гель-хроматографию G200.
В соответствии с поставленной выше задачей на стадии высаливания фикоэритрина в гелеобразной форме концентрат фикоэритрина в гелеобразной форме дополнительно очищают методом ультрафильтрации.
Краткое описание чертежей
Описанные особенности и многие из сопутствующих преимуществ настоящего изобретения можно легче оценить по прочтении следующего ниже подробного описания со ссылкой на приложенные чертежи, на которых:
на фиг.1 показана спектрограмма хроматографического анализа оптической плотности и флуоресценции фикоэритрина, измеренных методом жидкостной хроматографии высокого разрешения,
на фиг.2 показан жизненный цикл Bangia atropurpurea,
на фиг.3 показан жизненный цикл Porphyra angusta,
на фиг.4 показан жизненный цикл Nemalion;
на фиг.5А-5С показана спектрограмма хроматографического анализа фикоэритрина, экстрагированного из Bangia atropurpurea, проведенного методом жидкостной хроматографии высокого разрешения на волнах 280 нм, 565 нм и 615 нм,
на фиг.6А-6С показана спектрограмма хроматографического анализа фикоэритрина, экстрагированного из Porphyra angusta, проведенного методом жидкостной хроматографии высокого разрешения на волнах 280 нм, 565 нм и 615 нм,
на фиг.7А-7С показана спектрограмма хроматографического анализа фикоэритрина, экстрагированного из Galaxaura oblongata, проведенного методом жидкостной хроматографии высокого разрешения на волнах 280 нм, 565 нм и 615 нм,
на фиг.8А-8С показана спектрограмма хроматографического анализа фикоэритрина, экстрагированного из Halymenia ceylanica, проведенного методом жидкостной хроматографии высокого разрешения на волнах 280 нм, 565 нм и 615 нм,
на фиг.9А-9С показана спектрограмма хроматографического анализа фикоэритрина, экстрагированного из Helminthocladia australis, проведенного методом жидкостной хроматографии высокого разрешения на волнах 280 нм, 565 нм и 615 нм,
на фиг.10А-10С показана спектрограмма хроматографического анализа фикоэритрина, экстрагированного из Porphyra dentata, проведенного методом жидкостной хроматографии высокого разрешения на волнах 280 нм, 565 нм и 615 нм,
на фиг.11-15 показаны элементы предложенного в настоящем изобретении устройства для получения фикоэритрина с высокой оптической плотностью.
Описание предпочтительного варианта осуществления
Далее более подробно описаны некоторые примерные варианты осуществления настоящего изобретения. Тем не менее, следует признать, что настоящее изобретение может быть реализовано на практике в целом ряде других вариантов осуществления помимо непосредственно описанных, а объем настоящего изобретения не ограничен ничем, кроме приложенных патентных притязаний.
Фикоэритрины являются растворимыми в воде флуоресцирующими белковыми пигментами, которые получают из водорослей. Благодаря их особым флуоресцирующим свойствам их широко применяют для мечения флуоресцином антител, используемых в качестве диагностических средств. Поскольку фикоэритрин обладает наибольшей интенсивностью флуоресценции среди фикобилипротеинов, его применяют во многих тестах с использованием флуоресцина. На фиг.1 показана спектрограмма хроматографического анализа абсорбции и эмиссии фикоэритрина, проведенного методом жидкостной хроматографии высокого разрешения. Хроматография осуществлялась в следующих условиях:
Колонна для проведения жидкостной хроматографии высокого разрешения:
HYDROCELL DEAE NP10
Размер колонны: 50×4,6 мм
Буфер A: 10 mMK-PBS pH 6,0
Буфер В: 10 mMk-PBS,0.5 M NaCl pH 6,0
Градиент: 0% буфер В  12 мин. 12 мин.  50% буфер В 50% буфер В
Детекция: 565 нм
Расход жидкости: 1 мл/мин.
Жидкостную хроматографию высокого разрешения осуществляли с использованием насоса, фильтров, детекторов и записывающего устройства.
Как показано на фиг.2 и фиг.3, на протяжении жизненного цикла Bangia atropurpurea и Porphyra angusta попеременно происходит гамогенез и бесполое размножение очередных поколений. У зрелой мужской особи гаметофитов в сперматангиях вырабатываются спермации. Такие спермации попадают в воду и переносятся течением, оказываясь в карпогонах женских особей гаметофитов. В зрелом карпогоне вырабатываются карпоспоры, из которых образуются нитчатые талломные структуры (споровые растения) с споровместилищами для спор в форме раковин, споры которых, выделяясь из зрелых споровместилищ, вырастают в молодые прямостоящие талломные структуры. Через некоторое время молодые прямостоящие талломные структуры выделяют моноспоры, из которых многократно вырастают новые молодые прямостоящие талломные структуры или прямостоящие талломные структуры (гаметофиты) в надлежащем состоянии. Тем самым, продолжается попеременный гамогенез и бесполое размножение очередных поколений.
У других водорослей, таких как Nemalion, показанной на фиг.4, в течение жизненного цикла происходит чередование гамогенеза, бесполого размножения и вегетативного размножения. В зрелом карпогоне вырабатываются карпоспоры, из которых вырастают споровые растения с тетраспорами, которые, выделяясь из зрелых споровместилищ, вырастают в нитчатые талломные структуры. Нитчатые талломные структуры, выросшие из тетраспор, и нитчатые талломные структуры, выросшие из карпоспор, обладают различными свойствами. Так, нитчатые талломные структуры, выросшие из карпоспор, не содержат гель и тем самым могут сохраняться в определенных контролируемых условиях, таких как вторая среда с заданной температурой, степенью освещенности и суточной длительностью освещенности. В настоящем изобретении предложен способ экстрагирования фикоэритрина с высокой оптической плотностью из нитчатых талломных структур тетраспор. Для этого выбирают водоросли из группы, включающей Galaxaura oblongata, Halymenia ceylanica, Helminthocladia australis, Porphyra dentate или любые их сочетания. Более подробно это показано на фиг.11-15 на примере Galaxaura oblongata. Ниже описаны предложенные в изобретении способ и устройство.
1. Гаметофиты со зрелыми споровместилищами, выбранные из водорослей, жизненный цикл которых включает гамогенез, бесполое размножение и вегетативное размножение, таких как Galaxaura oblongata, Halymenia ceylanica, Helminlhocladia australis и Porphyra denlala, собирают и промывают стерилизованной водой, представляющей собой первую среду (не показана). После кратковременной воздушной сушки их помещают во вторую среду 100 (неорганическая среда SWM-III). Спустя несколько часов из водорослей удаляют тетраспоры 101. Затем тетраспоры 101 извлекают из второй среды и помещают в вегетационную камеру, такую как камеру 103 из листового стекла, в которой температура, степень освещенности, отношение свет/темнота и суточная длительность освещенности составляют соответственно 15-30°С, 500-6000 люкс, свыше 10:14 и 10-16 часов в сутки. Более предпочтительно температура, степень освещенности и отношение свет/темнота составляют соответственно 20°С, 2000 люкс и 12-12. См. фиг.11.
2. После того, как из тетраспор проросли разветвленные нити 201, нити 201 (не показаны) собирают и переносят в колбу с неорганической средой SWM-III, такую как емкость 200, и выращивают в указанных выше условиях до образования колоний. Затем нитчатые колонии разрезают на небольшие отрезки и переносят в емкость большего объема, чтобы способствовать их дальнейшему росту. Затем нитчатые колонии переносят в более объемное помещение, где продолжают их выращивание. После переноса в более объемное помещение происходит их дальнейший рост. Затем колонии снова измельчают для дальнейшего выращивания до необходимого количества. Важно, что при выращивании нитчатых колоний в резервуарах в них необходимо подавать приточный воздух (300 мл/мин) при помощи насоса 202, чтобы колонии находились во взвешенном состоянии в среде 204. Затем колонии собирают и фильтруют через сеть 203 с числом ячеек от 100 до 400. Питательную среду извлекают и используют повторно. См. фиг.12.
3. Затем профильтрованные нити 300 собирают флотационным методом и быстро высушивают в сушилке, такой как установка 301 для вакуумной сушки или сушки нагретым воздухом и измельчают в порошок в мельнице 302. См. фиг.13. Порошок, например 2,4 г порошка добавляют в раствор с уровнем рН в пределах 5-10, такой как содержащий 70 мл и 10 мМ фосфата калия 304 или любой жидкости, и тщательно перемешивают мешалкой 303. После центрифугирования в центрифуге 305 со скоростью 6000 об/мин в течение 10 минут при температуре 4°С получают красный прозрачный раствор пигмента. См. фиг.14. Затем получают неочищенный фикоэритрин путем добавления 20%-30% насыщенного раствора (NH4)2SO4, 307, чтобы удалить излишний белковый осадок 308 при помощи осадителя (не показан), и методом осаждения добавляют 60%-65% насыщенный раствор (NH4)2SO4 309, чтобы получить неочищенный фикоэритрин с высокой оптической плотностью, пригодный для получения пигментов 310, применимых в пищевой и косметической промышленности. Методом испытаний было установлено, что отношение ОП565/ОП280 У пигмента 310 составляет 2,66. См. фиг.15. Упомянутый выше красный прозрачный раствор пигмента также может быть получен путем непосредственного измельчения влажных нитей и добавления к ним фосфата калия. Пигмент также можно получить методом ультрафильтрации.
4. Осажденный неочищенный фикоэритрин может быть дополнительно очищен методом гель-хроматографии или ультрафильтрации. Например, после однократной очистки методом сефадексовой хроматографии G200 отношение ОП565/ОП280 у полученного фикоэритрина составляет 4,5. После процесса многократной очистки отношение ОП565/ОП280 у фикоэритрина достигает 5,3. Степень чистоты фикоэритрина составляет около 99% по результатам электрофореза в присутствии додецилсульфата натрия. Это является показателем того, что фикоэритрин, полученный предложенным в изобретении способом, может применяться в качестве реагента для проведения иммуноанализа.
На фиг 5А-6С показана спектрограмма хроматографического анализа методом жидкостной хроматографии высокого разрешения на волнах 280 нм, 565 нм и 615 нм, которому был подвергнут фикоэритрин, экстрагированный из Bangia atropurpurea и Porphyra angusta. На фиг 7А-10С показана спектрограмма хроматографического анализа методом жидкостной хроматографии высокого разрешения на волнах 280 нм, 565 нм и 615 нм, которому был подвергнут фикоэритрин, экстрагированный из Galaxaura oblongata, Halymenia ceylanica, Helminthocladia australis и Porphyra dentata. Поскольку спектрограммы хроматографического анализа фикоэритрина различаются в зависимости от того, из водорослей какого вида экстрагирован фикоэритрин, они позволяют легко определить источник происхождения фикоэритрина.
В таблице 2 приведены два значения оптической плотности для шести видов водорослей, в число которых входят Bangia atropurpurea, Porphyra angusta, Galaxaura oblongata, Halymenia ceylanica, Helminthocladia australis и Porphyra dentata. На первой строке таблицы 2 приведены количества (в миллиграммах) фикоэритрина, полученного в пересчете на одинаковое количество (в граммах) водорослей. На второй и третьей строках приведены отношения ОП565/ОП280 и ОП615/ОП565 для водорослей, используемых в настоящем изобретении, и водорослей Bangia atropurpurea и Porphyra angusta. Чем выше первое отношение, тем большей степенью чистоты отличается полученный фикоэритрин. Полученный таким способом фикоэритрин отличается достаточно высокой степенью чистоты для производства пищевых и косметических пигментов. Он также применим для иммунотерапии с целью профилактики заболеваний. Второе отношение является отношением степени чистоты фикоцианина и фикоэритрина. Чем ниже второе отношение, тем меньше степень чистоты полученного фикоцианина и, следовательно, тем выше качество полученного фикоэритрина. Из этого следует, что из нитей водорослей, используемых в настоящем изобретении, таких как Galaxaura oblongata, Halymenia ceylanica, Helminthocladia australis и Porphyra dentata, может быть получен фикоэритрин с более высокой оптической плотностью, чем это известно из уровня техники.
| Таблица 2 |
| Водоросли |
Ва |
Pa |
Go |
Не |
На |
Pd |
| RPE (мг)/водоросли (г) |
53,5 |
38,89 |
57,74 |
46,59 |
48,1 |
44,98 |
| ОП565/ОП280 |
1,40 |
1,54 |
2,66 |
1,44 |
2,34 |
1,96 |
| ОП615/ОП565 |
0,19 |
0,53 |
0,14 |
0,10 |
0,15 |
0,21 |
RPE – фикоэритриновый белок с максимальной способностью к поглощению ультрафиолетовых лучей на волне длиной 566 нм и флуоресценцией на волне длиной 575 нм.
Ва – Bangia atropurpurea
Pa – Porphyra angusta
Go – Galaxaura oblongata
He – Halymenia ceylanica
Ha – Helminthocladia australis
Pd – Porphyra dentata
Несмотря на то, что выше проиллюстрирован и описан конкретный вариант осуществления изобретения, для специалиста в данной области техники очевидно, что в него могут быть внесены различные изменения, не выходящие за объем изобретения, который ограничен исключительно приложенными притязаниями.
Формула изобретения
1. Способ получения фикоэритрина с высокой оптической плотностью (ОП) из нитчатых тетраспор определенных водорослей, жизненный цикл которых включает гамогенез, бесполое размножение и вегетативное размножение, с целью получения фикоэритрина с высокой оптической плотностью (ОП), в котором водоросли выбирают из группы, включающей Galaxaura oblongata, Halymenia ceylanica, Helminthocladia australis, Porphyra dentate и их сочетания.
2. Способ по п.1, в котором нитчатые тетраспоры представляют собой нити карпоспор.
3. Способ по п.2, в котором фикоэритрин, экстрагированный из нитчатых карпоспор Galaxaura oblongala, Halymenia ceylanica, Helminthocladia australis или Porphyra dentata, подвергают хроматографическому анализу методом жидкостной хроматографии высокого разрешения на волне 565 нм и получают спектрограммы, показанные на фиг.7В, 8В, 9В и 10В, соответственно.
4. Способ по п.3, в ходе осуществления которого для получения фикоэритрина с высокой оптической плотностью в питательной среде выращивают гаметофит со зрелыми споровместилищами, из которых получают тетраспоры, выращивают тетраспоры при температуре 15-30°C, освещенности 500-6000 люкс и отношении свет/темнота свыше 10:14, чтобы прорастить нити, собирают выращенные нити, добавляют выращенные нити в жидкий раствор с уровнем рН в пределах 5-10,
методом центрифугирования жидкого раствора получают красный прозрачный раствор белкового пигмента, содержащий фикоэритрин, и
высаливают из красного прозрачного раствора белкового пигмента концентрат фикоэритрина в гелеобразной форме.
5. Способ по п.1, в котором среда представляет собой неорганическую среду SWM-III.
6. Способ по п.4, в котором выращенные нити собирают флотационным методом при температуре, степени освещенности и отношении свет/темнота, соответственно, 20°C, 2000 люкс и 12:12.
7. Способ по п.1, в котором на стадии сбора и выращивания нитей дополнительно
выращенные нити собирают сетью, высушивают выращенные нити и измельчают выращенные нити в порошок.
8. Способ по п.7, в котором сеть имеет от 20 до 400 ячеек.
9. Способ по п.7, в котором выращенные нити высушивают способом, выбранным из группы, включающей сушку в вакууме или сушку нагретым воздухом.
10. Способ по п.4, в котором центрифугирование осуществляют в течение 10 мин со скоростью 6000 об/мин при температуре 4°С.
11. Способ по п.4, в котором жидкий раствор состоит из воды и фосфата калия.
12. Способ по п.4, в котором на стадии высаливания фикоэритрина в гелеобразной форме дополнительно добавляют в красный прозрачный белковый раствор пигмента 20%-ный раствор (NH4)2SO4 и
центрифугируют красный прозрачный белковый раствор пигмента со скоростью 6000 об/мин в течение 10 мин при температуре 4°C, чтобы удалить нежелательные белки и получить раствор белкового пигмента с более высокой степенью чистоты.
13. Способ по п.4, в котором на стадии высаливания фикоэритрина в гелеобразной форме дополнительно добавляют в красный прозрачный белковый раствор пигмента с более высокой степенью чистоты 60-65%-ный раствор (NH4)2SO4 и центрифугируют красный прозрачный белковый раствор пигмента с более высокой степенью чистоты со скоростью 6000 об/мин в течение 10 мин при температуре 4°C, чтобы получить концентрат фикоэритрина в гелеобразной форме.
14. Способ по п.4, в котором на стадии высаливания фикоэритрина в гелеобразной форме дополнительно концентрат фикоэритрина в гелеобразной форме очищают методом ультрафильтрации.
15. Способ по п.4, в котором на стадии высаливания фикоэритрина в гелеобразной форме дополнительно подвергают концентрат фикоэритрина в гелеобразной форме диализу и очищают фикоэритрин методом гель-хроматографии.
16. Способ по п.15, в котором гель-хроматография представляет собой сефадексовую гель хроматографию G200.
17. Устройство для использования нитчатых тетраспор определенных водорослей, жизненный цикл которых включает гамогенез, бесполое размножение и вегетативное размножение, с целью получения фикоэритрина с высокой оптической плотностью (ОП), состоящее из первой среды для выращивания гаметофита со зрелыми споровместилищами для тетраспор, из которых получают тетраспоры, расположенной вблизи первой среды второй среды для выращивания тетраспор при температуре 15-30°C, освещенности 500-6000 люкс и отношении свет/темнота свыше 10:14, чтобы прорастить нити, расположенного во второй среде средства сбора выращенных нитей, расположенного вблизи средства сбора средства измельчения в порошок выращенных нитей в средстве сбора, расположенного вблизи средства измельчения средства перемешивания выращенных измельченных нитей и выращенных нитей с целью получения красного прозрачного раствора белкового пигмента, расположенного вблизи средства перемешивания средства осаждения для получения фикоэритрина методом высаливания из красного прозрачного раствора белкового пигмента, при этом водоросли выбирают из группы водорослей, включающей Galaxaura oblongata, Halymenia ceylanica, Helminthocladia australis, Porphyra dentate и их сочетания.
18. Устройство по п.17, в котором фикоэритрин, экстрагированный из нитчатых карпоспор Galaxaura oblongata, Halymenia ceylanica, Helminthocladia australis или Porphyra dentata, подвергают хроматографическому анализу методом жидкостной хроматографии высокого разрешения на волне 565 нм и получают спектрограммы, показанные на фиг.7В, 8В, 9В и 10В, соответственно.
19. Устройство по п.17, в котором среда представляет собой неорганическую среду SWM-III.
20. Устройство по п.17, в котором выращенные нити собирают флотационным методом.
21. Устройство по п.17, в котором условия температуры, степени освещенности и отношении свет/темнота составляют, соответственно, 20°С, 2000 люкс и 12:12.
22. Устройство по п.17, в котором средство сбора представляет собой сеть с числом ячеек от 20 до 400.
23. Устройство по п.17, в котором средство сушки представляет собой вакуумное устройство или устройство для сушки нагретым воздухом.
24. Устройство по п.17, в котором средство осаждения действует по принципу высаливания, в ходе которого в красный прозрачный белковый раствор пигмента с более высокой степенью чистоты добавляют 60-65%-ный раствор (NH4)2SO4.
25. Устройство по п.17, в котором высаливание осуществляют методом ультрафильтрации или гель-хроматографии, которая представляет собой сефадексовую гель-хроматографию G200.
РИСУНКИ
TH4A – Переиздание описания изобретения к патенту Российской Федерации
Причина переиздания: Коррекция библиографических данных
Извещение опубликовано: 27.03.2008 БИ: 09/2008
TK4A – Поправки к публикациям сведений об изобретениях в бюллетенях “Изобретения (заявки и патенты)” и “Изобретения. Полезные модели”
Напечатано: (73) ЖЕНЬ-У БАЙОТЕКНОЛОДЖИ КО., ЛТД (CN), ЛЮ ДЖИХИ (CN)
Следует читать: (73) ЖЕНЬ-У БАЙОТЕКНОЛОДЖИ КО., ЛТД (TW), ЛЮ ДЖИХИ (TW)
Номер и год публикации бюллетеня: 2-2008
Код раздела: FG4A
Извещение опубликовано: 27.03.2008 БИ: 09/2008
|
|