Патент на изобретение №2315059
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
(54) АНАЛОГИ ГРЕЛИНА
(57) Реферат:
Изобретение относится к пептидильным аналогам грелина, активным при GHS-рецепторе. Пептидильные аналоги грелина могут использоваться для идентификации соединения, способного связываться с GHS-рецептором, а также для стимуляции секреции гормона роста у субъекта. 3 н. и 7 з.п. ф-лы, 1 табл.
Уровень техники Пульсирующее высвобождение гормона роста из гипофизарных соматотропов регулируется двумя нейропептидами гипоталамуса: высвобождающим гормон роста гормоном и соматостатином. Высвобождающий гормон роста гормон стимулирует высвобождение гормона роста, тогда как соматостатин ингибирует секрецию гормона роста (Frohman et al., Endocrinol. Rev. 1986, 7, 223-253, и Strobi et al., Pharmacol. Rev. 1994, 46, 1-34). Высвобождение гормона роста из гипофизарных соматотропов может также регулироваться высвобождающими гормон роста пептидами. Было обнаружено, что гексапептид, His-D-Trp-Ala-Trp-D-Phe-Lys-амид (GHRP-6), высвобождает гормон роста из соматотропов зависимым от дозы образом в нескольких видах, включая человека (Bowers et al., Endocrinology 1984, 114, 1537-1545). Последующие химические исследования на GHRP-6 привели к идентификации других сильнодействующих стимуляторов секреции, таких как GHRP-I, GHRP-2 и гексарелин (Cheng et al., Endocrinology 1989, 124, 2791-2798, Bowers, C.Y. Novel GH-Releasing Peptides, in Molecular and Clinical Advances in Pituitary Disorders, Ed: Melmed, S.; Endocrine Research and Education, Inc., Los Angeles, CA, USA 1993, 153-157 и Deghenghi et al., Life Sci. 1994, 54, 1321-1328): GHRP-I Ala-His-D-(2′)-Nal-Ala-Trp-D-Phe-Lys-NH2 GHRP-2 D-Ala-D-(2′)-Nal-Ala-Trp-D-Nal-Lys-NH2 гексарелин His-D-2-MeTrp-Ala-Trp-D-Phe-Lys-NH2. GHRP-I, GHRP-2, GHRP-6 и гексарелин являются синтетическими стимуляторами секреции гормона роста. Стимуляторы секреции гормона роста стимулируют секрецию гормона роста по механизму, отличающемуся от механизма, высвобождающего гормон роста гормона (Bowers et al., Endocrinology 1984, 114, 1537-1545, Cheng et al., Endocrinology 1989, 124, 2791-2798, Bowers, C.Y. Novel GH-Releasing Peptides, in Molecular and Clinical Advances in Pituitary Disorders, Ed: Melmed, S.; Endocrine Research and Education, Inc., Los Angeles, CA, USA 1993, 153-157 и Deghenghi et al., Life Sci. 1994, 54, 1321-1328). Низкая пероральная биодоступность (<1%) пептидильных стимуляторов секреции гормона роста стимулировала поиск непептидных соединений, имитирующих действие GHRP-6 в гипофизе. Сообщалось, что несколько бензолактамов и спироинданов стимулировали высвобождение гормона роста у различных видов животных и у человека (Smith et al., Science 1993, 260, 1640-1643, Patchett et al., Proc. Natl. Acad. Sci. USA 1995, 92, 7001-7005 и Chen et al., Bioorg. Med. Chem. Lett. 1996, 6, 2163-2169). Конкретным примером небольшого спироиндана является МК-0677 (Patchett et al., Proc. Natl. Acad. Sci. USA 1995, 92, 7001-7005: Действия вышеуказанных стимуляторов секреции гормона роста (как пептидных, так и непептидных), по-видимому, опосредовано специфическим рецептором стимулятора секреции гормона роста (GHS-рецептором) (Howard et al., Science 1996, 273, 974-977 и Pong et al., Molecular Endocrinology 1996, 10, 57-61). Этот рецептор присутствует в гипофизе и гипоталамусе различных видов млекопитающих (GHSR1a) и отличается от рецептора высвобождающего гормон роста гормона. GHS-рецептор был обнаружен также в других участках центральной нервной системы и в периферических тканях, например надпочечниках и щитовидной железе, сердце, легком, почке и скелетных мышцах (Chen et al., Bioorg. Med. Chem. Lett. 1996, 6, 2163-2169, Howard et al., Science 1996, 273, 974-977, Pong et al., Molecular Endocrinology 1996, 10, 57-61, Guan et al., Mol. Brain Res. 1997, 48, 23-29 и McKee et al., Genomics 1997, 46, 426-434). Сообщалась укороченная версия GHSR1a (Howard et al., Science 1996, 273, 974-977). GHS-рецептор является связанным с G-белком рецептором. Эффекты активации GHS-рецептора включают в себя деполяризацию и ингибирование калиевых каналов, увеличение межклеточных концентраций инозиттрифосфата (IP3) и транзиторное увеличение концентрации внутриклеточного кальция (Pong et al., Molecular Endocrinology 1996, 10, 57-61, Guan et al., Mol. Brain Res. 1997, 48, 23-29 и McKee et al., Genomics 1997, 46, 426-434). Сущность изобретения Данное изобретение относится к аналогам грелина, активным при GHS-рецепторе. Грелин является природно встречающимся пептидом, который, как считается, является эндогенным лигандом для GHS-рецептора (Kojima et al., Nature 1999, 402, 656-660). Аналоги данного изобретения могут связываться с GHS-рецептором и предпочтительно вызывать трансдукцию сигнала. Аналоги грелина имеют различные терапевтические применения, а также применения в качестве инструментов исследований. Известны нативные структуры грелинов из нескольких видов млекопитающих и отличных от млекопитающих животных (Kaiya et al., J. Biol. Chem. 2001, 276, 40441-40448; International Patent Application PCT/JP00/04907 (WO 01/07475)). Наблюдали, что, кроме ацилирования н-октановой кислотой, нативный грелин ацилировался также н-декановой кислотой (Kaiya et al., J. Biol. Chem. 2001, 276, 40441-40448). Было обнаружено, что внутренний район в грелине обеспечивает активность при GHS-рецепторе. Этот внутренний район содержит четыре N-концевые аминокислоты, где серин в положении 3 модифицирован н-октановой кислотой. Таким образом, первый аспект данного изобретения описывает аналог грелина в соответствии с формулой (I): (R2R3)-А1-А2-А3-А4-А5-А6-А7-А8-А9-А10-А11-А12-А13-А14-А15-А16-А17-А18-А19-А20-А21-А22-А23-А24-А25-А26-А27-А28-R1 (I) или его фармацевтически приемлемую соль, где: А1 обозначает Gly, Aib, Ala, А2 обозначает Ser, Aib, Act, Ala, Acc, Abu, Ava, Thr или Val; А3 обозначает Ser, Ser(C(O)-R4), Asp(O-R8), Asp(NH-R9), Cys(S-R14), Dap(S(O)2-R10), Dab(S(O)2-R11), Glu(O-R6), Glu(NH-R7), Thr, Thr(C(O)-R5 или HN-CH((CH2)n-N(R12R13))-С(О); А4 обозначает Phe, Acc, Aic, Cha, 2Fua, 1Nal, 2Nal, 2Pal, 3Pal, 4Pal, hPhe, (Х1,Х2,Х3,Х4,Х5)Phe, Taz, 2Thi, 3Thi, Trp или Tyr; А5 обозначает Leu, Abu, Acc, Aib, Ala, Cha, Ile, hLeu, Nle, Nva, Phe, Tle или Val; А6 обозначает Ser, Abu, Acc, Act, Aib, Ala, Gly, Thr или Val; А7 обозначает Pro, Dhp, Dmt, 3Hyp, 4Hyp, Inc, Ktp, Oic, Pip, Thz, Tic или делетирован; А8 обозначает Glu, Acc, Aib, Arg, Asn, Asp, Dab, Dap, Gln, Lys, Orn, HN-CH((CH2)n-N(R12R13))-С(О) или делетирован; А9 обозначает His, Apc, Aib, Acc, 2Fua, 2Pal, 3Pal, 4Pal, Taz, 2Thi, 3Thi, (Х1,Х2,Х3,Х4,Х5)Phe или делетирован; А10 обозначает Gln, Acc, Aib, Asn, Asp, Glu или делетирован; А11 обозначает Arg, Apc, hArg, Dab, Dap, Lys, Orn, HN-CH((CH2)n-N(R12R13))-C(O) или делетирован; А12 обозначает Val, Abu, Acc, Aib, Ala, Cha, Nva, Gly, Ile, Leu, Nle, Tle, Cha или делетирован; А13 обозначает Gln, Acc, Aib, Asn, Asp, Glu или делетирован; А14 обозначает Gln, Acc, Aib, Asn, Asp, Glu или делетирован; А15 обозначает Arg, hArg, Acc, Aib, Apc, Dab, Dap, Lys, Orn, HN-CH((CH2)n-N(R12R13))-С(О) или делетирован; А16 обозначает Lys, Acc, Aib, Apc, Arg, hArg, Dab, Dap, Orn, HN-CH((CH2)n-N(R12R13))-С(О) или делетирован; А17 обозначает Glu, Arg, Asn, Asp, Dab, Dap, Gln, Lys, Orn, HN-CH((CH2)n-N(R12R13))-С(О) или делетирован; А18 обозначает Ser, Abu, Acc, Act, Aib, Ala, Thr, Val или делетирован; А19 обозначает Lys, Acc, Aib, Apc, Arg, hArg, Dab, Dap, Orn, HN-CH((CH2)n-N(R12R13))-С(О) или делетирован; А20 обозначает Lys, Acc, Aib, Apc, Arg, hArg, Dab, Dap, Orn, HN-CH((CH2)n-N(R12R13))-С(О) или делетирован; А21 обозначает Pro, Dhp, Dmt, Inc, 3Hyp, 4Hyp, Ktp, Oic, Pip, Thz, Tic или делетирован; А22 обозначает Pro, Dhp, Dmt, 3Hyp, 4Hyp, Inc, Ktp, Oic, Pip, Thz, Tic или делетирован; А23 обозначает Abu, Acc, Act, Aib, Ala, Apc, Gly, Nva, Val или делетирован; А24 обозначает Lys, Acc, Aib, Apc, Arg, hArg, Dab, Dap, Orn, HN-CH((CH2)n-N(R12R13))-С(О) или делетирован; А25 обозначает Leu, Abu, Acc, Aib, Ala, Cha, Ile, hLeu, Nle, Nva, Phe, Tle, Val или делетирован; А26 обозначает Gln, Aib, Asn, Asp, Glu или делетирован; А27 обозначает Pro, Dhp, Dmt, 3Hyp, 4Hyp, Inc, Ktp, Oic, Pip, Thz, Tic или делетирован; А28 обозначает Acc, Aib, Apc, Arg, hArg, Dab, Dap, Lys, Orn, HN-CH((CH2)n-N(R12R13))-С(О) или делетирован; R1 обозначает -ОН, -NH2, -(С1-С30)алкокси или NH-X6-CH2-Z0, где Х6 обозначает (С1-С12)алкил, (С2-С12)алкенил, и Z0 обозначает -Н, -ОН, -СО2Н или -С(О)-NH2; R2 и R3, каждый, обозначают, независимо для каждого случая, Н, (С1-С20)алкил или (С1-С20)ацил; R4, R5, R6, R7, R8, R9, R10, R11 и R14, каждый, обозначают, независимо для каждого случая, (С1-С40)алкил, (С2-С40)алкенил, замещенный (С1-С40)алкил, замещенный (С2-С40)алкенил, алкиларил, замещенный алкиларил, арил или замещенный арил; R12 и R13, каждый, обозначают, независимо для каждого случая, Н, (С1-С40)алкил, (С1-С40)ацил, (С1-С30)алкилсульфонил или -С(NH)-NH2, где, когда R12 обозначает (С1-С40)ацил, (С1-С30)алкилсульфонил) или -С(NH)-NH2, тогда R13 обозначает Н или (С1-С40)алкил; n равно, независимо для каждого случая, 1, 2, 3, 4 или 5; Х1, Х2, Х3, Х4 и Х5, каждый, обозначают, независимо для каждого случая, Н, F, Cl, Br, I, (С1-С10)алкил, замещенный (С1-С10)алкил, арил, замещенный арил, ОН, NH2, NO2 или CN; при условии, что этот пептид содержит по меньшей мере одну аминокислоту, выбранную из группы, состоящей из: А2 обозначает Aib, Acc или Act; А3 обозначает Dap(S(O)2-R10), Dab(S(O)2-R11), Glu(NH-гексил) или Cys(S-децил); А5 обозначает Abu, Acc, Aib, Ala, Cha, Ile, hLeu, Nle, Nva, Phe, Tle или Val; А6 обозначает Abu, Acc, Act, Aib, Ala, Gly, Thr или Val; А7 обозначает Dhp, Dmt, 3Hyp, 4Hyp, Inc, Ktp, Oic, Pip, Thz или Tic; А8 обозначает Acc, Aib, Arg, Asn, Asp, Dab, Dap, Gln, Lys, Orn или HN-CH((CH2)n-N(R12R13))-С(О); А9 обозначает Aib, Acc, Apc, 2Fua, 2Pal, 3Pal, 4Pal, Taz, 2Thi, 3Thi или (Х1,Х2,Х3,Х4,Х5)Phe; и А10 обозначает Acc, Aib, Asn, Asp или Glu; и дополнительно при условии, что этот пептид не является (Lys8)чГрелин(1-8)-NH2 или (Arg8)чГрелин(1-8)-NH2. Предпочтительной группой соединений формулы (I), называемых соединениями Группы 1, является группа соединений, где: А1 обозначает Gly или Aib; А2 обозначает Ser, Aib, A5c, Act или Ava; А3 обозначает Ser(C(O)-R4), Glu(O-R6), Glu(NH-R7), Dap(S(O)2-R10) или Dab(S(O)2-R11); А4 обозначает Phe; А5 обозначает Leu, Acc, Aib, Cha или hLeu; А6 обозначает Ser, Abu, Act, Aib или Thr; А7 обозначает Pro, Dhp, Dmt, 4Hyp, Ktp, Pip, Tic или Thz; А8 обозначает Glu или Aib; А9 обозначает His, Aib, Apc, 2Fua, 2Pal, 3Pal, 4Pal, Taz или 2Thi; А10 обозначает Gln или Aib; А11 обозначает Arg; А12 обозначает Aib, Val или Acc; А13 обозначает Gln; А14 обозначает Gln; А15 обозначает Arg или Orn; А16 обозначает Lys или Apc; А17 обозначает Glu; А18 обозначает Ser; А19 обозначает Lys; А20 обозначает Lys; А21 обозначает Pro; А22 обозначает Pro; А23 обозначает Ala; А24 обозначает Lys; А25 обозначает Leu; А26 обозначает Gln; А27 обозначает Pro и А28 обозначает Arg, или их фармацевтически приемлемых солей. Более предпочтительной группой соединений формулы (I), называемых соединениями Группы 2, является группа соединений, где: R2 и R3, каждый, обозначают, независимо, Н, ацил, н-бутирил, изобутирил или н-октаноил; R4 обозначает октил; R6 обозначает гексил; R7 обозначает гексил; R10 обозначает октил и R11 обозначает октил, или их фармацевтически приемлемых солей, где Acc обозначает, независимо для каждого случая, А5с или А6с. Более предпочтительным соединением в соответствии с формулой (I), называемым соединением Группы 3, является соединение формулы: (Dap3(октансульфонил))чГрелин(1-28)-NH2; (Aib2, A6c5)чГрелин(1-28)-NH2; (A6c5)чГрелин(1-28)-NH2; (Aib2,6)чГрелин(1-28)-NH2; (Aib2, A5c12)чГрелин(1-28)-NH2; (Aib2, A5c12, Orn15)чГрелин(1-28)-NH2; (Aib2, A5c12, Apc16)чГрелин(1-28)-NH2; (Aib2, Act6)чГрелин(1-28)-NH2; (Aib2, 3Pal9)чГрелин(1-28)-NH2; (Aib2, Dmt7)чГрелин(1-28)-NH2; (Aib2, Thz7)чГрелин(1-28)-NH2; (A5c2)чГрелин(1-28)-NH2; (Act2)чГрелин(1-28)-NH2; (Aib2, A5c5)чГрелин(1-28)-NH2; (Aib2, A6c5)чГрелин(1-28)-NH2; (Aib2,5)чГрелин(1-28)-NH2; (Aib2, hLeu5)чГрелин(1-28)-NH2; (Aib2, Cha5)чГрелин(1-28)-NH2; (Aib2,6)чГрелин(1-28)-NH2; (Aib2, Act6)чГрелин(1-28)-NH2; (Aib2, Thr6)чГрелин(1-28)-NH2; (Aib2, Abu6)чГрелин(1-28)-NH2; (Aib2, 4Hyp7)чГрелин(1-28)-NH2; (Aib2, Thz7)чГрелин(1-28)-NH2; (Aib2, Pip7)чГрелин(1-28)-NH2; (Aib2, Dhp7)чГрелин(1-28)-NH2; (Aib2, Ktp7)чГрелин(1-28)-NH2; (Aib2,8)чГрелин(1-28)-NH2; (Aib2, 2Pal9)чГрелин(1-28)-NH2; (Aib2, 3Pal9)чГрелин(1-28)-NH2; (Aib2, 4Pal9)чГрелин(1-28)-NH2; (Aib2, Taz9)чГрелин(1-28)-NH2; (Aib2, 2Thi9)чГрелин(1-28)-NH2; (Aib2, 2Fua9)чГрелин(1-28)-NH2; (Aib2, Apc9)чГрелин(1-28)-NH2; (Aib2,9)чГрелин(1-28)-NH2; (Aib2,10)чГрелин(1-28)-NH2; (Aib2, Tic7)чГрелин(1-28)-NH2; (Aib6)чГрелин(1-28)-NH2; (A5c5)чГрелин(1-28)-NH2; (A6c5)чГрелин(1-28)-NH2; (Act6)чГрелин(1-28)-NH2; (3Pal9)чГрелин(1-28)-NH2; (Dmt7)чГрелин(1-28)-NH2; (Thz7)чГрелин(1-28)-NH2; (Aib5)чГрелин(1-28)-NH2; (hLeu5)чГрелин(1-28)-NH2; (Cha5)чГрелин(1-28)-NH2; (Thr6)чГрелин(1-28)-NH2; (Abu6)чГрелин(1-28)-NH2; (4Hyp7)чГрелин(1-28)-NH2; (Pip7)чГрелин(1-28)-NH2; (Dhp7)чГрелин(1-28)-NH2; (Ktp7)чГрелин(1-28)-NH2; (Aib8)чГрелин(1-28)-NH2; (2Pal9)чГрелин(1-28)-NH2; (3Pal9)чГрелин(1-28)-NH2; (4Pal9)чГрелин(1-28)-NH2; (Taz9)чГрелин(1-28)-NH2; (2Thi9)чГрелин(1-28)-NH2; (2Fua9)чГрелин(1-28)-NH2; (Apc9)чГрелин(1-28)-NH2; (Aib9)чГрелин(1-28)-NH2; (Aib10)чГрелин(1-28)-NH2; (Aib2, Dap3(октансульфонил), А6с5)чГрелин(1-28)-NH2; (Dap3(октансульфонил), А6с5)чГрелин(1-28)-NH2; (Aib2,6, Dap3(октансульфонил))чГрелин(1-28)-NH2; (Aib2, Dap3(октансульфонил), А5с12)чГрелин(1-28)-NH2; (Aib2, Dap3(октансульфонил), А5с12, Orn15)чГрелин(1-28)-NH2; (Aib2, Dap3(октансульфонил), А5с12, Apc16)чГрелин(1-28)-NH2; (Aib2, Dap3(октансульфонил), Act6)чГрелин(1-28)-NH2; (Aib2, Dap3(октансульфонил), 3Pal9)чГрелин(1-28)-NH2; (Aib2, Dap3(октансульфонил), Dmt7)чГрелин(1-28)-NH2; (Aib2, Dap3(октансульфонил), Thz7)чГрелин(1-28)-NH2; (A5c2, Dap3(октансульфонил))чГрелин(1-28)-NH2; (Act2, Dap3(октансульфонил))чГрелин(1-28)-NH2; (Aib2, Dap3(октансульфонил), А5с5)чГрелин(1-28)-NH2; (Aib2,5, Dap3(октансульфонил))чГрелин(1-28)-NH2; (Aib2, Dap3(октансульфонил), hLeu5)чГрелин(1-28)-NH2; (Aib2, Dap3(октансульфонил), Cha5)чГрелин(1-28)-NH2; (Aib2,6, Dap3(октансульфонил))чГрелин(1-28)-NH2; (Aib2, Dap3(октансульфонил), Thr6)чГрелин(1-28)-NH2; (Aib2, Dap3(октансульфонил), Abu6)чГрелин(1-28)-NH2; (Aib2, Dap3(октансульфонил), 4Hyp7)чГрелин(1-28)-NH2; (Aib2, Dap3(октансульфонил), Pip7)чГрелин(1-28)-NH2; (Aib2, Dap3(октансульфонил), Dhp7)чГрелин(1-28)-NH2; (Aib2, Dap3(октансульфонил), Ktp7)чГрелин(1-28)-NH2; (Aib2,8, Dap3(октансульфонил))чГрелин(1-28)-NH2; (Aib2, Dap3(октансульфонил), 2Pal9)чГрелин(1-28)-NH2; (Aib2, Dap3(октансульфонил), 3Pal9)чГрелин(1-28)-NH2; (Aib2, Dap3(октансульфонил), 4Pal9)чГрелин(1-28)-NH2; (Aib2, Dap3(октансульфонил), Taz9)чГрелин(1-28)-NH2; (Aib2, Dap3(октансульфонил), 2Thi9)чГрелин(1-28)-NH2; (Aib2, Dap3(октансульфонил), 2Fua9)чГрелин(1-28)-NH2; (Aib2, Dap3(октансульфонил), Apc9)чГрелин(1-28)-NH2; (Aib2,9, Dap3(октансульфонил))чГрелин(1-28)-NH2; (Aib2,10, Dap3(октансульфонил))чГрелин(1-28)-NH2; (Dap3(октансульфонил), А6с5)чГрелин(1-28)-NH2; (Dap3(октансульфонил), Aib6)чГрелин(1-28)-NH2; (Dap3(октансульфонил), А5с12)чГрелин(1-28)-NH2; (Dap3(октансульфонил), А5с12, Orn15)чГрелин(1-28)-NH2; (Dap3(октансульфонил), А5с12, Apc16)чГрелин(1-28)-NH2; (Dap3(октансульфонил), Act6)чГрелин(1-28)-NH2; (Dap3(октансульфонил), 3Pal9)чГрелин(1-28)-NH2; (Dap3(октансульфонил), Dmt7)чГрелин(1-28)-NH2; (Dap3(октансульфонил), Thz7)чГрелин(1-28)-NH2; (Dap3(октансульфонил), А5c5)чГрелин(1-28)-NH2; (Dap3(октансульфонил), Aib5)чГрелин(1-28)-NH2; (Dap3(октансульфонил), hLeu5)чГрелин(1-28)-NH2; (Dap3(октансульфонил), Cha5)чГрелин(1-28)-NH2; (Dap3(октансульфонил), Thr6)чГрелин(1-28)-NH2; (Dap3(октансульфонил), Abu6)чГрелин(1-28)-NH2; (Dap3(октансульфонил), 4Hyp7)чГрелин(1-28)-NH2; (Dap3(октансульфонил), Pip7)чГрелин(1-28)-NH2; (Dap3(октансульфонил), Dhp7)чГрелин(1-28)-NH2; (Dap3(октансульфонил), Ktp7)чГрелин(1-28)-NH2; (Dap3(октансульфонил), Aib8)чГрелин(1-28)-NH2; (Dap3(октансульфонил), 2Pal9)чГрелин(1-28)-NH2; (Dap3(октансульфонил), 3Pal9)чГрелин(1-28)-NH2; (Dap3(октансульфонил), 4Pal9)чГрелин(1-28)-NH2; (Dap3(октансульфонил), Taz9)чГрелин(1-28)-NH2; (Dap3(октансульфонил), 2Thi9)чГрелин(1-28)-NH2; (Dap3(октансульфонил), 2Fua9)чГрелин(1-28)-NH2; (Dap3(октансульфонил), Apc9)чГрелин(1-28)-NH2; (Dap3(октансульфонил), Aib9)чГрелин(1-28)-NH2; (Dap3(октансульфонил), Aib10)чГрелин(1-28)-NH2; (Dap3(октансульфонил), А5с12, Orn15)чГрелин(1-28)-NH2; (Dab3(октансульфонил), А5с12, Orn15)чГрелин(1-28)-NH2; (Aib2, A6c5, A5c12, Orn15)чГрелин(1-28)-NH2; (A6c5, A5c12, Orn15)чГрелин(1-28)-NH2; (Aib2,6, A5c12, Orn15)чГрелин(1-28)-NH2; (Aib2, Act6, A5c12, Orn15)чГрелин(1-28)-NH2; (Aib2, 3Pal9, A5c12, Orn15)чГрелин(1-28)-NH2; (Aib2, Dmt7, A5c12, Orn15)чГрелин(1-28)-NH2; (Aib2, Thz7, A5c12, Orn15)чГрелин(1-28)-NH2; (Aib2, A5c5, A5c12, Orn15)чГрелин(1-28)-NH2; (Aib2,5, A5c12, Orn15)чГрелин(1-28)-NH2; (Aib2, hLeu5, A5c12, Orn15)чГрелин(1-28)-NH2; (Aib2, Cha5, A5c12, Orn15)чГрелин(1-28)-NH2; (Aib2,6, A5c12, Orn15)чГрелин(1-28)-NH2; (Aib2, Thr6, A5c12, Orn15)чГрелин(1-28)-NH2; (Aib2, Abu6, A5c12, Orn15)чГрелин(1-28)-NH2; (Aib2, 4Hyp7, A5c12, Orn15)чГрелин(1-28)-NH2; (Aib2, Pip7, A5c12, Orn15)чГрелин(1-28)-NH2; (Aib2, Dhp7, A5c12, Orn15)чГрелин(1-28)-NH2; (Aib2, Ktp7, A5c12, Orn15)чГрелин(1-28)-NH2; (Aib2,8, A5c12, Orn15)чГрелин(1-28)-NH2; (Aib2, 2Pal9, A5c12, Orn15)чГрелин(1-28)-NH2; (Aib2, 3Pal9, A5c12, Orn15)чГрелин(1-28)-NH2; (Aib2, 4Pal9, A5c12, Orn15)чГрелин(1-28)-NH2; (Aib2, Taz9, A5c12, Orn15)чГрелин(1-28)-NH2; (Aib2, 2Thi9, A5c12, Orn15)чГрелин(1-28)-NH2; (Aib2, 2Fua9, A5c12, Orn15)чГрелин(1-28)-NH2; (Aib2, Apc9, A5c12, Orn15)чГрелин(1-28)-NH2; (Aib2,9, A5c12, Orn15)чГрелин(1-28)-NH2; (Aib2,10, A5c12, Orn15)чГрелин(1-28)-NH2; (Dap3(октансульфонил), А5с12, Apc16)чГрелин(1-28)-NH2; (Dab3(октансульфонил), А5с12, Apc16)чГрелин(1-28)-NH2; (Aib2, A6c5, A5c12, Apc16)чГрелин(1-28)-NH2; (A6c5, A5c12, Apc16)чГрелин(1-28)-NH2; (Aib2,6, A5c12, Apc16)чГрелин(1-28)-NH2; (Aib2, Act6, A5c12, Apc16)чГрелин(1-28)-NH2; (Aib2, 3Pal9, A5c12, Apc16)чГрелин(1-28)-NH2; (Aib2, Dmt7, A5c12, Apc16)чГрелин(1-28)-NH2; (Aib2, Thz7, A5c12, Apc16)чГрелин(1-28)-NH2; (Aib2, A5c5,12, Apc16)чГрелин(1-28)-NH2; (Aib2,5, A5c12, Apc16)чГрелин(1-28)-NH2; (Aib2, hLeu5, A5c12, Apc16)чГрелин(1-28)-NH2; (Aib2, Cha5, A5c12, Apc16)чГрелин(1-28)-NH2; (Aib2,6, A5c12, Apc16)чГрелин(1-28)-NH2; (Aib2, Thr6, A5c12, Apc16)чГрелин(1-28)-NH2; (Aib2, Abu6, A5c12, Apc16)чГрелин(1-28)-NH2; (Aib2, 4Hyp7, A5c12, Apc16)чГрелин(1-28)-NH2; (Aib2, Pip7, A5c12, Apc16)чГрелин(1-28)-NH2; (Aib2, Dhp7, A5c12, Apc16)чГрелин(1-28)-NH2; (Aib2, Ktp7, A5c12, Apc16)чГрелин(1-28)-NH2; (Aib2,8, A5c12, Apc16)чГрелин(1-28)-NH2; (Aib2, 2Pal9, A5c12, Apc16)чГрелин(1-28)-NH2; (Aib2, 3Pal9, A5c12, Apc16)чГрелин(1-28)-NH2; (Aib2, 4Pal9, A5c12, Apc16)чГрелин(1-28)-NH2; (Aib2, Taz9, A5c12, Apc16)чГрелин(1-28)-NH2; (Aib2, 2Thi9, A5c12, Apc16)чГрелин(1-28)-NH2; (Aib2, 2Fua9, A5c12, Apc16)чГрелин(1-28)-NH2; (Aib2, Apc9, A5c12, Apc16)чГрелин(1-28)-NH2; (Aib2,9, A5c12, Apc16)чГрелин(1-28)-NH2; (Aib2,10, A5c12, Apc16)чГрелин(1-28)-NH2; (A6c5, A5c12, Orn15)чГрелин(1-28)-NH2; (Aib6, A5c12, Orn15)чГрелин(1-28)-NH2; (Act6, A5c12, Orn15)чГрелин(1-28)-NH2; (3Pal9, A5c12, Orn15)чГрелин(1-28)-NH2; (Dmt7, A5c12, Orn15)чГрелин(1-28)-NH2; (Thz7, A5c12, Orn15)чГрелин(1-28)-NH2; (A5c5, A5c12, Orn15)чГрелин(1-28)-NH2; (Aib5, A5c12, Orn15)чГрелин(1-28)-NH2; (hLeu5, A5c12, Orn15)чГрелин(1-28)-NH2; (Cha5, A5c12, Orn15)чГрелин(1-28)-NH2; (Aib6, A5c12, Orn15)чГрелин(1-28)-NH2; (Thr6, A5c12, Orn15)чГрелин(1-28)-NH2; (Abu6, A5c12, Orn15)чГрелин(1-28)-NH2; (4Hyp7, A5c12, Orn15)чГрелин(1-28)-NH2; (Pip7, A5c12, Orn15)чГрелин(1-28)-NH2; (Dhp7, A5c12, Orn15)чГрелин(1-28)-NH2; (Ktp7, A5c12, Orn15)чГрелин(1-28)-NH2; (Aib8, A5c12, Orn15)чГрелин(1-28)-NH2; (2Pal9, A5c12, Orn15)чГрелин(1-28)-NH2; (3Pal9, A5c12, Orn15)чГрелин(1-28)-NH2; (4Pal9, A5c12, Orn15)чГрелин(1-28)-NH2; (Taz9, A5c12, Orn15)чГрелин(1-28)-NH2; (2Thi9, A5c12, Orn15)чГрелин(1-28)-NH2; (2Fua9, A5c12, Orn15)чГрелин(1-28)-NH2; (Apc9, A5c12, Orn15)чГрелин(1-28)-NH2; (Aib9, A5c12, Orn15)чГрелин(1-28)-NH2; (Aib10, A5c12, Orn15)чГрелин(1-28)-NH2; (Aib6, A5c12, Apc16)чГрелин(1-28)-NH2; (A5c5, A5c12, Apc16)чГрелин(1-28)-NH2; (Act6, A5c12, Apc16)чГрелин(1-28)-NH2; (3Pal9, A5c12, Apc16)чГрелин(1-28)-NH2; (Dmt7, A5c12, Apc16)чГрелин(1-28)-NH2; (Thz7, A5c12, Apc16)чГрелин(1-28)-NH2; (Aib5, A5c12, Apc16)чГрелин(1-28)-NH2; (hLeu5, A5c12, Apc16)чГрелин(1-28)-NH2; (Cha5, A5c12, Apc16)чГрелин(1-28)-NH2; (Thr6, A5c12, Apc16)чГрелин(1-28)-NH2; (Abu6, A5c12, Apc16)чГрелин(1-28)-NH2; (4Hyp7, A5c12, Apc16)чГрелин(1-28)-NH2; (Pip7, A5c12, Apc16)чГрелин(1-28)-NH2; (Dhp7, A5c12, Apc16)чГрелин(1-28)-NH2; (Ktp7, A5c12, Apc16)чГрелин(1-28)-NH2; (Aib8, A5c12, Apc16)чГрелин(1-28)-NH2; (2Pal9, A5c12, Apc16)чГрелин(1-28)-NH2; (3Pal9, A5c12, Apc16)чГрелин(1-28)-NH2; (4Pal9, A5c12, Apc16)чГрелин(1-28)-NH2; (Taz9, A5c12, Apc16)чГрелин(1-28)-NH2; (2Thi9, A5c12, Apc16)чГрелин(1-28)-NH2; (2Fua9, A5c12, Apc16)чГрелин(1-28)-NH2; (Apc9, A5c12, Apc16)чГрелин(1-28)-NH2; (Aib9, A5c12, Apc16)чГрелин(1-28)-NH2; (Aib10, A5c12, Apc16)чГрелин(1-28)-NH2; (Aib2, Glu3(NH-гексил), A6c5)чГрелин(1-28)-NH2; (Glu3(NH-гексил), A6c5)чГрелин(1-28)-NH2; (Aib2,6, Glu3(NH-гексил))чГрелин(1-28)-NH2; (Aib2, Glu3(NH-гексил), Act6)чГрелин(1-28)-NH2; (Aib2, Glu3(NH-гексил), 3Pal9)чГрелин(1-28)-NH2; (Aib2, Glu3(NH-гексил), Dmt7)чГрелин(1-28)-NH2; (Aib2, Glu3(NH-гексил), Thz7)чГрелин(1-28)-NH2; (Aib2, Glu3(NH-гексил), A5c5)чГрелин(1-28)-NH2; (Aib2,5, Glu3(NH-гексил))чГрелин(1-28)-NH2; (Aib2, Glu3(NH-гексил), hLeu5)чГрелин(1-28)-NH2; (Aib2, Cha5)чГрелин(1-28)-NH2; (Aib2,6, Glu3(NH-гексил))чГрелин(1-28)-NH2; (Aib2, Glu3(NH-гексил), Thr6)чГрелин(1-28)-NH2; (Aib2, Glu3(NH-гексил), Abu6)чГрелин(1-28)-NH2; (Aib2, Glu3(NH-гексил), 4Hyp7)чГрелин(1-28)-NH2; (Aib2, Glu3(NH-гексил), Pip7)чГрелин(1-28)-NH2; (Aib2, Glu3(NH-гексил), Dhp7)чГрелин(1-28)-NH2; (Aib2, Glu3(NH-гексил), Ktp7)чГрелин(1-28)-NH2; (Aib2,8, Glu3(NH-гексил))чГрелин(1-28)-NH2; (Aib2, Glu3(NH-гексил), 2Pal9)чГрелин(1-28)-NH2; (Aib2, Glu3(NH-гексил), 3Pal9)чГрелин(1-28)-NH2; (Aib2, Glu3(NH-гексил), 4Pal9)чГрелин(1-28)-NH2; (Aib2, Glu3(NH-гексил), Taz9)чГрелин(1-28)-NH2; (Aib2, Glu3(NH-гексил), 2Thi9)чГрелин(1-28)-NH2; (Aib2, Glu3(NH-гексил), 2Fua9)чГрелин(1-28)-NH2; (Aib2, Glu3(NH-гексил), Apc9)чГрелин(1-28)-NH2; (Aib2,9, Glu3(NH-гексил))чГрелин(1-28)-NH2; (Aib2,10, Glu3(NH-гексил))чГрелин(1-28)-NH2; (Glu3(NH-гексил), Aib6)чГрелин(1-28)-NH2; (Glu3(NH-гексил), A5c5)чГрелин(1-28)-NH2; (Glu3(NH-гексил), Act6)чГрелин(1-28)-NH2; (Glu3(NH-гексил), 3Pal9)чГрелин(1-28)-NH2; (Glu3(NH-гексил), Dmt7)чГрелин(1-28)-NH2; (Glu3(NH-гексил), Thz7)чГрелин(1-28)-NH2; (Glu3(NH-гексил), Aib5)чГрелин(1-28)-NH2; (Glu3(NH-гексил), hLeu5)чГрелин(1-28)-NH2; (Glu3(NH-гексил), Cha5)чГрелин(1-28)-NH2; (Glu3(NH-гексил), Thr6)чГрелин(1-28)-NH2; (Glu3(NH-гексил), Abu6)чГрелин(1-28)-NH2; (Glu3(NH-гексил), 4Hyp7)чГрелин(1-28)-NH2; (Glu3(NH-гексил), Pip7)чГрелин(1-28)-NH2; (Glu3(NH-гексил), Dhp7)чГрелин(1-28)-NH2; (Glu3(NH-гексил), Ktp7)чГрелин(1-28)-NH2; (Glu3(NH-гексил), Aib8)чГрелин(1-28)-NH2; (Glu3(NH-гексил), 2Pal9)чГрелин(1-28)-NH2; (Glu3(NH-гексил), 3Pal9)чГрелин(1-28)-NH2; (Glu3(NH-гексил), 4Pal9)чГрелин(1-28)-NH2; (Glu3(NH-гексил), Taz9)чГрелин(1-28)-NH2; (Glu3(NH-гексил), 2Thi9)чГрелин(1-28)-NH2; (Glu3(NH-гексил), 2Fua9)чГрелин(1-28)-NH2; (Glu3(NH-гексил), Apc9)чГрелин(1-28)-NH2; (Glu3(NH-гексил), Aib9)чГрелин(1-28)-NH2; (Glu3(NH-гексил), Aib10)чГрелин(1-28)-NH2; (Aib2, Glu3(NH-гексил), A6c5, A5c12, Orn15)чГрелин(1-28)-NH2; (A6c5, Glu3(NH-гексил), A5c12, Orn15)чГрелин(1-28)-NH2; (Aib2,6, Glu3(NH-гексил), A5c12, Orn15)чГрелин(1-28)-NH2; (Aib2, Glu3(NH-гексил), Act6, A5c12, Orn15)чГрелин(1-28)-NH2; (Aib2, Glu3(NH-гексил), 3Pal9, A5c12, Orn15)чГрелин(1-28)-NH2; (Aib2, Glu3(NH-гексил), Dmt7, A5c12, Orn15)чГрелин(1-28)-NH2; (Aib2, Glu3(NH-гексил), Thz7, A5c12, Orn15)чГрелин(1-28)-NH2; (Aib2, Glu3(NH-гексил), A5c5, A5c12, Orn15)чГрелин(1-28)-NH2; (Aib2,5, Glu3(NH-гексил), A5c12, Orn15)чГрелин(1-28)-NH2; (Aib2, hLeu5, A5c12, Orn15)чГрелин(1-28)-NH2; (Aib2, Glu3(NH-гексил), Cha5, A5c12, Orn15)чГрелин(1-28)-NH2; (Aib2,6, Glu3(NH-гексил), A5c12, Orn15)чГрелин(1-28)-NH2; (Aib2, Glu3(NH-гексил), Thr6, A5c12, Orn15)чГрелин(1-28)-NH2; (Aib2, Glu3(NH-гексил), Abu6, A5c12, Orn15)чГрелин(1-28)-NH2; (Aib2, Glu3(NH-гексил), 4Hyp7, A5c12, Orn15)чГрелин(1-28)-NH2; (Aib2, Glu3(NH-гексил), Pip7, A5c12, Orn15)чГрелин(1-28)-NH2; (Aib2, Glu3(NH-гексил), Dhp7, A5c12, Orn15)чГрелин(1-28)-NH2; (Aib2, Glu3(NH-гексил), Ktp7, A5c12, Orn15)чГрелин(1-28)-NH2; (Aib2,8, Glu3(NH-гексил), A5c12, Orn15)чГрелин(1-28)-NH2; (Aib2, Glu3(NH-гексил), 2Pal9, A5c12, Orn15)чГрелин(1-28)-NH2; (Aib2, Glu3(NH-гексил), 3Pal9, A5c12, Orn15)чГрелин(1-28)-NH2; (Aib2, Glu3(NH-гексил), 4Pal9, A5c12, Orn15)чГрелин(1-28)-NH2; (Aib2, Glu3(NH-гексил), Taz9, A5c12, Orn15)чГрелин(1-28)-NH2; (Aib2, Glu3(NH-гексил), 2Thi9, A5c12, Orn15)чГрелин(1-28)-NH2; (Aib2, Glu3(NH-гексил), 2Fua9, A5c12, Orn15)чГрелин(1-28)-NH2; (Aib2, Glu3(NH-гексил), Apc9, A5c12, Orn15)чГрелин(1-28)-NH2; (Aib2,9, Glu3(NH-гексил), A5c12, Orn15)чГрелин(1-28)-NH2; (Aib2,12, Glu3(NH-гексил), 4Pal9, Orn15)чГрелин(1-28)-NH2; (Aib2,10, Glu3(NH-гексил), A5c12, Orn15)чГрелин(1-28)-NH2; (Aib2, Glu3(NH-гексил), A6c5, A5c12, Apc16)чГрелин(1-28)-NH2; (Glu3(NH-гексил), A6c5, A5c12, Apc16)чГрелин(1-28)-NH2; (Aib2,6, Glu3(NH-гексил), A5c12, Apc16)чГрелин(1-28)-NH2; (Aib2, Glu3(NH-гексил), Act6, A5c12, Apc16)чГрелин(1-28)-NH2; (Aib2, Glu3(NH-гексил), 3Pal9, A5c12, Apc16)чГрелин(1-28)-NH2; (Aib2, Glu3(NH-гексил), Dmt7, A5c12, Apc16)чГрелин(1-28)-NH2; (Aib2, Glu3(NH-гексил), Thz7, A5c12, Apc16)чГрелин(1-28)-NH2; (Aib2, Glu3(NH-гексил), A5c5,12, Apc16)чГрелин(1-28)-NH2; (Aib2,5, Glu3(NH-гексил), A5c12, Apc16)чГрелин(1-28)-NH2; (Aib2, Glu3(NH-гексил), hLeu5, A5c12, Apc16)чГрелин(1-28)-NH2; (Aib2, Glu3(NH-гексил), Cha5, A5c12, Apc16)чГрелин(1-28)-NH2; (Aib2,6, Glu3(NH-гексил), A5c12, Apc16)чГрелин(1-28)-NH2; (Aib2, Glu3(NH-гексил), Thr6, A5c12, Apc16)чГрелин(1-28)-NH2; (Aib2, Glu3(NH-гексил), Abu6, A5c12, Apc16)чГрелин(1-28)-NH2; (Aib2, Glu3(NH-гексил), 4Hyp7, A5c12, Apc16)чГрелин(1-28)-NH2; (Aib2, Glu3(NH-гексил), Pip7, A5c12, Apc16)чГрелин(1-28)-NH2; (Aib2, Glu3(NH-гексил), Dhp7, A5c12, Apc16)чГрелин(1-28)-NH2; (Aib2, Glu3(NH-гексил), Ktp7, A5c12, Apc16)чГрелин(1-28)-NH2; (Aib2,8, Glu3(NH-гексил), A5c12, Apc16)чГрелин(1-28)-NH2; (Aib2, Glu3(NH-гексил), 2Pal9, A5c12, Apc16)чГрелин(1-28)-NH2; (Aib2, Glu3(NH-гексил), 3Pal9, A5c12, Apc16)чГрелин(1-28)-NH2; (Aib2, Glu3(NH-гексил), 4Pal9, A5c12, Apc16)чГрелин(1-28)-NH2; (Aib2, Glu3(NH-гексил), Taz9, A5c12, Apc16)чГрелин(1-28)-NH2; (Aib2, Glu3(NH-гексил), 2Thi9, A5c12, Apc16)чГрелин(1-28)-NH2; (Aib2, Glu3(NH-гексил), 2Fua9, A5c12, Apc16)чГрелин(1-28)-NH2; (Aib2, Glu3(NH-гексил), Apc9, A5c12, Apc16)чГрелин(1-28)-NH2; (Aib2,9, Glu3(NH-гексил), A5c12, Apc16)чГрелин(1-28)-NH2; (Aib2,10, Glu3(NH-гексил), A5c12, Apc16)чГрелин(1-28)-NH2; (Glu3(O-гексил))чГрелин(1-28)-NH2; (Aib2)чГрелин(1-28)-NH2; (Glu3(NH-гексил))чГрелин(1-28)-NH2; (Aib2, Glu3(O-гексил))чГрелин(1-28)-NH2; (Aib1, Glu3(O-гексил))чГрелин(1-28)-NH2; (Aib2, Glu3(NH-гексил))чГрелин(1-28)-NH2; (Dap3(1-октансульфонил))чГрелин(1-28)-NH2; (Aib2, Dap3(1-октансульфонил))чГрелин(1-28)-NH2; (Aib1, Dap3(1-октансульфонил))чГрелин(1-28)-NH2; (Ava2, Dap3(1-октансульфонил))чГрелин(1-28)-NH2; (Ac-Gly1)чГрелин(1-5)-NH2; (Ac-Gly1)чГрелин(1-6)-NH2; (Ac-Gly1)чГрелин(1-7)-NH2; (Ac-Gly1, Aib2)чГрелин(1-28)-NH2; (Ac-Gly1, Aib2, Glu3(NH-гексил))чГрелин(1-5)-NH2; (Ac-Gly1, Aib2, Glu3(NH-гексил))чГрелин(1-6)-NH2; (Ac-Gly1, Aib2, Glu3(NH-гексил))чГрелин(1-7)-NH2; (Ac-Gly1, Aib2, Glu3(NH-гексил))чГрелин(1-28)-NH2; (Ac-Gly1, Aib2, Glu3(NH-гексил, Arg8)чГрелин(1-8)-NH2; (Ac-Gly1, Aib2, Glu3(NH-гексил, Lys8)чГрелин(1-8)-NH2; (Ac-Gly1, Aib2,10, Glu3(NH-гексил))чГрелин(1-28)-NH2; (н-бутирил-Gly1)чГрелин(1-28)-NH2; (н-бутирил-Gly1, Aib2, Glu3(NH-гексил))чГрелин(1-28)-NH2; (изобутирил-Gly1)чГрелин(1-28)-NH2 или (н-октаноил-Gly1)чГрелин(1-28)-NH2, или его фармацевтически приемлемая соль. Еще более предпочтительным соединением в соответствии с формулой (I), называемым соединением Группы 4, является соединение формулы: (Thr6)чГрелин(1-28)-NH2; (4Hyp7)чГрелин(1-28)-NH2; (Aib8)чГрелин(1-28)-NH2; (Taz9)чГрелин(1-28)-NH2; (3Pal9)чГрелин(1-28)-NH2; (4Pal9)чГрелин(1-28)-NH2; (2Thi9)чГрелин(1-28)-NH2; (Aib2, Glu3(NH-гексил), Taz9)чГрелин(1-28)-NH2; (Aib2, Glu3(NH-гексил), Thr6)чГрелин(1-28)-NH2; (Aib2, Glu3(NH-гексил), 2Thi9)чГрелин(1-28)-NH2; (Aib2, Thr6)чГрелин(1-28)-NH2; (Aib2, 2Thi9)чГрелин(1-28)-NH2; чГрелин(1-28)-NH2; (Asp3(NH-гептил))чГрелин(1-28)-NH2; (Glu3(NH-гексил))чГрелин(1-28)-NH2; (Aib1)чГрелин(1-28)-NH2; (Aib2)чГрелин(1-28)-NH2; (Glu3(O-гексил))чГрелин(1-28)-NH2; (Asp3(O-гексил))чГрелин(1-28)-NH2; Cys3(S(CH2)9CH3)чГрелин(1-28)-NH2; (Aib2, Glu3(NH-гексил))чГрелин(1-28)-NH2; (Aib2,6)чГрелин(1-28)-NH2; (Aib2, Act6)чГрелин(1-28)-NH2; (A5c2)чГрелин(1-28)-NH2; (Act2)чГрелин(1-28)-NH2; (Aib2, A6c5)чГрелин(1-28)-NH2; (A6c5)чГрелин(1-28)-NH2; (Lys5)чГрелин(1-28)-NH2; (Aib2, 3Pal9)чГрелин(1-28)-NH2; (Dap3(октансульфонил))чГрелин(1-28)-NH2; (Aib2, Thz7)чГрелин(1-28)-NH2; (Aib2, Cha5)чГрелин(1-28)-NH2; (Aib2, Abu6)чГрелин(1-28)-NH2; (Aib2, 4Hyp7)чГрелин(1-28)-NH2; (Aib2, Taz9)чГрелин(1-28)-NH2; (Aib2, 4Pal9)чГрелин(1-28)-NH2; (Aib2, Dhp7)чГрелин(1-28)-NH2; (Aib2,8)чГрелин(1-28)-NH2; (Aib2, Pip7)чГрелин(1-28)-NH2; (Aib2, Glu3(NH-гексил), 4Hyp7)чГрелин(1-28)-NH2; (Aib2,8, Glu3(NH-гексил))чГрелин(1-28)-NH2; (Aib2,12, Glu3(NH-гексил), 4Pal9, Orn15)чГрелин(1-28)-NH2; (Aib2, Glu3(NH-гексил), 4Pal9)чГрелин(1-28)-NH2; (Aib2, Glu3(NH-гексил), 3Pal9)чГрелин(1-28)-NH2; (Aib2,10)чГрелин(1-28)-NH2; (Aib2,10, Glu3(NH-гексил))чГрелин(1-28)-NH2; (Ac-Gly1)чГрелин(1-5)-NH2; (Ac-Gly1)чГрелин(1-6)-NH2; (Ac-Gly1)чГрелин(1-7)-NH2; (Ac-Gly1, Aib2)чГрелин(1-28)-NH2; (Ac-Gly1, Aib2, Glu3(NH-гексил))чГрелин(1-5)-NH2; (Ac-Gly1, Aib2, Glu3(NH-гексил))чГрелин(1-6)-NH2; (Ac-Gly1, Aib2, Glu3(NH-гексил))чГрелин(1-7)-NH2; (Ac-Gly1, Aib2, Glu3(NH-гексил))чГрелин(1-28)-NH2; (Ac-Gly1, Aib2, Glu3(NH-гексил), Arg8)чГрелин(1-8)-NH2; (Ac-Gly1, Aib2, Glu3(NH-гексил), Lys8)чГрелин(1-8)-NH2; (Ac-Gly1, Aib2,10, Glu3(NH-гексил))чГрелин(1-28)-NH2; (н-бутирил-Gly1)чГрелин(1-28)-NH2; (н-бутирил-Gly1, Aib2, Glu3(NH-гексил))чГрелин(1-28)-NH2; (изобутирил-Gly1)чГрелин(1-28)-NH2 или (н-октаноил-Gly1)чГрелин(1-28)-NH2, или его фармацевтически приемлемая соль. Еще более предпочтительным соединением в соответствии с формулой (I), называемым соединением Группы 5, является соединение формулы: (Aib2, 3Pal9)чГрелин(1-28)-NH2; (Aib2, 4Hyp7)чГрелин(1-28)-NH2; (Aib2, Taz9)чГрелин(1-28)-NH2; (Aib2, Dhp7)чГрелин(1-28)-NH2; (Aib2,8)чГрелин(1-28)-NH2; (Aib2,8, Glu3(NH-гексил))чГрелин(1-28)-NH2; (Aib2,10, Glu3(NH-гексил))чГрелин(1-28)-NH2; (Aib2, Glu3(NH-гексил))чГрелин(1-28)-NH2; (Ac-Gly1)чГрелин(1-5)-NH2; (Ac-Gly1)чГрелин(1-6)-NH2; (Ac-Gly1)чГрелин(1-7)-NH2; (Ac-Gly1, Aib2)чГрелин(1-28)-NH2; (Ac-Gly1, Aib2, Glu3(NH-гексил))чГрелин(1-5)-NH2; (Ac-Gly1, Aib2, Glu3(NH-гексил))чГрелин(1-6)-NH2; (Ac-Gly1, Aib2, Glu3(NH-гексил))чГрелин(1-7)-NH2; (Ac-Gly1, Aib2, Glu3(NH-гексил))чГрелин(1-28)-NH2; (Ac-Gly1, Aib2, Glu3(NH-гексил), Arg8)чГрелин(1-8)-NH2; (Ac-Gly1, Aib2, Glu3(NH-гексил), Lys8)чГрелин(1-8)-NH2; (Ac-Gly1, Aib2,10, Glu3(NH-гексил))чГрелин(1-28)-NH2; (н-бутирил-Gly1)чГрелин(1-28)-NH2; (н-бутирил-Gly1, Aib2, Glu3(NH-гексил))чГрелин(1-28)-NH2; (изобутирил-Gly1)чГрелин(1-28)-NH2 или (н-октаноил-Gly1)чГрелин(1-28)-NH2, или его фармацевтически приемлемая соль. Другим еще более предпочтительным соединением в соответствии с формулой (I), называемым соединением Группы 6, является соединение формулы: (Aib2, 3Pal9)чГрелин(1-28)-NH2; (Aib2, 4Hyp7)чГрелин(1-28)-NH2; (Aib2, Taz9)чГрелин(1-28)-NH2; (Aib2, Dhp7)чГрелин(1-28)-NH2; (Aib2,8)чГрелин(1-28)-NH2; (Aib2,8, Glu3(NH-гексил))чГрелин(1-28)-NH2; (Aib2, Glu3(NH-гексил))чГрелин(1-28)-NH2; (Ac-Gly1)чГрелин(1-5)-NH2; (Ac-Gly1)чГрелин(1-6)-NH2; (Ac-Gly1)чГрелин(1-7)-NH2; (Ac-Gly1, Aib2)чГрелин(1-28)-NH2; (Ac-Gly1, Aib2, Glu3(NH-гексил))чГрелин(1-5)-NH2; (Ac-Gly1, Aib2, Glu3(NH-гексил))чГрелин(1-6)-NH2; (Ac-Gly1, Aib2, Glu3(NH-гексил))чГрелин(1-7)-NH2; (Ac-Gly1, Aib2, Glu3(NH-гексил))чГрелин(1-28)-NH2; (Ac-Gly1, Aib2, Glu3(NH-гексил), Arg8)чГрелин(1-8)-NH2; (Ac-Gly1, Aib2, Glu3(NH-гексил), Lys8)чГрелин(1-8)-NH2; (Ac-Gly1, Aib2,10, Glu3(NH-гексил))чГрелин(1-28)-NH2; (н-бутирил-Gly1)чГрелин(1-28)-NH2; (н-бутирил-Gly1, Aib2, Glu3(NH-гексил))чГрелин(1-28)-NH2; (изобутирил-Gly1)чГрелин(1-28)-NH2 или (н-октаноил-Gly1)чГрелин(1-28)-NH2, или его фармацевтически приемлемая соль. Другим предпочтительным соединением в соответствии с формулой (I), называемым соединением Группы 7, является соединение формулы: (Glu3(O-гексил))чГрелин(1-28)-NH2; (Aib2)чГрелин(1-28)-NH2; (Glu3(NH-гексил))чГрелин(1-28)-NH2 или (Cys3(S-децил))чГрелин(1-28)-NH2, или его фармацевтически приемлемая соль. Еще одним предпочтительным соединением в соответствии с формулой (I), называемым соединением Группы 8, является соединение формулы: (des-Ser2)чГрелин(1-28)-NH2 или (des-Gly1, des-Ser2)чГрелин(1-28)-NH2, или его фармацевтически приемлемая соль. Другим предпочтительным соединением в соответствии с формулой (I), называемым соединением Группы 9, является соединение формулы: (Aib1, Ser3)чГрелин(1-28)-NH2; (Aib2, Ser3)чГрелин(1-28)-NH2; (Aib2,6, Ser3)чГрелин(1-28)-NH2; (A5c5, Ser3)чГрелин(1-28)-NH2; (Aib2, Ser3, 3Pal9)чГрелин(1-28)-NH2; (Aib2, Ser3, Thz7)чГрелин(1-28)-NH2; (Aib2, Ser3, Cha5)чГрелин(1-28)-NH2; (Aib2, Ser3, Abu6)чГрелин(1-28)-NH2; (Aib2, Ser3, 4Hyp7)чГрелин(1-28)-NH2; (Aib2, Ser3, Taz9)чГрелин(1-28)-NH2; (Aib2,4, Ser3, 4Pal9)чГрелин(1-28)-NH2; (Aib2, Ser3, Dhp7)чГрелин(1-28)-NH2; (Aib2,8, Ser3)чГрелин(1-28)-NH2; (Aib2, Ser3, Pip7)чГрелин(1-28)-NH2; (Ac-Gly1, Aib2,10, Ser3)чГрелин(1-28)-NH2; (Aib2,10, Ser3)чГрелин(1-28)-NH2; (н-октаноил-Gly1, Ser3)чГрелин(1-28)-NH2; (изобутирил-Gly1, Ser3)чГрелин(1-28)-NH2; (н-бутирил-Gly1, Ser3)чГрелин(1-28)-NH2; (н-бутирил-Gly1, Aib2, Ser3)чГрелин(1-28)-NH2; (Ac-Gly1, Aib2, Ser3)чГрелин(1-28)-NH2; (Aib2, Ser3, Tic7)чГрелин(1-28)-NH2; (Ac-Gly1, Aib2, Ser3, Arg8)чГрелин(1-8)-NH2; (Ser3, Aib8)чГрелин(1-28)-NH2; (Ser3, Taz9)чГрелин(1-28)-NH2; (Ser3, 3Pal9)чГрелин(1-28)-NH2; (Ser3, 4Pal9)чГрелин(1-28)-NH2; (Aib2, Ser3, 2Thi9)чГрелин(1-28)-NH2; (Ser3, 2Thi9)чГрелин(1-28)-NH2; (Ser3, 4Hyp7)чГрелин(1-28)-NH2; (Aib2, Ser3, Tic7)чГрелин(1-28)-NH2; (Aib1, Thr3)чГрелин(1-28)-NH2; (Aib2, Thr3)чГрелин(1-28)-NH2; (Aib2,6, Thr3)чГрелин(1-28)-NH2; (A5c5, Thr3)чГрелин(1-28)-NH2; (Aib2, Thr3, 3Pal9)чГрелин(1-28)-NH2; (Aib2, Thr3, Thz7)чГрелин(1-28)-NH2; (Aib2, Thr3, Cha5)чГрелин(1-28)-NH2; (Aib2, Thr3, Abu6)чГрелин(1-28)-NH2; (Aib2, Thr3, 4Hyp7)чГрелин(1-28)-NH2; (Aib2, Thr3, Taz9)чГрелин(1-28)-NH2; (Aib2,4, Thr3, 4Pal9)чГрелин(1-28)-NH2; (Aib2, Thr3, Dhp7)чГрелин(1-28)-NH2; (Aib2,8, Thr3)чГрелин(1-28)-NH2; (Aib2, Thr3, Pip7)чГрелин(1-28)-NH2; (Ac-Gly1, Aib2,10, Thr3)чГрелин(1-28)-NH2; (Aib2,10, Thr3)чГрелин(1-28)-NH2; (н-октаноил-Gly1, Thr3)чГрелин(1-28)-NH2; (изобутирил-Gly1, Thr3)чГрелин(1-28)-NH2; (н-бутирил-Gly1, Thr3)чГрелин(1-28)-NH2; (н-бутирил-Gly1, Aib2, Thr3)чГрелин(1-28)-NH2; (Ac-Gly1, Aib2, Thr3)чГрелин(1-28)-NH2; (Aib2, Thr3, Tic7)чГрелин(1-28)-NH2; (Ac-Gly1, Aib2, Thr3, Arg8)чГрелин(1-8)-NH2; (Thr3, Aib8)чГрелин(1-28)-NH2; (Thr3, Taz9)чГрелин(1-28)-NH2; (Thr3, 3Pal9)чГрелин(1-28)-NH2; (Thr3, 4Pal9)чГрелин(1-28)-NH2; (Aib2, Thr3, 2Thi9)чГрелин(1-28)-NH2; (Thr3, 2Thi9)чГрелин(1-28)-NH2; (Thr3, 4Hyp7)чГрелин(1-28)-NH2; (Aib2, Thr3, Tic7)чГрелин(1-28)-NH2; (Aib2, Tic7)чГрелин(1-28)-NH2; (Ac-Gly1)чГрелин(1-28)-NH2; (Ac-Gly1, Glu3(NH-гексил))чГрелин(1-28)-NH2 или (Ac-Gly1, Ser3)чГрелин(1-28)-NH2, или его фармацевтически приемлемая соль. Еще одним предпочтительным соединением в соответствии с формулой (I), называемым соединением Группы 10, является соединение формулы: (Aib1, Ser3)чГрелин(1-28)-NH2; (Aib2, Ser3)чГрелин(1-28)-NH2; (Aib2,6, Ser3)чГрелин(1-28)-NH2; (A5c5, Ser3)чГрелин(1-28)-NH2; (Aib2, Ser3, 3Pal9)чГрелин(1-28)-NH2; (Aib2, Ser3, Thz7)чГрелин(1-28)-NH2; (Aib2, Ser3, Cha5)чГрелин(1-28)-NH2; (Aib2, Ser3, Abu6)чГрелин(1-28)-NH2; (Aib2, Ser3, 4Hyp7)чГрелин(1-28)-NH2; (Aib2, Ser3, Taz9)чГрелин(1-28)-NH2; (Aib2,4, Ser3, 4Pal9)чГрелин(1-28)-NH2; (Aib2, Ser3, Dhp7)чГрелин(1-28)-NH2; (Aib2,8, Ser3)чГрелин(1-28)-NH2; (Aib2, Ser3, Pip7)чГрелин(1-28)-NH2; (Ac-Gly1, Aib2,10, Ser3)чГрелин(1-28)-NH2; (Aib2,10, Ser3)чГрелин(1-28)-NH2; (н-октаноил-Gly1, Ser3)чГрелин(1-28)-NH2; (изобутирил-Gly1, Ser3)чГрелин(1-28)-NH2; (н-бутирил-Gly1, Ser3)чГрелин(1-28)-NH2; (н-бутирил-Gly1, Aib2, Ser3)чГрелин(1-28)-NH2; (Ac-Gly1, Aib2, Ser3)чГрелин(1-28)-NH2; (Aib2, Ser3, Tic7)чГрелин(1-28)-NH2; (Ac-Gly1, Aib2, Ser3, Arg8)чГрелин(1-8)-NH2; (Ser3, Aib8)чГрелин(1-28)-NH2; (Ser3, Taz9)чГрелин(1-28)-NH2; (Ser3, 3Pal9)чГрелин(1-28)-NH2; (Ser3, 4Pal9)чГрелин(1-28)-NH2; (Aib2, Ser3, 2Thi9)чГрелин(1-28)-NH2; (Ser3, 2Thi9)чГрелин(1-28)-NH2; (Ser3, 4Hyp7)чГрелин(1-28)-NH2 или (Aib2, Ser3, Tic7)чГрелин(1-28)-NH2, или его фармацевтически приемлемая соль. Еще одним предпочтительным соединением в соответствии с формулой (I), называемым соединением Группы 11, является соединение формулы: (Aib1, Ser3)чГрелин(1-28)-NH2; (Aib2, Ser3)чГрелин(1-28)-NH2; (Aib2,6, Ser3)чГрелин(1-28)-NH2; (A5c5, Ser3)чГрелин(1-28)-NH2; (Aib2, Ser3, 3Pal9)чГрелин(1-28)-NH2; (Aib2, Ser3, Thz7)чГрелин(1-28)-NH2; (Aib2, Ser3, Cha5)чГрелин(1-28)-NH2; (Aib2, Ser3, Abu6)чГрелин(1-28)-NH2; (Aib2, Ser3, 4Hyp7)чГрелин(1-28)-NH2; (Aib2, Ser3, Taz9)чГрелин(1-28)-NH2; (Aib2,4, Ser3, 4Pal9)чГрелин(1-28)-NH2; (Aib2, Ser3, Dhp7)чГрелин(1-28)-NH2; (Aib2,8, Ser3)чГрелин(1-28)-NH2; (Aib2, Ser3, Pip7)чГрелин(1-28)-NH2; (Ac-Gly1, Aib2,10, Ser3)чГрелин(1-28)-NH2; (Aib2,10, Ser3)чГрелин(1-28)-NH2; (н-октаноил-Gly1, Ser3)чГрелин(1-28)-NH2; (изобутирил-Gly1, Ser3)чГрелин(1-28)-NH2; (н-бутирил-Gly1, Ser3)чГрелин(1-28)-NH2; (н-бутирил-Gly1, Aib2, Ser3)чГрелин(1-28)-NH2; (Ac-Gly1, Aib2, Ser3)чГрелин(1-28)-NH2; (Aib2, Ser3, Tic7)чГрелин(1-28)-NH2; (Ac-Gly1, Aib2, Ser3, Arg8)чГрелин(1-8)-NH2; (Ser3, Aib8)чГрелин(1-28)-NH2; (Ser3, Taz9)чГрелин(1-28)-NH2; (Ser3, 3Pal9)чГрелин(1-28)-NH2; (Ser3, 4Pal9)чГрелин(1-28)-NH2; (Aib2, Ser3, 2Thi9)чГрелин(1-28)-NH2; (Ser3, 2Thi9)чГрелин(1-28)-NH2; (Ser3, 4Hyp7)чГрелин(1-28)-NH2 или (Aib2, Ser3, Tic7)чГрелин(1-28)-NH2, или его фармацевтически приемлемая соль. Еще одним предпочтительным соединением в соответствии с формулой (I), называемым соединением Группы 12, является соединение формулы: (Aib2, Tic7)чГрелин(1-28)-NH2; (Ac-Gly1)чГрелин(1-28)-NH2; (Ac-Gly1, Glu3(NH-гексил))чГрелин(1-28)-NH2 или (Ac-Gly1, Ser3)чГрелин(1-28)-NH2, или его фармацевтически приемлемая соль. Описанные здесь аналоги грелина являются активными в отношении одного или нескольких GHS-рецепторов. Эти аналоги могут связываться с рецептором и предпочтительно стимулировать рецепторную активность. Аналоги грелина имеют различные применения, в том числе используются в качестве инструмента для исследований и используются терапевтически. Применения в качестве инструмента для исследований включают в себя использование аналога грелина и присутствие GHS-рецептора или его фрагмента. GHS-рецептор может присутствовать в различных окружениях, таких как субъект-млекопитающее, целая клетка или фрагмент мембраны. Примеры применений в качестве инструмента для исследований включают в себя скрининг на соединения, активные при GHS-рецепторе, определение присутствия GHS-рецептора в пробе или препарате и испытание роли или эффекта грелина. Аналоги грелина могут быть использованы для скрининга либо на агонисты грелина, либо на антагонисты грелина. Скрининг на агонисты грелина может выполняться, например, с использованием аналога грелина в конкурентном эксперименте с тест-соединениями. Скрининг на антагонисты грелина может выполняться, например, с использованием аналога грелина для получения GHS-рецепторной активности и затем измерения способности соединения изменять GHS-рецепторную активность. Таким образом, другой аспект данного изобретения описывает способ скрининга на соединение, способное связываться с GHS-рецептором. Этот способ предусматривает стадию измерения способности соединения влиять на связывание аналога грелина либо с этим рецептором, фрагментом рецептора, содержащим сайт связывания грелина, полипептидом, содержащим этот фрагмент, либо с производным этого полипептида. Другой аспект данного изобретения описывает способ получения благотворного эффекта у субъекта, предусматривающий стадию введения этому субъекту эффективного количества одного или нескольких соединений в соответствии с формулой (I), более предпочтительно соединения в соответствии с одной или несколькими из Группы 1, Группы 2, Группы 3, Группы 4, Группы 5, Группы 6, Группы 7, Группы 8, Группы 9, Группы 10, Группы 11 и/или Группы 12 или его фармацевтически приемлемой соли, где вводимое количество является эффективным для получения благотворного эффекта в лечении (например, излечения или уменьшения тяжести) или профилактике (например, снижения вероятности возникновения или тяжести) заболевания или нарушения. Грелин индуцирует высвобождение гормона роста из первичной культуры клеток гипофиза зависимым от дозы образом без стимуляции высвобождения других гормонов гипофиза. При инъекции внутривенно анестезированным крысам грелин стимулировал пульсирующее высвобождение гормона роста (Kojima et al., Nature 1999, 402, 656-660). Таким образом, другой аспект данного изобретения описывает способ стимуляции секреции гормона роста у субъекта, нуждающегося в такой стимуляции, предусматривающий стадию введения субъекту эффективного количества одного или нескольких соединений в соответствии с формулой (I), более предпочтительно соединения в соответствии с одной или несколькими из Группы 1, Группы 2, Группы 3, Группы 4, Группы 5, Группы 6, Группы 7, Группы 8, Группы 9, Группы 10, Группы 11 и/или Группы 12 или его фармацевтически приемлемой соли, где указанное эффективное количество является по меньшей мере количеством, достаточным для получения детектируемого увеличения секреции гормона роста, и предпочтительно является количеством, достаточным для получения благотворного эффекта у субъекта. Предпочтительным способом непосредственно предыдущего способа является способ, в котором указанная стимуляция секреции гормона роста показана (необходима) для лечения состояния недостаточности гормона роста, для увеличения мышечной массы, для увеличения плотности костей, для лечения половой дисфункции у мужчин и женщин, для облегчения увеличения массы, для облегчения поддержания массы, для облегчения поддержания физической деятельности, для облегчения восстановления физической функции и/или для облегчения увеличения аппетита. Предпочтительным способом непосредственно предыдущего способа является способ, в котором облегчение прибавления массы, поддержания массы и/или увеличения аппетита является показанным (необходимым) у субъекта, имеющего заболевание или нарушение или подвергающегося лечению, которое сопровождается потерей массы. Предпочтительным способом непосредственно предыдущего способа является способ, в котором указанные заболевания или нарушения, сопровождающиеся потерей массы, включают в себя анорексию, булимию, раковую кахексию, СПИД, гипотрофию, общее истощение и гипотрофию у болезненных пожилых субъектов. Другим предпочтительным способом непосредственно предыдущего способа является способ, в котором лечение, сопровождающееся потерей массы, включает в себя химиотерапию, лучевую терапию, временную или перманентную иммобилизацию и/или диализ. Аналоги грелина, описанные здесь, могут быть также антагонистами действий грелина in vitro и in vivo. Таким образом, другой аспект данного изобретения описывает способ торможения секреции гормона роста у субъекта, нуждающегося в таком торможении, предусматривающий стадию введения этому субъекту эффективного количества одного или нескольких соединений в соответствии с формулой (I), более предпочтительно соединения в соответствии с одной или несколькими из Группы 1, Группы 2, Группы 3, Группы 4, Группы 5, Группы 6, Группы 7, Группы 8, Группы 9, Группы 10, Группы 11 и/или Группы 12 или его фармацевтически приемлемой соли, где указанное эффективное количество является по меньшей мере количеством, достаточным для получения детектируемого уменьшения секреции гормона роста, и предпочтительно является количеством, достаточным для получения благотворного эффекта у субъекта. Предпочтительным способом непосредственно предыдущего способа является способ, в котором торможение секреции гормона роста показано (необходимо) для лечения заболевания или состояния, характеризующегося избыточной секрецией гормона роста, для облегчения потери массы, для облегчения уменьшения аппетита, для облегчения поддержания массы, для лечения ожирения, для лечения диабета, для лечения осложнений диабета, включая ретинопатию, и/или для лечения сердечно-сосудистых нарушений. Предпочтительным способом непосредственно предыдущего способа является способ, в котором избыточная масса является фактором, способствующим заболеванию или состоянию, включая гипертензию, диабет, дислипидемию, сердечно-сосудистое заболевание, желчные конкременты, остеоартрит и различные виды рака. Следующим предпочтительным способом непосредственно предыдущего способа является способ, в котором облегчение потери массы уменьшает вероятность таких заболеваний и состояний или в котором облегчение потери массы включает в себя по меньшей мере частично лечение таких заболеваний или состояний. Другой аспект данного изобретения описывает способ лечения сердечно-сосудистого нарушения у субъекта, нуждающегося в таком лечении, предусматривающий стадию введения этому субъекту эффективного количества одного или нескольких соединений или их фармацевтически приемлемой соли, в соответствии с формулой (I), более предпочтительно соединения в соответствии с одной или несколькими из Группы 1, Группы 2, Группы 3, Группы 4, Группы 5, Группы 6, Группы 7, Группы 8, Группы 9, Группы 10, Группы 11 и/или Группы 12 и наиболее предпочтительно агониста рецептора грелина, где эффективное количество является количеством, достаточным для получения благотворного эффекта у субъекта. В одном варианте осуществления этим сердечно-сосудистым нарушением является тяжелая хроническая сердечная недостаточность. В другом варианте осуществления это соединение ингибирует апоптоз в кардиомиоцитах и/или эндотелиальных клетках. Другой аспект данного изобретения описывает способ вызывания эффекта у субъекта, опосредованного агонизмом в отношении рецептора грелина (например, лечения или профилактики мышечно-скелетной болезненности, лечения или профилактики диабета, лечения или профилактики застойной сердечной недостаточности, лечения или профилактики ожирения, лечения или профилактики болезненности (хрупкости), связанной со старением, или болезненности, связанной с ожирением, лечения инсулинорезистентности, ускорения заживления переломов костей, аттенуирования катаболической реакции белков после обширного оперативного вмешательства, уменьшения кахексии и потери белка вследствие хронической болезни, ускорения заживления ран, ускорения выздоровления пациентов с ожогами или пациентов, подвергшихся обширному оперативному вмешательству, улучшения мышечной силы или подвижности, улучшения поддержания толщины кожи, поддержания метаболического гомеостаза или поддержания почечного гомеостаза), в котором это соединение связывается с одним или несколькими рецепторами стимуляторов секреции гормона роста. Этот способ включает в себя стадию введения этому субъекту эффективного количества одного или нескольких соединений или их фармацевтически приемлемой соли в соответствии с формулой (I), более предпочтительно соединения в соответствии с одной или несколькими из Группы 1, Группы 2, Группы 3, Группы 4, Группы 5, Группы 6, Группы 7, Группы 8, Группы 9, Группы 10, Группы 11 и/или Группы 12 и наиболее предпочтительно соединения, в котором А3 обозначает Ser, Glu, Dap или Dab, где это соединение является агонистом для рецептора (рецепторов) и вводится в количестве, достаточном для вызывания данного эффекта. Еще в одном аспекте данного изобретения описан способ вызывания эффекта у субъекта, опосредованного антагонизмом в отношении рецептора грелина (например, уменьшения аппетита, потери массы или уменьшения метаболизма), в котором это соединение связывается с одним или несколькими рецепторами стимуляторов секреции гормона роста. Этот способ включает в себя стадию введения этому субъекту эффективного количества одного или нескольких соединений или их фармацевтически приемлемой соли в соответствии с формулой (I), более предпочтительно соединения в соответствии с одной или несколькими из Группы 1, Группы 2, Группы 3, Группы 4, Группы 5, Группы 6, Группы 7, Группы 8, Группы 9, Группы 10, Группы 11 и/или Группы 12 и наиболее предпочтительно соединения, в котором А3 обозначает Ser, Glu, Dap или Dab, где это соединение является антагонистом для рецептора (рецепторов) и вводится в количестве, достаточном для вызывания данного эффекта. Аналоги грелина могут быть введены субъекту. «Субъектом» называют млекопитающее или отличное от млекопитающего животное, включая, например, без ограничения, человека, крысу, мышь или сельскохозяйственное животное. Ссылка на субъект включает в себя, например, млекопитающее или отличное от млекопитающего животное, которое получает дозы аналога грелина в виде части эксперимента, млекопитающее или отличное от млекопитающего животное, которое подвергается лечению, для облегчения ослабления заболевания или нарушения, и млекопитающее или отличное от млекопитающего животное, которое подвергается профилактическому лечению для задержки или предотвращения возникновения заболевания или нарушения. Агонисты грелина могут быть использованы для получения благотворного эффекта у субъекта, такого как один или несколько из следующих эффектов: лечение состояния недостаточности гормона роста, увеличение мышечной массы, увеличение плотности костей, лечение половой дисфункции у мужчин или женщин, облегчение увеличения массы, облегчение поддержания массы, облегчение поддержания физической деятельности, облегчение восстановления физической функции и/или облегчение увеличения аппетита. Облегчение увеличения массы, поддержания массы или увеличения аппетита является особенно полезным для пациента, имеющего заболевание или состояние или подвергающегося обработке, которая сопровождается потерей массы. Примеры заболеваний или нарушений, сопровождающихся потерей массы, включают в себя анорексию, булимию, раковую кахексию, СПИД, гипотрофию, общее истощение и гипотрофию в случае болезненных пожилых людей. Примеры обработок, сопровождающихся потерей массы, включают в себя химиотерапию, лучевую терапию, временную или перманентную иммобилизацию и диализ. Антагонисты грелина также могут быть использованы для получения благоприятного эффекта у субъекта. Например, антагонист грелина может быть использован для облегчения потери массы, облегчения уменьшения аппетита, облегчения поддержания массы, лечения ожирения, лечения диабета, лечения осложнений диабета, включая ретинопатию, и/или лечения сердечно-сосудистых нарушений. Избыточная масса является фактором, способствующим различным заболеваниям, в том числе гипертензии, диабету, дислипидемии, сердечно-сосудистому заболеванию, желчным конкрементам, остеоартриту и определенным формам рака. Вызывание потери массы может быть использовано, например, для уменьшения вероятности таких заболеваний и в виде части лечения таких заболеваний. Другие признаки и преимущества данного изобретения являются очевидными из дополнительных описаний, обеспеченных здесь, в том числе различных примеров. Приведенные примеры иллюстрируют различные компоненты и методологию, используемые в применении на практике данного изобретения. Эти примеры не ограничивают заявленное изобретение. На основе данного описания специалист с квалификацией в данной области может идентифицировать и использовать другие компоненты и методологию, применимые для применения на практике данного изобретения. Если нет других указаний, аминокислоты с хиральным центром обеспечены в виде L-энантиомера. Ссылка на “ее производное” относится к модифицированной аминокислоте, такой как соответствующая D-аминокислота, N-алкиламинокислота, Подробное описание Данное изобретение описывает аналоги грелина, активные при GHS-рецепторе. Грелин человека является модифицированным пептидом из 28 аминокислот, где гидроксильная группа серина этерифицирована н-октановой кислотой (Kojima et al., Nature 1999, 402, 656-660 и Kojima, Abstract at the Third International Symposium on Growth Hormone Secretagogues, Keystone, Colorado, USA 2000, February 17-19). Некоторые аминокислоты, присутствующие в соединениях данного изобретения, могут быть такими, как представленные здесь следующие аминокислоты: Abu обозначает Aic обозначает 2-аминоиндан-2-карбоновую кислоту, Асс обозначает 1-амино-1-цикло(С3-С9)алкилкарбоновую кислоту, А3с обозначает 1-амино-1-циклопропанкарбоновую кислоту, А4с обозначает 1-амино-1-циклобутанкарбоновую кислоту, А5с обозначает 1-амино-1-циклопентанкарбоновую кислоту, А6с обозначает 1-амино-1-циклогексанкарбоновую кислоту, Act обозначает 4-амино-4-карбокситетрагидропиран, который имеет структуру:
Aib обозначает Ala или А обозначает аланин,
Арс обозначает структуру: Arg или R обозначает аргинин, hArg обозначает гомоаргинин, Asn или N обозначает аспарагин, Asp или D обозначает аспарагиновую кислоту, Cha обозначает Cys или С обозначает цистеин, Dab обозначает 2,4-диаминомасляную кислоту, Dap обозначает 2,3-диаминопропионовую кислоту, Dhp обозначает 3,4-дегидропролин, Dmt обозначает 5,5-диметилтиазолидин-4-карбоновую кислоту, 2Fua обозначает Gln или Q обозначает глутамин, Glu или Е обозначает глутаминовую кислоту, Gly или G обозначает глицин, His или Н обозначает гистидин, 3Hyp обозначает транс-3-гидрокси-L-пролин, т.е. (2S,3S)-3-гидроксипирролидин-2-карбоновую кислоту, 4Hyp обозначает 4-гидроксипролин, т.е. (2S,4R)-4-гидроксипирролидин-2-карбоновую кислоту, Ile или I обозначает изолейцин, Inc обозначает индолин-2-карбоновую кислоту, Inp обозначает изонипекотиновую кислоту, Ktp обозначает 4-кетопролин, Leu или L обозначает лейцин, hLeu обозначает гомолейцин, Lys или К обозначает лизин, Met или М обозначает метионин, Nle обозначает норлейцин, Nva обозначает норвалин, Oic обозначает октагидроиндол-2-карбоновую кислоту, Orn обозначает орнитин, 2Pal обозначает 3Pal обозначает 4Pal обозначает Phe или F обозначает фенилаланин, hPhe обозначает гомофенилаланин, Pip обозначает пипеколиновую кислоту, Pro или Р обозначает пролин, Ser или S обозначает серин, Taz обозначает 2Thi обозначает 3Thi обозначает Thr или Т обозначает треонин, Thz обозначает тиазолидин-4-карбоновую кислоту, Tic обозначает 1,2,3,4-тетрагидроизохинолин-3-карбоновую кислоту, Tle обозначает трет-лейцин, Thp или W обозначает триптофан, Tyr или Y обозначает тирозин и Val или V обозначает валин. Некоторые другие аббревиатуры, используемые здесь, определяются следующим образом: Вос обозначает трет-бутилоксикарбонил, Bzl обозначает бензил, DCM (ДХМ) обозначает дихлорметан, DIC обозначает N,N-диизопропилкарбодиимид, DIEA обозначает диизопропилэтиламин, Dmab обозначает 4-{N-(1-(4,4-диметил-2,6-диоксоциклогексилиден)-3-метилбутил)амино}бензил, DMAP обозначает 4-(диметиламино)пиридин, DMF (ДМФ) обозначает диметилформамид, DNP обозначает 2,4-динитрофенил, Fmoc обозначает флуоренилметилоксикарбонил, HBTU обозначает гексафторфосфат 2-(1Н-бензотриазол-1-ил)-1,1,3,3-тетраметилурония, cHex обозначает циклогексил, HOAt обозначает гексафторфосфат О-(7-азабензотриазол-1-ил)-1,1,3,3-тетраметилурония, HOBt обозначает 1-гидроксибензотриазол, Mmt обозначает 4-метокситритил, NM обозначает N-метилпирролидон, Pbf обозначает 2,2,4,6,7-пентаметилдигидробензофуран-5-сульфонил, tBu обозначает трет-бутил, TIS обозначает триизопропилсилан, TOS обозначает тозил, trt обозначает тритил, TFA (ТФУ) обозначает трифторуксусную кислоту, TFFH обозначает гексафторфосфат тетраметилфторфорамидиния и Z обозначает бензилоксикарбонил. За исключением N-концевой аминокислоты все аббревиатуры (например, Ala) аминокислот в данном описании обозначают структуру -NH-C(R)(R’)-CO-, где R и R’, каждый, обозначают независимо водород или боковую цепь аминокислоты (например, R =CH3 и R’ =Н для Ala) или R и R’ могут быть соединены с образованием кольцевой системы. Для N-концевой аминокислоты аббревиатура обозначает структуру (R2R3)-N-С(R)(R’)-СО-, где R2 и R3 имеют определенные в формуле (I) значения. Пептид данного изобретения обозначается здесь также посредством другого формата, например, (Aib2)чГрелин(1-28)-NH2, где замещенная аминокислота (замещенные аминокислоты) из природной последовательности помещены между первым комплектом скобок (например, Aib2 для Ser2 в чГрелине). Цифры между вторым комплектом скобок относятся к количеству аминокислот, присутствующих в данном пептиде (например, чГрелин(1-18)-NH2 обозначают аминокислоты 1-18 пептидной последовательности для грелина человека). Обозначение “NH2“, например, в (Aib2)чГрелин(1-28)-NH2, указывает на то, что С-конец этого пептида является амидированным. (Aib2)чГрелин(1-28) или альтернативно (Aib2)чГрелин(1-28)-ОН указывает на то, что С-конец является свободной кислотой. “Алкил” обозначает углеводородную группу, содержащую один или более атомов углерода, где множественные атомы углерода, если они присутствуют, соединены простыми связями. Алкильная углеводородная группа может быть прямой цепью или содержать одно или несколько ответвлений или циклические группы. “Замещенный алкил” обозначает алкил, в котором один или несколько атомов водорода углеводородной группы замещены одним или несколькими заместителями, выбранными из группы, состоящей из галогена (т.е. фтора, хлора, брома и йода), -ОН, -CN, -SH, -NH2, -NHCH3, -NO2, -C1-2алкила, замещенного 1-6 атомами галогена, -CF3, -ОСН3, -OCF3 и -(СН2)0-4-СООН. В различных вариантах осуществления присутствуют 1, 2, 3 или 4 заместителя. Присутствие -(СН2)0-4-СООН приводит к получению алкилсодержащей кислоты. Примеры алкилсодержащих кислот, содержащих -(СН2)0-4-СООН или состоящих из -(СН2)0-4-СООН, включают в себя 2-норборнануксусную кислоту, трет-масляную кислоту и 3-циклопентилпропионовую кислоту. «Гетероалкил» обозначает алкил, в котором один или несколько атомов углерода в углеводородной группе замещены одним или несколькими из следующих групп: амино, амидо, -О- или карбонил. В различных вариантах осуществления присутствуют 1 или 2 гетероатома. «Замещенный гетероалкил» обозначает гетероалкил, в котором один или несколько атомов углерода углеводородной группы замещены одним или несколькими заместителями, выбранными из группы, состоящей из галогена (т.е. фтора, хлора, брома и йода), -ОН, -CN, -SH, -NH2, -NHCH3, -NO2, -C1-2алкила, замещенного 1-6 атомами галогена, -CF3, -ОСН3, -OCF3 и -(СН2)0-4-СООН. В различных вариантах осуществления присутствуют 1, 2, 3 или 4 заместителя. «Алкенил» обозначает углеводородную группу, образованную двумя или более атомами углерода, где присутствуют одна или более двойных связей углерод-углерод. Алкенильная углеводородная группа может быть прямой цепью или содержать одно или несколько ответвлений или циклические группы. “Замещенный алкенил” обозначает алкенил, в котором один или несколько атомов водорода замещены одним или несколькими заместителями, выбранными из группы, состоящей из галогена (т.е. фтора, хлора, брома и йода), -ОН, -CN, -SH, -NH2, -NHCH3, -NO2, -C1-2 алкила, замещенного 1-6 атомами галогена, -CF3, -ОСН3, -OCF3 и -(СН2)0-4-СООН. В различных вариантах осуществления присутствуют 1, 2, 3 или 4 заместителя. «Арил» обозначает необязательно замещенную ароматическую группу по меньшей мере с одним кольцом, имеющую конъюгированную пи-электронную систему, содержащую до двух конъюгированных или конденсированных кольцевых систем. Арил включает в себя карбоциклическую арильную, гетероциклическую арильную и биарильную группы. Предпочтительно арил является 5- или 6-членным кольцом. Предпочтительными атомами для гетероциклического арила являются один или несколько атомов серы, кислорода и/или азота. Примеры арила включают в себя фенил, 1-нафтил, 2-нафтил, индол, хинолин, 2-имидазол и 9-антрацен. Заместители арила выбраны из группы, состоящей из -С1-4 алкила, -С1-4 алкокси, галогена (т.е. фтора, хлора, брома и йода), -ОН, -CN, -SH, -NH2, -NO2, -C1-2алкила, замещенного 1-5 атомами галогена, -CF3, -OCF3 и -(СН2)0-4-СООН. В различных вариантах осуществления присутствуют 0, 1, 2, 3 или 4 заместителя. «Алкиларил» обозначает «алкил», присоединенный к «арилу». «Glu(O-гексил)» обозначает «Glu(NH-гексил)» обозначает «Dap(1-октансульфонил)» обозначает «Cys(R15)» обозначает «Cys(S-гептил)» обозначает “Dap(октаноил)” обозначает Данное изобретение включает в себя диастереомеры, а также их рацемические и разделенные энантиомерно чистые формы. Аналоги грелина могут содержать D-аминокислоты, L-аминокислоты или их комбинацию. Предпочтительно аминокислоты, присутствующие в аналоге грелина, являются L-энантиомерами. Предпочтительные производные аналогов данного изобретения содержат D-аминокислоты, N-алкиламинокислоты, Защитная группа, ковалентно присоединенная к С-концевой карбоксигруппе, уменьшает реакционную способность карбокси-конца в условиях in vivo. Защитная группа карбокси-конца предпочтительно присоединена к ПРИМЕРЫ Ниже приведены примеры для дополнительной иллюстрации различных признаков данного изобретения. Эти примеры иллюстрируют также используемую методологию для применения на практике данного изобретения. Эти примеры не ограничивают заявленное изобретение. СИНТЕЗ Соединения данного изобретения могут быть получены с использованием способов, описанных в примерах здесь, а также способов, которые хорошо известны в данной области. Например, полипептидный район аналога грелина может быть синтезирован и модифицирован химически или биохимически. Примеры способов биохимического синтеза, включающие в себя введение нуклеиновой кислоты в клетку и экспрессию нуклеиновых кислот, обеспечены в Ausubel, Current Protocols in Molecular Biology, Johm Wiley, 1987-1998 и Sambrook et al., in Molecular Cloning: A Laboratory Manual, 2nd Edition, Cold Spring Harbor Laboratory Press, 1989. Способы химического синтеза полипептидов также хорошо известны в данной области (см., например, Vincent in Peptide and Protein Drug Delivery, New York, N.Y., Dekker, 1990). Например, пептиды данного изобретения могут быть получены стандартным твердофазным пептидным синтезом (см., например, Stewart, J.M., et al., Solid Phase Synthesis (Pierce Chemical Co., 2d ed. 1984)). Заместители R2 и R3 приведенной выше общей формулы могут быть присоединены к свободной аминогруппе N-концевой аминокислоты стандартными способами, известными в данной области. Например, алкильные группы, например (С1-С30)алкил, могут быть присоединены с использованием восстановительного алкилирования. Гидроксиалкильные группы, например (С1-С30)гидроксиалкил, могут быть также присоединены с использованием восстановительного алкилирования, в котором свободная гидроксигруппа защищена сложным трет-бутиловым эфиром. Ацильные группы, например СОЕ1, могут быть присоединены связыванием свободной кислоты, например Е1СООН, со свободной аминогруппой N-концевой аминокислоты смешиванием достроенной смолы с 3 молярными эквивалентами как свободной кислоты, так и диизопропилкарбодиимида в метиленхлориде в течение одного часа. Если эта свободная кислота содержит свободную гидроксигруппу, например п-гидроксифенилпропионовая кислота, то связывание следует выполнять с дополнительными 3 молярными эквивалентами HOBt. Когда R1 является NH-X2-CH2-CONH2, (т.е. Z0=CONH2), синтез пептида начинается с BocHN-X2-CH2-COOH, которую связывают со смолой MBHA. Если R1 является NH-X2-CH2-COOH (т.е. Z0=COOH), синтез пептида начинается с BocHN-X2-CH2-COOH, которую связывают со смолой РАМ. Для этой конкретной стадии используют 4 молярных эквивалента Вос-HN-X2-COOH, HBTU и HOBt и 10 молярных эквивалентов DIEA. Время связывания равно приблизительно 8 часам. Защищенную аминокислоту 1-(N-трет-бутоксикарбониламино)-1-циклогексанкарбоновую кислоту (Вос-A6c-OH) синтезировали следующим образом: 19,1 г (0,133 моль) 1-амино-1-циклогексанкарбоновой кислоты (Acros Organics, Fisher Scientific, Pittsburgh, PA) растворяли в 200 мл диоксана и 100 мл воды. К раствору добавляли 67 мл 2N NaOH. Этот раствор охлаждали на бане со смесью воды со льдом и к этому раствору добавляли 32,0 г (0,147 моль) ди-трет-бутилдикарбоната. Реакционную смесь перемешивали в течение ночи при комнатной температуре. Затем диоксан удаляли при пониженном давлении и к оставшемуся водному раствору добавляли 200 мл этилацетата. Смесь охлаждали на бане со смесью воды со льдом. рН водного слоя доводили до приблизительно 3 добавлением 4N NaOH. Органический слой отделяли. Водный слой экстрагировали этилацетатом (1×100 мл). Два органических слоя объединяли и промывали водой (2×150 мл), сушили над безводным MgSO4, фильтровали и концентрировали досуха при пониженном давлении. Остаток перекристаллизовывали в смеси этилацетат/гексаны и получали 9,2 г чистого продукта, выход 29%. Вос-А5с-ОН синтезировали аналогично синтезу Вос-А6с-ОН. Другие защищенные Acc-аминокислоты могут быть получены аналогичным образом обычным специалистом в данной области с использованием приведенных здесь описаний. В синтезе аналога грелина данного изобретения, содержащего А5с, А6с и/или Aib, время связывания равно 2 часам для этих остатков и остатка, следующего непосредственно после них. ПРИМЕР 1: (Glu3(O-гексил))чГрелин(1-28)-NH2 Указанный в заголовке пептид синтезировали на пептидном синтезаторе модели 433А Applied Biosystems (Foster City, CA). Смолу 4-(2′,4′-диметоксифенил-Fmoc-аминометил)феноксиацетамидонорлейцил-МВНА (Rink Amide MBHA resin, Novabiochem, San Diego, CA) использовали с замещением 0,72 ммоль/г. Fmoc-аминокислоты (AnaSpec, San Jose, CA) использовали со следующей защитой боковых цепей: Fmoc-Arg(Pbf)-OH, Fmoc-Pro-OH, Fmoc-Gln-OH, Fmoc-Leu-OH, Fmoc-Lys(Boc)-OH, Fmoc-Ala-OH, Fmoc-Ser(tBu)-OH, Fmoc-Glu(OtBu)-OH, Fmoc-Val-OH, Fmoc-His(Trt)-OH, Fmoc-Phe-OH и Fmoc-Asp(OtBu)-OH. Вос-Gly-OH (Midwest Bio-Tech, Fishers, IN) использовали в положении 1. В конце сборки пептидной цепи на пептидном синтезаторе 433А (ABI) Applied Biosystems смолу переносили в реакционный сосуд на шейкере для мануального синтеза. Защитную группу Dmab в боковой цепи остатка Glu удаляли раствором 2% гидразина в ДМФ в течение 2 часов. После промывания ДМФ смолу обрабатывали 2,5 ммоль гексафторфосфата тетраметилфторфорамидиния (TFFH) (Perseptive Biosystems, Warrington, UK) в дихлорметане (ДХМ) в течение 25 минут для превращения функциональной группы свободной кислоты в боковой цепи остатка Glu в ее фторангидрид кислоты. К этой смеси добавляли 5,0 ммоль гексанола, 2,5 ммоль гексафторфосфата О-(7-азабензотриазол-1-ил)-1,1,3,3-тетраметилурония (HOAt) (Anaspec, San Jose, CA), 5,0 ммоль диизопропилэтиламина (DIEA) (Aldrich, Milwaukee, WI) и каталитическое количество 4-(диметиламино)пиридина (DMAP) (Aldrich, Milwaukee, WI). Эту смесь встряхивали при комнатной температуре в течение 2 часов. Смолу промывали ДМФ и ДХМ и обрабатывали в течение ночи 2,5 ммоль N,N-диизопропилкарбодиимида (DIC) (Chem-Inpex International, Wood Dale, IL), 2,5 ммоль 1-гексанола, 2,5 ммоль HOBt и 0,025 ммоль DMAP. После промывания и сушки пептид отщепляли от смолы с использованием смеси ТФУ (9,5 мл), Н2О (0,85 мл) и триизопропилсилана (TIS) (0,85 мл) в течение 2 часов. Смолу отфильтровывали и фильтрат выливали в 70 мл эфира. Образовавшийся осадок отфильтровывали и промывали тщательно эфиром. Этот неочищенный продукт растворяли в 5% уксусной кислоте и очищали на обращенно-фазовой препаративной ВЭЖХ с использованием колонки (4×43 см) С18 DYNAMAX-100A0 (Varian, Walnut Creek, CA). Колонку элюировали линейным градиентом от 75% А и 25% В до 55% А и 45% В в течение часа, где А был 0,1% ТФУ в воде, а В был 0,1% ТФУ в ацетонитриле. Фракции проверяли аналитической ВЭЖХ. Фракции, содержащие чистый продукт, объединяли и лиофилизировали досуха. Чистота соединения была 92,8%. Выход был 8,6%. Анализ с использованием масс-спектрометрии с ионизацией с распылением электронов (ESI MS) давал молекулярную массу этого продукта 3369,4 (что находится в соответствии с рассчитанной молекулярной массой 3369,9). ПРИМЕР 2: (Aib2)чГрелин(1-28)-NH2 Указанный в заголовке пептид синтезировали согласно методике, описанной в примере 1 для синтеза (Glu3(O-гексил))чГрелин(1-28)-NH2, за исключением следующего: Fmoc-Ser-OH использовали в положении 3, Fmoc-Aib-OH использовали в положении 2 и Вос-Gly-OH использовали в положении 1. После сборки пептидной цепи пептид-смолу обрабатывали 25% пиперидином в ДМФ в течение 3×2 часа. Смолу промывали ДМФ и обрабатывали октановой кислотой (2,5 ммоль, 10-кратный избыток), HBTU (2,2 ммоль), HOBt (2,2 ммоль) и DIEA (7,5 ммоль) в ДМФ в течение 2 часов. Смолу промывали ДМФ и затем обрабатывали октановой кислотой (2,5 ммоль), DIC (2,5 ммоль), HOBt (2,5 ммоль) и DMAP (0,025 ммоль) в ДМФ в течение 2 часов. Конечное отщепление и процедуры очистки были такими же, что и процедуры в примере 1. Было обнаружено, что этот продукт был гомогенным, по аналитической ВЭЖХ, с чистотой 99% и с выходом 18,5%. Анализ с использованием масс-спектрометрии с ионизацией с распылением электронов (ESI MS) давал молекулярную массу этого продукта 3367,6 (что находится в соответствии с рассчитанной молекулярной массой 3367,0). ПРИМЕР 3: (Glu3(NH-гексил))чГрелин(1-28)-NH2 Указанный в заголовке пептид синтезировали на пептидном синтезаторе модели 430А Applied Biosystems (Foster City, CA), который был модифицирован для проведения ускоренного твердофазного пептидного синтеза с использованием Вос-химии. См. Schnolzer, et al., Int. J. Peptide Protein Res., 40:180 (1992). Использовали 4-метилбензгидриламиновую смолу (МВНА) (Peninsula, Belmont, CA) с замещением 0,91 ммоль/г. Вос-аминокислоты (Midwest Bio-Tech, Fishers, IN; Novabiochem, San Diego, CA) использовали со следующей защитой боковой цепи: Boc-Ala-OH, Boc-Arg(Tos)-OH, Boc-His(DNP)-OH, Boc-Val-OH, Boc-Leu-OH, Boc-Gly-OH, Boc-Gln-OH, Boc-Lys(2CIZ)-OH, Boc-Ser(Bzl)-OH, Boc-Phe-OH, Boc-Glu(OcHex)-OH и Boc-Pro-OH. Fmoc-Glu(OtBu-OH (Novabiochem, San Diego, CA) использовали для остатка в положении 3 в этой последовательности. Синтез проводили в масштабе 0,25 ммоль. Вос-группы удаляли обработкой 100% ТФУ в течение 2×1 мин. Вос-аминокислоты (2,5 ммоль) предактивировали HBTU (2,0 ммоль) и DIEA (1,0 ммоль) в 4 мл ДМФ и связывали без предварительной нейтрализации ТФУ-соли комплекса пептид-смола. Время связывания было равно 5 минут. В конце сборки первых 25 остатков на пептидном синтезаторе 430А ABI и перед связыванием Fmoc-Glu(OtBu)-OH защищенную содержащую пептид смолу переносили в реакционный сосуд на шейкере для мануального синтеза. После удаления защитной группы Вос с использованием 100% ТФУ в течение 2×1 мин и промывания ДМФ смолу смешивали с Fmoc-Glu(OtBu)-OH (2,5 ммоль), которая была предактивирована HBTU (2,0 ммоль), HOBt (2,0 ммоль) и DIEA (1,0 мл) в 4 мл ДМФ. Смесь встряхивали в течение 2 часов. Эту стадию связывания повторяли. После промывания ДМФ смолу обрабатывали раствором ТФУ, содержащим 5% воды и 5% TIS, в течение 2 часов для удаления защитной группы tBu в боковой цепи остатка Glu. Смолу нейтрализовали 10% DIEA в ДМФ и промывали ДМФ и ДХМ. Затем смолу обрабатывали гексиламином (2,0 ммоль), DIC (2,0 ммоль), HOBt (2,0 ммоль) в 5 мл ДХМ в течение 2×2 часа. Смолу промывали ДМФ и обрабатывали 25% пиперидином в ДМФ в течение 30 минут для удаления защитной группы Fmoc. После промывания ДМФ и ДХМ смолу переносили в реакционный сосуд на пептидном синтезаторе 430А ABI для сборки остальных двух остатков. В конце сборки полной пептидной цепи смолу обрабатывали раствором 20% меркаптоэтанол/10% DIEA в ДМФ в течение 2×30 минут для удаления группы DNP на боковой цепи His. Затем N-концевую группу Вос удаляли обработкой 100% ТФУ в течение 2×2 мин. Пептид-смолу промывали ДМФ и ДХМ и сушили при пониженном давлении. Конечное отщепление выполняли перемешиванием пептида-смолы в 10 мл HF, содержащих 1 мл анизола и дитиотреитола (50 мг), при 0°С в течение 75 минут. HF удаляли током азота. Остаток промывали эфиром (6×10 мл) и экстрагировали 4N HOAc (6×10 мл). Этот неочищенный продукт очищали обращенно-фазовой препаративной ВЭЖХ с использованием колонки (4×43 см) С18 DYNAMAX-100A0 (Varian, Walnut Creek, CA). Колонку элюировали линейным градиентом от 75% А и 25% В до 55% А и 45% В при скорости 10 мл/мин в течение часа, где А был 0,1% ТФУ в воде, а В был 0,1% ТФУ в ацетонитриле. Фракции собирали и проверяли аналитической ВЭЖХ. Фракции, содержащие чистый продукт, объединяли и лиофилизировали досуха. Получали 31,8 г твердого вещества белого цвета. Чистота соединения была 89% на основании анализа аналитической ВЭЖХ. Анализ с использованием масс-спектрометрии с ионизацией с распылением электронов (ESI MS) давал молекулярную массу этого продукта 3368,4 (что находится в соответствии с рассчитанной молекулярной массой 3368,9). ПРИМЕР 4: (Cys3(S-децил))чГрелин(1-28)-NH2 (i) Указанный пептид синтезировали в соответствии с методикой, описанной в примере 3 для синтеза (Glu3(NH-гексил))чГрелин(1-28)-NH2, со следующими модификациями: после сборки первых 25 остатков с использованием Вос-химии, последние 3 остатка собирали с использованием Fmoc-химии. Использовали следующие 3 Fmoc-аминокислоты: N- (ii) В конце сборки полной пептидной цепи комплекс защищенный пептид-смола обрабатывали раствором 20% меркаптоэтанола и 10% DIEA в ДМФ в течение 2×30 минут для удаления группы DNP на боковой цепи His. Затем защитную группу Mmt в боковой цепи остатка Cys удаляли с использованием раствора 1% ТФУ и 5% TIS в ДХМ в течение 30 минут и пептид-смолу промывали ДМФ. (iii) 1-(2-Пиридилдитио)декан получали перемешиванием 2,2′-дипиридилдисульфида (1,06 г, 4,8 ммоль), 1-декантиола (0,83 мл, 4 ммоль) и триэтиламина (2 мл) в пропаноле и ацетонитриле (1/9, об./об.) при комнатной температуре в течение приблизительно 3 часов (см. Carlsson et al., Biochem. J., 1978, 173, 723-737). Очистку неочищенного 1-(2-пиридилдитио)декана выполняли с использованием флэш-хроматографии, элюируя системой смешанных растворителей ДХМ/МеОН (10:0,4). (iv) Пептид-смолу со стадии (ii) обрабатывали 1-(2-пиридилдитио)деканом со стадии (iii) и DIEA (3 экв., 0,75 ммоль) в течение ночи в системе смешанных растворителей ДМФ/1-пропанол (7:3). Затем смолу промывали ДМФ и N-концевую защитную группу Fmoc удаляли обработкой 25% пиперидином в ДМФ в течение 30 минут. Затем пептид-смолу промывали ДМФ и ДХМ и сушили при пониженном давлении. (v) Конечное отщепление выполняли перемешиванием пептида-смолы в 10 мл HF, содержащих 1 мл анизола, при приблизительно 0°С в течение приблизительно 70 минут. Процедура очистки была такой же, как и процедура, описанная в примере 3. Было найдено, что целевой продукт (выход 10,2%) согласно аналитической ВЭЖХ имел чистоту 99,9%. Анализ с использованием масс-спектрометрии с ионизацией с распылением электронов (ESI MS) давал молекулярную массу этого продукта 3432,1 (что находится в соответствии с рассчитанной молекулярной массой 3432,1). Другие пептиды данного изобретения могут быть получены обычным специалистом в данной области с использованием синтетических процедур, аналогичных процедурам, описанным в общем виде выше, и/или процедур, описанных в предыдущих примерах, как были получены и соединения, представленные в таблице 1.
БИОЛОГИЧЕСКИЙ АНАЛИЗ Активность соединений данного изобретения при GHS-рецепторе может быть определена, и ее определяли с использованием способов, таких как способы, описанные в приведенных ниже примерах. В различных вариантах аналог грелина имеет по меньшей мере приблизительно 50%, по меньшей мере приблизительно 60%, по меньшей мере приблизительно 70%, по меньшей мере приблизительно 80% или по меньшей мере приблизительно 90% функциональной активности, относящейся к грелину, как определено с использованием одного или нескольких анализов функциональной активности, описанных ниже; и/или имеет IC50, большую, чем приблизительно 1000 нМ, большую, чем приблизительно 100 нМ, или большую, чем приблизительно 50 нМ, с использованием анализа связывания рецептора, описанного ниже. Что касается IC50, более высокая IC50 указывает на его высокую активность и, следовательно, свидетельствует о том, что требуется меньшее количество для достижения ингибирования связывания. Анализы измерения способности соединения связывать GHS-рецептор используют GHS-рецептор, фрагмент этого рецептора, содержащий сайт связывания грелина, полипептид, содержащий такой фрагмент, или производное этого полипептида. Предпочтительно этот анализ использует GHS-рецептор или его фрагмент. Полипептид, содержащий фрагмент GHS-рецептора, который связывает грелин, может также содержать один или несколько районов полипептида, не обнаруживаемых в GHS-рецепторе. Производное такого полипептида содержит фрагмент GHS-рецептора, который связывает грелин, вместе с одним или несколькими непептидными компонентами. Аминокислотная последовательность GHS-рецептора, участвующая в связывании грелина, может быть легко идентифицирована с использованием меченых грелина или аналогов грелина и различных фрагментов рецептора. Могут быть использованы различные стратегии для отбора фрагментов для тестирования для сужения района связывания. Примеры подобных стратегий включают в себя тестирование последовательных фрагментов с длиной приблизительно 15 аминокислот, начиная от N-конца, и тестирование более длинных фрагментов. Если тестируют более длинные фрагменты, фрагмент связывания грелина может быть разделен для дополнительного определения местоположения района связывания грелина. Фрагменты, используемые для исследований связывания, могут быть получены способами рекомбинантных нуклеиновых кислот. Анализы связывания могут быть выполнены с использованием индивидуальных соединений или препаратов, содержащих различные количества соединений. Препарат, содержащий различные количества соединений, способных связываться с GHS-рецептором, может быть разделен на меньшие группы соединений, которые могут быть тестированы для идентификации соединения (соединений), связывающихся с GHS-рецептором. В варианте осуществления данного изобретения в анализе связывания используют тест-препарат, содержащий по меньшей мере 10 соединений. Анализы связывания могут быть выполнены с использованием рекомбинантно полученных полипептидов GHS-рецептора, присутствующих в различных окружениях. Такие окружения включают в себя, например, клеточные экстракты и экстракты очищенных клеток, содержащие полипептид GHS-рецептора, экспрессируемый из рекомбинантной нуклеиновой кислоты или природно встречающейся нуклеиновой кислоты; и предусматривают также, например, использование очищенного полипептида GHS-рецептора, полученного рекомбинантным способом или из природно встречающейся нуклеиновой кислоты, которую вводят в отличающуюся среду. Скрининг на активные в отношении GHS-рецептора соединения Скрининг на активные в отношении GHS-рецептора соединения облегчается с использованием рекомбинантно экспрессируемого рецептора. Использование рекомбинантно экспрессируемого GHS-рецептора предоставляет несколько преимуществ, таких как возможность экспрессировать этот рецептор в клеточной системе определенного состава, так что реакция на соединение при GHS-рецепторе может быть более легко дифференцирована от реакций при других рецепторах. Например, GHS-рецептор может быть экспрессирован в клеточной линии, такой как НЕК 293, COS 7 и СНО, обычно не экспрессирующих этот рецептор, с использованием экспрессирующего вектора, где та же самая клеточная линия без этого экспрессирующего вектора может служить в качестве контроля. Скрининг на соединения, уменьшающие GHS-рецепторную активность, облегчается применением аналога грелина в этом анализе. Применение аналога грелина в анализе-скрининге обеспечивает GHS-рецепторную активность. Действие тест-соединений на такую активность может быть измерено для идентификации, например, аллостерических модуляторов и антагонистов. GHS-рецепторная активность может быть измерена с использованием различных способов, таких как детектирование изменения во внутриклеточной конформации GHS-рецептора, в связанных с G-белком активностях и/или во внутриклеточных мессенджерах. Предпочтительно GHS-рецепторную активность измеряют с использованием таких способов, как способы измерения внутриклеточного Са2+. Хорошо известные в данной области примеры способов, которые могут быть использованы для измерения Са2+, включают в себя применение красителей, таких как Fura-2, и применение Са2+-биолюминесцентных чувствительных репортерных белков, таких как аэкворин. Примером клеточной линии, использующей аэкворин для измерения активности G-белка, является НЕК293/aeq17 (Button et al., Cell Calcium, 1993, 14, 663-671 и Feighner et al., Science, 1999, 284, 2184-2188). Химерные рецепторы, содержащие район связывания грелина, функционально связанные с отличающимся G-белком, могут быть также использованы для измерения GHS-рецепторной активности. Химерный GHS-рецептор содержит N-концевой внеклеточный домен; трансмембранный домен, образованный из трансмембранных районов, внеклеточные петлевые районы и внутриклеточные петлевые районы; и внутриклеточный карбокси-конец. Способы получения химерных рецепторов и измерения связанных с G-белком реакций обеспечены, например, в Международной заявке с номером WO 97/05252 и Патенте США 5264565, которые включены в данное описание в качестве ссылки. Стимуляция GHS-рецепторной активности Аналоги грелина могут быть использованы для стимуляции GHS-рецепторной активности. Такая стимуляция может быть использована, например, для исследования действия модуляции GHS-рецептора, для исследования действия секреции гормона роста, для нахождения или для исследования антагонистов грелина или для получения благотворного действия у субъекта. Благотворные действия, которые могут быть достигнуты, включают в себя одно или несколько из следующих действий: лечение состояния недостаточности гормона роста, увеличение мышечной массы, увеличение плотности костей, лечение половой дисфункции у мужчин или у женщин, облегчение прибавления массы, облегчение поддержания массы, облегчение поддержания физической деятельности, облегчение восстановления физической функции и/или облегчение увеличения аппетита. Увеличение массы или аппетита могут быть полезными для увеличения массы или получения увеличения массы и аппетита у субъекта с пониженной массой или у пациента, имеющего заболевание или подвергающегося лечению, которое влияет на массу и аппетит. Кроме того, сельскохозяйственные животные, такие как свиньи, коровы и куры, могут быть, например, обработаны для увеличения массы тела. Субъекты с пониженной массой включают субъекты, имеющие массу тела приблизительно 10% или менее, 20% или менее или 30% или менее, чем нижняя граница «нормального» диапазона массы или индекса массы тела (“BMI”). «Нормальные» диапазоны массы хорошо известны в данной области и учитывают такие факторы, как возраст, рост и тип тела пациента. BMI измеряет ваше отношение рост/масса. Его определяют расчетом массы в килограммах, деленной на квадрат роста в метрах. «Нормальный» диапазон BMI равен 19-22. ПРИМЕР 5: Анализ связывания рецептора А. Получение клеток СНО-К1, экспрессирующих рекомбинантный GHS-рецептор человека кДНК для рецептора стимулятора секреции гормона роста человека (hGHS-R1a, или рецептора грелина) клонировали при помощи полимеразной цепной реакции (ПЦР) с использованием РНК головного мозга человека в качестве матрицы (Clontech, Palo Alto, CA), ген-специфических праймеров, фланкирующих полноразмерную кодирующую последовательность hGHS-R, (S: 5′ -A T G T G G A A C G C G A C G C C C A G C G A A G A G – 3′ и AS: 5′ – T C A T G T A T T A A T A C T A G A T T C T G T C C A – 3′), и набора для ПЦР Advantage 2 (Clontech). Продукт ПЦР клонировали в вектор pCR2.1 с использованием набора для клонирования Original TA (Invitrogen, Carlsbad, CA). Полноразмерный GHS-R человека субклонировали в экспрессирующий вектор млекопитающего pcDNA 3.1 (Invitrogen). Эту плазмиду трансфицировали в линию клеток яичника Китайского хомячка, СНО-К1 (American Type Culture Collection, Rockville, MD) с использованием кальций-фосфатного способа (Wigler, M. et al., Cell 11, 223, 1977). Клоны отдельных клеток, стабильно экспрессирующие hGHS-R, получали отбором трансфицированных клеток, выращиваемых в клонирующих кольцах в среде RPMI 1640, дополненной 10% фетальной телячьей сывороткой и 1 мМ пируватом натрия, содержащей 0,8 мг/мл G418 (Gibco, Grand Island, NY). В. Анализ связывания GHS-R Мембраны для исследований связывания радиолиганда могут быть получены и были получены гомогенизацией вышеуказанных клеток СНО-К1, экспрессирующих рекомбинантный GHS-рецептор человека, в 20 мл охлажденного на льду 50 мМ Трис-HCl с использованием Brinkman Polytron (Westburi, NY) (установка 6, 15 сек). Гомогенаты промывали дважды центрифугированием (39000 г/10 мин) и конечные осадки ресуспендировали в 50 мМ Трис-HCl, содержащем 2,5 мМ MgCl2 и 0,1% БСА. Для анализа аликвоты (0,4 мл) инкубировали с 0,05 нМ (125I)грелином (2000 Ки/ммоль, Perkin Elmer Life Sciences, Boston, MA), с 0,05 мл немеченых конкурирующих тест-пептидов и без них. После 60 минут инкубирования (4оС) связанный (125I)грелин отделяли от свободного быстрым фильтрованием через фильтры GF/C (Brandel, Gaithersburg, MD), которые были предварительно пропитаны 0,5% полиэтиленимином/0,1% БСА. Затем эти фильтры промывали три раза 5-мл аликвотами охлажденного на льду 50 мМ Трис-HCl и 0,1% бычьего сывороточного альбумина и связанную радиоактивность, уловленную на этих фильтрах, считали гамма-спектрометрией (Wallac LKB, Gaithersburg, MD). Специфическое связывание определяли в виде общего связанного (125I)грелина минус (125I)грелин, связанный в присутствии 1000 нМ грелина (Bachem, Torrence, CA). ПРИМЕР 6: Анализ функциональной активности GHS-R А. Опосредованная GHS-рецептором мобилизация внутриклеточного iCa2+ in vitro Вышеуказанные клетки СНО-К1, экспрессирующие GHS-рецептор человека, собирали инкубированием в растворе 0,3% ЭДТА/забуференный фосфатом солевой раствор (25°С) и промывали дважды центрифугированием. Промытые клетки ресуспендировали в сбалансированном солевом растворе Хенкса (HBSS) для нанесения флуоресцентного индикатора Са2+ Fura-2AM. Клеточные суспензии приблизительно 106 клеток/мл инкубировали с 2 мкМ Fura-2AM в течение 30 минут при приблизительно 25°С. Несвязанный Fura-2AM удаляли центрифугированием дважды в HBBS и конечные суспензии переносили в спектрофлуорометр (Hitachi F-2000), оборудованный механизмом магнитной мешалки и держателем кюветы с регулируемой температурой. После уравновешивания до 37°С, аналоги грелина добавляли для измерения мобилизации внутриклеточного Са2+. Длины волн возбуждения и испускания были 340 и 510 нм соответственно. В. Высвобождение/супрессия ГР in vivo Как хорошо известно в данной области, соединения могут быть тестированы на их способность стимулировать или подавлять высвобождение гормона роста (ГР) in vivo (см., например, Deghenghi, R., et al., Life Sciences, 1994, 54, 1321-1328; International Application No. WO 02/08250). Так, например, для установления способности соединения стимулировать высвобождение ГР in vivo соединение может быть инъецировано подкожно 10-дневным крысам при дозе, например, 300 мг/кг. Циркулирующий в кровотоке ГР может быть определен, например, при 15 минутах после инъекции и сравнен с уровнями ГР у крыс, инъецированных только растворителем (контроль). Подобным образом, соединения могут быть тестированы на их способность проявлять антагонизм в отношении индуцированной грелином секреции ГР in vivo. Так, соединение может быть инъецировано подкожно 10-дневным крысам при дозе, например, 300 мг/кг, вместе с грелином. Вновь может быть определен циркулирующий в кровотоке ГР, например, при 15 минутах после инъекции и сравнен с уровнями ГР у крыс, инъецированных только грелином. ВВЕДЕНИЕ Аналоги грелина могут быть приготовлены и введены субъекту с использованием приведенного здесь руководства и способов, хорошо известных в данной области. Предпочтительный способ введения гарантирует, что эффективное количество соединения достигает мишени. Руководства для фармацевтического введения вообще обеспечены, например, в Remington: The Science and Practice of Pharmacy 20th Edition, Ed. Gennaro, Lippincott, Williams & Wilkins Publishing, 2000, и Modern Pharmaceutics 2nd Edition, Eds. Banker and Rhodes, Marcel Dekker, Inc., 1990, включенных в данное описание в качестве ссылки. Аналоги грелина могут быть получены в виде кислотно-аддитивных или основно-аддитивных солей. Фармацевтически приемлемые соли (в форме растворимых в воде или масле или диспергируемых продуктов) включают в себя общепринятые нетоксичные соли или соли четвертичного аммония, которые образованы, например, из неорганических или органических кислот или оснований. Примеры таких солей включают в себя кислотно-аддитивные соли, такие как ацетат, адипат, альгинат, аспартат, бензоат, бензолсульфонат, бисульфат, бутират, цитрат, камфорат, камфорсульфонат, циклопентанпропионат, диглюконат, додецилсульфат, этансульфонат, фумарат, глюкогептаноат, глицерофосфат, гемисульфат, гептаноат, гексаноат, гидрохлорид, гидробромид, гидройодид, 2-гидроксиэтансульфонат, лактат, малеат, метансульфонат, 2-нафталинсульфонат, никотинат, оксалат, памоат, пектинат, персульфат, 3-фенилпропионат, пикрат, пивалат, пропионат, сукцинат, тартрат, тиоцианат, тозилат и ундеканоат; и основно-кислотные соли, такие как соли аммония, соли щелочных металлов, такие как соли натрия и калия, соли щелочно-земельных металлов, такие как соли кальция и магния, соли с органическими основаниями, такие как соли дициклогексиламина, N-метил-D-глюкамина, и соли с аминокислотами, такими как аргинин и лизин. Аналоги грелина могут быть введены с использованием различных способов, включая пероральный, назальный, инъекцией, трансдермальный и через слизистую оболочку. Активные ингредиенты, которые должны быть введены перорально в виде суспензии, могут быть получены в соответствии со способами, хорошо известными в области фармацевтического приготовления, и могут содержать микрокристаллическую целлюлозу для придания объема, альгиновую кислоту или альгинат натрия в качестве суспендирующего агента, метилцеллюлозу в качестве усилителя вязкости и подслащивающие/улучшающие вкус и запах агенты. В качестве таблеток немедленного высвобождения эти композиции могут содержать микрокристаллическую целлюлозу, дикальций-фосфат, крахмал, стеарат магния и лактозу и/или другие эксципиенты, связывающие вещества, наполнители, дезинтеграторы, разбавители и смазывающие вещества. Вводимые назальным аэрозолем или ингаляцией рецептуры могут быть приготовлены, например, в виде растворов в солевом растворе, с использованием бензилового спирта или других подходящих консервантов, усилителей абсорбции (всасывания) для усиления биодоступности, с использованием фторуглеродов и/или с использованием других солюбилизирующих или диспергирующих агентов. Аналоги грелина могут также быть введены во внутривенной (в виде болюса и в виде инфузии), внутрибрюшинной, подкожной, местной с окклюзией или без окклюзии или внутримышечной форме. При введении инъекцией инъецируемые раствор или суспензия могут быть приготовлены с использованием подходящих нетоксичных, парентерально-приемлемых разбавителей или таких растворителей, как раствор Рингера или изотонический раствор в хлориде натрия, или подходящих диспергирующих или увлажняющих и суспендирующих агентов, таких как стерильные, легкие, нелетучие масла, в том числе синтетические моно- или диглицериды, и жирные кислоты, в том числе олеиновая кислота. Подходящие схемы приема лекарственных средств предпочтительно определяются с учетом факторов, хорошо известных в данной области, в том числе типа получающего лекарственное средство субъекта; возраста, массы, пола и медицинского состояния субъекта; способа введения; функции почек и печени субъекта; желаемого эффекта и конкретного используемого соединения. Оптимальная точность в достижении концентраций лекарственного средства в диапазоне, который обеспечивает эффективность без токсичности, требует схемы введения, основанной на кинетике доступности данного лекарственного средства для участков-мишеней. Это включает в себя учет распределения, равновесия и элиминации лекарственного средства. Ожидается, что суточная доза для субъекта должна находиться между 0,01 и 1000 мг на субъекта в сутки. Аналоги грелина могут быть обеспечены в наборе. Такой набор обычно содержит активное соединение в дозированных формах для введения. Дозированная форма содержит достаточное количество активного соединения, так что может быть получен желаемый эффект при введении субъекту во время регулярных интервалов, например 1-6 раз в день во время курса лечения от 1 дня до нескольких дней. Предпочтительно, набор содержит инструкции, указывающие применение данной дозированной формы для достижения желаемого действия и количество дозированной формы, которое должно приниматься на протяжении указанного периода времени. Данное изобретение было описано иллюстративным образом, и должно быть понятно, что терминология, которая была использована, должна рассматриваться в качестве описания, а не в качестве ограничения. Очевидно, что в свете приведенных выше описаний возможны многочисленные модификации и вариации данного изобретения. Таким образом, должно быть понятно, что в пределах прилагаемой формулы изобретения данное изобретение может использоваться на практике по-другому, чем это конкретно описано здесь. Патентная и научная литература, на которую делаются ссылки, представляет объем знаний, который доступен специалистам в данной области. Все патенты, патентные публикации и другие публикации, цитируемые здесь, включены тем самым в качестве ссылки в их полном виде. ДРУГИЕ ВАРИАНТЫ Должно быть понятно, что, хотя данное изобретение было описано вместе с его подробным описанием, предыдущее описание предназначено для иллюстрации, а не для ограничения объема данного изобретения, который определяется объемом прилагаемой формулы изобретения. Другие аспекты, преимущества и модификации находятся в пределах этой формулы изобретения.
Формула изобретения
1. Соединение в соответствии с формулой (I) (R2R3)-А1-А2-А3-А4-А5-А6-А7-А8-А9-А10-А11-А12-А13-А14-А15-А16-А17-А18-А19-А20-А21-А22-А23-А24-А25-А26-А27-А28-R1 (I) или его фармацевтически приемлемая соль, где А1 обозначает Gly, Aib, Ala, А2 обозначает Ser, Aib, Act, Ala, Acc, Abu, Ava, Thr или Val; А3 обозначает Ser, Ser(C(O)-R4), Asp(O-R8), Asp(NH-R9), Cys(S-R14), Dap(S(O)2-R10), Dab(S(O)2-R11), Glu(O-R6), Glu(NH-R7), Thr, Thr(C(O)-R5; А4 обозначает Phe, Acc, Aic, Cha, 2Fua, 1Nal, 2Nal, 2Pal, 3Pal, 4Pal, hPhe, (Х1,Х2,Х3,Х4,Х5)Phe, Taz, 2Thi, 3Thi, Trp или Tyr; А5 обозначает Leu, Abu, Acc, Aib, Ala, Cha, Ile, hLeu, Nle, Nva, Phe, Tle, Val или Lys; А6 обозначает Ser, Abu, Acc, Act, Aib, Ala, Gly, Thr или Val; А7 обозначает Pro, Dhp, Dmt, 3Hyp, 4Hyp, Inc, Ktp, Oic, Pip, Thz, Tic; А8 обозначает Glu, Acc, Aib, Arg, Asn, Asp, Dab, Dap, Gln, Lys, Orn, HN-CH((CH2)n-N(R12R13))-С(О); А9 обозначает His, Apc, Aib, Acc, 2Fua, 2Pal, 3Pal, 4Pal, Taz, 2Thi, 3Thi, (Х1,Х2,Х3,Х4,Х5)Phe; А10 обозначает Gln, Acc, Aib, Asn, Asp, Glu; А11 обозначает Arg, Apc, hArg, Dab, Dap, Lys, Orn, HN-CH((CH2)n-N(R12R13))-C(O); А12 обозначает Val, Abu, Acc, Aib, Ala, Cha, Nva, Gly, Ile, Leu, Nle, Tle, Cha; А13 обозначает Gln, Acc, Aib, Asn, Asp, Glu; А14 обозначает Gln, Acc, Aib, Asn, Asp, Glu; А15 обозначает Arg, hArg, Acc, Aib, Apc, Dab, Dap, Lys, Orn, HN-CH((CH2)n-N(R12R13))-С(О); А16 обозначает Lys, Apc, Arg, hArg, Dab, Dap, Orn, HN-CH((CH2)n-N(R12R13))-С(О); А17 обозначает Glu, Arg, Asn, Asp, Dab, Dap, Gln, Lys, Orn, HN-CH((CH2)n-N(R12R13))-С(О); А18 обозначает Ser, Abu, Acc, Act, Aib, Ala, Thr, Val; А19 обозначает Lys, Apc, Arg, hArg, Dab, Dap, Orn, HN-CH((CH2)n-N(R12R13))-С(О); А20 обозначает Lys, Apc, Arg, hArg, Dab, Dap, Orn, HN-CH((CH2)n-N(R12R13))-С(О); А21 обозначает Pro, Dhp, Dmt, Inc, 3Hyp, 4Hyp, Ktp, Oic, Pip, Thz, Tic; А22 обозначает Pro, Dhp, Dmt, 3Hyp, 4Hyp, Inc, Ktp, Oic, Pip, Thz, Tic; А23 обозначает Abu, Acc, Act, Aib, Ala, Gly, Nva, Val; А24 обозначает Lys, Apc, Arg, hArg, Dab, Dap, Orn, HN-CH((CH2)n-N(R12R13))-С(О); А25 обозначает Leu, Abu, Acc, Aib, Ala, Cha, Ile, hLeu, Nle, Nva, Phe, Tle, Val; А26 обозначает Gln, Aib, Asn, Asp, Glu; А27 обозначает Pro, Dhp, Dmt, 3Hyp, 4Hyp, Inc, Ktp, Oic, Pip, Thz, Tic; А28 обозначает Apc, Arg, hArg, Dab, Dap, Lys, Orn, HN-CH((CH2)n-N(R12R13))-С(О); R1 обозначает -ОН, -NH2; R2 и R3, каждый, обозначают, независимо для каждого случая, Н, (С1-С10)алкил или (С1-С10)ацил; R4, R5, R6, R7, R8, R9, R10, R11 и R14, каждый, обозначают, независимо для каждого случая, (С1-С10)алкил; R12 и R13, каждый, обозначают, независимо для каждого случая, Н, (С1-С10)алкил; n равно, независимо для каждого случая, 1, 2, 3, 4 или 5; Х1, Х2, Х3, Х4 и Х5, каждый, обозначают, независимо для каждого случая, Н; при условии, что этот пептид содержит по меньшей мере одну аминокислоту, выбранную из группы, состоящей из: А2 обозначает Aib, Acc или Act; А3 обозначает Dap(S(O)2-R10), Dab(S(O)2-R11), Glu(NH-гексил) или Cys(S-децил); А5 обозначает Abu, Acc, Aib, Ala, Cha, Ile, hLeu, Nle, Nva, Phe, Tle, Val или Lys; А6 обозначает Abu, Acc, Act, Aib, Ala, Gly, Thr или Val; А7 обозначает Dhp, Dmt, 3Hyp, 4Hyp, Inc, Ktp, Oic, Pip, Thz или Tic; А8 обозначает Acc, Aib, Arg, Asn, Asp, Dab, Dap, Gln, Lys, Orn или HN-CH((CH2)n-N(R12R13))-С(О); А9 обозначает Aib, Acc, Apc, 2Fua, 2Pal, 3Pal, 4Pal, Taz, 2Thi, 3Thi или (Х1,Х2,Х3,Х4,Х5)Phe; и А10 обозначает Acc, Aib, Asn, Asp или Glu; и дополнительно при условии, что этот пептид не является (Lys8)чГрелин(1-8)-NH2 или (Arg8)чГрелин(1-8)-NH2. 2. Соединение по п.1 или его фармацевтически приемлемая соль, где А1 обозначает Gly или Aib; А2 обозначает Ser, Aib, A5c, Act или Ava; А3 обозначает Ser(C(O)-R4), Glu(O-R6), Glu(NH-R7), Dap(S(O)2-R10) или Dab(S(O)2-R11); А4 обозначает Phe; А5 обозначает Leu, Acc, Aib, Cha или hLeu; А6 обозначает Ser, Abu, Act, Aib или Thr; А7 обозначает Pro, Dhp, Dmt, 4Hyp, Ktp, Pip, Tic или Thz; А8 обозначает Glu или Aib; А9 обозначает His, Aib, Apc, 2Fua, 2Pal, 3Pal, 4Pal, Taz или 2Thi; А10 обозначает Gln или Aib; А11 обозначает Arg; А12 обозначает Aib, Val или Acc; А13 обозначает Gln; А14 обозначает Gln; А15 обозначает Arg или Orn; А16 обозначает Lys или Apc; А17 обозначает Glu; А18 обозначает Ser; А19 обозначает Lys; А20 обозначает Lys; А21 обозначает Pro; А22 обозначает Pro; А23 обозначает Ala; А24 обозначает Lys; А25 обозначает Leu; А26 обозначает Gln; А27 обозначает Pro и А28 обозначает Arg. 3. Соединение по п.2 или его фармацевтически приемлемая соль, где R2 и R3, каждый, обозначают, независимо, Н, ацил, н-бутирил, изобутирил или н-октаноил; R4 обозначает октил; R6 обозначает гексил; R7 обозначает гексил; R10 обозначает октил и R11 обозначает октил, где Acc обозначает, независимо для каждого случая, А5с или А6с. 4. Соединение по п.3 или его фармацевтически приемлемая соль, выбранное из (Dap3(октансульфонил))чГрелин(1-28)-NH2; (Aib2, A6c5)чГрелин(1-28)-NH2; (A6c5)чГрелин(1-28)-NH2; (Aib2,6)чГрелин(1-28)-NH2; (Aib2, Act6)чГрелин(1-28)-NH2; (Aib2, 3Pal9)чГрелин(1-28)-NH2; (Aib2, Thz7)чГрелин(1-28)-NH2; (A5c2)чГрелин(1-28)-NH2; (Act2)чГрелин(1-28)-NH2; (Aib2, Cha5)чГрелин(1-28)-NH2; (Aib2, Abu6)чГрелин(1-28)-NH2; (Aib2, 4Hyp7)чГрелин(1-28)-NH2; (Aib2, Pip7)чГрелин(1-28)-NH2; (Aib2, Dhp7)чГрелин(1-28)-NH2; (Aib2,8)чГрелин(1-28)-NH2; (Aib2, 4Pal9)чГрелин(1-28)-NH2; (Aib2, Taz9)чГрелин(1-28)-NH2; (Aib2, 2Thi9)чГрелин(1-28)-NH2; (Aib2,10)чГрелин(1-28)-NH2; (Aib2, Tic7)чГрелин(1-28)-NH2; (3Pal9)чГрелин(1-28)-NH2; (Aib8)чГрелин(1-28)-NH2; (Taz9)чГрелин(1-28)-NH2; (2Thi9)чГрелин(1-28)-NH2; (Aib2, Glu3(NH-гексил), 3Pal9)чГрелин(1-28)-NH2; (Aib2, Glu3(NH-гексил), 4Hyp7)чГрелин(1-28)-NH2; (Aib2,8, Glu3(NH-гексил))чГрелин(1-28)-NH2; (Aib2, Glu3(NH-гексил), 4Pal9)чГрелин(1-28)-NH2; (Aib2, Glu3(NH-гексил), Taz9)чГрелин(1-28)-NH2; (Aib2, Glu3(NH-гексил), 2Thi9)чГрелин(1-28)-NH2; (Aib2,10, Glu3(NH-гексил))чГрелин(1-28)-NH2; (Glu3(NH-гексил), 4Hyp7)чГрелин(1-28)-NH2; (Glu3(NH-гексил), Aib8)чГрелин(1-28)-NH2; (Aib2, Glu3(NH-гексил))чГрелин(1-28)-NH2; (Aib2,12, Glu3(NH-гексил), 4Pal9, Orn15)чГрелин(1-28)-NH2; (Aib2,8, Glu3(NH-гексил))чГрелин(1-28)-NH2; (Aib2)чГрелин(1-28)-NH2; (Glu3(O-гексил))чГрелин(1-28)-NH2; (Glu3(NH-гексил))чГрелин(1-28)-NH2; (Aib1)чГрелин(1-28)-NH2; (Ac-Gly1, Aib2)чГрелин(1-28)-NH2; (Ac-Gly1, Aib2, Glu3(NH-гексил))чГрелин(1-28)-NH2; (Ac-Gly1, Aib2,10, Glu3(NH-гексил))чГрелин(1-28)-NH2; (н-бутирил-Gly1)чГрелин(1-28)-NH2; (н-бутирил-Gly1, Aib2, Glu3(NH-гексил))чГрелин(1-28)-NH2; (изобутирил-Gly1)чГрелин(1-28)-NH2; (н-октаноил-Gly1)чГрелин(1-28)-NH2; (Asp3(NH-гексил))чГрелин(1-28)-NH2; (Asp3(O-гексил))чГрелин(1-28)-NH2; Cys3(S(CH2)9CH3)чГрелин(1-28)-NH2; (Lys5)чГрелин(1-28)-NH2. 5. Соединение по п.4, или его фармацевтически приемлемая соль, выбранное из: (Aib8)чГрелин(1-28)-NH2; (Taz9)чГрелин(1-28)-NH2; (3Pal9)чГрелин(1-28)-NH2; (2Thi9)чГрелин(1-28)-NH2; (Aib2, Glu3(NH-гексил), Taz9)чГрелин(1-28)-NH2; (Aib2, Glu3(NH-гексил), 2Thi9)чГрелин(1-28)-NH2; (Aib2, 2Thi9)чГрелин(1-28)-NH2; (Glu3(NH-гексил))чГрелин(1-28)-NH2; (Aib1)чГрелин(1-28)-NH2; (Aib2)чГрелин(1-28)-NH2; (Glu3(O-гексил))чГрелин(1-28)-NH2; (Asp3(O-гексил))чГрелин(1-28)-NH2; Cys3(S(CH2)9CH3)чГрелин(1-28)-NH2; (Aib2, Glu3(NH-гексил))чГрелин(1-28)-NH2; (Aib2,6)чГрелин(1-28)-NH2; (Aib2, Act6)чГрелин(1-28)-NH2; (A5c2)чГрелин(1-28)-NH2; (Act2)чГрелин(1-28)-NH2; (Aib2, A6c5)чГрелин(1-28)-NH2; (A6c5)чГрелин(1-28)-NH2; (Lys5)чГрелин(1-28)-NH2; (Aib2, 3Pal9)чГрелин(1-28)-NH2; (Dap3(октансульфонил))чГрелин(1-28)-NH2; (Aib2, Thz7)чГрелин(1-28)-NH2; (Aib2, Cha5)чГрелин(1-28)-NH2; (Aib2, Abu6)чГрелин(1-28)-NH2; (Aib2, 4Hyp7)чГрелин(1-28)-NH2; (Aib2, Taz9)чГрелин(1-28)-NH2; (Aib2, 4Pal9)чГрелин(1-28)-NH2; (Aib2, Dhp7)чГрелин(1-28)-NH2; (Aib2,8)чГрелин(1-28)-NH2; (Aib2, Pip7)чГрелин(1-28)-NH2; (Aib2, Glu3(NH-гексил), 4Hyp7)чГрелин(1-28)-NH2; (Aib2,8, Glu3(NH-гексил))чГрелин(1-28)-NH2; (Aib2,12, Glu3(NH-гексил), 4Pal9, Orn15)чГрелин(1-28)-NH2; (Aib2, Glu3(NH-гексил), 4Pal9)чГрелин(1-28)-NH2; (Aib2, Glu3(NH-гексил), 3Pal9)чГрелин(1-28)-NH2; (Aib2,10)чГрелин(1-28)-NH2; (Aib2,10, Glu3(NH-гексил))чГрелин(1-28)-NH2; (Ac-Gly1, Aib2)чГрелин(1-28)-NH2; (Ac-Gly1, Aib2, Glu3(NH-гексил))чГрелин(1-5)-NH2; (Ac-Gly1, Aib2,10, Glu3(NH-гексил))чГрелин(1-28)-NH2; (н-бутирил-Gly1)чГрелин(1-28)-NH2; (н-бутирил-Gly1, Aib2, Glu3(NH-гексил))чГрелин(1-28)-NH2; (изобутирил-Gly1)чГрелин(1-28)-NH2 и (н-октаноил-Gly1)чГрелин(1-28)-NH2. 6. Соединение по п.5, или его фармацевтически приемлемая соль, выбранное из (Aib2, 3Pal9)чГрелин(1-28)-NH2; (Aib2, 4Hyp7)чГрелин(1-28)-NH2; (Aib2, Taz9)чГрелин(1-28)-NH2; (Aib2, Dhp7)чГрелин(1-28)-NH2; (Aib2,8)чГрелин(1-28)-NH2; (Aib2,8, Glu3(NH-гексил))чГрелин(1-28)-NH2; (Aib2,10, Glu3(NH-гексил))чГрелин(1-28)-NH2; (Aib2, Glu3(NH-гексил))чГрелин(1-28)-NH2; (Ac-Gly1, Aib2)чГрелин(1-28)-NH2; (Ac-Gly1, Aib2, Glu3(NH-гексил))чГрелин(1-28)-NH2; (Ac-Gly1, Aib2,10, Glu3(NH-гексил))чГрелин(1-28)-NH2; (н-бутирил-Gly1)чГрелин(1-28)-NH2; (н-бутирил-Gly1, Aib2, Glu3(NH-гексил))чГрелин(1-28)-NH2; (изобутирил-Gly1)чГрелин(1-28)-NH2 и (н-октаноил-Gly1)чГрелин(1-28)-NH2. 7. Соединение по п.6, или его фармацевтически приемлемая соль, выбранное из (Aib2, 3Pal9)чГрелин(1-28)-NH2; (Aib2, 4Hyp7)чГрелин(1-28)-NH2; (Aib2, Taz9)чГрелин(1-28)-NH2; (Aib2, Dhp7)чГрелин(1-28)-NH2; (Aib2,8)чГрелин(1-28)-NH2; (Aib2,8, Glu3(NH-гексил))чГрелин(1-28)-NH2; (Aib2, Glu3(NH-гексил))чГрелин(1-28)-NH2; (Ac-Gly1, Aib2)чГрелин(1-28)-NH2; (Ac-Gly1, Aib2, Glu3(NH-гексил))чГрелин(1-28)-NH2; (Ac-Gly1, Aib2,10, Glu3(NH-гексил))чГрелин(1-28)-NH2; (н-бутирил-Gly1)чГрелин(1-28)-NH2; (н-бутирил-Gly1, Aib2, Glu3(NH-гексил))чГрелин(1-28)-NH2; (изобутирил-Gly1)чГрелин(1-28)-NH2 и (н-октаноил-Gly1)чГрелин(1-28)-NH2. 8. Соединение по п.1, или его фармацевтически приемлемая соль, выбранное из (Aib2, Tic7)чГрелин(1-28)-NH2; (Ac-Gly1)чГрелин(1-28)-NH2; (Ac-Gly1, Glu3(NH-гексил))чГрелин(1-28)-NH2. 9. Способ идентификации соединения, способного связываться с GHS-рецептором, предусматривающий стадию измерения способности указанного соединения влиять на связывание соединения по любому из пп.1-8 с указанным рецептором, с фрагментом указанного рецептора, с полипептидом, содержащим указанный фрагмент указанного рецептора, и с производным указанного полипептида. 10. Применение соединения или фармацевтической соли по любому из пп.1-8 для производства лекарственного средства для стимуляции секреции гормона роста у субъекта, нуждающегося в такой стимуляции.
PD4A – Изменение наименования обладателя патента СССР или патента Российской Федерации на изобретение
(73) Новое наименование патентообладателя:
Адрес для переписки:
Извещение опубликовано: 27.04.2010 БИ: 12/2010
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

 АППЛИКАСЬОН СЬЕНТИФИК (С.К.Р.А.С.) (FR)
АППЛИКАСЬОН СЬЕНТИФИК (С.К.Р.А.С.) (FR)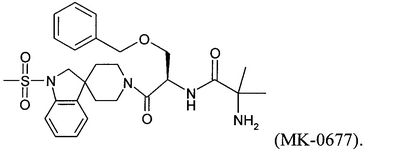
 -Ala или Асс;
-Ala или Асс; -аминомасляную кислоту,
-аминомасляную кислоту,
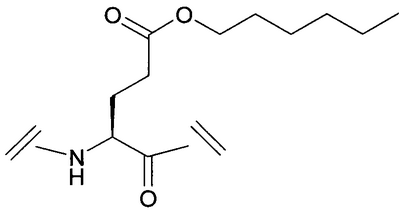
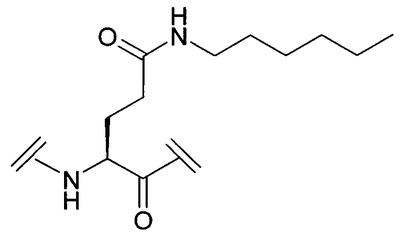
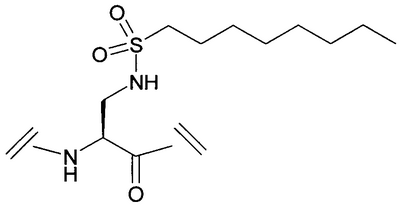
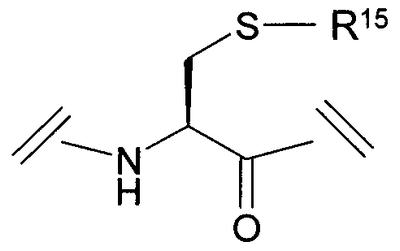
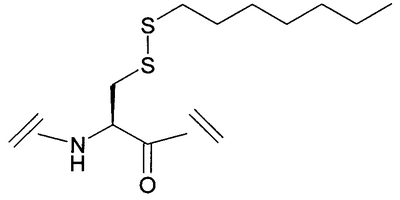
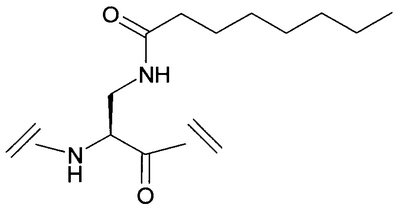
 -4-{N-(1-(4,4-Диметил-2,6-диоксоциклогексилиден)-3-метилбутил)амино}бензиловый эфир N-
-4-{N-(1-(4,4-Диметил-2,6-диоксоциклогексилиден)-3-метилбутил)амино}бензиловый эфир N-