|
|
(21), (22) Заявка: 2004117088/04, 25.11.2002
(24) Дата начала отсчета срока действия патента:
25.11.2002
(30) Конвенционный приоритет:
06.12.2001 US 60/338,984
(43) Дата публикации заявки: 27.03.2005
(46) Опубликовано: 20.01.2008
(56) Список документов, цитированных в отчете о
поиске:
WO 01/42246 A1, 14.06.2001. RU 2136683 С1, 10.09.1999.
(85) Дата перевода заявки PCT на национальную фазу:
04.06.2004
(86) Заявка PCT:
IB 02/04948 (25.11.2002)
(87) Публикация PCT:
WO 03/048162 (12.06.2003)
Адрес для переписки:
129010, Москва, ул. Б.Спасская, 25, стр.3, ООО “Юридическая фирма Городисский и Партнеры”, пат.пов. Е.Е.Назиной, рег. № 517
|
(72) Автор(ы):
ФЛАНАГАН Марк Эдвард (US),
ЛИ Зхенг Джейн (US)
(73) Патентообладатель(и):
ПФАЙЗЕР ПРОДАКТС ИНК. (US)
|
(54) КРИСТАЛЛИЧЕСКАЯ ФОРМА МОНОЦИТРАТА 3-{(3R,4R)-4-МЕТИЛ-3-[МЕТИЛ-(7Н-ПИРРОЛО[2,3-d] ПИРИМИДИН-4-ИЛ)АМИНО]ПИПЕРИДИН-1-ИЛ}-3-ОКСО-ПРОПИОНИТРИЛА И ЕЕ ПРИМЕНЕНИЕ
(57) Реферат:
Изобретение относится к новой кристаллической форме моноцитрата 3-{(3R,4R)-4-метил-3-[метил-(7Н-пирроло[2,3-d]пиримидин-4-ил)амино]пиперидин-1-ил}-3-оксо-пропионитрила, имеющей характеристические пики порошковой рентгенограммы, полученной с использованием Cu источника излучения, выраженные в градусах два-тэта, при приблизительно 5,7, 16,1, 20,2 и 20,5, а также к способу ее получения и ее применению для приготовления лекарственных средств для лечения или профилактики заболеваний, опосредованных протеинтирозинкиназами, такими как JAK3. Способ получения заключается во взаимодействии 3-{(3R,4R)-4-метил-3-[метил-(7Н-пирроло[2,3-d]пиримидин-4-ил)амино]пиперидин-1-ил}-3-оксо-пропионитрила с лимонной кислотой. 3 н. и 2 з.п. ф-лы, 1 табл.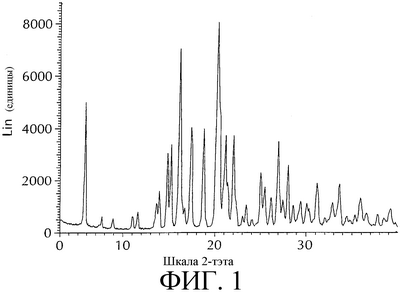
Уровень техники
Данное изобретение относится к новой кристаллической форме моноцитрата 3-{(3R,4R)-4-метил-3-[метил-(7Н-пирроло[2,3-d]пиримидин-4-ил)амино]пиперидин-1-ил}-3-оксо-пропионитрила и к способам ее получения.
3-{(3R,4R)-4-Метил-3-[метил-(7Н-пирроло[2,3-d]пиримидин-4-ил)амино]пиперидин-1-ил}-3-оксо-пропионитрил имеет химическую формулу C16H20N6O и следующую структурную формулу:
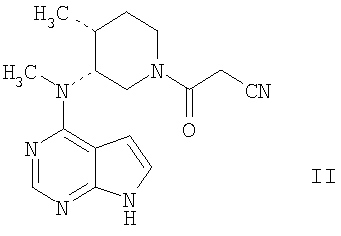
Его синтез описан в совместно рассматриваемой заявке на патент США №09/732669, поданной 8 декабря 2000, и предварительной заявке на патент США №60/294775, поданной 31 мая 2001, переданной заявителю по данному изобретению, которые включены сюда в качестве ссылок в полном объеме. 3-{(3R,4R)-4-метил-3-[метил-(7Н-пирроло[2,3-d]пиримидин-4-ил)амино]пиперидин-1-ил}-3-оксо-пропионитрил и его соответствующий цитрат применяют в качестве ингибиторов протеинкиназ, таких как фермент Janus Kinase 3 (далее обозначенный как JAK3) и, как таковой, является терапевтическим средством, таким как иммунодепрессант при отторжении трансплантатов органов, ксенотрансплантации, волчанке, рассеянном склерозе, ревматоидном артрите, псориазе, диабете I типа и осложнениях, связанных с диабетом, раке, астме, атопическом дерматите, аутоиммунных расстройствах щитовидной железы, язвенном колите, болезни Крона, болезни Альцгеймера, лейкемии и других показаниях, при которых желательна иммуносупрессия.
Определено, что кристаллическая форма моноцитрата 3-{(3R,4R)-4-метил-3-[метил-(7Н-пирроло[2,3-d]пиримидин-4-ил)амино]пиперидин-1-ил}-3-оксо-пропионитрила имеет свойства в твердом состоянии, которые подходят для получения таблеток.
Данное изобретение также относится к способам получения кристаллического моноцитрата 3-{(3R,4R)-4-метил-3-[метил-(7Н-пирроло[2,3-d]пиримидин-4-ил)амино]пиперидин-1-ил}-3-оксо-пропионитрила.
Краткое описание изобретения
Данное изобретение относится к новой кристаллической форме моноцитрата 3-{(3R,4R)-4-метил-3-[метил-(7Н-пирроло[2,3-d]пиримидин-4-ил)амино]пиперидин-1-ил}-3-оксо-пропионитрила, которую применяют для (а) лечения или профилактики расстройства или состояния, выбранного из отторжения трансплантатов органов, ксенотрансплантации, волчанки, рассеянного склероза, ревматоидного артрита, псориаза, диабета I типа и осложнений, связанных с диабетом, рака, астмы, атопического дерматита, аутоиммунных расстройств щитовидной железы, язвенного колита, болезни Крона, болезни Альцгеймера, лейкемии и других аутоиммунных заболеваний, или (b) ингибирования протеинкиназ или Janus Kinase 3 (JAK3) у млекопитающих, включая человека. Новая кристаллическая форма плавится при температуре от около 203 до около 210°С и имеет рентгенограмму с характеристическими пиками, выраженными в градусах 2-тэта (2 ) при 5,7, 16,1, 20,2 и 20,5, как показано на фиг. 1. Обсуждение теории порошковых рентгенограмм можно найти в Stout & Jensen, X-Ray Structure Determination; A Practical Guide, MacMillan Co., New York, N.Y. (1968), которая включена сюда в качестве ссылки в полном объеме. ) при 5,7, 16,1, 20,2 и 20,5, как показано на фиг. 1. Обсуждение теории порошковых рентгенограмм можно найти в Stout & Jensen, X-Ray Structure Determination; A Practical Guide, MacMillan Co., New York, N.Y. (1968), которая включена сюда в качестве ссылки в полном объеме.
Данное изобретение также относится к кристаллической форме моноцитрата 3-{(3R,4R)-4-метил-3-[метил-(7Н-пирроло[2,3-d]пиримидин-4-ил)амино]пиперидин-1-ил}-3-оксо-пропионитрила, имеющей термограмму дифференциальной сканирующей калориметрии, показанную на фиг. 2, с характеристическими пиками при температуре от около 203 до около 210°С, имеющей температуру начала плавления от около 199 до около 206°С при скорости сканирования 5°С в минуту.
Данное изобретение также относится к аморфной форме моноцитрата 3-{(3R,4R)-4-метил-3-[метил-(7Н-пирроло[2,3-d]пиримидин-4-ил)амино]пиперидин-1-ил}-3-оксо-пропионитрила.
Данное изобретение также относится к фармацевтической композиции для (а) лечения или профилактики расстройства или состояния, выбранного из отторжения трансплантатов органов, ксенотрансплантации, волчанки, рассеянного склероза, ревматоидного артрита, псориаза, диабета I типа и осложнений, связанных с диабетом, рака, астмы, атопического дерматита, аутоиммунных расстройств щитовидной железы, язвенного колита, болезни Крона, болезни Альцгеймера, лейкемии и других аутоиммунных заболеваний, или (b) ингибирования протеинкиназ или Janus Kinase 3 (JAK3) у млекопитающих, включая человека, содержащей количество соединения формулы I, которое является эффективным при таких расстройствах или состояниях, и фармацевтически приемлемый носитель.
Данное изобретение также относится к способу ингибирования тирозинкиназ белка или Janus Kinase 3 (JAK3) у млекопитающих, включая человека, включающему введение указанному млекопитающему эффективного количества соединения формулы I.
Данное изобретение также относится к способу лечения или профилактики расстройства или состояния, выбранного из отторжения трансплантатов органов, ксенотрансплантации, волчанки, рассеянного склероза, ревматоидного артрита, псориаза, диабета I типа и осложнений, связанных с диабетом, рака, астмы, атопического дерматита, аутоиммунных расстройств щитовидной железы, язвенного колита, болезни Крона, болезни Альцгеймера, лейкемии и других аутоиммунных заболеваний у млекопитающих, включая человека, включающему введение указанному млекопитающему количества соединения формулы I, которое эффективно для лечения такого состояния.
Данное изобретение также относится к способу получения моноцитрата 3-{(3R,4R)-4-метил-3-[метил-(7Н-пирроло[2,3-d]пиримидин-4-ил)амино]пиперидин-1-ил}-3-оксо-пропионитрила, включающему взаимодействие 3-{(3R,4R)-4-метил-3-[метил-(7Н-пирроло[2,3-d]пиримидин-4-ил)амино]пиперидин-1-ил}-3-оксо-пропионитрила с лимонной кислотой.
Краткое описание чертежей.
На фиг. 1 представлена характеристическая порошковая рентгенограмма моноцитрата 3-{(3R,4R)-4-метил-3-[метил-(7Н-пирроло[2,3-d]пиримидин-4-ил)амино]пиперидин-1-ил}-3-оксо-пропионитрила. (Вертикальная ось: интенсивность (единицы); горизонтальная ось: два тэта (градусы)).
На фиг. 2 представлена характеристическая термограмма дифференциальной сканирующей калориметрии моноцитрата 3-{(3R,4R)-4-метил-3-[метил-(7Н-пирроло[2,3-d]пиримидин-4-ил)амино]пиперидин-1-ил}-3-оксо-пропионитрила. (скорость сканирования: 5°С в минуту; вертикальная ось: тепловой поток (Вт/г); горизонтальная ось: температура (°С)).
Подробное описание изобретения
Кристаллическую форму соединения в соответствии с данным изобретением, моноцитрата 3-{(3R,4R)-4-метил-3-[метил-(7Н-пирроло[2,3-d]пиримидин-4-ил)амино]пиперидин-1-ил}-3-оксо-пропионитрила, получают, как описано ниже.
Схема 1
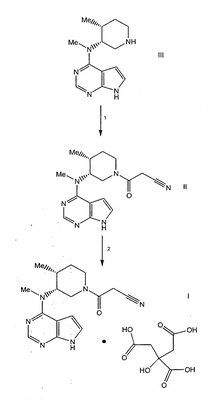 Схема 2 Схема 2
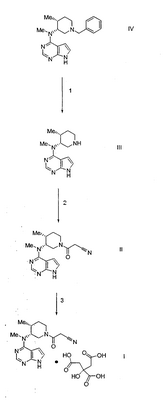
В реакции 1 схемы 1 (3R,4R)-метил-(4-метил-пиперидин-3-ил)-(7Н-пирроло[2,3-d]пиримидин-4-ил)амин, соединение формулы III, превращают в соответствующий 3-{(3R,4R)-4-метил-3-[метил-(7Н-пирроло[2,3-d]пиримидин-4-ил)амино]пиперидин-1-ил}-3-оксо-пропионитрил, соединение формулы II, взаимодействием III с 2,5-диоксо-пирролидин-1-иловым эфиром цианоуксусной кислоты в присутствии основания, такого как триэтиламин. Реакционную смесь перемешивают при комнатной температуре в течение от около 15 минут до около 2 часов, предпочтительно, около 30 минут.
В реакции 2 схемы 1 3-{(3R,4R)-4-метил-3-[метил-(7Н-пирроло[2,3-d]пиримидин-4-ил)амино]пиперидин-1-ил}-3-оксо-пропионитрил, соединение формулы II, превращают в соответствующий моноцитрат 3-{(3R,4R)-4-метил-3-[метил-(7Н-пирроло[2,3-d]пиримидин-4-ил)амино]пиперидин-1-ил}-3-оксо-пропионитрила, соединение формулы I, взаимодействием II с водным раствором лимонной кислоты.
В реакции 1 схемы 2, ((3R,4R)-1-бензил-4-метил-пиперидин-3-ил)-метил-(7Н-пирроло[2,3-d]пиримидин-4-ил)амин, соединение формулы IV, превращают в соответствующий (3R,4R)-метил-(4-метил-пиперидин-3-ил)-(7Н-пирроло[2,3-d]пиримидин-4-ил)амин, соединение формулы III, обработкой IV водородом в присутствии 20% гидроксида палладия на угле (50 мас.% воды) и полярного протонного растворителя, такого как этанол. Реакционную смесь перемешивают при температуре от около 45 до около 75°С, предпочтительно, около 60°С, под давлением около 60 фунт/д2, предпочтительно, около 50 фунт/д2, в течение от около двух дней до около четырех дней, предпочтительно, в течение трех дней.
В реакции 2 схемы 2 (3R,4R)-метил-(4-метил-пиперидин-3-ил)-(7Н-пирроло[2,3-d]пиримидин-4-ил)амин, соединение формулы III, превращают в соответствующий 3-{(3R,4R)-4-метил-3-[метил-(7Н-пирроло[2,3-d]пиримидин-4-ил)амино]пиперидин-1-ил}-3-оксо-пропионитрил, соединение формулы II, взаимодействием III с 2,5-диоксо-пирролидин-1-иловым эфиром цианоуксусной кислоты в присутствии полярного протонного растворителя, такого как этанол. Реакционную смесь перемешивают при комнатной температуре в течение от около 30 минут до около 3 часов, предпочтительно, около 1 часа.
В реакции 3 схемы 2 3-{(3R,4R)-4-метил-3-[метил-(7Н-пирроло[2,3-d]пиримидин-4-ил)амино]пиперидин-1-ил}-3-оксо-пропионитрил, соединение формулы II, превращают в соответствующий моноцитрат 3-{(3R,4R)-4-метил-3-[метил-(7Н-пирроло[2,3-d]пиримидин-4-ил)амино]пиперидин-1-ил}-3-оксо-пропионитрила, соединение формулы I, взаимодействием II с лимонной кислотой в присутствии полярного растворителя, такого как ацетон. Реакционную смесь перемешивают при температуре от около 30 до около 50°С, предпочтительно при около 40°С, в течение от около 1 часа до около 3 часов, предпочтительно около 2 часов. Полученную реакционную смесь необязательно далее перемешивают при температуре от около 20 до около 40°С, предпочтительно при около 30°С, в течение от около 3 часов до около 5 часов, предпочтительно около 4 часов, с последующим перемешиванием при комнатной температуре в течение от около 16 часов до около 20 часов, предпочтительно в течение 18 часов.
Композиции в соответствии с данным изобретением могут быть составлены обычным методом с применением одного или более фармацевтически приемлемых носителей.
Для перорального введения фармацевтические композиции могут иметь форму таблеток, полученных обычными методами, с фармацевтически приемлемыми наполнителями, такими как связующие агенты (например, преджелатинизированный кукурузный крахмал, поливинилпирролидон или гидроксипропилметилцеллюлоза); наполнители (например, лактоза, микрокристаллическая целлюлоза или фосфат кальция); смазывающие агенты (например, стеарат магния, тальк или двуокись кремния); разрыхлители (например, картофельный крахмал или натрий гликолят крахмала); или увлажняющие агенты (например, лаурилсульфат натрия). Таблетки могут быть покрыты оболочкой с применением методов, хорошо известных в данной области техники.
Предлагаемая доза активного соединения в соответствии с данным изобретением для перорального, парентерального или буккального введения для среднего взрослого человека для лечения перечисленных выше состояний (например, ревматоидного артрита), составляет от 0,1 до 1000 мг активного ингредиента на единичную дозу, которая может вводиться, например, от 1 до 4 раз в день.
Соединение формулы I вводят в фармацевтически приемлемой форме либо в чистом виде, либо в сочетании с одним или более дополнительными агентами, которые модулируют иммунную систему млекопитающего, или с противовоспалительными агентами, которые могут включать, но не ограничены ими, циклоспорин А (например, Sandimmune® или Neoral®), рапамицин, FK-506 (такролимус), лефлуномид, деоксиспергуалин, микофенолят (например, Callcept®), азатиоприн (например, Imuran®), даклизумаб (например, Zenapax®), ОКТ3 (например, Orthocolone®), AtGam, аспирин, акктаминофен, ибупрофен, напроксен, пироксикам и противовоспалительные стероиды (например, преднизолон или дексаметазон); и такие агенты могут вводиться как часть одних и тех же или различных стандартных лекарственных форм, одним и тем же или различными способами введения и по одной и той же или различным схемам введения в соответствии со стандартной фармакологической практикой.
FK506 (такролимус) дают перорально при 0,10-0,15 мг/кг массы тела каждые 12 часов в течение 48 часов после операции. Дозу контролируют через уровень такролимуса в сыворотке.
Циклоспорин А (Sandimmune для перорального или внутривенного ведения, или Neoral®, раствор или капсулы для перорального введения) дают перорально при 5 мг/кг массы тела каждые 12 часов в течение 48 часов после операции. Дозу контролируют через уровень циклоспорина А в крови.
Активные агенты могут быть сформированы для замедленного выделения в соответствии с методами, хорошо известными специалистам в данной области техники. Примеры таких препаративных форм могут быть найдены в патентах США №№ 3538214, 4060598, 4173626, 3119742 и 3492397.
Способность соединения формулы I ингибировать Janus Kinase 3 (JAK3) и, следовательно, демонстрировать эффективность при лечении расстройств или состояний, характеризующихся Janus Kinase 3, показана в представленных ниже тестах in vitro.
Биологическое исследование
JAK3 (JH1:GST) ферментное исследование
В исследовании JAK3 киназы применяется белок, экспрессированный в инфицированных бакуловирусом клетках SF9 (слитый белок GST и каталитический домен человеческой JAK3), очищенный аффинной хроматографией на глутатион-сефарозе. Субстратом для реакции является полиглутаминовая кислота – тирозин (PGT (4:1) каталог Sigma № Р0275), нанесенный в планшеты Nunc Maxi Sorp при концентрации 100 мкг/мл и выдержанный в течение ночи при температуре 37°С. На следующее утро после нанесения, планшеты три раза промывают и в ячейки, содержащие 100 мкл киназного буфера (50 мМ HEPES, рН 7,3, 125 мМ NaCl, 24 мМ MgCl2) + 0,2 мкМ АТФ + 1 мМ Na ортованадата), добавляют JAK3. Реакционную смесь выстаивают в течение 30 минут при комнатной температуре и планшеты промывают еще три раза. Уровень фосфорилированного тирозина в данной ячейке рассчитывают стандартным методом ELISA, применяя антитело анти-фосфотирозина (ICN PY20, кат. № 69-151-1).
Ингибирование пролиферации зависимых от человеческого ИЛ-2 бластных Т-клеток
Данный скрининг позволяет измерить ингибирующее действие соединений на пролиферацию ИЛ-2 зависимых бластных Т-клеток in vitro. Так как посыл сигналов через рецептор ИЛ-2 требует JAK-3, активные по отношению к клеткам ингибиторы JAK-3 должны ингибировать пролиферацию ИЛ-2 зависимых бластных Т-клеток.
Клетки для данного исследования выделяют из свежей крови человека. После отделения одноядерных клеток с помощью Accuspin System-Histopaque-1077 (Sigma № А7054) первичные Т-клетки человека выделяют с помощью отрицательного отбора с применением Lympho-Kwik T (One Lambda, Inc., кат. № LK-50Т). Т-клетки культивируют при 1-2х106/мл в среде (RPMI + 10% инактивированная теплом фетальная телячья сыворотка (Hyclone кат. № А-1111-L)+1% пенициллин/стрептомицин (Gibco)) и индуцируют для пролиферации добавлением 10 мкг/мл ФГА (Murex Diagnostics, кат. № НА 16). Через 3 дня при температуре 37°С в 5% CO2 клетки 3 раза промывают средой, повторно суспендируют до плотности 1-2х106 клеток/мл в среде плюс 100 ед./мл человеческого рекомбинантного ИЛ-2 (R&D Systems, кат. № 202-IL). Через 1 неделю клетки становятся ИЛ-2 зависимыми и могут сохраняться вплоть до 3 недель при добавлении дважды в неделю равных объемов среды + 100 ед./мл ИЛ-2.
Для исследования способности тестируемых соединений ингибировать пролиферацию ИЛ-2 зависимых Т-клеток ИЛ-2 зависимые клетки промывают 3 раза, повторно суспендируют в среде и затем помещают на планшет (50000 клеток/ячейку/0,1 мл) в плоскодонный 96-ячеечный титрационный планшет для микротитрования (Falcon № 353075). Из 10 мМ исходного раствора тестируемого соединения в ДМСО, последовательно добавляют соединение при двукратном разбавлении в три ячейки, начиная при 10 мкМ. Через один час 10 ед./мл ИЛ-2 добавляют в каждую тестируемую ячейку. Затем планшеты инкубируют при температуре 37°С, 5% СО2 в течение 72 часов. Затем планшеты подвергают импульсной обработке 3Н-тимидином (0,5 мкКи/ячейку) (NEN, кат. № NET-027А) и инкубируют в течение еще 18 часов. Затем планшеты с культурой собирают с помощью харвестера для 96-ячеечных планшетов, и количество 3Н-тимидина, введенное в пролиферированные клетки, определяют подсчетом на сцинтилляционном счетчике Packard Top Count. Данные анализируют с помощью кривой зависимости % ингибирования от концентрации тестируемого соединения. Значение IC50 (мкМ) определяют из указанной кривой.
Представленные ниже примеры иллюстрируют получение соединений в соответствии с данным изобретением, но не ограничивают их. Температуры плавления не скорректированы. ЯМР данные даны в частях на миллион ( ) и относятся к сигналам дейтерия образца растворителя (дейтерийхлороформ, если не указано иначе). ) и относятся к сигналам дейтерия образца растворителя (дейтерийхлороформ, если не указано иначе).
Пример 1
Моноцитрат 3-{(3R,4R)-4-метил-3-[метил-(7Н-пирроло[2,3-d]пиримидин-4-ил)амино]пиперидин-1-ил}-3-оксо-пропионитрила
Этанол (13 литров), (3R,4R)-метил-(4-метил-пиперидин-3-ил)-(7Н-пирроло[2,3-d]пиримидин-4-ил)амин (1,3 кг), 2,5-диоксопирролидин-1-иловый эфир цианоуксусной кислоты (1,5 кг) и триэтиламин (1,5 литра) объединяют и перемешивают при температуре окружающей среды. При завершении реакции (определяется высокоэффективной жидкостной хроматографией (ВЭЖХ), приблизительно 30 минут) раствор фильтруют, концентрируют и подвергают азеотропной перегонке с 15 литрами метиленхлорида. Реакционную смесь промывают последовательно 12 литрами 0,5 н. раствора гидроксида натрия, 12 литрами солевого раствора и 12 литрами воды. Органический слой концентрируют и подвергают азеотропной перегонке с 3 литрами ацетона (конечная температура куба 42°С). Полученный раствор охлаждают до температуры от 20 до 25°С с последующим добавлением 10 литров ацетона. Этот раствор фильтруют и затем добавляют водный раствор лимонной кислоты (0,8 кг в 4 литрах воды) через линейный фильтр. Реакционную смесь оставляют гранулироваться. Суспензию охлаждают перед сбором твердого вещества фильтрацией. Твердое вещество сушат с получением 1,9 кг (71%) моноцитрата (3R,4R)-3-{4-метил-3-[метил-(7Н-пирроло[2,3-d]пиримидин-4-ил)амино]пиперидин-1-ил}-3-оксо-пропионитрила. Этот материал затем объединяют с 15 литрами 1:1 этанола/воды и суспензию перемешивают в течение ночи. Твердое вещество фильтруют и сушат с получением 1,7 кг (63% из (3R,4R)-метил-(4-метил-пиперидин-3-ил)-(7Н-пирроло[2,3-d]пиримидин-4-ил)амина) указанного в заголовке соединения в виде белого кристаллического твердого вещества.
1Н ЯМР (400 МГц)(D2O)  HOD: 0,92 (2Н, д, J=7,2 Гц), 0,96 (1Н, д, J=7,6 Гц), 1,66 (1Н, м), 1,80 (1Н, м), 2,37 (1Н, м), 2,58 (2Н, 1/2 ABq, J=15,4 Гц), 2,70 (2Н, 1/2 ABq, J=154 Гц), 3,23 (2Н, с), 3,25 (1Н, с), 3,33 (1Н, м), 3,46 (1Н, м), 3,81 (4Н, м), 4,55 (1Н, м), 6,65 (1Н, д, J=3,2 Гц), 7,20 (1Н, т, J=3,2 Гц), 8,09 (1Н, м). HOD: 0,92 (2Н, д, J=7,2 Гц), 0,96 (1Н, д, J=7,6 Гц), 1,66 (1Н, м), 1,80 (1Н, м), 2,37 (1Н, м), 2,58 (2Н, 1/2 ABq, J=15,4 Гц), 2,70 (2Н, 1/2 ABq, J=154 Гц), 3,23 (2Н, с), 3,25 (1Н, с), 3,33 (1Н, м), 3,46 (1Н, м), 3,81 (4Н, м), 4,55 (1Н, м), 6,65 (1Н, д, J=3,2 Гц), 7,20 (1Н, т, J=3,2 Гц), 8,09 (1Н, м).
Пример 2
Моноцитрат 3-{(3R,4R)-4-метил-3-[метил-(7Н-пирроло[2,3-d]пиримидин-4-ил)амино]пиперидин-1-ил}-3-оксо-пропионитрила
К раствору 79 г ((3R,4R)-1-бензил-4-метил-пиперидин-3-ил)-метил-(7Н-пирроло[2,3-d]пиримидин-4-ил)амина, растворенного в 2 литрах этанола добавляют 79 грамм 20% гидроксида палладия на угле (50 мас.% воды) и смесь перемешивают при атмосферном давлении 50 фунт/д2 водорода в течение трех дней (проведение гидрогенолиза при повышенной температуре [50-70°С] значительно снижает время реакции). После удаления катализатора фильтрацией через Celite® к раствору в этаноле добавляют 51 грамм 2,5-диоксо-пирролидин-1-илового эфира цианоуксусной кислоты и полученную смесь перемешивают при комнатной температуре в течение 1 часа, после чего этанол удаляют при повышенном давлении. Остаток повторно растворяют в 1,0 литре дихлорметана и раствор последовательно промывают 0,6 литра насыщенного водного раствора бикарбоната натрия и 0,4 литра насыщенного бикарбоната натрия. Объединенные водные слои повторно промывают 0,4 литра дихлорметана, слои дихлорметана объединяют, сушат над сульфатом магния, фильтруют и концентрируют в вакууме с получением 61 грамма янтарного масла. Этот продукт затем растворяют в 2,1 литра ацетона и раствор нагревают до температуры 40°С. К раствору медленно добавляют тонкоизмельченную лимонную кислоту (37 граммов) (в виде твердого вещества). Смесь продолжают перемешивают при температуре 40°С в течение двух часов (завершается гранулирование). После охлаждения до комнатной температуры твердое вещество собирают фильтрацией, промывают ацетоном и сушат в вакууме с получением 78,5 граммов (66% из ((3R,4R)-1-бензил-4-метил-пиперидин-3-ил)-метил-(7Н-пирроло[2,3-d]пиримидин-4-ил)амина) указанного в заголовке соединения в виде слегка беловатого кристаллического твердого вещества.
Пример 3
Моноцитрат 3-{(3R,4R)-4-метил-3-[метил-(7Н-пирроло[2,3-d]пиримидин-4-ил)амино]пиперидин-1-ил}-3-оксо-пропионитрила
Перемешиваемый раствор (3R,4R)-3-{4-метил-3-[метил-(7Н-пирроло[2,3-d]пиримидин-4-ил)амино]пиперидин-1-ил}-3-оксо-пропионитрила (230 мг/0,74 ммоль), растворенного в 23 мл ацетона, нагревают до температуры 40°С. К этому раствору добавляют 155 мг (0,81 ммоль) тонкоизмельченной лимонной кислоты. Полученную смесь перемешивают при температуре 40°С в течение 2 часов, затем при температуре 30°С в течение 4 часов, с последующим перемешиванием при комнатной температуре в течение еще 18 часов. После чего твердое вещество собирают фильтрацией, промывают ацетоном и сушат в вакууме с получением 280 мг (75%) указанного в заголовке соединения в виде белого кристаллического твердого вещества.
Пример 4
Способ получения порошковой рентгенограммы для моноцитрата 3-{(3R,4R)-4-метил-3-[метил-(7Н-пирроло[2,3-d]пиримидин-4-ил)амино]пиперидин-1-ил}-3-оксо-пропионитрила
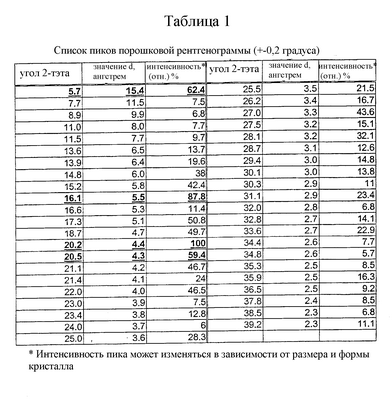
Порошковую рентгенограмму для моноцитрата 3-{(3R,4R)-4-метил-3-[метил-(7Н-пирроло[2,3-d]пиримидин-4-ил)амино]пиперидин-1-ил}-3-оксо-пропионитрила получают с применением диффрактометра Bruker D5000 (Madison, Wisconsin), оборудованного медным излучателем, с фиксированными головками (1,0, 1,0, 0,6 мм) и определителем твердого состояния Kevex. Данные фиксируют следующим образом: Cu анод; длина волны 1: 1,54056; длина волны 2: 1,54439 (отн. интенсивность: 0,500); от 3,0 до 40,0 градусов в 2 тэта с применением шага-0,04 градуса и времени шага-1,0 секунда. Результаты представлены в таблице 1.
Формула изобретения
1. Кристаллическая форма моноцитрата 3-{(3R,4R)-4-метил-3-[метил-(7Н-пирроло[2,3-d]пиримидин-4-ил)амино]пиперидин-1-ил}-3-оксо-пропионитрила, имеющая характеристические пики порошковой рентгенограммы, полученной с использованием Cu источника излучения, выраженные в градусах два-тэта, при приблизительно 5,7, 16,1, 20,2 и 20,5.
2. Кристаллическая форма по п.1, имеющая характеристические пики порошковой рентгенограммы, выраженные в градусах два-тэта, при приблизительно
| угол 2-тэта |
угол 2-тэта |
угол 2-тэта |
угол 2-тэта |
| 5,7 |
17,3 |
25,5 |
32,8 |
| 7,7 |
18,7 |
26,2 |
33,6 |
| 8,9 |
20,2 |
27,0 |
34,4 |
| 11,0 |
20,5 |
27,5 |
34,8 |
| 11,5 |
21,1 |
28,1 |
35,3 |
| 13,6 |
21,4 |
28,7 |
35,9 |
| 13,9 |
22,0 |
29,4 |
36,5 |
| 14,8 |
23,0 |
30,1 |
37,8 |
| 15,2 |
23,4 |
30,3 |
38,5 |
| 16,1 |
24,0 |
31,1 |
39,2 |
| 16,6 |
25,0 |
32,0 |
|
3. Кристаллическая форма моноцитрата 3-{(3R,4R)-4-метил-3-[метил-(7Н-пирроло[2,3-d]пиримидин-4-ил)амино]пиперидин-1-ил}-3-оксо-пропионитрила по п.1, имеющая температуру начала плавления от около 199 до около 206°С.
4. Применение кристаллического моноцитрата 3-{(3R,4R)-4-метил-3-[метил-(7Н-пирроло[2,3-d]пиримидин-4-ил)амино]пиперидин-1-ил}-3-оксо-пропионитрила по п.1 для приготовления лекарственных средств для лечения или профилактики заболеваний, опосредованных протеинтирозинкиназами, такими как JAK3.
5. Способ получения кристаллического моноцитрата 3-{(3R,4R)-4-метил-3-[метил-(7Н-пирроло[2,3-d]пиримидин-4-ил)амино]пиперидин-1-ил}-3-оксо-пропионитрила, включающий взаимодействие 3-{(3R,4R)-4-метил-3-[метил-(7Н-пирроло[2,3-d]пиримидин-4-ил)амино]пиперидин-1-ил}-3-оксо-пропионитрила с лимонной кислотой.
РИСУНКИ
|
|