|
|
(21), (22) Заявка: 2004139068/04, 03.06.2003
(24) Дата начала отсчета срока действия патента:
03.06.2003
(30) Конвенционный приоритет:
04.06.2002 US 60/385,502
(43) Дата публикации заявки: 27.06.2005
(46) Опубликовано: 20.01.2008
(56) Список документов, цитированных в отчете о
поиске:
RU 2135498, 27.08.1999. WO 01/12629, 22.02.2001. EP 0941994, 15.09.1999. US 5444056, 22.08.1995. WO 03/013510, 20.02.2003. WO 02/098857, 12.12.2002. TSAI Y. ET AL. «N1-(benzenesulfonyl)tryptamines as novel 5-HT6 antagonysts», Bioorganic & medicinal chemistry letters, 2000, 10(20), 2295-2299.
(85) Дата перевода заявки PCT на национальную фазу:
11.01.2005
(86) Заявка PCT:
US 03/17466 (03.06.2003)
(87) Публикация PCT:
WO 03/101990 (11.12.2003)
Адрес для переписки:
129010, Москва, ул. Б.Спасская, 25, стр.3, ООО “Юридическая фирма Городисский и Партнеры”, пат.пов. Е.Е.Назиной, рег. № 517
|
(72) Автор(ы):
БЕРНОТАС Рональд Чарльз (US),
ЛЕНИСЕК Стивен Эдвард (US),
АНТАНЕ Шуйлер А. (US)
(73) Патентообладатель(и):
УАЙТ (US)
|
(54) 1-(АМИНОАЛКИЛ)-3-СУЛЬФОНИЛАЗАИНДОЛЫ В КАЧЕСТВЕ ЛИГАНДОВ 5-ГИДРОКСИТРИПТАМИНА-6
(57) Реферат:
Данная группа изобретений представляет собой соединения формулы (I), способы их получения, а также их применение для терапевтического лечения расстройств нервной системы, связанных с рецептором 5-ГТ6. Технический результат – получение ряда новых биологически активных веществ, характеризующихся формулой (I), и фармацевтических композиций на их основе для лечения расстройств нервной системы, находящихся под воздействием рецептора 5-ГТ6. 8 н. и 14 з.п. ф-лы, 6 табл.
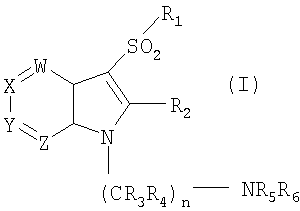
Данное изобретение относится к 1-(аминоалкил)-3-сульфонилазаиндолам, применяемым в качестве лигандов 5-гидрокситриптамин-6, к способам их получения, к способам лечения с их применением и к фармацевтическим композициям, содержащим их.
Уровень техники
Рецепторы серотонина (5-гидрокситриптамина) (5-ГТ) играют критическую роль во многих физиологических и поведенческих функциях у человека и животных. Такие функции медиируются через различные рецепторы 5-ГТ, распределенные в организме. В настоящее время существует приблизительно пятнадцать различных подтипов рецепторов 5-ГТ человека, которые клонированы, многие из них играют хорошо определенную роль у человека. Одним из недавно идентифицированных подтипов рецепторов 5-ГТ является рецептор 5-ГТ6, впервые клонированный из ткани крысы в 1993 году (Monsma, F.J.; Shen, Y.; Ward, R.P.; Hamblin, M.W. Molecular Pharmacology 1993, 43, 320-327) и затем из ткани человека (Kohen, R.; Metcalf, M.A.; Khan, N.; Druck, T.; Huebner, K.; Sibley, D.R. Journal of Neurochemistry 1996, 66, 47-56). Рецептор представляет собой сопряженный с G-белком рецептор (GPCR), положительно сопряженный с аденилатциклазой (Ruat, M.; Traiffort, E.; Arrang, J-M.; Tardivel-Lacombe, L.; Diaz, L.; Leurs, R.; Schwartz, J-C. Biochemical Biophysical Research Communications 1993, 193, 268-276). Рецептор найден практически исключительно в центральной нервной системе (ЦНС), как у крыс, так и у человека. Исследования гибридизации in situ рецептора 5-ГТ6 в мозге крысы с применением мРНК показали основную локализацию в областях проекции 5-ГТ, включая стриатум, necleus accumbens, обонятельные бугорки и гиппокампальные образования (Ward, R.P.; Hamblin, M.W.; Lachowicz, J.E.; Hoffman, B.J.; Sibley, D.R.; Dorsa, D.M. Neuroscience 1995, 64, 1105-1111).
Существует множество потенциальных областей применения для лигандов 5-ГТ6 у человека, основанных на прямом действии и на показаниях из известных научных исследований. Эти исследования включают локализацию рецептора, аффинность лигандов с известной in vivo активностью и различные исследования на животных, проводимые вплоть до настоящего времени.
Одной из потенциальных областей применения модуляторов функции рецептора 5-ГТ6 является улучшение познавательной способности и памяти у человека при таких заболеваниях, как болезнь Альцгеймера. Высокие уровни рецептора, найденные в важных структурах в переднем мозге, включая каудат/скорлупу, гиппокамп, necleus accumbens и кору головного мозга, предполагают вовлеченность рецептора в функции памяти и познавательной способности, так как известно, что эти области играют жизненно важную роль для памяти (Garard, C.; Martres, M.-P.; Lefevre, K.; Miquel, M.C.; Verge, D.; Lanfumey, R.; Doucet, E.; Hamon, M.; El Mestikawy, S. Brain Research, 1997, 746, 207-219). Способность известных лигандов рецептора 5-ГТ6 улучшать холинергическую трансмиссию также подтверждает возможность применения для улучшения познавательной способности (Bentley, J.C.; Boursson, A.; Boess, F.G.; Kone, F.C.; Marsden, C.A.; Petit, N.; Sleight, A.J. British Journal of Pharmacology, 1999, 126(7), 1537-1542). В процессе исследований было обнаружено, что известный селективный антагонист 5-ГТ6 значительно повышает уровни глутамата и аспартата в лобной коре головного мозга, не увеличивая уровни норадреналина, допамина или 5-ГТ. Такое селективное увеличение нейрохимических веществ, которое, как известно, вовлечено в функции памяти и познавательной способности, четко указывает на роль лигандов 5-ГТ6 в познавательной способности (Dawson, L.A.; Nguyen, H.Q.; Li, P. British Journal of Pharmacology, 2000, 120(7), 23-26). Исследования памяти животных и изучение известного селективного антагониста 5-ГТ6 показали некоторый положительный эффект (Rogers, D.C.; Hatcher, P.D.; Hagan, J.J. Society of Neuroscience, Abstracts 2000, 26, 680).
Подобным потенциальным терапевтическим применением лигандов 5-ГТ6 является лечение расстройств дефицита внимания (РДВ, также известных, как заболевание гиперактивности дефицита внимания или ЗГДВ) у детей и у взрослых. Так как, похоже, что антагонисты 5-ГТ6 улучшают активность нигростриарного допаминового пути и так как ЗГДВ связано с аномалиями в каудате (Ernst, M.; Zametkin, A.J.l Matochik, J.H.; Jons, P.A.; Cohen, R.M. Journal of Neuroscience 1998, 18(15), 5901-5907), антагонисты 5-ГТ6 могут ослаблять расстройства дефицита внимания.
В ранних исследованиях, в которых изучали аффинность различных лигандов ЦНС при известном терапевтическом применении или большое структурное сходство с известными лекарственными средствами, была предложена роль лигандов 5-ГТ6 в лечении шизофрении и депрессии. Например, клозапин (эффективное клиническое антипсихотическое средство) имеет высокую аффинность к 5-ГТ6 подтипу рецептора. Также некоторые клинические антидепрессанты имеют высокую аффинность к рецептору и действуют как антагонисты на этом участке (Branchek, T.A.; Blackburn, T.P. Annual Reviews in Pharmacology and Toxicology 2000, 40, 319-334).
Далее, недавние in vivo исследования на крысах показали, что модуляторы 5-ГТ6 могут быть полезны при лечении расстройств движения, включая эпилепсию (Stean, T,; Routledge, C.; Upton, N. British Journal of Pharmacology, 1999, 127 Proc. Supplement 131P и Rouledge, C.; Bromidge, S.M.; Moss, S.F.; Price, G.W.; Hirst, W.; Newman, H.; Riley, G.; Gager, T.; Stean, T.; Upton, N.; Clarke, S.F.; Brown, A.M. British Journal of Pharmacology, 2000, 130(7), 1606-1612).
Взятые вместе, указанные исследования твердо подтверждают, что соединения, которые являются лигандами 5-ГТ6, могут применяться при терапевтических показаниях, включая: лечение заболеваний, связанных с дефицитом памяти, познавательной способности и способности к обучению, таких как болезнь Альцгеймера и расстройство дефицита внимания; лечение расстройств личности, таких как шизофрения; лечение расстройств поведения, например, тревоги, депрессии и обсессивно-компульсивных расстройств; лечение расстройств движения или моторики, таких как болезнь Паркинсона и эпилепсия; лечение заболеваний, связанных с нейродегенерацией, таких как удар и травма головы; или снятие зависимости от лекарственных средств, включая зависимость от никотина, алкоголя и других веществ, вызывающих привыкание.
Поэтому объектом данного изобретения являются соединения, которые полезны в качестве терапевтических агентов при лечении различных расстройств центральной нервной системы, связанных или находящихся под воздействием рецептора 5-ГТ6.
Другим объектом данного изобретения являются терапевтические способы и фармацевтические композиции, применяемые при лечении расстройств центральной нервной системы, связанных или находящихся под воздействием рецептора 5-ГТ6.
Характерной особенностью данного изобретения является то, что соединения в соответствии с данным изобретением также могут применяться для дальнейших исследований и оценки рецептора 5-ГТ6.
Эти и другие объекты и характеристики данного изобретения станут более понятными из подробного описания, представленного ниже.
Кратное описание изобретения
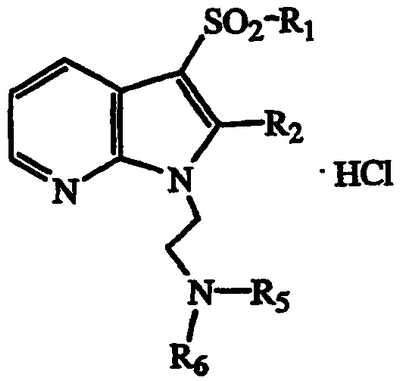
Данное изобретение относится к производному 1-(аминоалкил)-3-сульфонилазаиндола формулы I
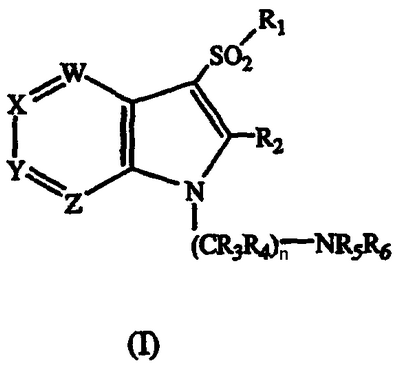
где
W является N или CR7;
Х является N или CR8;
Y является N или CR9;
Z является N или CR10 при условии, что, по крайней мере, один и не более двух из W, X, Y и Z должны быть N;
n является целым числом 2, 3, 4 или 5;
R1 является необязательно замещенным С1-С6-алкилом, С3-С7-циклоалкилом, арилом или гетероарилом, или необязательно замещенной 8-13-членной бициклической или трициклической системой колец, имеющей атом N в основании мостиковой связи и необязательно содержащей 1, 2 или 3 дополнительных гетероатома, выбранных из N, O или S;
R2 является Н, галогеном или С1-С6-алкилом, С1-С6-алкокси, С3-С7-циклоалкилом, арилом или гетероарилом, каждый из которых необязательно замещен;
R3 и R4, каждый независимо является Н или необязательно замещенным С1-С6-алкилом;
R5 и R6, каждый независимо является Н или С1-С6-алкилом, С2-С6-алкенилом, С2-С6-алкинилом, С3-С7-циклоалкилом, циклогетероалкилом, арилом или гетероарилом, каждый из которых необязательно замещен, или R5 и R6 вместе с атомом, к которому они присоединены, образуют необязательно замещенное 5-8-членное кольцо, необязательно содержащее дополнительный гетероатом, выбранный из О, NR11 или SOm;
R7, R8, R9 и R10 независимо являются Н, галогеном, CN, OCO2R12, CO2R13, CONR14R15, SOpR16, NR17R18, OR19, COR20 или С1-С6-алкилом, С2-С6-алкенилом, С2-С6-алкинилом, С3-С7-циклоалкилом, циклогетероалкилом, арилом или гетероарилом, каждый из которых необязательно замещен;
R11, R12, R13, R16, R19 и R20, каждый независимо является Н или С1-С6-алкилом, С2-С6-алкенилом, С2-С6-алкинилом, С3-С6-циклоалкилом, циклогетероалкилом, арилом или гетероарилом, каждый из которых необязательно замещен;
R14 и R15, каждый независимо является Н или необязательно замещенным С1-С6-алкилом, или R14 и R15 вместе с атомом, к которому они присоединены, могут образовывать 5-7-членное кольцо, необязательно содержащее другой гетероатом, выбранный из О, NR22 или S;
R17 и R18, каждый независимо является Н или необязательно замещенным С1-С4-алкилом, или R17 и R18 вместе с атомом, к которому они присоединены, могут образовывать 5-7-членное кольцо, необязательно содержащее другой гетероатом, выбранный из О, NR21 или SOx;
R21 и R22, каждый независимо является Н или С1-С6-алкилом, С2-С6-алкенилом, С3-С7-циклоалкилом, циклогетероалкилом, арилом или гетероарилом, каждый из которых необязательно замещен; и
m, p и х, каждый независимо равен 0 или целому числу 1 или 2; или
его стереоизомеру или его фармацевтически приемлемой соли.
Данное изобретение также представляет способы и композиции, применяемые для терапевтического лечения расстройств центральной нервной системы, связанных или находящихся под воздействием рецептора 5-ГТ6.
Подробное описание изобретения
Рецептор 5-гидрокситриптамин-6 (5-ГТ6) является одним из рецепторов, недавно идентифицированных молекулярным клонированием. Его способность связывать широкий спектр терапевтических соединений, применяемых в психиатрии, в сочетании с его интересным распределением в мозге, обуславливает значительный интерес к новым соединениям, которые способны взаимодействовать с или влиять на данный рецептор. Были предприняты значительные усилия для того, чтобы понять возможную роль рецептора 5-ГТ6 в психиатрии, дисфункции познавательной способности, моторных функциях и контроле, памяти, настроении и подобных. К настоящему времени соединения, которые демонстрируют аффинность связывания с рецептором 5-ГТ6, считаются полезными как в качестве вспомогательного средства для изучения рецептора 5-ГТ6, так и в качестве потенциальных терапевтических агентов при лечении расстройств центральной нервной системы, например, см. C. Reavill and D.C. Rogers, Current Opinion in Investigational Drugs, 2001, 2(1): 104-109, Pharma Press Ltd.
Неожиданно было обнаружено, что производные 1-(аминоалкил)-3-сульфонилазаиндола формулы I демонстрируют аффинность к 5-ГТ6. Преимущественно такие производные азаиндола могут применяться в качестве эффективных терапевтических агентов для лечения расстройств центральной нервной системы (ЦНС), связанных или находящихся под воздействием рецептора 5-ГТ6.
Следовательно, данное изобретение относится к производным 1-(аминоалкил)-3-сульфонилазаиндола формулы I

где
W является N или CR7;
Х является N или CR8;
Y является N или CR9;
Z является N или CR10 при условии, что, по крайней мере, один и не более двух из W, X, Y и Z должны быть N;
n является целым числом 2, 3, 4 или 5;
R1 является необязательно замещенным С1-С6-алкилом, С3-С7-циклоалкилом, арилом или гетероарилом, или необязательно замещенным 8-13-членной бициклической или трициклической системой колец, имеющей атом N в основании мостиковой связи и необязательно содержащей 1, 2 или 3 дополнительных гетероатома, выбранных из N, O или S;
R2 является Н, галогеном или С1-С6-алкилом, С1-С6-алкокси, С3-С7-циклоалкилом, арилом или гетероарилом, каждый из которых необязательно замещен;
R3 и R4, каждый независимо является Н или необязательно замещенным С1-С6-алкилом;
R5 и R6, каждый независимо является Н или С1-С6-алкилом, С2-С6-алкенилом, С2-С6-алкинилом, С3-С7-циклоалкилом, циклогетероалкилом, арилом или гетероарилом, каждый из которых необязательно замещен, или R5 и R6 вместе с атомом, к которому они присоединены, образуют необязательно замещенное 5-8-членное кольцо, необязательно содержащее дополнительный гетероатом, выбранный из О, NR11 или SOm;
R7, R8, R9 и R10 независимо являются Н, галогеном, CN, OCO2R12, CO2R13, CONR14R15, SOpR16, NR17R18, OR19, COR20 или С1-С6-алкилом, С2-С6-алкенилом, С2-С6-алкинилом, С3-С7-циклоалкилом, циклогетероалкилом, арилом или гетероарилом, каждый из которых необязательно замещен;
R11, R12, R13, R16, R19 и R20, каждый независимо является Н или С1-С6-алкилом, С2-С6-алкенилом, С2-С6-алкинилом, С3-С6-циклоалкилом, циклогетероалкилом, арилом или гетероарилом, каждый из которых необязательно замещен;
R14 и R15, каждый независимо является Н или необязательно замещенным С1-С6-алкилом, или R14 и R15 вместе с атомом, к которому они присоединены, могут образовывать 5-7-членное кольцо, необязательно содержащее другой гетероатом, выбранный из О, NR22 или S;
R17 и R18, каждый независимо является Н или необязательно замещенным С1-С4-алкилом, или R17 и R18 вместе с атомом, к которому они присоединены, могут образовывать 5-7-членное кольцо, необязательно содержащее другой гетероатом, выбранный из О, NR21 или SOx;
R21 и R22, каждый независимо является Н или С1-С6-алкилом, С2-С6-алкенилом, С3-С7-циклоалкилом, циклогетероалкилом, арилом или гетероарилом, каждый из которых необязательно замещен; и
m, p и х, каждый независимо равен 0 или целому числу 1 или 2; или
их стереоизомерам или их фармацевтически приемлемым солям.
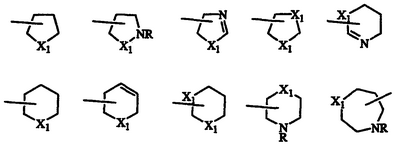
В данном описании и формуле изобретения термин галоген означает F, Cl, Br или I, и термин циклогетероалкил означает 5-7-членную систему колец, содержащую 1 или 2 гетероатома, которые могут быть одинаковыми или разными, выбранных из азота, кислорода и серы, и необязательно содержит одну двойную связь. Примеры циклогетероалкильной системы колец, входящей в представленный здесь термин, включают такие кольца, в которых Х1 является NR, О или S; и R является Н или необязательным заместителем, таким как описано ниже:
Применяемый в описании и в формуле изобретения термин гетероарил означает 5-10-членную ароматическую систему колец, содержащую 1, 2 или 3 гетероатома, которые могут быть одинаковыми или разными, выбранных из N, O или S. Такие гетероарильные системы колец включают пирролил, азолил, оксазолил, тиазолил, имидазолил, фурил, тиенил, хинолинил, изохинолинил, индолинил, бензотиенил, бензофуранил, бензизоксазолил или подобные. Термин арил означает карбоциклическую ароматическую систему колец, например, имеющую 6-14 атомов углерода, такую как фенил, нафтил, антраценил и подобные. Термин галогеналкил в данном описании означает группу CnH2n+1, имеющую от одного до 2n+1 атомов галогена, которые могут быть одинаковыми или разными, и термин галогеналкокси в данном описании означает группу OCnH2n+1, имеющую от одного до 2n+1 атомов галогена, которые могут быть одинаковыми или разными.
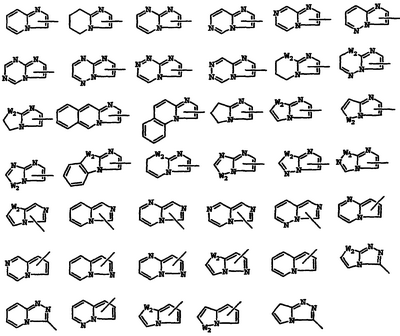
Примеры 8-13-членных бициклических или трициклических систем колец, имеющих атом N в основании мостиковой связи и необязательно содержащих 1, 2 или 3 дополнительных гетероатома, выбранных из N, O или S, охваченные применяемым в данном описании термином, включают представленные ниже кольцевые системы, в которых W2 является NR, O или S; и R является Н или необязательным заместителем, таким как показано ниже:
В описании и формуле изобретения, где термины, такие как С1-С6-алкил, С2-С6-алкенил, С2-С6-алкинил, С3-С6-циклоалкил, циклогетероалкил, арил или гетероарил, указаны как необязательно замещенные, группы заместителей, которые необязательно присутствуют, могут быть в количестве одной или более, например, 2 или 3, и представляют собой группы, обычно применяемые в фармацевтических соединениях или модификациях таких соединений для того, чтобы повлиять на их структуру/активность, стойкость, абсорбцию, стабильность или другие полезные свойства. Определенные примеры таких заместителей включают атомы галогена, нитро, циано, гидроксил, алкил, галогеналкил, алкокси, галогеналкокси, амино, алкиламино, диалкиламино, формил, алкоксикарбонил, карбоксил, алканоил, алкилтио, алкилсульфинил, алкилсульфонил, карбамоил, алкиламидо, фенил, фенокси, бензил, бензилокси, гетероциклил (такой как гетероарил или циклогетероалкил) или циклоалкил, предпочтительно, атомы галогена или низшие алкильные группы. Обычно присутствует от 0 до 3 заместителей. Если любой из указанных выше заместителей представляет или содержит алкильный заместитель в виде группы или части группы, он может быть линейным или разветвленным и может содержать вплоть до 12, предпочтительно вплоть до 6, более предпочтительно вплоть до 4 атомов углерода.
Фармацевтически приемлемой солью может быть любая кислотно-аддитивная соль, образованная из соединения формулы I и фармацевтически приемлемой кислоты, такой как фосфорная, серная, хлористоводородная, бромистоводородная, лимонная, малеиновая, малоновая, миндальная, янтарная, фумаровая, уксусная, молочная, азотная, сульфоновая, п-толуолсульфоновая, метансульфоновая кислота или подобные.
Соединения в соответствии с данным изобретением включают сложные эфиры, карбаматы или другие обычные формы пролекарств, которые, в общем, являются функциональными производными соединений в соответствии с данным изобретением и которые легко превращаются в активную группу настоящего изобретения in vivo. Соответственно, способ в соответствии с данным изобретением включает лечение различных состояний, описанных выше, соединением формулы I или соединением, которое не описано конкретно, но которое, при введении, превращается в соединение формулы I in vivo. Также в объем включены метаболиты соединений в соответствии с данным изобретением, определенные как активные соединения, полученные при введении указанных соединений в биологическую систему.
Соединения в соответствии с данным изобретением могут существовать в виде одного или более стереоизомеров. Различные стереоизомеры включают энантиомеры, диастереомеры, атропизомеры и геометрические изомеры. Специалисту в данной области будет понятно, что один стереоизомер может быть более активным или может обладать благоприятным действием, будучи обогащенным по отношению к другому(им) стереоизомеру(ам) или при отделении от другого(их) стереоизомера(ов). Кроме того, специалисту в данной области известно, как отделять, обогащать или селективно получать указанные стереоизомеры. Следовательно, данное изобретение включает соединения формулы I, их стереоизомеры и их фармацевтически приемлемые соли. Соединения в соответствии с данным изобретением могут быть в виде смеси стереоизомеров, отдельных стереоизомеров или в виде оптически активной или энантиомерно чистой формы.
Предпочтительными соединениями в соответствии с данным изобретением являются соединения формулы I, в которых W или Z являются N. Также предпочтительными являются соединения формулы I, в которых n равно 2. Другая группа предпочтительных соединений формулы I включает соединения, в которых R1 является необязательно замещенным фенилом, нафтилом или имидазотиазолилом.
Более предпочтительными соединениями в соответствии с данным изобретением являются соединения формулы I, в которых W является CR7; Х является CR8; Y является CR9; и Z является N. Другая группа более предпочтительных соединений включает соединения формулы I, в которых W является N; Х является CR8; Y является CR9; и Z является CR10. Более предпочтительные соединения формулы I также включают соединения, в которых n равно 2 и R3 и R4 являются Н. Также более предпочтительными соединениями являются те соединения формулы I, в которых W или Z являются N; n равно 2; R1 является необязательно замещенным фенилом, нафтилом или имидазотиазолилом; R2, R3 и R4 являются Н; и R5 и R6, каждый независимо являются Н или С1-С3-алкилом.
Примеры предпочтительных соединений в соответствии с данным изобретением включают:
2-[3-(фенилсульфонил)-1Н-пирроло[2,3-b]пиридин-1-ил]этиламин;
2-[3-(фенилсульфонил)-1Н-пирроло[2,3-с]пиридин-1-ил]этиламин;
2-[3-(фенилсульфонил)-1Н-пирроло[3,2-с]пиридин-1-ил]этиламин;
2-{3-[(4-фторфенил)сульфонил]-1Н-пирроло[3,2-b]пиридин-1-ил}этиламин;
2-{3-[(4-метилфенил)сульфонил]-1Н-пирроло[2,3-b]пиридин-1-ил}этиламин;
2-[3-(нафт-1-ил)сульфонил)-1Н-пирроло[2,3-b]пиридин-1-ил]этиламин;
2-{3-[(6-хлоримидазо[2,1-b][1,3]тиазол-5-ил)сульфонил]-1Н-пирроло[2,3-b]пиридин-1-ил}этиламин;
2-{3-[(3-хлорфенил)сульфонил]-1Н-пирроло[2,3-b]пиридин-1-ил}этиламин;
2-{3-[(2-хлорфенил)сульфонил]-1Н-пирроло[2,3-с]пиридин-1-ил}этиламин;
2-{3-[(3-метоксифенил)сульфонил]-1Н-пирроло[3,2-с]пиридин-1-ил}этиламин;
2-{3-[(4-фторфенил)сульфонил]-1Н-пирроло[3,2-b]пиридин-1-ил}этиламин;
N,N-диметил-N-(2-{3-[(3-фторфенил)сульфонил]-1Н-пирроло[2,3-b]пиридин-1-ил}этил)амин;
N,N-диметил-N-{2-[3-(нафт-1-илсульфонил)-1Н-пирроло[2,3-b]пиридин-1-ил]этил}амин;
N,N-диметил-N-(2-{3-[(6-хлоримидазо[1,2-b][1,3]тиазол-5-ил)сульфонил]-1Н-пирроло[2,3-b]пиридин-1-ил}этил)амин;
N,N-диметил-N-(2-{3-[(3-хлорфенил)сульфонил]-1Н-пирроло[2,3-b]пиридин-1-ил}этил)амин;
3-[3-(фенилсульфонил)-1Н-пирроло[2,3-b]пиридин-1-ил]пропан-1-амин;
3-[3-(фенилсульфонил)-1Н-пирроло[2,3-с]пиридин-1-ил]пропан-1-амин;
3-[3-(фенилсульфонил)-1Н-пирроло[3,2-с]пиридин-1-ил]пропан-1-амин;
3-{3-[(4-фторфенил)сульфонил]-1Н-пирроло[3,2-b]пиридин-1-ил}пропан-1-амин;
2-{6-хлор-3-[(3-хлорфенил)сульфонил]-1Н-пирроло[2,3-b]пиридин-1-ил}этиламин;
2-{7-хлор-3-[(2-хлорфенил)сульфонил]-1Н-пирроло[2,3-с]пиридин-1-ил}этиламин;
4-{3-[(3-метоксифенил)сульфонил]-1Н-пирроло[3,2-с]пиридин-1-ил}бутан-1-амин;
4-{3-[(4-фторфенил)сульфонил]-1Н-пирроло[3,2-b]пиридин-1-ил}бутан-1-амин;
N,N-диметил-N-{2-[3-(фенилсульфонил)-1Н-пирроло[2,3-с]пиридин-1-ил]этил}амин;
N,N-диметил-N-{2-[3-(фенилсульфонил)-1Н-пирроло[3,2-с]пиридин-1-ил]этил}амин;
N,N-диметил-N-{2-[3-(тиан-2-ил)-1Н-пирроло[2,3-b]пиридин-1-ил]этил}амин;
N,N-диметил-N-{2-[3-(нафт-1-ил)-1Н-пирроло[2,3-b]пиридин-1-ил]этил}амин;
N,N-диметил-N-(2-{3-[(4-фторфенил)сульфонил]-1Н-пирроло[3,2-b]пиридин-1-ил}этил)амин;
N-метил-N-(2-{3-[(3-хлорфенил)сульфонил]-1Н-пирроло[2,3-b]пиридин-1-ил}этил)амин;
N-метил-N-(2-{3-[(3-фторфенил)сульфонил]-1Н-пирроло[2,3-b]пиридин-1-ил}этил)амин;
N-метил-N-{2-[3-(нафт-1-илсульфонил)-1Н-пирроло[2,3-b]пиридин-1-ил]этил}амин;
N-метил-N-(2-{3-[(6-хлоримидазо[1,2-b][1,3]тиазол-5-ил)сульфонил]-1Н-пирроло[2,3-b]пиридин-1-ил}этил)амин;
N-метил-N-(2-{3-[(2-хлорфенил)сульфонил]-1Н-пирроло[3,2-с]пиридин-1-ил}этил)амин;
N-метил-N-(2-{3-[(3-метоксифенил)сульфонил]-1Н-пирроло[2,3-с]пиридин-1-ил}этил)амин;
N-бензил-N-(2-{3-[(4-фторфенил)сульфонил]-1Н-пирроло[3,2-b]пиридин-1-ил}этил)амин;
N,N-дибензил-3-[3-(фенилсульфонил)-1Н-пирроло[2,3-b]пиридин-1-ил]пропан-1-амин;
3-[3-(фенилсульфонил)-1Н-пирроло[2,3-с]пиридин-1-ил]пропан-1-амин;
3-[3-(фенилсульфонил)-1Н-пирроло[3,2-с]пиридин-1-ил]пропан-1-амин;
их стереоизомеры и фармацевтически приемлемые соли.
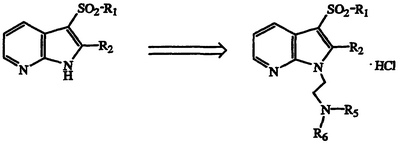
Данное изобретение также представляет способы получения соединений формулы I, таких как определены выше, или их стереоизомеров или их фармацевтически приемлемых солей, где способы включают один из следующих:
а) взаимодействие соединения формулы II
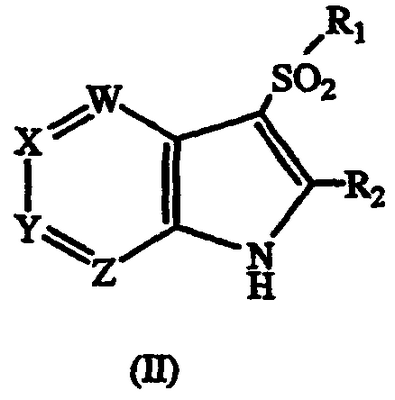
где W, X, Y, Z, R1 и R2 такие, как описаны выше, с галогеналкиламином формулы III
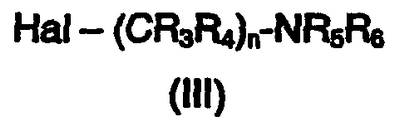
где Hal является Cl, Br или I и R3, R4, R5, R6 и n такие, как описано выше, в присутствии основания с получением соединения формулы I;
или
b) взаимодействие соединения формулы (V)
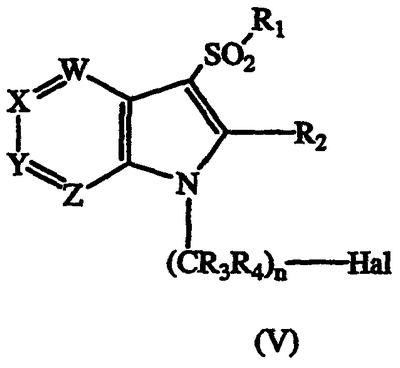
где W, X, Y, Z, R1, R3, R4 и n такие, как описаны выше, и Hal является галогеном, с соединением формулы
HNR5R6,
где R5 и R6 такие, как описано выше, с получением соединения формулы I;
или
с) сульфонилирование соединения формулы XVI:
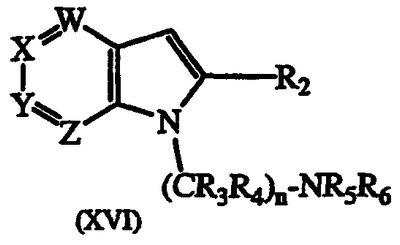
где W, X, Y, Z, R3, R4, R5, R6 и n такие, как описаны выше, с соединением формулы:
ClSO2R1,
где R1 такой, как определено выше, с получением соединения формулы I;
или
d) восстановление соединения формулы ХХ:
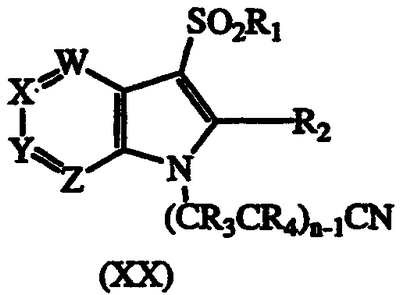
где W, X, Y, Z, R1, R3, R4 и n такие, как описаны выше, с получением соответствующего соединения формулы I, в котором R5 и R6, оба являются водородом;
или
е) взаимодействие соединения формулы
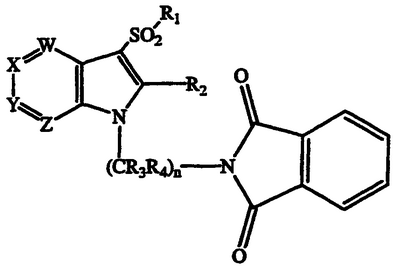
где W, X, Y, Z, R1, R2, R3, R4, n и m такие, как описаны выше, с гидразином с получением соответствующего соединения формулы I, в котором R5 и R6, оба являются водородом;
или
f) превращение основного соединения формулы I в фармацевтически приемлемую соль или наоборот.
Соединения в соответствии с данным изобретением обычно получают способами, иллюстрированными на представленных ниже схемах, в которых Hal является Cl, Br или I.
Схема I
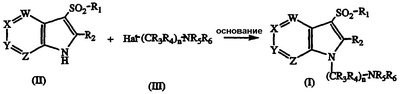
Основания, подходящие для применения в способе в соответствии с данным изобретением, включают сильные основания, такие как NaH, KOt-Bu, NaOH или любые подходящие основания, способные удалять протон от основного атома азота азаиндола.
Растворители, подходящие для применения в способе в соответствии с данным изобретением, включают полярные растворители, такие как диметилформамид, диметилсульфоксид, ацетонтирил, тетрагидрофуран или подобные. Если применяют два несмешиваемых растворителя, может присутствовать межфазный катализатор. Предпочтительно, для получения соединений формулы I, в которых R5 и R6 являются Н, соединение формулы II может быть подвергнуто взаимодействию с основанием, как описано выше, в присутствии межфазного катализатора, такого как гидросульфат тетрабутиламмония, с получением желаемого соединения формулы I, в котором R5 и R6 являются Н.
Альтернативно, соединения формулы I, в которых R5 и R6 являются Н (Ia), могут быть получены взаимодействием соединения формулы II с соединением дигалогеналкила формулы IV с получением 1-(галогеналкил)азаиндола формулы V; взаимодействием азаиндола формулы V с фталимидом калия с получением промежуточного соединения формулы VI, и взаимодействием указанного промежуточного соединения с гидразином с получением желаемого соединения формулы Ia. Последовательность реакции показана на схеме II, где Hal является Cl, Br или I.
Схема II
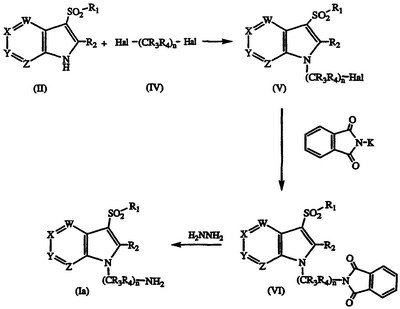
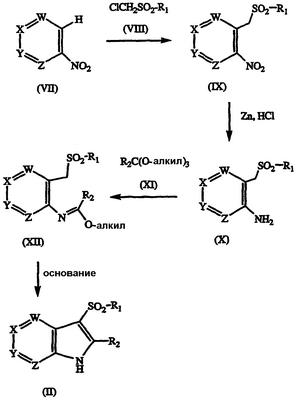
Соединения формулы V также могут быть подвергнуты непосредственно взаимодействию с амином, HNR5R6, с получением соединения формулы I. Соединения формулы II могут быть получены с применением обычных методов синтеза и, если необходимо, стандартного разделения и выделения. Например, соединение нитропиридина формулы VII может быть подвергнуто взаимодействию с соединением хлорметилсульфонила формулы VIII в присутствии сильного основания с получением промежуточного соединения формулы IX; указанное промежуточное соединение формулы IX затем может быть обработано восстанавливающим агентом, таким как Fe, Zn или Sn в присутствии кислоты с получением амина формулы Х; затем указанный амин может быть ацилирован соответствующим сложным ортоэфиром формулы XI с получением соединения формулы XII; и указанное соединение может быть циклизировано в присутствии основания с получением желаемого 3-сульфонилазаиндола формулы II. Общий метод синтеза описан у W. Wojciechowski and M. Makosza, Synthesis, 1986, 651-653. Последовательность реакции показана на схеме III.
Схема III
Соединения формулы II также могут быть получены непосредственно из соединения азаиндола, например, азаиндол формулы XIII может быть подвергнут взаимодействию с йодом, необязательно в присутствии KI, с получением соответствующего 3-йодазаиндола формулы XIV, и указанный 3-йодазаиндол может быть сочетан с соответствующим тиолом формулы XV с получением 3-тиоазаиндола формулы XVI. Указанное соединение формулы XVI затем может быть окислено с применением обычных окисляющих реагентов, таких как Н2О2, м-хлорпербензойная кислота или подобные с получением промежуточного соединения формулы II. Реакция показана на схеме IV.
Схема IV
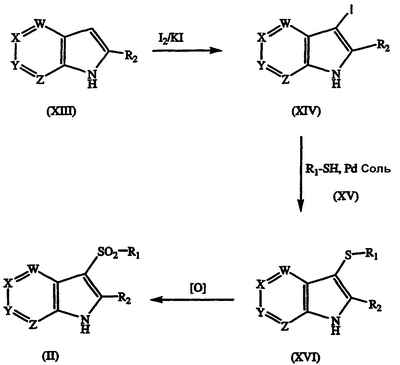
Альтернативно, промежуточное соединение 3-тиоазаиндола формулы XVI может быть получено в одну стадию из азаиндола формулы XIII взаимодействием указанного соединения формулы XIII с тиолом формулы XV в присутствии йода, предпочтительно в полярном растворителе, таком как водный спирт. Полученные таким образом соединения формулы II затем могут быть превращены в желательные соединения формулы I алкилированием атома азота основного азаиндола, как показано на схемах I и II выше.
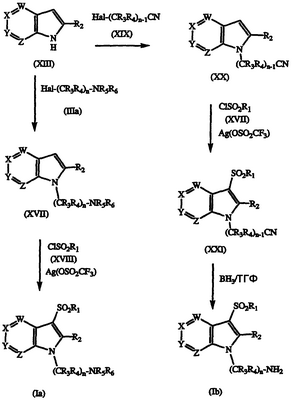
Соединения формулы XIII также могут быть превращены в желаемые соединения формулы I, в которых R5 и R6 отличны от Н (Ia), взаимодействием азаиндола формулы XIII с амином формулы IIIa, в котором R5 и R6 отличны от Н, с получением N-алкилированного соединения формулы XVII; взаимодействием соединения формулы XVII с сульфонилхлоридом формулы XVIII, необязательно в присутствии реагента, такого как Ag(OSO2CF3) или Bi(OSO2CF3)3, с получением желаемого соединения формулы Ia. Также соединения формулы I, в которых R5 и R6 являются Н (Ib), могут быть получены непосредственно из промежуточного соединения формулы XIII взаимодействием указанного промежуточного соединения формулы XIII с нитрилом формулы XIX с получением соответствующего алкилированного соединения формулы ХХ; сульфонированием указанного соединения формулы ХХ с получением соединения формулы XXI и восстановлением соединения формулы XXI с применением обычных восстанавливающих агентов, таких как боран, в тетрагидрофуране (ТГФ) с получением желаемых соединений формулы Ib. Реакции показаны на схеме V, где Hal является Cl, Br или I.
Схема V
Преимущественно, соединения формулы I в соответствии с данным изобретением применяют для лечения расстройств ЦНС, связанных или находящихся под воздействием рецептора 5-ГТ6, включая расстройства моторики, настроения, личности, поведения, психиатрические, когнитивные, нейродегенеративные или подобные, например, болезнь Альцгеймера, болезнь Паркинсона, расстройство дефицита внимания, тревогу, эпилепсию, депрессию, обсессивно-компульсивное расстройство, нарушения сна, нейродегенеративные расстройства (такие как травма или удар), расстройства питания (такие как анорексия или булимия), шизофрению, потерю памяти, расстройства, связанные с отменой лекарственных средств или никотиновой зависимости, или подобных, или некоторых желудочно-кишечных расстройств, таких как синдром раздраженного кишечника. Следовательно, данное изобретение представляет способ лечения расстройства центральной нервной системы, связанного или находящегося под воздействием рецептора 5-ГТ6 у пациента, нуждающегося в таком лечении, который включает введение указанному пациенту терапевтически эффективного количества соединения формулы I, такого как описано выше. Соединения могут вводиться пероральным или парентеральным путем или любым обычным путем, который обеспечивает эффективное введение терапевтического агента пациенту, нуждающемуся в этом.
Термин «введение» в данном контексте, в смысле введения соединения или вещества в соответствии с данным изобретением, означает либо введение непосредственно такого соединения или вещества, или введения пролекарства, производного или аналога, который дает эквивалентное количество соединения или вещества в организме.
Терапевтически эффективное количество, применяемое для лечения определенного расстройства ЦНС, может варьироваться в зависимости от определенных условий лечимого состояния, размера, возраста и реакции пациента, тяжести расстройства, показаний лечащего терапевта и подобных. В общем, эффективные количества для ежедневного перорального введения составляют от около 0,01 до 1000 мг/кг, предпочтительно от около 0,5 до 500 мг/кг, и эффективное количество для парентерального введения составляет от около 0,1 до 100 мг/кг, предпочтительно от 0,5 до 50 мг/кг.
На практике, соединения в соответствии с данным изобретением дают путем введения соединения или его предшественника в твердой или жидкой форме, либо в чистом виде, либо в комбинации с одним или более обычными фармацевтическими носителями или наполнителями. Следовательно, данное изобретение представляет фармацевтическую композицию, которая содержит фармацевтически приемлемый носитель и эффективное количество соединения формулы I, такого как описано выше.
Твердые носители, подходящие для применения в композициях в соответствии с данным изобретением, включают одно или более веществ, которые также могут действовать как вкусовые агенты, лубриканты, солюбилизаторы, суспендирующие агенты, наполнители, глиданты, вспомогательные для прессования агенты, связующие агенты, агенты для дезинтеграции таблеток или инкапсулирующие материалы. В порошках носитель может представлять собой тонкоизмельченное твердое вещество в смеси с тонкоизмельченным соединением формулы I. В таблетках соединение формулы I может быть смешано с носителем, имеющим необходимые свойства для прессования, в подходящих пропорциях и иметь желаемую форму и размер. Указанные порошки и таблетки могут содержать вплоть до 99 мас.% соединения формулы I. Твердые носители, подходящие для применения в композициях в соответствии с данным изобретением, включают фосфат кальция, стеарат магния, тальк, сахара, лактозу, декстрин, крахмал, желатин, целлюлозу, метилцеллюлозу, натрийкарбоксиметилцеллюлозу, поливинилпирролидон, воски с низкой температурой плавления и ионообменные смолы.
В композициях в соответствии с данным изобретением могут применяться любые фармацевтически приемлемые жидкие носители, подходящие для получения растворов, суспензий, эмульсий, сиропов и эликсиров. Соединения формулы I могут быть растворены или суспендированы в фармацевтически приемлемом жидком носителе, таком как вода, органический растворитель или фармацевтически приемлемое масло или жир, или их смеси. Указанные жидкие композиции могут содержать другие фармацевтически приемлемые добавки, такие как солюбилизаторы, эмульгаторы, буферы, консерванты, подсластители, вкусовые агенты, суспендирующие агенты, загустители, красители, регуляторы вязкости, стабилизаторы, осмотические регуляторы или подобные. Примеры жидких носителей, подходящих для перорального и парентерального введения, включают воду (особенно содержащую добавки, такие как указаны выше, например, производные целлюлозы, предпочтительно, раствор натрийкарбоксиметилцеллюлозы), спирты (включая одноатомные спирты и многоатомные спирты, например, гликоли) или их производные, или масла (например, фракционированное кокосовое масло и арахисовое масло). Для парентерального введения носитель также может быть сложным эфиром жирных кислот, таким как этилолеат или изопропилмиристат.
Композиции в соответствии с данным изобретением, которые представляют собой стерильные растворы или суспензии, применяют для внутримышечного, внутрибрюшинного или подкожного ведения. Стерильные растворы также могут вводиться внутривенно. Композиции в соответствии с данным изобретением, подходящие для перорального применения, могут быть как в жидкой, так и в твердой форме.
Для более ясного понимания и для иллюстрации данного изобретения ниже представлены конкретные примеры. Представленные ниже примеры являются только иллюстративными и не должны пониматься как ограничивающие объем и основополагающие принципы данного изобретения никоим образом.
Термин Н-ЯМР означает протонный ядерный магнитный резонанс. Термины CH2Cl2 и ДМФ означают метиленхлорид и диметилформамид, соответственно. Хроматографию проводят с применением SiO2 в качестве подложки.
Пример 1
Получение 3-(фенилтио)-1Н-пирроло[2,3-b]пиридина
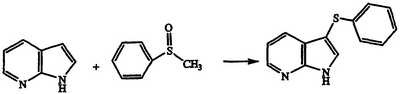
Раствор метилфенилсульфоксида (8,33 г, 59,4 ммоль) в CH2Cl2 охлаждают до температуры -78°С и по каплям обрабатывают трифторуксусным ангидридом (4,1 мл, 5,3 ммоль). После перемешивания в течение 30 минут при температуре -78°С добавляют раствор 7-азаиндола (5,2 г, 44,0 ммоль) в CH2Cl2. Через 30 минут при температуре -78°С добавляют триэтиламин (74 мл, 534 ммоль), и реакционную смесь нагревают до температуры окружающей среды. После перемешивания в течение 3,5 дней реакционную смесь концентрируют в вакууме, обрабатывают насыщенным водным NaHCO3 и экстрагируют CH2Cl2. Органические экстракты объединяют и концентрируют в вакууме. Полученный остаток кристаллизуют из метанола/Н2О и перекристаллизовывают из CH2Cl2/гексана с получением указанного в заголовке соединения в виде беловатого твердого вещества, 1,26 г, т.пл. 188-189°С, охарактеризованного масс-спектральным анализом и анализом Н-ЯМР.
Пример 2
Получение 3-(фенилсульфонил)-1Н-пирроло[2,3-b]пиридина
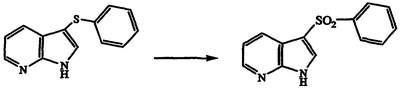
Раствор 3-(фенилтио)-1Н-пирроло[2,3-b]пиридина (100 мг, 0,44 ммоль) в трет-бутиловом спирте обрабатывают MnSO4·H2O (4 мг, 0,020 ммоль) и охлаждают до температуры 0°С. Смесь 30% водной перекиси водорода (500 мг, 4,41 ммоль) и 0,2 н. водного NaHCO3 (7,5 мл) добавляют по каплям. Реакционную смесь перемешивают в течение 23 часов при температуре 20°С, разбавляют насыщенным водным NaHCO3 и экстрагируют этилацетатом. Объединенные экстракты сушат над MgSO4 и концентрируют в вакууме. Хроматография (1:50 метанол/CH2Cl2) полученного остатка дает твердый продукт, который перекристаллизовывают из CH2Cl2/гексана с получением указанного в заголовке соединения в виде розовато-белого твердого вещества, 50 мг, т.пл. >250°С, охарактеризованного масс-спектральным анализом и анализом Н-ЯМР.
Пример 3
Получение 1-(2-хлорэтил)-3-(фенилсульфонил)-1Н-пирроло[2,3-b]пиридина
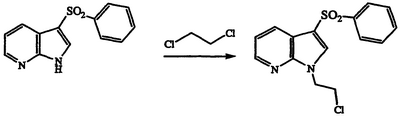
Раствор 3-(фенилсульфонил)-1Н-пирроло[2,3-b]пиридина (4,30 г, 16,6 ммоль) в 1,2-дихлорэтане (33 мл, 420 ммоль) обрабатывают Aliquat® (хлорид трикаприлметиламмония, производится в Aldrich, Milwaukee, WI) (6,9 г) и 50% водным NaOH (1,6 г, 20 ммоль). Реакционную смесь перемешивают в течение 6 часов при температуре 45°С. Охлажденный раствор разбавляют Н2О (200 мл) и экстрагируют CH2Cl2 (3×250 мл). Объединенные экстракты CH2Cl2 сушат над MgSO4 и концентрируют в вакууме до коричневой смолы. Эту смолу подвергают хроматографии (1:4 этилацетат/гексан) и затем кристаллизуют из этилацетата/гексана с получением указанного в заголовке соединения в виде белого твердого вещества, 3,84 г, т.пл. 117-119°С, охарактеризованного масс-спектральным анализом и анализом Н-ЯМР.
Пример 4
Получение 2-{2-[3-(фенилсульфонил)-1Н-пирроло[2,3-b]пиридин-1-ил]этил}-1Н-изоиндол-1,3(2Н)-диона
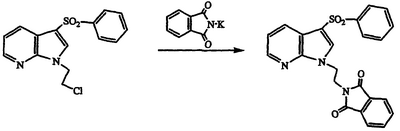
Раствор 1-(2-хлорэтил)-3-(фенилсульфонил)-1Н-пирроло[2,3-b]пиридина (3,84 г, 12,0 ммоль) в ДМФ обрабатывают фталатом калия (2,78 г, 15,0 ммоль), нагревают при температуре 115°С в течение 16 часов, охлаждают до комнатной температуры, разбавляют водой и экстрагируют этилацетатом. Объединенные экстракты промывают насыщенным раствором соли, сушат над MgSO4 и концентрируют в вакууме. Полученный остаток кристаллизуют из CH2Cl2/гексана с получением указанного в заголовке соединения в виде белого твердого вещества, 4,54 г, охарактеризованного анализом Н-ЯМР.
Пример 5
Получение дигидрохлорида 2-[3-(фенилсульфонил)-1Н-пирроло[2,3-b]пиридин-1-ил]этиламина
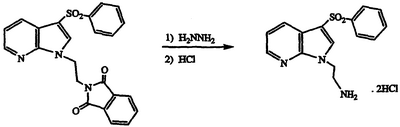
Раствор 2-{2-[3-(фенилсульфонил)-1Н-пирроло[2,3-b]пиридин-1-ил]этил}-1Н-изоиндол-1,3(2Н)-диона (4,54 г, 10,5 ммоль) в диоксане обрабатывают безводным гидразином (8,3 мл, 265 ммоль), нагревают при температуре 50°С в течение 3 часов, концентрируют в вакууме, разбавляют водой и экстрагируют CH2Cl2. Объединенные экстракты сушат над MgSO4 и концентрируют в вакууме с получением прозрачного смолистого остатка. Хроматография (1:9 метанол/CH2Cl2) остатка дает свободный амин указанного в заголовке соединения в виде прозрачной смолы. Свободный амин растворяют в этаноле, подкисляют 2 н. водной HCl и концентрируют в вакууме. Кристаллизация полученного остатка из этанола/простого эфира дает указанное в заголовке соединение в виде белого твердого вещества, 3,20 г, т.пл. 195-197°С, охарактеризованного масс-спектральным анализом и анализом Н-ЯМР.
Пример 6
Получение гидрохлорида N,N-диметил-N-{2-[3-(фенилсульфонил)-1Н-пирроло[2,3-b]пиридин-1-ил]этил}амина
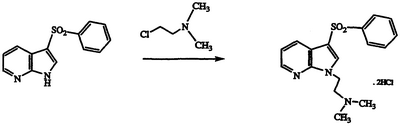
Раствор 3-(фенилсульфонил)-1Н-пирроло[2,3-b]пиридина (400 мг, 1,55 ммоль) в сухом ДМФ охлаждают до температуры 0°С, обрабатывают гидридом натрия (60% в масле, 97 мг, 2,43 ммоль), перемешивают в течение 3 часов при температуре 20°С, охлаждают до температуры -20°С, обрабатывают гидрохлоридом 2-(диметиламино)этилхлоридf (336 мг, 2,33 ммоль), перемешивают при температуре 60°С в течение 16 часов, охлаждают до комнатной температуры, гасят водой и экстрагируют этилацетатом. Органические экстракты объединяют, промывают насыщенным раствором соли, сушат над MgSO4 и концентрируют в вакууме с получением свободного амина указанного в заголовке соединения в виде желтоватой смолы. Смолу растворяют в этаноле, обрабатывают 1 н. водной HCl и концентрируют в вакууме. Кристаллизация полученного остатка из этанола/простого эфира дает указанное в заголовке соединение в виде светлого рыжевато-коричневого твердого вещества, 111 мг, т.пл. 214-217°С, охарактеризованного масс-спектральным анализом и анализом Н-ЯМР.
Пример 7
Получение дигидрохлорида 2-{3-[(4-метилфенил)сульфонил]-1Н-пирроло[2,3-b]пиридин-1-ил}этиламина
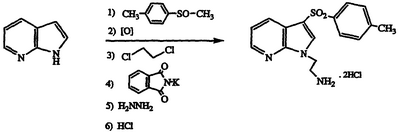
По методике примеров 1-6 и применяя 7-азаиндол и метил п-толилсульфоксид в качестве исходных материалов, получают указанное в заголовке соединение в виде белого твердого вещества, т.пл. 215-217°С, охарактеризованного масс-спектральным анализом и анализом Н-ЯМР.
Пример 8
Получение 3-йод-1Н-пирроло[2,3-b]пиридина
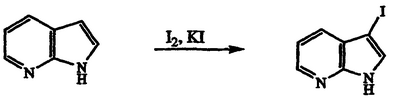
Раствор 7-азаиндола (20,0 г, 169 ммоль) в этаноле обрабатывают йодом (57,9 г, 228 ммоль), йодидом калия (37,8 г, 228 ммоль) и 1 н. водным NaOH (204 мл, 204 ммоль). После перемешивания в течение 4 часов при температуре 20°С реакционную смесь разбавляют водой и экстрагируют этилацетатом. Органические экстракты объединяют и концентрируют в вакууме. Полученный остаток кристаллизуют из метанола/воды с получением указанного в заголовке соединения в виде розовато-белого твердого вещества, 35,4 г, т.пл. 201-204°С, охарактеризованного масс-спектральным анализом и анализом Н-ЯМР.
Пример 9
Получение 3-[(4-фторфенил)тио]-1Н-пирроло[2,3-b]пиридина
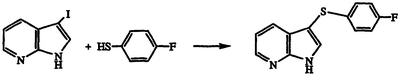
Раствор 3-йод-1Н-пирроло[2,3-b]пиридина (4,0 г, 16,4 ммоль) в ДМФ обрабатывают 4-фторбензолтиолом (2,09 мл, 19,7 ммоль), карбонатом калия (3,40 г, 24,6 ммоль) и йодидом меди (4,21 г, 22,1 ммоль). Реакционную смесь нагревают при температуре 65°С в течение 4 часов, охлаждают, разбавляют конц. водным NH4OH и экстрагируют этилацетатом. Экстракты объединяют, промывают насыщенным раствором соли, сушат над MgSO4 и концентрируют в вакууме. Хроматография (1:50 метанол/CH2Cl2) остатка с последующей кристаллизацией из метанола/Н2О дает указанное в заголовке соединение в виде беловатого твердого вещества, 3,56 г, т.пл. 183-184°С, охарактеризованного масс-спектральным анализом и анализом Н-ЯМР.
Пример 10
Получение 3-[(4-фторфенил)сульфонил]-1Н-пирроло[2,3-b]пиридина
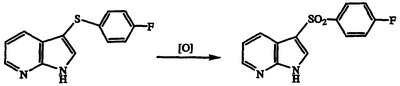
Раствор 3-[(4-фторфенил)тио]-1Н-пирроло[2,3-b]пиридина (3,36 г, 13,8 ммоль) в ацетоне обрабатывают раствором NaHCO3 (2,90 г, 35,4 ммоль) в воде. Реакционную смесь обрабатывают Oxone® (2KHSO5×KHSO4×K2SO4, производства DuPont, Wilmington, DE.) (25,5 г, 41,4 ммоль), перемешивают в течение 3 часов при температуре 20°С, разбавляют водой, охлаждают на бане лед-вода и фильтруют. Фильтровальную лепешку промывают водой и сушат в вакууме с получением указанного в заголовке соединения в виде белого твердого вещества, 1,73 г, т.пл. 212-213°С, охарактеризованного масс-спектральным анализом и анализом Н-ЯМР.
Пример 11
Получение гидрохлорида 2-{3-[(4-фторфенил)сульфонил]-1Н-пирроло[3,2-b]пиридин-1-ил}этиламина
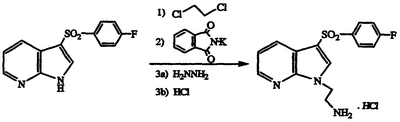
По методике примеров 3-5, применяя 3-[(4-фторфенил)сульфонил]-1Н-пирроло[2,3-b]пиридин в качестве субстрата, получают указанное в заголовке соединение в виде белого твердого вещества, т.пл. 193-197°С, охарактеризованного масс-спектральным анализом и анализом Н-ЯМР.
Пример 12
Получение дигидрохлорида 2-{3-[(3-хлорфенил)сульфонил]-1Н-пирроло[2,3-b]пиридин-1-ил}этиламина
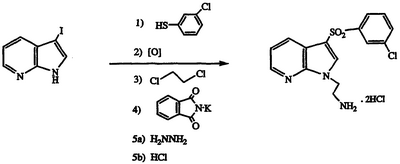
По указанным выше методикам и с применением 3-йод-1Н-пирроло[2,3-b]пиридина и 3-хлорбензолтиола в качестве исходных материалов получают указанное в заголовке соединение в виде белого твердого вещества, т.пл. 203-206°С, охарактеризованного масс-спектральным анализом и анализом Н-ЯМР.
Примеры 13-30
Получение гидрохлорида N,N-диметил-N-(2-{3-[(замещенный фенил)сульфонил]-1Н-пирроло[2,3-b]пиридин-1-ил}этил)амина
По методикам, указанным в примерах 4, 5 или 6, или применяя метод, описаны в J. Alvarez-Builla, et al., Synthetic Communications, (1991) 21(4) 535-544, и применяя соответствующий 3-(замещенный сульфонил)-1Н-пирроло[2,3-b]пиридин и желаемый галогеналкиламин, получают продукты, показанные в таблице 1, и идентифицируют их масс-спектральным анализом и анализом Н-ЯМР.
| Таблица I |
 |
| Пример № |
R1 |
R2 |
R5 |
R6 |
т.пл., °С |
| 13 |
4-F-C6H4 |
H |
CH3 |
CH3 |
189-192a |
| 14 |
3-Cl-C6H4 |
H |
CH3 |
CH3 |
182=186а |
| 15 |
1-нафтил |
H |
CH3 |
CH3 |
203-206 |
| 16 |
1-нафтил |
H |
H |
H |
148-170 |
| 17 |
3-F-C6H4 |
H |
H |
H |
202-204 |
| 18 |
C6H5 |
CH3 |
H |
H |
>250а |
| 19 |
3-CF3-C6H4 |
H |
CH3 |
CH3 |
108-112 |
| 20 |
2-CF3-C6H4 |
H |
CH3 |
CH3 |
196-198 |
| 21 |
2-CF3-C6H4 |
H |
H |
H |
182-185а |
| 22 |
3-CF3-C6H4 |
H |
H |
H |
179-183 |
| 23 |
2-тиенил |
H |
H |
H |
202-204а |
| 24 |
3,5-диCl-C6H3 |
H |
H |
H |
136-140 |
| 25 |
2-тиенил |
H |
CH3 |
CH3 |
212-216а |
| 26 |
3,5-диCl-C6H3 |
H |
CH3 |
CH3 |
227-232а |
| 27 |
3-Cl-C6H4 |
H |
CH2-CH2-CH2-CH2 |
183-185а |
| 28 |
3-F-C6H4 |
H |
CH2-CH2-CH2-CH2 |
198-200а |
| 29 |
3-F-C6H4 |
H |
CH2-CH2-CH2-CH2-CH2 |
197-199а |
| 30 |
3-F-C6H4 |
H |
CH2-CH2-O-CH2-CH2 |
127-129 |
| адигидрохлорид |
Пример 31
Получение N,N-диметил-N-[2-(1Н-пирроло[2,3-b]пиридин-1-ил)этил]амина
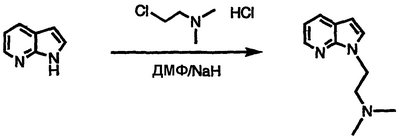
Перемешиваемый раствор 1Н-пирроло[2,3-b]пиридина (5,00 г, 42,3 ммоль) в ДМФ при температуре окружающей среды обрабатывают 95% гидридом натрия в масле (3,78 г, 150 ммоль). После окончания выделения газа реакционную смесь обрабатывают гидрохлоридом 2-(диметиламино)этилхлорида (6,40 г, 44,4 ммоль), перемешивают в течение 16 часов и концентрируют в вакууме. Полученный остаток распределяют между EtOAc и водой. Органическую фазу отделяют, сушат над MgSO4 и концентрируют в вакууме с получением указанного в заголовке соединения в виде масла, 6,50 г (выход 81%), идентифицируемого масс-спектральным анализом и анализом Н-ЯМР.
Пример 32
Получение дигидрохлорида N,N-диметил-N-(2-{3-[(3-фторфенил)сульфонил]-1Н-пирроло[2,3-b]пиридин-1-ил}этил)амина
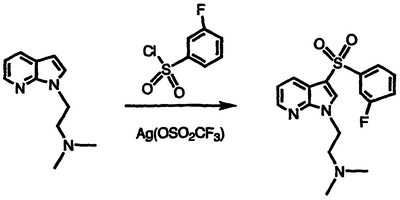
Перемешиваемый раствор N,N-диметил-N-[2-(1Н-пирроло[2,3-b]пиридин-1-ил)этил]амина (1,66 г, 8,8 ммоль) в нитробензоле обрабатывают 3-фторфенилсульфонилхлоридом (1,88 г, 9,7 ммоль) в атмосфере азота с последующей обработкой трифторметилсульфонатом серебра (2,94 г, 11,4 ммоль), нагревают до температуры 100°С в течение 22 часов, охлаждают и фильтруют через хлопковый фильтр. Фильтрат обрабатывают водой и насыщенным водным NaHCO3 и экстрагируют CH2Cl2. Экстракты объединяют, сушат над MgSO4 и концентрируют в вакууме. Полученный остаток подвергают хроматографии, элюируя 2:98 концентрированным NH4OH/этанолом, с получением свободного амина указанного в заголовке соединения в виде вязкого масла, которое затвердевает (1,25 г, 41%). Свободный амин растворяют в теплом этаноле, обрабатывают 4 М HCl в диоксане и фильтруют. Фильтрат сушат с получением указанного в заголовке соединения в виде бледно-желтого твердого вещества, 1,07 г (29% выход), т.пл. 191-192°С, охарактеризованного масс-спектральным анализом и анализом Н-ЯМР.
Примеры 33-56
Получение производных N-{[2-(3-арилсульфонил)-1Н-пирроло[2,3-b]пиридин-1-ил]этил}амина
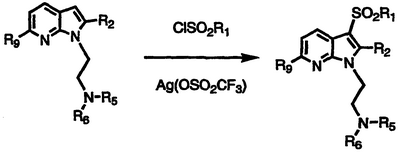
По методикам, указанным выше, и применяя соответствующий N1-замещенный 1Н-пирроло[2,3-b]пиридин и желаемый арилсульфонилхлорид, получают продукты, показанные в таблице II, и идентифицируют их масс-спектральным анализом и анализом Н-ЯМР.
| Таблица II |
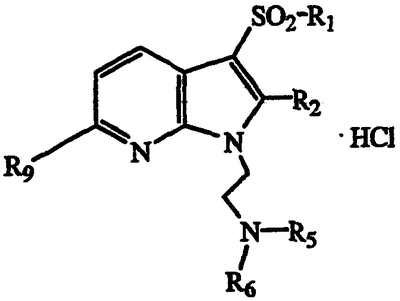 |
| Пример № |
R1 |
R2 |
R9 |
R5 |
R6 |
т.пл., °С |
| 33 |
5-Cl-тиен-2-ил |
H |
H |
CH3 |
CH3 |
169-171a |
| 34 |
6-Cl-имидазо[2,1-b][1,3]тиазол-5-ил |
H |
H |
CH3 |
CH3 |
180-182a |
| 35 |
3-Cl-C6H4 |
H |
H |
C2H5 |
C2H5 |
74-76 |
| 36 |
3-CH3-5-Cl-бензотиен-2-ил |
H |
H |
CH3 |
CH3 |
212-215 |
| 37 |
2,6-диCl-C6H3 |
H |
H |
CH3 |
CH3 |
220-222 |
| 38 |
2,5-диCl-C6H3 |
H |
H |
CH3 |
CH3 |
230-232a |
| 39 |
6-Cl-имидазо[2,1-b][1,3]тиазол-5-ил |
H |
H |
бензил |
бензил |
140-145b |
| 40 |
3-CH3-C6H4 |
H |
H |
CH3 |
CH3 |
195-197 |
| 41 |
C6H5 |
H |
Br |
CH3 |
CH3 |
182-184 |
| 42 |
C6H5 |
H |
OCH3 |
CH3 |
CH3 |
217-119 |
| 43 |
C6H5 |
H |
Cl |
CH3 |
CH3 |
193-195 |
| 44 |
3-CN-C6H4 |
H |
H |
CH3 |
CH3 |
148-150 |
| 45 |
2-нафтил |
CH3 |
H |
CH3 |
CH3 |
238-240 |
| 46 |
3-CN-C6H4 |
CH3 |
H |
CH3 |
CH3 |
158-160 |
| 47 |
3,5-диCl-C6H3 |
CH3 |
H |
CH3 |
CH3 |
250-252 |
| 48 |
3-CF3-C6H4 |
CH3 |
H |
CH3 |
CH3 |
195-197 |
| 49 |
2-тиенил |
CH3 |
H |
CH3 |
CH3 |
213-216 |
| 50 |
6-Cl-имидазо[2,1-b][1,3]тиазол-5-ил |
CH3 |
H |
CH3 |
CH3 |
195-199 |
| 51 |
3-F-C6H4 |
CH3 |
H |
CH3 |
CH3 |
185-190 |
| 52 |
1-нафтил |
CH3 |
H |
CH3 |
CH3 |
135-139 |
| 53 |
2,5-диCl-C6H3 |
CH3 |
H |
CH3 |
CH3 |
222-224 |
| 54 |
3-CH3-5-Cl-бензотиен-2-ил |
CH3 |
H |
CH3 |
CH3 |
193-197 |
| 55 |
3-Cl-C6H4 |
CH3 |
H |
CH3 |
CH3 |
210-213 |
| 56 |
5-Cl-тиен-2-ил |
CH3 |
H |
CH3 |
CH3 |
208-211 |
адигидрохлорид
bпены |
Пример 57
Получение гидрохлорида N-(2-{3-[(3-хлорфенил)сульфонил]-1Н-пирроло[2,3-b]пиридин-1-ил}этил)-N-метиламина
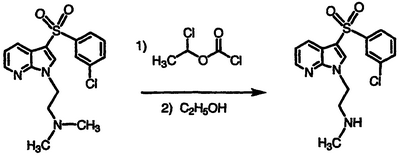
Перемешиваемый в атмосфере азота раствор N-(2-{3-[(3-хлорфенил)сульфонил]-1Н-пирроло[2,3-b]пиридин-1-ил}этил)-N,N-диметиламина (0,540 г, 1,49 ммоль) в 1,2-дихлорэтане обрабатывают 1-хлорэтилхлорформиатом (0,40 мл, 3,7 ммоль), нагревают до температуры кипения с обратным холодильником в течение 2 часов, охлаждают и концентрируют в вакууме. Полученный остаток обрабатывают этанолом, нагревают при температуре кипения с обратным холодильником в течение 2 часов и концентрируют в вакууме. Полученный остаток подвергают хроматографии с применением 2:98 концентрированного NH4OH/этанола в качестве элюента, с получением свободного амина указанного в заголовке соединения в виде полутвердого вещества (311 мг, 60%). Свободный амин растворяют в этаноле, обрабатывают 4 М HCl в диоксане и фильтруют. Фильтрат сушат с получением указанного в заголовке соединения в виде бледно-желтого твердого вещества, 274 мг (48% выход), т.пл. 263-265°С (разл.), охарактеризованного масс-спектральным анализом и анализом Н-ЯМР.
Примеры 58-62
Получение производных N-{[2-(3-арилсульфонил)-1Н-пирроло[2,3-b]пиридин-1-ил]этил}амина
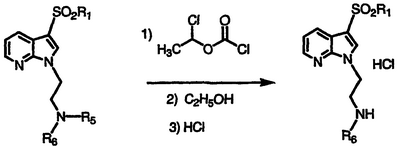
По методикам, указанным выше, и применяя соответствующий N-(N,N-дизамещенный аминоалкил)-1Н-пирроло[2,3-b]пиридин, получают продукты, показанные в таблице III, и идентифицируют их масс-спектральным анализом и анализом Н-ЯМР.
| Таблица III |
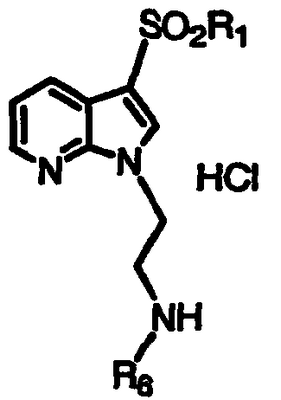 |
| Пример № |
R1 |
R6 |
т.пл., °С |
| 58 |
6-Cl-имидазо[2,1b][1,3]тиазол-5-ил |
CH3 |
182-186
(пены) |
| 59 |
3-F-C6H4 |
CH3 |
225-260 |
| 60 |
3-Cl-C6H4 |
C2H5 |
231-233 |
| 61 |
6-Cl-имидазо[2,1-b][1,3]тиазол-5-ил |
CH2C6H5 |
173-175 |
| 62 |
3-CH3-C6H4 |
CH3 |
244-246 |
Пример 63
Получение 1-(1Н-пирроло[2,3-b]пиридин-1-ил)ацетонитрила
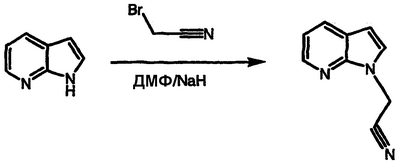
Перемешиваемый раствор 1Н-пирроло[2,3-b]пиридина (5,06 г, 42,8 ммоль) в ДМФ при температуре окружающей среды порциями обрабатывают 95% гидридом натрия (1,10 г, 43,5 ммоль). После завершения выделения газа реакционную смесь обрабатывают бромацетонитрилом (3,00 мл, 43,1 ммоль), перемешивают в течение 16 часов и концентрируют в вакууме. Полученный остаток распределяют между EtOAc и водой. Органическую фазу отделяют, сушат над MgSO4 и концентрируют в вакууме. Остаток подвергают хроматографии, элюируя 1:3 EtOAc/гексаном с получением указанного в заголовке соединения в виде воскового твердого вещества, т.пл. 77-79°С, охарактеризованного масс-спектральным анализом и анализом Н-ЯМР.
Пример 64
Получение 1-[3-(фенилсульфонил)-1Н-пирроло[2,3-b]пиридин-1-ил]ацетонитрила
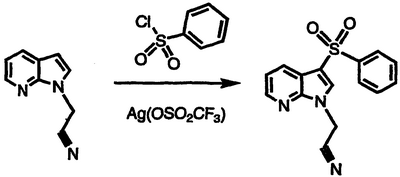
Перемешиваемый раствор 1-(1Н-пирроло[2,3-b]пиридин-1-ил)ацетонитрила (0,68 г, 4,33 ммоль) в нитробензоле обрабатывают бензолсульфонилхлоридом (0,57 мл, 4,4 ммоль) и трифторметансульфонатом серебра (1,50 г, 5,8 ммоль), нагревают при температуре 125°С в течение 16 часов, охлаждают и разделяют между насыщенным водным NaHCO3 и CH2Cl2. Органическую фазу сушат над MgSO4 и концентрируют в вакууме. Полученный остаток подвергают хроматографии, элюируя сначала 1:4 EtOAc/гексаном, затем 1:2 EtOAc/гексаном с получением указанного в заголовке соединения в виде рыжевато-коричневого твердого вещества, 0,70 г (54% выход), т.пл. 140-142°С, охарактеризованного масс-спектральным анализом и анализом Н-ЯМР.
Пример 65
Получение 2-[3-(фенилсульфонил)-1Н-пирроло[2,3-b]пиридин-1-ил]этиламина
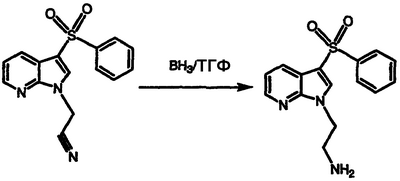
Часть 1-[3-(фенилсульфонил)-1Н-пирроло[2,3-b]пиридин-1-ил]ацетонитрила (0,30 г, 1,00 ммоль) обрабатывают 1,0 М бораном в тетрагидрофуране (ТГФ) (4,0 мл, 4,0 ммоль) порциями по 0,5 мл при температуре окружающей среды, перемешивают в течение 16 часов, обрабатывают 2,0 М HCl (15 мл), нагревают при температуре 100°С в течение 2 часов, охлаждают на ледяной бане, обрабатывают 2,5 М водным NaOH и экстрагируют простым эфиром. Экстракты объединяют, сушат над MgSO4 и концентрируют в вакууме с получением указанного в заголовке соединения в виде масла, 0,180 г (60% выход), охарактеризованного масс-спектральным анализом и анализом Н-ЯМР.
Примеры 66-68
Получение производных [3-(арилсульфонил)-1Н-пирроло[2,3-b]пиридин-1-ил]алкиламина
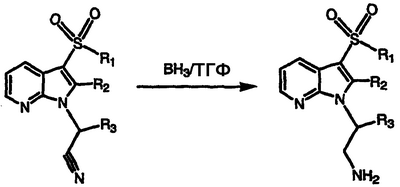
По методикам, описанным в примерах 64 и 65, и применяя соответствующий 3-арилсульфонил-1Н-пирроло[2,3-b]пиридин-1-ацетонитрил, получают соединения, показанные в таблице IV, и идентифицируют их масс-спектральным анализом и анализом Н-ЯМР.
| Таблица IV |
 |
| Пример № |
R1 |
R2 |
R3 |
т.пл., °С |
| 66 |
3-F-C6H4 |
CH3 |
H |
239-241a |
| 67 |
2-нафтил |
H |
H |
233-238a |
| 68 |
C6H5 |
H |
CH3 |
180-185a |
| агидрохлорид |
Пример 69
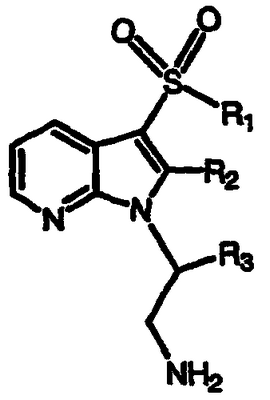
Получение 4-нитро-3-[(фенилсульфонил)метил]пиридин-N-оксида
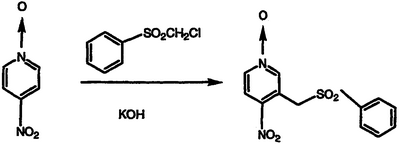
С применением адаптированной методики Makosza, et al., Liebigs Ann. Chem., 1984, 8-14, перемешиваемую смесь 4-нитропиридин-N-оксида (1,40 г, 10,0 ммоль) и хлорметилфенилсульфона (1,92 г, 10,0 ммоль) в ДМСО (25 мл) на холодной водяной бане обрабатывают раствором КОН (4,0 г, 71 ммоль) в ДМСО, перемешивают в течение 45 минут, выливают в 1,0 М хлористоводородную кислоту и воду и экстрагируют CH2Cl2. Водную фазу фильтруют и фильтровальную лепешку сушат в вакууме с получением указанного в заголовке соединения, 1,20 г (выход 41%). Органические экстракты объединяют, сушат над MgSO4 и концентрируют в вакууме. Полученное влажное твердое вещество нагревают в кипящем этаноле/воде (4:1) и фильтруют. Фильтрат охлаждают, концентрируют и фильтруют. Полученную фильтровальную лепешку сушат в вакууме с получением дополнительной порции указанного в заголовке соединения, 0,967 г (общий выход 74%), т.пл. 219-220°С, охарактеризованного масс-спектральным анализом и анализом Н-ЯМР.
Пример 70
Получение 3-фенилсульфонил-1Н-пирроло[3,2-c]пиридина
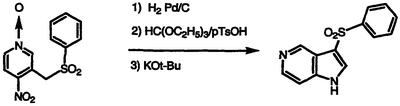
Смесь 4-нитро-3-[(фенилсульфонил)метил]пиридин-N-оксида (1,43 г, 4,90 ммоль) в метаноле нагревают с формиатом аммония (1,54 г, 24,5 ммоль) и 10% палладием на угле (0,50 г) при температуре 50°С в течение 24 часов, обрабатывают дополнительным количеством формиата аммония (0,63 г, 10 ммоль), нагревают при температуре кипения с обратным холодильником в течение 30 часов, охлаждают и фильтруют. Фильтрат концентрируют в вакууме. Полученный остаток суспендируют в этаноле/воде и фильтруют для удаления остаточного катализатора. Фильтрат концентрируют, охлаждают и фильтруют. Фильтровальную лепешку сушат с получением рыжевато-коричневого твердого вещества (0,60 г). Это твердое вещество (0,55 г) смешивают с триэтилортоформиатом (1,84 мл, 11,1 ммоль), моногидратом пара-толуолсульфокислоты (pTsOH) (42 мг, 0,22 ммоль) и 1,2-дихлорэтаном, нагревают при температуре кипения с обратным холодильником в течение 7 часов и концентрируют в вакууме. Полученный остаток диспергируют в тетрагидрофуране, обрабатывают 1,0 М KO-t-Bu в тетрагидрофуране (3,1 мл, 3,1 ммоль), перемешивают в течение 2 часов, обрабатывают насыщенным водным NH4Cl и водой и экстрагируют CH2Cl2. Экстракты объединяют, сушат над MgSO4 и концентрируют в вакууме. Полученное оранжевое твердое вещество подвергают хроматографии, элюируя сначала EtOAc, затем 10:90 этанолом/EtOAc с получением указанного в заголовке соединения в виде беловатого твердого вещества, 330 мг (58% выход), т.пл. 261-263°С, охарактеризованного масс-спектральным анализом и анализом Н-ЯМР.
Пример 71
Получение дигидрохлорида N,N-диметил-N-{2-[3-(фенилсульфонил)-1Н-пирроло[3,2-с]пиридин-1-ил]этил}амина
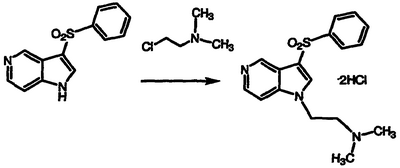
По методике примера 6, применяя 3-фенилсульфонил-1Н-пирроло[3,2-c]пиридин, температуру окружающей среды в качестве температуры реакции и время реакции 24 часа, получают указанное в заголовке соединение в виде беловатого твердого вещества, т.пл. 255-257°С, охарактеризованного масс-спектральным анализом и анализом Н-ЯМР.
Пример 72
Получение 6-метокси-3-нитро-2-[(фенилсульфонил)метил]-пиридина
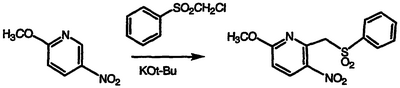
1 М KOt-Bu раствор в тетрагидрофуране (50 мл, 50 ммоль) охлаждают до температуры -40°С, порциями обрабатывают раствором хлорметилфенилсульфона (4,39 г, 23,0 ммоль) и затем раствором 2-метокси-5-нитропиридина (3,55 г, 23,0 ммоль) в тетрагидрофуране, перемешивают в течение 45 минут при температуре -40°С, обрабатывают ледяной уксусной кислотой (3,0 г, 50 ммоль) и фильтруют. Фильтровальную лепешку сушат на воздухе с получением указанного в заголовке соединения в виде рыжевато-коричневого твердого вещества, 5,70 г (80% выход), т.пл. 147-149°С, охарактеризованного масс-спектральным анализом и анализом Н-ЯМР.
Пример 73
Получение 3-амино-6-метокси-2-[(фенилсульфонил)метил]пиридина
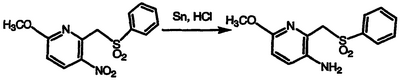
К перемешиваемой смеси 6-метокси-3-нитро-2-[(фенилсульфонил)метил]пиридина (6,17 г, 20,0 ммоль) в метаноле и конц. HCl (50 мл) добавляют тонкие полоски оловянной фольги (10,0 г, 84,2 ммоль), нагревают при температуре 60°С в течение 20 часов и фильтруют горячей. Фильтрат выливают на лед и 2,5 н. водный NaOH, перемешивают в течение 0,5 часа и фильтруют. Фильтровальную лепешку сушат на воздухе с получением указанного в заголовке соединения в виде белого твердого вещества, выход 5,26 г (94%), охарактеризованного масс-спектральным анализом и анализом Н-ЯМР.
Пример 74
Сложный этиловый эфир N-{6-метокси-[2-(фенилсульфонил)метил]пиридин-3-ил}формимидной кислоты
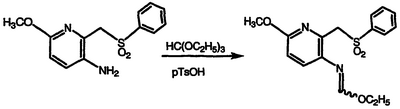
Перемешиваемую смесь 3-амино-6-метокси-2-[(фенилсульфонил)метил]пиридина (2,40 г, 8,62 ммоль) в триэтилортоформиате (20 мл) и моногидрате п-толуолсульфокислоты (pTsOH) (0,15 г, 0,788 ммоль) нагревают при температуре 155°С в течение 48 часов и концентрируют в вакууме. Полученный остаток разбавляют гексаном и фильтруют с получением указанного в заголовке соединения в виде рыжевато-коричневого вещества, 2,54 г (88% выход), охарактеризованного масс-спектральным анализом и анализом Н-ЯМР.
Пример 75
Получение 5-метокси-3-фенилсульфонил-1Н-пирроло[3,2-b]пиридина
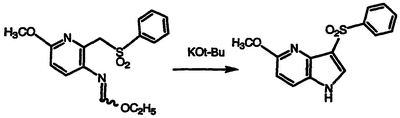
Перемешиваемый раствор сложного этилового эфира N-{6-метокси-[2-(фенилсульфонил)метил]пиридин-3-ил}формимидной кислоты (2,54 г, 7,60 ммоль) в ДМСО обрабатывают порошкообразным KOt-Bu (4,59 г, 38,0 ммоль), перемешивают при температуре окружающей среды в течение 4 часов, обрабатывают 10% водным NH4Cl и экстрагируют EtOAc. Экстракты объединяют, сушат над MgSO4 и концентрируют в вакууме. Полученный остаток перекристаллизовывают из EtOAc с получением указанного в заголовке соединения в виде рыжевато-коричневого вещества, 0,42 г (19% выход), т.пл. 223-225°С, охарактеризованного масс-спектральным анализом и анализом Н-ЯМР.
Пример 76
Получение дигидрохлорида N,N-диметил-N-{2-[3-(фенилсульфонил)-1Н-пирроло[3,2-b]пиридин-1-ил]этил}амина
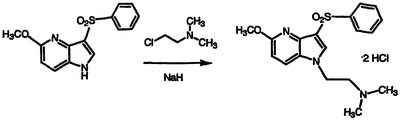
Перемешиваемый раствор 5-метокси-3-фенилсульфонил-1Н-пирроло[3,2-b]пиридина (0,288 г, 1,00 ммоль) в сухом диметилформамиде обрабатывают 95% NaH (0,075 г, 2,97 ммоль), перемешивают при температуре окружающей среды до прекращения выделения газа, обрабатывают гидрохлоридом 2-(диметиламино)этилхлорида (0,200 г, 1,39 ммоль), перемешивают в течение 16 часов при температуре 80°С, концентрируют в вакууме и распределяют между водой и EtOAc. Органическую фазу сушат над MgSO4 и концентрируют в вакууме. Полученный остаток подвергают хроматографии, элюируя EtOAc, затем 1:9 CH3OH/EtOAc с получением полутвердого вещества (0,216 г, 60% выход свободного амина). Полутвердое вещество растворяют в этаноле и обрабатывают 4 н. HCl в диоксане и фильтруют. Фильтровальную лепешку сушат и растирают с простым эфиром с получением указанного в заголовке соединения в виде белого твердого вещества, 0,19 г, т.пл. 212-214°С, охарактеризованного масс-спектральным анализом и анализом Н-ЯМР.
Пример 77
Получение дигидрохлорида N,N-диметил-N-(2-{3-[(3-фторфенил)сульфонил]-1Н-пирроло[3,2-b]пиридин-1-ил}этил)амина
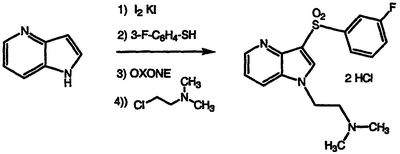
По методике примеров 6, 8, 9 и 10, применяя 1Н-пирроло[3,2-b]пиридин в качестве исходного материала, получают указанное в заголовке соединение в виде белого твердого вещества, т.пл. 163-165°С, охарактеризованного масс-спектральным анализом и анализом Н-ЯМР.
Примеры 78-81
Получение производных N-{2-[3-(арилсульфонил)-1Н-пирроло[3,2-b]пиридин-1-ил]этил}амина
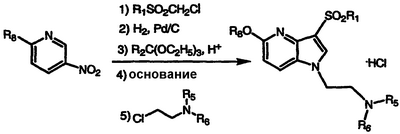
По методике примеров 72-76, применяя соответствующие замещенные нитробензолы в качестве исходного материала и арилсульфонилхлорид и хлорэтиламин, получают соединения, показанные в таблице V, охарактеризованные масс-спектральным анализом и анализом Н-ЯМР.
| Таблица V |
 |
| Пример № |
R1 |
R8 |
R5 |
R6 |
т.пл., °С |
| 78 |
4-Br-C6H4 |
OCH3 |
CH3 |
CH3 |
225-226 |
| 79 |
3-F-C6H4 |
OCH3 |
CH3 |
CH3 |
208-212 |
| 80 |
1-нафтил |
OCH3 |
CH3 |
CH3 |
233-235 |
| 81 |
C6H5 |
Cl |
CH3 |
CH3 |
244-246 |
Пример 82
Сравнительная оценка аффинности связывания тестируемых соединений к 5-ГТ6
Аффинность тестируемых соединений к рецептору серотонина 5-ГТ6 оценивают следующим образом. Культивированные клетки Hela, экспрессирующие человеческие клонированные рецепторы 5-ГТ6, собирают и центрифугируют при низкой скорости (1000×g) в течение 10 минут для удаления культурной среды. Собранные клетки суспендируют в половине объема свежего физиологического раствора с фосфатным буфером и повторно центрифугируют при той же скорости. Операцию повторяют. Собранные клетки затем гомогенизируют в десяти объемах 50 мМ Трис·HCl (рН 7,4) и 0,5 мМ ЭДТК. Гомогенат центрифугируют при 40000×g в течение 30 минут и осадок собирают. Полученный осадок после центрифугирования повторно суспендируют в 10 объемах Трис·HCl буфера и повторно центрифугируют при той же скорости. Конечный осадок после центрифугирования суспендируют в небольшом объеме Трис·HCl буфера и содержание белка в ткани определяют в аликвотах объемом 10-25 мкл. Альбумин бычьей сыворотки применяют в качестве стандарта при определении белка по методу, описанному у Lowry et al., J. Biol. Chem., 193:265 (1951). Объем суспендированных мембран клеток доводят до получения концентрации белка в ткани 1,0 мг/мл суспензии. Полученную суспензию мембран (концентрированную в 10 раз) аликвотируют в объемах 1,0 мл и хранят при температуре -70°С до применения в последующих экспериментах на связывание.
Эксперименты на связывание проводят в 96-ячеечных титровальных микропланшетах общим объемом 200 мкл. В каждую ячейку добавляют следующую смесь: 80,0 мкл инкубационного буфера, полученного в 50 мМ Трис·HCl буфере (рН 7,4), содержащего 10,0 мМ MgCl2 и 0,5 мМ ЭДТК и 20 мкл [3H]-ЛСД (S.A., 86,0 Ки/ммоль, от Amersham Life Science), 3,0 нМ. Константа диссоциации, Kd [3H]-ЛСД для человеческого рецептора серотонина 5-ГТ6 составляет 2,9 нМ, что определяется насыщением связывания при увеличивающихся концентрациях [3H]-ЛСД. Реакцию начинают добавлением 100,0 мкл суспензии ткани. Неспецифическое связывание измеряют в присутствии 10,0 мкМ метиотепина. Тестируемые соединения добавляют в объеме 20,0 мкл.
Реакцию проводят в темноте в течение 120 минут при комнатной температуре, в течение чего связанный комплекс лиганда-рецептора отфильтровывают в 96-ячеечный унифильтр с харвестером Packard Filtermate® 196. Связанный комплекс, уловленный на фильтровальном диске, сушат на воздухе и его радиоактивность измеряют на Packard TopCount®, оборудованном шестью датчиками фотоумножителя, после добавления 40,0 мкл сцинтиллянта Microscint®-20 в каждую плоскую ячейку. Планшет с унифильтром герметизируют при нагревании и считывают на Packard TopCount® с эффективностью трития 31,0%.
Специфическое связывание с рецепторами 5-ГТ6 определяют как общую связанную радиоактивность за минусом связывания в присутствии 10,0 мкМ немеченого метиотепина. Связывание в присутствии различных концентраций тестируемых соединений выражают в процентах специфического связывания по сравнению с отсутствием тестируемого соединения. Результаты наносят в виде логарифма % связывания по отношению к логарифму концентрации тестируемого соединения. Нелинейный регрессионный анализ данных проводят с помощью программного обеспечения Prism® с получением значений IC50 и Ki тестируемых соединений с 95% достоверностью. Строят график линейной регрессии данных, из которого определяют значение IC50, и значение Ki определяют с помощью следующего уравнения:
Ki = IC50/(1 + L/KD),
где L является концентрацией применяемого радиоактивного лиганда и KD является константой диссоциации лиганда для рецептора, выраженные в нМ.
В данном исследовании определяют значения Ki и сравнивают их со значениями, полученными для сравнительных соединений, известных связыванием с рецептором 5-ГТ6. Данные показаны в таблице VI ниже.
| Таблица VI |
| Тестируемое соединение (пример №) |
Ki связывания 5-ГТ6 (нМ) |
| 5 |
6 |
| 6 |
23 |
| 7 |
9 |
| 11 |
22 |
| 12 |
20 |
| 13 |
50 |
| 14 |
2 |
| 15 |
1 |
| 16 |
2 |
| 17 |
6 |
| 18 |
5 |
| 19 |
5 |
| 20 |
11 |
| 21 |
2 |
| 22 |
2 |
| 23 |
9 |
| 24 |
3 |
| 25 |
15 |
| 26 |
4 |
| 27 |
45 |
| 28 |
88 |
| 29 |
158 |
| 30 |
403 |
| 32 |
5 |
| 33 |
4 |
| 34 |
2 |
| 35 |
20 |
| 36 |
102 |
| 37 |
9 |
| 38 |
12 |
| 39 |
212 |
| 40 |
10 |
| 41 |
41 |
| 42 |
39 |
| 43 |
27 |
| 44 |
63 |
| 45 |
10 |
| 46 |
10 |
| 47 |
7 |
| 48 |
2 |
| 49 |
14 |
| 50 |
1 |
| 51 |
3 |
| 52 |
3 |
| 53 |
11 |
| 54 |
94 |
| 55 |
4 |
| 56 |
2 |
| 57 |
0,3 |
| 58 |
1 |
| 59 |
1 |
| 60 |
3 |
| 61 |
9 |
| 62 |
1 |
| 65 |
6 |
| 66 |
2 |
| 67 |
24 |
| 68 |
14 |
| 76 |
56 |
| 77 |
200 |
| 78 |
4 |
| 79 |
11 |
| 80 |
2 |
| 81 |
214 |
| Сравнительные примеры |
Ki связывания 5-ГТ6 (нМ) |
| Клозапин |
6,0 |
| Локсапин |
41,4 |
| Бромокриптин |
23,0 |
| Метиотепин |
8,3 |
| Миансерин |
44,2 |
| Оланзепин |
19,5 |
Как можно видеть из показанных выше результатов, соединения в соответствии с данным изобретением демонстрируют значительную аффинность к рецептору 5-ГТ6.
Формула изобретения
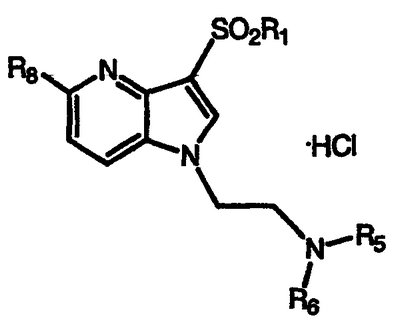
1. Соединение формулы (I)
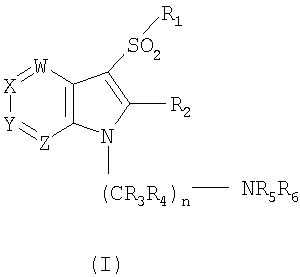
где W является N или CR7;
Х является N или CR8;
Y является N или CR9;
Z является N или CR10 при условии, что, по крайней мере, один, и не более двух из W, X, Y и Z должны быть N;
n является целым числом 2, 3, 4 или 5;
R1 является необязательно замещенным арилом или гетероарилом, или необязательно замещенной 8-13-членной бициклической или трициклической системой колец, имеющей 1, 2 или 3 дополнительных гетероатома, выбранных из N, О или S;
R2 является Н, галогеном, незамещенным или замещенным C1-С6-алкилом, C1-С6-алкокси или С3-С7-циклоалкилом;
R3 и R4, каждый независимо является Н или необязательно замещенным С1-С6-алкилом;
R5 и R6, каждый независимо является Н или С1-С6-алкилом, С3-С7-циклоалкилом, или R5 и R6 вместе с атомом азота, к которому они присоединены, образуют необязательно замещенное 5-8-членное кольцо, необязательно содержащее дополнительный атом О;
R7, R8, R9 и R10 независимо являются Н, галогеном, OR19, COR20, C1-С6-алкилом или С3-С7-циклоалкилом;
R19 и R20, каждый независимо является C1-С6-алкилом или С3-С6-циклоалкилом, или его фармацевтически приемлемая соль.
2. Соединение по п.1, в котором W или Z является N.
3. Соединение по п.1 или 2, в котором n равно 2.
4. Соединение по п.3, в котором R1 является необязательно замещенным фенилом, нафтилом или имидазотиазолилом.
5. Соединение по п.4, в котором R1 является фенилом, необязательно замещенным галогеном или 1-нафтилом или 6-хлоримидазо[1,2-b][1,3]тиазол-5-илом.
6. Соединение по п.3, в котором W является CR7; Х является CR8; Y является CR9.
7. Соединение по п.3, в котором Х является CR8; Y является CR9; и Z является CR10.
8. Соединение по п.6, в котором R5 и R6, каждый независимо является Н или С1-С3-алкилом.
9. Соединение по п.8, в котором R3 и R4 являются Н.
10. Соединение по п.9, в котором R2 является Н.
11. Соединение по п.1, выбранное из группы, включающей
2-[3-(фенилсульфонил)-1Н-пирроло[2,3-b]пиридин-1-ил]этиламин;
2-[3-(фенилсульфонил)-1Н-пирроло[2,3-с]пиридин-1-ил]этиламин;
2-[3-(фенилсульфонил)-1Н-пирроло[3,2-с]пиридин-1-ил]этиламин;
2-{3-[(4-фторфенил)сульфонил]-1Н-пирроло[3,2-b]пиридин-1-ил}этиламин;
2-{3-[(4-метилфенил)сульфонил]-1Н-пирроло[2,3-b]пиридин-1-ил}этиламин;
2-[3-(нафт-1-ил)сульфонил)-1Н-пирроло[2,3-b]пиридин-1-ил]этиламин;
2-{3-[(6-хлоримидазо[2,1-b][1,3]тиазол-5-ил)сульфонил]-1Н-пирроло[2,3-b]пиридин-1-ил}этиламин;
2-{3-[(3-хлорфенил)сульфонил]-1Н-пирроло[2,3-b]пиридин-1-ил}этиламин;
2-{3-[(2-хлорфенил)сульфонил]-1Н-пирроло[2,3-с]пиридин-1-ил}этиламин;
2-{3-[(3-метоксифенил)сульфонил]-1Н-пирроло[3,2-с]пиридин-1-ил}этиламин;
2-{3-[(4-фторфенил)сульфонил]-1Н-пирроло[3,2-b]пиридин-1-ил}этиламин;
N,N-диметил-N-(2-{3-[(3-фторфенил)сульфонил]-1Н-пирроло[2,3-b]пиридин-1-ил}этил)амин;
N,N-диметил-N-{2-[3-(нафт-1-илсульфонил)-1Н-пирроло[2,3-b]пиридин-1-ил]этил}амин;
N,N-диметил-N-(2-{3-[(6-хлоримидазо[1,2-b][1,3]тиазол-5-ил)сульфонил]-1Н-пирроло[2,3-b]пиридин-1-ил}этил)амин;
N,N-диметил-N-(2-{3-[(3-хлорфенил)сульфонил]-1Н-пирроло[2,3-b]пиридин-1-ил}этил)амин;
3-[3-(фенилсульфонил)-1Н-пирроло[2,3-b]пиридин-1-ил]пропан-1-амин;
3-[3-(фенилсульфонил)-1Н-пирроло[2,3-с]пиридин-1-ил]пропан-1-амин;
3-[3-(фенилсульфонил)-1Н-пирроло[3,2-с]пиридин-1-ил]пропан-1-амин;
3-{3-[(4-фторфенил)сульфонил]-1Н-пирроло[3,2-b]пиридин-1-ил}пропан-1-амин;
2-{6-хлор-3-[(3-хлорфенил)сульфонил]-1Н-пирроло[2,3-b]пиридин-1-ил}этиламин;
2-{7-хлор-3-[(2-хлорфенил)сульфонил]-1Н-пирроло[2,3-с]пиридин-1-ил}этиламин;
4-{3-[(3-метоксифенил)сульфонил]-1Н-пирроло[3,2-с]пиридин-1-ил}бутан-1-амин;
4-{3-[(4-фторфенил)сульфонил]-1Н-пирроло[3,2-b]пиридин-1-ил}бутан-1-амин;
N,N-диметил-N-{2-[3-(фенилсульфонил)-1Н-пирроло[2,3-с]пиридин-1-ил]этил}амин;
N,N-диметил-N-{2-[3-(фенилсульфонил)-1Н-пирроло[3,2-с]пиридин-1-ил]этил}амин;
N,N-диметил-N-{2-[3-(тиан-2-ил)-1Н-пирроло[2,3-b]пиридин-1-ил]этил}амин;
N,N-диметил-N-{2-[3-(нафт-1-ил)-1Н-пирроло[2,3-b]пиридин-1-ил]этил}амин;
N,N-диметил-N-(2-{3-[(4-фторфенил)сульфонил]-1Н-пирроло[3,2-b]пиридин-1-ил}этил)амин;
N-метил-N-(2-{3-[(3-хлорфенил)сульфонил]-1Н-пирроло[2,3-b]пиридин-1-ил}этил)амин;
N-метил-N-(2-{3-[(3-фторфенил)сульфонил]-1Н-пирроло[2,3-b]пиридин-1-ил}этил)амин;
N-метил-N-{2-[3-(нафт-1-илсульфонил)-1Н-пирроло[2,3-b]пиридин-1-ил]этил}амин;
N-метил-N-(2-{3-[(6-хлоримидазо[1,2-b][1,3]тиазол-5-ил)сульфонил]-1Н-пирроло[2,3-b]пиридин-1-ил}этил)амин;
N-метил-N-(2-{3-[(2-хлорфенил)сульфонил]-1Н-пирроло[3,2-с]пиридин-1-ил}этил)амин;
N-метил-N-(2-{3-[(3-метоксифенил)сульфонил]-1Н-пирроло[2,3-с]пиридин-1-ил}этил)амин;
N-бензил-N-(2-{3-[(4-фторфенил)сульфонил]-1Н-пирроло[3,2-b]пиридин-1-ил}этил)амин;
N,N-дибензил-3-[3-(фенилсульфонил)-1Н-пирроло[2,3-b]пиридин-1-ил]пропан-1-амин;
3-[3-(фенилсульфонил)-1Н-пирроло[2,3-с]пиридин-1-ил]пропан-1-амин;
3-[3-(фенилсульфонил)-1Н-пирроло[3,2-с]пиридин-1-ил]пропан-1-амин;
и их фармацевтически приемлемые соли.
12. Способ лечения расстройства центральной нервной системы, связанного или находящегося под воздействием рецептора 5-ГТ6, у пациента, нуждающегося в этом, который включает введение указанному пациенту терапевтически эффективного количества соединения формулы I по любому из пп.1-11, или его фармацевтически приемлемой соли.
13. Способ по п.12, в котором указанным расстройством является расстройство моторики, тревога или когнитивное расстройство.
14. Способ по п.12, в котором указанным расстройством является нейродегенеративное расстройство.
15. Способ по п.13, в котором указанным расстройством является дефицит внимания или обсессивно-компульсивное расстройство.
16. Способ по п.14, в котором указанным расстройством является удар или травма головы.
17. Фармацевтическая композиция, обладающая активностью в отношении рецептора 5-гидрокситриптамина-6, которая содержит соединение формулы I или его фармацевтически приемлемую соль по любому из пп.1-11 и фармацевтически приемлемый носитель.
18. Способ получения соединения формулы I по п.1, или его фармацевтически приемлемых солей, который включает взаимодействие соединения формулы II
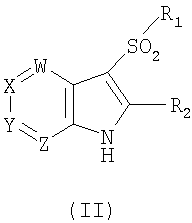
где W, X, Y, Z, R1 и R2 имеют значения, указанные в п.1, с галогеналкиламином формулы III
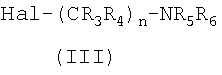
где Hal является Cl, Br или I, и R3, R4, R5, R6 и n имеют значения, указанные в п.1, в присутствии основания с получением соединения формулы I; и, если необходимо, превращение основного соединения формулы I в фармацевтически приемлемую соль, или наоборот.
19. Способ получения соединения формулы I по п.1, или его фармацевтически приемлемых солей, который включает взаимодействие соединения формулы (V)
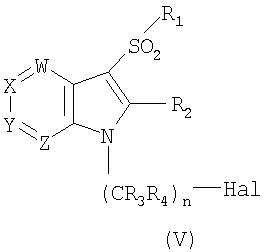
где W, X, Y, Z, R1, R2, R3, R4 и n имеют значения, указанные в п.1, и Hal является галогеном, с соединением формулы
HNR5R6
где R5 и R6 имеют значения, указанные в п.1, с получением соединения формулы I; и, если необходимо, превращение основного соединения формулы I в фармацевтически приемлемую соль, или наоборот.
20. Способ получения соединения формулы I по п.1, или его фармацевтически приемлемых солей, который включает сульфонилирование соединения формулы XVI
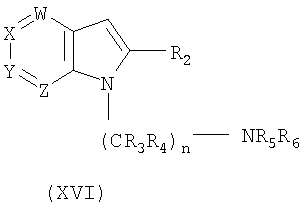
где W, X, Y, Z, R2, R3, R4, R5, R6 и n имеют значения, указанные в п.1, соединением формулы
ClSO2R1,
где R1 имеет значения, указанные в п.1, с получением соединения формулы I; и, если необходимо, превращение основного соединения формулы I в фармацевтически приемлемую соль или наоборот.
21. Способ получения соединения формулы I по п.1, где W, X, Y, Z, R1, R2, R3, R4 и n имеют значения, указанные в п.1, R5 и R6 представляют собой водород; или его фармацевтически приемлемых солей, который включает восстановление соединения формулы XX
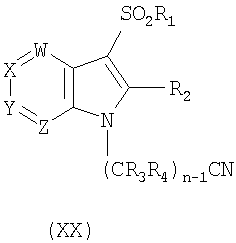
где W, X, Y, Z, R1, R2, R3, R4 и n имеют значения, указанные выше, и, если необходимо, превращение основного соединения формулы I в фармацевтически приемлемую соль, или наоборот.
22. Способ получения соединения формулы I по п.1,
где W, X, Y, Z, R1, R2, R3, R4 и n имеют значения, указанные в п.1, R5 и R6 представляют собой водород, или его фармацевтически приемлемых солей который включает взаимодействие соединения формулы
где W, X, Y, Z, R1, R2, R3, R4 и n имеют значения, указанные выше, с гидразином, и, если необходимо, превращение основного соединения формулы I в фармацевтически приемлемую соль или наоборот.
MM4A – Досрочное прекращение действия патента СССР или патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 04.06.2008
Извещение опубликовано: 27.07.2010 БИ: 21/2010
|
|