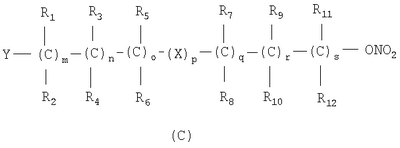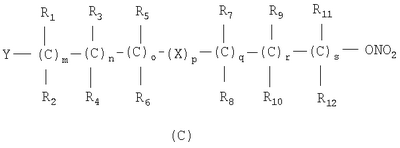Патент на изобретение №2315035
|
||||||||||||||||||||||||||
(54) СПОСОБ ПОЛУЧЕНИЯ НИТРООКСИПРОИЗВОДНЫХ НАПРОКСЕНА
(57) Реферат:
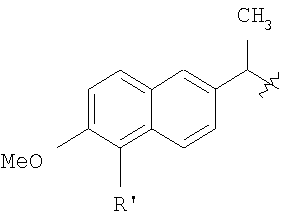
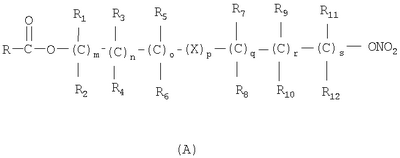
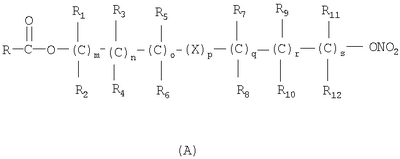
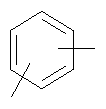
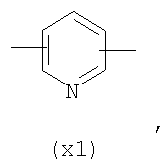
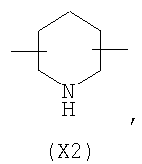
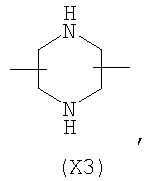
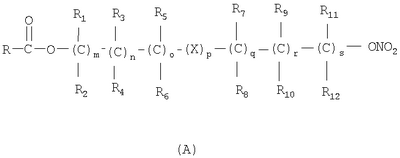
Настоящее изобретение относится к способу получения нитрооксипроизводных напроксена. Описываются способ получения соединения общей формулы (А), где R означает
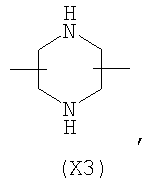
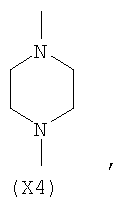
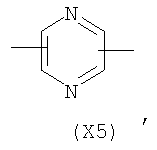
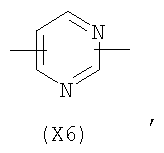
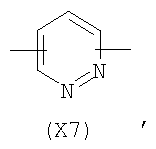
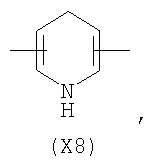
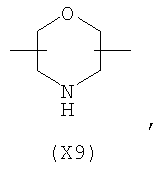
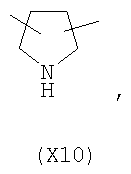
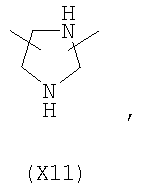
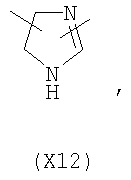
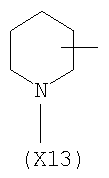
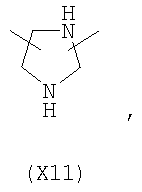
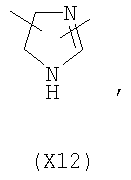
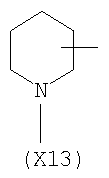
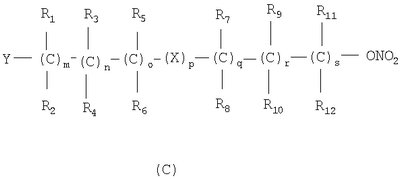
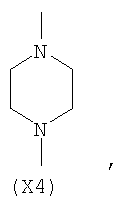
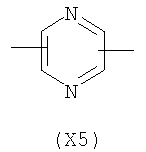
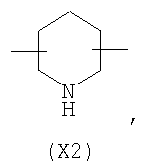
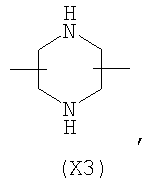
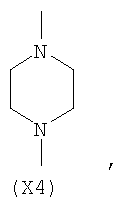
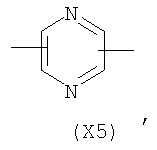
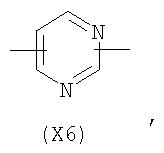
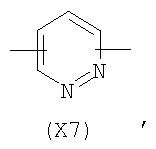
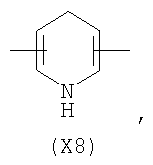
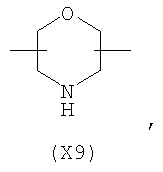
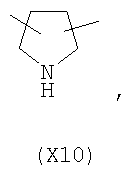
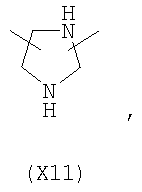
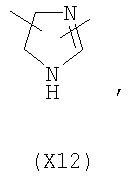
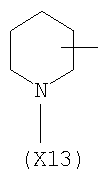
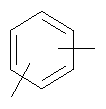
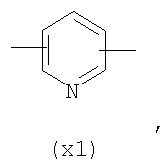
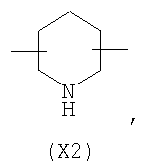
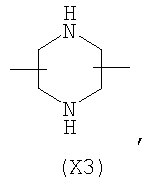
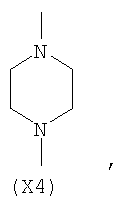
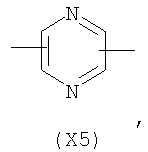
в котором R’ означает атом водорода или Br, R1-R12 являются одинаковыми или различными и независимо означают водород, линейный или разветвленный C1-С6, алкил, необязательно замещенный арилом; m, n, о, q, r и s каждый независимо означает целое число от 0 до 6, и р означает 0 или 1, и Х означает О, S, SO, SO2, NR13 или PR13, в котором R13 означает водород, C1-С6 алкил, или Х выбран из группы, включающей: – циклоалкилен с 5-7 атомами углерода в циклоалкиленовом кольце, при этом кольцо необязательно замещено боковыми цепями Т, где Т означает линейный или разветвленный алкил с 1-10 атомами углерода; – арилен, необязательно замещенный одним или более атомов галогена, линейными или разветвленными алкильными группами, содержащими от 1 до 4 атомов углерода, или линейным или разветвленным C1-С3 перфторалкилом; – 5- или 6-членное насыщенное, ненасыщенное или ароматическое гетероциклическое кольцо, выбранное из формул Х1-Х13, и указанный способ включает: i) реакцию соединения формулы (В): R-COOZ, где R является таким, как определено выше, и Z означает водород или катион, выбранный из Li+, Na+, Ca++, Mg++, тетраалкиламмония, тетраалкилфосфония, с соединением следующей формулы (С), где R1-R2 и m, n, о, р, q, r, s являются такими, как определены выше, и Y выбран из атома галогена, -BF4, -SbF6, FSO3-, RASO3-, в котором RA означает линейный или разветвленный С1-С6 алкил, необязательно замещенный одним или более атомов галогена, или C1-С6 алкиларил; -RBСОО–, где RB означает линейный или разветвленный C1-С6 алкил, арил, необязательно замещенный одним или более атомов галогена или NO2 группами, С4-С10 гетероарил и содержащий один или более гетероатомов, которые являются одинаковыми или различными, выбранными из азота, кислорода, серы или фосфора; – арилокси-группы, необязательно замещенной одним или более атомов галогена или NO2 группами, или гетероарилокси-группы, и ii) при необходимости превращения соединения формулы (А), где R’ означает Br, в соединение формулы (А), где R’ означает водород. 2. н. и 7 з.п. ф-лы.
(56) (продолжение): CLASS=”b560m”Chemical And Pharmaceutical Bulletin, JP, vol.41, №6, 1993, pp.1049-1054. JP 05279359 A, 26.10.1993. ABADI, ASHRAF H. et al. «Synthesis and cyclooxygenase ingibitiry properties of novel (+) 2-(6-methoxy-2-nafthyl)propanoic acid (naproxen) derivatives», Archiv Der Pharmazie, vol.334, №3, 2001, pp.104-106. C.GIORDANO et al. «A stereoconvergent strategy for the syntesis of enantiomericaly pure R-(-) and (S)-(+)-2-(6-Methoxy-2-naphthyl)-propanoic acid (naproxen)», Tertahedron, vol.45, №13, 1989, pp.4243-4252. RU 2136653 C1, 10.09.1999. WO 98/25918 A, 18.06.1998.
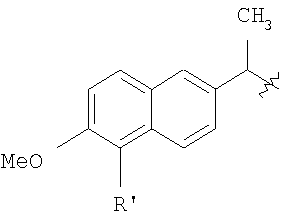
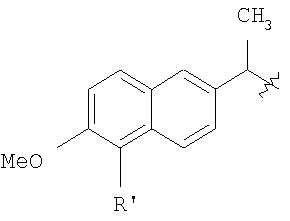
Настоящее изобретение относится к способу получения нитрооксиалкилэфиров напроксена (2-(S)-(6-метокси-2-нафтил)-пропионовой кислоты) или бромнапроксена (2-(S)-(5-бром-6-метокси-2-нафтил)-пропионовой кислоты) (Tetrahedron 1989, vol.45, рр.4243-4252). Из предшествующего уровня техники хорошо известно, что противовоспалительная активность 2-(S)-(6-метокси-2-нафтил)-пропионовой кислоты обусловлена S энантиомером, который является продуктом, доступным в продаже (напроксен). WO 01/10814 описывает способ получения нитрооксибутилэфира 2-(S)-(6-метокси-2-нафтил)-пропионовой кислоты реакцией 2-(S)-(6-метокси-2-нафтил)-пропионилхлорида с 4 нитрооксибутан-1-олом в метиленхлориде и в присутствии карбоната калия. Полученный сложный эфир имеет энантиомерный избыток (е.е.) больше или равный 97%. Этот способ имеет недостаток, заключающийся в том, что формируется несколько побочных продуктов и фактически очень трудно получить нитроксиалкилспирты в чистом виде и 2-арилпропаноилгалиды высокой химической и энантиомерной чистоты. Кроме того, например, 4-нитрооксибутан-1-ол является стабильным только в растворе и не может быть выделен как чистое вещество. Настоящее изобретение предоставляет новый способ получения нитрооксиалкилэфиров напроксена или бромнапроксена, имеющих энантиомерный избыток такой же высокий, как у исходного напроксена или бромнапроксена, где примеси и побочные продукты присутствуют по существу в незначительном количестве. Следовательно, исходя из энантиомерно чистого напроксена, получают энантиомерно чистые сложные эфиры. Это особенно важно, так как: i) большинство нитрооксиалкилэфиров напроксена являются веществами с низкой точкой плавления или жидкими веществами, следовательно, е.е. полученных неочищенных сложных эфиров не может быть увеличен стандартными физическими способами; ii) отсутствие функциональных групп, не считая эфирную группу, в рассматриваемых молекулах делает очистку проблематичной. Другое преимущество настоящего изобретения заключается в том, что исходные соединения являются стабильными. В способе согласно настоящему изобретению используется в качестве исходного материала соль напроксена и нитрооксиалкилпроизводное, имеющее уходящую группу в виде заместителя в алкильной цепи. Соль напроксена используется в виде соли аммония или соли щелочного металла. Натриевая соль химически и энантиомерно стабильна и является доступной в продаже в отличие от 2-(S)-(6-метокси-2-нафтил)-пропаноилхлорида (хлорида напроксена), который не доступен в продаже в крупном масштабе, химически нестабилен и легко рацемизируется. Также нитрооксиалкилпроизводное является более стабильным по сравнению с соответствующим нитрооксиалкиловым спиртом. Следовательно, оба реагента, вовлеченные в настоящий способ, являются гораздо более стабильными по сравнению с реагентами, упомянутыми в предшествующем уровне техники. Обнаруженная высокая селективность способа была неожиданной из-за присутствия двух заместителей на нитрооксиалкилпроизводном, нитрокси- и уходящей групп, которые, как ожидали, будут конкурировать в реакции замещения солью напроксена с сопутствующей потерей селективности способа. Другое преимущество настоящего изобретения заключается в том, что исходные соединения являются стабильными. Способ согласно настоящему изобретению использует в качестве исходного материала соль напроксена взамен хлорида кислоты в соответствии с предшествующим уровнем техники, в частности натриевую соль, которая является стабильным и доступным в продаже продуктом. Нитрооксиалкилэфиры бромнапроксена являются по существу биологически активными и могут превращаться в соответствующие эфиры напроксена стандартным способом. Настоящее изобретение относится к способу получения соединения общей формулы (А) где R означает
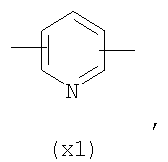
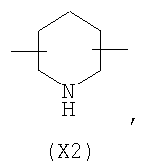
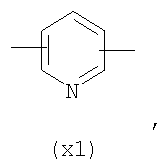
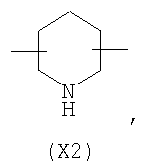
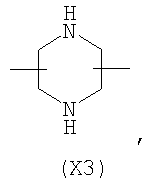
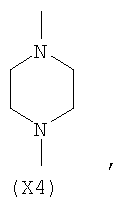
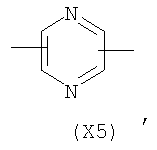
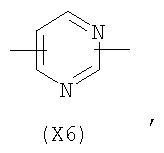
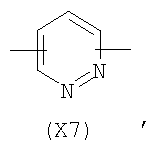
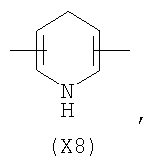
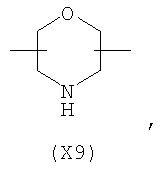
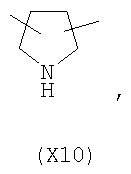
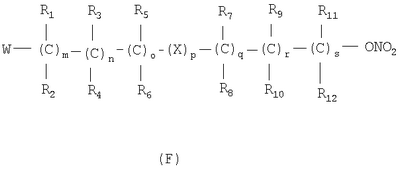
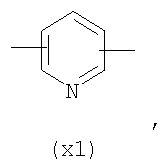
в котором R’ означает атом водорода или Br; R1-R12 являются одинаковыми или различными и независимо означают водород, линейный или разветвленный C1-C6, алкил, необязательно замещенный арилом; m, n, о, q, r и s каждый независимо означает целое число от 0 до 6, и р означает 0 или 1, и Х означает О, S, SO, SO2, NR13 или PR13, в котором R13 означает водород, C1-С6 алкил, или Х выбран из группы, включающей: – циклоалкилен с 5-7 атомами углерода в циклоалкиленовом кольце, при этом кольцо необязательно замещено боковыми цепями Т, где Т означает линейный или разветвленный алкил с 1-10 атомами углерода предпочтительно CH3; – арилен, необязательно замещенный одним или более атомов галогена, линейными или разветвленными алкильными группами, содержащими от 1 до 4 атомов углерода, или линейным или разветвленным C1-С3 перфторалкилом; – 5- или 6-членное насыщенное, ненасыщенное или ароматическое гетероциклическое кольцо, выбранное из
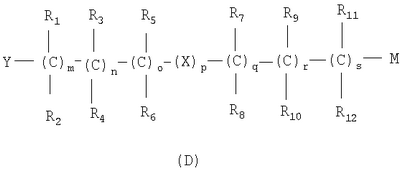
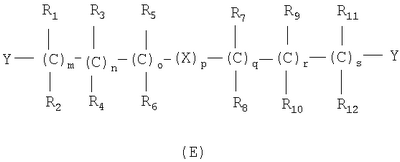
где связи, когда они имеют неопределенное положение, как предполагается, могут находиться в любом возможном положении в кольце; и указанный способ включает i) реакцию соединения формулы (В) R-COOZ (В) где R является таким, как определено выше, и Z означает водород или катион, выбранный из: Li+, Na+, К+, Са++, Mg++, аммония, триалкиламмония, тетраалкиламмония и тетраалкилфосфония; с соединением следующей формулы (С): где R1-R2 и m, n, o, p, q, r, s являются такими, как определены выше, и Y выбран из – атома галогена – -BF4, -SbF6, FSO3-, ClO4-, RASO3-, в котором RA означает линейный или разветвленный C1-C6, алкил, необязательно замещенный одним или более атомов галогена, или C1-С6 алкиларил; – RBCOO–, где RB означает линейный или разветвленный С1-С6 алкил, арил, необязательно замещенный одним или более атомов галогена или NO2 группами, С4-С10 гетероарил и содержащий один или более гетероатомов, которые являются одинаковыми или различными, выбранными из азота, кислорода, серы или фосфора; – арилокси-группы, необязательно замещенной одним или более атомов галогена или NO2 группами, или гетероарилокси-группы, и ii) при необходимости превращение соединения формулы (А), где R’ означает Br, в соединение формулы (А), где R’ означает водород. Предпочтительно настоящее изобретение относится к способу получения соединения формулы А, как определено выше, где заместители R1-R12 являются одинаковыми или различными и независимо означают водород или линейный или разветвленный C1-С3 алкил, m, n, о, р, q, r и s являются такими, как определено выше, Х означает О, S или
Наиболее предпочтительно изобретение относится к способу получения соединения формулы А по пп.1 или 2, где R1-R4 и R7-R10 означают водороды, m, n, q, r означают 1, о и s означают 0, р означает 0 или 1, и Х означает О или S. В соединениях формулы (С) Y предпочтительно выбирают из группы, включающей Br, Cl, I, -BF4, ClO4-, -SbF6, FSO3-, CF3SO3-, С2F5SO3-, С3F7SO3-, С4F9SO3-, р-СН3С6Н4SO3-. Реакцию между соединением формулы (В) и соединением формулы (С) можно проводить в органическом растворителе, выбранном из ацетона, тетрагидрофурана, диметилформамида, N-метилпирролидона, сульфолана и ацетонитрила. Альтернативно, реакцию можно проводить в двухфазной системе, включающей апротонный диполярный растворитель, выбранный из толуола, хлорбензола, нитробензола, трет-бутилметилэфира и водного раствора, где органический раствор содержит (С), а водный раствор содержит (В) в виде соли щелочного металла, в присутствии межфазного катализатора, такого как ониевые соли, например соли тетраалкиламмония и тетраалкилфосфония. Реакцию проводят при температуре в диапазоне от 0 до 100°С и при молярном соотношении (В)/(С) 2-0,5. Соль карбоновой кислоты может быть получена отдельно или может вырабатываться in situ, например, при проведении реакции между (В) и (С) в присутствии стехиометрического количества третичного амина или используя избыточное количество вышеуказанного амина. Соединения формулы (С) могут быть получены нитрованием соединений формулы (D), указанной ниже, нитрующими агентами, выбранными, например, из сульфоазотной смеси и т.п.: где М означает ОН, и Y, X, m, n, о, р, q, r, s и R1-R12 имеют значения, упомянутые выше. Альтернативно, соединения формулы (С) могут быть получены реакцией соединения формулы (Е) с нитрирующими агентами, выбранными, например, из нитратов щелочных металлов, нитратов четвертичного аммония, солей четвертичного фосфония и AgNO3, Zn(NO)2·6H2О: где Y, X, m, n, o, р, q, r, s и R1-R12 имеют значения, указанные выше. Альтернативно, соединения формулы (С) могут быть получены реакцией формулы (F) где W означает ОН или галоген, с соединением, выбранным из сульфонилхлорида алкила и сульфонилхлорида арила, ангидрида трифторметансульфоновой кислоты, когда W означает ОН, или с AgSbF6, AgBF4, AgClCO4, CF3SO3Ag, AgSO3CH3, CH3C6H4SO3Ag, когда W означает галоген. Нитрование соединения (D) проводят в органическом растворителе, как правило, в растворителе, выбранном из ацетона, тетрагидрофурана, диметилформамида, N-метилпирролидона, сульфолана, ацетонитрила, метиленхлорида и т.д., с нитрирующими агентами, выбранными из солей переходных металлов или, когда М означает ОН, с нитрирующими системами, основанными на азотной кислоте, такой как сульфоазотная смесь. Молярное соотношение (D)/нитрирующий агент составляет от 2 до 0,5, в частности от 1,5 до 0,5, и нитрование проводят при температуре от 0 до 100°С, предпочтительно от 15 до 80°С. Реакционный продукт (С) может быть выделен, или его раствор может использоваться как таковой для реакции с субстратом (В) с получением (А). Нитрование соединения (Е) проводят в органическом растворителе, как правило, в растворителе, выбранном из ацетона, тетрагидрофурана, диметилформамида, N-метилпирролидона, сульфолана, ацетонитрила, метиленхлорида и т.д., с нуклеофильными нитрирующими агентами, такими как нитраты щелочного металла, нитраты ониевых солей, например нитрат тетраалкиламмония, тетраалкилфосфония или триалкилфосфония и т.д. Реакцию проводят при температуре от 0 до 100°С, в частности от 15 до 80°С, и молярное соотношение (Е)/нитрирующий агент составляет от 20 до 2, предпочтительно от 8 до 1. Реакционный продукт (С) может быть выделен, или его раствор может использоваться как таковой для реакции с субстратом (В) с получением (А). Реакцию для получения соединения (С) из (F) можно проводить в органическом растворителе, как правило, выбранном из группы, состоящей из ацетона, тетрагидрофурана, диметилформамида, N-метилпирролидона, сульфолана, ацетонитрила, метиленхлорида и т.п., с солями переходных металлов, выбранных из солей серебра, цинка, ртути или, когда W означает ОН, реакцию проводят с хлоридом кислоты, таким как метансульфонилхлорид и т.д., или с подходящим ангидридом, таким как трифторметансульфоновый ангидрид. Реакцию проводят при температуре в диапазоне от -20 до 100°С, в частности от -20 до 60°С, при молярном соотношении (F)/нитрирующий агент от 2 до 0,5, предпочтительно от 1,5 до 0,5. Реакционный продукт (С) может быть выделен, или его раствор может использоваться как таковой для реакции с субстратом (В) с получением (А). Примеры Получение 4-нитрооксибутилбромида согласно Chem. Pharm. Bull., 1993, 41, 1040 Азотную кислоту (90%, 0,8 молей) по каплям добавляют при перемешивании в серную кислоту, поддерживаемую при 0°С (0,8 молей), и смесь перемешивают при 0°С в течение 80 минут. В полученный таким образом раствор, поддерживаемый при 0°С, при перемешивании добавляют по каплям 4-бромбутанол (0,4 молей) и смесь перемешивают опять в течение дополнительных 210 минут при той же температуре. Затем раствор выливают в смесь воды со льдом и экстрагируют дважды диэтиловым эфиром. Эфирные экстракты объединяют вместе и промывают насыщенным раствором бикарбоната натрия. Растворитель выпаривают под вакуумом с получением желтого масла (выход: 84,8%). Пример 1 Получение 4-нитрооксибутил п-толуолсульфоната К раствору 4-бромбутанола (5,0 г, 33 ммолей) в пиридине (50 мл), поддерживаемому при 0°С, при перемешивании и в атмосфере азота добавляют тозилхлорид (6,8 г, 36 ммолей). Полученную смесь поддерживают при перемешивании в течение дополнительных 20 минут и затем оставляют на ночь при -18°С. Реакционную смесь выливают в смесь воды со льдом (около 400 мл) и экстрагируют этиловым эфиром (500 мл). Органическую фазу промывают 6 н. соляной кислотой (500 мл) и высушивают на сульфате натрия. В результате выпаривания растворителя под вакуумом получается маслянистый остаток (7 г). К раствору маслянистого остатка (7 г, 23 ммолей) в ацетонитриле (50 мл) при перемешивании и в атмосфере азота при комнатной температуре добавляют нитрат серебра (7,8 г, 46 ммолей). Через приблизительно 15 минут обнаруживается образование желтого нерастворимого продукта. Гетерогенную смесь поддерживают при перемешивании в течение ночи. Нерастворимый продукт удаляют фильтрацией и раствор выливают в воду (200 мл) и экстрагируют этиловым эфиром (2×250 мл). Объединенные органические экстракты высушивают над сульфатом натрия. Выпаривание растворителя под вакуумом дает маслянистый остаток (5 г). Хроматография остатка на силикагеле (100 г) со смесью гексан/этиловый эфир в качестве элюента дает продукт, указанный в названии примера, (3 г), т.пл. 38-40°С и чистота, определенная посредством ВЭЖХ, выше чем 98%. ИК-спектроскопия с Фурье-преобразованием (FTIR) (твердый KBr, см-1): 2966, 1626, 1355, 1281, 1177, 1097, 959, 876, 815, 663, 553. 300 МГц 1Н-ЯМР (CDCl3) дельта 1,77 (м, 4Н); 2,35 (с, 3Н); 4,06 (м, 2Н); 4,38 (м, 2Н); 7,36 (2Н); 7.7 (2Н). Пример 2 Синтез 4-нитрооксибутилового эфира 2-(S)-(6-метокси-2-нафтил)-пропионовой кислоты KHCO3 (5,22 г, 52 ммолей) добавляют в атмосфере азота к раствору 2-(S)-(6-метокси-2-нафтил)-пропионовой кислоты (напроксен) (99 энантиомерный избыток, определенный хиральной ВЭЖХ) (10,0 г, 43 ммолей) в ДМФ (200 мл). Гетерогенную смесь нагревают до 50-60°С и поддерживают при этой температуре в атмосфере азота при перемешивании магнитной мешалкой в течение 90 мин. Реакционной смеси дают возможность охладиться до комнатной температуры. Иодид калия (2,14 г, 12,9 ммолей) и 4-бромбутинилнитрат (14,48 г, 73 ммоля) добавляют к вышеуказанной смеси и реакционную смесь перемешивают при комнатной температуре в атмосфере азота в течение 25 часов. К реакционной смеси по каплям добавляют воду (200 мл) в течение 5 мин. Смесь экстрагируют t-BuOMe (200 мл), органическую фазу промывают 10% водным раствором NaCl (2×200 мл) и сушат над Na2SO4. Выпаривание растворителя в вакууме дает маслянистый остаток (17,3 г). Хроматография на силикагеле (элюент гексаны/этил ацетат) упомянутого остатка дает 4-(нитроокси)бутиловый эфир 2-(S)-(6-метокси-2-нафтил)-пропионовой кислоты в виде желтого маслянистого соединения (10,8 г, выход 73%, энантиомерный избыток, определенный ВЭЖХ, выше чем 99%). Продукт идентифицируют сравнением с аутентичным образцом. Пример 3 Синтез 4-(нитрокси)бутилового эфира 2-(S)-(6-метокси-2-нафтил)пропионовой кислоты KHCO3 (5,22 г, 52 ммоля) добавляют в атмосфере азота к раствору 2-(S)-(6-метокси-2-нафтил)-пропионовой кислоты (напроксен) (99 энантиомерный избыток, определенный хиральной ВЭЖХ) (10,0 г, 43 ммолей) в ДМФ (200 мл). Гетерогенную смесь нагревают до 50-60°С и поддерживают при этой температуре в атмосфере азота при перемешивании магнитной мешалкой в течение 90 мин. Реакционной смеси дают возможность охладиться до комнатной температуры. 4-(Нитроокси)бутил-4-метилбензолсульфонат (21,1 г, 73 ммоля) добавляют к вышеупомянутой смеси и реакционную смесь перемешивают при комнатной температуре в атмосфере азота в течение 25 часов. За обычной водной обработкой следует хроматография на силикагеле (элюент гексаны/этилацетат) реакционного неочищенного продукта с получением 4-(нитрокси)бутилового эфира 2-(S)-(6-метокси-2-нафтил)-пропионовой кислоты (10,4 г, выход 70%, энантиомерный избыток, определенный ВЭЖХ, выше чем 99%). Пример 4 Синтез 4-(нитрокси)бутилового эфира 2-(S)-(+)-(5-бром-6-метокси-2-нафтил)-пропионовой кислоты Смесь триэтиламина (5,25 г, 52 ммоля), 2-(S)-(5-бром-6-метокси-2-нафтил)-пропионовой кислоты (бром-напроксен) (13,3 г, 43 ммоля, энатиомерный избыток 99%) и 4-бромбутилнитрата (43 ммоля) в ДМФ (120 мл) перемешивают в атмосфере азота в течение 2 дней при 25°С. За удалением ДМФ под вакуумом следует обычная водная обработка с получением неочищенного продукта реакции. Хроматография на силикагеле (элюент гексаны/этилацетат) остатка дает чистый (нитрокси)бутиловый эфир 2-(S)-(5-бром-6-метокси-2-нафтил)-пропионовой кислоты (11,9 г, выход 65%, энантиомерный избыток, определенный ВЭЖХ, выше чем 99%). Продукт идентифицируют спектроскопическими методами.
Формула изобретения
1. Способ получения соединения общей формулы (А) где R означает
в котором R’ означает атом водорода или Br; R1-R12 являются одинаковыми или различными и независимо означают водород, линейный или разветвленный C1-C6, алкил, необязательно замещенный арилом; m, n, о, q, r и s каждый независимо означает целое число от 0 до 6, и р означает 0 или 1; и Х означает О, S, SO, SO2, NR13 или PR13, в котором R13 означает водород, С1-С6алкил, или Х выбран из группы, включающей: циклоалкилен с 5-7 атомами углерода в циклоалкиленовом кольце, при этом кольцо необязательно замещено боковыми цепями Т, где Т означает линейный или разветвленный алкил с 1-10 атомами углерода; арилен, необязательно замещенный одним или более атомов галогена, линейными или разветвленными алкильными группами, содержащими от 1 до 4 атомов углерода, или линейным или разветвленным С1-С3 перфторалкилом; 5- или 6-членное насыщенное, ненасыщенное или ароматическое гетероциклическое кольцо, выбранное из
и указанный способ включает i) реакцию соединения формулы (В) R-COOZ (В), где R является таким, как определено выше, и Z означает водород или катион, выбранный из Li+, Na+, Ca++, Mg++, тетраалкиламмония, тетраалкилфосфония, с соединением следующей формулы (С): где R1-R2 и m, n, о, р, q, r, s являются такими как определены выше, и Y выбран из атома галогена; -BF4, -SbF6, FSO3-, RASO3-, в котором RA означает линейный или разветвленный C1-С6 алкил, необязательно замещенный одним или более атомов галогена, или C1-С6 алкиларил; RBСОО–, где RB означает линейный или разветвленный C1-С6 алкил, арил, необязательно замещенный одним или более атомов галогена или NO2 группами, С4-С10 гетероарил и содержащий один или более гетероатомов, которые являются одинаковыми или различными, выбранными из азота, кислорода, серы или фосфора; арилоксигруппы, необязательно замещенной одним или более атомов галогена или NO2 группами, или гетероарилоксигруппы, и ii) при необходимости превращение соединения формулы (А), где R’ означает Br, в соединение формулы (А), где R’ означает водород. 2. Способ получения соединения формулы А по п.1, в котором заместители R1-R12 являются одинаковыми или различными и независимо означают водород или линейный или разветвленный C1-С3 алкил, m, n, о, р, q, r и s являются такими как определено выше, Х означает О, S или
3. Способ получения соединения формулы А по п.1, в котором R1-R4 и R7-R10 означают водороды, m, n, q, r означают 1, о и s означают 0, р означает 0 или 1, и Х означает О или S. 4. Способ получения соединения формулы А по п.1, в котором Y выбирают из группы, включающей Br, Cl, I, -Br4, -SbF6, FSO3-, CIO4-, CF3SO3-, С2F5SO3-, С3F7SO3-, С4F9SO3-, р-СН3С6Н4SO3-. 5. Способ получения соединения формулы А по п.1, в котором реакцию проводят в органическом растворителе, выбранном из ацетона, тетрагидрофурана, диметилформамида, N-метилпирролидона, сульфолана и ацетонитрила. 6. Способ получения соединения формулы А по любому из п.1, в котором реакцию проводят в двухфазной системе, включающей апротонный диполярный растворитель, выбранный из толуола, хлорбензола, нитробензола, трет-бутилметилэфира и водного раствора, где органический раствор содержит (С), а водный раствор содержит (В) в виде соли щелочного металла, в присутствии межфазного катализатора. 7. Способ получения соединения формулы А по п.1, в котором реакцию проводят при температуре в диапазоне от 0 до 100°С. 8. Способ получения соединения формулы А по п.1, в котором соединения формулы В и С реагируют при молярном соотношении (В)/(С) 2-0,5. 9. 4-(Нитроокси)бутиловый эфир 2-(S)-(5-бром-6-метокси-2-нафтил)-пропионовой кислоты.
|
||||||||||||||||||||||||||