|
|
(21), (22) Заявка: 2006116457/02, 12.05.2006
(24) Дата начала отсчета срока действия патента:
12.05.2006
(46) Опубликовано: 20.12.2007
(56) Список документов, цитированных в отчете о
поиске:
SU 1202291 A1, 20.12.1995. SU 829726, 25.05.1981. RU 2230135 С1, 10.06.2004. SU 967053 Al, 30.08.1983.
Адрес для переписки:
236041, г.Калининград, ул. А. Невского, 14, РГУ им. И. Канта, УНИР
|
(72) Автор(ы):
Белоглазов Сергей Михайлович (RU),
Мямина Мария Алексеевна (RU),
Живописцев Виктор Петрович (RU)
(73) Патентообладатель(и):
Российский государственный университет имени Иммануила Канта (РГУ им. И. Канта) (RU)
|
(54) ИНГИБИТОР МИКРОБИОЛОГИЧЕСКОЙ КОРРОЗИИ КАДМИРОВАННОЙ СТАЛИ
(57) Реферат:
Изобретение относится к защите от коррозии деталей машин, конструкций и сооружений из кадмированных углеродистых и низколегированных сталей, которые контактируют с водными растворами солей, кислот, сточными водами, морской водой, увлажненными почвами. В качестве ингибитора коррозии кадмированной в его присутствии стали в водно-солевой среде, содержащей сульфатредуцирующие бактерии, применяют производное антипирина общей формулы:
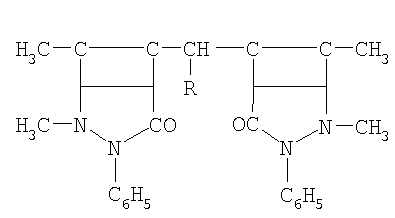
где R: -Н; -СН3; -С2Н5; -С3Н7; -С4Н9; -С5Н11; -С6Н5; -С6Н13. Технический результат: повышение коррозионной стойкости стали с кадмиевым покрытием, с включенным в него в процессе электроосаждения производным антипирина, к воздействию сульфатредуцирующих бактерий в водно-солевой среде. 9 табл.
Изобретение относится к защите деталей, машин, конструкций и сооружений из кадмированных углеродистых и низколегированных сталей, которые по условиям эксплуатации контактируют с водными растворами солей, кислот, с промышленными и хозяйственно-бытовыми сточными водами, морской водой, а также увлажненными почвами. В этих случаях на поверхности стали с Cd-покрытием часто складываются анаэробные условия, способствующие развитию сульфатредуцирующих бактерий (СРБ). Специфичность коррозионной среды, формируемой при участии СРБ состоит в том, что они выделяют в нее сероводород и органические кислоты. Эти продукты метаболизма СРБ сильно ускоряют коррозионное разрушение как тонкого электрохимически нанесенного Cd – покрытия, так и стали после ее обнажения хотя бы на отдельных участках поверхности, а сероводород является к тому же еще и сильным стимулятором абсорбции водорода сталью, приводящей к выраженному проявлению водородной хрупкости стали, которая проявляется тем сильнее, чем больше содержание углерода в ней, то есть чем выше уровень прочности стали.
Из описания к патенту РФ №2279455 известно «Применение МоО3 в качестве ингибитора коррозии и композиции для покрытия, содержащие такой ингибитор коррозии», МПК C09D 5/08, заявл. 2001.11.12, опубл. 2004.12.10. Данный ингибитор применяют в качестве агента для усиления антикоррозионных свойств композиции для антикоррозионного покрытия на основе дисперсного металла. По мнению авторов, подобный ингибитор позволяет улучшить стойкость композиции к воздействию солевого тумана.
Однако данный ингибитор недостаточно эффективен в водонефтяных средах, содержащих сероводород.
Наиболее близким к предложенному изобретению по технической сущности и достигаемому результату является ингибитор коррозии в водонефтяных сероводородсодержащих средах, включающий смесь производных карбоновых кислот [авт. свид. №1202291, МКИ С23F 11/00, 1995 г.]. Однако данный известный ингибитор не предохраняет сталь от водородного охрупчивания, возникающего при абсорбции водорода приповерхностными слоями металла.
Целью данного изобретения является применение ингибитора коррозии, сочетающего в себе свойства биоцида и ингибитора наводороживания стали одновременно.
Указанная цель достигается тем, что в качестве ингибиторов коррозии кадмированной, в их присутствии, стали в водно-солевой среде, содержащей сульфатредуцирущие бактерии применяются производные антипирина, включенные в электроосадок кадмия, общей формулы:
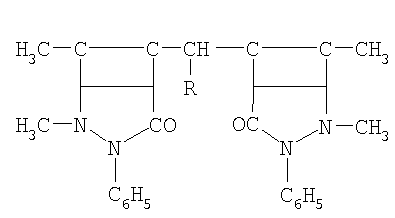
где R: -Н; -СН3; -С2Н5; -С3Н7; -С4Н9; -С5Н11; -С6Н5; -С6Н13.
Технический результат – улучшение коррозионной стойкости стали с кадмиевым покрытием, с включенными в него в процессе электроосаждения производными антипирина, к воздействию сульфатредуцирующих бактерий в водно-солевой среде.
Для исследования ингибирующего коррозию действия были выбраны соединения – производные антипирина (таблица 1). Антипирин является производным гетероциклического соединения – пиразола. Несмотря на наличие пятичленного кольца с двумя атомами азота, пиразол и его гомологи относятся к высокопрочным соединениям.
Диантипирилметан-4,4′-метилен-бис-(1,2-дигидро-1,5-диметил-2-фенил-3-пиразолон) (ДАМ) – типичное слабое двухосновное основание. Реакция протона с ДАМ даже в слабокислой среде касается обеих карбонильных групп. Образует комплексы со многими металлами состава: [MeDAMn]Xm, а также ионные
Таблица 1
Органические соединения, исследованные в качестве ингибиторов микробиологической коррозии кадмированной в разных режимах стали |
| № |
Название |
Формула соединения |
| 1 |
ДАМ-диантипирилметан |
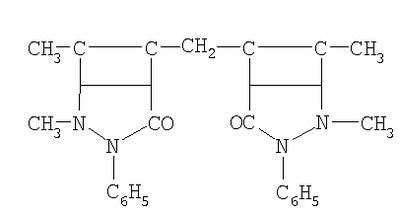 |
| 2 |
ГДАМ-гексилдиантипирилметан |
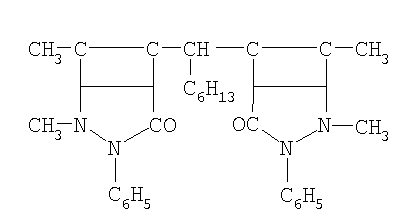 |
| 3 |
ФДАМ-фенилдиантипирилметан |
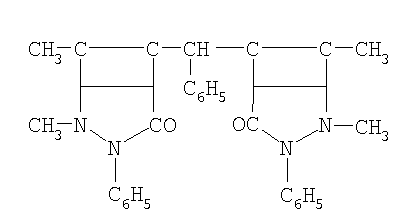 |
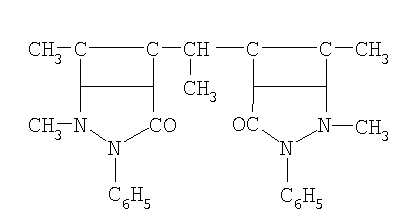
| 4 |
МДАМ метилдиантипирилметан |
 |
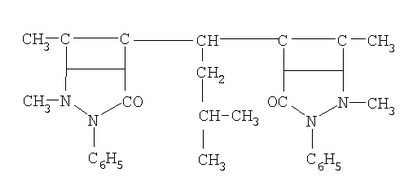
| 5 |
ИБДАМ-изобутилдиантипирилметан |
 |
ассоциаты (DAMH)n-m[MeX]n, где Me – металл, X – однозарядный анион, m – степень окисления металла. Высокая эффективность предлагаемого ингибитора подтверждается следующим образом: при использовании производных диантипирилметана в качестве ингибитора коррозии и наводороживания стали в водно-солевых средах имеет место образование адсорбционных связей между молекулами ингибитора и поверхностными атомами Cd-покрытия и Fe-стали, которое носит хемосорбционный характер и сила этой связи зависит от электронной плотности на гетероатомах молекулы, а также от взаимодействия  -электронов ароматических колец с металлической поверхностью. -электронов ароматических колец с металлической поверхностью.
Кроме того, заявленные органические соединения в кислых средах ведут себя как катионактивные. При попадании в водно-солевую среду в результате разрушения Cd-покрытия они частично (в большей или меньшей степени – в зависимости от рН среды и рК-соединения) диссоциируют с образованием органических катионов. Поверхность углеродистых сталей в коррозионной среде, формирующейся в результате жизнедеятельности СРБ, из-за образования сульфидных мостиков приобретает обычно отрицательный заряд. Это создает предпосылки для электростатического взаимодействия (электросорбции) частиц ингибитора в катионной форме с поверхностью стали, обнажающейся после растворения Cd-покрытия с анодных участков локальных коррозионных элементов.
Синтез азотсодержащего соединения (диантипирилметана) осуществляют следующим образом: 500 г антипирина растворяют в 1 л 0.1 М серной кислоты, приливают 250 мл 35-40%-ного раствора формалина (профильтрованного через бумажный фильтр) и нагревают прикрытый часовым стеклом стакан на водяной бане (таблица 2). После начала выделения кристаллов продолжают нагревание еще 30-40 мин, затем охлаждают реакционную смесь и отфильтровывают выделившийся продукт на воронке Бюхнера. После промывки водой осадок отжимают и для более полной очистки, в основном, от формалина переносят в стакан, заливают 800-900 мл дистиллированной воды, добавляют 4-5 мл концентрированного раствора аммиака и нагревают на водяной бане при периодическом перемешивании в течение 2 часов. После охлаждения и фильтрования обработку дистиллированной водой, но без добавления аммиака повторяют, нагревая на водяной бане 2 часа. Отфильтрованный, промытый еще раз на воронке Бюхнера водой и тщательно отжатый реагент высушивают на воздухе или в термостате при 80-90°С. Для ускорения высушивания можно пропустить через находящийся на воронке реагент небольшую порцию диэтилового эфира. Полученный продукт обычно не требует дополнительной очистки и может быть применен в анализе. Выход количественный. В некоторых случаях при высушивании в термостате или длительном хранении (особенно, если в атмосфере содержится значительное количество диоксида серы) реагент может слегка пожелтеть. В этом случае его следует растворить в 0.25 М растворе серной кислоты, снова осадить разбавленным аммиаком и повторить операцию очистки (нагревание с водой и фильтрование).
Таблица 2
Условия синтеза различных R-диантипирилметанов |
| Реагент |
Альдегид |
Среда для синтеза |
Кислотность |
Тпл., °С |
| Диантипирилметан |
Формалин |
Водная |
0.1M H2SO4 |
179-180 |
| МетилДАМ |
Уксусный |
Водная |
0.5 М HCl |
153 |
| ЭтилДАМ |
Пропионовый |
Водная |
0.025 М H2SO4 |
152 |
| ПропилДАМ |
Масляный |
Водная |
0.025 М H2SO4 |
164-165 |
Для испытания заявляемых соединений в качестве коррозионной среды использовали водно-солевую среду, обеспечивающую как интенсивное развитие СРБ, так и высокую скорость коррозионного разрушения Cd-покрытия и стальной основы (таблица 3).
Таблица 3
Состав коррозионной среды |
| №, п/п |
Название соединения |
Количество, г/л |
| 1 |
Хлорид натрия |
7.5 |
| 2 |
Сульфат магния |
1.0 |
| 3 |
Сульфат натрия |
2.0 |
| 4 |
Карбонат натрия |
1.0 |
| 5 |
Дигидроортофосфат натоия |
0.5 |
| 6 |
Лактат кальция |
2.0 |
СРБ являются анаэробной культурой, то есть растворенный в среде кислород вызывает переход бактериальных клеток в латентное состояние. Для устранения посторонней микрофлоры и создания анаэробных условий, необходимых для жизнедеятельности СРБ, среду стерилизовали кипячением, затем инокулировали накопительной культурой СРБ, полученной многократным пересевом пробы, отобранной из природного источника. Сульфатредуцирующие бактерии были культивированы в виде чистой культуры на среде Постгейта «Б». В момент загрузки образцов 1 мл такой среды содержал 3,9·107 клеток сульфатредуцирующих бактерий рода Desulfovibrio.
В предварительно простерилизованные при Т=433К в течение 1,5 ч стеклянные пробирки с 100 мл коррозионной среды и 2 мл чистой культуры сначала помещали плоские образцы 50×20×1,5 мм стали марки Ст.3. Образцы перед внесением в среду шлифовали тонкой шкуркой на полотне, обезжиривали ацетоном, облучали под ртутно-кварцевой лампой ОКН-11 по 10 мин с каждой стороны. Пробирки плотно закрывали стерилизованными резиновыми пробками и выдерживали в термостате при 310К. На вторые сутки с начала эксперимента (что было достаточно для увеличения численности клеток СРБ) образцы из стали заменяли на стальные образцы с Cd-покрытием, полученным в результате электроосаждения в сульфатном электролите кадмирования в присутствии заявляемых веществ. Кадмирование проводилось без перемешивания при комнатной температуре и плотностях тока 1,0; 2,0 и 3,0 А/дм2 в сернокислом электролите следующего состава:
| CdSO4·8/3H2O |
«ч» ГОСТ 4456-56 |
50 г/л |
| H2SO4 |
«х. ч.» ГОСТ 4204-66 |
50 г/л |
| Na2SO4·10H2O |
«ч» ГОСТ 6318-68 |
50 г/л |
Для приготовления электролита растворяли отдельно каждое вещество в дистиллированной воде в концентрациях 1,0; 2,0 и 5,0 мМоль/л. Перед началом электролиза электролит прорабатывали 4 ч для удаления примесей других металлов.
Коррозионные процессы изучали гравиметрическим, потенциометрическим и потенциостатическим методами.
Подсчет числа клеток сульфатредукторов производился под микроскопом «БИОЛАМ ЛОМО», снабженным фазовоконтрастным устройством ФК-2 в камере Горяева для определения титра бактерий, по которому можно судить о жизнедеятельности изучаемых организмов.
Общее число бактерий в единице объема коррозионной среды (бактериальный титр) определяли по формуле:

где  – среднее число клеток в квадрате камеры Горяева; – среднее число клеток в квадрате камеры Горяева;
n – глубина камеры (0,1 мм);
S – площадь квадрата сетки в камере (1/400 мм2).
Ежедневно проводили измерения редокс-потенциала с Pt-электродом, рН коррозионной среды со стеклянным электродом и электродного потенциала стального образца на универсальном иономере ЭВ-74.
Цикл развития сульфатредуцирующих бактерий составляет 8 сут. Поэтому по истечении 7 сут образцы извлекали из коррозионной среды, отмывали жесткой щеткой от продуктов коррозии и взвешивали. Скорость коррозии измеряли гравиметрически, определяя потерю массы  m на каждом из трех образцов в параллельных опытах. m на каждом из трех образцов в параллельных опытах.
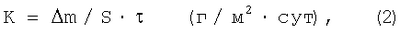
где  m – изменение массы образца, г; m – изменение массы образца, г;
S – поверхность образца, м2 (1×10-3м2);
 – время проведения опыта, сутки (7 сут). – время проведения опыта, сутки (7 сут).
Результаты измерений в трех параллельных опытах усредняли.
Защитный ингибирующий эффект органических добавок определяли по формуле:
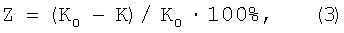
где К0 – скорость коррозии в среде без ингибитора;
К – скорость коррозии в присутствии ингибитора.
В процессе развития сульфатредуцирующих бактерий происходило выделение в коррозионную среду биогенного сероводорода, который взаимодействовал с кадмиевым покрытием образцов, осажденным в сульфатном электролите кадмирования в присутствии заявляемых соединений, с образованием сульфидов кадмия и железа. Сначала на поверхности образца появлялся осадок сульфидов кадмия и железа, наблюдалось помутнение среды, затем можно было обнаружить налет продуктов коррозии на стенках пробирки и на ее дне, что особенно проявлялось на 4 сут эксперимента. Затем в коррозионной среде происходила флокуляция сульфидов и некоторое просветление раствора. При неизменной температуре (37°С) на 6-7 сут среда становилась почти прозрачной, на дне пробирок появлялся осадок из продуктов коррозии и отмерших клеток СРБ, что свидетельствовало об истощении питательной среды и гибели культуры СРБ.
Биогенный сероводород определяли каждые сутки методом осадительного йодометрического титрования.
При выполнении эксперимента соблюдали необходимые способы предосторожности для сохранения сероводорода в коррозионной среде: минимальное время взятия пробы, плотно закрытые пробки. Перед началом титрования для определения концентрации сероводорода после тщательного перемешивания среды отбирали пробу объемом 5 мл, проводили осаждение ацетатом свинца (II). Отфильтрованный и промытый горячей водой осадок помещали в колбу с 25 мл 0,05 н. раствора йода, подкисленного серной кислотой, и титровали 0,05 н. раствором тиосульфата натрия до характерного цвета. Концентрацию биогенного сероводорода определяли по формуле:
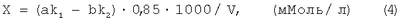
где а – объем прибавленного раствора йода, мл;
b – объем раствора тиосульфата, мл;
V – объем пробы исследуемого раствора, мл;
k1 – поправочный коэффициент для приведения концентрации йода к 0,05 н.;
k2 – поправочный коэффициент для приведения концентрации раствора тиосульфата натрия к 0,05 н.
Наблюдения за жизнедеятельностью СРБ вели путем ежедневного подсчета под микроскопом в фазовом контрасте численности микроорганизмов с помощью камеры Горяева. Концентрацию сульфатного остатка определяли йодометрическим титрованием по калибровочному графику. Величины рН и редокс-потенциала сред определяли потенциометрически.
Обезжиренные и облученные ртутно-кварцевой лампой стальные образцы с Cd-покрытием, полученным в процессе формирования электроосадка в сульфатном электролите кадмирования в присутствии заявляемых веществ вводили в коррозионную среду спустя 48 ч после инокуляции культурой СРБ, необходимых для их развития в коррозионной среде, и сразу же снимали первые показания физико-химических параметров: электродного потенциала поверхности образца, окислительно-восстановительного потенциала и водородного показателя рН коррозионной среды, концентрации биогенного сероводорода, количества бактериальных клеток (бактериальный титр).
Значения электродного потенциала ( ) стального образца с Cd-покрытиями (таблица 4), электроосажденными в присутствии всех заявляемых органических соединений, на 4-е сут эксперимента смещаются в сторону более положительных значений. Наибольшее облагораживание ) стального образца с Cd-покрытиями (таблица 4), электроосажденными в присутствии всех заявляемых органических соединений, на 4-е сут эксперимента смещаются в сторону более положительных значений. Наибольшее облагораживание  наблюдается в присутствии соединения 5, введенного в электролит в процессе осаждения кадмия при плотности катодного тока Дк=1 А/дм2 (таблица 4). Наименьший сдвиг значений наблюдается в присутствии соединения 5, введенного в электролит в процессе осаждения кадмия при плотности катодного тока Дк=1 А/дм2 (таблица 4). Наименьший сдвиг значений  вызвало соединение 1, введенное в электролит в процессе осаждения кадмия при Дк=3 А/дм2. вызвало соединение 1, введенное в электролит в процессе осаждения кадмия при Дк=3 А/дм2.
Таблица 4
Величина электродного потенциала в коррозионной среде образцов, полученных из электролитов с различной концентрацией заявляемых соединений при трех Дк (экспозиция 96 ч) |
| Соединение |
Дк, А/дм2 |
Электродный потенциал стали с Cd-покрытием, мВ, при концентрациях соединений в электролите кадмирования, мМоль/л |
| 1.0 |
2.0 |
5.0 |
| 1 |
1 |
-397 |
-379 |
-373 |
| 2 |
-416 |
-401 |
-394 |
| 3 |
-422 |
-416 |
-410 |
| 2 |
1 |
-392 |
-373 |
-367 |
| 2 |
-409 |
-397 |
-391 |
| 3 |
-414 |
-409 |
-403 |
| 3 |
1 |
-389 |
-369 |
-361 |
| 2 |
-405 |
-394 |
-386 |
| 3 |
-409 |
-405 |
-397 |
| 4 |
1 |
-384 |
-363 |
-355 |
| 2 |
-399 |
-390 |
-383 |
| 3 |
-402 |
-399 |
-392 |
| 5 |
1 |
-379 |
-359 |
-347 |
| 2 |
-392 |
-385 |
-379 |
| |
3 |
-397 |
-392 |
-384 |
На 3-4 сут эксперимента наблюдалось смещение окислительно-восстановительного потенциала ( h) в сторону более положительных значений по сравнению с контрольной серией. Причем сдвиг h) в сторону более положительных значений по сравнению с контрольной серией. Причем сдвиг  h был тем сильнее, чем больше концентрация заявляемых веществ была в электролите электроосаждения кадмия. Наибольший сдвиг 8h наблюдался в присутствии соединения 5, вводимого в электролит в процессе осаждения при Дк=1 А/дм2, а наименьший – при введении соединения 1, введенного в электролит в процессе осаждения при Дк=3 А/дм2 (таблица 4а). В присутствии в коррозионной среде всех заявляемых органических веществ, переходящих в нее в результате коррозионного разрушения Cd, в последние сутки жизненного цикла микроорганизмов значения h был тем сильнее, чем больше концентрация заявляемых веществ была в электролите электроосаждения кадмия. Наибольший сдвиг 8h наблюдался в присутствии соединения 5, вводимого в электролит в процессе осаждения при Дк=1 А/дм2, а наименьший – при введении соединения 1, введенного в электролит в процессе осаждения при Дк=3 А/дм2 (таблица 4а). В присутствии в коррозионной среде всех заявляемых органических веществ, переходящих в нее в результате коррозионного разрушения Cd, в последние сутки жизненного цикла микроорганизмов значения  h незначительно смещаются в сторону более отрицательных значений. h незначительно смещаются в сторону более отрицательных значений.
Таблица 4a.
Окислительно-восстановительный потенциал коррозионной среды при коррозии кадмированной в электролите с заявляемыми соединениями стали (экспозиция 96 ч) |
| Соединение |
Дк, А/дм2 |
Редокс-потенциал среды, мВ, при различных концентрациях соединений в электролите кадмирования, мМоль/л |
| 1.0 |
2.0 |
5.0 |
| 1 |
1 |
218,7 |
152,7 |
109 |
| 2 |
236 |
191 |
137 |
| 3 |
245 |
208 |
154 |
| 2 |
1 |
207 |
141 |
99 |
| 2 |
229 |
184 |
127 |
| 3 |
240 |
191 |
145 |
| |
1 |
201 |
132 |
86 |
| 3 |
2 |
221 |
177 |
119 |
| 3 |
235 |
183 |
137 |
| 4 |
1 |
195 |
122 |
75 |
| 2 |
215 |
169 |
112 |
| 3 |
232 |
174 |
129 |
| 5 |
1 |
187 |
112 |
66 |
| 2 |
207 |
161 |
104 |
| 3 |
228 |
161 |
123 |
Вводимые в коррозионную среду образцы (таблица 5) со встроенными в осадок Cd исследуемыми органическими соединениями приводят к смещению рН среды в сторону менее кислых значений по сравнению с контрольной серией.
Таблица 5
Водородный показатель коррозионной среды после 96 ч экспозиции стальных образцов, кадмировавшихся при трех плотностях тока в электролите с исследуемыми соединениями в трех концентрациях |
| Соединение |
Дк, А/дм2 |
рН среды Постгейта «Б» при концентрациях исследуемых соединений в электролите кадмирования, мМоль/л |
| 1.0 |
2.0 |
5.0 |
| 1 |
1 |
5,66 |
5,75 |
5,77 |
| 2 |
5,55 |
5,61 |
5,57 |
| 3 |
5,33 |
5,36 |
5,36 |
| |
1 |
5,67 |
5,78 |
5,81 |
| 2 |
2 |
5,58 |
5,64 |
5,59 |
| 3 |
5,36 |
5,39 |
5,39 |
| 3 |
1 |
5,69 |
5,82 |
5,84 |
| 2 |
5,60 |
5,69 |
5,63 |
| 3 |
5,39 |
5,44 |
5,43 |
| 4 |
1 |
5,72 |
5,85 |
5,87 |
| 2 |
5,62 |
5,74 |
5,63 |
| 3 |
5,42 |
5,47 |
5,46 |
| 5 |
1 |
5,75 |
5,89 |
5,90 |
| 2 |
5,63 |
5,80 |
5,69 |
| 3 |
5,45 |
5,50 |
5,49 |
При этом сдвиг рН уменьшается при уменьшении плотности катодного тока в процессе осаждения кадмия с введенными в электролит органическими веществами и увеличением концентрации вводимого органического соединения. Наименьшее смещение значений водородного показателя на 4 сут эксперимента в сторону кислых значений наблюдается при введении в коррозионную среду стальных образцов с Cd-покрытиями, полученными при Дк=1 А/дм2. Так соединение 5 вызывает смещение рН коррозионной среды до 5,75 (при С=1,0 мМоль/л) и до 5,89-5,90 (при С=2,0 и 5,0 мМоль/л), а добавка 1 до 5,66 (при С=1,0 мМоль/л) и до 5,77 (при С=5,0 мМоль/л) – таблица 5.
На 3-4 сут эксперимента в стерильной среде наблюдался “всплеск” численности СРБ. В пробах с заявляемыми соединениями, наоборот, уже через 1 сут после введения исследуемых веществ численность клеток резко уменьшалась.
Таблица 6
Количество микробных клеток в коррозионной среде в зависимости от концентрации заявляемых соединений в электролите для осаждения Cd в конце экспозиции (96 ч) |
| Соединение |
Дк, А/дм2 |
Количество микробных клеток, ед·10-7л-1, при концентрациях исследуемых органических соединений в электролите кадмирования, мМоль/л |
| 1.0 |
2.0 |
5.0 |
| 1 |
1 |
163 |
156 |
147 |
| 2 |
167 |
163 |
158 |
| 3 |
172 |
167 |
163 |
| 2 |
1 |
157 |
149 |
136 |
| 2 |
162 |
157 |
150 |
| 3 |
180 |
172 |
169 |
| 3 |
1 |
147 |
138 |
127 |
| 2 |
155 |
147 |
140 |
| 3 |
170 |
162 |
157 |
| 4 |
1 |
138 |
129 |
119 |
| 2 |
143 |
138 |
129 |
| 3 |
160 |
152 |
146 |
| 5 |
1 |
129 |
118 |
106 |
| 2 |
136 |
129 |
119 |
| 3 |
150 |
140 |
135 |
Спустя 48 ч экспозиции наблюдалось незначительное увеличение количества клеток СРБ, что связано со способностью бактерий приспосабливаться к измененным условиям среды. Затем по мере истощения питательных свойств среды численность СРБ снижалась монотонно. Соединения 5 и 4 вызывают большее уменьшение численности микроорганизмов (таблица 6).
Таблица 7
Изменение содержания сероводорода в среде после экспозиции образцов, кадмированных в электролите с органическими соединениями (экспозиция 96 ч) |
| Соединение |
Дк, А/дм2 |
Содержание сероводорода, мг/л, при концентрациях соединений в электролите кадмирования, мМоль/л |
| 1.0 |
2.0 |
5.0 |
| 1 |
1 |
14,4 |
10,6 |
9,2 |
| 2 |
15,7 |
14,0 |
11,9 |
| 3 |
21,0 |
18,9 |
16,7 |
| 2 |
1 |
12,6 |
9,4 |
8,0 |
| 2 |
14,8 |
12,6 |
10,4 |
| 3 |
19,6 |
17,8 |
15,7 |
| 3 |
1 |
10,7 |
8,1 |
6,8 |
| 2 |
13,5 |
11,4 |
9,7 |
| 3 |
18,6 |
16,1 |
14,5 |
| 4 |
1 |
9,0 |
6,3 |
5,3 |
| 2 |
12,3 |
10,3 |
8,3 |
| 3 |
16,9 |
14,6 |
13,1 |
| |
1 |
7,7 |
4,5 |
4,2 |
| 5 |
2 |
10,7 |
9,3 |
7,0 |
| 3 |
15,2 |
13,5 |
11,7 |
На вторые сутки экспозиции в коррозионной среде кадмированных стальных образцов, полученных из электролита с добавками заявляемых соединений – производных антипирина, наблюдали уменьшение в ней основного метаболита бактерий – сероводорода. По мере завершения жизненного цикла СРБ, концентрация сероводорода в среде принимает относительно постоянное значение. Соединение 5 вызвало наибольшее снижение концентрации сероводорода в коррозионной среде (таблица 7). Из таблицы 8, приведенной ниже, видно, что скорость коррозии кадмированной в присутствии заявляемых веществ стали монотонно снижается с увеличением концентрации вводимых в электролит кадмирования органических соединений, достигая довольно небольших значений. Образец, кадмированный в присутствии соединения 5, имел наименьшую скорость коррозии, что соответствует его действию на рН,  h, CH2S, nкл. h, CH2S, nкл.
Таблица 8
Величины скорости коррозии кадмированной стали и защитного эффекта встроенных в Cd-покрытие органических добавок в зависимости от их концентрации в сульфатном электролите кадмирования |
| Органическое соединение – добавка при кадмировании |
Концентрация в электролите кадмирования, мМоль/л |
Скорость коррозии, г/м2·сут |
Защитный эффект, % |
| Кадмирование при Дк, А/дм2 |
Кадмирование при Дк, А/дм2 |
| 1 |
2 |
3 |
1 |
2 |
3 |
| |
0 |
0,37 |
0,39 |
0,41 |
0 |
0 |
0 |
| 1 |
1
2
5 |
0,08
0,07
0,06 |
0,16
0,13
0,13 |
0,23
0,19
0,18 |
78
81
84 |
59
67
67 |
44
54
56 |
| 2 |
1 |
0,08 |
0,14 |
0,22 |
78 |
64 |
46 |
| |
2 |
0,06 |
0,12 |
0,17 |
84 |
69 |
58 |
| |
5 |
0,06 |
0,12 |
0,17 |
84 |
69 |
58 |
| 3 |
1 |
0,07 |
0,14 |
0,20 |
81 |
64 |
51 |
| |
2 |
0,05 |
0,12 |
0,15 |
86 |
69 |
63 |
| |
5 |
0,05 |
0,11 |
0,15 |
86 |
72 |
63 |
| 4 |
1 |
0,06 |
0,13 |
0,18 |
84 |
67 |
56 |
| |
2 |
0,04 |
0,11 |
0,14 |
89 |
72 |
66 |
| |
5 |
0,04 |
0,10 |
0,14 |
89 |
74 |
66 |
| 5 |
1 |
0,06 |
0,12 |
0,16 |
84 |
69 |
61 |
| |
2 |
0,04 |
0,10 |
0,12 |
89 |
74 |
71 |
| |
5 |
0,04 |
0,09 |
0,13 |
89 |
77 |
68 |
По степени защиты кадмированной стали от коррозии описываемые производные антипирина можно расположить в ряд: №5>№4>№3>№2>№1. Соединения 5 и 4 обладают наилучшими из описываемых заявляемых веществ ингибирующими коррозию Cd-стали и биоцидными свойствами.
Соединение 5 отличалось от остальных заявляемых соединений также по действию на электродный потенциал при выделении кадмия на катоде, которое было наиболее интенсивным. Это связано с появлением у молекул этого соединения наибольшей способности к адсорбции на поверхности металла катода (сталь, кадмий) в процессе электроосаждения, повлекшей за собой наибольшее среди исследуемых органических соединений включение (по массе органического вещества) в растущий электроосадок кадмия. Кроме того, повышенная адсорбционная способность соединения 5 на металле катода повлекла за собой и большее ингибирование коррозии кадмированной стали (таблица 8), поскольку ингибирование коррозии, протекающей по электрохимическому механизму, происходит, имея обязательную стадию – адсорбцию молекул органического соединения на поверхности корродирующего металла. Повышенная адсорбционная способность соединения 5 объясняется наличием в молекуле этого соединения электронодонорной группы (изобутил), связанной с центральным атомом С, что должно приводить к увеличению электронной плотности на всех гетероатомах N и обоих карбонильных атомах О. Таким образом, устанавливающиеся хемосорбционные связи молекул соединения 5 с атомами Fe и Cd, находящимися на поверхности, обеспечивают эффективное экранирование большой поверхности металла от коррозионной среды, достаточное для торможения как анодного (ионизация металла), так и катодного (разряд Н3О+) процессов.
Заявляемые соединения проявляют также биоцидное действие на СРБ (таблица 6), особенно сильно выраженное у соединения 5, и в меньшей степени у соединения 1. Биоцидное действие соединений имеет своим следствием и подавление сероводородогенеза в коррозионной среде, инокулированной СРБ рода Desulfovibrio.
Из представленных данных в таблицах 5-8 видно также, что наибольший полезный эффект оказывают заявляемые соединения, будучи встроенными в электроосадки Cd из сульфатного электролита, формируемые при меньшей катодной плотности тока (1 А/дм2), которая фактически и применяется на отечественных машиностроительных, судостроительных, авиамоторных и радиотехнических заводах при кадмировании многочисленного ассортимента изделий.
Формула изобретения
Применение производного антипирина общей формулы
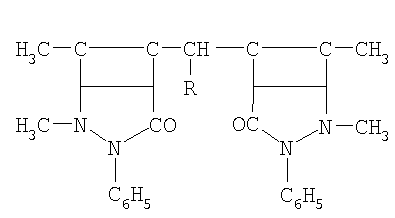
где R – -Н; -СН3; -С2Н5; -С3Н7; -С4Н9; -С5Н11; -С6Н5; -С6Н13,
в качестве ингибитора коррозии кадмированной в его присутствии стали в вводно-солевой среде, содержащей сульфатредуцирующие бактерии.
MM4A – Досрочное прекращение действия патента СССР или патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 13.05.2008
Извещение опубликовано: 20.02.2010 БИ: 05/2010
|
|