|
|
(21), (22) Заявка: 2004119961/15, 04.12.2002
(24) Дата начала отсчета срока действия патента:
04.12.2002
(30) Конвенционный приоритет:
04.12.2001 (пп.1-20) US 60/337,113
(43) Дата публикации заявки: 20.04.2005
(46) Опубликовано: 20.12.2007
(15) Информация о коррекции:
Версия коррекции № 1 (W1 C2)
(48) Коррекция опубликована:
27.03.2008 Бюл. № 20089
(56) Список документов, цитированных в отчете о
поиске:
US 5116964 A, 26.05.1992. реф. PFLANZ S. et al. A fusion protein of interleukin-11 and soluble interleukin-11 receptor acts as a superagonist on cells expressing gp130. FEBS Lett. 1999; 450(1-2): 117-22. RU 2114119 C1, 27.06.1997. RU 2120475 C1, 20.10.1998. RU 2157701 C1, 20.10.2000. реф. Holden S.A. et al. Augmentation of antitumor activity of an
(85) Дата перевода заявки PCT на национальную фазу:
05.07.2004
(86) Заявка PCT:
US 02/38780 (04.12.2002)
(87) Публикация PCT:
WO 03/048334 (12.06.2003)
Адрес для переписки:
191186, Санкт-Петербург, а/я 230, “АРС-ПАТЕНТ”, пат.пов. С.В.Новоселовой
|
(72) Автор(ы):
ДЖИЛЛИЗ Стефен Д. (US)
(73) Патентообладатель(и):
МЕРК ПАТЕНТ ГМБХ (DE)
|
(54) ИММУНОЦИТОКИНЫ С МОДУЛИРОВАННОЙ СЕЛЕКТИВНОСТЬЮ
(57) Реферат:
Изобретение относится к химико-фармацевтической промышленности и касается цитокинсодержащих слитых белков с повышенным терапевтическим индексом и способов повышения терапевтического индекса этих слитых белков. Слитые белки согласно настоящему изобретению способны связываться с более чем одним типом рецепторов цитокинов, экспрессируемых на клетках, а также связываться с более чем одним типом клеток. Кроме того, слитые белки согласно настоящему изобретению обладают большим периодом полужизни в кровотоке в организме пациента, чем соответствующие естественно существующие цитокины. 2 н. и 19 з.п. ф-лы, 3 табл.
(56) (продолжение):
CLASS=”b560m”antibody-interleukin 2 immunocytokine with chemotherapeutic agents.” Clin. Cancer Res. 2001; 7(9): 2862-9.
Текст описания приведен в факсимильном виде.
Формула изобретения
1. Слитый белок, содержащий компонент, не являющийся IL-2, соединенный с мутантным IL-2-компонентом, при этом компонент, не являющийся IL-2, представляет собой антитело или домен антитела, выбранный из группы, состоящей из KS-1/4, dl-KS, dl-KS( 4h)(FN>AQ), huKS, huKS (N на Q), NHS76( 4h)(FN>AQ), huKS, huKS (N на Q), NHS76( 2h), NHS76( 2h), NHS76( 4h), NHS76( 4h), NHS76( 2h)(FN>AQ), NHS76( 2h)(FN>AQ), NHS76( 4h)(FN>AQ) и 14.18, a мутантный IL-2 содержит замены аминокислот N на R в положении 88 (N88R) и/или D на Т в положении 20 (D20T), причем указанный слитый белок проявляет большую селективность, чем контрольный белок, к клеткам, экспрессирующим рецептор с высоким сродством, а указанный контрольный белок содержит такой же компонент, не являющийся IL-2, соединенный с немутантным IL-2-компонентом, и указанная селективность измеряется как отношение уровня активации клеток, экспрессирующих IL-2R 4h)(FN>AQ) и 14.18, a мутантный IL-2 содержит замены аминокислот N на R в положении 88 (N88R) и/или D на Т в положении 20 (D20T), причем указанный слитый белок проявляет большую селективность, чем контрольный белок, к клеткам, экспрессирующим рецептор с высоким сродством, а указанный контрольный белок содержит такой же компонент, не являющийся IL-2, соединенный с немутантным IL-2-компонентом, и указанная селективность измеряется как отношение уровня активации клеток, экспрессирующих IL-2R   рецептор, выбранных из группы, состоящей из CTLL-2, Kit-225 и зрелых Т-клеток, к уровню активации клеток, экспрессирующих IL-2R рецептор, выбранных из группы, состоящей из CTLL-2, Kit-225 и зрелых Т-клеток, к уровню активации клеток, экспрессирующих IL-2R  рецептор, выбранных из группы, состоящей из TF-1 рецептор, выбранных из группы, состоящей из TF-1 клеток и НК-клеток. клеток и НК-клеток.
2. Слитый белок по п.1, отличающийся тем, что указанная селективность составляет от примерно 0,1% до примерно 30% селективности контрольного слитого белка, содержащего компонент, не являющийся IL-2, соединенный с мутантным IL-2-компонентом от человека с заменой аминокислоты N на R в положении 88 (N88R) зрелого белка IL-2 человека.
3. Слитый белок по п.1, отличающийся тем, что указанная селективность составляет от примерно 1% до примерно 20% селективности контрольного слитого белка, содержащего компонент, не являющийся IL-2, соединенный с мутантным IL-2-компонентом от человека с заменой аминокислоты N на R в положении 88 (N88R) зрелого белка IL-2 человека.
4. Слитый белок по п.1, отличающийся тем, что указанная селективность составляет от примерно 2% до примерно 10% селективности контрольного слитого белка, содержащего компонент, не являющийся IL-2, соединенный с мутантным IL-2-компонентом от человека с заменой аминокислоты N на R в положении 88 (N88R) зрелого белка IL-2 человека.
5. Слитый белок по п.1, отличающийся тем, что домен антитела выбран из группы, состоящей из:
(i) mAb KS-1/4;
(ii) mAb dl-KS;
(iii) mAb dl-KS, содержащего домен IgG гамма 4 с шарнирной областью IgG гамма 1, причем в последовательности SEQ ID NO: 2 указанного IgG гамма 4 последовательность F-N заменена на A-Q;
(iv) mAb huKS;
(v) mAb huKS, в котором в последовательности SEQ ID NO: 1 IgG гамма 1 N заменен на Q;
(vi) mAb NHS76, содержащего домен IgG гамма 2 с шарнирной областью IgG гамма 1;
(vii) mAb NHS76, содержащего домен IgG гамма 4 с шарнирной областью IgG гамма 1;
(viii) mAb NHS76, содержащего домен IgG гамма 2 с шарнирной областью IgG гамма 1, причем в последовательности SEQ ID NO: 2 указанного IgG гамма 2 последовательность F-N заменена на A-Q;
(ix) mAb NHS76, содержащего домен IgG гамма 4 с шарнирной областью IgG гамма 1, причем в последовательности SEQ ID NO: 2 указанного IgG гамма 4 последовательность F-N заменена на A-Q; и
(х) mAb 14.18.
6. Слитый белок по п.1, отличающийся тем, что указанная мутация оказывает дифференциальный эффект на сродство слитого белка к IL-2R  рецептору по отношению к сродству белка к IL-2R рецептору по отношению к сродству белка к IL-2R   рецептору. рецептору.
7. Слитый белок по п.6, отличающийся тем, что его дифференциальный эффект больше 2-кратного и определяется следующим образом:
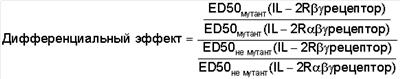
8. Слитый белок по п.6, отличающийся тем, что дифференциальный эффект лежит в диапазоне между примерно 5-кратным и примерно 10-кратным.
9. Слитый белок по п.6, отличающийся тем, что дифференциальный эффект лежит в диапазоне между примерно 10-кратным и примерно 1000-кратным.
10. Слитый белок по п.1, отличающийся тем, что мутантный IL-2-компонент содержит замену аминокислоты, изменяющую N на R в положении 88 (N88R), и замену аминокислоты, изменяющую D на Т в положении 20 (D20T), зрелого белка IL-2 человека.
11. Слитый белок по п.10, отличающийся тем, что мутантный IL-2-компонент дополнительно содержит замены аминокислот, изменяющие L на Т в положении 85 и I на Т в положении 86 зрелого белка IL-2 человека.
12. Слитый белок по п.1, отличающийся тем, что указанный мутантный IL-2-компонент дополнительно содержит мутацию в положении аминокислоты зрелого белка IL-2 человека, выбранном из группы, состоящей из К8, Q13, Е15, Н16, L19, Q22, М23, N26, Н79, L80, R81, D84, N88, I92 и Е95.
13. Слитый белок по п.1, отличающийся тем, что указанный мутантный IL-2-компонент дополнительно содержит мутацию в положении аминокислоты зрелого белка IL-2 человека, выбранном из группы, состоящей из L25, N31, L40, М46, K48, K49, D109, E110, А112, Т113, V115, E116, N119, R120, I122, T123, Q126, S127, S130 и T131.
14. Слитый белок по п.13, отличающийся тем, что мутация аминокислоты является мутацией Q126D.
15. Слитый белок по п.12 или 13, отличающийся тем, что одна или несколько указанных мутаций аминокислот оказывают дифференциальный эффект на сродство слитого белка к IL-2R  рецептору по отношению к сродству белка к IL-2R рецептору по отношению к сродству белка к IL-2R   рецептору. рецептору.
16. Слитый белок по п.12 или 13, отличающийся тем, что его дифференциальный эффект больше 2-кратного и определяется следующим образом:
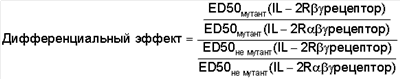
17. Слитый белок, содержащий компонент, являющийся IL-2, и компонент, не являющийся IL-2, причем компонент, не являющийся IL-2, содержит домен IgG гамма 1, домен IgG гамма 2 или домен IgG гамма 4, и содержит мутацию, которая оказывает дифференциальный эффект на сродство указанного слитого белка к 2R  рецептору, экспрессированному клетками, выбранными из группы, состоящей из TF-1 рецептору, экспрессированному клетками, выбранными из группы, состоящей из TF-1 клеток и НК-клеток, по отношению к сродству этого слитого белка к IL-2R клеток и НК-клеток, по отношению к сродству этого слитого белка к IL-2R   рецептору, который экспрессируется клетками, выбранными из группы, состоящей из CTLL-2, Kit-225 и зрелых Т-клеток. рецептору, который экспрессируется клетками, выбранными из группы, состоящей из CTLL-2, Kit-225 и зрелых Т-клеток.
18. Слитый белок по п.17, отличающийся тем, что указанная мутация изменяет N в последовательности SEQ ID NO: 1 на другую аминокислоту.
19. Слитый белок по п.17, отличающийся тем, что указанная аминокислота N заменена на Q.
20. Слитый белок по п.17, отличающийся тем, что указанная мутация изменяет FN в последовательности SEQ ID NO: 2 на AQ.
21. Слитый белок по п.17, отличающийся тем, что слитый белок является димером двух пептидов, содержащих последовательности аминокислот SEQ ID NO: 35 и SEQ ID NO: 36.
РИСУНКИ
TH4A – Переиздание описания изобретения к патенту Российской Федерации
Причина переиздания: Коррекция в тексте формулы изобретения
Извещение опубликовано: 27.03.2008 БИ: 09/2008
TK4A – Поправки к публикациям сведений об изобретениях в бюллетенях “Изобретения (заявки и патенты)” и “Изобретения. Полезные модели”
Напечатано: (57) 13. …, R120, T122, T123, Q126, …
Следует читать: (57) 13. …, R120, I122, T123, Q126, …
Номер и год публикации бюллетеня: 35-2007
Код раздела: FG4A
Извещение опубликовано: 27.03.2008 БИ: 09/2008
|
|