Патент на изобретение №2159250
|
||||||||||||||||||||||||||
(54) АНАЛОГИ ПЕПТИДА p277 И СОДЕРЖАЩИЕ ИХ ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ ДЛЯ ЛЕЧЕНИЯ И ДИАГНОСТИКИ ДИАБЕТА
(57) Реферат: Описывается новый полипептид последовательности I:  где X1 и X2 каждый представляют собой остатки Cys или Val и X3 является остатком Thr или Lys, но X1 и X2 оба не могут быть остатками Cys, когда X3 представляет собой Thr, и его соли и функциональные производные. Предложенный новый полипептид обладает, по существу, такой же биологической активностью, как p277, но имеет существенно лучшую устойчивость. Он может быть использован для любой цели, для которой можно использовать p277. Описываются также содержащие их фармацевтические композиции для лечения и диагностики диабета. 8 с. и 9 з.п. ф-лы, 5 ил., 9 табл. где X1 и X2 каждый представляют собой остатки Cys или Val и X3 является остатком Thr или Lys, но X1 и X2 оба не могут быть остатками Cys, когда X3 представляет собой Thr, и его соли и функциональные производные. Предложенный новый полипептид обладает, по существу, такой же биологической активностью, как p277, но имеет существенно лучшую устойчивость. Он может быть использован для любой цели, для которой можно использовать p277. Описываются также содержащие их фармацевтические композиции для лечения и диагностики диабета. 8 с. и 9 з.п. ф-лы, 5 ил., 9 табл.
Настоящее изобретение относится к новым пептидам, являющимся вариантами эпитопа человеческого хитшокового белка в 60 кД (hsp 60), и к фармацевтическим композициям, содержащим такие пептиды, и к способам диагностики и лечения инсулинзависимого сахарного диабета (IDDM) с использованием таких пептидов. Предпосылки создания изобретения Диабет типа I или IDDM является аутоиммунным заболеванием, вызванным T-клетками, которые атакуют и разрушают продуцирующие инсулин  -клетки, находящиеся в островках поджелудочной железы (Castano и Eisenbarth, 1990). Аутоиммунный процесс, завершающийся IDDM, начинается и развивается без симптомов. Заболевание проявляется клинически только тогда, когда совокупная утрата -клетки, находящиеся в островках поджелудочной железы (Castano и Eisenbarth, 1990). Аутоиммунный процесс, завершающийся IDDM, начинается и развивается без симптомов. Заболевание проявляется клинически только тогда, когда совокупная утрата  -клеток превышает способность оставшихся -клеток превышает способность оставшихся  -клеток вырабатывать инсулин. В самом деле, полагают, что коллапс глюкозного гомеостаза и клинический IDDM имеют место только после того, как иммунной системой инактивированы 80-90% -клеток вырабатывать инсулин. В самом деле, полагают, что коллапс глюкозного гомеостаза и клинический IDDM имеют место только после того, как иммунной системой инактивированы 80-90%  -клеток. Таким образом, пациенты, которых идентифицируют как страдающих от IDDM, непременно находятся в поздней стадии аутоиммунного разрушения их -клеток. Таким образом, пациенты, которых идентифицируют как страдающих от IDDM, непременно находятся в поздней стадии аутоиммунного разрушения их  -клеток. Кроме того, диагноз начального, преклинического диабета путем детекции иммунологических маркеров -клеток. Кроме того, диагноз начального, преклинического диабета путем детекции иммунологических маркеров  -клеточного аутоиммунитета можно установить только после начала аутоиммунного процесса. Следовательно, терапевтический поиск должен найти безопасный, специфичный и эффективный способ сворачивания аутоиммунного процесса, который уже пошел.
Авторы настоящего изобретения прежде изучали этот вопрос, исследуя развитие спонтанного диабета у мышей линии NOD, который, как считается, является достоверной моделью человеческого IDDM (Castano и Eisenbarth, 1990). У мышей NOD в возрасте примерно 4 недель развивается инсулит, который начинается как околоостровковый инфильтрат и развивается до серьезного внутриостровкового воспаления. Гипергликемия, которая подтверждает недостаточность инсулина, начинается у самок в нашей колонии в возрасте 14-17 недель. В возрасте 35-40 недель почти у всех мышей NOD развивается тяжелый диабет и большинство погибает при отсутствии лечения инсулином. Самцы мышей NOD реже заболевают диабетом по неясным причинам. Показано, что диабет у мышей NOD вызывается аутоиммунными T-клетками (Bendelac et al., 1987).
T-клеточная реактивность и аутоантитела к различным антигенам определены у больных IDDM, а также у мышей NOD (Elias, 1994), и неясно, является ли первичной причиной заболевания иммунитет к любому одному из возможных мишенных антигенов. Кроме вопроса о причинах заболевания существует вопрос лечения.
Показано, что инициация аутоиммунного процесса у мышей NOD может быть предупреждена различными воздействиями на мышей – до появления диабета, такими как ограничение питания, вирусные инфекции или неспецифическая стимуляция иммунной системы (Bowman et al., 1994). Диабет у мышей NOD также предупреждается путем индукции иммунологической толерантности у преддиабетных мышей к антигену глутаминовой кислоты-декарбоксилазы (GAD) (Kaufman et al., 1993; Tisch et ai., 1993).
Авторы настоящего изобретения ранее обнаружили, что диабет у мышей NOD можно предупредить T-клеточной вакцинацией с использованием Т-клеток, специфических для пептидной последовательности p277 молекулы человеческого hsp60 (Elias et al., 1991). Этот белок прежде назывался hsp65, но теперь называется hsp60 с учетом более точных сведений о молекулярной массе; независимо от названия, это одинаковые белки.
Пептид p277, будучи эпитопом человеческого hsp60, вовлеченным в IDDM и соответствующим позициям 437-460 последовательности человеческого hsp60, впервые описан в заявке на патент Израиля N 94241 заявителей настоящей заявки и в работе Elias и Cohen, 1994, и имеет следующую последовательность: -клеточного аутоиммунитета можно установить только после начала аутоиммунного процесса. Следовательно, терапевтический поиск должен найти безопасный, специфичный и эффективный способ сворачивания аутоиммунного процесса, который уже пошел.
Авторы настоящего изобретения прежде изучали этот вопрос, исследуя развитие спонтанного диабета у мышей линии NOD, который, как считается, является достоверной моделью человеческого IDDM (Castano и Eisenbarth, 1990). У мышей NOD в возрасте примерно 4 недель развивается инсулит, который начинается как околоостровковый инфильтрат и развивается до серьезного внутриостровкового воспаления. Гипергликемия, которая подтверждает недостаточность инсулина, начинается у самок в нашей колонии в возрасте 14-17 недель. В возрасте 35-40 недель почти у всех мышей NOD развивается тяжелый диабет и большинство погибает при отсутствии лечения инсулином. Самцы мышей NOD реже заболевают диабетом по неясным причинам. Показано, что диабет у мышей NOD вызывается аутоиммунными T-клетками (Bendelac et al., 1987).
T-клеточная реактивность и аутоантитела к различным антигенам определены у больных IDDM, а также у мышей NOD (Elias, 1994), и неясно, является ли первичной причиной заболевания иммунитет к любому одному из возможных мишенных антигенов. Кроме вопроса о причинах заболевания существует вопрос лечения.
Показано, что инициация аутоиммунного процесса у мышей NOD может быть предупреждена различными воздействиями на мышей – до появления диабета, такими как ограничение питания, вирусные инфекции или неспецифическая стимуляция иммунной системы (Bowman et al., 1994). Диабет у мышей NOD также предупреждается путем индукции иммунологической толерантности у преддиабетных мышей к антигену глутаминовой кислоты-декарбоксилазы (GAD) (Kaufman et al., 1993; Tisch et ai., 1993).
Авторы настоящего изобретения ранее обнаружили, что диабет у мышей NOD можно предупредить T-клеточной вакцинацией с использованием Т-клеток, специфических для пептидной последовательности p277 молекулы человеческого hsp60 (Elias et al., 1991). Этот белок прежде назывался hsp65, но теперь называется hsp60 с учетом более точных сведений о молекулярной массе; независимо от названия, это одинаковые белки.
Пептид p277, будучи эпитопом человеческого hsp60, вовлеченным в IDDM и соответствующим позициям 437-460 последовательности человеческого hsp60, впервые описан в заявке на патент Израиля N 94241 заявителей настоящей заявки и в работе Elias и Cohen, 1994, и имеет следующую последовательность:Val-Leu-Gly-Gly-Gly-Cys-Ala-Leu-Leu-Arg-Cys-Ile-Pro-Ala-Leu-Asp-Ser-Leu-Thr-Pro-Ala-Asn-Glu-Asp (послед. N 1). Показано, что введение самого пептида p277 в начале инсулита также предотвращает развитие диабета, вероятно, посредством отрицательной негативной модуляции иммунитета против p277, что существенно для NOD-диабета (Elias et al., 1991; заявка на патент Израиля N 94241). Последние исследования показали, что пептид p277 также можно использовать для реверсии  -клеточного аутоиммунитета, который развился до поздней стадии (Elias и Cohen, 1994).
Согласно последним лабораторным исследованиям авторов настоящего изобретения, форма аутоиммунного диабета может быть индуцирована в мышах линии C57BL/KsJ путем введения очень низкой дозы -клеточного аутоиммунитета, который развился до поздней стадии (Elias и Cohen, 1994).
Согласно последним лабораторным исследованиям авторов настоящего изобретения, форма аутоиммунного диабета может быть индуцирована в мышах линии C57BL/KsJ путем введения очень низкой дозы  -клеточного токсина стрептозотоцина (STZ) (Elias et al., 1994). В то время как стандартная низкая доза STZ в 40 мг/кг, вводимая ежедневно в течение 5 дней, обычно вызывает клинический диабет в пределах 3 недель, введение 30 мг/кг в течение 5 дней индуцирует клинический диабет только через скрытый период примерно в 3 месяца. Эта модель индуцированного диабета отличается появлением в продромный период аутоантител к инсулину, антиидиотипических антител к антиинсулиновым антителам и аутоантител к hsp60. Мыши также проявляют спонтанную T-клеточную реактивность к hsp60 и к его пептиду p277 (Elias et al., 1994). Таким образом, оказывается, что доза STZ ниже стандартной низкой дозы инициирует аутоиммунный процесс, не отличающийся от процесса, наблюдаемого при спонтанном диабете, развивающемся у мышей NOD (Elias et al., 1990).
Предметом настоящего изобретения являются варианты пептида p277, причем указанные варианты могут использоваться для диагностики и лечения IDDM.
Краткое изложение сущности изобретения -клеточного токсина стрептозотоцина (STZ) (Elias et al., 1994). В то время как стандартная низкая доза STZ в 40 мг/кг, вводимая ежедневно в течение 5 дней, обычно вызывает клинический диабет в пределах 3 недель, введение 30 мг/кг в течение 5 дней индуцирует клинический диабет только через скрытый период примерно в 3 месяца. Эта модель индуцированного диабета отличается появлением в продромный период аутоантител к инсулину, антиидиотипических антител к антиинсулиновым антителам и аутоантител к hsp60. Мыши также проявляют спонтанную T-клеточную реактивность к hsp60 и к его пептиду p277 (Elias et al., 1994). Таким образом, оказывается, что доза STZ ниже стандартной низкой дозы инициирует аутоиммунный процесс, не отличающийся от процесса, наблюдаемого при спонтанном диабете, развивающемся у мышей NOD (Elias et al., 1990).
Предметом настоящего изобретения являются варианты пептида p277, причем указанные варианты могут использоваться для диагностики и лечения IDDM.
Краткое изложение сущности изобретенияПри исследовании фрагментов и вариантов пептида p277 неожиданно обнаружилось, что пептиды, в которых один треониновый остаток заменяется на лизиновый остаток, и/или один или оба остатка цистеина заменяются на остаток (остатки) валина, так же активны при лечении диабета, как p277. Эти результаты были даже более неожиданными, так как замещение цистеиновых остатков остатками серина дает в результате инактивные пептиды. Таким образом, настоящее изобретение относится к пептиду, содержащему последовательность I  где каждый из X1 и X2 является остатком Cys или Val, а X3 является остатком Thr или Lys, но оба X1 и X2 не могут быть остатками Cys, когда X3 является Thr-остатком. В конкретных вариантах осуществления настоящего изобретения пептид состоит из последовательности I, в которой как X1, так и X2 являются Cys, а X3 представляет собой Lys и назван здесь p277(Lys19) (послед. N 3); или X1 представляет собой Val, X2 представляет собой Cys, а X3 является Thr или Lys, и такие пептиды названы здесь p277(Val6) (послед. N 4) и p277(Val6-Lys19) (послед. N 5), соответственно; или X1 представляет собой Cys, X2 представляет собой Val, а X3 является Thr или Lys, и такие пептиды названы здесь p277(Val11) (послед. N 6) и p277(Val11-Lys19) (послед. N 7), соответственно; или как X1, так и X2 представляют собой Val, а X3 является Thr или Lys, и такие пептиды названы здесь p277(Val6-Val11) (послед. N 8) и p277(Val6,11-Lys19) (послед. N 9), соответственно. Пептид p277(Val6-Val11) называется здесь также p277(V). Также целью настоящего изобретения являются способы и наборы для ранней диагностики IDDM, использующие пептид последовательности I изобретения. В процессе развития IDDM животные экспрессируют молекулы hsp60 или молекулы, которые являются перекрестно-реактивными с ними, которые находят их путь в крови и моче животных. Они также экспрессируют антитела и T-клетки, направленные специфически к таким молекулам. Таким образом, присутствие hsp60 (или молекул, которые перекрестно-реактивны с ним) или антител или T-клеток, специфических для него, в крови или в моче служит методом анализа для обнаружения процесса IDDM до завершения разрушения бета-клеток, когда индивидуум обречен на пожизненный диабет. Наличие или появление IDDM у пациента можно диагностировать путем анализа крови или мочи указанного пациента на присутствие антител против hsp60 или T-клеток, которые иммунологически реактивны с человеческим hsp60, с использованием в качестве антигена пептида последовательности I настоящего изобретения. В самом деле, любая из описанных ранее процедур, которую можно осуществлять с использованием p277, таких, какие описаны в заявке на международный патент, опубликованной под N WO 90/10499, включенный здесь в качестве ссылки, также может использоваться с заменой p277 на пептид с последовательностью I настоящего изобретения. Соответственно, настоящее изобретение относится к способу диагностирования наличия или появления IDDM у пациента, включающему проверку указанного пациента на присутствие антител к hsp60 или T-клетки, которая иммунореактивна с hsp60, причем положительный результат такой проверки, указывающий на присутствие антител к hsp60 или T-клетки, которая иммунореактивна с hsp60, указывает на высокую вероятность наличия или появления IDDM. При этом способе диагностики IDDM пациента можно проверить на присутствие антител против hsp60, при этом указанный способ исследования может включать радиоиммуноанализ или анализ методом ELISA. Пациента также можно проверить на присутствие T-клетки, которая иммунореактивна с hsp60. В одном из вариантов осуществления изобретения в таком аспекте метод исследования включает испытание на T-клеточную пролиферацию, содержащее стадии: (I) получения мононуклеарной клеточной фракции, содержащей T-клетки из образца крови, взятого у указанного пациента; (II) добавления к указанной мононуклеарной клеточной фракции антигена, выбранного из числа пептидов последовательности I настоящего изобретения; (III) инкубации указанной клеточной фракции в присутствии указанного антигена в течение соответствующего периода времени и при подходящих условиях культивирования; (IV) добавления меченого нуклеотида к инкубированной клеточной культуре, полученной в (III), в подходящий момент времени перед окончанием указанного инкубационного периода для обеспечения включения указанного меченого нуклеотида в ДНК пролиферирующих Т-клеток; и (V) определения количества пролиферирующих T-клеток путем анализа количества меченых нуклеотидов, включенных в указанные T-клетки. На описанной выше стадии (IV) указанный меченый нуклеотид представляет собой, предпочтительно, 3H-тимидин. Определение количества пролиферирующих T-клеток осуществляют путем вычисления индекса стимуляции T-клеток стандартными способами. В другом варианте осуществления изобретения в этом аспекте метод исследования включает испытание на T-клеточный цитокиновый ответ, при котором стадии (I)-(III) такие же, как в описанном выше испытании на T-клеточную пролиферацию, а на четвертой (IV) стадии определяют с помощью стандартных способов с коммерчески доступными наборами присутствие цитокина, такого как интерферон-  ИЛ-2, ИЛ-4, ИЛ-6, ИЛ-10, ИЛ-2, ИЛ-4, ИЛ-6, ИЛ-10,  -ФНО или TGF -ФНО или TGF , секретированного в среду отвечающими лимфоцитами.
В своем другом аспекте настоящее изобретение относится к способу in vivo, при котором антиген, выбранный из пептидов с последовательностью I, инъецируют пациенту подкожно и наблюдают появление детектируемой кожной реакции (DTH).
Настоящее изобретение также относится к средствам осуществления таких анализов, а также к наборам для осуществления таких анализов. Наборы можно получить для осуществления любого из многих анализов, применяемых для выполнения настоящего изобретения. Каждый такой набор включает все материалы, необходимые для проведения отдельного анализа или определенного числа анализов. Например, набор для определения присутствия антител против hsp60 может содержать иммобилизованный на твердой фазе пептид последовательности I и меченое антитело, способное узнавать невариабельную область антитела против hsp60, которое детектируют, как, например, меченое античеловеческое Fab. Набор также может содержать указания по применению набора и емкости для хранения материалов набора. Можно использовать любую обычную метку, такую как радиоизотоп, фермент, хромофор или флуорофор. Типичным радиоизотопом является иод-125 или сера-35. Типичными ферментами для этих целей являются пероксидаза хрена обыкновенного, , секретированного в среду отвечающими лимфоцитами.
В своем другом аспекте настоящее изобретение относится к способу in vivo, при котором антиген, выбранный из пептидов с последовательностью I, инъецируют пациенту подкожно и наблюдают появление детектируемой кожной реакции (DTH).
Настоящее изобретение также относится к средствам осуществления таких анализов, а также к наборам для осуществления таких анализов. Наборы можно получить для осуществления любого из многих анализов, применяемых для выполнения настоящего изобретения. Каждый такой набор включает все материалы, необходимые для проведения отдельного анализа или определенного числа анализов. Например, набор для определения присутствия антител против hsp60 может содержать иммобилизованный на твердой фазе пептид последовательности I и меченое антитело, способное узнавать невариабельную область антитела против hsp60, которое детектируют, как, например, меченое античеловеческое Fab. Набор также может содержать указания по применению набора и емкости для хранения материалов набора. Можно использовать любую обычную метку, такую как радиоизотоп, фермент, хромофор или флуорофор. Типичным радиоизотопом является иод-125 или сера-35. Типичными ферментами для этих целей являются пероксидаза хрена обыкновенного,  -галактозидаза и щелочная фосфотаза.
Набор для диагностирования наличия IDDM посредством исследований на присутствие антител против hsp60 включает: -галактозидаза и щелочная фосфотаза.
Набор для диагностирования наличия IDDM посредством исследований на присутствие антител против hsp60 включает:(I) антиген, выбранный из пептидов последовательности I; (II) меченое антитело, способное узнавать невариабельную область указанных антител против hsp60, которые определяют. Набор для диагностирования наличия IDDM посредством исследований на присутствие T-клетки, которая иммунореактивна с hsp60, включает: (I) антиген, выбранный из пептидов последовательности I; (II) подходящую среду для культивирования лимфоцитов (T-клеток); (III) либо меченый нуклеотид для испытания на T-клеточную пролиферацию, либо набор для цитокинового анализа, например на  -интерферон, ИЛ-2, ИЛ-4, ИЛ-6, ИЛ-10, -интерферон, ИЛ-2, ИЛ-4, ИЛ-6, ИЛ-10,  -ФНО или TGF -ФНО или TGF , для испытания на цитокины.
Для проверки in vivo набор будет содержать только пептид последовательности I в форме, подходящей для инъекции.
Настоящее изобретение также относится к способам предупреждения или лечения IDDM. Вакцинация антигенным пептидом последовательности I настоящего изобретения может обеспечить специфический супрессирующий эффект для аутоиммунитета к антигену, и эффективно создает сопротивление аутоиммунному процессу IDDM. То же справедливо в отношении вакцинации T-клетками, специфическими для таких антигенов, в аттенюированной или авирулентной форме, или после обработки для улучшения ее антигенности, или их фрагментами или активными фракциями. Если видно, что пациент уже находится в преклинической начальной стадии IDDM, инъекция такого антигена или Т-клеток (или фракции) может вызвать супрессирующее действие на аутоиммунный процесс для этого антигена и, таким образом, остановить аутоиммунный процесс, прежде чем он причинит значительные необратимые повреждения. Пептид также можно использовать в качестве терапевтического средства для остановки аутоиммунного процесса даже после того, как он далеко продвинулся, как показали недавно авторы настоящего изобретения в отношении лечения мышей NOD пептидом p277 (Elias and Cohen, 1994).
Соответственно, настоящее изобретение относится к препарату для предупреждения или лечения инсулинзависимого сахарного диабета (IDDM), содержащему T-клеточный продукт, выбранный из группы, состоящей из (а) человеческих T-клеток, которые показывают специфичность к последовательности p277 человеческого hsp60, причем указанные клетки активированы путем инкубации в присутствии указанного пептида последовательности I; (б) указанных человеческих T-клеток по (а), которые облучены или аттенюированы другим способом; (в) указанных человеческих Т-клеток по (а), которые подвергнуты обработке под давлением посредством гидростатического давления, обработке химическим перекрестно-сшивающим агентом и/или обработке цитоскелетным перекрестно-сшивающим агентом; (г) фрагментов или поверхностных белков, образованных из T-клеток (а), (б) или (в); или (д) пептида, состоящего, по существу, из вариабельной области рецептора (а), специфического для указанного белка, или его соль, функциональное производное или активную фракцию.
В предпочтительном варианте осуществления настоящего изобретения препарат содержит аутологичные человеческие T-клетки, полученные от пациента с IDDM, которого лечат, и эти T-клетки активированы путем контакта in vitro с указанным пептидом последовательности I. Такие специфические и активированные T-клетки затем вводят тому же пациенту, от которого их первоначально получили.
Настоящее изобретение также относится к фармацевтической композиции для предупреждения или лечения IDDM, содержащей фармацевтически приемлемый носитель и, в качестве активного элемента, эффективное количество пептида последовательности I, его соли или функционального производного. Фармацевтически приемлемый носитель представляет собой, предпочтительно, масляный носитель, такой как эмульсия минерального масла, известная как неполный адъювант Фрейнда (IFA). Однако IFA, как и полный адъювант Фрейнда (CFA; препарат, содержащий различные количества убитых организмов микобактерии), не допускает применения для человека, поскольку минеральное масло не преобразуется в ходе обмена веществ и не может разлагаться организмом.
В настоящее время авторами настоящего изобретения обнаружено, что некоторые жировые эмульсии, которые в течение многих лет применяют для парентерального питания пациентов-людей, также могут действовать как носители для пептидной терапии, использующей пептиды настоящего изобретения. Например, две такие эмульсии являются коммерчески доступными жировыми эмульсиями, известными под названиями интралипид (Intralipid) и липофундин (Lypofundin). “Интралипид” является зарегистрированным торговым названием фирмы Kabi Pharma-cia, Швеция, для жировой эмульсии для парентерального питания, описанной в патенте США N 3169094. “Липофундин” является зарегистрированным торговым названием фирмы В. Braun Melsungen, Германия. Обе эмульсии в качестве жира содержат соевое масло (100 или 200 г в 1000 мл дистиллированной воды, соответственно 10% или 20%). В качестве эмульгаторов в интралипиде используются фосфолипиды яичного желтка (12 г на 1 л дистиллированной воды), а в липофундине используется лецитин яичного желтка (12 г на 1 л дистиллированной воды). Как в интралипиде, так и в липофундине изотоничность достигается добавлением глицерина (25 г/л).
Настоящее изобретение также относится к способу предупреждения или лечения IDDM, который включает введение пациенту, нуждающемуся в таком лечении, фармацевтической композиции, содержащей пептид последовательности I, или препарата, содержащего T-клетки, которые выращены специфически к указанному пептиду последовательности I настоящего изобретения.
Краткое описание чертежей , для испытания на цитокины.
Для проверки in vivo набор будет содержать только пептид последовательности I в форме, подходящей для инъекции.
Настоящее изобретение также относится к способам предупреждения или лечения IDDM. Вакцинация антигенным пептидом последовательности I настоящего изобретения может обеспечить специфический супрессирующий эффект для аутоиммунитета к антигену, и эффективно создает сопротивление аутоиммунному процессу IDDM. То же справедливо в отношении вакцинации T-клетками, специфическими для таких антигенов, в аттенюированной или авирулентной форме, или после обработки для улучшения ее антигенности, или их фрагментами или активными фракциями. Если видно, что пациент уже находится в преклинической начальной стадии IDDM, инъекция такого антигена или Т-клеток (или фракции) может вызвать супрессирующее действие на аутоиммунный процесс для этого антигена и, таким образом, остановить аутоиммунный процесс, прежде чем он причинит значительные необратимые повреждения. Пептид также можно использовать в качестве терапевтического средства для остановки аутоиммунного процесса даже после того, как он далеко продвинулся, как показали недавно авторы настоящего изобретения в отношении лечения мышей NOD пептидом p277 (Elias and Cohen, 1994).
Соответственно, настоящее изобретение относится к препарату для предупреждения или лечения инсулинзависимого сахарного диабета (IDDM), содержащему T-клеточный продукт, выбранный из группы, состоящей из (а) человеческих T-клеток, которые показывают специфичность к последовательности p277 человеческого hsp60, причем указанные клетки активированы путем инкубации в присутствии указанного пептида последовательности I; (б) указанных человеческих T-клеток по (а), которые облучены или аттенюированы другим способом; (в) указанных человеческих Т-клеток по (а), которые подвергнуты обработке под давлением посредством гидростатического давления, обработке химическим перекрестно-сшивающим агентом и/или обработке цитоскелетным перекрестно-сшивающим агентом; (г) фрагментов или поверхностных белков, образованных из T-клеток (а), (б) или (в); или (д) пептида, состоящего, по существу, из вариабельной области рецептора (а), специфического для указанного белка, или его соль, функциональное производное или активную фракцию.
В предпочтительном варианте осуществления настоящего изобретения препарат содержит аутологичные человеческие T-клетки, полученные от пациента с IDDM, которого лечат, и эти T-клетки активированы путем контакта in vitro с указанным пептидом последовательности I. Такие специфические и активированные T-клетки затем вводят тому же пациенту, от которого их первоначально получили.
Настоящее изобретение также относится к фармацевтической композиции для предупреждения или лечения IDDM, содержащей фармацевтически приемлемый носитель и, в качестве активного элемента, эффективное количество пептида последовательности I, его соли или функционального производного. Фармацевтически приемлемый носитель представляет собой, предпочтительно, масляный носитель, такой как эмульсия минерального масла, известная как неполный адъювант Фрейнда (IFA). Однако IFA, как и полный адъювант Фрейнда (CFA; препарат, содержащий различные количества убитых организмов микобактерии), не допускает применения для человека, поскольку минеральное масло не преобразуется в ходе обмена веществ и не может разлагаться организмом.
В настоящее время авторами настоящего изобретения обнаружено, что некоторые жировые эмульсии, которые в течение многих лет применяют для парентерального питания пациентов-людей, также могут действовать как носители для пептидной терапии, использующей пептиды настоящего изобретения. Например, две такие эмульсии являются коммерчески доступными жировыми эмульсиями, известными под названиями интралипид (Intralipid) и липофундин (Lypofundin). “Интралипид” является зарегистрированным торговым названием фирмы Kabi Pharma-cia, Швеция, для жировой эмульсии для парентерального питания, описанной в патенте США N 3169094. “Липофундин” является зарегистрированным торговым названием фирмы В. Braun Melsungen, Германия. Обе эмульсии в качестве жира содержат соевое масло (100 или 200 г в 1000 мл дистиллированной воды, соответственно 10% или 20%). В качестве эмульгаторов в интралипиде используются фосфолипиды яичного желтка (12 г на 1 л дистиллированной воды), а в липофундине используется лецитин яичного желтка (12 г на 1 л дистиллированной воды). Как в интралипиде, так и в липофундине изотоничность достигается добавлением глицерина (25 г/л).
Настоящее изобретение также относится к способу предупреждения или лечения IDDM, который включает введение пациенту, нуждающемуся в таком лечении, фармацевтической композиции, содержащей пептид последовательности I, или препарата, содержащего T-клетки, которые выращены специфически к указанному пептиду последовательности I настоящего изобретения.
Краткое описание чертежейФиг. 1 представляет график, показывающий устойчивость p277 и p277(Val6-Val11). Заштрихованные кружки относятся к результатам, полученным с p277, а незаштрихованные кружки – к p277(Val6-Val11). Большие кружки показывают результаты, полученные после 1 недели хранения, кружки среднего размера – результаты после 9 недель и самые маленькие кружки – после 20 недель. Фиг. 2 показывает, что NOD-T-клетки диабетогенного клона C9 пролиферируют в ответ на пептиды p277 (заштрихованные кружки) и p277(Val6-Val11) (незаштрихованные кружки). Фиг. 3 показывает, что T-клетки селезенки мышей NOD пролиферируют в присутствии пептида p277(Lys19). Исследовались селезенки 5 самок мышей NOD в каждой возрастной группе на T-клеточную пролиферацию в ответ на пептид p277(Lys19) (заштрихованные кружки), p277 (незаштрихованные кружки) и контрольный пептид p278 (заштрихованные квадраты). Фиг. 4 показывает, что T-клетки диабетогенного клона C9 мышей NOD пролиферируют в ответ на пептид p277(Lys19). Фиг. 5 представляет диаграмму, показывающую эффективность предварительной обработки p277(V) в IFA при предупреждении индуцированного STZ диабета по сравнению с контрольной обработкой или обработкой GADp34. Подробное описание изобретения Всякий раз, когда в описании изобретения употребляется выражение “пептид последовательности I”, подразумеваются также его соли и функциональные производные, пока сохраняется биологическая активность пептида в отношении диабета. “Соли” пептида I, предполагаемые изобретением, являются физиологически приемлемыми органическими и неорганическими солями. “Функциональные производные” пептида I, о которых здесь идет речь, охватывают производные, которые можно получить на основе функциональных групп, которые встречаются в боковых цепях в остатках или в N- или C-концевых группах, способами, известными в технике, и включаются в изобретение, пока они остаются фармацевтически приемлемыми, т.е. не разрушают активность пептида настолько, насколько это касается его подобия известной активности p277, не придают токсических свойств композициям, которые их содержат, и не оказывают вредного влияния на их антигенные свойства. Такие “функциональные производные” не включают такие изменения, которые эффективно превращают одну аминокислоту в другую. С учетом приведенных выше ограничений эти производные могут, например, включать сложные эфиры алифатических спиртов карбоксильных групп, амиды, полученные при реакции карбоксильных групп с аммиаком или первичными или вторичными аминами, N-ацильные производные свободных аминогрупп аминокислотных остатков, образовавшиеся при реакции с ацильными группами (например, алканоильными или карбоциклическими ароильными группами), или O-ацильные производные свободной гидроксильной группы (например, гидроксильной группы серильного или треонильного остатков), образовавшиеся при реакции с ацильными группами. Пептид последовательности I изобретения можно использовать в качестве иммуногена в фармацевтических композициях, в частности в вакцинах, для снятия симптомов или лечения IDDM, а также в качестве антигена в диагностических композициях для диагностики IDDM. Указанные фармацевтические и диагностические композиции, которые можно получить способами, известными в технике, также составляют часть настоящего изобретения. Когда пептид настоящего изобретения используется для терапевтического лечения или в виде профилактической вакцины, его, предпочтительно, вводят с биологически активным носителем, который промотирует сдвиг ТН1-ТН2 аутоиммунных T-клеток. T-клетки CD4 хелперного типа подразделяются на две группы в соответствии с цитокинами, которые они секретируют, когда активированы (Mosmann and Coffman, 1989): клетки ТН1 секретируют ИЛ-2 и интерферон-  , в то время как клетки ТН2 секретируют ИЛ-4 и ИЛ-10. Такой носитель, предпочтительно, представляет собой жировую эмульсию, содержащую 10-20% триглицеридов растительного и/или животного происхождения, 1,2-2,4% фосфолипидов растительного и/или животного происхождения, 2,25-4,5% осморегулятора, 0-0,5% антиоксиданта и стерильную воду до 100%. Такой носитель представляет собой, наиболее предпочтительно, интралипид или липофундин. Применение таких носителей описано в заявке на патент Израиля (указанной ссылкой заявителя 9523), зарегистрированной в один день с датой регистрации израильской заявки на настоящее изобретение (указанной ссылкой заявителя 9451A), с тем же Заявителем, что и настоящая заявка, и эта заявка включена в настоящее в качестве ссылки.
Лечебная композиция по настоящему изобретению может вводиться перорально или парентерально, например подкожно, внутримышечно, внутривенно, интраназально или интраректально.
Приведенные здесь примеры доказывают эффективность терапевтического лечения соединениями и композициями настоящего изобретения на научно признанных животных моделях IDDM человека.
Примеры , в то время как клетки ТН2 секретируют ИЛ-4 и ИЛ-10. Такой носитель, предпочтительно, представляет собой жировую эмульсию, содержащую 10-20% триглицеридов растительного и/или животного происхождения, 1,2-2,4% фосфолипидов растительного и/или животного происхождения, 2,25-4,5% осморегулятора, 0-0,5% антиоксиданта и стерильную воду до 100%. Такой носитель представляет собой, наиболее предпочтительно, интралипид или липофундин. Применение таких носителей описано в заявке на патент Израиля (указанной ссылкой заявителя 9523), зарегистрированной в один день с датой регистрации израильской заявки на настоящее изобретение (указанной ссылкой заявителя 9451A), с тем же Заявителем, что и настоящая заявка, и эта заявка включена в настоящее в качестве ссылки.
Лечебная композиция по настоящему изобретению может вводиться перорально или парентерально, например подкожно, внутримышечно, внутривенно, интраназально или интраректально.
Приведенные здесь примеры доказывают эффективность терапевтического лечения соединениями и композициями настоящего изобретения на научно признанных животных моделях IDDM человека.
ПримерыМатериалы и методы (I) Мыши. Инбредных самок мышей линии NOD/Lt получают из Центра по разведению животных (Animal Breeding Center) Weizmann Institute of Science, Rehovot, Израиль. У этих мышей в возрасте 14-17 недель спонтанно развивается аутоиммунный диабет, который имитирует IDDM у людей. (II) Пептиды. Пептиды синтезируют обычными методами Fmoc-химии с использованием синтезатора ABIMED (ФРГ) и очищают на колонках для ВЭЖХ с помощью хроматографии с обращенной фазой. Последовательности устанавливают с помощью анализа аминокислот. Синтезируют следующие пептиды: пептид p277; контрольный пептид p278 с последовательностью Asn-Glu-Asp-Gln-Lys-Ile-Gly-Ile-Glu-Ile-Ile-Lys-Arg-Thr-Leu-Lys-Ile (послед. N 10), соответствующий позициям 458-474 молекулы человеческого hsp60; фрагменты p277: аминополовину p277 (p277. N), карбоксиполовину p277 (p277.C) и p277C, объединенный с p278 (p277.C-p278); пептид p277(Lys19); и пептид p277 с различными аминокислотными замещениями двух цистеиновых остатков в последовательности вида p277 с мостиковыми -SH группами (p277 (мостик Cys-Cys)); p277 с замещением обоих цистиновых остатков валином (p277(Val6-Val11)) или серином (p277(Ser6-Ser11)). (III) Обработка и контроль. Мышам дают эмульсии p277, других пептидов или бычий сывороточный альбумин (БСА, приобретен у Sigma, Сент-Луис, Миссури, США) в объемах 0,1 мл инъекцией подкожно в спину. Антигены разводят в ЗФР и эмульгируют в равном объеме минерального масла (неполный адъювант Фрейнда (IFA); Sigma) или 10% интралипида. У мышей проверяют содержание глюкозы в крови при 10 А.М. в неголодающем состоянии, как описано Elias с сотр., 1991, во время лечения (в возрасте 7, 12, 15 или 17 недель), и у мышей, которые выжили, в возрасте 40 недель. Значительной гипергликемией считается концентрация глюкозы 11,1 мМ/л или выше, поскольку такая концентрация глюкозы в крови превышает три стандартных отклонения от среднего уровня содержания глюкозы в крови, измеренного у 100 здоровых мышей (не показан). Гистологическое исследование островков поджелудочной железы осуществляют на срезах, окрашенных гематоксилином или эозином. Срезы оцениваются независимо двумя наблюдателями, которым не известно об идентичности групп. Чтобы удостовериться в статистических различиях при различных обработках, используют критерий хи-квадрат. (IV) Анализ T-клеточной пролиферации. Суспензии клеток клона C9 и селезеночных клеток, полученных от самок мышей NOD, анализируют на T-клеточную пролиферацию, как описано ранее (Elias et al., 1991). Коротко, 1  105 клоновых клеток/мл или 1 105 клоновых клеток/мл или 1 106 спленоцитов/мл инкубируют при четырехкратном повторении в течение 72 ч в 0,2 мл культуральной среды в лунках на микротитровальном планшете в присутствии или при отсутствии 5 мкг/мл различных антигенов. Пролиферацию измеряют, включая [3H]-тимидин в ДНК во время последних 12 ч инкубации. Результаты подсчитывают в виде индекса стимуляции – отношения тестового среднего чим (число импульсов в минуту) в присутствии антигена к среднему фоновому чим при отсутствии антигена. Стандартные отклонения между четырьмя повторами всегда составляли менее 10% от среднего чим. Фон составляет < 1000 чим при экспериментах со спленоцитами и < 200 чим в случае клеток C9. Селезенку каждой мыши исследуют отдельно. Результаты, полученные в каждой группе мышей, приведены ниже в виде среднего 106 спленоцитов/мл инкубируют при четырехкратном повторении в течение 72 ч в 0,2 мл культуральной среды в лунках на микротитровальном планшете в присутствии или при отсутствии 5 мкг/мл различных антигенов. Пролиферацию измеряют, включая [3H]-тимидин в ДНК во время последних 12 ч инкубации. Результаты подсчитывают в виде индекса стимуляции – отношения тестового среднего чим (число импульсов в минуту) в присутствии антигена к среднему фоновому чим при отсутствии антигена. Стандартные отклонения между четырьмя повторами всегда составляли менее 10% от среднего чим. Фон составляет < 1000 чим при экспериментах со спленоцитами и < 200 чим в случае клеток C9. Селезенку каждой мыши исследуют отдельно. Результаты, полученные в каждой группе мышей, приведены ниже в виде среднего  ст.откл.
Пример 1 ст.откл.
Пример 1Обработка мышей NOD p277 или его фрагментами Чтобы проверить, эффективны ли обе половины p277 из 12 аминокислот, одни или в сочетании, для мышей NOD в той же мере, как p277, самок мышей NOD в возрасте 7 недель обрабатывают посредством подкожной инокуляции 50 мкг различных пептидов в масле. Определяют состояние мышей в возрасте 40 недель. Результаты приводятся в табл. 1. Можно видеть, что контрольный пептид p278 hsp60 не оказывает действия на развитие заболевания: из 40 обработанных мышей все имеют диабет и 90% погибает в возрасте 40 недель. В противоположность этому, пептид p277 полностью предотвращает гибель и излечивает 60% из 20 обработанных мышей. Фрагменты p277 менее эффективны: аминополовина p277 (p277. N), карбоксиполовина p277 (p277.C) и их смесь (p277.N, p277.C) действуют наполовину так же, как интактный p277. Пептид p277.C синтезируют присоединенным к пептиду p278, чтобы получить более длинный пептид; однако p277.C-p278 оказался ничуть не лучше одного p277C. Следовательно, можно сделать вывод, что для полного терапевтического эффекта требуется интактный пептид p277. Пример 2 Обработка мышей NOD пептидами с замещениями в p277 Испытывают на мышах NOD следующие пептиды: p277, p277 (мостик Cys-Cys), p277(Val6-Val11) и p277(Ser6-Ser11). Самок NOD обрабатывают 100 мкг пептида в 0,2 см3 эмульсии минерального масла (IFA), которые вводят подкожно. Мышей обрабатывают в возрасте 12 недель, и представляют число случаев диабета в 30 недель. Как показано в табл. 2, p277(Val6-Val11) так же эффективен при лечении диабета, как p277, причем частота диабета у необработанных мышей составляет 80%, в то время как у мышей, обработанных p277 и p277(Val6– Val11), число случаев диабета составляет 22% и 23% соответственно. С другой стороны, ни p277 (мостик Cys-Cys), ни p277(Ser6-Ser11) не имеют никакого терапевтического эффекта. Два дополнительных варианта p277, в которых цистеиновые остатки в позициях 6 и 11 замещаются остатками аланина или  -аминомасляной кислоты, также неэффективны при испытаниях in vitro как с клоном C9, так и с селезеночными T-клетками NOD. Так как эти два пептида не распознаются специфическими T-клетками против p277 (не показано), в дальнейшем их не испытывали на терапевтический эффект in vivo.
Пример 3 -аминомасляной кислоты, также неэффективны при испытаниях in vitro как с клоном C9, так и с селезеночными T-клетками NOD. Так как эти два пептида не распознаются специфическими T-клетками против p277 (не показано), в дальнейшем их не испытывали на терапевтический эффект in vivo.
Пример 3Устойчивость p277(Val6-Val11) Так как причиной для замены цистеинов является проблематичная устойчивость пептида p277, проверяется устойчивость p277(Val6-Val11) в различные моменты времени после его синтеза. Пептид p277 неустойчив и разрушается даже в строго выдержанных условиях (лиофилизованный порошок в вакууме, -20oC). Чтобы сравнить устойчивость p277 с его аналогом p277(Val6-Val11), оба пептида синтезируют одновременно и хранят в виде сухих порошков при -20oC. Через 1, 9 и 20 дней после даты синтеза взвешивают аликвоты, растворяют и проводят испытания. Показателем устойчивости пептида является его способность стимулировать T-клеточный клон C9. Результаты эксперимента показаны на фиг. 1. Можно видеть, что в то время как нативный p277 теряет большую часть своей эффективности в пределах 9 недель и всю свою эффективность в течение 20 недель после синтеза, p277(Val6-Val11) не изменяется после 20 недель хранения. Так как предполагалось, что неустойчивость p277 вызвана цистеиновыми остатками, ожидается, что любые аналоги настоящего изобретения, которые сохраняют биологическую активность p277, будут обладать повышенной устойчивостью при сравнении с p277 по способу, подобному тому, который показан в этом примере для p277(Val6-Val11). Пример 4 Обработка самок мышей NOD p277 или p277(Val6-Val11) реверсирует инсулит Самкам мышей NOD в возрасте 12 недель дают подкожно 100 мкг/мышь немодифицированного p277 или p277(Val6-Val11) в 0,1 см3 эмульсии минерального масла (неполный адъювант Фрейнда). Контрольные мыши получают эмульсию ЗФР и минерального масла. В возрасте 6 месяцев по 5 мышей в каждой группе умерщвляют, извлекают их поджелудочные железы и фиксируют в bouin, и срезы окрашивают гематоксилином:эозином. Инсулит оценивают слепым методом. Так как у контрольных мышей развивается тяжелый диабет, их умерщвляют в возрасте 5 месяцев. В это время содержание глюкозы в крови контрольных мышей находится в интервале 29-48 ммоль/л. Результаты приводятся в табл. 3. В возрасте 12 недель на момент обработки около 60% островков у необработанных мышей показывают внутриостровковый инсулит, около 20% островков имеют периостровковый инсулит и около 20% островков показывают отсутствие инсулита. Считается, что внутриостровковая инфильтрация является тяжелой формой инсулита, ассоциированной с потерей функции  -клеток. Как показано в табл. 3, проявляется заметное отклонение в появлении островков в двух обработанных группах по сравнению с контрольными мышами, получившими одно масло. Мыши, обработанные маслом (контрольные животные), показывают прогрессирующее падение количества неповрежденных островков, и можно видеть только 10% нормальных островков в возрасте 22 недель – время, когда все мыши явно больны диабетом. Около 67% островков показывают внутриостровковый инсулит в возрасте 22 недель, а остальные 23% островков обнаруживают околоостровковый инсулит. В противоположность этому, мыши, обработанные p277 или p277(Val6-Val11), демонстрируют возрастание числа нормальных островков (от 25 до 52%) и падение числа островков с внутриостровковым инсулитом (от 6 до 17%). Число островков с околоостровковым инсулитом возрастает до 31-69%. Таким образом, обработка p277 или p277(Val6-Val11) ассоциируется с улучшением гистологической картины, согласующимся с изменением в обратном направлении степени инсулита, сохраняющимся свыше 3 месяцев после обработки.
Дополнительные результаты, полученные на самках мышей NOD с использованием p277(V) -клеток. Как показано в табл. 3, проявляется заметное отклонение в появлении островков в двух обработанных группах по сравнению с контрольными мышами, получившими одно масло. Мыши, обработанные маслом (контрольные животные), показывают прогрессирующее падение количества неповрежденных островков, и можно видеть только 10% нормальных островков в возрасте 22 недель – время, когда все мыши явно больны диабетом. Около 67% островков показывают внутриостровковый инсулит в возрасте 22 недель, а остальные 23% островков обнаруживают околоостровковый инсулит. В противоположность этому, мыши, обработанные p277 или p277(Val6-Val11), демонстрируют возрастание числа нормальных островков (от 25 до 52%) и падение числа островков с внутриостровковым инсулитом (от 6 до 17%). Число островков с околоостровковым инсулитом возрастает до 31-69%. Таким образом, обработка p277 или p277(Val6-Val11) ассоциируется с улучшением гистологической картины, согласующимся с изменением в обратном направлении степени инсулита, сохраняющимся свыше 3 месяцев после обработки.
Дополнительные результаты, полученные на самках мышей NOD с использованием p277(V)Проведено пятнадцать дополнительных экспериментов с 10 самками мышей NOD в каждой группе, которым давали p277(V) в масле или одно масло, в возрасте 12-15 недель. Из общего числа мышей 150, обработанных одним маслом, у 90% развился диабет и 85% погибли в возрасте 32 недель. В противоположность этому, мыши, обработанные p277(V), показали только 50% случаев диабета (p < 0,01) и только 20% погибли от тяжелого заболевания (p < 0,01). Следовательно, поздняя обработка p277(V) эффективна при задержке развития летального диабета. Пример 5 Пептидная терапия при диабете типа I с использованием p277(Val6-Val11) в липидных эмульсиях Аутоиммунная деструкция инсулинпродуцирующих  -клеток в поджелудочной железе опосредована T-лимфоцитами. Воспалительный инфильтрат развивается около островков поджелудочной железы в возрасте 5-8 недель, и разрушение -клеток в поджелудочной железе опосредована T-лимфоцитами. Воспалительный инфильтрат развивается около островков поджелудочной железы в возрасте 5-8 недель, и разрушение  -клеток, ведущее к инсулиновой недостаточности и явному диабету, становится очевидным в возрасте 14-20 недель, причем в возрасте 35-40 недель поражаются почти 100% самок мышей NOD.
Самкам мышей NOD дают 100 мкг пептида p277(Val6-Val11) на мышь подкожно в 0,1 мл ЗФР или 10% липидной эмульсии, состоящей из 10% соевого масла, 1,2% яичных фосфолипидов и 2,25% глицерина (интралипид, Kabi Pharmacia AB, Швеция).
Затем проверяют частоту диабета в возрасте 6 месяцев и продуцирование антител против p277(Val6-Val11). Диабет диагностируют как устойчивую гипергликемию, содержание глюкозы в крови, превышающее 11,1 ммоль/л, измеряют по меньшей мере дважды с интервалами в неделю анализатором глюкозы II, Beckman. Успешность пептидной обработки анализируют по сохранению нормального уровня концентрации глюкозы в крови (менее 11,1 ммоль/л), ремиссии внутриостровкового воспаления панкреатических островков (инсулита) и индукции антител к лечебному пептиду как индикатору иммунного ответа ТН2-типа. Результаты приводятся в табл. 4.
Как можно видеть из табл. 4, лечение пептидом настоящего изобретения, вводимым в интралипиде, эффективно для снижения числа случаев диабета и смертности. С другой стороны, лечение при введении пептида в ЗФР является неэффективным.
Пример 6 -клеток, ведущее к инсулиновой недостаточности и явному диабету, становится очевидным в возрасте 14-20 недель, причем в возрасте 35-40 недель поражаются почти 100% самок мышей NOD.
Самкам мышей NOD дают 100 мкг пептида p277(Val6-Val11) на мышь подкожно в 0,1 мл ЗФР или 10% липидной эмульсии, состоящей из 10% соевого масла, 1,2% яичных фосфолипидов и 2,25% глицерина (интралипид, Kabi Pharmacia AB, Швеция).
Затем проверяют частоту диабета в возрасте 6 месяцев и продуцирование антител против p277(Val6-Val11). Диабет диагностируют как устойчивую гипергликемию, содержание глюкозы в крови, превышающее 11,1 ммоль/л, измеряют по меньшей мере дважды с интервалами в неделю анализатором глюкозы II, Beckman. Успешность пептидной обработки анализируют по сохранению нормального уровня концентрации глюкозы в крови (менее 11,1 ммоль/л), ремиссии внутриостровкового воспаления панкреатических островков (инсулита) и индукции антител к лечебному пептиду как индикатору иммунного ответа ТН2-типа. Результаты приводятся в табл. 4.
Как можно видеть из табл. 4, лечение пептидом настоящего изобретения, вводимым в интралипиде, эффективно для снижения числа случаев диабета и смертности. С другой стороны, лечение при введении пептида в ЗФР является неэффективным.
Пример 6Пептиды p277 и p277(Val6-Val11) являются иммунологически перекрестно-реактивными Клетки из T-клеточного клона C9, выделенные из мышей NOD в преддиабетическом состоянии, инкубируют с пептидами p277 (заштрихованные кружки), p277(Val6-Val11) (незаштрихованные кружки), p277(Ser6-Ser11) (заштрихованные квадраты) и p277 (мостик Cys-Cys) (незаштрихованные ромбы). Результаты приводятся на фиг. 2. Обнаружено, что клон C9 проявляет реакцию позитивной пролиферации только на пептиды p277 и p277(Val6-Val11). Это доказывает, что p277 и p277(Val6-Val11) являются перекрестно-реактивными, и что пептиды p277(Ser6-Ser11) и p277 (мостик Cys-Cys), которые терапевтически неэффективны, не являются иммунологически перекрестно-реактивными. Пример 7 Пациенты с только что установленным диагнозом IDDM демонстрируют T-клеточные пролиферативные ответы как на p277, так и на p277(Val6-Val11) Пациенты, у которых только что установлен диагноз IDDM (возраст 2 – 4 недели), подвергаются исследованию на анализ пролиферации. Лимфоциты периферийной крови выделяют из цельной гепаринизированной крови на фиколл-гипаке и скринируют in vitro на пролиферацию, измеряемую в виде включения 3H-тимидина, индуцированную пептидами hsp60 p277, p277(Val6-Val11) и контрольным пептидом p278. Реакцию T-клеточной пролиферации изображают в виде индекса стимуляции (SI) – отношения стимулированных пептидом включений тимидина к фоновым (без добавления антигена) включениям тимидина в T-клетки. Как показано в табл. 5, пациенты с только что установленным диагнозом IDDM отвечают на p277(Val6-Val11) так же, как на пептид p277. Следовательно, p277(Val6-Val11) иммунологически эквивалентен p277. Так как терапевтический эффект p277 опосредован иммунологическим узнаванием, тот факт, что p277(Val6-Val11) иммунологически перекрестно-реактивен с p277, показывает, что его можно применять вместо p277 при лечении диабета. Пример 8 T-клеточные ответы на hsp60 и пептид при IDDM и у здоровых индивидуумов Двадцать один пациент с IDDM и четырнадцать здоровых доноров крови скринируют на анти-hsp60 и p277(V) посредством анализа пролиферации из примера 7. Табл. 6 и 7 показывают пролиферативную реакцию T-клеток (индекс стимуляции; SI) каждого индивидуума на контрольный антиген (контрольный Аг), т.е. на столбнячный токсин и вирус гриппа – штамм Texas, к целому рекомбинатному hsp60 и к p277(V). Величины SI 3 или больше считаются позитивными. Табл. 8 является итоговой таблицей, показывающей, что 86% и 52% пациентов отвечает на hsp60 и p277(V), по сравнению с 21% и 14% контрольными (p < 0,05). Таким образом, группа с IDDM является существенно положительной для T-клеточных реакций на hsp60 и p277(V). Отсюда следует вывод, что число индивидуумов, реактивных к hsp60 и p277(V), выше среди пациентов с IDDM, чем среди здоровых людей. Пример 9 T-Клеточная пролиферация у NOD-мышей на p277(Lys19) Пептид p277(Lys19) отличается от p277 одной аминокислотой. Чтобы подтвердить, что p277(Lys19) является аутоантигеном при IDDM у мышей NOD, сравнивают T-клеточную пролиферацию на пептид p277 и пептид p277(Lys19). Фиг. 3 показывает, что T-клетки селезенки самки мышей NOD пролиферируют в ответ на p277(Lys19) в такой же степени, как на p277. Нет реакции на контрольный пептид p278. Приведенные выше результаты подтверждаются при применении клона C9 – дибетогенного клона T-клеток NOD, который, как обнаружено, отвечает на человеческий пептид p277 (Elias et al., 1991). Обнаружено, что клетки C9 пролиферируют в ответ на пептид p277(Lys19) в такой же степени, как на пептид p277 (фиг. 4). Пример 10 Обработка самок мышей NOD p277(Lys19) Авторы настоящего изобретения ранее сообщали, что развитой инсулит, имеющий место у самок мышей NOD в возрасте 3 месяцев, можно остановить посредством введения мышам одной инъекции человеческого p277; у обработанных мышей меньше число случаев развития диабета до клинически явного и число смертей от тяжелой гипергликемии. Чтобы проверить, является ли пептид p277(Lys19), который представляет собой собственно мышиный пептид p277, таким же эффективным, самкам мышей NOD в возрасте 3 месяцев дают 100 мкг либо человеческого p277, либо p277(Lys19) в IFA. Пептиды p277 или p277(Lys18) при концентрации 2 мг/мл в забуференном фосфатом физиологическом растворе (ЗФР) эмульгируют с равным объемом неполного адъюванта Фрейнда (IFA). Группам по 10 особей самок мышей NOD в возрасте 3 месяцев инъецируют подкожно 0,1 мл (100 мкг пептида) эмульсии, содержащей один из двух пептидов. Контрольной группе инъецируют эмульсию ЗФР и IFA. У мышей берут кровь каждые 4 недели, и определяют уровень глюкозы в крови с помощью анализатора глюкозы II, Beckman. Частоту гипергликемии и смертности от диабета оценивают в возрасте 6 месяцев. Мыши считаются в состоянии диабета, если у них содержание глюкозы в крови превышает 11 ммоль/л. Результаты приводятся в табл. 9. В возрасте 6 месяцев 90% контрольных мышей имели тяжелую гипергликемию и 60% погибли от диабета. В противоположность этому, обработка либо p277, либо p277(Lys19) предотвращает как диабет (40% и 50% случаев соответственно), так и гибель (10% и 20% случаев соответственно). Таким образом, оказывается, что собственно мышиный пептид p277(Lys19) так же эффективен, как чужеродный p277 при лечении развитого инсулита. Эти результаты показывают, что пролиферативные реакции T-клеток мышей NOD, детектированные с применением молекулы человеческого hsp60 и его пептида p277, являются эквивалентами аутоиммунных ответов на мышиный hsp60 и мышиную последовательность p277(Lys19). Это обнаружено в случае диабетогенного T-клеточного клона C9, а также в случае спонтанной реакции, развивающейся в селезенке мышей в состоянии преддиабета. Кроме того, p277(Lys19) эффективен, как и p277, при лечении диабета у мышей NOD. Селезеночные T-клетки противоположных по возрасту и полу мышей других штаммов не проявляют реакции спонтанной T-клеточной пролиферации на p277 (не показано). Обнаружение аутоиммунитета к последовательности мышиного hsp60, являющейся мишенью диабетогенных T-клеток, подтверждает общее предположение, что IDDM вызывается аутоиммунным процессом. Пример 11 Лечение индуцированного STZ диабета с помощью p277(V) Стрептозотоцин является бета-клеточным специфическим токсином, который может вызвать токсический диабет, разрушая бета-клетки в течение 24-48 ч, если инъецирована одна доза в 200 мг/кг. Полученный в небольших субтоксичных дозах, он индуцирует у генетически восприимчивых мышей инсулит, ведущий к диабету. Восполительный процесс может занять 20-30 дней, в зависимости от дозы STZ. Обычной схемой индуцирования диабета STZ является доза STZ в 200 мг на 1 кг массы тела, данная в виде 5 равных доз по 40 мг/кг день за днем (Like and Rossini, 1976), а моделью является названная низкая доза STZ. Обнаружено, что если общая доза снижается до 150 мг/кг (30 мг/кг  5), диабет развивается в течение 80-100 дней. Такая медленно прогрессирующая форма индуцированного STZ диабета, вероятно, больше походит на аутоиммунный диабет у людей и имеет такую же длительность, как преклиническая стадия спонтанного диабета у мышей NOD (Castano and Eisenbarth, 1990). Кроме того, при уменьшении дозы снижается острое токсическое действие.
Хитшоковый белок в 60 кД (hsp60) играет роль как при NOD-диабете (Elias et al. , 1990), так и при индуцированном STZ диабете (Elias et al., 1994). Авторы изобретения ранее показали, 5), диабет развивается в течение 80-100 дней. Такая медленно прогрессирующая форма индуцированного STZ диабета, вероятно, больше походит на аутоиммунный диабет у людей и имеет такую же длительность, как преклиническая стадия спонтанного диабета у мышей NOD (Castano and Eisenbarth, 1990). Кроме того, при уменьшении дозы снижается острое токсическое действие.
Хитшоковый белок в 60 кД (hsp60) играет роль как при NOD-диабете (Elias et al. , 1990), так и при индуцированном STZ диабете (Elias et al., 1994). Авторы изобретения ранее показали,что как антителогенез, так и T-клеточная пролиферативная реакция к hsp60 имеют место до начала явного диабета. T-клеточные клоны, специфические для hsp60, получают от мышей NOD в состоянии преддиабета и могут перенести инсулит и гипергликемию, с хорошим усвоением, молодым мышам NOD (Elias et ai., 1991) или мышам NOD   i i . Диабетогенные T-клеточные клоны NOD узнают пептид длиной в 24 аминокислоты последовательности hsp60 437-460, которая названа p277. Диабет, индуцированный STZ, также сопровождается T-клеточными реакциями против p277 в преклинической стадии.
В предыдущих примерах показано, что пептид p277(Val6-Val11) защищает мышей NOD. В настоящем эксперименте проверяется эффективность обработки p277 (V) на модели с низкой дозой STZ.
Самцов мышей, по 10 в группе, обрабатывают дозами STZ в 30 мг/кг ежедневно в течение 5 дней. Неделю спустя мышам дают 100 мкг либо p277 (V) в масле, либо пептида глутаминовая кислота – декарбоксилаза (GADp34), описанного Кауфманом с сотр., 1993, как участвующего в диабете у мышей NOD, либо одно масло. Обработку повторяют на 85 день. На 100 день у мышей берут кровь, и их кровь проверяют на гипергликемию (концентрация глюкозы превышает 15 нмолей/л). Результаты суммированы на фиг. 5. Можно видеть, что среднее содержание глюкозы в крови в группах мышей, обработанных GADp34, или у необработанных находится в гипергликемическом интервале. В противоположность этому, средний уровень глюкозы в крови у мышей, обработанных p277 (V), находится в нормальных пределах. Таким образом, p277 (V) может быть эффективным при лечении диабета, индуцированного STZ у самцов мышей C57BL/ksj, а также спонтанного диабета, развивающегося у генетически отличных самок мышей NOD. Применимость лечения p277 (V) не ограничивается только одним случаем диабета или диабета только одного генотипа или пола.
Все цитированные здесь ссылки, включая журнальные статьи или рефераты, опубликованные или соответствующие заявки на патент США, или на иностранные патенты, выданные в США или иностранные патенты, или любые другие ссылки, полностью включены в настоящее в качестве ссылок, включая все данные, таблицы, чертежи и тексты, представленные в цитированных ссылках. Кроме того, полное содержание ссылок, цитированных в ссылках, цитированных здесь, также полностью включено в настоящее в качестве ссылок.
Ссылки на стадии известного способа, стадии обычного способа, известные способы или обычные способы никоим образом не допускают, что какой-либо аспект, описание или вариант осуществления настоящего изобретения раскрываются, поясняются или предлагаются в данной области техники.
Приведенное выше описание конкретных вариантов осуществления изобретения будут показывать общую сущность изобретения настолько полно, что, используя известные сведения в данной области техники (включая содержание цитированных здесь ссылок), другие специалисты могут легко модифицировать и/или приспособить такие конкретные варианты осуществления изобретения для различного применения, без чрезмерного экспериментирования, не отступая от главной идеи настоящего изобретения. Следовательно, имеется в виду, что такие адаптации и модификации находятся в пределах целей и серии эквивалентов раскрытых вариантов осуществления изобретения, основанных на представленных здесь пояснениях и указаниях. Следует также иметь в виду, что использованная здесь фразеология или терминология предназначена для целей описания, а не ограничения, так что терминология или фразеология в настоящем описании должна интерпретироваться специалистами в свете представленных здесь пояснений и указаний, в сочетании со знаниями специалиста в этой области техники.
Ссылки . Диабетогенные T-клеточные клоны NOD узнают пептид длиной в 24 аминокислоты последовательности hsp60 437-460, которая названа p277. Диабет, индуцированный STZ, также сопровождается T-клеточными реакциями против p277 в преклинической стадии.
В предыдущих примерах показано, что пептид p277(Val6-Val11) защищает мышей NOD. В настоящем эксперименте проверяется эффективность обработки p277 (V) на модели с низкой дозой STZ.
Самцов мышей, по 10 в группе, обрабатывают дозами STZ в 30 мг/кг ежедневно в течение 5 дней. Неделю спустя мышам дают 100 мкг либо p277 (V) в масле, либо пептида глутаминовая кислота – декарбоксилаза (GADp34), описанного Кауфманом с сотр., 1993, как участвующего в диабете у мышей NOD, либо одно масло. Обработку повторяют на 85 день. На 100 день у мышей берут кровь, и их кровь проверяют на гипергликемию (концентрация глюкозы превышает 15 нмолей/л). Результаты суммированы на фиг. 5. Можно видеть, что среднее содержание глюкозы в крови в группах мышей, обработанных GADp34, или у необработанных находится в гипергликемическом интервале. В противоположность этому, средний уровень глюкозы в крови у мышей, обработанных p277 (V), находится в нормальных пределах. Таким образом, p277 (V) может быть эффективным при лечении диабета, индуцированного STZ у самцов мышей C57BL/ksj, а также спонтанного диабета, развивающегося у генетически отличных самок мышей NOD. Применимость лечения p277 (V) не ограничивается только одним случаем диабета или диабета только одного генотипа или пола.
Все цитированные здесь ссылки, включая журнальные статьи или рефераты, опубликованные или соответствующие заявки на патент США, или на иностранные патенты, выданные в США или иностранные патенты, или любые другие ссылки, полностью включены в настоящее в качестве ссылок, включая все данные, таблицы, чертежи и тексты, представленные в цитированных ссылках. Кроме того, полное содержание ссылок, цитированных в ссылках, цитированных здесь, также полностью включено в настоящее в качестве ссылок.
Ссылки на стадии известного способа, стадии обычного способа, известные способы или обычные способы никоим образом не допускают, что какой-либо аспект, описание или вариант осуществления настоящего изобретения раскрываются, поясняются или предлагаются в данной области техники.
Приведенное выше описание конкретных вариантов осуществления изобретения будут показывать общую сущность изобретения настолько полно, что, используя известные сведения в данной области техники (включая содержание цитированных здесь ссылок), другие специалисты могут легко модифицировать и/или приспособить такие конкретные варианты осуществления изобретения для различного применения, без чрезмерного экспериментирования, не отступая от главной идеи настоящего изобретения. Следовательно, имеется в виду, что такие адаптации и модификации находятся в пределах целей и серии эквивалентов раскрытых вариантов осуществления изобретения, основанных на представленных здесь пояснениях и указаниях. Следует также иметь в виду, что использованная здесь фразеология или терминология предназначена для целей описания, а не ограничения, так что терминология или фразеология в настоящем описании должна интерпретироваться специалистами в свете представленных здесь пояснений и указаний, в сочетании со знаниями специалиста в этой области техники.
СсылкиBendelac A, Carnaud C, Boitard C, Bach JF. (1987) Syngeneic transfer of autoimmune diabetes from diabetic NOD ice to healthy neonates. Requirement for both L3T4+ and Ly  2 + T cells. J Exp Med. 166:823-32.
Bowman MA, Leiter EH and Atkinson MA. (1994) Prevention of diabetes in the NOD mouse: implications for therapeutic intervention in human disease. Immunology Today. 15:115-20.
Castano L, Eisenbarth GS. (1990) Type-I diabetes: a chronic autoimmune disease of human, mouse, and rat. Annu Rev Immunol. 8:647-79.
Elias, Dana. (1994) The NOD mouse: A model for autoimmune insulin-dependent diabetes. Autoimmune Disease Models. A Guidebook. pp 147-61.
Elias D, Markovits D, Reshef T, van-Der Zee R and Cohen IR (1990) Induction and therapy of autoimmune diabetes in the non- obese diabetic (NOD/Lt) mouse by a 65-kDa heat shock protein. Proc Natl Acad Sci USA. 87:1576-80.
Elias D, Prigozin H, Polak N, Rapoport M, Lohse AW, Cohen IR (1994) Autoimmune diabetes induced by the b-cell toxin streptozotocin. Diabetes. 43: 992-98.
Elias D, Reshef T, Birk OS, van der Zee R, Walker MD, Cohen IR. (1991) Vaccination against autoimmune mouse diabetes with a T-cell epitope of the human 65 kDa heat shock protein. Proc Natl Acad Sci USA. 88:3088-91.
Elias D. and Cohen IR. (1994) Peptide therapy for diabetes in NOD mice. The Lancet. 343:704-06.
Kaufman DL, Clare-Salzler M, Tian J, Forsthuber T, Ting GSP, Robinson P, Atkinson MA, Sercarz ЕЕ, Tobin AJ, Lehmann PV. (1993) Spontaneous loss of T-cell tolerance to glutamic acid decarboxylase in murine insulin-dependent diabetes. Nature. 366:69-72.
Like AA, Rossini AA (1976) Streptozotocin-induced pancreatic insulitis: new model of diabetes mellitus. Science. 193:415-17.
Mosmann T.R. and Coffman R.I. (1989) Ann Rev Immunol. 7:145-73.
Tisch R, Yang XD, Singer SM, Liblav RS, Fuggar L, McDevitt HO. (1993) Immune response to glutamic acid decarboxylase correlates with insulitis in non-obese diabetic mice. Nature. 366:72-75.
Список последовательностей 2 + T cells. J Exp Med. 166:823-32.
Bowman MA, Leiter EH and Atkinson MA. (1994) Prevention of diabetes in the NOD mouse: implications for therapeutic intervention in human disease. Immunology Today. 15:115-20.
Castano L, Eisenbarth GS. (1990) Type-I diabetes: a chronic autoimmune disease of human, mouse, and rat. Annu Rev Immunol. 8:647-79.
Elias, Dana. (1994) The NOD mouse: A model for autoimmune insulin-dependent diabetes. Autoimmune Disease Models. A Guidebook. pp 147-61.
Elias D, Markovits D, Reshef T, van-Der Zee R and Cohen IR (1990) Induction and therapy of autoimmune diabetes in the non- obese diabetic (NOD/Lt) mouse by a 65-kDa heat shock protein. Proc Natl Acad Sci USA. 87:1576-80.
Elias D, Prigozin H, Polak N, Rapoport M, Lohse AW, Cohen IR (1994) Autoimmune diabetes induced by the b-cell toxin streptozotocin. Diabetes. 43: 992-98.
Elias D, Reshef T, Birk OS, van der Zee R, Walker MD, Cohen IR. (1991) Vaccination against autoimmune mouse diabetes with a T-cell epitope of the human 65 kDa heat shock protein. Proc Natl Acad Sci USA. 88:3088-91.
Elias D. and Cohen IR. (1994) Peptide therapy for diabetes in NOD mice. The Lancet. 343:704-06.
Kaufman DL, Clare-Salzler M, Tian J, Forsthuber T, Ting GSP, Robinson P, Atkinson MA, Sercarz ЕЕ, Tobin AJ, Lehmann PV. (1993) Spontaneous loss of T-cell tolerance to glutamic acid decarboxylase in murine insulin-dependent diabetes. Nature. 366:69-72.
Like AA, Rossini AA (1976) Streptozotocin-induced pancreatic insulitis: new model of diabetes mellitus. Science. 193:415-17.
Mosmann T.R. and Coffman R.I. (1989) Ann Rev Immunol. 7:145-73.
Tisch R, Yang XD, Singer SM, Liblav RS, Fuggar L, McDevitt HO. (1993) Immune response to glutamic acid decarboxylase correlates with insulitis in non-obese diabetic mice. Nature. 366:72-75.
Список последовательностей(1) Общая информация (I) ЗАЯВИТЕЛЬ: (А) ИМЯ: YEDA RESEARCH AND DEVELOPMENT CO. LTD (Б) УЛИЦА: P.O. Box 95 (В) ГОРОД: Rehovot (Д) СТРАНА: Израиль (Е) ПОЧТОВЫЙ ИНДЕКС (ZIP): 76100 (А) ИМЯ: lrun R. COHEN (Б) УЛИЦА: 11 Hankin Street (В) ГОРОД: Rehovot (Д) СТРАНА: Израиль (Е) ПОЧТОВЫЙ ИНДЕКС (ZIP): 76354 (А) ИМЯ; Dana ELIAS (Б) УЛИЦА: 57 Derech Yavne (В) ГОРОД: Rehovot (Д) СТРАНА: Израиль (Е) ПОЧТОВЫЙ ИНДЕКС (ZIP): 76344 (А) ИМЯ: Matityahu FRIDKIN (Б) УЛИЦА: 23 Miller Street (В) ГОРОД: Rehovot (Д) СТРАНА: Израиль (Е) ПОЧТОВЫЙ ИНДЕКС (ZIP): 76284 (II) НАЗВАНИЕ ИЗОБРЕТЕНИЯ: АНАЛОГИ ПЕПТИДА p277 И СОДЕРЖАЩИЕ ИХ ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ ДЛЯ ЛЕЧЕНИЯ ИЛИ ДИАГНОСТИКИ ДИАБЕТА (III) ЧИСЛО ПОСЛЕДОВАТЕЛЬНОСТЕЙ: 10 (IV) ФОРМА КОМПЬЮТЕРНОГО СЧИТЫВАНИЯ: (А) ТИП СРЕДЫ: Дискета (Б) КОМПЬЮТЕР: совместимый с системой IDM PC (В) ОПЕРАЦИОННАЯ СИСТЕМА: PC-DOS/MS-DOS (Г) ПРОГРАММНОЕ ОБЕСПЕЧЕНИЕ: Patentln Release #1.0, версия #1.30 (EPO) (VI) СВЕДЕНИЯ О ПРЕДЫДУЩЕЙ ЗАЯВКЕ: (А) НОМЕР ЗАЯВКИ: IL 112094 (Б) ДАТА РЕГИСТРАЦИИ: 21 декабря 1994 (VI) СВЕДЕНИЯ О ПРЕДЫДУЩЕЙ ЗАЯВКЕ: (А) НОМЕР ЗАЯВКИ: IL 114460 (Б) ДАТА РЕГИСТРАЦИИ: 05 июля 1995 (2) ИНФОРМАЦИЯ О ПОСЛЕД. N 1 (I) ХАРАКТЕРИСТИКИ ПОСЛЕДОВАТЕЛЬНОСТИ: (А) ДЛИНА: 24 аминокислоты (Б) ТИП: аминокислота (В) Одноцепочечная (Г) ТОПОЛОГИЯ: линейная (II) ТИП МОЛЕКУЛЫ: пептид (XI) ОПИСАНИЕ ПОСЛЕДОВАТЕЛЬНОСТИ: ПОСЛЕД. N 1 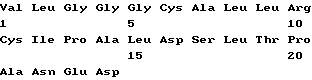 (2) ИНФОРМАЦИЯ О ПОСЛЕД. N 2 (I) ХАРАКТЕРИСТИКИ ПОСЛЕДОВАТЕЛЬНОСТИ: (А) ДЛИНА: 24 аминокислоты (Б) ТИП: аминокислота (В) Одноцепочечная (Г) ТОПОЛОГИЯ: линейная (II) ТИП МОЛЕКУЛЫ: пептид (IX) ПРИЗНАКИ: (А) НАЗВАНИЕ/КЛЮЧ: Пептид (Б) РАСПОЛОЖЕНИЕ; 6, 11, 19 (Г) ДРУГАЯ ИНФОРМАЦИЯ: /примечание=”Xaa в поз. 6/11=Cys или Val; Xaa в поз. 19=Thr или Lys; при этом Xaa в поз. 6/11 оба не равны Cys, когда Xaa в поз. 19 равен Thr.” (XI) ОПИСАНИЕ ПОСЛЕДОВАТЕЛЬНОСТИ: ПОСЛЕД. N 2. 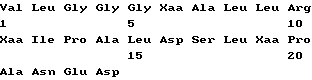 (2) ИНФОРМАЦИЯ О ПОСЛЕД. N 3 (I) ХАРАКТЕРИСТИКИ ПОСЛЕДОВАТЕЛЬНОСТИ: (А) ДЛИНА: 24 аминокислоты (Б) ТИП: аминокислота (В) Одноцепочечная (Г) ТОПОЛОГИЯ: линейная (II) ТИП МОЛЕКУЛЫ: пептид (XI) ОПИСАНИЕ ПОСЛЕДОВАТЕЛЬНОСТИ: ПОСЛЕД. N 3 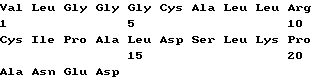 (2) ИНФОРМАЦИЯ О ПОСЛЕД. N 4 (I) ХАРАКТЕРИСТИКИ ПОСЛЕДОВАТЕЛЬНОСТИ: (А) ДЛИНА: 24 аминокислоты (Б) ТИП: аминокислота (В) Одноцепочечная (Г) ТОПОЛОГИЯ: линейная (II) ТИП МОЛЕКУЛЫ: пептид (IX) ПРИЗНАКИ: (А) НАЗВАНИЕ/КЛЮЧ: Пептид (Б) РАСПОЛОЖЕНИЕ: 19 (Г) ДРУГАЯ ИНФОРМАЦИЯ:/примечание=”Xaa в поз. 19=Thr или Lys” (XI) ОПИСАНИЕ ПОСЛЕДОВАТЕЛЬНОСТИ: ПОСЛЕД. N 4 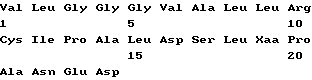 (2) ИНФОРМАЦИЯ О ПОСЛЕД. N 5 (I) ХАРАКТЕРИСТИКИ ПОСЛЕДОВАТЕЛЬНОСТИ: (А) ДЛИНА: 24 аминокислоты (Б) ТИП: аминокислота (В) Одноцепочечная (Г) ТОПОЛОГИЯ: линейная (II) ТИП МОЛЕКУЛЫ: пептид (XI) ОПИСАНИЕ ПОСЛЕДОВАТЕЛЬНОСТИ: ПОСЛЕД. N 5 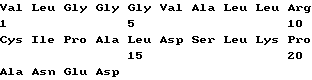 (2) ИНФОРМАЦИЯ О ПОСЛЕД. N 6 (I) ХАРАКТЕРИСТИКИ ПОСЛЕДОВАТЕЛЬНОСТИ: (А) ДЛИНА: 24 аминокислоты (Б) ТИП: аминокислота (В) Одноцепочечная (Г) ТОПОЛОГИЯ: линейная (II) ТИП МОЛЕКУЛЫ: пептид (IX) ПРИЗНАКИ: (А) НАЗВАНИЕ/КЛЮЧ: Пептид (Б) РАСПОЛОЖЕНИЕ: 19 (Г) ДРУГАЯ ИНФОРМАЦИЯ:/примечание=”Xaa в поз. 19 = Thr или Lys” (XI) ОПИСАНИЕ ПОСЛЕДОВАТЕЛЬНОСТИ: ПОСЛЕД. N 6 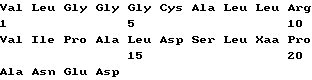 (2) ИНФОРМАЦИЯ О ПОСЛЕД. N 7 (I) ХАРАКТЕРИСТИКИ ПОСЛЕДОВАТЕЛЬНОСТИ: (А) ДЛИНА: 24 аминокислоты (Б) ТИП: аминокислота (В) Одноцепочечная (Г) ТОПОЛОГИЯ: линейная (II) ТИП МОЛЕКУЛЫ: пептид (XI) ОПИСАНИЕ ПОСЛЕДОВАТЕЛЬНОСТИ: ПОСЛЕД. N 7 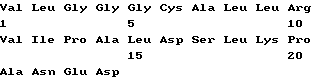 (2) ИНФОРМАЦИЯ О ПОСЛЕД. N 8 (I) ХАРАКТЕРИСТИКИ ПОСЛЕДОВАТЕЛЬНОСТИ: (А) ДЛИНА: 24 аминокислоты (Б) ТИП: аминокислота (В) Одноцепочечная (Г) ТОПОЛОГИЯ: линейная (II) ТИП МОЛЕКУЛЫ: пептид (IX) ПРИЗНАКИ: (А) НАЗВАНИЕ/КЛЮЧ: Пептид (Б) РАСПОЛОЖЕНИЕ: 19 (Г) ДРУГАЯ ИНФОРМАЦИЯ:/примечание=”Xaa в поз. 19 равно Thr или Lys” (XI) ОПИСАНИЕ ПОСЛЕДОВАТЕЛЬНОСТИ: ПОСЛЕД. N 8 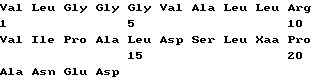 (2) ИНФОРМАЦИЯ О ПОСЛЕД. N 9 (I) ХАРАКТЕРИСТИКИ ПОСЛЕДОВАТЕЛЬНОСТИ: (А) ДЛИНА: 24 аминокислоты (Б) ТИП: аминокислота (В) Одноцепочечная (Г) ТОПОЛОГИЯ: линейная (II) ТИП МОЛЕКУЛЫ: пептид (XI) ОПИСАНИЕ ПОСЛЕДОВАТЕЛЬНОСТИ: ПОСЛЕД. N 9 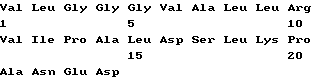 (2) ИНФОРМАЦИЯ О ПОСЛЕД. N 10 (I) ХАРАКТЕРИСТИКИ ПОСЛЕДОВАТЕЛЬНОСТИ: (А) ДЛИНА: 17 аминокислот (Б) ТИП: аминокислота (В) Одноцепочечная (Г) ТОПОЛОГИЯ: линейная (II) ТИП МОЛЕКУЛЫ: пептид (XI) ОПИСАНИЕ ПОСЛЕДОВАТЕЛЬНОСТИ: ПОСЛЕД. N 10 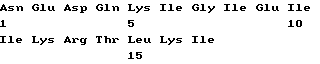
Формула изобретения
 где X1 и X2 каждый представляют собой остатки Cys или Val и X3 является остатком Thr или Lys, но X1 и X2 оба не могут быть остатками Cys, когда X3 представляет собой Thr, и его соли и функциональные производные. 2. Пептид по п. 1, выбранный из пептидов, обозначенных здесь как p277 (Val11), где X1 представляет собой Cys, X2 представляет собой Val и X3 представляет собой Thr; p277 (Val6-Val11), где как X1, так и X2 являются Val и X3 представляет собой Thr; p277 (Val11-Lys19), где X1 представляет собой Cys, X2 является Val и X3 представляет собой Lys; p277 (Val6,11-Lys19), где как X1, так и X2 представляют собой Val и X3 представляет собой Lys. 3. Пептид по п.1 или 2 для получения композиции для диагностики инсулинзависимого сахарного диабета (далее – IDDM). 4. Способ диагностики развившегося или развивающегося IDDM у пациента, включающий исследование крови или мочи указанного пациента с помощью пептида по п. 1 или 2 в качестве антигена на присутствие антител, которые иммунологически реактивны с человеческим hsp60, результат которого, показывающий положительное присутствие антител против hsp60, которая иммунореактивна с hsp60, указывает на высокую вероятность наличия или начальной стадии IDDM. 5. Способ по п.4, отличающийся тем, что присутствие антител против hsp60 исследуют с помощью радиоиммуноанализа или по методу ELISA (твердофазный иммуноферментный анализ). 6. Набор для диагностики IDDM путем исследования на присутствие антител против hsp60 по способу по п.4 или 5, содержащий: (I) антиген, являющийся пептидом последовательности (1) по п.1, и (II) меченое антитело, способное распознавать невариабельную область указанных антител против hsp60, которые определяют. 7. Способ диагностики развившегося или развивающегося IDDM у пациента, включающий исследование крови или мочи указанного пациента с помощью пептида по п.1 или 2 в качестве антигена на присутствие Т-клеток, которые иммунологически реактивны с человеческим hsp60, результат которого, показывающий положительное присутствие Т-клеток, которые иммунореактивны с hsp60, указывает на высокую вероятность наличия или начальной стадии IDDM. 8. Способ по п.7, отличающийся тем, что присутствие Т-клеток, которые иммунореактивны с hsp60, проверяют с помощью испытания на Т-клеточную пролиферацию, включающий следующие стадии: (I) получение мононуклеарной клеточной фракции, содержащей Т-клетки из образца крови, взятого у указанного пациента, (II) добавление к указанной мононуклеарной клеточной фракции антигена, выбранного из числа пептидов по п.1; (III) инкубирование указанной клеточной фракции в присутствии указанного антигена в течение подходящего периода времени и при подходящих для культивирования условиях; (IV) добавление меченого нуклеотида к инкубируемой клеточной культуре (III) в подходящий момент времени перед окончанием указанного периода инкубации для обеспечения включения указанного меченого нуклеотида в ДНК пролиферирующих Т-клеток и (V) определение количества пролиферирующих Т-клеток с помощью анализа количества меченого нуклеотида, включенного в указанные Т-клетки. 9. Способ по п.7, отличающийся тем, что присутствие Т-клеток, которые иммунореактивны с hsp60, проверяют с помощью испытания на Т-клеточную цитокинную реакцию, включающего следующие стадии: (I) получение мононуклеарной клеточной фракции, содержащей Т-клетки из образца крови, взятого у указанного пациента; (II) добавление к указанной мононуклеарной клеточной фракции антигена, выбранного из числа пептидов по п.1; (III) инкубирование указанной клеточной фракции в присутствии указанного антигена в течение подходящего периода времени и при подходящих для культивирования условиях и (IV) определение наличия цитокина, секретированного отвечающими лимфоцитами в среду, при этом цитокин представляет собой  -интерферон, IL-2, IL-4, IL-6, IL-10, TNF -интерферон, IL-2, IL-4, IL-6, IL-10, TNF или TGF или TGF .
10. Набор для диагностики IDDM путем испытания на присутствие Т-клеток, которые иммунореактивны с hsp60, по способу по п.8, содержащий: (I) антиген, являющийся пептидом по п.1; (II) меченый нуклеотид и (III) подходящую среду для культивирования лимфоцитов.
11. Набор для диагностики IDDM путем испытания на присутствие Т-клеток, которые иммунореактивны с hsh60, по способу по п.9, содержащий: (I) антиген, являющийся пептидом по п.1; (II) подходящую среду для культивирования лимфоцитов и (III) аналитический набор для определения присутствия цитокина, секретированного отвечающими лимфоцитами в среду.
12. Препарат для профилактики или лечения IDDM, содержащий Т-клеточный продукт, выбранный из группы, включающей: а) человеческие Т-клетки, которые проявляют специфичность к последовательности p277 человеческого hsp60, где указанные клетки активированы путем инкубации в присутствии пептида последовательности (I) по п.1; (б) указанные человеческие Т-клетки, которые облучены или аттенюированы другим способом; (в) указанные человеческие Т-клетки, которые подвергнуты обработке давлением посредством гидростатического давления, обработке химическим перекрестносшивающим агентом и/или обработке цитоскелетным перекрестносшивающим агентом; (г) фрагменты или поверхностные белки, образованные из Т-клеток по (а), (б) или (в); или (д) пептид, состоящий, по существу, из вариабельной области рецептора (а), специфического для указанного белка, или его соль, функциональное производное, предшественник или его активную фракцию.
13. Препарат по п.12, отличающийся тем, что указанные человеческие Т-клетки (а) являются аутологичными Т-клетками, полученными от больного IDDM, подвергаемого лечению, и указанная специфичность указанных Т-клеток создана путем контакта in vitro с указанным пептидом последовательности 1.
14. Препарат по п.12 или 13, отличающийся тем, что указанные Т-клетки обладают созданной in vitro специфичностью к пептиду последовательности 1 по п.1.
15. Фармацевтическая композиция для профилактики или лечения IDDM, содержащая пептид последовательности 1 по п.1 и фармацевтически приемлемый носитель.
16. Фармацевтическая композиция по п.15, где указанный пептид является пептидом по п.2.
17. Пептид по п. 1 или 2 в качестве активного ингредиента фармацевтической композиции для предупреждения или лечения IDDM.
Приоритет по пунктам: .
10. Набор для диагностики IDDM путем испытания на присутствие Т-клеток, которые иммунореактивны с hsp60, по способу по п.8, содержащий: (I) антиген, являющийся пептидом по п.1; (II) меченый нуклеотид и (III) подходящую среду для культивирования лимфоцитов.
11. Набор для диагностики IDDM путем испытания на присутствие Т-клеток, которые иммунореактивны с hsh60, по способу по п.9, содержащий: (I) антиген, являющийся пептидом по п.1; (II) подходящую среду для культивирования лимфоцитов и (III) аналитический набор для определения присутствия цитокина, секретированного отвечающими лимфоцитами в среду.
12. Препарат для профилактики или лечения IDDM, содержащий Т-клеточный продукт, выбранный из группы, включающей: а) человеческие Т-клетки, которые проявляют специфичность к последовательности p277 человеческого hsp60, где указанные клетки активированы путем инкубации в присутствии пептида последовательности (I) по п.1; (б) указанные человеческие Т-клетки, которые облучены или аттенюированы другим способом; (в) указанные человеческие Т-клетки, которые подвергнуты обработке давлением посредством гидростатического давления, обработке химическим перекрестносшивающим агентом и/или обработке цитоскелетным перекрестносшивающим агентом; (г) фрагменты или поверхностные белки, образованные из Т-клеток по (а), (б) или (в); или (д) пептид, состоящий, по существу, из вариабельной области рецептора (а), специфического для указанного белка, или его соль, функциональное производное, предшественник или его активную фракцию.
13. Препарат по п.12, отличающийся тем, что указанные человеческие Т-клетки (а) являются аутологичными Т-клетками, полученными от больного IDDM, подвергаемого лечению, и указанная специфичность указанных Т-клеток создана путем контакта in vitro с указанным пептидом последовательности 1.
14. Препарат по п.12 или 13, отличающийся тем, что указанные Т-клетки обладают созданной in vitro специфичностью к пептиду последовательности 1 по п.1.
15. Фармацевтическая композиция для профилактики или лечения IDDM, содержащая пептид последовательности 1 по п.1 и фармацевтически приемлемый носитель.
16. Фармацевтическая композиция по п.15, где указанный пептид является пептидом по п.2.
17. Пептид по п. 1 или 2 в качестве активного ингредиента фармацевтической композиции для предупреждения или лечения IDDM.
Приоритет по пунктам:21.12.94 по пп.1 – 17. РИСУНКИ
|
||||||||||||||||||||||||||
