Патент на изобретение №2159248
|
||||||||||||||||||||||||||
(54) ОЛИГОНУКЛЕОТИД, СПОСОБ АМПЛИФИКАЦИИ НУКЛЕИНОВОЙ КИСЛОТЫ-МИШЕНИ И НАБОР ДЛЯ ПРОВЕДЕНИЯ РЕАКЦИИ АМПЛИФИКАЦИИ
(57) Реферат: Описывается олигонуклеотид, имеющий следующее строение: 5′ -S1-N(R)-3′ или 5′-S1-N(R)S2-3′, где S1 обозначает первую нуклеотидную последовательность, имеющую длину от приблизительно 5 до приблизительно 50 нуклеотидов, S2 обозначает вторую последовательность, имеющую длину от одного до трех нуклеотидов. N обозначает нуклеотид, который содержит пуриновое или пиримидиновое основание, в состав которого входит экзоциклический амин, R обозначает группу-модификатор, причем R ковалентно связан с N через экзоциклический амин и имеет следующую структуру: R1-C(H)-R2, где R1 и R2 независимо друг от друга обозначают водород, фенильную группу, замещенную фенильную группу. Олигонуклеотид является праймером для амплификации последовательности нуклеиновой кислоты. Описывается также способ амплификации нуклеиновой кислоты-мишени и набор для проведения реакции амплификации. Применение модифицированных праймеров по изобретению позволяет уменьшить неспецифическую амплификацию, прежде всего образование праймерного димера, и/или соответственно увеличить выход требуемого целевого продукта по сравнению с амплификацией, проводимой с немодифицированными праймерами. 3 с. и 7 з.п. ф-лы, 6 ил., 12 табл. Настоящее изобретение относится к области молекулярной биологии и химии нуклеиновых кислот. В частности, оно относится к способам и реагентам, предназначенным для увеличения выхода нуклеиновой кислоты в реакциях амплификации. Следовательно, изобретение может найти применение в любой области, в которой используется амплификация нуклеиновых кислот. Разработка полимеразной цепной реакции (ПЦР) сделало возможным амплификацию in vitro последовательностей нуклеиновых кислот. ПЦР описана в патентах США 4683195; 4683202; 4965188; у Saiki и др., 1985, Science 230: 1350-1354; Mullis и др., 1986, Cold Springs Harbor Symp. Quant. Biol. 51: 263-273; и у Mullis и Faloona, 1987, Methods Enzymol. 155: 335-350. В литературе имеются многочисленные данные о совершенствовании и применении ПЦР. Например, широкий спектр связанных с ПЦР проблем представлен в таких изданиях, как PCR Technology – principles and applications for DNA amplification, 1989, (ред. H.A. Erlich), Stockton Press, New York; PCR Protocols: A guide to methods and applications, 1990, (ред. M.A. Innes и др.,), Academic Press, San Diego; и в PCR Strategies, 1995, (ред. M.A. Innes и др.,), Academic Press, San Diego. Коммерческие поставщики, такие как фирма Perkin Elmer (Norwalk, CT), продают реагенты для ПЦР и публикуют ПЦР-протоколы. После первых публикаций по амплификации нуклеиновых кислот были описаны различные, основанные на применении праймеров способы амплификации нуклеиновых кислот, которые включают: лигазную реакцию синтеза цепи (Ligase Chain Reaction (LCR), Wu и Wallace, 1989, Genomics 4: 560-569 и Barany, 1991, Proc. Natl. Acad. Sci. США, 88: 189-193); полимеразно-лигазную реакцию синтеза цепи (Barany, 1991, PCR Methods and Applic. 1: 5-16); “брешь”-LCR (Gap-LCR) (публикация WO 90/01069); реакцию репарации цепи (публикация EP 439182-A2), 3SR (Kwoh и др., 1989, Proc. Natl. Acad. Sci. США, 86: 1173-1177); Guatelly и др. , 1990, Proc. Natl. Acad. Sci. США, 87: 1874-1878; публикация PCT WO 92/0880A) и NASBA (патент США 5130238), но не ограничены ими. Обзор систем амплификации был опубликован Abramson и Myers, 1993, Current Opinion in Biotechnology 4: 41-47. Специфичность реакций амплификации, основанных на использовании праймеров, зависит от специфичности гибридизации праймера. При повышенных температурах, применяемых при обычной амплификации, праймеры гибридизируются только с требуемой целевой последовательностью, также называемой последовательностью-мишенью. Однако реакционные смеси для амплификации обычно готовят при комнатной температуре, значительно более низкой, чем температура, необходимая для обеспечения специфичности гибридизации праймера. При таких менее жестких условиях праймеры могут неспецифично связываться с другими только частично комплементарными последовательностями нуклеиновых кислот или с другими праймерами и инициировать синтез нежелательных продуктов удлинения, которые могут быть амплифицированы наряду с последовательностью-мишенью. Амплификация неспецифических продуктов удлинения праймера может конкурировать с амплификацией требуемых последовательностей-мишеней и может в значительной степени снижать эффективность амплификации требуемой последовательности. Одним из часто встречающихся типов продукта неспецифической амплификации является не зависящий от матрицы артефакт реакций амплификации, обозначенный как “праймерный димер”. Праймерный димер представляет собой двухцепочечный фрагмент, длина которого обычно близка сумме длин двух праймеров, и вероятно он образуется при наложении одного праймера на другой. В результате сцепления образуется нежелательная матрица, которая вследствие своей небольшой длины эффективно амплифицируется. Неспецифическая амплификация может быть снижена путем уменьшения образования продуктов удлинения праймеров до начала реакции. В одном из методов, названном протоколом “hot-start” (протоколом “горячей инициации”), один или несколько важных реагентов не добавляют в реакционную смесь до тех пор, пока температура не поднимется до уровня, достаточного для обеспечения необходимой специфичности гибридизации. Таким образом, в реакционной смеси не может осуществляться удлинение праймера в то время, когда условия реакции не гарантируют специфическую гибридизацию праймера. Методы “горячей инициации”, при которых вручную открывают реакционные пробирки после начальной стадии высокотемпературной инкубации и добавляют недостающие реагенты, являются трудоемкими и увеличивают риск загрязнения реакционной смеси. В альтернативном варианте для разделения или секвестирования реакционных компонентов может быть использован легкоплавкий материал, такой как воск, как описано в патенте США 5411876 и у Chou и др., 1992, Nucl. Acids Res. 20(7): 1717-1723. В этих методах высокая температура инкубации до начала реакции плавит легкоплавкий материал, позволяя, таким образом, реагентам смешиваться. Другой способ уменьшения образования продуктов удлинения праймеров до начала реакции основан на термообратимом ингибировании ДНК-полимеразы специфическими для ДНК-полимеразы антителами, как описано в патенте США 5338672. Антитела инкубируют с ДНК-полимеразой в буфере при комнатной температуре до составления реакционной смеси с целью обеспечить образование комплекса антитело-ДНК-полимераза. Ингибирование антителом ДНК-полимеразной активности инактивируют путем высокотемпературной инкубации до начала реакции. Недостатком этого метода является то, что получение антител, специфических по отношению к ДНК-полимеразе, особенно в больших количествах, является дорогостоящим и требует значительных затрат времени. Кроме того, добавление антител в реакционную смесь может потребовать повторного планирования реакции амплификации. Образование продуктов удлинения до начала реакции также можно ингибировать путем добавления в реакционную смесь одноцепочечного связывающего протеина, который нековалентно связывается с праймерами термообратимым образом и, препятствуя гибридизации, ингибирует удлинение праймера. Неспецифическую амплификацию также можно уменьшить путем ферментативного разложения продуктов удлинения, образованных до начала реакции, с применением способов, описанных в патенте США 5418149. Разложения вновь синтезированных продуктов удлинения достигают путем включения в реакционную смесь дУТФ и урацил-ДНК-гликозилазы (UNG) и инкубации реакционной смеси при 45-60oC до проведения реакции амплификации. Удлинение праймера приводит к образованию урацилсодержащей ДНК, которая разлагается UNG в условиях, соответствующих таковым до амплификации. Недостатком этого метода является то, что разложение продукта удлинения конкурирует с образованием продукта удлинения, а удаление неспецифического продукта удлинения праймера, вероятно, может оказаться менее полным. Преимуществом этого метода является то, что урацилсодержащая ДНК, попавшая в реакционную смесь в качестве загрязнителя от предыдущей реакции, также разлагается, и, таким образом, метод также позволяет уменьшить проблему загрязнения ПЦР амплифицированными нуклеиновыми кислотами, образовавшимися в предыдущих реакциях. Обычные методы молекулярной биологии и химии нуклеиновых кислот, известные в данной области техники, достаточно полно описаны в литературе. См., например, Sambrook и др., 1989, Molecular Cloning-A Laboratory Manual, Cold Spring Harbor Laboratory, Cold Spring Harbor, New York; Oligonucleotide Synthesis (M.J. Gait, ред., 1984); Nucleic Acid Hybridization (B.D. Hames и S. J. Higgins, ред-ы, 1984); и в сериях Methods in Enzymology (Academic Press, Inc.). Настоящее изобретение относится к ковалентно модифицированным олигонуклеотидным праймерам для амплификации последовательностей нуклеиновых кислот in vitro. Применение модифицированных праймеров по изобретению позволяет уменьшить неспецифическую амплификацию, прежде всего образование праймерного димера, и/или соответственно увеличить выход требуемого целевого продукта по сравнению с амплификацией, проводимой с немодифицированными праймерами. Согласно настоящему изобретению предлагается олигонуклеотидный праймер для амплификации последовательности нуклеиновой кислоты, имеющий следующее общее строение: 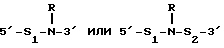 где S1 обозначает первую нуклеотидную последовательность длиной от приблизительно 5 до приблизительно 50 нуклеотидов; S2 обозначает вторую нуклеотидную последовательность длиной от одного до трех нуклеотидов; N обозначает нуклеотид, который содержит пуриновое или пиримидиновое основание, в состав которого входит экзоциклический амин; R обозначает группу-модификатор, причем R ковалентно связывается с N через экзоциклический амин и R имеет следующую структуру: 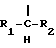 где R1 и R2 независимо друг от друга обозначают водород, C1-C10алкильную группу, алкоксигруппу, фенильную группу, феноксигруппу, замещенную фенильную группу, нафтильную группу или замещенную нафтильную группу. Алкильные группы могут быть разветвленными или неразветвленными. В предпочтительном варианте N обозначает модифицированный обычный нуклеотид, т. е. N обозначает модифицированный аденозин, цитидин или гуанозин, причем модифицирующий фрагмент ковалентно присоединен к экзоциклическому амину аденинового, гуанинового или цитозинового основания. В более предпочтительном варианте N обозначает аденозин. В предпочтительном варианте R обозначает 2-нафтилметильную группу, бензильную группу или замещенную бензильную группу. Предпочтительные замещенные бензильные группы имеют следующую структуру: 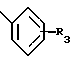 где R3 обозначает разветвленную или линейную C1-C6алкильную группу, более предпочтительно разветвленную или линейную C1-C4алкильную группу, метоксигруппу или нитрогруппу. Предпочтительно R3 присоединен в пара-положении. В более предпочтительном варианте R обозначает бензильную, пара-метилбензильную, пара-трет-бутилбензильную, пара-метоксибензильную или 2-нафтилметильную группу. Согласно изобретению предлагаются также праймеры для амплификации, которые модифицированы путем фотолабильного ковалентного присоединения группы-модификатора, что приводит к частичному или полному ингибированию удлинения праймера. Фотолабильный модификатор может быть присоединен либо к экзоциклическому амину, как в описанных выше модифицированных нуклеотидах, либо к кольцевому азоту. В одном из вариантов по крайней мере одна нитробензильная группа присоединена к экзоциклическому амину аденинового, гуанинового или цитозинового основания 3′-концевого нуклеотида. Далее, согласно изобретению предлагается пара или набор праймеров, причем по крайней мере один из праймеров модифицирован таким образом, как это описано выше. В предпочтительном варианте оба члена пары праймеров или все члены набора праймеров модифицированы. Согласно изобретению предлагаются также способы амплификации нуклеиновой кислоты, включающие проведение реакции амплификации с использованием модифицированных праймеров по изобретению. Далее согласно изобретению предлагаются способы амплификации нуклеиновой кислоты-мишени, включающие проведение реакции амплификации с использованием фотолабильных модифицированных праймеров по изобретению, причем реакционную смесь облучают светом, достаточным для удаления группы-модификатора и позволяющим образовывать продукты удлинения праймера. В одном из вариантов облучение осуществляют в виде отдельной стадии до начала реакции амплификации, но после того, как реакционная смесь была нагрета до температуры выше приблизительно 50oC. В другом варианте стадию облучения объединяют с предварительной стадией процесса амплификации, такой как стадия обратной транскрипции в реакции амплификации РНК, или с начальной стадией денатурации в реакции амплификации ДНК. Согласно изобретению предлагаются также наборы для амплификации последовательностей нуклеиновых кислот in vitro, при этом такие наборы содержат пару праймеров, из которых по крайней мере один праймер модифицирован таким образом, как это указано в данном описании. Наборы по настоящему изобретению также могут включать один или более реагентов для амплификации, например полимеразу или лигазу нуклеиновой кислоты, нуклеозидтрифосфатазу и соответствующие буферы. Краткое описание чертежей На фиг. 1 приведены результаты амплификаций РНК ВИЧ-1, проведенных с использованием бензилированных праймеров согласно примеру 5. На фиг. 2 приведены результаты амплификаций РНК HCV (цитомегаловирус человека), проведенных с использованием бензилированных праймеров согласно примеру 6. На фиг. 3 приведены результаты амплификаций РНК HCV, проведенных с использованием праймеров, модифицированных одной из трех групп-модификаторов, согласно примеру 7. На фиг. 4 приведены результаты амплификаций РНК HCV, проведенных с использованием фотолабильных модифицированных праймеров согласно примеру 8. На фиг. 5 приведены результаты амплификаций ДНК микобактерий, проведенных с использованием праймеров, модифицированных с помощью бензильной группы, и праймеров, модифицированных с помощью пара-трет-бутилбензильной группы, согласно примеру 10. На фиг. 6 приведена общая реакционная схема, пригодная для синтеза стекла с порами, контролируемыми дезоксиаденозином (dA-CPG), модифицированным бензилом или замещенным бензилом. Для лучшего понимания изобретения приведены ниже значения некоторых терминов и понятий. Понятия “нуклеиновая кислота” и “олигонуклеотид” относятся к полидезоксирибонуклеотидам (содержащим 2-дезокси-D-рибозу), к полирибонуклеотидам (содержащим D-рибозу) и к любому другому типу полинуклеотида, представляющего собой N-гликозид пуринового или пиримидинового основания или модифицированного пуринового или пиримидинового основания. Понятия “нуклеиновая кислота” и “олигонуклеотид” не подразумевают различия в длине цепи, и эти понятия могут использоваться взаимозаменяемо. Эти понятия относятся только к первичной структуре молекулы. Таким образом, эти понятия включают двух- и одноцепочечную ДНК, а также двух- и одноцепочечную РНК. Понятие “обычный” по отношению к основаниям нуклеиновой кислоты, нуклеозидам или нуклеотидам обозначает таковые, которые встречаются в естественных условиях в изучаемом полинуклеотиде. Четыре обычные (также называемые “основными”) дезоксирибонуклеотида ДНК содержат пуриновые основания аденин и гуанин и пиримидиновые основания цитозин и тимин. Четыре обычные рибонуклеотида РНК содержат пуриновые основания аденин и гуанин и пиримидиновые основания цитозин и урацил. Кроме указанных выше обычных или общих оснований в некоторых нуклеиновых кислотах в небольших количествах встречается целый ряд других пуриновых и пиримидиновых производных, называемых редкими или минорными основаниями. В контексте данного описания понятие “необычный” по отношению к основаниям нуклеиновой кислоты, нуклеозидам или нуклеотидам относится к редким или минорным основаниям нуклеиновой кислоты, нуклеозидам или нуклеотидам и к модификациям, производным или аналогам обычных оснований, нуклеозидов или нуклеотидов и включает синтетические нуклеотиды, имеющие модифицированнные фрагменты оснований и/или модифицированные фрагменты сахара (см. Protocols for Oligonucleotide Conjugates, Methods in Molecular Biology, том 26 (Sudhir Agrawal, ред., Humana Press, Totowa, NJ (1994) и Oligonucleotides and Analogues, A Practical Approach (Fritz Eckstein, ред., IRL Press, Oxford University Press, Oxford). Олигонуклеотиды могут быть получены любым приемлемым способом, включая, например, клонирование и рестрикцию соответствующих последовательностей и прямой химический синтез с помощью такого метода, как фосфотриэфирный метод, описанный у Narang и др., 1979, Meth. Enzymol. 68: 90-99; фосфодиэфирный метод, описанный у Brown и др., 1979, Meth. Enzymol. 68: 109-151; диэтилфосфорамидитный метод, описанный у Beaucage и др., 1981, Tetrahedron Lett. 22: 1859-1862; и метод с использованием твердой подложки, описанный в патенте США 4458066. Обзор методов синтеза представлен у Goodchild, 1990, Bioconjugate Chemistry, 1(3): 165-187, который включен в настоящее описание в качестве ссылки. Понятие “спаривание оснований”, также известное в данной области как “спаривание оснований по Уотсону-Крику”, относится к хорошо известному образованию водородных связей между комплементарными парами оснований аденин-тимин и гуанин-цитозин в двухцепочечной молекуле ДНК, аденин-урацил и гуанин-цитозин в гибридной молекуле РНК/ДНК и к аналогичному образованию связей необычных нуклеотидных пар. Понятие “гибридизация” относится к образованию двойной (дуплексной) структуры в результате спаривания комплементарных оснований двух одноцепочечных нуклеиновых кислот. Гибридизация может происходить между полностью комплементарными цепями нуклеиновых кислот или между “практически комплементарными” цепями нуклеиновых кислот, которые содержат минорные области ошибочного спаривания. Условия, при которых будет происходить гибридизация только полностью комплементарных цепей нуклеиновых кислот, называются “жесткими условиями гибридизации” или “специфическими в отношении последовательности условиями гибридизации”. Стабильные дуплексы практически комплементарных последовательностей могут быть получены в менее жестких условиях гибридизации; степень допустимых ошибочных спариваний может контролироваться с помощью соответствующего регулирования условий гибридизации. Специалисты в области технологии нуклеиновых кислот могут определить стабильность дуплекса эмпирически, анализируя различные параметры, в том числе, например, длину и концентрацию пар оснований олигонуклеотидов, ионную силу и частоту ошибочно спаренных пар оснований, следуя руководству в этой области (см., например, Sambrook и др., 1989, Molecular Cloning – A Laboratory Manual, Cold Spring Harbor Laboratory, Cold Spring Harbor, New York; и Wetmur, 1991, Critical Reviews in Biochem. and Mol. Biol., 26(3/4): 227-259). Понятие “праймер” относится к олигонуклеотиду, способному действовать в качестве точки инициации синтеза ДНК в таких условиях, в которых индуцируется синтез продукта удлинения праймера, комплементарного цепи нуклеиновой кислоты, т.е. в присутствии четырех различных нуклеозидтрифосфатов и агента, предназначенного для полимеризации (например, ДНК-полимеразы или обратной транскриптазы) в соответствующем буфере и при приемлемой температуре. В контексте настоящего изобретения понятие “праймер” включает олигонуклеотиды, используемые в опосредованных лигированием процессах амплификации, в которых один олигонуклеотид “удлиняется” в результате лигирования со вторым олигонуклеотидом, гибридизующимся в соседнем положении. Таким образом, понятие “удлинение праймера”, как оно используется в настоящем описании, относится как к синтезу ДНК, происходящему вследствие полимеризации отдельных нуклеозидтрифосфатов с использованием праймера в качестве точки инициации, так и к лигированию двух праймеров с образованием удлиненного праймера. Предпочтительно праймер представляет собой одноцепочечную ДНК. Приемлемая длина праймера зависит от предполагаемого применения праймера, но обычно составляет от 6 до 50 нуклеотидов. Для праймеров с короткими молекулами обычно требуются более низкие температуры для образования достаточно стабильных гибридных комплексов с матрицей. Праймер необязательно должен отражать точную последовательность матричной нуклеиновой кислоты, но он должен быть в достаточной степени комплементарным, чтобы гибридизироваться с матрицей. Конструкция приемлемых праймеров для амплификации конкретной последовательности-мишени хорошо известна в данной области техники и описана в литературе, указанной в настоящем описании. Праймеры могут включать дополнительные элементы, способствующие обнаружению или иммобилизации праймера, но не изменяющие основное свойство праймера, а именно его действие в качестве точки инициации синтеза ДНК. Например, праймеры могут содержать дополнительную последовательность нуклеиновой кислоты на 5′-конце, которая не гибридизируется с нуклеиновой кислотой-мишенью, но которая облегчает клонирование амплифицированного продукта. Область праймера, комплементарную матрице, которая в достаточной степени обеспечивает гибридизацию с матрицей, в настоящем описании обозначают областью гибридизации. Понятия “мишень”, “последовательность-мишень”, “область-мишень” и “нуклеиновая кислота-мишень” относятся к области или подпоследовательности нуклеиновой кислоты, которая должна быть амлифицирована. Праймер в контексте настоящего описания является “специфическим” по отношению к последовательности-мишени, если число ошибочных спариваний, образующихся при гибридизации последовательности праймера с последовательностью-мишенью, меньше числа ошибочных спариваний, образующихся при гибридизации последовательности праймера с последовательностями, не являющимися мишенями, которые могут присутствовать в образце. Могут быть выбраны такие условия гибридизации, при которых стабильные дуплексы формируются только в тех случаях, если число имеющихся ошибочных спариваний не превосходит число ошибочных спариваний, образующихся при гибридизации последовательности праймера с последовательностью-мишенью. При таких условиях праймер может образовывать стабильный дуплекс только с последовательностью-мишенью. Таким образом, использование праймеров, специфических по отношению к мишени, в приемлемых жестких условиях амплификации дает возможность осуществлять специфическую амплификацию тех последовательностей-мишеней, которые содержат сайты, обусловливающие образование связи между праймерами и мишенью. Использование специфических по отношению к последовательности условий амплификации позволяет осуществлять специфическую амплификацию тех последовательностей-мишеней, которые содержат сайты, связывающиеся со строго комплементарными праймерами. Понятие “неспецифическая амплификация” относится к амплификации отличных от последовательности-мишени последовательностей нуклеиновых кислот, которые образуются вследствие гибридизации праймеров с последовательностями, отличными от последовательности-мишени, и затем служат субстратом для удлинения праймера. Гибридизация праймера с последовательностью, не являющейся мишенью, рассматривается как “неспецифическая гибридизация” и может осуществляться при менее жестких предреакционных условиях, характеризующихся более низкой температурой. Понятие “праймерный димер” относится к не зависящему от матрицы продукту неспецифической амплификации, который образуется в результате удлинения праймера, когда в качестве матрицы служит другой праймер. Хотя праймерный димер, по-видимому, часто является конкатемером двух праймеров, т.е. димером, также могут образовываться конкатемеры более двух праймеров. Понятие “праймерный димер” в настоящем описании используется для общего обозначения не зависящего от матрицы продукта неспецифической амплификации. Понятие “реакционная смесь” относится к раствору, содержащему реагенты, необходимые для проведения данной реакции. Понятие “реакционная смесь для амплификации” относится к раствору, содержащему реагенты, необходимые для проведения реакции амплификации, при этом такая смесь обычно содержит олигонуклеотидные праймеры и ДНК-полимеразу или лигазу в приемлемом буфере. “Реакционная смесь для ПЦР” обычно содержит олигонуклеотидные праймеры, термостабильную ДНК-полимеразу, дНТФ и двухвалентный катион металла в приемлемом буфере. Реакционную смесь рассматривают как полную, если она содержит все реагенты, необходимые для проведения реакции, и как неполную, если она содержит только часть набора необходимых реагентов. Для специалиста в данной области техники очевидно, что для удобства, стабильности при хранении или для обеспечения регулирования концентрации компонентов в зависимости от применения компоненты реакции обычно хранят в виде отдельных растворов, каждый из которых содержит часть полного набора компонентов, а затем реакционные компоненты объединяют перед реакцией с получением полной реакционной смеси. Кроме того, для специалиста в данной области техники очевидно, что для продажи реакционные компоненты упаковывают по отдельности и что пригодные коммерческие наборы могут содержать любую часть полного набора реакционных компонентов, включающую модифицированные праймеры по настоящему изобретению. Модифицированные праймеры Праймеры для амплификации по изобретению модифицируют путем ковалентного присоединения группы к одному из четырех нуклеотидов на 3′-конце праймера. В одном из вариантов модифицированный праймер по изобретению состоит из последовательности нуклеиновой кислоты, имеющей следующее общее строение: 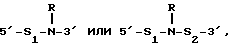 где S1 обозначает первую нуклеотидную последовательность длиной от приблизительно 5 до приблизительно 50 нуклеотидов; S2 обозначает вторую нуклеотидную последовательность длиной от одного до трех нуклеотидов; N обозначает нуклеотид, который содержит пуриновое или пиримидиновое основание, в состав которого входит экзоциклический амин; R обозначает группу-модификатор, причем R ковалентно связывается с N через экзоциклический амин и R имеет приведенную ниже структуру. Как описано в примерах, модифицирующий эффект является максимальным, когда модификация затрагивает 3′-концевой нуклеотид. Таким образом, предпочтительно праймер имеет модифицированный 3′-концевой нуклеотид. Подлежащий модификации нуклеотид выбирают из таковых, у которых основание содержит экзоциклический амин, участвующий в спаривании основания нуклеотида с комплементарным ему нуклеотидом. Обычно праймерами являются ДНК, состоящие только из обычных нуклеотидов. Из четырех обычных оснований нуклеотидов, присущих ДНК, аденин, гуанин и цитозин содержат экзоциклический первичный амин, который участвует в спаривании основания с комплементарным ему основанием. В предпочтительном варианте осуществления изобретения праймер модифицируют путем присоединения одной группы-модификатора к экзоциклическому амину, замещая один из двух атомов водорода аминной группы, который в немодифицированном основании может участвовать в спаривании оснований. Строения модифицированных нуклеотидов, содержащих модифицированное адениновое, гуаниновое и цитозиновое основание соответственно, приведены ниже: 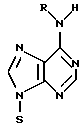 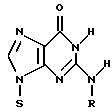 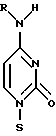 где S обозначает фрагмент сахара, а R обозначает группу-модификатор. Настоящее изобретение не ограничено праймерами, состоящими из обычных нуклеотидов. Любой нуклеотидный аналог, в котором фрагмент основания содержит экзоциклический первичный амин, который участвует в спаривании основания с комплементарным основанием, может быть модифицирован в соответствии с настоящим описанием. Примеры необычных нуклеотидов включают 3-метиладенин, 7-метилгуанин, 3-метилгуанин, 5-метилцитозин и 5 гидроксиметилцитозин. Группа-модификатор ограничивает способность модифицированного основания участвовать в образовании водородной связи, поскольку модификатор замещает один атом водорода. Оставшийся атом водорода еще сохраняет способность участвовать в образовании водородной связи. Таким образом, модификаторы могут оказывать воздействие как на кинетику, так и на термодинамику гибридизации. Изобретение включает различные группы-модификаторы, обладающие следующими свойствами, заключающимися в их способности: 1. оказывать воздействие на спаривание модифицированного основания с комплементарным основанием (спаривание оснований по Уотсону-Крику), но не препятствовать ему; 2. оказывать воздействие на удлинение модифицированного праймера, но не препятствовать ему; и 3. позволять осуществлять синтез цепи, комплементарной продукту удлинения модифицированного праймера. Группа-модификатор оказывает стерическое воздействие на спаривание оснований и, следовательно, на удлинение праймера. Таким образом, физический объем модификатора влияет на степень его воздействия на гибридизацию. Когда модифицированный аденозиновый или цитидиновый нуклеотид включают в двухцепочечную нуклеиновую кислоту, группа-модификатор вдается в центральное пространство большой бороздки. Следовательно, даже относительно крупные группы-модификаторы должны вызывать лишь небольшие стерические нарушения в строении дуплекса. Однако пригодные модификаторы не являются настолько крупными, чтобы препятствовать образованию водородной связи или предотвращать ферментативное удлинение 3′-гидроксильной группы праймера. Когда модифицированный гуанозиновый нуклеотид включают в двухцепочечную нуклеиновую кислоту, группа-модификатор вдается в малую бороздку, которая не имеет достаточного пространства для размещения всего объема группы-модификатора. Следовательно, для присоединения к гуаниновому основанию предпочтительны более мелкие группы-модификаторы. Продукты удлинения праймеров, которые используются в качестве матриц в последующих циклах амплификации, содержат модифицированное основание, включенное с помощью праймера. Группу-модификатор выбирают таким образом, чтобы наличие модифицированного основания в матрице не вызывало терминацию удлинения праймера или не приводило к ингибированию удлинения праймера. Предпочтительно строение группы-модификатора не должно приводить к увеличению количества случаев мутагенеза, при котором происходит потеря идентичности модифицированного основания при репликации полученной с помощью праймера матрицы. Воздействие модифицированного основания на матрицу или на продукт удлинения праймера можно оценить общепринятыми методами, следуя руководствам, указанным в настоящем описании и известным в данной области техники (см., например, Gniazdowski и Cera, 1996, Chem. Rev. 96: 619-634). Группы-модификаторы R, удовлетворяющие вышеуказанным требованиям, имеют следующую структуру: 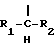 где R1 и R2 независимо друг от друга обозначают водород, C1-C10алкильную группу, алкоксигруппу, фенильную группу, феноксигруппу, замещенную фенильную группу, нафтильную группу или замещенную нафтильную группу. Алкильные группы могут быть разветвленными или линейными. Также могут использоваться алкильные группы с большим числом атомов, по крайней мере до C20. В предпочтительном варианте R обозначает 2-нафтилметильную группу, бензильную группу или замещенную бензильную группу. Предпочтительные замещенные бензильные группы имеют следующее строение: 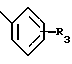 где R3 обозначает разветвленную или линейную C1-C6алкильную группу, более предпочтительно разветвленную или линейную C1-C4алкильную группу, метоксигруппу или нитрогруппу. Разветвленная или линейная C1-C4алкильная группа представляет собой метил, этил, пропил, бутил, изопропил, изобутил, трет-бутил и т.п. Предпочтительными алкильными группами являются метил и трет-бутил. Предпочтительно R3 присоединен в пара-положении. Особенно предпочтительные группы-модификаторы R приведены ниже: 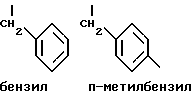 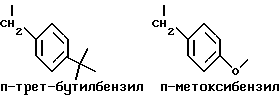 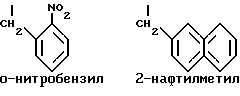 Ряд конкретных групп-модификаторов приведен в примерах. В целом эмпирический отбор конкретной пригодной группы-модификатора из указанного класса соединений может быть осуществлен специалистом в данной области техники общепринятым способом, следуя руководству, представленному в настоящем описании. Предпочтительно пригодность конкретной группы определяют эмпирически, используя модифицированные праймеры в реакции амплификации. Успешная амплификация свидетельствует о том, что модифицированное основание не полностью ингибирует удлинение праймера, а также о том, что присутствие модифицированного основания в полученной с помощью праймера матрице не приводит к прекращению удлинения праймера. Редукцию праймерного димера определяют по описанной в примерах методике. Праймеры с фотолабильной модификацией В альтернативном варианте осуществления изобретения праймеры модифицируют с помощью одной или нескольких фотолабильных групп, которые могут быть удалены при экспозиции светом после того, как в реакции были достигнуты высокотемпературные реакционные условия, гарантирующие ее специфичность. Поскольку модификатор удаляют до удлинения праймера, не требуется, чтобы модифицированный праймер обладал способностью к удлинению до удаления группы. Примеры фотолабильных модификаторов, которые могут быть использованы в способах по настоящему изобретению, описаны у Pillai, 1980 “Photoremovable Protecting Groups in Organic Synthesis”, Synthesis: 1-26. Предпочтительно фотолабильные праймеры по изобретению модифицируют на 3′-концевом нуклеотиде, присоединяя одну или две орто-нитробензильные группы: 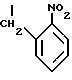 В праймерах, модифицированных путем присоединения одной нитробензильной группы к экзоциклическому первичному амину фрагмента основания, образовавшийся вторичный амин еще сохраняет способность участвовать в спаривании оснований, если аминная группа повернута таким образом, что сохранившийся атом водорода ориентирован по направлению к комплементарному основанию. Как описано в примерах, эти праймеры могут применяться при амплификации либо после удаления модификатора облучением ультрафиолетовым светом, либо без его удаления. Праймеры, модифицированные путем присоединения двух нитробензильных групп к экзоциклическому амину основания, не могут удлиняться. Ингибирование в основном происходит из-за неспособности модифицированного основания участвовать в спаривании оснований, а этому препятствует то, что оба водорода экзогенного амина замещены объемистыми нитробензильными группами. Применение праймеров, модифицированных двумя нитробензильными группами, при амплификации, когда реакционную смесь облучают ультрафиолетовым светом в течение периода времени, достаточного для удаления нитробензильных групп, тем самым давая возможность протекать реакции удлинения праймера, описано в примерах. В другом варианте осуществления группу-модификатор присоединяют к кольцевому атому азота. Праймеры, модифицированные присоединением нитробензильной группы к кольцевому атому азота основания, не могут удлиняться вследствие неспособности модифицированного основания подвергаться спариванию оснований. Удаление нитробензильных групп облучением ультрафиолетовым светом дает возможность протекать реакции удлинения праймера. Применение фотолабильных праймеров, которые не могут удлиняться до тех пор, пока не удалена группа-модификатор, практически позволяет осуществить амплификацию методом “горячей инициации”. Удлинение праймера ингибируют во время неспецифических предшествующих реакции условий. Реакционную смесь облучают и праймеры разблокируют только после того, как температура реакции была поднята до температуры, которая гарантирует специфичность реакции. Синтез модифицированных праймеров Синтез модифицированных праймеров проводят с использованием стандартных химических способов, хорошо известных в данной области. Способы введения этих модификаторов могут быть подразделены на четыре класса: 1. модификатор может быть введен путем применения модифицированного нуклеозида в виде вспомогательного элемента при синтезе ДНК; 2. модификатор может быть введен путем применения модифицированного нуклеозида в качестве фосфорамидита; 3. модификатор может быть введен путем применения реагента в процессе синтеза ДНК (например, путем обработки бензиламином обратимого амидита при включении в последовательность ДНК); 4. модификация после синтеза: модификатор может быть введен в виде реактивного реагента при контакте с синтезированной ДНК. Синтез конкретных модифицированных праймеров описан в примерах. Дополнительные модифицированные праймеры могут быть синтезированы аналогичным образом с использованием стандартных методов синтеза. Предпочтительно модифицированные праймеры синтезируют с использованием в качестве подложки для синтеза дериватизированного стекла с контролируемыми порами (CPG). Общая реакционная схема для синтеза дериватизированного dA-CPG (модифицированного сшиванием с различными производными дезоксиаденозина) приведена на фиг. 6. Конкретные группы-модификаторы могут добавляться с помощью алкилирующего агента, такого как алкилгалогенид, бензилгалогенид, замещенный бензилгалогенид, метилнафтилгалогенид или замещенный метилнафгилгалогенид. Синтез бензилированного и пара-трет-бензилированного dA-CPG описан в примерах 1 и 2 в соответствии со схемой, приведенной на фиг. 6. Алкилирование экзоциклической аминогруппы может быть проведено с использованием методов, аналогичных таковым, описанным для метилирования у Griffin и Reese, 1963, Biochim. Acta 68: 185-192. Дополнительные методы синтеза описаны у Aritoma и др., 1995, J. Chem. Soc. Perkin Trans. 1: 1837-1849. Амплификации с использованием модифицированных праймеров Способы по настоящему изобретению включают проведение основанной на применении праймеров амплификации с использованием модифицированных праймеров по настоящему изобретению. В целом при амплификации, основанной на применении праймеров, немодифицированные праймеры могут быть замещены модифицированными праймерами, содержащими такую же нуклеотидную последовательность, без изменения условий реакции амплификации. Для специалиста в данной области техники должно быть очевидным, что для некоторых реакций может оказаться целесообразной общепринятая небольшая повторная оптимизация условий реакции. В предпочтительном варианте модифицированные праймеры по настоящему изобретению применяют в полимеразной цепной реакции (ПЦР). Однако изобретение не ограничено какой-либо конкретной системой амплификации. Модифицированные праймеры по настоящему изобретению могут использоваться в любой, основанной на применении праймеров системе амплификации, в которой может быть образован праймерный димер или продукт неспецифической амплификации. Примеры включают методы амплификации, описанные в указанных выше ссылках. По мере разработки других систем эти системы могут оказаться целесообразными для практической реализации настоящего изобретения. Способы по настоящему изобретению пригодны для амплификации как ДНК, так и РНК. Например, амплификация РНК с использованием обратной транскрипции/полимеразной цепной реакции (ОТ-ПЦР) хорошо известна в данной области техники и описана в патентах США 5322770 и 5310652; у Myers и Gelfand, 1991, Biochemistry, 30(31): 7661-7666; у Young и др., 1993, J. Clin. Microbiol., 31(4): 882-886, и у Mulder и др., 1994, J. Clin. Microbiol. 32(2): 292-300. В основанной на применении праймеров амплификации удлинение праймера обычно осуществляют при повышенной температуре, используя термостабильный фермент, такой как термостабильная ДНК-полимераза. Фермент инициирует синтез на 3′-конце праймера и достраивает его в направлении к 5′-концу матрицы вплоть до окончания синтеза. Очищенные термостабильные ДНК-полимеразы, пригодные для реакций амплификации, хорошо известны в данной области техники и включают ферменты, описанные в патенте США 4889818; патенте США 5079352; патенте США 5352600; патенте США 5491086; в заявках WO 91/09950; WO 92/03556; WO 92/06200; WO 92/06202; WO 92/09689; и в патенте США 5210036, но не ограничены ими. Обзор термостабильных ДНК-полимераз представлен у Abramson, 1995, в PCR Strategies (ред. M.A.Innis и др.), стр. 39-57, Academic Press, San Diego. В предпочтительном варианте, в частности при амплификации ДНК, амплификацию осуществляют с использованием обратимо инактивированного фермента, как описано в EP 0771870 A1. Применение обратимо инактивированного фермента, который реактивируют при высокотемпературных условиях реакции, в дальнейшем уменьшает неспецифическую амплификацию посредством ингибирования удлинения праймера до начала реакции. Обратимо инактивированная термостабильная ДНК-полимераза, которая разработана и производится фирмой Hoffmann-La Roche (Nutley, NJ) и поставляется фирмой Perkin Elmer (Norwalk, CT), описана у Birch и др., 1996, Nature 381(6581): 445-446. Воздействие группы-модификатора на способность фермента удлинять праймер частично зависит от конкретного используемого фермента и частично от выбранных условий реакции. Например, ДНК-полимераза Tth наиболее предпочтительна, когда в некоторых реакциях амплификации РНК в качестве двухвалентного катиона используют Mn2+, а не Mg2+. Для специалиста в данной области техники должно быть очевидно, что при обычном выборе пригодной группы-модификатора следует учитывать применяемые фермент и условия реакции. Методы подготовки образца, пригодные для реакций амплификации, хорошо известны в данной области и достаточно полно описаны в указанных в данном описании литературных ссылках. Выбор конкретного используемого метода не имеет решающего значения для настоящего изобретения. Специалист в данной области техники может выбрать оптимальные условия реакции для применения с известными способами подготовки образцов. Методы анализа амплифицированной нуклеиновой кислоты хорошо известны в данной области техники и достаточно полно описаны в указанных в данном описании литературных ссылках. Выбор конкретного используемого метода не имеет решающего значения для настоящего изобретения. Специалист в данной области техники может выбрать соответствующий метод анализа в зависимости от применения. Предпочтительным методом анализа реакции амплификации является таковой, с помощью которого контролируют увеличение общего количества двухцепочечной ДНК в реакционной смеси, как описано у Higuchi и др., 1992, Bio/Technology, 10: 413-417; Higuchi и др. , 1993, Bio/Technology, 11: 1026-1030; и в EP 512334 и 640828. При использовании этого метода, обозначенного в данном описании как “кинетическая ПЦР”, обнаружение двухцепочечной ДНК основано на увеличении флуоресценции, которая проявляется в том случае, когда бромид этидия (EtBr) и другие связывающиеся с ДНК метки связываются с двухцепочечной ДНК. Амплификацию проводят в присутствии метки. Увеличение количества двухцепочечной ДНК в результате синтеза последовательностей-мишеней приводит к заметному увеличению флуоресценции, которую контролируют в процессе амплификации. Таким образом, эти методы позволяют контролировать развитие реакции амплификации. При использовании метода кинетической ПЦР измеряемая флуоресценция зависит от общего количества присутствующей двухцепочечной ДНК, образовавшейся либо в результате неспецифической амплификации, либо в результате амплификации последовательности-мишени. Контроль флуоресценции позволяет оценить увеличение общего количества двухцепочечной ДНК, однако увеличение, связанное с амплификацией последовательности-мишени, нельзя выявить независимо от увеличения, связанного с продуктом неспецифической амплификации. Модифицированные праймеры по настоящему изобретению особенно пригодны для метода кинетической ПЦР, поскольку они не только уменьшают количество образующихся праймерных димеров, но также и задерживают образование заметного количества праймерного димера. Задержка образования праймерного димера до тех пор, пока не произошло заметное увеличение последовательности-мишени, позволяет независимо контролировать амплификацию последовательностей-мишеней и свести к минимуму помехи, связанные с праймерным димером. Наборы Настоящее изобретение также относится к наборам, многоконтейнерным наборам, содержащим пригодные для практической реализации изобретения компоненты. Соответствующий набор содержит праймеры, по крайней мере один из которых модифицирован согласно настоящему описанию, для амплификации нуклеиновой кислоты. Другие необязательные компоненты набора включают, например, агент, катализирующий синтез продуктов удлинения праймера, нуклеозидтрифосфаты в качестве субстратов, соответствующие реакционные буферы и инструкции для осуществления настоящего способа. Представленные ниже примеры осуществления настоящего изобретения приведены только для иллюстрации и не ограничивают объем изобретения. Многочисленные варианты осуществления изобретения в объеме формулы изобретения, приведенной после примеров, должны быть очевидны специалистам в данной области техники на основании вышеприведенного описания и последующих примеров. Пример 1 Синтез праймеров, модифицированных бензильной группой Праймеры, модифицированные путем добавления бензильной группы, синтезировали с помощью одного из двух описанных ниже способов. Праймеры, модифицированные на 3′-концевом основании, синтезировали с использованием для инициации синтеза ДНК CPG (стекло с порами, контролируемыми N6-бензилдезоксиаденозином). Праймеры, модифицированные по внутреннему основанию, синтезировали с использованием N6-бензилдезоксиаденозинфосфорамидита. В примерах использованы следующие стандартные сокращения: ДМАП 4-диметиламинопиридин ДМФ N,N-диметилформамид ТЭА триэтиламин ЭДК гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида ТГФ тетрагидрофуран ДМТ 4,4′-диметокситритил LCAA-CGP стекло с порами, контролируемыми алкиламиногруппой с длинной цепью I. Синтез N6-бензилдезоксиаденозин-CPG Стадия 1: Синтез N6-бензоил-N6-бензил-5′-O-ДМТ-2′- дезоксиаденозина К N6-бензоил-5′-O-(4,4′-диметокситритил)-2′- дезоксиаденозину (657 мг, 1,0 ммоль; фирма Aldrich Chemical Co., Milwaukee, WI) добавляли пиридин (10 мл) и смесь сушили упариванием под вакуумом. Этот процесс повторяли. Образовавшуюся пену растворяли в безводном ДМФ (15 мл; Aldrich Chemical Co., Milwaukee, WI) и охлаждали до 5oC. В атмосфере аргона добавляли гидрид натрия (44 мг, 1,1 ммоля, 1,1 экв., 60%-ная дисперсия в масле) и перемешивали при комнатной температуре в течение 45 минут. В течение 2 минут добавляли бензилбромид (143 мкл, 206 мг, 1,2 ммоля, 1,2 экв.; Aldrich Chemical Co., Milwaukee, WI) и смесь перемешивали в течение ночи при комнатной температуре. Смесь сушили упариванием под вакуумом и остаток распределяли между этилацетатом и водой (по 10 мл каждого соединения) и экстрагировали. Водную фазу повторно экстрагировали этилацетатом (10 мл) и объединенные экстракты сушили над безводным сульфатом магния, фильтровали и упаривали. Неочищенный продукт очищали колоночной хроматографией на силикагеле (75 г), используя метанол, триэтиламин, метиленхлорид (3:0,5:96,5). Фракции, содержащие продукт, объединяли и сушили упариванием, получая требуемый N6-бензоил-N6-бензил-5′-O-ДМТ-2′-дезоксиаденозин (410 мг, 54%). Строение продукта подтверждено ЯМР. Стадия 2: Сукцинилирование К N6-бензоил-N6-бензил-5′-O-ДМТ-2′-дезоксиаденозину (295 мг, 0,39 ммоля) добавляли пиридин (10 мл), смесь сушили упариванием в глубоком вакууме. Эту стадию повторяли. Добавляли свежий безводный пиридин (10 мл) вместе с янтарным ангидридом (200 мг, 2 ммоля, 5,0 экв.) и ДМАП (24 мг) и раствор перемешивали в атмосфере аргона в течение ночи при комнатной температуре. Весь растворитель удаляли под вакуумом, остаток распределяли между метиленхлоридом (20 мл) и раствором цитрата натрия (20 мл, 0,1 М, pH 5,0) и экстрагировали. Водную фазу повторно экстрагировали метиленхлоридом (20 мл) и объединенные экстракты сушили над безводным сульфатом натрия, фильтровали и сушили упариванием. Продукт очищали колоночной хроматографией на силикагеле (4,5 г) с использованием этилацетата, триэтиламина, метиленхлорида (32:1: 67), получая требуемый 3′-эфир янтарной кислоты, N6-бензоил-N6-бензил-3′-O-сукцинат-5′-O-ДМТ-2′-дезоксиаденозин (247 мг, 74%). Стадия 3: Дериватизация CPG Промытое кислотой CPG получали следующим образом. LCAA-CGP (1,0 г, LCA00500C, 500 ангстрем, 88,6 молей/г; CPG Inc., Fairfield, NJ) промывали дихлоруксусной кислотой в дихлорметане (2%, 20 мл) путем периодического перемешивания в течение 20 минут при комнатной температуре. Промытое кислотой CPG фильтровали через стеклообразную фритту и промывали дихлорметаном до полного удаления кислоты. Порошок сушили на воздухе, а затем сушили под вакуумом при комнатной температуре в течение ночи. Сшивание модифицированного нуклеозидного промежуточного продукта с промытым кислотой CPG осуществляли следующим образом. К раствору N6-бензоил-N6-бензил-3′-O-сукцинат-5′-O-ДМТ-2′- дезоксиаденозина (170 мг, 0,2 ммоля), полученного по описанной выше методике, в дихлорметане (10 мл) добавляли ТЭА (100 мкл) и раствор концентрировали до объема приблизительно 5 мл в атмосфере аргона. Последовательно добавляли ДМАП (12 мг, 0,1 ммоля, 0,5 экв.), ТЭА (100 мкл), ЭДК (384 мг, 2,0 ммоля, 10 экв.) и полученное выше промытое кислотой CPG. Добавляли безводный пиридин (5 мл), смесь закрывали и встряхивали в течение 3 дней при комнатной температуре. CPG отфильтровывали под вакуумом и интенсивно промывали изопропанолом, а затем дихлорметаном, сушили на воздухе, а затем сушили в течение 1 часа под вакуумом. Кэппирование дериватизированного CPG осуществляли следующим образом. К сухому дериватизированному CPG добавляли растворы Cap A и Cap B (по 5 мл каждого, уксусный ангидрид/2,6 лутидин/ТГФ и 10%-ный N-метилимидазол в ТГФ; Glen Research DNA synthesis reagent. Sterling, VA) и смесь встряхивали в течение 4 часов при комнатной температуре. CGP отфильтровывали под вакуумом и интенсивно промывали изопропанолом, а затем дихлорметаном, сушили на воздухе, а затем сушили под вакуумом в течение ночи. II. Синтез N6-бензилдезоксиаденозинфосфорамидита N6-бензоил-N6-бензил-5′-O-ДМТ-2′-дезоксиаденозин синтезировали по описанной выше методике. К N6-бензоил-N6-бензил-5′-O-ДМТ-2′-дезоксиаденозину (196 мг, 0,26 ммоля) в безводном ТГФ (8 мл) добавляли диизопропилэтиламин (350 мкл, 270 мг, 2,04 ммоля, 7,8 экв.) и 2-цианэтил-N,N-диизопропилхлорфосфорамидит (161 мг, 0,68 ммоля, 2,6 экв.; Aldrich Chemical Co., Milwaukee, WI) и смесь перемешивали в течение 30 минут при комнатной температуре в атмосфере аргона. Растворитель удаляли под вакуумом и остаток распределяли между раствором бикарбоната натрия (5%-ный, 20 мл) и этилацетатом (20 мл). Органическую фазу последовательно промывали раствором бикарбоната, водой и насыщенным соляным раствором (по 20 мл каждого), сушили над сульфатом натрия, фильтровали и упаривали. Остаток очищали колоночной хроматографией на силикагеле (4 г) с использованием смеси ацетон/гексан/ТЭА (34:65:0,7), получая требуемый фосфорамидит (248 мг, 100%). III. Синтез, очистка и анализ ДНК Бензилированное производное аденозин-CPG (25 мг, 1,0 моль) переносили в незаполненные колонки для синтеза (фирма Glen Research, Sterling, VA) и использовали их для создания олигонуклеотидов на ДНК-синтезаторе типа ABI 374 (фирма Perkin Elmer, Applied Biosystems Division, Foster City, CA), применяя общепринятые методы синтеза и условия удаления защитных групп. Неочищенную ДМТ-ДНК очищали и превращали в 5′-гидрокси-ДНК стандартным методом On/Off-ДМТ ЖХВД, используя колонку типа Rainin Pure-DNA в ЖХВД-системе Rainin (фирма Rainin Instrument Co, Woburn, MA). Олигонуклеотиды анализировали с использованием системы капиллярного электрофореза типа ABI (Perkin Elmer, Applied Biosystems Division, Foster City, CA) или с помощью денатуририрующей анионообменной ЖХВД на колонке типа Dionex Nucleopak (Dionex Corp., Sunnyvale, CA). Аналогично этому осуществляли синтез праймеров, модифицированных во внутренней области, используя немодифицированное CPG и модифицированный фосфорамидит, синтезированный по описанной выше методике. Пример 2 Синтез праймеров, модифицированных трет-бутилбензильной группой B настоящем примере описан синтез праймеров, модифицированных на 3′-концевом аденозине пара-трет-бутилбензильной группой. Модифицированные праймеры синтезировали в основном согласно примеру 1, но используя N6-(пара-трет-бутилбензил)дезоксиаденозин-CPG. Синтез дериватизированного CPG описан ниже. Стадия 1: Синтез N6-бензоил-N6-(пара-трет- бутилбензил)-5′-O-(4′,4′-диметокситритил)-2′-дезоксиаденозина К N6-бензоил-5′-O-(4,4′-диметокситритил)-2′-дезоксиаденозину (658 мг, 1,0 ммоль) добавляли ДМФ (безводный, 10 мл) и упаривали досуха. Этот процесс повторяли. В атмосфере аргона добавляли свежий ДМФ (10 мл). Добавляли гидрид натрия (44 мг, 60%-ный в масле, 1,1 ммоля) и смесь перемешивали в течение 0,5 часа при комнатной температуре. Добавляли по каплям 4-(трет-6утил)бензилбромид (272 мг, 1,2 ммоля) и перемешивали при комнатной температуре в течение ночи. Растворитель удаляли под вакуумом и остаток распределяли между этилацетатом и водой (по 20 мл каждого). Органическую фазу промывали водой (трижды, используя порции по 20 мл), сушили над безводным сульфатом магния, фильтровали и упаривали досуха. Неочищенный продукт очищали колоночной хроматографией на силикагеле (100 г) с использованием метиленхлорида: метанола:триэтиламина (96,5:3:0,5), получая требуемый N6-бензоил-N6-(пара-трет-бутилбензил)-5′-O-(4′, 4′-диметокситритил)-2′-дезоксиаденозин (229 мг, 28,5%). Стадия 2: Сукцинилирование N6-бензоил-N6-(пара-трет-бутилбензил)-5′-O- 4′,4′-диметокситритил)-2′-дезоксиаденозин (217 мг, 0,27 ммоля) обрабатывали янтарным ангидридом (135 мг, 5,0 экв.) и ДМАП (17 мг, 0,5 экв.) в пиридине (10 мл). Работая аналогично и хроматографируя, как описано выше в примере 1, получили N6-бензоил-N6-(пара-трет-бутилбензил)-5′-O-(4′, 4′-диметокситритил)-2′-дезоксиаденозин-3′-O-сукцинат (199 мг, 82%). Стадия 3: Дериватизация CPG Сукцинат (180 мг, 0,2 ммоля), полученный выше на стадии 2, обрабатывали промытым кислотой LCAA-CPG, как описано в примере 1. CPG кэппировали и сушили под вакуумом, получая N6-бензоил-N6-(пара-трет-бутилбензил)-5′-O-(4′, 4′-диметокситритил)-2′-дезоксиаденозин-3′-O-сукцинатное производное CPG (1,065 г). Пример 3 Синтез праймеров, модифицированных метильной группой Праймеры, модифицированные на 3′-концевом аденозине метильной группой, синтезировали с использованием N6-метилированного dA-CPG (22 мг, 1 мкмоль, фирма Glen Research, Sterling, VA). N6-метилированное dA-CPG помещали в незаполненную колонку для синтеза и синтезировали праймеры, применяя общепринятые методы синтеза и условия удаления защитных групп. Праймеры очищали методом On/Off-ДМТ ЖХВД, как описано в примере 1. Пример 4 Синтез модифицированных фотолабильных праймеров В настоящем примере описан синтез праймеров, модифицированных на 3′-концевом аденозине одной или двумя нитробензильными группами. Модифицированные праймеры синтезировали в основном аналогично примеру 1, но используя либо мононитробензилированное dA-CPG, либо бисниробензилированное dA-CPG. I. Мононитробензилированные праймеры Для синтеза N6-бензоил-N6-орто-нитробензил 2′-дезоксиаденозиновых производных CPG применяли общие методы синтеза N6-бензоил-N6-бензил-2′-дезоксиаденозиновых производных CPG (см. пример 1), но используя в качестве алкилирующего агента орто-нитробензилбромид. Последующие стадии с использованием CPG были идентичны таковым, описанным в примере 1, с тем отличием, что промежуточные продукты защищали от света, заворачивая реакционные сосуды в алюминиевую фольгу. После синтеза дериватизированного CPG праймеры синтезировали аналогично примеру 1, но выделение проводили с помощью твердофазной экстракции, используя одноразовые колонки типа Nensorb Prep (NEN Research Products Biotechnology Systems, Du Pont Co, Boston, MA) на основе протоколов производителя. II. Биснитробензилированные праймеры Биснитробензилдезоксиаденозиновое CPG получали следующим образом. После синтеза дериватизированного CPG праймеры синтезировали и очищали аналогично тому, как это описано для мононитробензилированных праймеров. Стадия 1: Синтез 5′-O-ДМТ-N6-бис-орто-нитробензил- 2′-дезоксиаденозина. Моногидрат 2′-дезоксиаденозина (538 мг, 2,0 ммоля, Aldrich Chemical Co., Milwaukee, WI) сушили упариванием с безводным пиридином (дважды, порции по 10 мл) под вакуумом. Остаток растворяли в безводном ДМФ (10 мл, Aldrich, Milwaukee, WI) в атмосфере аргона, добавляли гидрид натрия (88 мг, 2,2 ммоля, 1,1 экв., 60%-ная дисперсия в масле) и перемешивали при комнатной температуре в течение 40 минут. Добавляли 2-нитробензилбромид (710 мг, 3,3 ммоля, 1,5 экв. ) и раствор перемешивали в течение 4 часов при комнатной температуре. ДМФ удаляли выпариванием под вакуумом и остаток распределяли между этилацетатом и водой (по 20 мл каждого). Водную фазу экстрагировали этилацетатом (20 мл), объединенные экстракты промывали водой (20 мл) и сушили над сульфатом магния, фильтровали и упаривали. Неочищенный продукт очищали колоночной хроматографией на силикагеле (50 г, с использованием 3%-ного MeOН в CH2Cl2), получая 2-дезокси-N6-бис-орто-нитробензиладенозин (320 мг, 30%). К 2-дезокси-N6-бис-орто-нитробензиладенозину (200 мг, 0,518 ммоля) добавляли безводный пиридин (10 мл) и упаривали досуха. После пиридина (10 мл) добавляли 4,4′-диметокситритилхлорид (900 мг, 2,3 ммоля, 4,5 экв.) и триэтиламин (280 мг, 2,76 ммоля, 4,0 экв.) и перемешивали при комнатной температуре в атмосфере аргона в течение 5 часов. Добавляли воду (0,5 мл) и перемешивали в течение 20 минут. Смесь распределяли между простым эфиром и водой (по 20 мл каждого) и водную фазу повторно экстрагировали простым эфиром (20 мл). Экстракты объединяли, промывали водой (20 мл) и сушили над безводным сульфатом натрия, фильтровали и упаривали. Продукт очищали хроматографией на силикагеле (4 г с использованием 0,7-2,5%-ного метанола в метиленхлориде), получая 5′-O-ДМТ-N6-бис-орто-нитробензил-2′-дезоксиаденозин (121 мг, 33%). Стадия 2: Сукцинилирование 5′-O-ДМТ-N6-бис-орто-нитробензил-2′-дезоксиаденозин (121 мг, 0,145 ммоля) сушили упариванием с безводным пиридином (дважды, 3 мл). Добавляли пиридин (3 мл), янтарный ангидрид (58 мг, 0,58 ммоля, 4 экв.) и ДМАП (11 мг, каталитическое количество) и раствор перемешивали при комнатной температуре в течение 3 дней. Раствор упаривали под вакуумом и остаток распределяли между метиленхлоридом (10 мл) и натрий-цитратном буфером (0,1 М, pH 5,0, 10 мл). Органическую фазу сушили над безводным сульфатом натрия, фильтровали и упаривали досуха. Неочищенный продукт очищали хроматографией на силикагеле (2 г, с использованием EtOAc:CH2Cl2:ТЭА в соотношении 32:67:1, 10 мл, затем MeOH: CH2Cl2 в соотношении 3: 97, 25 мл), получая 5′-O-ДМТ-N6-бис-орто-нитробензил-2′-дезоксиаденозин-3′-O-сукцинат в виде светло-желтой пены (138 мг, 99,5%). Стадия 3: Дериватизация CPG Промытое кислотой LCAA-CPG получали аналогично примеру 1. Сшивание модифицированного нуклеозидного промежуточного продукта с промытым кислотой CPG осуществляли следующим образом. 5′-O-ДМТ-N6-бис-орто-нитробензил-2′-дезоксиаденозин-3′-O-сукцинат (37 мг, 0,04 ммоля) обрабатывали ТЭА (16 мкл) в стеклянном сосуде янтарного цвета и упаривали. К этому остатку добавляли безводный пиридин (1,5 мл), ТЭА (2 мкл), ДМАП (2,4 мг), ЭДК (76 мг, 0,04 ммоля) и промытое кислотой LCAA-CPG (200 мг) и смесь встряхивали в орбитальном смесителе в течение 3 дней при комнатной температуре. CPG отфильтровывали при пониженном давлении и интенсивно промывали изопропанолом, а затем метиленхлоридом, сушили на воздухе, а затем сушили в течение 1 часа под вакуумом. Кэппирование дериватизированного CPG осуществляли аналогично примеру 1. Пример 5 Амплификации с использованием модифицированных праймеров – влияние положения модифицированного нуклеотида С целью продемонстрировать влияние модифицированных праймеров на образование праймерного димера проводили амплификации РНК ВИЧ-1 с использованием как модифицированных праймеров, так и немодифицированных праймеров. Кроме того, для оценки влияния положения модифицированного нуклеотида на редукцию праймерного димера проводили амплификации с использованием трех различных инициирующих синтез против хода транскрипции модифицированных праймеров, которые отличались только положением модифицированного основания. Нуклеиновая кислота-мишень Матрицы РНК ВИЧ-1 синтезировали с использованием вектора для транскрипции РНК ВИЧ-1 в основном аналогично тому, как это описано у Mulder и др., 1994, J. Clin. Microbiol. 32(2):292-300. Праймеры Амплификации проводили с использованием как немодифицированных праймеров, так и модифицированных праймеров. Нуклеотидные последовательности немодифицированных праймеров приведены ниже в ориентации 5′—>3′. С использованием инициирующего синтез против хода транскрипции праймера RAR1032MB (SEQ ID: 1) и инициирующего синтез по ходу транскрипции праймера RAR1033MB (SEQ ID: 2) амплифицируют продукт длиной 175 пар оснований, соответствующий положениям нуклеотидов 2956-3130 последовательности ВИЧ-1 эталонного штамма HXB2 (GenBank, регистрацинный номер K03455) (см. табл. 1). Праймеры, указанные в табл. 1, относятся к немодифицированным праймерам. Немодифицированные праймеры биотинилировали на 5′-конце. Модифицированные праймеры, которые состояли из таких же нуклеотидных последовательностей, что и немодифицированные праймеры, но содержали бензилированный аденозин либо на 3′-конце, либо на расстоянии одного или трех нуклеотидов против хода транскрипции от 3′-конца, синтезировали аналогично примеру 1. Модифицированные формы праймеров обозначены в табл. 2. Амплификация Амплификации проводили в реакционных смесях объемом 100 мкл, содержащих следующие реагенты: 100 копий матрицы РНК ВИЧ-1 50 мМ трицин (pH 8,33) 110 мМ KOAc 300 мкМ каждого из дАТФ, дЦТФ и дГТФ 50 мкМ дТТФ 500 мкМ дУТФ 50 мкМ каждого праймера 3,5 мМ Mn(OAc)2 13%-ный глицерин 20 единиц ДНК-полимеразы ZO5* и 2,0 единицы урацил-ДНК-гликозилазы (UNG)** * Описана в патенте США 5455170. ** Производство и разработка фирмы Hoffmann-La Roche, поставляется фирмой Perkin Elmer (Norwalk, CT). Термический цикл амплификации проводили в ДНК-термоячейке типа TC480 (фирма Perkin Elmer, Norwalk, CT) с использованием следующего температурного профиля: Предреакционная инкубация: 45oC в течение 4 мин; Обратная транскрипция: 60oC в течение 20 мин; 46 циклов: денатурация: при 94oC в течение 45 с, отжиг/удлинение: при 60oC в течение 45 с; Окончательное удлинение: 60oC в течение 7 мин; Постреакционное выдерживание: 10oC до анализа (в течение короткого промежутка времени). Обнаружение амплифицированного продукта Присутствие амплифицированного продукта выявляли с помощью гель-электрофореза следующим образом. Продукты реакции фракционировали с использованием агарозного геля (100 мл 3% NuSieve и 0,5% SeaChem) и 1X ТБЭ (0,089 М трис, 0,089 М борная кислота, 0,0025 М двунатриевая соль ЭДТК) в качестве подвижного буфера. Для окраски любой присутствующей ДНК использовали бромид этидия (0,5 мкг/мл). Электрофорез проводили при 100 вольтах в течение приблизительно 1 часа. Окрашенные бромидом этидия зоны, соответствующие ДНК, визуализировали с использованием ультрафиолетового облучения. Результаты Результаты анализа с использованием гель-электрофореза приведены на фиг. 1. Номера зон, соответствующих каждой из амплификаций, проведенных с применением комбинаций немодифицированных и модифицированных праймеров, приведены в табл. 3. Полосы, соответствующие нужному ВИЧ-продукту, обозначены на чертеже стрелкой. Другие полосы на геле соответствуют продукту неспецифической амплификации и, в частности, праймерному димеру (см. табл. 3). Поскольку образование праймерного димера конкурирует с образованием требуемого продукта амплификации, редукция праймерного димера обычно приводит к соответствующему увеличению количества образовавшегося целевого продукта. Таким образом, эффект модифицированных праймеров можно выявить как при сравнении количества образовавшегося праймерного димера с его количеством, образовавшимся при использовании немодифицированных праймеров, так и при сравнении количества образовавшейся нужной мишени с ее количеством, образовавшимся при использовании немодифицированных праймеров. Сравнение результатов, полученных при использовании двух немодифицированных праймеров (зона 1), с результатами, полученными при использовании одного 3′-модифицированного праймера (зоны 2 и 5), и результатами, полученными при использовании двух 3′-модифицированных праймеров (зона 6), показывает, что уменьшение количества праймерного димера имеет место как при использовании одного, так и двух модифицированных праймеров. При амплификациях с использованием одного 3′-модифицированного праймера было обнаружено небольшое различие в редукции праймерного димера, которое зависело от того, каким образом праймер был модифицирован. Применение двух модифицированных праймеров (зона 6) привело как к существенно большему уменьшению количества праймерного димера, так и к заметному увеличению количества амплифицированной последовательности-мишени. Влияние положения модифицированного нуклеотида видно при сравнении зон 6-8. Редукция праймерного димера, полученная при использовании праймера, модифицированного на нуклеотиде, соседнем с 3′-концевым нуклеотидом (зона 7), оказалась эквивалентной таковой, полученной при использовании праймера, модифицированного на 3′-концевом нуклеотиде (зона 6), тогда как положительный результат, полученный при использовании праймера, модифицированного на нуклеотиде, расположенном на расстоянии трех оснований против хода транскрипции от 3′-концевого нуклеотида (зона 8), оказался менее выраженным. Пример 6 Дополнительные амплификации с использованием модифицированных праймеров – влияние положения модифицированного нуклеотида Для дополнительной демонстрации влияния модифицированных праймеров на образование праймерного димера сравнивали амплификации РНК HCV с использованием модифицированных праймеров и немодифицированных праймеров, используя в основном описанную выше методику. Амплификации проводили с применением трех различных модифицированных инициирующих синтез против хода транскрипции праймеров, которые отличались только положением модифицированного основания. Нуклеиновая кислота-мишень Матрицы РНК HCV синтезировали с использованием вектора для транскрипции РНК HCV, как описано у Young и др., 1993, J. Clin. Microbiol. 31(4): 882-886. Праймеры Амплификации проводили с использованием как немодифицированных праймеров, так и модифицированных праймеров. Нуклеотидные последовательности немодифицированных праймеров приведены в табл. 4 в ориентации 5′—>3′. С помощью инициирующего синтез против хода транскрипции праймера ST280A (SEQ ID N: 3) и инициирующего синтез по ходу транскрипции праймера ST778AA (SEQ ID N: 4) амплифицируют продукт длиной 240 пар оснований от 5′-нетранслируемой области генома HCV (см. табл. 4). Праймеры, указанные в табл. 4, относятся к немодифицированным праймерам. Модифицированные праймеры, которые состояли из таких же нуклеотидных последовательностей, что и немодифицированные праймеры, но содержали бензилированный аденозин либо на 3′-конце, либо на расстоянии одного или трех нуклеотидов против хода транскрипции от 3′-конца, синтезировали аналогично примеру 1. Модифицированные формы праймеров обозначены в табл. 5. Амплификация и анализ Амплификации проводили в основном аналогично примеру 3, но используя 100 копий матрицы РНК HCV. Анализ амиплифицированного продукта осуществляли методом гель-электрофореза согласно примеру 3. Результаты Результаты анализа с использованием гель-электрофореза приведены на фиг. 2. Номера зон, соответствующих каждой из амплификаций, проведенных с применением комбинаций немодифицированных и модифицированных праймеров, приведены в табл. 6. Полосы, соответствующие нужному HCV-продукту, обозначены на чертеже стрелкой. Другие полосы на геле соответствуют продукту неспецифической амплификации и, в частности, праймерному димеру (см. табл. 6). Поскольку образование праймерного димера конкурирует с образованием требуемого продукта амплификации, редукция праймерного димера обычно приводит к соответствующему увеличению количества образовавшегося нужного продукта. Таким образом, эффект модифицированных праймеров можно выявить как при сравнении количества образовавшегося праймерного димера с его количеством, образовавшимся при использовании немодифицированных праймеров, так и при сравнении количества образовавшейся нужной мишени с ее количеством, образовавшимся при использовании немодифицированных праймеров. Полученные результаты оказались сходными с таковыми, полученными при амплификации ВИЧ, описанных в предыдущем примере, но в случае амплификаций HCV увеличение количества нужного продукта было более выраженным, чем в случае амплификаций ВИЧ. Сравнение результатов, полученных с использованием двух немодифицированных праймеров (зона 1), с результатами, полученными с использованием 3′-модифицированного праймера (зоны 2 и 5), и с результатами, полученными с использованием двух 3′-модифицированных праймеров (зона 6), свидетельствуют о том, что уменьшение количества праймерного димера имеет место при использовании как одного, так и двух модифицированных праймеров. Применение двух модифицированных праймеров (зона 6) привело как к существенно большему уменьшению количества праймерного димера, так и к существенному увеличению количества амплифицированной последовательности-мишени. Так же, как и в предыдущем примере, было обнаружено небольшое различие в редукции праймерного димера при амплификациях, проведенных с использованием одного 3′-модифицированного праймера, которое зависело от того, каким образом праймер был модифицирован. Влияние положения модифицированного нуклеотида видно при сравнении зон 6-8. В целом одинаковые результаты были получены при использовании праймеров, модифицированных на 3′-концевом нуклеотиде (зона 6), на нуклеотиде, соседнем с 3′-концевым нуклеотидом (зона 7), и на нуклеотиде, расположенном на расстоянии трех оснований против хода транскрипции от 3′-концевого нуклеотида (зона 8). Эти результаты свидетельствуют о том, что группа-модификатор может быть присоединена к любому из четырех нуклеотидов на 3′-конце праймера. Пример 7 Амплификации с использованием модифицированных праймеров – влияние группы-модификатора Для дополнительной демонстрации влияния модифицированных праймеров на образование праймерного димера и для демонстрации влияния дополнительных модификаций праймеров сравнивали амплификации РНК HCV с использованием как модифицированных праймеров, так и немодифицированных праймеров, причем праймеры модифицировали, добавляя одну из трех различных групп-модификаторов: бензильную, нитробензильную или метильную группу. Результаты амплификаций анализировали двумя различными методами. В одной серии сравнительных исследований присутствие праймерного димера определяли, анализируя с помощью гель-электрофореза продукты реакции. Во второй серии сравнительных исследований образование праймерного димера в процессе амплификации оценивали с использованием описанных выше методов кинетической ПЦР. Нуклеиновая кислота-мишень Матрицы РНК HCV синтезировали, используя вектор для транскрипции РНК HCV, как описано у Young и др., 1993, J. Clin. Microbiol. 31(4): 882-886. Праймеры для амплификации Амплификации проводили с использованием как немодифицированных праймеров, так и модифицированных праймеров. Модифицированные праймеры состояли из тех же нуклеотидных последовательностей, что и немодифицированные праймеры, но были модифицированы на 3′-концевом аденозине путем добавления метильной, бензильной либо нитробензильной группы. Праймеры синтезировали аналогично предыдущим примерам. Обозначения использованных праймеров приведены в табл. 7. Реакции амплификации Амплификации проводили в реакционных смесях объемом 100 мкл, содержащих следующие реагенты: 0, 20 или 200 копий матрицы РНК HCV 50 мМ трицин, pH 8,3; 110 мМ KOAc; 3,5 мМ Mn(OAc)2; 300 мкМ каждого из дАТФ, дЦТФ и дГТФ; 50 мкМ дТТФ; 500 мкМ дУТФ; 250 нМ каждого праймера; 20 ед. rTth*; 2 единицы UNG* и 13%-ный глицерин * Производство и разработка фирмы Hoffmann-La Roche, поставляется фирмой Perkin Elmer (Norwalk, CT). Термический цикл каждой реакционной смеси проводили в ДНК-термоячейке типа GeneAmp  PCR System 9600 (фирма Perkin Elmer, Norwalk, CT) с использованием следующего температурного профиля: PCR System 9600 (фирма Perkin Elmer, Norwalk, CT) с использованием следующего температурного профиля:Предреакционная инкубация: 45oC в течение 4 мин; Обратная транскрипция: 60oC в течение 24 мин; 46 циклов: денатурация при 94oC в течение 30 с, отжиг/удлинение при 60oC в течение 30 с; Окончательное удлинение: 60oC в течение 7 мин; Постреакционная выдержка: 4oC Обнаружение амплифицированного продукта А. Гель-электрофорез Присутствие амплифицированного продукта выявляли с помощью гель-электрофореза следующим образом. Продукты реакции фракционировали с использованием агарозного геля (100 мл 3% NuSieve, 0,5% SeaChem и 0,5 мкг/мл бромида этидия) и 1X ТБЭ (0,089 М трис, 0,089 М борная кислота, 0,0025 М двунатриевая соль ЭДТК) в качестве подвижного буфера. Электрофорез проводили при 100 вольтах в течение приблизительно 1 часа. Окрашенные бромидом этидия зоны, соответствующие ДНК, визуализировали с использованием ультрафиолетового облучения. Б. Определение с помощью кинетической ПЦР В описанных выше методах кинетической ПЦР в ПЦР добавляют интеркалирующий краситель, такой как бромид этидия, который более интенсивно флуоресцирует, когда встраивается в двухцепочечную ДНК. Увеличение количества двухцепочечной ДНК в процессе амплификации определяют измерением флуоресценции красителя в процессе реакции. Поскольку методы кинетической ПЦР позволяют измерить только увеличение общего количества двухцепочечной ДНК, образование продукта неспецифической амплификации не может быть измерено независимо. С целью независимо от амплификации матрицы оценить наличие происходящей неспецифической амплификации, приводящей к образованию праймерного димера, проводили реакции без матрицы нуклеиновой кислоты. В такой реакции без использования матрицы любое увеличение двухцепочечной ДНК связано с образованием не зависящего от матрицы продукта неспецифического продукта амплификации. Условия реакции при использовании метода кинетической ПЦР соответствовали описанным выше, за исключением того, что бромид этидия добавляли в реакционную смесь в концентрации 1 г/мл. Реакции оценивали измерением флуоресценции реакционной смеси, как описано в EP 640828. Измеренные значения флуоресценции стандартизировали путем выделения начального значения флуоресценции, полученного во время начального цикла реакции, когда значения флуоресценции между циклами были относительно постоянными. Выбранное для измерения начальной флуоресценции количество циклов было одинаковым для всех сравниваемых реакций, поэтому все измерения характеризуют увеличение относительно одного и того же реакционного цикла. Флуоресценция реакционной смеси в реакциях без использования матрицы оставалась относительно постоянной до момента образования праймерного димера. В большинстве реакций, если проводят достаточное количество циклов амплификации, то в конечном итоге оказывается возможным обнаружить праймерный димер. Роль модифицированных праймеров может быть выявлена при сравнении количества циклов, которые необходимо провести до образования праймерного димера, если образование последнего вообще имеет место. Результаты Результаты анализа с помощью гель-электрофореза приведены на фиг. 3. Номера зон, соответствующих каждой амплификации с использованием немодифицированного и трех типов модифицированных праймеров и 200 копий, 20 копий или 0 копий РНК HCV, приведены в табл. 8 (номера зон считают слева направо: зоны 1-30 находятся в верхней половине геля; зоны 31-60 находятся в нижней половине геля). Кроме того, молекулярные массы маркеров показаны в зонах 1 и 31 (ДНК PhiX 174 RF, расщепленная рестриктазой HaeIII, New England Biolabs, Beverly, MA) и в зонах 30 и 60 (Superladder-low, лестница длиной 20 пар оснований, Gen Sura, Del Mar, CA). Полосы, соответствующие нужному конкретному продукту, указаны на чертеже стрелкой (~230 пар оснований). Другие полосы в геле соответствуют продукту неспецифической амплификации и, в частности, праймерному димеру (см. табл. 8). Результаты, указанные в табл. 8, показывают, что амплификация с использованием модифицированных праймеров привела к получению большего количества амплифицированной нуклеиновой кислоты HCV, чем амплификации с использованием немодифицированных праймеров. Кроме того, амплификация с использованием модифицированных праймеров привела к редукции праймерного димера по сравнению с амплификациями, проведенными с использованием немодифицированных праймеров. При применении метода кинетической ПЦР в процессе реакции оценивали флуоресценцию. Скорость возрастания флуоресценции после того, как увеличение флуоресценции становилось заметным, оказалась примерно одинаковой во всех реакциях, что видно по форме кривой, полученной при построении графика зависимости флуоресценции от количества циклов (не показано). Это свидетельствует о том, что модифицированные праймеры не ингибируют заметно эффективность каждой стадии амплификации после начальной фазы амплификации. Реакции существенно отличались по количеству циклов, которые требовалось провести до того, как оказалось возможным заметно увеличить флуоресценции. Для количественной оценки различий между реакциями результаты выражают в виде количества циклов амплификаций, которые следует провести до того, как флуоресценция превысит некоторый условный уровень флуоресценции (УУФ). УУФ был выбран близким к базовому уровню флуоресценции, но выше диапазона случайных флуктуаций измеряемой флуоресценции таким образом, чтобы кинетические характеристики реакции можно было измерять на фазе геометрического роста амплификации. Накопление амплифицированного продукта в более поздних циклах ингибирует реакцию и в конечном итоге приводит к кривой выхода реакции на горизонтальный участок. Результаты, полученные с помощью кинетической ПЦР, обобщены в табл. 9. Каждое значение для амплификации с использованием 20 или 200 копий матрицы мишени представляет собой среднее значение, полученное по пяти повторным амплификациям, за исключением вариантов амплификации с использованием бензилированных праймеров и 20 копий мишени, которые представляют собой средние значения, полученные по четырем повторностям. Каждое значение для амплификаций без матрицы представляет собой среднее значение по восьми повторностям. Две из восьми повторностей амплификаций, проведенных с использованием бензилированных праймеров и без мишени, не приводили к образованию праймерного димера после 46 циклов. Представлено полученное по остальным шести амплификациям среднее значение, которое представляет собой условное среднее значение для вариантов с образованием праймерного димера. Условное среднее значение не сопоставимо с другими приведенными данными, поскольку некоторые данные исключены (см. табл. 9). Данные свидетельствуют о том, что модифицированные праймеры выраженно замедляют амплификацию нуклеиновой кислоты-мишени, поскольку УУФ достигается на несколько циклов позднее. Замедление не коррелирует с уменьшением конечного выхода продукта специфической амплификации. Установлено, что все амплификации нуклеиновой кислоты-мишени достигали горизонтального участка кривой в течение 46 применяемых в эксперименте циклов и, как доказано соответствующими данными, полученными с помощью гель-электрофореза, конечный выход увеличивался при использовании модифицированных праймеров. Данные свидетельствуют о том, что замедление образования праймерного димера оказалось существенно более выраженным, чем замедление амплификации мишени. Положительное действие праймеров более четко видно при сравнении амплификаций, проведенных без использования мишени, и амплификаций, проведенных с использованием 200 копий матрицы. При применении немодифицированных праймеров в амплификациях без использования мишени увеличение флуоресценции до УУФ происходило только на один цикл позднее, что свидетельствует о том, что амплификацию мишени может оказаться трудно отличить от образования праймерного димера. В противоположность этому при применении модифицированных праймеров возрастание флуоресценции вследствие образования праймерного димера, если оно вообще имеет место, происходит позднее по крайней мере на три цикла, а при использовании бензилированных праймеров – позднее по крайней мере на 6 циклов. Таким образом, амплификация мишени может быть выявлена и ее можно отличить от образования праймерного димера. При сравнении амплификаций без использования мишени и амплификаций с использованием 20 копий матрицы видно, что модифицированные праймеры оказывали такое же действие, заключающееся в более выраженном замедлении образования праймерного димера без замедления амплификации мишени. При использовании немодифицированных праймеров 20 копий матрицы не могли быть выявлены. При использовании нитробензилированных и бензилированных праймеров образование праймерного димера оказалось существенно замедленным, что позволило обнаружить в этой системе 20 копий матрицы. Данные, полученные при оценке флуоресценции в каждом цикле амплификации (не приведены), показали, что в целом замедление образования праймерного димера оказалось достаточным для предотвращения того, чтобы образование праймерного димера вышло на горизонтальный участок в течение 46 циклов. Таким образом, по-видимому, модифицированные праймеры замедляют образование праймерного димера в достаточной степени, чтобы амплификация мишени могла быть завершена, а реакция прекращена до образования значительного количества праймерного димера. Пример 8 Фотолабильные праймеры Для демонстрации возможности применения фотолабильных модифицированных праймеров проводили амплификации РНК HCV с использованием как модифицированных праймеров, так и немодифицированных праймеров. Модифицированные праймеры модифицировали присоединением одной или двух нитробензильных групп к экзоциклическому амину 3′-концевого аденина. Праймеры для амплификации Праймеры синтезировали аналогично примеру 4. Обозначения использованных праймеров приведены в табл. 10. Реакции амплификации Для каждой пары праймеров проводили реакции с использованием серийных разбавлений исходной концентрации мишени. Проводили две серии реакций, в каждой из которых использовали все комбинации пар праймеров и исходную концентрацию мишени, и в каждой серии реакций каждую реакцию, содержащую данную пару праймеров и концентрацию мишени, проводили с дублированием. Амплификации проводили в реакционных смесях объемом 100 мкл, содержащих следующие реагенты: 0, 10, 102, 103, 104 или 105 копий матрицы РНК HCV; 55 мМ трицин; 90 мМ KOAc; 3 мМ Mn(OAc)2; 200 мкМ каждого из дАТФ, дЦТФ, дГТФ и дТТФ; 200 мкМ дУТФ; 250 нМ каждого праймера; 10 ед. rTth*; 2 единицы UNG* и 8 %-ный глицерин. (* Производство и разработка фирмы Hoffmann-La Roche, поставляется фирмой Perkin Elmer (Norwalk, CT)). Термический цикл каждой реакционной смеси проводили в ДНК-термоячейке типа GeneAmp PCR System 9600 (фирма Perkin Elmer, Norwalk, CT) с использованием следующего температурного профиля: Предреакционная инкубация: 50oC в течение 5 мин; Обратная транскрипция: 60oC в течение 30 мин; Начальная денатурация: 95oC в течение 1 мин; 2 цикла: денатурация при 95oC в течение 15 с, отжиг/удлинение при 60oC в течение 20 с; 46 циклов: денатурация при 90oC в течение 15 с, отжиг/удлинение при 60oC в течение 20 с; Окончательное удлинение: 72oC в течение 10 мин. В эксперименте применяли полированные крышки для реакционных пробирок (Perkin Elmer, Norwalk, CT). После того, как температуру реакции поднимали до 60oC, необходимой для стадии обратной транскрипции, из планшета для ПЦР в блоке термоячейки удаляли нагревательную крышку и половину реакционных пробирок (один полный набор дублирующихся реакционных смесей) покрывали алюминиевой фольгой. Другую часть освещали в течение 10 минут ультрафиолетовой лампой с держателем, испускающей свет с длиной волны 302 нм (UVP модель UVM-57, фирма UVP Products, San Gabriel, CA). Нагревательную крышку возвращали на место и продолжали амплификацию. Результаты Результаты амплификаций анализировали с помощью гель-электрофореза, как описано выше. Результаты приведены на фиг. 4. Праймеры и используемое в каждой реакции количество копий матрицы указаны на фотографии геля (дан логарифм числа копий). На чертеже указаны полосы, соответствующие требуемому продукту. Другие полосы в геле соответствуют продукту неспецифической амплификации и, в частности, праймерному димеру. Сравнительный анализ серии реакций, проведенных с использованием ультрафиолетового облучения, показывает, что применение модифицированных праймеров привело к значительному уменьшению праймерного димера, особенно при небольшом количестве копий. Сравнительный анализ серии реакций, проведенных без использования облучения, показывает, что применение биснитробензилированных праймеров привело, как и ожидалось, к полному ингибированию амплификации. Амплификации, проведенные с использованием мононитробензилированных праймеров, не только привели к получению продукта, но в них обнаружено существенное уменьшение праймерного димера, что согласуется с результатами, полученными в предыдущем примере. Пример 9 Амплификации с использованием праймеров, модифицированных пара-трет-бутилбензилом В этом примере описана амплификация РНК HCV с использованием праймеров, модифицированных пара-трет-бутилбензильными группами. Нуклеиновая кислота-мишень Матрицы РНК HCV синтезировали с использованием вектора для транскрипции РНК HCV, как описано у Young и др., 1993, J. Clin. Microbiol. 31(4): 882-886. Праймеры Амплификации проводили с использованием модифицированных праймеров, синтезированных аналогично примеру 2. Нуклеотидные последовательности немодифицированных праймеров приведены ниже в ориентации 5′—>3′. Использованные праймеры представляли собой модифицированные варианты инициирующего синтез против хода транскрипции праймера ST280A (SEQ ID N: 3) и инициирующего синтез по ходу транскрипции праймера ST778AA (SEQ ID N: 4). Модифицированные формы праймеров обозначены в табл. 11. Амплификация и анализ Амплификации проводили в реакционных смесях объемом 100 мкл, содержащих следующие реагенты: 20,5, 2,5, 2 или 0 копий матрицы РНК HCV; 50 мМ трицин (pH 8,33); 110 мМ KOAc; 300 мкМ каждого из дАТФ, дЦТФ и дГТФ; 50 мкМ дТТФ; 500 мкМ дУТФ; 50 нМ каждого праймера; 3,5 мМ Mn(OAc)2; 13%-ный глицерин; 20 ед. ДНК-полимеразы rTth и 8,0 единиц UNG*. * Производство и разработка фирмы Hoffmann-La Roche, поставляется фирмой Perkin Elmer (Norwalk, CT). Термический цикл амплификации проводили в ДНК-термоячейке типа TC480 (фирма Perkin Elmer, Norwalk, CT) с использованием следующего температурного профиля: Предреакционная инкубация: 45oC в течение 12 мин; Инактивация UNG: 90oC в течение 30 с; Обратная транскрипция: 60oC в течение 20 мин; 47 циклов: денатурация при 94oC в течение 45 с, отжиг/удлинение при 60oC в течение 70 с; Окончательное удлинение: 60oC в течение 7 мин; Постреакционная выдержка: при 10oC до анализа (в течение короткого промежутка времени). Продукты амплификации анализировали гель-электрофорезом, как описано выше. Результаты Амплификации, проводимые для каждого количества матриц мишени, дублировали следующим образом: 3 амплификации проводили с использованием 20 копий матрицы мишени, 3 амплификации проводили с использованием 5 копий матрицы мишени, 2 амплификации проводили с использованием 2,5 копий матрицы мишени, 1 амплификацию проводили с использованием 2 копий матрицы мишени и 23 амплификации проводили без использования матрицы. Все положительные амплификации матриц давали отдельную полосу на геле, соответствующую мишени ожидаемого размера. Ни одна из амплификаций не привела к образованию ни праймерного димера, ни другого продукта неспецифической амплификации. Результаты можно сравнить с результатами, приведенными выше в примере 6, где ту же самую HCV-мишень амплифицировали с использованием тех же самых праймерных последовательностей. Сравнение этих результатов с таковыми из примера 6 показывает, что амплификации с использованием праймеров, модифицированных пара-трет-бутилбензилом, были значительно улучшены по сравнению с соответствующими амплификациями, проведенными с немодифицированными праймерами. Проводили дополнительные эксперименты, в которых РНК ВИЧ-1 амплифицировали с использованием вариантов праймеров, модифицированных пара-трет-бутилбензилом, описанных выше в примере 5. Амплификации проводили в основном по описанной выше методике. Так же, как и в случае HCV-системы, представленной в данном описании, все положительные амплификации матриц ВИЧ-1 давали отдельную полосу на геле, соответствующую мишени ожидаемого размера, и ни одна из амплификаций не привела к образованию ни праймерного димера, ни другого продукта неспецифической амплификации. Эти дополнительные результаты можно сравнить с результатами, приведенными выше в примере 5, где ту же самую ВИЧ-мишень амплифицировали с использованием тех же самых праймерных последовательностей. Сравнение этих результатов с таковыми из приведенного выше примера 5 показывает, что амплификации с использованием праймеров, модифицированных пара-трет-бутилбензилом, были значительно улучшены по сравнению с соответствующими амплификациями, проведенными с немодифицированными праймерами. Пример 10 Амплификация ДНК микобактерий В этом примере приведено сравнение амплификаций ДНК микобактерий, проведенных с использованием немодифицированных и модифицированных праймеров. Применяли как праймеры, модифицированные путем добавления бензильной группы к 3′-концевому нуклеотиду, так и праймеры, модифицированные путем добавления пара-трет-бутилбензильной группы к 3′-концевому нуклеотиду. Реакции с использованием немодифицированных праймеров осуществляли в основном согласно методике, описанной у Tevere и др., 1996, J. Clin. Microbiol., 34(4): 918-923. Амплификации проводили с использованием образцов мокроты, в которые была добавлена в известной концентрации ДНК микобактерий для имитации зараженных клинических образцов. Дополнительные амплификации осуществляли с использованием очищенной ДНК микобактерий и с использованием лишенных ДНК образцов в качестве отрицательного контроля. Подготовка образца Образцы мокроты, для которых ранее путем микроскопии и культивирования было показано отсутствие микобактерий, разжижали и обеззараживали с помощью N-ацетилцистеин-NaOН-метода, рекомендованного CDC (Kent и Kubica, 1985, Public Health Mycobacteriology – a guide for the level III laboratory, U.S. Departament of Health and Human Services, Centers for Disease Control, Атланта, данное руководство включено в настоящее описание в качестве ссылки). Разжиженную мокроту (100 мкл) добавляли к 500 мкл реактива для промывки респираторных образцов (Respiratory Specimen Wash Reagent) (10 мМ трис-HCl, 1 мМ ЭДТК, 1% (об./об.) тритона X-100, 0,05% NaN3, pH 8,0) и центрифугировали в течение 10 минут при 12500xg. Каждый дебрис повторно суспендировали в 100 мкл лизирующего реагента (0,05 н. NaOH, 1% (об./об.) тритона X-100, 1 мМ ЭДТК, 0,05% NaN3) и инкубировали в течение 45 минут при 60oC. Затем лизаты нейтрализовали с помощью 100 мкл нейтрализующего реагента (0,2 М трис-HCl, 8 мМ MgCl2, 0,05% NaN3, pH 7,5). Группы лизатов мокроты получали объединением по 80 мкл каждого из двух различных лизатов мокроты. К каждой из 8 групп лизатов мокроты (по 160 мкл в каждой) добавляли 15 мкл маточного раствора ДНК (2 копии/мкл в смеси 1:1 лизирующего и нейтрализующего реагентов), выделенной из культуры M. tuberculosis. Образцы, содержащие очищенную ДНК микобактерии (без мокроты) в известной концентрации, готовили добавлением 10 мкл маточного раствора ДНК к 100 мкл смеси 1:1 лизирующего реагента и нейтрализующего реагента. Образцы отрицательного контроля (без ДНК) состояли из смеси 100 мкл лизирующего реагента и 100 мкл нейтрализующего реагента. Праймеры для амплификации Амплификации проводили с использованием праймеров, состоящих из следующих нуклеотидных последовательностей: Праймер KY18 (SEQ ID N: 5) Последовательность 5′-CACATGCAAGTCGAACGGAAAGG-3′ Праймер KY436 (SEQ ID N: 6) Последовательность 5′-TAACACATGCAAGTCGAACGGAAA-3′ Праймер KY75 (SEQ ID N: 7) Последовательность 5′-GCCCGTATCGCCCGCACGCTCACA-3′ Для амплификации использовали следующие пары праймеров, содержащих определенную группу-модификатор, присоединенную к 3′-концевому основанию. Все модифицированные праймеры синтезировали аналогично предыдущим примерам. Все праймеры биотинилировали на 5′-конце (см. табл. 12). Амплификация Для каждого образца амплификации проводили с использованием пары немодифицированных праймеров KY18 (SEQ ID N: 5) и KY75 (SEQ ID N: 7) и модифицированных форм пары праймеров KY436 (SEQ ID N: 6) и KY75 (SEQ ID N: 7). Амплификации проводили в реакционных смесях объемом 100 мкл, каждая из которых содержала по 50 мкл одного из трех описанных выше образцов и 50 мкл двукратной смеси реактивов, содержащих следующие реагенты: 100 мМ трис-HCl, pH 8,9; 500 нМ каждого праймера; 200 мкМ каждого из дНТФ (дАТФ, дЦТФ, дГТФ и дУТФ); 20% (об./об.) глицерина; 10 ед. AmpliTaq* 6 ед. AmpliErase* * Производство и разработка фирмы Hoffmann-La Roche, поставляется фирмой Perkin Elmer (Norwalk, CT). Термический цикл для каждой реакции проводили в термоячейке GeneAmp PCR-системы 9600 (фирма Perkin Elmer, Norwalk, CT) с использованием следующего температурного профиля: Предреакционная инкубация: 50oC в течение 5 мин; 2 цикла: денатурация при 98oC в течение 20 с, отжиг при 62oC в течение 20 с, удлинение при 72oC в течение 45 с; 41 цикл: денатурация при 94oC в течение 20 с, отжиг при 62oC в течение 20 с, удлинение при 72oC в течение 45 с; Окончательное удлинение: 72oC в течение приблизительно 12 ч (в течение ночи). Продукты амплификации визуализировали с помощью электрофореза на 2% NuSieve  , 0,5%-ном агарозном геле с последующим окрашиванием бромидом этидия.
Результаты , 0,5%-ном агарозном геле с последующим окрашиванием бромидом этидия.
РезультатыРезультаты электрофоретического анализа приведены на фиг. 5. Для каждого образца продукты, полученные в результате амплификаций, проведенных с немодифицированными праймерами (обозначены “A”) и с модифицированными праймерами (обозначены “B” и “C”), разгоняли в соседних зонах. Полосы, соответствующие нужной микобактериальной последовательности-мишени, указаны стрелками. Другие полосы соответствуют продукту неспецифической амплификации; самые нижние полосы в геле соответствуют праймерному димеру. Зоны, обозначенные “M”, содержат маркер молекулярной массы (ДНК PhiX174, обработанная рестриктазой HaeIII). При использовании немодифицированных праймеров амплификации очищенной ДНК микобактерии привели к образованию праймерного димера. Применение любой пары модифицированных праймеров привело к увеличению количества присутствующей нужной последовательности и практически исключило образование заметного количества праймерного димера. В отличие от амплификаций с применением очищенной ДНК при использовании немодифицированных праймеров присутствие в реакции амплификации лизата мокроты привело к снижению эффективности и к увеличению образования продукта неспецифической амплификации, что видно по наличию полос, соответствующих постороннему продукту. Увеличение продукта неспецифической амплификации не является неожиданным, поскольку лизаты мокроты содержат значительные количества ДНК человека, которая отсутствовала при амплификациях очищенной ДНК микобактерии. Применение любой пары модифицированных праймеров в амплификациях, осуществляемых в присутствии мокроты, привело как к значительному увеличению количества полученного нужного продукта, так и к снижению неспецифической амплификации. Пример 11 Дополнительный синтез праймеров, модифицированных бензильной группой Праймеры, модифицированные путем добавления бензильной группы к концевому цитозину, синтезировали в основном аналогично примеру 1, но применяя LCCA-CPG, сшитое с N4-ацетил-N4-бензил-5′-O- ДМТ-2′-дезоксицитидином, полученным следующим образом. Стадия 1: Синтез N44-бензил-2′-дезоксицитидина К гидрохлориду 2′-дезоксицитидина (5,28 г, 20 ммолей, фирма U.S. Biochemical Corp., Cleveland, OH) добавляли бензиламин (20 мл) и смесь выдерживали при 150oC в течение 3 часов в атмосфере аргона. Раствор концентрировали под вакуумом, получая вязкое масло желтого цвета, которое распределяли между водой (100 мл) и этилацетатом (100 мл). Водную фазу промывали этилацетатом (100 мл) и отделяли. Водную фазу концентрировали под вакуумом, получая сироп желтого цвета (13 г), который очищали колоночной хроматографией на силикагеле с использованием в качестве элюента метиленхлорида:метанола в соотношении 15:1, получая нужный продукт (5,8 г, 91,5%) в виде бесцветного сиропа. Стадия 2: Синтез N4-ацетил-N4-бензил-2′-дезоксицитидина N4-бензил-2′-дезоксицитидин (2,5 г, 7,9 ммоля) растворяли в 15 мл безводного диметилформамида (15 мл), добавляли уксусный ангидрид (8 г, 79 ммолей, 10 экв.) и смесь перемешивали в течение ночи при комнатной температуре. Растворитель и избыток уксусного ангидрида выпаривали под вакуумом. Продукт очищали колоночной хроматографией на силикагеле с использованием в качестве элюента метиленхлорида:метанола в соотношении 20:1, получая указанное в заголовке соединение (1,3 г, 48%). Соединение обладало высокой гигроскопичностью и его хранили в обезвоженном состоянии при -20oC. Стадия 3: Синтез N4-ацетил-N4-бензил-5′-O-ДМТ- 2′-дезоксицитидина N4-ацетил-N4-бензил-2′-дезоксицитидин (76 мг, 0,2 ммоля) растворяли в 1 мл безводного пиридина и добавляли ДМТ-Cl (122 мг, 0,2 ммоля, 1,0 экв.). Реакционную смесь перемешивали в течение 3 часов. Анализ с помощью ТСХ показал, что некоторое количество исходного продукта не вступило в реакцию, поэтому добавляли аликвотное количество ДМТ-Cl (61 мг, 0,5 экв.) и образовавшуюся смесь перемешивали в течение еще 1 ч, после чего анализ с помощью ТСХ показал, что реакция завершена. Реакцию прекращали добавлением 15 мл соляного раствора и водную фазу экстрагировали метиленхлоридом (3х15 мл). Объединенный органический слой промывали соляным раствором (2х15 мл) и сушили над безводным сульфатом магния. Растворитель выпаривали и смесь очищали хроматографией на силикагеле с использованием метиленхлорида:метанола в соотношении 50:1, получая N4-ацетил-N4-бензил-5′-O-ДМТ-2′-дезоксицитидин (96 мг, выход 65%). Стадия 4: Сукцинилирование N4-ацетил-N4-бензил-5′-O-ДМТ-2′-дезоксицитидин (96 мг, 0,13 ммоля) растворяли в 2 мл безводного пиридина. Добавляли янтарный ангидрид (100 мг, 1,0 ммоль) и диметиламинопиридин (20 мг) и образовавшуюся смесь перемешивали при комнатной температуре в течение 3 дней. Растворитель выпаривали и остаток упаривали совместно с толуолом (3х10 мл). Для растворения остатка добавляли хлороформ (50 мл) (для улучшения растворения применяли обработку ультразвуком). Хлороформный слой промывали соляным раствором (3х15 мл) и водой (1х15 мл). Органический слой сушили над безводным сульфатом магния. Растворитель выпаривали с получением 108 мг чистого N4-ацетил-N4-бензил-5′-O-ДМТ-2′-дезоксицитидин-3′-O-сукцината (выход 97%). Стадия 5: Получение LCAA-CPG, сшитого с N4-ацетил-N4-бензил-5′-O-ДМТ-2′-дезоксицитидин-3′-O-сукцинатом Активированное CPG получали следующим образом. LCAA-CGP (1,0 г, LCA00500C, CPG Inc., Fairfield, NJ) обрабатывали трихлоруксусной кислотой в метиленхлориде (3%, 10 мл) и перемешивали путем вращения в течение 4 часов на роторном испарителе (роторный испаритель фирмы Buchi, Flawil, Швейцария) (без вакуума). Растворитель отфильтровывали и CPG промывали последовательно смесью 9:1 триэтиламина:этилдиизопропиламина (3х5 мл), метиленхлоридом (3х10 мл) и простым эфиром (3х10 мл), а затем сушили под вакуумом. Сшивание модифицированного нуклеозидного промежуточного продукта с промытым кислотой CPG осуществляли следующим образом. К 1 г активированного LCAA-CGP добавляли N4-ацетил-N4-бензил-5′-O-ДМТ-2′-дезоксицитидин-3′-O-сукцинат (108 мг, 0,13 ммоля), полученный по описанной выше методике, диметиламинопиридин (20 мг) и 5 мл безводного пиридина. Реакционную смесь перемешивали путем вращения на роторном испарителе (без вакуума) в течение 3 дней. Супернатант отфильтровывали и сшитое LCAA-CGP последовательно промывали пиридином (3х5 мл), метиленхлоридом (3х10 мл) и простым эфиром (3х10 мл) и затем сушили под вакуумом. Кэппирование LCAA-CPG, сшитого с N4-ацетил-N4-бензил-5′-O-ДМТ-2′-дезоксицитидин-3′-O-сукцинатом, осуществляли следующим образом. К дериватизированному CPG добавляли смесь для кэппирования, состоящую из реагента A (ТГФ/лутидин/Ac2O в соотношении 8:1:1; Glen Research DNA synthesis reagent, Sterling, VA) и реагента B (10%-ный N-метилимидазол в ТГФ, Glen Research) и реакционную смесь перемешивали вращением на роторном испарителе (без вакуума) в течение ночи. Раствор отфильтровывали и сшитое LCAA-CPG последовательно промывали пиридином (3х5 мл), метиленхлоридом (3х10 мл), ТГФ (3х10 мл) и простым эфиром (3х10 мл) и затем сушили под вакуумом. Сшивающую способность дериватизированного LCAA-CPG определяли обработкой 5 мг продукта 3%-ной трихлоруксусной кислотой в метиленхлориде и количество высвободившегося иона диметоксилтритилкарбония измеряли с помощью УФ-спектроскопии. Установлено, что количество производного нуклеозида, сшитого с LCAA-CPG, составляло 19,5 мкмоль/г. Перечень последовательностей приведен в конце описания. Формула изобретения
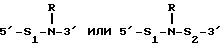 где S1 обозначает первую нуклеотидную последовательность, имеющую длину от приблизительно 5 до приблизительно 50 нуклеотидов; S2 обозначает вторую последовательность, имеющую длину от одного до трех нуклеотидов; N обозначает нуклеотид, который содержит пуриновое или пиримидиновое основание, в состав которого входит экзоциклический амин; R обозначает группу-модификатор, причем R ковалентно связан с N через экзоциклический амин и имеет следующую структуру 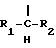 где R1 и R2 независимо друг от друга обозначают водород, C1-C10алкильную группу, алкоксигруппу, фенильную группу, феноксигруппу, замещенную фенильную группу, нафтильную группу или замещенную нафтильную группу. 2. Олигонуклеотид по п. 1, где R обозначает 2-нафтилметильную группу, бензильную группу или замещенную бензильную группу. 3. Олигонуклеотид по п.1 или 2, где R обозначает замещенную бензильную группу, имеющую следующую структуру 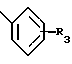 где R3 обозначает разветвленную или линейную C1-C6алкильную группу, метоксигруппу или нитрогруппу. 4. Олигонуклеотид по любому из пп.1 – 3, где R3 обозначает разветвленную или линейную C1-C4алкильную группу, метоксигруппу или нитрогруппу. 5. Олигонуклеотид по п.3 или 4, где R3 присоединен в пара-положении. 6. Олигонуклеотид по любому из пп.1 – 5, где N обозначает аденозин. 7. Олигонуклеотид по любому из пп. 1 – 6, где R выбирают из группы, включающей бензил, пара-метилбензил, пара-третбутилбензил, пара-метоксибензил, орто-нитробензил и 2-нафтилметил. 8. Способ амплификации нуклеиновых кислот, предусматривающий применение праймеров, отличающийся тем, что в качестве праймеров применяют по крайней мере один олигонуклеотид по любому из пп.1 – 7. 9. Способ по п. 8, где способ представляет собой полимеразную цепную реакцию. 10. Набор для амплификации нуклеиновых кислот, содержащий праймеры, отличающийся тем, что в качестве праймеров он содержит по меньшей мере один олигонуклеотид по любому из пп.1 – 7. РИСУНКИ
|
||||||||||||||||||||||||||
