Патент на изобретение №2159241
|
||||||||||||||||||||||||||
(54) СОЛИ ПРОИЗВОДНОГО ИНДОЛА ПРОТИВ МИГРЕНИ
(57) Реферат: Описывается новая кристаллическая гидробромидная соль в альфаполиморфной форме (3-(N-метил-2 (R) пирролидинилметил)-5-(2-фенил-сульфонилэтил)-1Н-индола формулы (I), характеризующаяся тем, что в нуджоле имеет инфракрасный спектр, который показывает значительные полосы поглощения при  = 3371, 3293, 2713, 2524, 1419, 1343, 1307, 1264, 1151, 1086, 1020, 1008, 999, 922, 900, 805, 758, 740, 728, 689, 672, 652, 640, 598, 581, 573, 531, 498, 465, 457, 443, 428, 422, 414 и 399 см-1. Соединения проявляют активность, пригодную для лечения мигрени и других расстройств. 5 с. и 9 з.п.ф-лы, 6 ил. , 2 табл. = 3371, 3293, 2713, 2524, 1419, 1343, 1307, 1264, 1151, 1086, 1020, 1008, 999, 922, 900, 805, 758, 740, 728, 689, 672, 652, 640, 598, 581, 573, 531, 498, 465, 457, 443, 428, 422, 414 и 399 см-1. Соединения проявляют активность, пригодную для лечения мигрени и других расстройств. 5 с. и 9 з.п.ф-лы, 6 ил. , 2 табл.
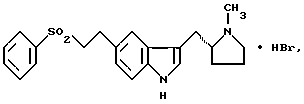
Изобретение относится к гидробромидным солям 3-(N-метил-2(R)-пирролидинилметил)-5-(2-фенилсульфонилэтил)-1H-индола, имеющим формулу (I) 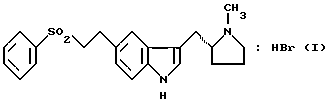 Предпочтительно изобретение относится к специфической полиморфной форме, упоминаемой в дальнейшем как альфа-форма вышеуказанной гидробромидной соли. Кроме того, оно относится к промежуточной полиморфной форме, упоминаемой в дальнейшем как бета-форма указанной гидробромидной соли, к способам получения альфа- и бета-форм, к фармацевтическим препаратам, содержащим альфа-форму, и к применению альфа-формы в медицине. WO-A-92/06973 относится к ряду 3,5-замещенных индолов и их фармацевтически приемлемых солей, которые пригодны для лечения мигрени и других расстройств. Приведенными в этом источнике примерами таких солей являются гидрохлорид, гидробромид, гидроиодид, нитрат, сульфат или бисульфат, фосфат или кислый фосфат, ацетат, лактат, цитрат или кислый цитрат, тартрат или битартрат, сукцинат, малеат, фумарат, глюконат, сахарат, бензоат, метансульфонат и памоат. Конкретно, в нем описаны 3-(N-метил-2(R)-пирролидинилметил)-5-(2- фенилсульфонилэтил)-1H-индол и его соль гемисукцинат, последняя характеризуется как некристаллическая пена. Дальнейшие исследования подтвердили, что эта соль непригодна для фармацевтических композиций, так как многочисленные попытки получить ее в форме, которая имела бы свойства, необходимые для препарата, оказались безуспешными. Проблема, которую ставит перед собой настоящее изобретение, – это обеспечение фармацевтически приемлемой соли 3-(N-метил-2(R)-пирролидинилметил)-5-(2-фенилсульфонилэтил)-1H-индола, которая могла бы быть эффективно переработана для получения стабильных и эффективных лекарственных препаратов, в частности твердых и прессуемых лекарственных форм. К таким лекарственным формам относятся оральные таблетки с обычным выделением полезного вещества, таблетки (матрицы) с регулируемым выделением, быстрорастворимые таблетки (например, лиофилизованные), таблетки, закладываемые под язык или за щеку, заполненные порошком или гранулами оральные капсулы, порошки для восстанавливаемых суспензий, системы из множества частиц с обычным или регулируемым выделением, заключенных в капсулы или спрессованных в таблетки, пастилки, драже, суппозитории, пессарии, твердые имплантаты, лиофильные тампоны, наночастицы и микрочастицы и порошок для суспензии и введения через нос, а также сухие системы для ингаляции. Наряду с другими критериями, которые должны быть удовлетворены, важным является то, что выбранная соль должна быть кристаллической, должна иметь подходящую температуру плавления, должна быть негигроскопичной, пригодной для прессования и устойчивой в твердом состоянии в сочетании с достаточной растворимостью и свойствами в растворенном состоянии. Эта проблема неожиданно разрешена благодаря новой альфа-форме гидробромидной соли формулы (I), которая отвечает вышеуказанным требованиям настолько, что она в высшей степени пригодна для получения фармацевтических препаратов в твердой лекарственной форме, в частности, для орального, защечного и подъязычного введения. Первым шагом в поисках разрешения проблемы было получение аддитивной соли с кислотой монокислого основания 3-(N-метил-2(R)-пирролидинилметил)-5-(2-фенилсульфонилэтил)-1H-индола, которая и является кристаллической, и имеет достаточно высокую температуру плавления (> около 130oC), что необходимо для фармацевтической переработки при производстве и прессовании твердой лекарственной формы. Были сделаны попытки получить подходящую форму следующих солей: гидрохлорида, гидробромида, гемисульфата, бисульфата, нитрата, кислого фосфата, фосфата, метансульфоната, бензолсульфоната, п-толуолсульфоната, (+)-камфорсульфоната, ацетата, бензоата, цитрата, гемифумарата, фумарата, гемималеата, малеата, гемисукцината, сукцината, геми-L-тартрата, L-тартрата, геми-D-тартрата, D-тартрата, L-лактата, (R)-(-)манделата, гиппурата, гемифталата, фталата и гемитерефталата. Из этих тридцати возможных солей только четыре могли быть получены как кристаллические твердые вещества, а именно: гемисульфат, гидрохлорид, гидробромид и бензосульфонат; остальные были получены как некристаллические/низко или нерезко плавящиеся/липкие твердые вещества, камеди, стекла, пены, смолы или масла. Более того, из четырех кристаллических солей бензосульфонат оказался имеющим недостаточно высокую температуру плавления 74-75oC. Только гемисульфатная, гидрохлоридная и гидробромидная соли были подвергнуты более детальным исследованиям. Гемисульфатная соль Первоначально выделенная гемисульфатная соль (т.пл. 145-147oC), обозначенная как бета-форма, не показала четкой эндотермы единого плавления при исследовании дифференциальной сканирующей калориметрией (ДСК), но дала комплексную линию, показательную для полиморфного перехода. Действительно, эта бета-форма очень гидроскопична при относительных влажностях (ОВ) выше 50%, и при определенных условиях впитывание воды может вызвать полиморфное превращение в альтернативную форму, обозначенную как альфа-форма, с т.пл. 185oC или даже разложение. Более того, бета-форма изменяет цвет при сжатии и вызывает образование пленки на пуансоне при таблетировании и, таким образом, по разным причинам ее физико-химические свойства оказываются непригодными для разработки твердых лекарственных форм. Хотя альфа-форма гемисульфатной соли не проявляет нестабильности твердого состояния, связанной с впитыванием воды, однако, она исключительно гигроскопична и поэтому также непригодна для создания новых материалов вследствие трудностей, вызванных изменениями свойств текучести, и нестабильностью лекарственной формы, такие изменения, среди прочего, препятствуют точному установлению активности лекарства. Гидрохлоридная соль В зависимости от растворителя, используемого как реакционная среда и для кристаллизации, может быть получена любая из двух форм гидрохлоридной соли. Первая из них, которая была выделена и охарактеризована, обозначенная как бета-форма с т.пл. 125-129oC (широкая эндотерма при 135oC при скорости сканирования 20oC/мин при ДСК, но не выявлено эндотерм дегидрации), имела, как было обнаружено Karl Fisher титрометрическим анализом (КФТА), содержание воды 4,42% (1,08 моль). Однако, хотя исследование гигроскопичности показало, что бета-форма не проявляет нестабильности твердого состояния, она была исключена из дальнейшей работы, из-за ее поведения при изучении сжатия, при котором наблюдались плавление и прилипание диска к пуансонам, что усиливает потребность в более высоко плавящемся твердом веществе. Альтернативная гидрохлоридная соль, обозначенная как альфа-форма, показала главную четкую эндотерму при 165oC при ДСК (скорости сканирования 20oC/мин). Определение профиля ее гигроскопичности показало, что после семи дней при температуре (T) 40oC и ОВ 75%, в отличие от бета-формы, значительное количество воды было впитано. Обнаружено, что такое поглощение воды связано с изменениями кривой ДСК, которые показывают, что по крайней мере в этих условиях влажности, безводная альфа-форма превращается в гидратированную бета-форму. Таким образом, фармацевтическая переработка альфа-формы также ограничена из-за неадекватной физической устойчивости. Гидробромидная соль Гидробромидная соль также может быть выделена в одной из двух форм в зависимости от условий ее получения. Обнаружено, что форма с более низкой температурой плавления, обозначенная как бета-форма, не может быть выбрана для разработки твердой лекарственной формы, потому что, когда предпринимаются попытки улучшить ее качество, она подвергается полиморфному превращению в форму с более высокой температурой плавления, обозначенную как альфа-форма. Однако, напротив, обнаружено, что новая альфа-форма гидробромидной соли формулы (I) является уникальной, благодаря неожиданному сочетанию свойств, необходимых для осуществления эффективной разработки твердых лекарственных форм, а именно: кристалличностью, достаточно высокой т.пл., отсутствием гигроскопичности, устойчивостью в твердом состоянии, прессуемостью и отсутствием полиморфного превращения, наряду с удовлетворительной растворимостью и профилями скорости растворения. Настоящее изобретение относится к кристаллической полиморфной альфа-форме гидробромидной соли формулы (I), инфракрасный (ИК) спектр которой как пасты в нуджоле (очищенном парафиновом масле) показывает значительные полосы поглощения при  = 3371, 3293, 2713, 2524, 1419, 1343, 1307, 1264, 1151, 1086, 1020, 1008, 999, 922, 805, 758, 740, 728, 689, 672, 652, 640, 598, 581, 573, 531, 498, 465, 457, 443, 428, 422, 414 и 399 см-1.
Альфа-форма характеризуется также порошковой рентгенограммой (дебаеграммой), полученной с использованием излучения меди, отфильтрованного графитовым монохроматором (лямбда = 0,15405 нм), которая показывает главные пики при 9,7, 10,7, 15,9, 16,5, 17,8, 18,3, 19,3, 19,8, 20,1, 21,2, 24,4, 25,5, 25,8, 26,7, 27,6 и 29,4 градуса угла 2 = 3371, 3293, 2713, 2524, 1419, 1343, 1307, 1264, 1151, 1086, 1020, 1008, 999, 922, 805, 758, 740, 728, 689, 672, 652, 640, 598, 581, 573, 531, 498, 465, 457, 443, 428, 422, 414 и 399 см-1.
Альфа-форма характеризуется также порошковой рентгенограммой (дебаеграммой), полученной с использованием излучения меди, отфильтрованного графитовым монохроматором (лямбда = 0,15405 нм), которая показывает главные пики при 9,7, 10,7, 15,9, 16,5, 17,8, 18,3, 19,3, 19,8, 20,1, 21,2, 24,4, 25,5, 25,8, 26,7, 27,6 и 29,4 градуса угла 2 . .Альфа-форма характеризуется также кривой дифференциальной сканирующей калориметрии (ДСК), которая показывает четкую эндотерму при 176,5oC при скорости сканирования 20oC/мин. Изобретение также обеспечивает кристаллическую полиморфную бета-форму гидробромидной соли формулы (I), которая может быть использована как промежуточное вещество при получении альфа-формы. Ее ИК спектр как пасты в нуджоле показывает значительные полосы поглощения при  = 3239, 2672, 2656, 2632, 1409, 1366, 1351, 1334, 1303, 1293, 1152, 1138, 1122, 1098, 1086, 791, 771, 746, 688, 634, 557, 528, 484, 476, 469, 463, 455, 432, 424, 413 и 401 см-1.
Бета-форма далее характеризуется порошковой рентгенограммой, полученной с использованием излучения меди, отфильтрованного графитовым монохроматором (лямбда = 0,15405 нм), которая показывает главные пики при 11,0, 17,2, 19,2, 20,1, 21,6, 22,6, 23,6 и 24,8 градуса угла 2 = 3239, 2672, 2656, 2632, 1409, 1366, 1351, 1334, 1303, 1293, 1152, 1138, 1122, 1098, 1086, 791, 771, 746, 688, 634, 557, 528, 484, 476, 469, 463, 455, 432, 424, 413 и 401 см-1.
Бета-форма далее характеризуется порошковой рентгенограммой, полученной с использованием излучения меди, отфильтрованного графитовым монохроматором (лямбда = 0,15405 нм), которая показывает главные пики при 11,0, 17,2, 19,2, 20,1, 21,6, 22,6, 23,6 и 24,8 градуса угла 2 . .Кроме того, бета-форма характеризуется кривой ДСК, которая показывает резкую эндотерму при 154,8oC и скорости сканирования 20oC/мин. Изобретение также относится к способам получения альфа-формы соединения формулы (I), как проиллюстрировано далее. (А) Обработка раствора 3-(N-метил-2(R)-пирролидинилметил)-5-(2- фенилсульфонилэтил)-1H-индола в подходящем растворителе, предпочтительно в ацетоне, при комнатной температуре водным раствором бромистоводородной кислоты с последующей кристаллизацией выделенного сырого масла из подходящего растворителя, предпочтительно 2-пропанола, дает альфа-форму требуемой гидробромидной соли. (Б) Обработка раствора 3-(N-метил-2(R)-пирролидинилметил)-5-(2- фенилсульфонилэтил)-1H-индола в подходящем растворителе, предпочтительно ацетоне, либо в простом эфирном растворителе, таком как тетрагидрофуран или 1,2-диметоксиэтан, более предпочтительно 1,2-диметоксиэтан, при температуре от 0 до 10oC водным раствором бромистоводородной кислоты дает бета-форму требуемой гидробромидной соли. Кристаллизация бета-формы из подходящего растворителя, предпочтительно водного ацетона, с последующим суспендированием полученной смеси дает желаемую альфа-форму. (В) Обработка раствора 3-(N-метил-2(R)-пирролидинилметил)-5-(2- фенилсульфонилэтил)-1H-индола в подходящем растворителе, предпочтительно ацетоне, при температуре от 0 до 5oC водным раствором бромистоводородной кислоты, а затем суспендирование реакционной смеси, возможно, с последующим нагреванием с возвращением флегмы, охлаждением и следующим суспендированием обеспечивает требуемую альфа-форму. Как было упомянуто ранее, WO-A-92/06973 описывает 3-(N-метил-2(R)-пирролидинилметил)-5-(2-фенилсульфонилэтил)-1H-индол и его фармацевтически приемлемые соли для лечения мигрени и других расстройств (указано в виде ссылки). Настоящее изобретение также относится к фармацевтическим композициям, содержащим альфа-форму его гидробромидной соли, применениям альфа-формы как лекарственного средства и для получения лекарственного средства для лечения мигрени и других расстройств, способу лечения аьфа-формой млекопитающего, страдающего мигренью или каким-либо из других указанных расстройств. Оценка in vitro периферической агонистической активности альфа-формы по отношению к 5-HT1 рецептору может быть проведена тестированием того, до какой степени она имитирует суматриптан при сокращении изолированной полоски подкожной вены ноги собаки (P. P.A. Humprey et al., Brit. J. Pharmacol., 1988, 94, 1123). Этот эффект может быть блокирован метиотепином, известным 5-HT антагонистом. Известно, что суматриптан полезен при лечении мигрени и вызывает избирательное повышение каротидного сосудистого сопротивления у анестезированной собаки и последующее снижение аротидного артериального потока крови. Предполагается (W. Feniuk et al., Brit. J. Pharmacol., 1989, 96, 83), что это является основанием для его эффективности. Центральная 5-HT1-агонистическая активность альфа-формы может быть измерена in vitro анализами связывания рецептора, как описано для 5-HT1A-рецептора, с использованием крысиной коры головного мозга, как источника рецептора, и [3H]8-OH-DPAT, как радиолиганда (D. Hoyer et al., Europ. J. Pharmacol., 1985, 118, 13), и, как описано для 5-HT1D-рецептора, с использованием бычьего хвоста, как источника рецептора, и [3H]5-HT, как радиолиганда (R.E. Heuring and s. J. Peroutka, J. Neuroscience, 1987, 7, 894). В терапии альфа-форма гидробромидной соли формулы (I) может вводиться как таковая, но в основном лучше вводить ее в смеси с фармацевтически приемлемыми наполнителями, включая вещества, улучшающие скольжение, диспергаторы и смазки, которые выбирают, принимая во внимание способ введения и обычную фармацевтическую практику. В частности, ее можно вводить орально в форме таблеток, драже или пастилок, содержащих такие наполнители, как крахмал или лактоза, или в капсулах, ячейках или имплантатах как одну, так и в смеси с наполнителями. За щеку или под язык она может быть введена в форме таблеток, драже или пастилок, которые могут быть приготовлены обычным способом. Для введения пациентам через рот, за щеку или под язык суточная доза альфа-формы соли формулы (I) должна быть от 0,01 мг до 20 мг/кг (в одной или нескольких дозах). Такие таблетки или капсулы должны содержать от 0,5 мг до 0,5 г активного соединения для введения один раз, два или более раз за назначенное время. Врач в каждом случае должен определять полезную дозу, которая наиболее подходит для каждого пациента и которая может изменяться с учетом возраста, массы и реакции этого пациента. Вышеуказанные дозировки являются примерными для усредненного случая; могут быть, конечно, индивидуальные случаи, когда оправданы более низкие или более высокие дозировки. Таким образом, изобретение предоставляет фармацевтический препарат, содержащий альфа-форму соединения формулы (I) вместе с фармацевтически приемлемым разбавителем или носителем, а также ее применение в качестве лекарственного средства. Кроме того, изобретение включает в себя применение альфа-формы соединения формулы (I) или ее фармацевтической композиции как для производства лекарственного средства для лечебного или профилактического воздействия на мигрень или связанное с ней состояние, такое как “гистаминовая” головная боль, хроническая пароксизмальная гемикрания или головная боль, связанная с сосудистым нарушением, или депрессия, беспокойное состояние, нарушение питания, ожирение, лекарственная зависимость, гипертензия или рвота, так и для производства лекарственного средства для лечения или профилактики медицинского состояния, для которого показаны избирательный агонист 5-HT1-рецепторов. С другой стороны, изобретение обеспечивает как способ лечения или профилактики человека от мигрени или связанного с ней состояния, такого как “гистаминовая” головная боль, хроническая пароксизмальная гемикрания или головная боль, связанная с сосудистым нарушением, или депрессия, беспокойное состояние, нарушение питания, ожирение, лекарственная зависимость, гипертензия или рвота, так и способ лечения или профилактики у человека такого медицинского состояния, для которого показан избирательный агонист 5-HT1-рецепторов, эти способы предусматривают введение указанному человеку эффективного количества альфа-формы соединения формулы (I) или ее фармацевтической композиции. Получение альфа-формы гидробромидной соли формулы (I) и ее фармацевтических композиций иллюстрируется следующими примерами. Комнатная температура обозначает 20-25oC, и т.пл. обозначает температуру плавления. ИК обозначает инфракрасный, ПРД – порошковую рентгеновскую диффракцию, ДСК обозначает дифференциальную сканирующую калориметрию, T обозначает температуру, ОВ обозначает относительную влажность, ВЭЖХ обозначает высокоэффективную жидкостную хроматографию, КФТА обозначает Karl Fisher титрометрический анализ. Пример 1. 3-(N-Метил-2(R)-пирролидинилметил)-5-(2- фенилсульфонилэтил)-1H-индол гидробромид, альфа-форма. 49%-ную масс/масс бромистоводородную кислоту (432 мг, 0,3 мл, 2,6 ммоля) добавляют к перемешиваемому раствору 3-(N-метил-2(R)-пирролидинилметил)-5-(2-фенилсульфонилэтил)-1H-индола (1,0 г, 2,6 ммоля) в ацетоне (10 мл) при комнатной температуре. Через 15 мин реакционную смесь испаряют при пониженном давлении с получением желтой жидкости; остаточную воду азеотропно удаляют с использованием 2-пропанола. Полученное мутное желтоватое масло (1,55 г) титруют с простым эфиром, а затем растворяют в горячем 2-пропаноле (25 мл); этот раствор при охлаждении дает названное соединение (1,13 г) как бледно-желтое кристаллическое твердое вещество после фильтрования, промывания 2-пропанолом и высушивания в вакууме, которое имеет т.пл. 165-170oC. Определено: C 56,67; H 5,78; N 5,82. C22H28N2O2S; HBr требует C 57,02; H 5,87; N 6,04%. Пример 2. 3-(N-Метил-2(R)-пирролидинилметил)-5-(2- фенилсульфонилэтил)-1H-индол гидробромид, альфа-форма. 3-(N-Метил-2(R)-пирролидинилметил)-5-(2-фенилсульфонилэтил)-1H-индол гидробромид, бета-форма. 49%-ную масс/масс бромистоводородную кислоту (27,86 мл, 0,25 ммоль) добавляют в течение 1 часа к перемешиваемому раствору 3-(N-Метил-2(R)-пирролидинилметил)-5-(2-фенилсульфонилэтил)-1H-индола (92,86 г, 0,24 моль) в 1,2-диметоксиэтане (2,08 л) при около 5oC. Охлаждающую ванну удаляют, а полученной суспензии позволяют гранулироваться при перемешивании при комнатной температуре в течение 18 часов. Фильтрование, с последующим промыванием 1,2-диметоксиэтаном и высушиванием позволяет получить требуемый продукт (97,9 г) как твердое вещество с т.пл. 150-151oC. Определено: C 56,77; H 5,87; N 5,85. C22H26N2O2S; HBr требует C 57,02; H 5,87; N 6,04%. (б) Перемешиваемую смесь предыдущего продукта (20 г), ацетона (140 мл) и воды (6 мл) кипятят с обратным холодильником до полного растворения бета-формы. Раствору позволяют остыть до комнатной температуры, перемешивают в течение 1 часа, а затем к полученной суспензии добавляют ацетон (460 мл). После 1 часа суспензию охлаждают до 0-5oC и перемешивание продолжают в течение до 18 часов. Бесцветное кристаллическое твердое вещество собирают фильтрованием, промывают ацетоном и сушат в вакууме до получения названного соединения (13,22 г), которое идентично соединению из примера 1. Пример 3. 3-(N-Метил-2(R)-пирролидинилметил)-5-(2- фенилсульфонилэтил)-1H-индол гидробромид, альфа-форма. 62%-ную масс/масс бромистоводородную кислоту (1,706 г, 13,07 ммоль) добавляют в течение 1 часа к перемешиваемому раствору 3-(N-метил-2(R)-пирролидинилметил)-5-(2-фенилсульфонилэтил)-1H-индола (5,0 г, 13,07 ммоль) в ацетоне (112 мл) при 0-5oC. После суспендирования реакционной смеси при 0-5oC в течение 3 часов осуществляют ее нагревание с обратным холодильником в течение 2 часов с последующим охлаждением до 0-5oC и еще суспендируют в течение 1 часа при этой температуре. Фильтрование с последующим промыванием ацетоном и высушиванием в вакууме позволяет получить указанное соединение (5,18 г), которое идентично соединению из примера 1. В примерах 4-6 “активный ингредиент” обозначает альфа-форму гидробромидной соли. Пример 4. Таблетки для орального введения. А. Непосредственное прессование: – мг/таблетка Активный ингредиент – 12,12 Микрокристаллическая целлюлоза, Ph Eur – 25,00 Лактоза, Ph Eur – 60,88 Натриевая соль кроскармеллозы, NF – 1,00 Стеарат магния, Ph Eur – 6,00 – для 50 г смеси, г: Активный ингредиент – 6,06 Микрокристаллическая целлюлоза, Ph Eur – 12,50 Лактоза, Ph Eur – 30,44 Натриевая соль кроскармеллозы, NF – 0,50 Стеарат магния, Ph Eur – 0,50 Активный ингредиент просеивают и смешивают с другими компонентами. Полученную смесь прессуют в таблетки, используя вращательный таблеточный пресс (Manesty Betapress), снабженный 6 мм нормально вогнутыми пуансонами. Полученные таблетки могут быть покрыты пленкой из подходящего пленкообразующего материала. Б. Влажное гранулирование: – мг/таблетка Активный ингредиент – 1,21 Лактоза, Ph Eur – 56,03 Кукурузный крахмал, Ph Eur – 18,68 Поливинилпирролидон (2% мас./об. р-р) – 1,60 Коллоидальный безводный диоксид кремния, Ph Eur – 0,08 Натриевая соль кроскармеллозы, NF – 1,60 Стеарат магния, Ph Eur – 0,80 – для 50 г смеси, г Активный ингредиент – 0,76 Лактоза, Ph Eur – 35,02 Кукурузный крахмал, Ph Eur – 11,67 Поливинилпирролидон (2% мас./об. р-р) – 1,00 Коллоидальный безводный диоксид кремния, Ph Eur – 0,05 Натриевая соль кроскармеллозы, NF – 1,00 Стеарат магния, Ph Eur – 0,50 Поливинилпирролидон растворяют в очищенной воде до подходящей концентрации. Активный ингредиент просеивают и смешивают со всеми остальными компонентами, за исключением стеарата магния. Подходящие объемы раствора поливинилпирролидона добавляют и порошки гранулируют. После высушивания гранулы просеивают и смешивают со стеаратом магния. Затем гранулы прессуют в таблетки, используя пуансоны подходящего диаметра. Таблетки с другими прочностями могут быть приготовлены путем изменения отношения активного ингредиента к наполнителям или прессующей нагрузки и использования соответствующих штампов. Пример 5. Капсулы – мг/капсула: Активный ингредиент – 18,18 Лактоза, Ph Eur – 208,89 Кукурузный крахмал, Ph Eur – 69,63 Коллоидальный безводный диоксид кремния, Ph Eur – 0,30 Стеарат магния, Ph Eur – 3,00 Общая масса – 300,00 Активный ингредиент просеивают и смешивают с остальными компонентами. Смесь набивают в твердые желатиновые капсулы размером N 2 с помощью подходящего оборудования. Другие дозы могут быть приготовлены изменением массы набивки и, если необходимо, соответствующим изменением размера капсулы. Пример 6. Подъязычные таблетки: – мг/таблетка Активный ингредиент – 1,2 Лактоза, Ph Eur – 25,0 Кукурузный крахмал, Ph Eur – 25,0 Маннит, Ph Eur – 25,0 Натриевая соль кроскармеллозы, NF – 3,0 Стеарат магния, Ph Eur – 0,8 – для 50 г смеси, г: Активный ингредиент – 0,750 Лактоза, Ph Eur – 15,625 Кукурузный крахмал, Ph Eur – 15,625 Маннит, Ph Eur – 15,625 Натриевая соль кроскармеллозы, NF – 1,875 Стеарат магния, Ph Eur – 0,500 Активный ингредиент просеивают через подходящее сито, смешивают с наполнителями и прессуют, используя подходящие штампы. Таблетки других прочностей могут быть получены путем изменения отношения активных ингредиентов к наполнителям или прессующей нагрузки и использованием соответствующих штампов. Характеристика альфа- и бета-форм гидробромидной соли ИК, ПРД и ДСК анализом. (а) ИК-спектроскопия ИК-спектр определен при волновом числе () в пределах 4000-400 см-1 как паст в нуджоле (очищенном парафиновом масле) с помощью Nicolet 800 FT-IR спектрометра и представлен фиг. 1A и 1B. Что касается идентификации волнового числа значительных полос поглощения, см. выше. (б) ПРД Порошковые рентгенограммы получают с использованием Siemens D500 дифрактометра, который работает при 40 кВ/30 мА, и с использованием излучения меди, отфильтрованного графитовым монохроматором (лямбда = 0,15405 нм), и сцинтилляционного счетчика-детектора. Для каждой формы интенсивность пучка как функцию угла 2 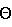 регистрируют в пределах 2-45o 2 регистрируют в пределах 2-45o 2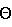 , используя шаговый сканирующий режим счета за шесть секунд при шаговых интервалах 0,003o 2 , используя шаговый сканирующий режим счета за шесть секунд при шаговых интервалах 0,003o 2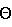 . Что касается идентификации главных пиков (градусы 2 . Что касается идентификации главных пиков (градусы 2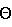 ), наблюдаемых на каждой из рентгенограмм, представленных на фиг. 2A и 2B, см выше.
(в) ДСК ), наблюдаемых на каждой из рентгенограмм, представленных на фиг. 2A и 2B, см выше.
(в) ДСКОбразцы (около 5 мг) каждой формы анализируют с помощью Perkin Elmer 7 Series thermal analyser при скорости сканирования 20oC в минуту. Что касается идентификации соответствующих нэтдотерм, показанных на типичных ДСК термограммах фиг. 3A и 3B, см. выше. Исследования гигроскопичности/устойчивости твердого состояния. Образцы (около 10 мг) просеивают (250 мкм) и затем хранят при каждом из следующих условий температуры (T) и относительной влажности (ОВ) до 4 недель: 30oC при 75 и 90% ОВ и 40oC при 75 и 90% ОВ, требуемые величины влажности обеспечивают, используя подходящий насыщенный солевой раствор в эксикаторе. Измерения изменений содержания воды проводят весовым анализом с использованием микровесов и Karl Fisher титрометрическим анализом (КФТА) и оценку химической и физической устойчивости проводят высокоэффективной жидкостной хроматографией (ВЭЖХ) и ДСК. ВЭЖХ анализы проводят на LDC изократной системе при следующих условиях: колонка – Novopak C18, 5 мкм, 15 см; подвижная фаза – pH 6,0, 60:40 об/об, 0,02 М KH2PO4 (0,5% триэтиламин):метанол; определение – УФ (254 нм); скорость потока – 1,0 мл/мин; вводимый объем – 20 мл; образец 0,1 мг/мл в подвижной фазе. КФТА проводят с использованием гигрометра фирмы Mitsubishi и около 10 мг каждого образца. Таблица 1 показывает результаты по гигроскопичности для альфа-формы гидробромидной соли и альфа- и бета-форм гемисульфатной соли, выраженные как изменения влаги, определенные по изменению массы в процентах при различных T (oC) и ОВ (%). Как видно из таблицы 1, альфа-форма гидробромидной соли имеет относительную стабильность массы в течение всего курса исследования с небольшой потерей влаги при низкой (11%) ОВ, которую наблюдают как при 30oС, так и при 40oC, а эти результаты подтверждаются результатами, получаемыми при КФТА анализе. Особо заслуживает внимания то, что при ОВ 75% в ней отмечают небольшое изменение содержания влаги по сравнению со значительным впитыванием, наблюдаемым при 40oC, характерным для бета-формы и, особенно, альфа-формы гемисульфатной соли. Более того, впитывание воды бета-формой гемисульфатной соли сопровождается изменением цвета образца от кремового до желтого; хотя альфа-форма гемисульфатной соли адсорбирует воду даже более быстро, чем бета-форма, никакого сопутствующего изменения цвета не наблюдается. Как упоминалось ранее, гигроскопичность бета-формы гемисульфатной соли приводит к полиморфному превращению в альфа-форму и, окончательно, к разложению. Для образцов альфа-формы гидробромидной соли при T = 40oC/ОВ = 90% не выявлено никакого изменения кривой ДСК, в то же время ВЭЖХ анализ подтверждает их устойчивость при всех экспериментальных условиях. Таблица 2 показывает результаты по гигроскопичности для альфа- и бета-форм гидрохлоридной соли, выраженные как изменения влаги, определенные по изменению массы в процентах при T = 40oC/ОВ = 75% ОВ (%). Бета-форма признана негигроскопичной как на основании результатов, представленных в таблице 2, так и близко сравнимых результатов, полученных при КФТА анализе в течение 4 недель, когда нестабильности твердого состояния не было обнаружено. Хотя при этом исследовании альфа-форму инкубировали только в течение 1 недели, очевидно, что она поглощает значительное количество влаги даже за это короткое время, и это поглощение воды связано с изменениями кривой ДСК, что выявляет превращение альфа-формы в бета-форму в таких условиях. Исследование прессования. Образцы (200 мг) прессуют на ступенчатом IR прессе (Graseby Specac Model 15.011) при 5 тоннах в течение 1 минуты с использованием комплекта из 13 мм пуансона и формы, затем оценивают изменение цвета и случай плавления. Дальнейший анализ (ДСК и ВЭЖХ) проводят после растирания уплотненного образца в ступке с пестиком. Для альфа-формы гидробромидной соли никаких изменений на термограмме ни в отношении температуры плавления, ни энтальпии плавления, ни после прессования, ни после растирания не наблюдается. Кроме того, не было случая изменения внешнего вида образца или образования пленки на пуансоне при уплотнении. Как упоминалось выше, бета-форма гемисульфатной соли изменяет цвет при прессовании, а также вызывает образование пленки на пуансоне при уплотнении, в то время как бета-форма гидрохлоридной соли плавится и вызывает прилипание диска к пуансонам при прессовании, такое поведение объясняется значительно более низкой т. пл. последней. Альфа-форма гидрохлоридной соли не плавится при уплотнении. Полиморфное превращение ДСК используют для определения полиморфных превращений бета-форм гидробромидной и гемисульфатной солей в их соответствующие альфа-формы, а также превращение альфа-формы гидрохлоридной формы в ее бета-форму, которое, как полагают, является ангидрат-гидрат переходом. Никаких полиморфных превращений альфа-формы гидробромидной соли не наблюдалось в условиях исследования. Формула изобретения
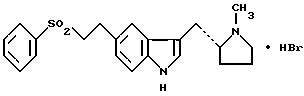 характеризующаяся тем, что в нуджоле имеет инфракрасный спектр, который показывает значительные полосы поглощения при  = 3371, 3293, 2713, 2524, 1419, 1343, 1307, 1264, 1151, 1086, 1020, 1008, 999, 922, 900, 805, 758, 740, 728, 689, 672, 652, 640, 598, 581, 573, 531, 498, 465, 457, 443, 428, 422, 414 и 399 см-1.
2. Соединение по п. 1, которое дополнительно характеризуется тем, что порошковая рентгенограмма, полученная с использованием излучения меди, отфильтрованного графитовым монохроматором ( = 3371, 3293, 2713, 2524, 1419, 1343, 1307, 1264, 1151, 1086, 1020, 1008, 999, 922, 900, 805, 758, 740, 728, 689, 672, 652, 640, 598, 581, 573, 531, 498, 465, 457, 443, 428, 422, 414 и 399 см-1.
2. Соединение по п. 1, которое дополнительно характеризуется тем, что порошковая рентгенограмма, полученная с использованием излучения меди, отфильтрованного графитовым монохроматором ( = 0,15405 нм), показывает главные пики при 9,7, 10,7, 15,9, 16,5, 17,8, 18,3, 19,3, 19,8, 20,1, 21,2, 24,4, 25,5, 25,8, 26,7, 27,6, и 29,4 градусов 2 = 0,15405 нм), показывает главные пики при 9,7, 10,7, 15,9, 16,5, 17,8, 18,3, 19,3, 19,8, 20,1, 21,2, 24,4, 25,5, 25,8, 26,7, 27,6, и 29,4 градусов 2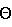 . .3. Кристаллическая гидробромидная соль в бета-полиморфной форме 3-(N-метил-2(R)-пирролидинилметил)-5-(2-фенил-сульфонилэтил)-1H-индола формулы I 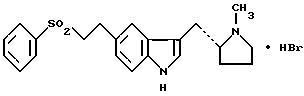 характеризующаяся тем, что в виде пасты в нуждоле имеет инфракрасный спектр, который показывает значительные полосы поглощения при  = 3239, 2672, 2656, 2632, 1409, 1366, 1351, 1334, 1303, 1293, 1152, 1138, 1122, 1098, 1086, 791, 771, 746, 688, 634, 557, 528, 484, 476, 469, 463, 455, 432, 424, 413 и 401 см-1.
4. Соединение по п. 3, которое дополнительно характеризуется тем, что порошковая рентгенограмма, полученная с использованием излучения меди, отфильтрованного графитовым монохроматором ( = 3239, 2672, 2656, 2632, 1409, 1366, 1351, 1334, 1303, 1293, 1152, 1138, 1122, 1098, 1086, 791, 771, 746, 688, 634, 557, 528, 484, 476, 469, 463, 455, 432, 424, 413 и 401 см-1.
4. Соединение по п. 3, которое дополнительно характеризуется тем, что порошковая рентгенограмма, полученная с использованием излучения меди, отфильтрованного графитовым монохроматором ( = 0,15405 нм), показывает главные пики при 11,0, 17,2, 19,2, 20,1, 21,6, 22,6, 23,6 и 24,8 градусов 2 = 0,15405 нм), показывает главные пики при 11,0, 17,2, 19,2, 20,1, 21,6, 22,6, 23,6 и 24,8 градусов 2 . .5. Соединение по п. 1 или 2 в качестве средства, обладающего избирательной агонистической активностью по отношению к 5-HTI-рецептору. 6. Соединение по п.1 или 2 для получения медикамента для лечебного или профилактического воздействия на состояние, при котором показан избирательный агонист 5-HTI рецепторов. 7. Соединение по п.1 или 2 для получения медикамента для лечебного или профилактического воздействия на состояния, которыми являются мигрень, или “гистаминовая” головная боль, или хроническая пароксизмальная гемикрания, или головная боль, связанная с сосудистым нарушением. 8. Способ получения кристаллической гидробромидной соли в альфа-полиморфной форме формулы I 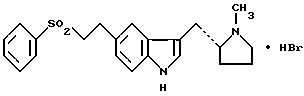 характеризуемой в виде пасты в нуджоле инфракрасным спектром, который показывает значительные полосы поглощения при  = 3371, 3293, 2713, 2524, 1419, 1343, 1307, 1264, 1151, 1086, 1020, 1008, 999, 922, 900, 805, 758, 740, 728, 689, 672, 652, 640, 598, 581, 573, 531, 498, 465, 457, 443, 428, 422, 414 и 399 см-1, = 3371, 3293, 2713, 2524, 1419, 1343, 1307, 1264, 1151, 1086, 1020, 1008, 999, 922, 900, 805, 758, 740, 728, 689, 672, 652, 640, 598, 581, 573, 531, 498, 465, 457, 443, 428, 422, 414 и 399 см-1,отличающийся тем, что осуществляют а) обработку соединения формулы II 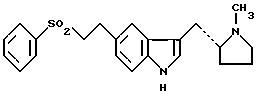 в ацетоне 49%-ным мас./мас. водным раствором бромистого водорода при 20 – 25oC с последующей кристаллизацией выделенного сырого масла из 2-пропанола; б) кристаллизацию полученной бета-полиморфной формы соединения формулы (I), характеризуемой в виде пасты в нуджоле инфракрасным спектром, который показывает значительные полосы поглощения при  = 3239, 2672, 2656, 2632, 1409, 1366, 1351, 1334, 1303, 1293, 1152, 1138, 1122, 1098, 1086, 791, 771, 746, 688, 634, 557, 528, 484, 476, 469, 463, 455, 432, 424, 413 и 401 см-1, из водного ацетона с последующим суспендированием полученной смеси; или в) обработку соединения формулы (II) в ацетоне 62%-ным мас./мас. водным раствором бромистого водорода, при 0 – 5oC, а затем суспендирование реакционной смеси, возможно с последующим нагреванием с обратным холодильником, охлаждением и дальнейшим суспендированием.
9. Способ по п.8, отличающийся тем, что альфа-полиморфная форма соединения формулы (I) также характеризуется порошковой рентгенограммой, полученной с использованием излучения меди, отфильтрованного графитовым монохроматором ( = 3239, 2672, 2656, 2632, 1409, 1366, 1351, 1334, 1303, 1293, 1152, 1138, 1122, 1098, 1086, 791, 771, 746, 688, 634, 557, 528, 484, 476, 469, 463, 455, 432, 424, 413 и 401 см-1, из водного ацетона с последующим суспендированием полученной смеси; или в) обработку соединения формулы (II) в ацетоне 62%-ным мас./мас. водным раствором бромистого водорода, при 0 – 5oC, а затем суспендирование реакционной смеси, возможно с последующим нагреванием с обратным холодильником, охлаждением и дальнейшим суспендированием.
9. Способ по п.8, отличающийся тем, что альфа-полиморфная форма соединения формулы (I) также характеризуется порошковой рентгенограммой, полученной с использованием излучения меди, отфильтрованного графитовым монохроматором ( = 0,15405 нм), которая показывает главные пики при 9,7, 10,7, 15,9, 16,5, 17,8, 18,3, 19,3, 19,8, 20,1, 21,2 24,4, 25,5, 25,8, 26,7, 27,6 и 29,4 градусов 2 = 0,15405 нм), которая показывает главные пики при 9,7, 10,7, 15,9, 16,5, 17,8, 18,3, 19,3, 19,8, 20,1, 21,2 24,4, 25,5, 25,8, 26,7, 27,6 и 29,4 градусов 2 , и бета-полиморфная форма также характеризуется порошковой рентгенограммой, полученной с использованием излучения меди, отфильтрованного графитовым монохроматором ( , и бета-полиморфная форма также характеризуется порошковой рентгенограммой, полученной с использованием излучения меди, отфильтрованного графитовым монохроматором ( = 0,15405 нм), которая показывает главные пики при 11,0, 17,2, 19,2, 20,1, 21,6, 22,6, 23,6 и 24,8 градусов 2 = 0,15405 нм), которая показывает главные пики при 11,0, 17,2, 19,2, 20,1, 21,6, 22,6, 23,6 и 24,8 градусов 2 . .10. Способ получения кристаллической бета-полиморфной формы соединения формулы I по п.3 или 4, отличающийся тем, что раствор соединения формулы II в 1,2-диметоксиэтане обрабатывают 49%-ным мас./мас. водным раствором бромистого водорода при 0-10oC. 11. Фармацевтическая композиция, обладающая избирательной агонистической активностью по отношению к 5-HTI-рецептору, содержащая соединение по п.1 или 2 вместе с фармацевтически приемлемым разбавителем или носителем. 12. Фармацевтическая композиция по п.11 в форме твердой лекарственной формы. 13. Способ лечения или предупреждения состояния, при котором показан избирательный агонист 5-HTI-рецептора, путем введения эффективного количества соединения по п.1 или 2 или фармацевтической композиции по п.11 или 12. 14. Способ по п.13, отличающийся тем, что состоянием, при котором показан избирательный агонист 5-HTI-рецептора, является мигрень, “гистаминовая” головная боль, пароксизмальная гемикрания или головная боль, связанная с сосудистым нарушением. РИСУНКИ
|
||||||||||||||||||||||||||
