Патент на изобретение №2159238
|
||||||||||||||||||||||||||
(54) БЕНЗОФУРАНЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ
(57) Реферат: Описываются новые бензофураны формулы I, где R1 обозначает NH2, 1-пиперазинил или 4-R3-пиперазинил; R2 обозначает Н; R3 обозначает бензил или само по себе известную, защитную для аминной функции группу; Х обозначает СООН, СООА или CONR4R5; R4 и R5 каждый независимо друг от друга обозначают Н; А обозначает алкил с 1-4 С-атомами; а также их соли, пригодные в качестве промежуточных продуктов при синтезе лекарственных средств и обладающие свойствами воздействия на центральную нервную систему. Описывается также способ их получения. 2 с. и 2 з.п.ф-лы. 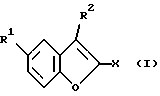
Изобретение относится к бензофуранам формулы I 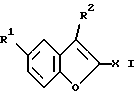 где R1 обозначает NH2, 1-пиперазинил или 4-R3-пиперазинил; R2 – обозначает H, Cl, Br, OH или OA; R3 обозначает бензил или само по себе известную защитную для аминной функции группу; X обозначает CN, COON, COOA, COOPh, COOCH2Ph, COOPy, CONR4R5 или CO-Гет; R4 и R5 каждый независимо друг от друга обозначает H, A или бензил; A обозначает алкил с 1-4 C-атомами; Ph обозначает фенил; Гет обозначает имидазол-1-ил, триазол-1-ил или тетразол-1-ил; и Py обозначает пиридил; а также к их солям. Подобные соединения известны из патента ФРГ 4333254. В основу изобретения положена задача получения новых соединений, которые, в частности, можно применять в качестве промежуточных продуктов при синтезе лекарственных средств, однако также они могут найти применение непосредственно для приготовления лекарственных средств. Найдено, что соединения формулы I и их соли представляют собой важные промежуточные продукты для приготовления лекарственных средств и одновременно обладают фармакологическими свойствами. Так, они обладают, например, свойствами воздействия на центральную нервную систему. Предметом изобретения являются производные бензофурана формулы I и их соли. Выше- и нижеуказанные остатки R1, R2, R3, R4, R5, R6, X, X1, A, Ph, Гет и Py имеют указанные для формул I – VI значения, если не указано ничего другого. В вышеуказанных формулах A содержит 1-4, предпочтительно 1, 2 или 3 C-атома. Предпочтительно A обозначает метил или этил, далее, пропил, изопропил, далее также бутил, изобутил, втор-бутил или трет-бутил. Остаток Ph обозначает фенил. Остаток Гет обозначает замещенный в положении 1 имидазол, триазол или тетразол. Остаток Py предпочтительно обозначает пиридин-2-ильный остаток, далее, также пиридин-4-ильный остаток. Остаток X обозначает CN, COOH, COOA, COOPh, COOCH2Ph, COOPy, CONR4R5 или CO-Гет. Остаток R1 обозначает NH2, 1-пиперазинил или замещенный в положении 4 с помощью радикала R3 1-пиперазинильный остаток. Остаток R2 обозначает H, Cl, Br, OH или OA. Остаток R3 обозначает бензил, предпочтительно, однако, само по себе известную, защитную для аминной функции группу. Выражение “защитная для аминной функции группа” общеизвестно и относится к группам, которые пригодны для защиты (блокирования) аминогруппы от химических взаимодействий, которые, однако, легко удаляются, после того как в других местах молекулы прошла желательная химическая реакция. Типичными для таких групп являются, в частности, незамещенные ацильные, арильные, аралкоксиметильные или аралкильные группы. Так как защитные для аминной функции группы после желательной реакции (или последовательности реакций) удаляют, их род и величина, впрочем, не критические; однако предпочтительны группы с 1-20, в частности с 1-8, C-атомами. Выражение “ациальная группа” в связи с настоящим способом и имеющимися соединениями нужно понимать в самом широком смысле. Оно охватывает производимые от алифатических, аралифатических, ароматических или гетероциклических карбоновых кислот или сульфокислот ацильные группы, а также в частности алкоксикарбонильные группы. Примерами такого рода ацильных групп являются алканоил, как ацетил, пропионил, бутирил; аралканоил, как фенилацетил; ароил, как бензоил или толуил; арилоксиалканоил, как феноксиацетил; алкоксикарбонил, как метоксикарбонил, этоксикарбонил, 2,2,2-трихлорэтоксикарбонил, BOC (трет-бутоксикарбонил), 2-йод-этоксикарбонил; аралкилоксикарбонил, как CBZ (карбобензоксикарбонил, также называемый “Z”), 4-метоксибензилоксикарбонил, FMOC (9-флуоренилметоксикарбонил); арилсульфонил, как Mtr (4-метокси-2,3,6-триметилфенилсульфонил). Предпочтительными защитными для аминной функции группами являются BOC и Mtr, далее, CBZ или FMOC. Соединения формулы (I) могут иметь один или несколько хиральных центров и поэтому могут существовать в различных стереоизомерных формах. Формула I охватывает все эти формы. Предметом изобретения, далее, является способ получения бензофуранов формулы I, а также их солей, отличающийся тем, что соединение, которое соответствует формуле I, где R1 обозначает нитрогруппу, само по себе обычным образом восстанавливают, или соединение, которое соответствует формуле I, где R1 обозначает NH2-группу, вводят во взаимодействие с соединением формулы II R6N(CH2CH2X1)2 где R6 обозначает H или бензил и X1 обозначает Cl, Br, I, OH или реакционноспособную, функционально измененную OH-группу; или соединение, которое соответствует формуле I, где R1 обозначает 1-пиперазинильный остаток, путем введения само по себе известной защитной для аминной функции группы превращают в другое соединение формулы I, в которой R1 обозначает 4-R3-пиперазинильный остаток, где R3 имеет указанное значение, или соединение, которое соответствует формуле I, где X обозначает COOA-группу, в которой A в свою очередь имеет указанное значение, превращают в другое соединение формулы I, в которой X обозначает CONR4R5, где R4 и R5 имеют указанные значения, или соединение, которое соответствует формуле I, где X обозначает COOH-группу, превращают в другое соединение формулы I, в которой X обозначает CO-Гет, где Гет имеет указанное значение, или соединение, которое соответствует формуле I, где R1 обозначает 4-R3-пиперазинильную группу, в которой R3 имеет указанное значение, путем отщепления защитной группы превращают в соединение формулы I, в которой R1 обозначает 1-пиперазинил; и/или основание формулы I путем обработки с помощью кислоты превращают в одну из его солей. Соединения формулы I и также исходные вещества для их получения, впрочем, получают само по себе известными способами, которые описаны в литературе (например, в стандартных работах, как Губен-Вейл, Методы органической химии, изд. Georg-Thiеme, Штутгарт), а именно при реакционных условиях, которые известны и пригодны для указанных превращений (взаимодействий). При этом также можно использовать сами по себе известные, здесь подробнее не упомянутые варианты. Исходные вещества, если желательно, также можно получать in situ, так что их не выделяют из реакционной смеси, а тотчас вводят во взаимодействие далее для получения соединений формулы I. В соединениях формулы II остаток X1 обозначает предпочтительно Cl или Br; однако он может обозначать также I, OH или реакционноспособную измененную OH-группу, как алкилсульфонилоксигруппа с 1-6 C-атомами (предпочтительно метилсульфонилоксигруппа) или арилсульфонилоксигруппа с 6-10 C-атомами (предпочтительно фенильная, п-толилсульфонилокси-, 1- или 2-нафталинсульфонилоксигруппа). В соединениях формулы II остаток R6 обозначает H или бензил. Соединения формулы II отчасти известны, неизвестные соединения можно легко получать аналогично известным соединениям. Взаимодействие соединений формулы II с соединениями формулы I, в которых R1 обозначает NH2, протекает по способам, которые известны из литературы для алкилирования аминов. Можно сплавлять компоненты друг с другом в отсутствие растворителя, в случае необходимости в закрытой трубке или в автоклаве. Однако также можно соединения вводить во взаимодействие в присутствии инертного растворителя. В качестве инертных растворителей пригодны, например, углеводороды, как гексан, петролейный эфир, бензол, толуол или ксилол; хлорированные углеводороды, как трихлорэтилен, 1,2-дихлорэтан, четыреххлористый углерод, хлороформ или дихлорэтан, спирты, как метанол, этанол, изопропанол, н-пропанол, н-бутанол или трет-бутанол; простые эфиры, как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран (ТГФ) или диоксан; простые гликолевые эфиры, как этиленгликольмонометиловый или моноэтиловый простой эфир (метилгликоль или этилгликоль), этиленгликольдиметиловый простой эфир (диглим); кетоны, как ацетон или бутанон; амиды, как ацетамид, диметилацетамид или диметилформамид (ДМФ); нитрилы, как ацетонитрил; сульфоксиды, как диметилсульфоксид (ДМСО), сероуглерод; нитросоединения, как нитрометан или нитробензол; сложные эфиры, как этилацетат; в случае необходимости также смеси указанных растворителей друг с другом или смеси с водой. Может быть благоприятной добавка кислотосвязующего средства, например гидроксида, карбоната или бикарбоната щелочного или щелочно-земельного металла или другой соли слабой кислоты щелочных или щелочно-земельных металлов, предпочтительно калия, натрия или кальция, или добавка органического основания, как триэтиламин, диметиламин, пиридин или хинолин, или избыток аминокомпоненты. Время реакции, в зависимости от применяемых условий, составляет от нескольких минут до 14 дней; температура реакции составляет от 0oC до 150oC, обычно от 20 до 130oC. Превращение соединения формулы I, в которой R1 обозначает нитрогруппу, в соединение формулы I, в которой R1 обозначает аминогруппу, предпочтительно осуществляют с помощью газообразного водорода при катализе с помощью катализатора на основе переходного металла (например, путем гидрирования на никеле Ренея или Pd на угле в инертном растворителе, как метанол или этанол). Превращение соединения формулы I, где R1 обозначает 1-пиперазинильный остаток, в соединение формулы I, в которой R1 обозначает 4-R3-пиперазинильный остаток, осуществляют известными способами, которые описаны в литературе (например, в стандартных работах, как Губен-Вейл, Методы органической химии, изд. Georg-Thieme, Штутгарт), например, для алкилирования или ацилирования аминов, а именно при реакционных условиях, которые известны и пригодны для указанных превращений (взаимодействий). При этом также можно использовать само по себе известные, здесь подробнее не упомянутые варианты. Превращение соединения формулы I, где X обозначает карбоксильную группу, в соединение формулы I, в которой X обозначает COOA, COOPh, COOCH2Ph, COOPy или CO-Гет, осуществляют само по себе известными способами, которые описаны в литературе (например, в стандартных работах, как Губен-Вейл, Методы органической химии, изд. Georg-Thieme, Штутгарт) для такого рода этерификаций до сложных эфиров или амидирований; а именно при реакционных условиях, которые известны и пригодны для указанных превращений (взаимодействий). При этом также можно использовать само по себе известные, здесь подробнее не упомянутые варианты. Превращение соединений формулы I, в которой X обозначает COOA, в соединения формулы I, в которой X обозначает COOH, осуществляют, например, с помощью NaOH или KOH в воде, смеси воды с ТГФ или воды с диоксаном при температурах 0 – 100oC. Превращение соединений формулы I, в которой X обозначает CN, COOH, COOA, COOPh, COOCH2Ph, COOPy или Co-Гет, в соединения формулы I, в которой X обозначает CONR4R5, осуществляют, например, с помощью HCONR4R5 в инертном, как вышеуказанные, растворителе, в случае необходимости при добавке основания. В качестве основания служат, например, алкоголят калия или натрия, как метилат, этилат или трет-бутилат калия или натрия. Отщепление остатка R3 от соединения формулы I осуществляют в зависимости от используемой защитной группы, например, с помощью сильных кислот, целесообразно с помощью ТФК (трифторуксусная кислота) или хлорной кислоты, однако также с помощью других сильных неорганических кислот, как соляная кислота или серная кислота; сильных органических карбоновых кислот, как трихлоруксусная кислота; или сульфокислот, как бензоил- или п-толуолсульфокислота. Присутствие дополнительного инертного растворителя возможно, однако не всегда требуется. В качестве инертных растворителей пригодны предпочтительные органические, например карбоновые кислоты, как уксусная кислота; простые эфиры, как тетрагидрофуран или диоксан; амиды, как диметилформамид; галогенированные углеводороды, как дихлорметан; далее, также спирты, как метанол, этанол или изопропанол, а также вода. Далее, применяют смеси вышеуказанных растворителей. ТФК предпочтительно используют в избытке без добавления другого растворителя; хлорную кислоту предпочтительно используют в виде смеси из уксусной кислоты и 70%-ной хлорной кислоты в соотношении 9:1. Реакционные температуры целесообразно составляют примерно 0 – 50oC, предпочтительно работают при 15 – 30oC. Группу ВОС предпочтительно отщепляют с помощью ТФК в дихлорметане или с помощью примерно 3 – 5 н. соляной кислоты в диоксане при 15 – 30oC. Гидрогенолитически удаляемые защитные группы (например, CBZ или бензил) можно отщеплять, например, путем обработки с помощью водорода в присутствии катализатора (например, катализатора на основе благородного металла, как палладий, целесообразно на носителе, как уголь). В качестве растворителей, при этом пригодны вышеуказанные, в частности, например, спирты, как метанол или этанол, или амиды, как ДМФ. Гидрогенолиз осуществляют как правило при температуре примерно от 0oC до 100oC и давлениях примерно от 1 до 200 бар, предпочтительно при 20 – 30oC и давлении 1-10 бар. Основание формулы I с помощью кислоты можно переводить в соответствующую соль присоединения кислоты, например, путем взаимодействия эквивалентных количеств основания и кислоты в инертном растворителе, как этанол, и последующего выпаривания. Для этого превращения меняют, в частности, кислоты, которые дают физиологически приемлемые соли. Так, можно применять неорганические кислоты, например, серную кислоту; азотную кислоту; галогенводородные кислоты, как соляная кислота или бромисто-водородная кислота; фосфорные кислоты, как ортофосфорная кислота; сульфаминовую кислоту; далее, органические кислоты, в частности алифатические, алициклические, аралифатические, ароматические или гетероциклические одно- или многоосновные карбоновые, сульфоновые или серные кислоты, например, как муравьиная кислота, уксусная кислота, пропионовая кислота, пивалиновая кислота, диэтилуксусная кислота, малоновая кислота, янтарная кислота, пимелиновая кислота, фумаровая кислота, малеиновая кислота, молочная кислота, винная кислота, яблочная кислота, лимонная кислота, глюконовая кислота, аскорбиновая кислота, никотиновая кислота, изоникотиновая кислота, метан- или этансульфокислота, этандисусльфокислота, 2-гидроксиэтансульфокислота, бензолсульфокислота, п-толуолсульфокислота, нафталин-моно- и ди-сульфокислоты, лаурилсерная кислота. Соли с физиологически неприемлемыми кислотами, например пикраты, можно использовать для выделения и/или очистки соединений формулы I. С другой стороны, соединения формулы I с помощью оснований (например, гидроксида или карбоната натрия или калия) можно превращать в соответствующие соли металлов, в частности в соли щелочных металлов или щелочно-земельных металлов, или в соответствующие соли аммония. Предметом изобретения являются также лекарственные средства на основе соединений формулы I и их физиологически приемлемые соли. Предметом изобретения, далее, является применение соединения формулы I в качестве промежуточных продуктов для синтеза лекарственных средств. Соответствующие лекарственные средства описываются, например, в патенте ФРГ 4333254. Предметом изобретения соответственно этому является, в частности, применение соединений формулы I по п. 1 формулы изобретения при синтезе 1-[4-(5-циан-индол-3-ил)бутил] -4-(2-карбамоил-бензофуран-5-ил)- пиперазина и его солей, отличающееся тем, что нитруют 2-(2-формилфенокси)уксусную кислоту; циклизуют таким образом полученную 2-(2-формил-4-нитрофенокси)-уксусную кислоту; этерифицируют до сложного эфира таким образом полученную 5-нитробензофуран-2-карбоновую кислоту; таким образом полученное соединение формулы III 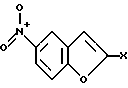 где X обозначает COOA, COOPh или COOCH2Ph, восстанавливают; таким образом полученное соединение формулы I, где R1 обозначает NH2 и X обозначает COOA, COOPh или COOCH2Ph, превращают в его соль присоединения кислоты и ее вводят во взаимодействие с солью присоединения кислоты соединения формулы II NH(CH2CH2X1)2, где X1 обозначает Cl, Br, I, OH или реакционноспособную, функционально измененную OH-группу, с получением производного пиперазина формулы IV 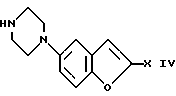 где X обозначает COOA, COOPh или COOCH2Ph; таким образом полученное соединение формулы IV превращают в его соль присоединения кислоты; эту соль вводят во взаимодействие с соединением, которое пригодно для введения защитной для аминной функции группы; таким образом полученное соединение формулы V 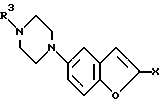 где R3 обозначает само по себе известную защитную для аминной функции группу и X имеет указанное значение, превращают в соединение формулы VI 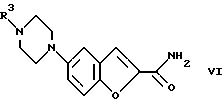 где R3 имеет вышеуказанное значение; таким образом полученное соединение формулы VI путем отщепления защитной для аминной функции группы превращают в 5-(1-пиперазинил)-бензофуран-2-карбоксамид или соль присоединения кислоты; и 5-(1-пиперазинил)-бензофуран-2-карбоксамид или соответствующую соль вводят во взаимодействие с 3-(4-хлорбутил)-5-циан-индолом с получением 1-[4-(5-циан-индол-3-ил)бутил] -4-(2-карбамоил-бензофуран-5-ил)пиперазина и в случае необходимости затем переводят в соль присоединения кислоты. 3-(4-Хлорбутил)-5-циан-индол известен из патента ФРГ 4101686; 1-[4-(5-циан-индол-3-ил)бутил] -4-(2-карбамоил-бензофуран-5-ил)пиперазин известен из патента ФРГ 4333254. Предметом изобретения, далее, является применение соединений формулы I в качестве промежуточных продуктов для синтеза лекарственных средств, которые оказывают воздействия на центральную нервную систему. Предметом изобретения, далее, является применение соединений формулы I и/или их физиологически приемлемых солей для приготовления фармацевтических композиций, в частности, нехимическим путем. При этом их вместе по меньшей мере с одним твердым, жидким и/или полужидким носителем или вспомогательным веществом и в случае необходимости в комбинации с одним или несколькими другими биологически активными веществами можно доводить до пригодной дозировочной формы. Предметом изобретения, далее, являются фармацевтические композиции, содержащие по меньшей мере одно соединение формулы I и/или одну из его физиологически приемлемых солей. Эти композиции можно применять в качестве лекарственных средств в медицине или ветеринарии. В качестве носителей применяют органические или неорганические вещества, которые пригодны для кишечного (например, орального), парентерального или топического применения и не реагируют с новыми соединениями, например воду, растительные масла, бензиловые спирты, алкиленгликоли, полиэтиленгликоли, глицеринтриацетат, желатину, углеводы, как лактоза или крахмал, стеарат магния, тальк, вазелин. Для орального применения служат, в частности, таблетки, пилюли, драже, капсулы с лекарством, порошки, грануляты, сиропы, соки или капли; для ректального применения служат свечи; для парентерального применения служат растворы, предпочтительно масляные или водные растворы, далее суспензии, эмульсии или имплантаты; для топического применения служат мази, кремы или пудры. Новые соединения также можно лиофилизировать и полученные лиофилизаты применять, например, для приготовления препаратов для инъекции. Указанные композиции могут быть стерилизованы и/или могут содержать вспомогательные вещества, как придающие скользкость средства, консерванты, стабилизаторы и/или смачиватели, эмульгаторы, соли для влияния на осмотическое давление, буферные вещества, красители, вкусовые вещества и/или несколько других биологически активных веществ, например один или несколько витаминов. Соединения формулы I и их физиологически приемлемые соли можно применять при борьбе с заболеваниями. Все выше- и нижеуказанные температуры указываются в oC. В нижеследующих примерах выражение “обычная обработка” обозначает: добавляют, если требуется, воду; устанавливают, если требуется, в зависимости от строения целевого продукта, pH-значение от 2 до 10; экстрагируют этилацетатом или дихлорметаном; разделяют, органическую фазу сушат над сульфатом натрия, выпаривают и очищают путем хроматографии на силикагеле и/или путем кристаллизации. Rf-значения определяются на силикагеле. Пример 1 Раствор из 2,3 г этилового эфира 5-нитробензофуран-2-карбоновой кислоты в 60 мл метанола гидрируют в присутствии никеля Ренея. Катализатор отфильтровывают и раствор концентрируют. После обычной обработки получают этиловый эфир 5-аминобензофуран-2-карбоновой кислоты; Rf = 0,1 (дихлорметан/этанол = 9,5:0,5); гидрохлорид; т.пл. 246-248oC. Пример 2 Раствор из 2,05 г этилового эфира 5-аминобензофуран-2-карбоновой кислоты в 80 мл дихлорметана смешивают с 1,5 г N,N-бис(2-хлорэтил)-амина и перемешивают в течение 10 часов. Обрабатывают как обычно и получают этиловый эфир 5-(1-пиперазинил)бензофуран-2-карбоновой кислоты. Rf=0,55 (изопропанол/вода= 95:5). Пример 3 Раствор из 1 г этилового эфира 5-(1-пиперазинил)бензофуран-2-карбоновой кислоты в 50 мл ТГФ вместе с 1 г ди-трет-бутил-дикарбоната перемешивают в течение 3-х часов. После обычной обработки получают этиловый эфир 5-(4-трет-бутилкарбонил-1-пиперазинил)бензофуран-2-карбоновой кислоты; т.пл. 116 – 118oC. Пример 4 Раствор из 3 г этилового эфира 5-(4-трет-бутилоксикарбонил-1- пиперазинил)бензофуран-2-карбоновой кислоты в 100 мл N-метилпирролидона вместе с 1 г формамида и 3 г алкоголята натрия перемешивают в течение 5 часов. После обычной обработки получают 5-(4-трет-бутилоксикарбонил-1-пиперазинил)бензофуран-2-карбоксамид; т.пл. 198 – 200oC. Пример 5 Раствор 1 г этилового эфира 5-(1-пиперазинил)бензофуран-2- карбоновой кислоты в 50 мл дихлорметана смешивают с 1 г бензилхлорида и перемешивают в течение 2-х часов. После обычной обработки получают этиловый эфир 5-(4-бензил-1-пиперазинил)бензофуран-2-карбоновой кислоты; т.пл. = 219 – 222oC. Пример 6 1 г 5-(4-трет -бутилоксикарбонил-1-пиперазинил)бензофуран-2- карбоксамида растворяют в 50 мл метанольного раствора HCl и перемешивают в течение 1 часа. После обычной обработки получают 5-(1- пиперазинил)бензофуран-2-карбоксамид. Т.пл. 252 – 255oC. Нижеследующие примеры относятся к фармацевтическим композициям: Пример А. Флаконы с препаратами для инъекций В растворе из 100 г биологически активного вещества формулы I и 5 г вторичного кислого фосфата натрия в 3 л дважды перегнанной воды с помощью 2 н. соляной кислоты устанавливают pH = 6,5, раствор стерильно фильтруют, заполняют им флаконы для препаратов для инъекций, лиофилизируют в стерильных условиях и стерильно закрывают. Каждый флакон с препаратом для инъекции содержит 5 мг биологически активного вещества. Пример Б. Свечи Расплавляют смесь из 20 г биологически активного вещества формулы I со 100 г соевого лецитина и 1400 г масло какао, разливают в формы и оставляют охлаждаться. Каждая свеча содержит 20 мг биологически активного вещества. Пример В. Раствор Готовят раствор из 1 г биологически активного вещества формулы I, 9,38 г NaH2PO4  2H2O, 28,48 г Na2HPO4 2H2O, 28,48 г Na2HPO4 12H2O и 0,1 г бензальконийхлорида в 940 мл дважды перегнанной воды. Устанавливают pH = 6,8, доливают до общего объема 1 литр и стерилизуют путем облучения. Этот раствор можно применять в форме глазных капель.
Пример Г. Мазь 12H2O и 0,1 г бензальконийхлорида в 940 мл дважды перегнанной воды. Устанавливают pH = 6,8, доливают до общего объема 1 литр и стерилизуют путем облучения. Этот раствор можно применять в форме глазных капель.
Пример Г. МазьСмешивают 500 мг биологически активного вещества формулы I с 99,5 г вазелина при асептических условиях. Пример Д. Таблетки Смесь из 1 кг биологически активного вещества формулы I, 4 кг лактозы, 1,2 кг картофельного крахмала, 0,2 кг талька и 0,1 кг стеарат магния обычным образом прессуют в таблетки, таким образом, что таблетка содержит 10 мг биологически активного вещества. Пример Е. Драже Аналогично примеру Д прессуют таблетки, на которые затем обычным образом наносят покрытие из сахарозы, картофельного крахмала, талька, траганта и красителя. Пример Ж. Капсулы 2 кг биологически активного вещества формулы I обычным образом вносят в твердые желатиновые капсулы так, что каждая капсула содержит 20 мг биологически активного вещества. Пример З. Ампулы Раствор из 1 кг биологически активного вещества формулы I в 60 л дважды перегнанной воды стерильно фильтруют, разливают в ампулы, лиофилизируют в стерильных условиях и стерильно закрывают. Каждая ампула содержит 10 мг биологически активного вещества. Пример 7 Получение 5-{4-[4-(5-циано-3-индолил) -бутил]-1-пиперазинил}- бензофуран-2-карбоксамид-гидрохлорид К смеси 75 г диметилформамида и 15 г K2CO3 в атмосфере азота добавляли 2,5 г 3-(4-хлорбутил)-индол-5- карбонитрила и 2,5 г 5-(1-пиперазинил)-бензофуран-2-карбоксамид и перемешивали в течение 12 часов при 110oC и затем отфильтровывали, не охлаждая. Жидкую фазу освобождали от растворителя в вакууме при температуре 60oC и остаток смешивали с 80 г этанола. Образовавшийся осадок отделяли, сушили при 40oC, растворяли в 130 г этилацетата и вновь отфильтровывали. Раствор при перемешивании смешивали с 15 г 1 н. соляной кислоты и далее перемешивали в течение одного часа. Образовавшийся бледно-желтый осадок выделяли путем фильтрования и сушили в вакууме при 60oC. Выход 3,0 г (61%). Температура плавления 285 – 295oC (разложение). Формула изобретения
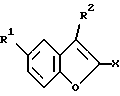 где R1 обозначает NH2, 1-пиперазинил или 4-R3-пиперазинил; R2 обозначает H; R3 обозначает бензил или само по себе известную, защитную для аминной функции группу; X обозначает COOH, COOA, или CONR4R5; R4 и R5 каждый независимо друг от друга, обозначают H; A обозначает алкил с 1-4 с-атомами; а также их соли. 2. Соединение формулы I по п.1, представляющей собой а)Этиловый эфир 5-аминобензофуран-2-карбоновой кислоты и его соли; б) 5-(1-пиперазинил)бензофуран-2-карбоновая кислота и ее соли; в) этиловый эфир 5-(1-пиперазинил)бензофуран-2-карбоновой кислоты и его соли; г) этиловый эфир 5-(4-трет. -бутилоксикарбонил-1-пиперазинил)-бензофуран-2-карбоновой кислоты; д) 5-(4-трет. -бутилоксикарбонил-1-пиперазинил)бензофуран-2-карбоксамид; е) 5-(1-пиперазинил)бензофуран-2-карбоксамид. 3. Способ получения бензофуранов формулы I по п.1, а также их солей отличающийся тем, что соединение формулы I, где R1 обозначает 1-пиперазинильный остаток, путем введения аминозащитной группы превращают в соединение формулы I, в которой R1 обозначает 4-R3-пиперазинильный остаток, где R3 имеет указанные значения. 4. Соединение формулы I по п.1 в качестве промежуточных продуктов для синтеза лекарственных средств. |
||||||||||||||||||||||||||
