Патент на изобретение №2312097
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
(54) СПОСОБ ПОЛУЧЕНИЯ СИММЕТРИЧНЫХ ДИ(ПОЛИФТОРАЛКИЛОВЫХ) ЭФИРОВ
(57) Реферат:
Изобретение относится к способу получения симметричных ди(полифторалкиловых) эфиров формулы [H(CF2)nСН2]2О (n=2, 4, 6) из соответствующих полифторированных спиртов в присутствии катализатора -N,N-диметилформамида, заключающийся в смешении реагентов при температуре -15÷-10°С, с их последующим взаимодействием. При этом смесь полифторированного спирта с катализатором взаимодействует с тионилхлоридом при мольном соотношении реагентов, равном 1:(0,005-0,009):(1-1,1) соответственно, при ступенчатом повышении температуры: сначала при 20-30°С в течение 1-2 ч, затем при 30-50°С в течение 3-6 ч, а выделяющиеся диоксид серы и хлористый водород отдуваются инертным газом. Способ позволяет получать симметричные ди(полифторалкиловые) эфиры с высоким выходом в одну стадию. 1 табл.
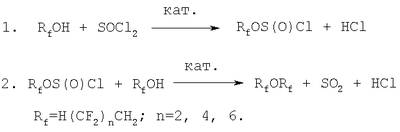
Изобретение относится к способу синтеза симметричных ди(полифторалкиловых) эфиров из полифторированных спиртов и тионилхлорида. Известно множество методов синтеза полифторированных простых эфиров. Наиболее распространенными являются два направления – это фторирование элементарным фтором, фтористым водородом и различными фторидами. Второе направление – это синтез эфиров на основе полифторированных спиртов или алкоголятов. Известен метод низкотемпературного фторирования элементарным фтором. В криогенном реакторе с несколькими температурными зонами (от -78 до 0°С) в течение нескольких дней субстрат контактирует с разбавленным фтором [Соединения фтора: Синтез и применение / Под ред. Н.Исикавы. М.: Мир. 1990. 407 с.]. Простые перфторэфиры можно синтезировать электролитическим фторированием в безводном фториде водорода соответствующих углеводородных простых эфиров [Соединения фтора: Синтез и применение / Под ред. Н.Исикавы. М.: Мир. 1990. 407 с.]. Однако в связи с деструкцией углерод – углеродных цепей, как и в случае низкотемпературного фторирования элементарным фтором, и другими побочными реакциями, выходы целевых продуктов невысоки – 15-32%. К недостаткам этих методов можно также отнести длительность процесса и сложность аппаратурного оформления. Фторированные спирты типа RfCH2OH и (Rf)2 Недостатком этого способа является невысокий выход эфиров. Кроме того, исходные полифторалкоксиэтилхлориды необходимо предварительно получать реакцией соответствующих спиртов с тионилхлоридом, что значительно усложняет технологию. Известен способ получения диполифторированных эфиров [RU 2203881 C1, C07C 43/12, опубл. 10.05.2005] путем взаимодействия полифторированного спирта с тетрафторэтиленом в присутствии катализатора – гидроксида калия (1,2-2,0% от массы полифторированного спирта). Процесс ведут в присутствии 2-10 мас.% метанола, температура процесса 50-110°С, давление 9-16 кгс/см2. Недостатком этого способа является образование побочных продуктов – алкиловых эфиров 2,3,3,3-тетрапропионовой кислоты и продуктов замещения фтора на алкокси-группу. Недостатком этого способа является невысокий выход, образование побочного продукта – трифторметилсульфокислоты или арилсульфокислоты, и использование большого избытка спирта, который для повторного применения после выделения продуктов необходимо дополнительно очищать и осушать. Наиболее близким к предлагаемому изобретению является способ получения диполифторалкиловых эфиров из полифторированных спиртов [Рахимов А.И., Налесная А.В., Вострикова О.В. Синтез ди(полифторалкиловых) эфиров / ЖПХ. 2004. Т.77. Вып.9. С.1573-1574] (прототип). Ди(полифторалкиловые) эфиры получают взаимодействием (полифторалкил)хлорсульфитов с полифторированными спиртами в присутствии каталитических количеств N,N-диметилформамида (ДМФА). Раствор хлорсульфита добавляют в смесь соответствующего спирта с ДМФА в мольном соотношении хлорсульфит : полифторированный спирт : ДМФА, равном 1:1:(0,005-0,01), при минус 10°С, затем выдерживают реакционную массу при 20°С два часа, отдувая выделяющиеся хлористый водород и диоксид серы осушенным воздухом, и еще 1 сутки при комнатной температуре. После отгонки растворителя (хлороформ, диэтиловый эфир) и перегонки продукта выход диполифторалкилового эфира составляет 59-98%. Недостатком этого способа является необходимость работы с хлорсульфитами – едкими веществами с неприятным запахом, легко разлагающимися в присутствии влаги и оснований. Кроме того, хлорсульфиты необходимо предварительно получать реакцией полифторированных спиртов с тионилхлоридом. Применение этого способа значительно усложняет использование растворителя, а также увеличивает продолжительность реакции. Техническим результатом предлагаемого изобретения является получение симметричных ди(полифторалкиловых) эфиров с высоким выходом (до 96,4%) в одну стадию, что упрощает способ получения заявляемых соединений. Технический результат достигается тем, что способ получения симметричных ди(полифторалкиловых) эфиров формулы [H(CF2)nCH2]2O (n=2, 4, 6) из соответствующих полифторированных спиртов в присутствии катализатора N,N-диметилформамида (ДМФА), заключающийся в смешении реагентов при температуре -15÷-10°С, причем смесь полифторированного спирта с катализатором взаимодействует с тионилхлоридом при мольном соотношении реагентов, равном 1:(0,005-0,009):(1-1,1) соответственно, при ступенчатом повышении температуры: сначала при 20-30°С в течение 1-2 ч, затем при 30-50°С в течение 3-6 ч; выделяющиеся диоксид серы и хлористый водород отдуваются инертным газом. Сущностью изобретения является то, что образующийся при взаимодействии полифторированного спирта с тионилхлоридом хлорсульфит не выделяется из реакционной массы, а далее при повышении температуры реагирует с избытком полифторированного спирта, что позволяет получать симметричные ди(полифторалкиловые) эфиры непосредственно из полифторированных спиртов и тионилхлорида, минуя стадию выделения и очистки (полифторалкил)хлорсульфитов, что значительно упрощает способ получения. Технология способа состоит в следующем: в охлажденный до -15÷-10°С тионилхлорид при интенсивном перемешивании дозируют смесь полифторированного спирта с ДМФА в мольном соотношении 1:(0,005-0,009), затем температуру повышают до 20-30°С и выдерживают 1-2 ч, при этом образуется хлорсульфит. Затем температуру повышают до 30-50°С и выдерживают еще 3-6 ч. На протяжении всего процесса образующиеся по реакции хлористый водород и диоксид серы отдувают инертным газом, например сухим азотом. Процесс ведут в отсутствие растворителя. Из реакционной смеси отгоняют последовательно избыток тионилхлорида, непрореагировавшие полифторированный спирт и хлорсульфит, затем перегоняют в вакууме продукт – ди(полифторалкиловый) эфир. Выход эфиров составляет до 96,4%. Так как при этом растворитель не используется, технология значительно упрощается. Пример 1. Получение ди(1,1,3-тригидроперфторпропилового) эфира К 14,2 г (0,1197 моль) тионилхлорида при температуре -15°С, интенсивном перемешивании и продувке сухим азотом прибавляли смесь 15,8 г (0,1197 моль) 1,1,3-тригидроперфторпропанола и 0,043 г (0,0006 моль) ДМФА в течение получаса, затем температуру повышали до 20°С и выдерживали 1 ч. Потом температуру повышали до 30-40°С и выдерживали еще 4 ч. Отгоняли последовательно избыток тионилхлорида (т.кип. 79°С) и непрореагировавшие 1,1,3-тригидроперфторпропанол (т.кип. 109°С) и хлорсульфит (т.кип. 36°С / 5 мм рт.ст.). После перегонки остатка получили 11,16 г (75,8%) ди(1,1,3-тригидроперфторпропилового) эфира, т.кип. 65°С (1 мм рт.ст.), nD 20 1,3575, d20 4 1,6251. Пример 2. Получение ди(1,1,5-тригидроперфторпентилового) эфира К 8,64 г (0,0726 моль) тионилхлорида при температуре -10°С, интенсивном перемешивании и продувке сухим азотом прибавляли смесь 15,85 г (0,0683 моль) 1,1,5-тригидроперфторпентанола и 0,026 г (0,0004 моль) ДМФА в течение получаса, затем температуру повышали до 25°С и выдерживали 1,5 ч. Потом температуру повышали до 30-40°С и выдерживали еще 5 ч. Отгоняли последовательно избыток тионилхлорида (т.кип. 79°С) и непрореагировавшие 1,1,5-тригидроперфторпропанол (т.кип. 141°С) и хлорсульфит (т.кип. 64°С / 5 мм рт.ст.). После перегонки остатка получили 14,68 г (96,4%) ди(1,1,5-тригидроперфторпентилового) эфира, т.кип. 103°С (2 мм рт.ст.), nD 20 1,3385, d20 4 1,7344. Пример 3. Получение ди(1,1,7-тригидроперфторгептилового) эфира К 6,48 г (0,0575 моль) тионилхлорида при температуре -10°С, интенсивном перемешивании и продувке сухим азотом прибавляли смесь 17,37 г (0,0523 моль) 1,1,7-тригидроперфторгептанола и 0,036 г (0,0005 моль) ДМФА в течение получаса, затем температуру повышали до 30°С и выдерживали 2 ч. Потом температуру повышали до 40-50°С и выдерживали еще 6 ч. Отгоняли последовательно избыток тионилхлорида (т.кип. 79°С) и непрореагировавшие 1,1,7-тригидроперфторпропанол (т.кип. 170°С) и хлорсульфит (т.кип. 61°С / 1 мм рт.ст.). После перегонки остатка получили 13,06 г (77,3%) ди(1,1,7-тригидроперфторгептилового) эфира, т.кип. 130°С (1 мм рт.ст.), nD 20 1,3370, d20 4 1,8014. Для определения оптимальных условий проведения реакции были проведены опыты с 1,1,3-тригидроперфторпропанолом, аналогичные примеру 1, результаты опытов приведены в таблице (пример 4-6).
Из таблицы видно, что применение эквимолярного количества тионилхлорида (0,5 моль на 1 моль спирта) приводит к понижению выхода эфира (пример 4), это объясняется тем, что для получения промежуточного хлорсульфита необходим (как это было показано в [RU 2247110 C1, C07C 301/00, опубл. 27.02.2005]) избыток тионилхлорида, что и подтверждается примерами 5 и 6. Таким образом, оптимальным является соотношение полифторированный спирт : тионилхлорид, равное 1:(1-1,1) моль, дальнейшее увеличение избытка тионилхлорида мало влияет на выход продукта и поэтому нецелесообразно. Превращение полифторированного спирта в ди(полифторалкиловый) эфир протекает через две последовательные реакции – образование хлорсульфита и его взаимодействие со спиртом: Установлено, что синтез хлорсульфита необходимо проводить при 20-30°С [RU 2247110 C1, C07C 301/00, опубл. 27.02.2005], при этом повышение температуры приводит к образованию побочных продуктов и снижению выхода хлорсульфита. Для более полного протекания второй реакции – превращения хлорсульфита, при комнатной температуре необходима выдержка в течение суток (прототип). Повышение температуры ускоряет реакцию, таким образом, для увеличения выхода симметричных ди(полифторалкиловых) эфиров необходимо ступенчатое повышение температуры: сначала до 20-30°С, затем – до 30-50°С. В примере 6 наряду с эфиром был выделен также хлорсульфит (около 10%), то есть для повышения выхода эфира необходимо увеличить продолжительность реакции с 3 до 4 и более часов, стремясь к более полному превращению промежуточного хлорсульфита (примеры 1-3). Чем больше молекулярная масса исходного полифторированного спирта, тем он менее реакционноспособен, поэтому необходимо при переходе от спирта с n=2 к n=6 увеличивать количество катализатора, температуру и время реакции. Для доказательства эффективности предлагаемого нами способа сравним выход эфиров по одностадийному (предлагаемому) методу и суммарный выход по двухстадийному методу, включающему получение хлорсульфитов [RU 2247110 C1, C07C 301/00, опубл. 27.02.2005] и превращение хлорсульфитов в эфиры (прототип). Выход симметричных ди(полифторалкиловых) эфиров [H(CF2)nCH2]2O составляет: для n=2-75,8% (пример 1) и 75,17% (двухстадийный); для n=4-96,4% (пример 2) и 52,22% (двухстадийный); для n=6-77,3% (пример 3) и 45,26% (двухстадийный). Очевидно, что предлагаемый одностадийный метод получения симметричных ди(полифторалкиловых) эфиров намного более выгоден. Таким образом, предлагается способ получения симметричных ди(полифторалкиловых) эфиров из полифторированных спиртов и тионилхлорида с использованием в качестве катализатора N,N-диметилформамида при соотношении реагентов полифторированный спирт : тионилхлорид : ДМФА, равном 1:(1-1,1):(0,005-0,009) моль, позволяющий получать эфиры с выходом, до – 96,4%.
Формула изобретения
Способ получения симметричных ди(полифторалкиловых) эфиров формулы [H(CF2)nСН2]2О (n=2, 4, 6) из соответствующих полифторированных спиртов в присутствии катализатора – N,N-диметилформамида, заключающийся в смешении реагентов при температуре -15÷-10°С с их последующим взаимодействием, отличающийся тем, что смесь полифторированного спирта с катализатором взаимодействует с тионилхлоридом при мольном соотношении реагентов 1:(0,005-0,009):(1-1,1) соответственно, при ступенчатом повышении температуры сначала при 20-30°С в течение 1-2 ч, затем при 30-50°С в течение 3-6 ч; выделяющиеся диоксид серы и хлористый водород отдуваются инертным газом.
MM4A – Досрочное прекращение действия патента СССР или патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 14.07.2008
Извещение опубликовано: 10.07.2010 БИ: 19/2010
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||