|
|
(21), (22) Заявка: 2006108266/13, 17.03.2006
(24) Дата начала отсчета срока действия патента:
17.03.2006
(46) Опубликовано: 20.11.2007
(56) Список документов, цитированных в отчете о
поиске:
LIN ET AL., Enzyme Microb. Technol., 2000, v.27, p.482-491. US 5,719,044, 17.02.1998. US 6,174,700, 16.01.2001.
Адрес для переписки:
117312, Москва, пр. 60-летия Октября, 7, корп.1, Центр “Биоинженерия” РАН
|
(72) Автор(ы):
Редо Вадим Александрович (RU),
Эльдаров Михаил Анатольевич (RU),
Хатунцева Светлана Анатольевна (RU),
Жгун Александр Александрович (RU),
Зейналов Орхан Ахмед оглы (RU),
Скрябин Константин Георгиевич (RU)
(73) Патентообладатель(и):
Центр “Биоинженерия” РАН (RU)
|
(54) РЕКОМБИНАНТНАЯ ДНК, КОДИРУЮЩАЯ ФУНКЦИОНАЛЬНО АКТИВНЫЙ ГИБРИДНЫЙ БЕЛОК ОКСИДАЗЫ D-АМИНОКИСЛОТ С ХИТИНСВЯЗЫВАЮЩИМ ДОМЕНОМ (DAOcbd) РЕКОМБИНАНТНАЯ ПЛАЗМИДА pVR1, ОБЕСПЕЧИВАЮЩАЯ ЕГО СИНТЕЗ В КЛЕТКАХ Escherichia coli, И РЕКОМБИНАНТНЫЙ ШТАММ Escherichia coli С 41(DE3)/pVR1 – ПРОДУЦЕНТ DAOcbd
(57) Реферат:
Изобретение относится к области биотехнологии, в частности к генетической инженерии, и может быть использовано в микробиологической промышленности при получении полусинтетических бета-лактамных антибиотиков нового поколения. Сконструирована рекомбинантная плазмида экспрессии pVR1, содержащая фрагмент ДНК, который кодирует функционально активный гибридный белок (DAOcbd), состоящий из оксидазы D-аминокислот штамма Trigonopsis variabilis BKM Y-2601 и хитинсвязывающего домена хитиназы A1 Bacillus circulans. В результате трансформации штамма Е. coli предложенной рекомбинантной плазмидой и селекции трансформированных клонов получен новый штамм E.coli C41(DE3)/pVR1 – продуцент гибридного белка DAOcbd, обеспечивающий высокий выход рекомбинантного фермента. Получение активной DAO в предложенной комбинации с хитинсвязывающим доменом существенно облегчает очистку целевого белка, причем в результате проведения процесса очистки образуется иммобилизованная форма фермента, пригодная как для непосредственного использования в технологическом процессе, так и для последующей «пришивки» к другим носителям. 3 с.п. ф-лы, 3 ил., 2 табл.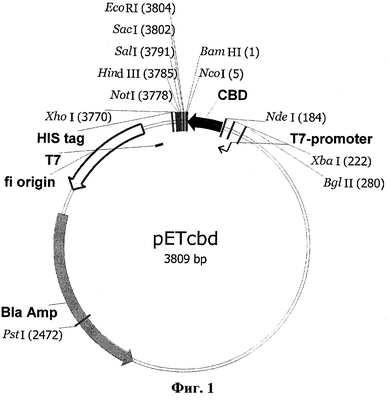
Настоящее изобретение относится к области биотехнологии, в частности к генетической инженерии, и может быть использовано в микробиологической промышленности при получении полусинтетических цефалоспориновых антибиотиков нового поколения. Предлагаются:
– рекомбинантная ДНК, кодирующая функционально активный гибридный белок (DAOcbd), который состоит из оксидазы D-аминокислот штамма Trigonopsis variabilis BKM Y-2601, слитой с хитинсвязывающим доменом хитиназы A1 Bacillus circulans;
– рекомбинантная плазмида pVR1, содержащая рекомбинантную ДНК, кодирующую DAOcbd, и обеспечивающая высокий уровень экспрессии гибридного белка в клетках E.coli;
– рекомбинантный штамм E.coli C41(DE3)/pVR1 – продуцент гибридного белка DAOcbd.
Уровень техники
Оксидазы D-аминокислот (d-Amino acid oxidase, DAO; EC 1.4.3.3.), выделенные из дрожжей Т.variabilis R.gracilis, – промышленные ферменты, широко используемые в составе биокатализаторов при производстве полусинтетических бета-лактамных антибиотиков нового поколения [1]. В связи с потребностью в наращивании объема производства этой широко применяемой ныне группы антибиотиков усовершенствование известных методов получения необходимых для их синтеза ферментов, в том числе с помощью технологий рекомбинантных ДНК, представляет несомненный практический интерес.
К настоящему времени известны рекомбинантные плазмидные ДНК, направляющие синтез функционально активных ферментов DAO Trigonopsis variabilis [2, 3], Rhodotorula gracilis [4, 5] в клетках бактерий [2-5] или дрожжей [6, 7]. Получение оксидаз D-аминокислот в гетерологичных бактериальных системах сопряжено с целым рядом трудностей. Во-первых, сверхпродукция DAO в клетке оказывает неблагоприятное воздействие на клетки обычных хозяйских штаммов бактерий, поскольку сопряжена с высвобождением токсичного соединения – перекиси водорода, а также приводит к подавлению синтеза клеточной стенки бактерий [3, 4]. Во-вторых, препараты рекомбинантной DAO, используемые для биотрансформации цефалоспориновых антибиотиков, не должны содержать примесей посторонних белков, в частности бета-лактамазы, что осложняет проблему выбора векторных конструкций для эксперессии белка и методов его очистки. В силу этого актуальной остается задача разработки новых систем экспрессии DAO и упрощения очистки фермента.
Поскольку одним из наиболее эффективных способов очистки белка сегодня является аффинная хроматография [8], в последние годы получили широкое распространение методы экспрессии рекомбинантных белковых продуктов в форме гибридных белков, содержащих вспомогательный полипептид, специфически связывающийся с соединением, которое применяется в качестве лиганда при последующей очистке белка аффинной хроматографией. Получение рекомбинантных ферментов в форме гибридных белков является достаточно простым и эффективным методом, имеющим, однако, существенный недостаток, который заключается в том, что модификация первичной структуры ферментного белка при связывании его с вспомогательным компонентом может внести нежелательные изменения в его конформацию и соответственно привести к снижению или даже потере функциональной активности. В подобных ситуациях может быть предусмотрена возможность последующего расщепления гибридного белка (дополнительная стадия) на составляющие под действием химических или энзиматических агентов. Однако введение процедуры расщепления экспрессированного гибридного белка требует проведения последующей дополнительной очистки. В результате такие возможные преимущества способа, как простота и эффективность, по существу сводятся к нулю.
С учетом этих особенностей получения ферментов в виде гибридных белков более перспективным представляется поиск такой комбинации целевого и вспомогательного белка, в которой присутствие дополнительного компонента в препарате фермента не будет отрицательно сказываться на свойствах целевого продукта, а объединение предназначенного для очистки полипептида с интересующим белком, в свою очередь, не приведет к уменьшению его специфической связывающей активности. Кроме того, что при получении такого гибридного белка упрощается очистка целевого продукта и гарантируется полное сохранение его активности в составе слитого белка, при удачном выборе вспомогательного компонента рекомбинантные ферменты в форме такой гибридной конструкции оказываются полностью подготовленными к использованию в качестве иммобилизованного препарата, если это предусмотрено технологическим процессом.
Что касается оксидазы D-аминокислот, то попытки осуществить ее экспрессию в форме слитого белка по существу ограничиваются получением аналога, несущего 6 дополнительных N-концевых гистидиновых остатков, которые традиционно используются для последующей хроматографической очистки многих рекомбинантных белков. Однако известно, что полученный белок не отличался стабильностью и был склонен к агрегации и инактивации [9]. Поэтому в настоящем изобретении была поставлена задача конструирования гибридного белка, включающего оксидазу D-аминокислот, в котором стабильно сохранялась бы полная функциональная активность обеих его составляющих, а также разработки векторов и систем экспрессии для его получения.
Раскрытие изобретения
Решение задачи получения любого функционально активного гибридного белка включает следующие необходимые этапы:
а) дизайн конструкции гена гибридного белка, предполагающий оптимальную с точки зрения сохранения функциональной активности комбинацию целевого и вспомогательного белка; б) получение и объединение с помощью методов рекомбинантных ДНК нуклеотидных последовательностей, кодирующих компоненты гибридного белка; в) выбор клеток-хозяев и создание векторных конструкций для экспрессии гибридного белка в избранной гетерологичной системе; г) оптимизация условий продукции и очистки гибридного белка.
Поставленная цель получить функционально активный гибридный белок на основе DAO, пригодный для использования в качестве иммобилизованного препарата, была достигнута за счет того, что
1) сконструирована рекомбинантная ДНК, кодирующая гибридный белок (DAOcbd), в котором последовательность оксидазы D-аминокислот штамма Trigonopsis variabilis (TvDAO) слита с хитинсвязывающим доменом хитиназы А1 Bacillus circulans;
2) сконструирована рекомбинантная плазмида pVR1, содержащая рекомбинантную ДНК, кодирующую гибридный белок, и обеспечивающая синтез DAOcbd в клетках кишечной палочки с высоким выходом;
3) в результате трансформации экспрессирующей плазмидой pVR1 клеток штамма E.coli C41(DE3) получен рекомбинантный штамм Escherichia coli C41(DE3)/pVR1, характеризующийся высоким уровнем индуцируемого синтеза и стабильной продукцией гибридного белка DAOcbd.
Выбор хитинсвязывающего домена хитиназы A1 Bacillus circulans (CBD) в качестве вспомогательного полипептида был обусловлен рядом причин: а) применяемый в этом случае для очистки хитин представляет собой природное соединение, а также является более дешевым по сравнению со многими другими носителем для аффинной хроматографии; б) система фермент-CBD-хитин, как правило, повышает стабильность белкового препарата (фермент, иммобилизованный на хитиновом носителе через хитинсвязывающий домен может быть использован многократно); в) во многих известных нам случаях использования хитинсвязывающих доменов в комбинации с активными белками они не оказывали неблагоприятного воздействия на энзиматическую активность. Поскольку последнее обстоятельство не было очевидным применительно к конкретному ферменту (DAO), уровень ферментативной активности DAO после объединения с хитинсвязывающим доменом был предварительно определен экспериментальным путем, в результате чего была подтверждена правильность сделанного выбора.
Нуклеотидную последовательность, кодирующую хитинсвязывающий домен хитиназы A1 Bacillus circulans (SEQ ID №12), получили из коммерческой плазмиды pTYB-4.
Полная кодирующая последовательность гена TvDAO (SEQ ID №6) была получена нами из штамма Trigonopsis variabilis BKM Y-2601 путем ПЦР-амплификации области гена DAO с применением праймеров tv1 (SEQ ID №1) и tv2 (SEQ ID2), специфичных по отношению к его N- и С-концевым участкам, и последующего удаления из полученной последовательности интрона с помощью ПЦР с праймерами tv3 (SEQ ID №4) и tv5 (SEQ ID №5).
Для получения последовательности, кодирующей гибридный белок, сначала был сконструирован промежуточный вектор pETcbd (фиг.1), представляющий собой коммерческий вектор рЕТ23а (Novagen), содержащий в области полилинкера кодирующую последовательность хитинсвязывающего домена (cbd), в который затем по сайтам рестрикции NcoI и XhoI была встроена последовательность (SEQ ID №6), кодирующая TvDAO, с образованием плазмиды pETDAOcbd (фиг.2), включающей полную последовательность гибридного гена (SEQ ID №13) для белка TvDAOcbd
Рекомбинантная плазмида pVR1, предназначенная для экспрессии TvDAOcbd, была получена путем субклонирования полной последовательности гибридного гена (SEQ ID №13) из вектора pETDAOcbd в сконструированную нами промежуточную плазмиду pET-TetI, представляющую собой вектор рЕТ21 (Novagen), в котором ген устойчивости к ампициллину заменен геном устойчивости к тетрациклину.
Путем трансформации клеток штамма Escherichia coli C41(DE3) [10] сконструированной плазмидой pVR1, отбора и культивирования клонов трансформантов с высоким уровнем синтеза функционально-активного гибридного белка получен рекомбинантный штамм C41(DE3)/pVR1 – продуцент гибридного белка, состоящего из TvDAO, слитой с хитинсвязывающим доменом хитиназы A1 Bacillus circulans. Синтез TvDAOcbd в полученном рекомбинантном штамме осуществляется при культивировании на обычных селективных средах с добавлением индуктора изопропил-D-тиогалактозида (ИПТГ) или лактозы. Уровень синтеза TvDAOcbd в штамме C41(DE3)/pVR1 составляет около 100 мг/л при титре культуры 1×109 кл/мл, а удельная активность фермента в составе полученного гибрида – 85 ед/мг белка.
Таким образом, настоящее изобретение включает три объекта.
Первый объект – рекомбинантная ДНК, которая кодирует гибридный белок (DAOcbd), состоящий из оксидазы D-аминокислот Trigonopsis variabilis и хитинсвязывающего домена хитиназы A1 Bacillus circulans, и характеризуется нуклеотидной последовательностью SEQ ID №13.
Второй объект – рекомбинантная плазмида pVR1, обеспечивающая синтез гибридного белка TvDAOcbd в клетках Escherichia coli и состоящая из фрагмента ДНК с последовательностью SEQ ID №13, кодирующей названный гибридный белок, и NdeI/XhoI фрагмента плазмиды pET-TetI, полученной путем замены гена бета-лактамазы в векторе рЕТ23 геном устойчивости к тетрациклину (TetR) в обратной ориентации.
Третий объект – рекомбинантный штамм Escherichia coli C41(DE3)/pVR1 – продуцент функционально активного гибридного белка TvDAOcbd.
Краткое описание фигур.
Фиг.1 – Физическая и генетическая карты вектора pETcbd. Обозначены положения индикаторных сайтов рестрикции, участки промотора и терминатора РНК-полимеразы фага Т7 (T7-promoter и Т7), область начала репликации (f1 origin), ген устойчивости к ампициллину (Bla Amp), ген CBD, участок, кодирующий гексогистидиновый таг (HIS tag).
Фиг.2 – Физическая и генетическая карты вектора pETDAOcbd. Обозначено положение гена DAOcbd, остальные обозначения, как на Фиг.1.
Фиг.3 – Физическая и генетическая карты вектора pVR1. Обозначено положение гена устойчивости к тетрациклину (TetR), остальные обозначения, как на Фиг.1.
Осуществление изобретения
При осуществлении изобретения, помимо методов, подробно раскрытых в нижеследующих примерах, использовали хорошо известные специалистам методики, описанные в руководствах по молекулярной биологии и генетической инженерии [11, 12].
Пример 1. ПЦР-амплификация последовательности гена DAO Trigonopsis variabilis.
Первичная структура гена DAO Trigonopsis variabilis и его мРНК известны (номер доступа в GenBank Z80895). Это обстоятельство позволяет спроектировать «прямой» и «обратный» праймеры для ПЦР-амплификации требуемой области гена. В данном случае в качестве праймеров использовались следующие олигонуклеотиды:
5′-TGATAGGCAAATCCGTGCTC_-3′ «прямой» tv1-праймер (SEQ ID №1) и
5′-GTAAACACGTCGCAGTCGTC-3′ «обратный» tv2-праймер(SEQ ID №2).
Геномную ДНК Trigonopsis variabilis BKM Y-2601, выделенную традиционными методами, денатурируют путем нагревания при 100°С в течение 5 минут, помещают в лед и подвергают 30 циклам ПЦР.
Смесь для ПЦР (50 мкл):
5 мкл 10-кратного Taq-SE ПЦР-буфера (Сибэнзим);
5 мкл геномной ДНК (200 нг/мкл);
5 мкл 3 мкМ праймера tv1;
5 мкл 3 мкМ праймера tv2;
5 мкл 2,5 мМ dNTP каждого вида;
25 мкл деионизованной воды;
1 мкл Taq-SE полимеразы (5 ед/мкл, Сибэнзим).
Условия проведения ПЦР: 94°, 5′ (денатурация), 94°, 30″; 50°, 30″; 72°, 1′ (амплификация).
После амплификации 5 мкл ПЦР смеси анализируют электрофорезом в 1% агарозном геле и выявляют гомогенный фрагмент размером около 1 тпн. Фрагмент выделяют из геля с помощью набора Wizard PCR Preps Kit и подвергают автоматическому секвенированию с использованием праймеров tv1, tv2. Его последовательность представлена здесь как SEQ ID №3.
Далее из полученного фрагмента ДНК удаляют интрон, для чего его подвергают повторной ПЦР-амплификации с праймерами tv5 (SEQ ID №4) и tv3 (SEQ ID №5).
Использованные праймеры ограничивают фрагмент гена DAO, включающий начало 2-го экзона, расположенного в положении +125 последовательности SEQ ID №3, и терминаторный кодон TAG, расположенный в положении +1170 той же последовательности, и добавляют к этой последовательности инициаторный кодон трансляции ATG и участок, кодирующий 8 аминокислот 1-го экзона. Праймеры несут также сайты для рестриктаз NcoI и XhoI, отсутствующие в кодирующей последовательности гена DAO. 1 нг полученного на первом этапе ПЦР-фрагмента подвергают 25 циклам ПЦР-амплификации с праймерами tv5/tv3. Из агарозного геля выделяют фрагмент размером около 1 тпн и секвенируют. Нуклеотидная последовательность данного фрагмента представлена в SEQ ID №6.
Пример 2. Получение последовательности ДНК, кодирующей гибридный белок, и содержащего ее вектора экспрессии pVR1.
Ген гибридного белка DAOcbd получали путем объединения фрагментов, кодирующих отдельные домены белка, в составе одной плазмидной конструкции.
2.1. Конструирование промежуточной плазмиды pETcbd.
Сначала получали плазмиду, несущую CBD-домен хитиназы A1 B.circulans под контролем промотора фага Т7 вектора рЕТ23а. В качестве источника последовательности CBD домена использовали плазмиду pTYB4 (New England Biolabs). С помощью праймеров CBD_F (SEQ ID №8) и CBD_R (SEQ ID №9) на матрице плазмиды pTYB4 с использованием Pfu-полимеразы получали уникальный ПЦР фрагмент размером 0,2 т.п.н., который выделяли из агарозного геля. 100 нг полученного фрагмента гидролизовали 5 единицами рестриктаз NdeI и BamHI (Fermentas) и лигировали с гидролизованным NdeI/BamHI вектором рЕТ23а с помощью Т4 ДНК лигазы.
Полученной лигазной смесью трансформировали компетентные клетки штамма Escherichia coli XL1-Blue. Из полученных ампициллин-устойчивых трансформантов выделяли плазмидную ДНК, отбирали «положительные» клоны методом ПЦР-скрининга с праймерами CBD_R и T7prom (SEQ ID №10) и детектировали образование ПЦР-продукта размером 268 п.н.
Несколько «положительных» клонов проверяли секвенированием с использованием праймеров T7prom и T7term (SEQ ID №11) и отбирали клон с инсерцией CBD-кодирующего фрагмента (SEQ ID №12), не содержащий неспецифических мутаций. Плазмида, содержащаяся в клетках отобранного клона, была обозначена как pETcbd (Фиг1).
2.2. Получение плазмиды pETDAOcbd.
В вектор pETcbd по сайтам рестрикции NcoI/XhoI встраивали фрагмент ДНК с геном TvDAO(SEQ ID №6). Селекцию нужных клонов проводили с помощью рестриктного анализа препаратов плазмидной ДНК по образованию фрагментов размером 1266 и 3586 п.н. при гидролизе NdeI+XhoI. Один из отобранных векторов с молекулярной массой 4852 п.н. обозначили как pETDAOcbd и использовали в дальнейшей работе. Вставку гена гибридного белка в полученном векторе секвенировали с праймеров Т7 prom, T7term, CBD_F и CBD_R для подтверждения идентичности полученной последовательности гена гибридного белка ожидаемой (SEQ ID №13).
2.3. Конструирование промежуточного вектора pET-TetR.
В плазмиде рЕТ23 заменяли ген устойчивости к ампициллину геном устойчивости к тетрациклину. «Вставку», несущую ген устойчивости к тетрациклину, получали из плазмиды pKRP12[13]. Для этого 2 мкг плазмидной ДНК гидролизовали рестриктазой PstI и выделяли из агарозного геля фрагмент размером 1200 п.н. Полученный фрагмент лигировали с гидролизованной по сайту PstI плазмидой рЕТ23 в реакционной смеси, содержавшей 1 мкл раствора рестрицированного вектора с концентрацией 20 нг/мкл, 1 мкл раствора фрагмента с концентрацией 50 нг/мкл, 2 мкл 5-кратного лигазного буфера (Gibco-BRL), 5 мкл воды и 1 мкл Т4 ДНК лигазы (1 ед/мкл, Сибэнзим). Смесь инкубировали в течение 14 часов при 12°С, затем прогревали 15 мин при 65°С, охлаждали во льду и 5 мкл смеси использовали для трансформации компетентных клеток штамма Escherichia coli JM109 [14]. Отбирали тетрациклин-устойчивые клоны, чувствительные к ампициллину. Дополнительную селекцию нужных клонов проводили с помощью рестриктного анализа препаратов плазмидной ДНК (по образованию фрагментов размером 1873, 2132, 2721 п.н. при гидролизе EcoRI+PstI). В отобранных клонах определяли «ориентацию» вставки маркера Tetr путем одновременной обработки рестриктазами ClaI+XhoI. Образование фрагментов размером 1,7 тпн и 5 тпн свидетельствует о «прямой» ориентации вставки маркера Tetr, а фрагментов размером 2,7 тпн и 4 тпн – об «обратной». Плазмида с «прямой» ориентацией маркера была обозначена как pET-TetF, а плазмида с «обратной» ориентацией – как pET-TetR. В дальнейшей работе использовали вектор pET-TetR.
2.4. Получение вектора экспрессии pVR1.
Для получения вектора экспрессии гибридного белка DAOcbd из плазмиды pETDAOcbd выделяли фрагмент NdeI/XhoI размером 1200 пн и встраивали его в гидролизованный рестиктазами NdeI/XhoI вектор pET-TetR. Полученную плазмиду обозначили как pVR1 (фиг.3).
Пример 3. Получение рекомбинантного штамма – продуцента гибридного белка TvDAO cbd.
Полученной рекомбинантной плазмидой pVR1 трансформировали штамм E.coli C41(DE3) [10]. Выбор данного штамма в качестве реципиента был сделан по результатам предварительно проведенного анализа, в котором сравнивалась продуктивность штаммов Е.coli BL21(DE3) [F-, ompT, hsdSB (rВ-, mВ-), dcm, gal,  (DE3)], BL21(DE3)/plysS [15] и C41(DE3). Штамм C41(DE3) является производным от BL21(DE3) и несет дополнительную мутацию, снижающую уровень транскрипции с Т7 промотора и улучшающую сопряжение между транскрипцией и трансляцией целевых генов, находящихся под контролем Т7 промотора [10, 16]. (DE3)], BL21(DE3)/plysS [15] и C41(DE3). Штамм C41(DE3) является производным от BL21(DE3) и несет дополнительную мутацию, снижающую уровень транскрипции с Т7 промотора и улучшающую сопряжение между транскрипцией и трансляцией целевых генов, находящихся под контролем Т7 промотора [10, 16].
Отдельные клоны трансформантов выращивали в 50 мл среды при температуре 30°С и пониженной аэрации, оптимальной для продукции DAO [17]. После достижения культурой плотности 1,6 ОЕ (А600) вносили индуктор ИПТГ до конечной концентрации 1 мМ и продолжали инкубацию еще 18 часов. В конце культивирования определяли параметры роста культуры и активности фермента в бактериальных клетках, как описано ранее [17]. Для получения грубого экстракта осадок клеток разрушали ультразвуком с периодическим охлаждением во льду (4 раза по 30 сек с интервалом 1 мин) и отделяли клеточный дебрис центрифугированием (13000 об/мин, 10 мин).
50 мкл полученного осветленного лизата инкубировали с 250 мкл 10 мМ D-аланина в 50 mM фосфатном буфере, рН 8,0, в течение 15 или 30 мин, реакцию останавливали добавлением 100 мкл насыщенного раствора 2,4-динитрофенилгидразина в 2N HCl и через 5 мин к раствору добавляли 300 мкл 3М NaOH и 2,5 мл дистиллированной воды. После инкубации в течение 10 мин при комнатной температуре измеряли поглощение раствора при 550 нм, которое сравнивали с калибровочной кривой, построенной с использованием стандартных концентраций пировиноградной кислоты. Удельную активность выражали в единицах фермента (мкмоли субстрата в 1 мин при 25°С) на мг общего белка осветленного экстракта. Содержание общего белка определяли по методу Брэдфорда [11].
На основании полученных данных был отобран клон (№6), отличающийся лучшим накоплением биомассы и наиболее высоким выходом функционально активного фермента (Таблица 1), который был обозначен C41(DE3)/pVR1 и использован для получения рекомбинантного штамма.
| Таблица 1 |
| Параметры роста культуры и активности оксидазы у отдельных трансформантов штамма C41(DE3) плазмидой pVR1 |
| Индивидуальные клоны |
Рост культуры, А600 |
Активность DAO, ед/мг белка |
Выход DAO, ед/мл |
| №1 |
5,4 |
15 |
11 |
| №2 |
4,8 |
11 |
9 |
| №3 |
5,0 |
12 |
10 |
| №4 |
5,8 |
17 |
15 |
| №5 |
5,1 |
16 |
18 |
| №6 |
6,7 |
20 |
21 |
Пример 4. Характеристика рекомбинантного штамма E.coli C41(DE3)/pVR1
Морфологические признаки: Клетки имеют продолговатую палочковидную форму, при делении не почкуются.
Культуральные признаки:
Клетки хорошо растут на обычно используемых питательных средах. Время генерации около 60 мин в жидкой LB-среде. На 2-2,5% питательном агаре “Difco” образуются круглые, гладкие, желтоватые колонии с ровными краями. При выращивании на жидких LB- и YT-средах образуется интенсивная ровная мутность.
Физиолого-биохимические признаки:
Оптимальная температура культивирования – от 25 до 30°С, оптимум рН – 7,6. Источником азота служат органические соединения (в виде триптона, дрожжевого экстракта).
Уровень синтеза DAOcbd (по данным определения активности в образцах биомассы штамма-продуцента) составляет около 100 мг/л при титре культуры 1×109 кл/мл.
Пример 5. Очистка гибридного белка и анализ активности иммобилизованной на хитиновом носителе TvDAOcbd.
Полученную биомассу рекомбинантного штамма (5 г) суспендировали в 20 мл буфера А, содержащего 100 мМ фосфат натрия, рН 7,5, 5 мМ 2-меркаптоэтанол, 2 мМ ЕДТА, 0,3% цетилтриметил аммоний бромид (СТАВ), и разрушали ультразвуковой дезинтеграцией. Супернатант собирали, дебрис промывали буфером А и отбрасывали.
Балластные белки из супернатанта осаждали сульфатом аммония (30% насыщения), рекомбинантную DAOcbd из супернатанта осаждали сульфатом аммония (60% насыщения). Осадок растворяли в 10 мл буфера Б (10 мМ пирофосфат натрия, рН 8, 5 мМ 2-меркаптоэтанол, 2 мМ ЕДТА, 10% глицерин, 300 мМ NaCl) и наносили на колонку с хитиновыми гранулами (2×5 cm). Колонку промывали буфером Б до исчезновения поглощения на A280, отбирали аликвоту сорбента и использовали для определения активности оксидазы ( -кетокислотный метод) и общего белка. Этапы очистки и иммобилизации отражены в Таблице 2. -кетокислотный метод) и общего белка. Этапы очистки и иммобилизации отражены в Таблице 2.
| Таблица 2 |
| Очистка и иммобилизация DAOcbd |
| Этап очистки |
Общий белок (мг) |
Активность оксидазы (мкмоль/мин) |
Выход, % |
Степень очистки (раз) |
Общая
(Е) |
Удельная (Е/мг) |
| Бесклеточный экстракт |
905 |
16290 |
18 |
100 |
1 |
| Сульфат-аммонийный осадок (60%) |
325 |
13030 |
40 |
80 |
2,2 |
| Иммобилизация на хитиновом сорбенте |
125 |
10590 |
85 |
65 |
4,7 |
| Примечание: в опыт взято 10 г влажной биомассы E.coli |
Определенная нами удельная активность гибридного белка DAOcbd в иммобилизованном состоянии составляет 85 ед/мг белка, что по существу соответствует известным из литературы показателям удельной активности (95 ед/мг) не иммобилизованной рекомбинантной DAO, экспрессированной в Е.coli в виде простого (не гибридного) белка [3, 7]. Это позволяет сделать вывод, что созданная конструкция химерного белка является функционально активной и в полной мере сохраняющей свойства обоих входящих в нее компонентов. Получение активной DAO в предложенной комбинации с хитинсвязывающим доменом существенно облегчает очистку целевого белка, причем в результате проведения процесса очистки образуется иммобилизованная форма фермента, пригодная как для непосредственного использования в технологическом процессе, так и для последующей «пришивки» к другим носителям, в частности для дополнительного повышения стабильности и долговечности ферментного препарата.
 











Формула изобретения
1. Рекомбинантная ДНК, которая кодирует функционально активный гибридный белок (DAOcbd), состоящий из оксидазы D-аминокислот Trigonopsis variabilis и хитинсвязывающего домена хитиназы A1 Bacillus circulans, и характеризуется нуклеотидной последовательностью SEQ ID №13.
2. Рекомбинантная плазмида pVR1, обеспечивающая синтез гибридного белка TvDAOcbd в клетках Escherichia coli и состоящая из фрагмента ДНК, представляющего собой рекомбинантную ДНК по п.1 (SEQ ID №13), кодирующую названный гибридный белок, и NdeI/XhoI фрагмента плазмиды pET-TetR, полученной путем замены гена бета-лактамазы в векторе рЕТ23 геном устойчивости к тетрациклину (Tetr) в обратной ориентации.
3. Рекомбинантный штамм Escherichia coli C41(DE3)/pVR1-продуцент функционально активного гибридного белка TvDAOcbd.
РИСУНКИ
|
|