|
(21), (22) Заявка: 2006107774/15, 13.03.2006
(24) Дата начала отсчета срока действия патента:
13.03.2006
(46) Опубликовано: 10.11.2007
(56) Список документов, цитированных в отчете о
поиске:
ТОКАРЕВ Ю.Н. и др. Иммунохимический метод диагностики ряда гемоглобинопатий. – Метод. рекомендации/ ЦНИИ гематологии и переливания крови. Азерб. НИИ гематологии и переливания крови. – Баку: Новая книжная типография, 1982, с.9. US 20020081014 A1, 27.06.2002. TURPEINEN U. et al. Determination of fetal hemoglobin by time-resolved immunofluorometric
Адрес для переписки:
414000, г.Астрахань, ул. Бакинская, 121, ГОУ ВПО Астраханская государственная медицинская академия, инженеру-патентоведу С.А. Голубкиной
|
(72) Автор(ы):
Кривенцев Юрий Алексеевич (RU),
Никулина Дина Максимовна (RU),
Бисалиева Рината Альбкалиевна (RU)
(73) Патентообладатель(и):
Кривенцев Юрий Алексеевич (RU)
|
(54) СПОСОБ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ ФЕТАЛЬНОГО ГЕМОГЛОБИНА ЧЕЛОВЕКА
(57) Реферат:
Изобретение относится к области медицины, а именно к лабораторной диагностике. Сущность способа: количественное определение фетального гемоглобина (HbF) проводят иммунологически в гелевом носителе с содержащимися в нем специфическими антителами к фетальному гемоглобину. Способ осуществляют с помощью ракетного электрофореза в агаровом геле в соотношении 20 мл геля на 0,5 мл антисыворотки, исследуемые образцы антигена предварительно смешивают с 0,2% водным раствором додецилсульфата натрия в равной объемной пропорции, а полученные в результате электрофореза высушенные пластинки геля окрашивают 0,3% раствором гваякола на 0,1 М ацетатном буфере рН 4,6 с 0,2% MnCl2 и 0,1% перекиси водорода. Концентрацию HbF определяют по стандартным калибровочным кривым. Использование способа позволяет повысить эффективность и точность количественного определения HbF. 2 ил.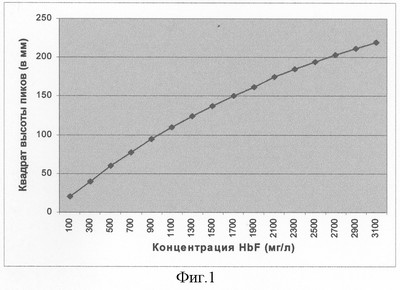
(56) (продолжение):
CLASS=”b560m”assay. – Clin. Chem., 1992, Oct., Vol.38, №10, pp.2013-2018 (реферат) [он-лайн]. Найдено из базы данных Entrez PabMed PMID: 1382895 [найдено 12.01.2007]. MARIO N. et al. Qualitative and quantitative analysis of hemoglobin variants by capillary isoelectric focusing. – J. Chromatogr. B. Biomed. Sci. Appl., 1998, Feb., Vol.27 №706(1), pp 123-129 (реферат) [он-лайн]. Найдено из базы данных Entrez PabMed PMID: 9544814 [найдено 12.01.2007]. NFVENOT J.M. et al. New method for quantitative determination of fetal hemoglobin-containing red blood cells by flow cytometry: application to sickle-cell disease. – Cytometry, 1998, Jul., Vol.1, №32 (3), pp.186-190 (реферат) [он-лайн]. Найдено из базы данных Entrez PabMed PMID: 9667507 [найдено 12.01.2007].
Изобретение относится к области медицины, а именно к биохимии, и может быть использовано для количественного определения фетального гемоглобина человека (HbF).
Недостатками известного способа являются:
– трудоемкость, сложность используемых методов;
– невысокая точность определения;
– низкая разрешающая способность;
– низкая достоверность результатов при определении малых величин гемоглобина;
– низкая специфичность: этим способом регистрируется щелочеустойчивая фракция гемоглобина, к которой можно отнести как фетальный, так и примитивный (эмбриональный) типы гемоглобина.
4)2SO4 и определением концентрации оставшегося в супернатанте гемоглобина спектрофотометрически при длине волны 540 нм.
Однако известный способ имеет следующие недостатки:
– низкая достоверность результатов при определении малых величин гемоглобина;
– невысокая точность определения;
– неполная специфичность: этим способом регистрируется щелочеустойчивая фракция гемоглобина, к которой можно отнести как фетальный, так и примитивный (эмбриональный) типы гемоглобина;
– применение в ходе определения токсических реагентов.
Недостатками прототипа являются:
– длительность технологического процесса с учетом начальных этапов до окончательного анализа (от 18 до 36 часов);
– методика не автоматизирована и все манипуляции проводятся вручную, что влечет погрешности в результатах, связанные с индивидуальными профессиональными качествами лаборанта;
– недостаточная достоверность получаемых результатов, вынуждающая проводить повторные определения;
– вынужденные затраты времени при проведении повторных определений;
– невысокая разрешающая способность при слишком высоких и низких концентрациях антигена.
Целью предлагаемого способа является повышение эффективности и точности количественного определения HbF.
Поставленная цель в изобретении достигается тем, что определение фетального гемоглобина проводят методом ракетного электрофореза в агаровом геле при соотношении 20 мл геля на 0,5 мл антисыворотки, исследуемые образцы антигена предварительно смешивают с 0,2% водным раствором додецилсульфата натрия в равной объемной пропорции, а полученные в результате электрофореза высушенные пластинки геля окрашивают 0,3% раствором гваякола на 0,1 М ацетатном буфере рН 4,6 с 0,2% MnCl2 и 0,1% перекиси водорода.
Предлагаемый способ основан на том, что при обработке белковых препаратов раствором додецилсульфата натрия (ДСН) в результате неселективной сорбции данного вещества на молекулы белка антигены приобретают выраженный отрицательный заряд, что значительно повышает скорость их электрофоретической миграции к аноду. Практическая значимость этого феномена наиболее применима к гемоглобину, поскольку количественное определение этого белка в нативном состоянии (без обработки ДСП) методом ракетного электрофореза крайне затруднительно, т.к. электрофоретическая подвижность HbF (и других типов гемоглобина) близка к таковой у антител (IgG) агарового носителя, что усложняет (или делает невозможным) образование пиков преципитации.
В ходе разработки предлагаемого способа выявлены оптимальные параметры проведения методики: состав, ионная сила и рН рабочего буфера, рабочие напряжение и сила тока при электрофорезе, его длительность, природа и концентрация обрабатывающего вещества (ДСН), рабочие разведения исследуемых образцов, методика специфического окрашивания электрофоретического препарата. Кроме того, смоделирована рабочая калиброворчная кривая (фиг.1) для определения концентрации HbF в исследуемых растворах предлагаемым методом.
Авторами использовались чистые препараты HbF и моноспецифические антисыворотки к HbF, полученные самостоятельно и прошедшие строгий контроль чистоты и специфичности.
Предлагаемый способ был успешно апробирован в научной лаборатории кафедры биохимии с курсом клинической лабораторной диагностики Астраханской государственной медицинской академии в течение 2004-2005 гг.
Ниже приводятся результаты апробации:
Пример №1:
Для количественного анализа HbF использовали метод ракетного электрофореза в агаровом геле в варианте Laurell С.В. и Merrill D. (Laurell С.В., Scand. J. Clin. Lab. Invest. – 1972. – 29. – Suppl, 124. – p.21).
Готовили 1% золь агарозы в веронал-мединаловом буфере рН 8,6 с ионной силой 0,05. После охлаждения золя до 56°С его смешивали с моновалентной антисывороткой на HbF в соотношении 20 мл золя на 0,5 мл антисыворотки (работать рекомендуется с самым большим разведением антисыворотки, при котором еще возможно образование видимого преципитата). Смесь быстро заливали на заранее приготовленные стандартные стеклянные электрофоретические пластинки размером 90×120 мм до достижения агаровым слоем толщины 2 мм. В агаровом слое делали лунки диаметром 2 мм, ближе к катодному концу пластины. Лунки располагали на расстоянии не менее 6 мм друг от друга и 1,5 см от краев геля. В лунки вносили смесь исследуемых образцов, предварительно смешанную с 0.2% раствором ДСН в соотношении 1:1.
Электрофорез проводили при низком напряжении тока 50 V и низкой силе тока 10 мА. Длительность проведения электрофореза 8 часов.
После проведения электрофореза непреципитированные белки удаляли слоями фильтровальной бумаги толщиной 2-3 см под давлением 10 г/см2. Затем гель многократно промывали вначале 0,9% раствором NaCl, затем дистиллированной водой. Процедуру повторяли.
Сухие пластинки геля подвергали специфическому окрашиванию в растворе, полученном следующим образом: 0,2 г гваякола в 50 мл ледяной уксусной кислоты добавляли в 0,1 М ацетатный буфер рН 4,6 до 0,3% концентрации. Туда же добавляли хлорид марганца (II) до 0,2% и перекись водорода до 0,1%. Экспозиция окрашивания 45 мин. В результате окраски гемоглобиновые преципитаты приобретают голубой цвет. Стекла фотографировали в отраженно-рассеянном свете.
Для стандартизации расчета концентрации HbF проводили ракетный электрофорез вышеописанным способом чистых препаратов HbF с известной концентрацией (определяемой иммунохимическими и оптическим методами) в различных разведениях. Высоты образующихся пиков преципитации соотносили с соответствующими концентрациями стандартных препаратов HbF и на основе полученных данных строили калибровочные кривые. Итоговая стандартная калибровочная кривая для количественного определения HbF (фиг.1) была построена по усредненным данным множества идентичных экспериментов.
Вывод: Параметры и условия эксперимента в данном примере оказались оптимальными. Регистрировалось иммунохимическое проявление, т.к. обработка образцов ДСН обеспечивала значительное увеличение электрофоретической подвижности HbF без нарушения структуры белка. Концентрация антител в агаровом геле обеспечивала образование четких пиков преципитации HbF-антитело (см. фиг.2, лунки 1-2 – образцы HbF, не обработанные ДСН; лунки 3-7 – образцы HbF, обработанные ДСН), а окраска препаратов гваяколовым раствором не только усиливала интенсивность преципитата, но и служила дополнительным подтверждением специфичности определения.
Пример №2
Количественное определение HbF ракетным электрофорезом проводили по методике примера №1, но со следующим отличием: агаровый золь до смешивали с моновалентной антисывороткой на HbF в соотношении 20 мл золя на 0,2 мл антисыворотки.
Вывод: Полученные в результате ракетного электрофореза пики были четко ограниченными, но их интенсивность была неудовлетворительна, что, очевидно, объяснялось неадекватным количеством введенных в агаровый носитель антител на HbF.
Пример №3
Определение концентрации HbF ракетным электрофорезом проводили по методике примера №1, но со следующим отличием: охлажденный до 56°С агар смешивали с моновалентной антисывороткой на HbF в соотношении 20 мл агара на 1,0 мл антисыворотки.
Вывод: Визуальная характеристика полученных пиков преципитации не имела принципиальных отличий от таковых в экспериментах примера №4, но затраты антисыворотки при этом были большими. Следовательно, параметры данного эксперимента оптимальными считать нельзя.
Пример №4
Определение концентрации HbF ракетным электрофорезом проводили по методике примера №1, но со следующими отличиями: электрофорез проводили при напряжении тока 150 V и силе тока 20-30 мА в течение 3-4 часов.
Вывод: Эксперименты, проведенные вышеописанным способом, можно считать относительно удачными, т.к. регистрировалось иммунохимическое проявление, т.к. обработка образцов ДСН обеспечивала значительное увеличение электрофоретической подвижности HbF без нарушения структуры белка. Но образующиеся пики преципитации были нечеткими и размазанными, что можно объяснить слишком «жесткими» условиями электрофореза: высокой силой тока и напряжением.
Пример №5
Количественное определение HbF ракетным электрофорезом проводили по методике примера №1, но со следующим отличием: исследуемые образцы вносили в лунки без обработки раствором ДСН.
Вывод: Эксперименты, проведенные вышеописанным способом, были неудачны, поскольку пики преципитации не образовывались, что видно на фиг.2 (лунки 1-2 – образцы HbF, не обработанные ДСН; лунки 3-7 – образцы HbF, обработанные ДСН). Объясняется это тем, что электрофоретическая подвижность HbF (и других типов гемоглобина) близка к таковой у антител (IgG) агарового носителя, что усложняет образование пиков преципитации.
Предлагаемый способ имеет следующие преимущества:
– абсолютная селективность регистрации только фетального гемоглобина, обеспечиваемая специфичностью моновалентной антисыворотки на HbF и подтверждаемая гваяколовой окраской препаратов;
– значительное упрощение способа: нет необходимости в очистке гемоглобина и его обработке адаптирующими реагентами, для проведения анализа достаточно свежей цитратной крови;
– высокая чувствительность метода (нижний порог чувствительности от 1 мг/л);
– высокая точность получаемых результатов; исключается проведение повторных определений (максимальная погрешность±2%);
– высокая достоверность определения, в том числе и при определении малых величин гемоглобина (p 0,01); 0,01);
– экономия трудозатрат за счет сокращения времени методики (длительность технологического процесса с учетом начальных этапов до окончательного анализа не более 12 часов).
Формула изобретения
Способ количественного определения фетального гемоглобина человека, включающий иммуноанализ, проводимый в гелевом носителе с содержащейся в нем специфической антисывороткой к фетальному гемоглобину и последующим определением концентрации этого белка по стандартным калибровочным кривым, отличающийся тем, что определение фетального гемоглобина проводят методом ракетного электрофореза в агаровом геле, при соотношении: 20 мл геля на 0,5 мл антисыворотки, исследуемые образцы антигена предварительно смешивают с 0,2% водным раствором додецилсульфата натрия в равной объемной пропорции, а полученные в результате электрофореза высушенные пластинки геля окрашивают 0,3% раствором гваякола на 0,1 М ацетатном буфере рН 4,6 с 0,2% MnCl2 и 0,1% перекиси водорода.
РИСУНКИ
MM4A – Досрочное прекращение действия патента СССР или патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 14.03.2008
Извещение опубликовано: 20.02.2010 БИ: 05/2010
|