Патент на изобретение №2158916
|
||||||||||||||||||||||||||
(54) УСТРОЙСТВО И СПОСОБ ПРОВЕДЕНИЯ КОЛИЧЕСТВЕННОГО АНАЛИЗА СРОДСТВА С ИСПОЛЬЗОВАНИЕМ ФЛУОРЕСЦЕНТНЫХ МЕТОК
(57) Реферат: Изобретение относится к устройству и способу для проведения, в частности, количественного флуоресцентного иммунотеста с помощью возбуждения кратковременным полем. В устройстве применяют по меньшей мере один источник излучения, близкого монохроматическому и имеющего длину волны, которая вызывает флуоресценцию маркировочного материала, связанного с антителом. Излучение направляют под углом, определяющим заданную глубину проникновения для кратковременного поля, на поверхность раздела между оптически прозрачным экраном из материала с коэффициентом преломления n1, большим коэффициента преломления материала, расположенного над поверхностью раздела, и приемной полостью для образца, имеющей форму кюветы. Приемную полость закрывают покровной пластиной со стороны, противоположной экрану, а с той стороны экрана, где расположен источник света, размещают детектор для регистрации флуоресцентного излучения. Способ включает анализ компонентов, иммобилизованных на поверхности приемной полости. Технический результат – упрощение устройства и способа количественного анализа сродства биохимических компонентов. 2 с. и 28 з.п. ф-лы, 12 ил. Изобретение относится, в частности, к устройству для проведения количественного анализа сродства с применением флуоресцентных меток, возбуждаемых кратковременным полем. В основу такого анализа могут быть положены самые различные известные биохимические методики исследования систем рецептор – лиганд вообще, как, например, антитело – антиген, лектин – углевод, ДНК или РНК – комплементарные нуклеиновые кислоты, ДНК или РНК – белок, рецептор к гормону, фермент – кофакторы фермента, иммуноглобин – G-белок или A-белок, или авидин – биотин. Однако наиболее предпочтительной является система антитело – антиген. Флуоресцентные иммунотесты, а также флуоресцентные иммуносенсоры используют систему антитело-антиген и широко применяются на практике в течение довольно длительного времени. Они служат в основном для того, чтобы количественно определить неизвестное содержание определенного химического или биохимического вещества в жидкой матрице образца. При этом антитела селективно связываются с определяемым веществом. Определяемое вещество специалисты называют также антигеном. При флуоресцентных иммунотестах специфические для анализируемого компонента антитела помечают маркировочным составом, который возбуждается оптическим излучением с определенной для этого материала длиной волны  ex , излучая флуоресцентный свет с другой длиной волны, как правило большей. При этом используется соответствующий детектор, измеряющий интенсивность флуоресцентного излучения. Использование кратковременного возбуждения поля при проведении таких флуоресцентных иммунотестов по отношению к флуоресцентным иммуносенсорам уже известно из уровня техники. Так, например, различные технические решения уже описаны в WO 94/27137, R.A. Badlay, R.A.L. Drake, I.А. Shanks, F.R.S., в A.M.Smith и P.R. Stephenson “Optical biosensors for immunoassays: fluorescence capillary-fill device”, (“Оптические биосенсоры для иммунологических исследований: флуоресцентное устройство с капиллярным заполнением”) Phil. Trans. R. soc. Lund. В 316, 143-160 (1987) и D. Christensen, S. Dyer, D. Fowers и J. Herron, “Analysis of Exitation and Collection Geometries for Planar Waveguide Immunosensors” (“Анализ возбуждения и геометрических параметров планарных волноводных иммуносенсоров”), Proc. SPIE-Int. Soc. Opt. Eng. Vol. 1986, Fiber Optic Sensors in Medical Diagnostics (Оптические волоконные датчики в медицинской диагностике), 2 – 8 (1993). Однако известные решения обладают общим недостатком, который заключается в относительно высокой сложности и стоимости конструкции, обеспечивающей сопряжение со световодом излучения, которое необходимо для получения флуоресценции и/или вывода флуоресцентного излучения, при этом указанная конструкция является важной составной частью обычных устройств, применяющихся до сих пор.
Наряду с этим в патенте США 3939350 описано решение, которое позволяет проводить флуоресцентные иммунологические исследования посредством кратковременного поля возбуждения.
При этом световое излучение от источника света направляют под определенным углом через призму на поверхность раздела таким образом, что происходит полное отражение, и флуоресценцию, вызываемую в образце, можно измерять детектором. При этом весь образец помещают в замкнутое герметичное пространство, и вследствие относительно большого объема образца только в момент прекращения диффузии возможно проведение измерения, которое будет неизбежно содержать погрешности.
В патентной заявке WO 90/05295 описана оптическая биосенсорная система, в которой с помощью дорогостоящей оптики излучение возбуждения в чувствительной области можно направлять на сложную канальную систему, через которую посредством управляемых вентилей и насосов пропускают объем образца, а флуоресцентное излучение в чувствительной области выводят через специальное окно и направляют на детектор для измерения интенсивности. Наряду с уже упомянутыми недостатками, связанными со сложностью и трудоемкостью изготовления системы, следует указать на необходимость очистки насосов и всей канальной системы до и/или после проведения анализа, чтобы исключить последующие ошибки измерения.
В патентной заявке WO 90/06503 описан чувствительный элемент, в котором излучение возбуждения направляют под определенным углом через оптически прозрачную подложку на поверхность раздела к оптически прозрачному переходному слою, на который нанесен дополнительный волноводный слой, с которым в свою очередь связаны анализируемые компоненты.
При этом коэффициент преломления у переходного слоя меньше, чем у подложки и волновода. На поверхности раздела между подложкой и переходным слоем происходит полное отражение за счет выбора соответствующего угла падения возбуждающего излучения, при этом возникает кратковременное поле, которое обеспечивает ввод возбуждающего излучения в волновод, расположенный над переходным слоем. Это излучение проходит по волноводу вследствие полного внутреннего отражения, и образующееся при этом кратковременное поле используется, соответственно, для возбуждения флуоресцентного излучения.
Образец может быть помещен в одну или несколько полостей, при этом соответствующие размеры такой полости ограничены только необходимостью подачи образца в полость за счет капиллярных сил. После заполнения полости образцом дальнейший поток или перемещение образца прекращаются.
В патентной заявке WO 89/09408 A1 приведено аналогичное решение, которое также использует источник света для генерации возбуждающего излучения и детектор флуоресцентного излучения, расположенные с одной стороны. Анализируемый образец подают в полость, образованную между волноводом и покровной пластиной. В этом случае после заполнения полости образцом также прекращаются дальнейший поток или перемещение образца.
В связи с изложенным задачей настоящего изобретения является создание весьма простого устройства для проведения количественного анализа сродства различных известных биохимических компонентов с помощью флуоресцентных меток.
Согласно формуле изобретения эта задача решается с помощью признаков, указанных в отличительной части пункта 1 для устройства и признаков пункта 2 для способа. Предпочтительные варианты выполнения и усовершенствования изобретения обеспечиваются при использовании признаков, указанных в зависимых пунктах.
С помощью устройства согласно изобретению можно проводить флуоресцентные иммунотесты в различных процессах (анализах) и другие количественные анализы сродства с помощью флуоресцентных меток. При этом возникает возможность проведения конкурентных анализов, а также использования методик типа “сэндвич” и других известных форм анализа.
С устройством согласно изобретению работают так же, как с другими устройствами, известными в данной области. При этом в качестве маркировочного материала используют флуорофор, которым наносят метки на антитела, специфические для анализируемого компонента. Связанный флуорофор возбуждается возбуждающим кратковременным полем, и интенсивность флуоресцентного излучения, возникающего при этом, позволяет установить количество меченых антител и, соответственно, количественно определять анализируемый компонент.
В устройстве согласно изобретению свет от источника направляют под углом ex , излучая флуоресцентный свет с другой длиной волны, как правило большей. При этом используется соответствующий детектор, измеряющий интенсивность флуоресцентного излучения. Использование кратковременного возбуждения поля при проведении таких флуоресцентных иммунотестов по отношению к флуоресцентным иммуносенсорам уже известно из уровня техники. Так, например, различные технические решения уже описаны в WO 94/27137, R.A. Badlay, R.A.L. Drake, I.А. Shanks, F.R.S., в A.M.Smith и P.R. Stephenson “Optical biosensors for immunoassays: fluorescence capillary-fill device”, (“Оптические биосенсоры для иммунологических исследований: флуоресцентное устройство с капиллярным заполнением”) Phil. Trans. R. soc. Lund. В 316, 143-160 (1987) и D. Christensen, S. Dyer, D. Fowers и J. Herron, “Analysis of Exitation and Collection Geometries for Planar Waveguide Immunosensors” (“Анализ возбуждения и геометрических параметров планарных волноводных иммуносенсоров”), Proc. SPIE-Int. Soc. Opt. Eng. Vol. 1986, Fiber Optic Sensors in Medical Diagnostics (Оптические волоконные датчики в медицинской диагностике), 2 – 8 (1993). Однако известные решения обладают общим недостатком, который заключается в относительно высокой сложности и стоимости конструкции, обеспечивающей сопряжение со световодом излучения, которое необходимо для получения флуоресценции и/или вывода флуоресцентного излучения, при этом указанная конструкция является важной составной частью обычных устройств, применяющихся до сих пор.
Наряду с этим в патенте США 3939350 описано решение, которое позволяет проводить флуоресцентные иммунологические исследования посредством кратковременного поля возбуждения.
При этом световое излучение от источника света направляют под определенным углом через призму на поверхность раздела таким образом, что происходит полное отражение, и флуоресценцию, вызываемую в образце, можно измерять детектором. При этом весь образец помещают в замкнутое герметичное пространство, и вследствие относительно большого объема образца только в момент прекращения диффузии возможно проведение измерения, которое будет неизбежно содержать погрешности.
В патентной заявке WO 90/05295 описана оптическая биосенсорная система, в которой с помощью дорогостоящей оптики излучение возбуждения в чувствительной области можно направлять на сложную канальную систему, через которую посредством управляемых вентилей и насосов пропускают объем образца, а флуоресцентное излучение в чувствительной области выводят через специальное окно и направляют на детектор для измерения интенсивности. Наряду с уже упомянутыми недостатками, связанными со сложностью и трудоемкостью изготовления системы, следует указать на необходимость очистки насосов и всей канальной системы до и/или после проведения анализа, чтобы исключить последующие ошибки измерения.
В патентной заявке WO 90/06503 описан чувствительный элемент, в котором излучение возбуждения направляют под определенным углом через оптически прозрачную подложку на поверхность раздела к оптически прозрачному переходному слою, на который нанесен дополнительный волноводный слой, с которым в свою очередь связаны анализируемые компоненты.
При этом коэффициент преломления у переходного слоя меньше, чем у подложки и волновода. На поверхности раздела между подложкой и переходным слоем происходит полное отражение за счет выбора соответствующего угла падения возбуждающего излучения, при этом возникает кратковременное поле, которое обеспечивает ввод возбуждающего излучения в волновод, расположенный над переходным слоем. Это излучение проходит по волноводу вследствие полного внутреннего отражения, и образующееся при этом кратковременное поле используется, соответственно, для возбуждения флуоресцентного излучения.
Образец может быть помещен в одну или несколько полостей, при этом соответствующие размеры такой полости ограничены только необходимостью подачи образца в полость за счет капиллярных сил. После заполнения полости образцом дальнейший поток или перемещение образца прекращаются.
В патентной заявке WO 89/09408 A1 приведено аналогичное решение, которое также использует источник света для генерации возбуждающего излучения и детектор флуоресцентного излучения, расположенные с одной стороны. Анализируемый образец подают в полость, образованную между волноводом и покровной пластиной. В этом случае после заполнения полости образцом также прекращаются дальнейший поток или перемещение образца.
В связи с изложенным задачей настоящего изобретения является создание весьма простого устройства для проведения количественного анализа сродства различных известных биохимических компонентов с помощью флуоресцентных меток.
Согласно формуле изобретения эта задача решается с помощью признаков, указанных в отличительной части пункта 1 для устройства и признаков пункта 2 для способа. Предпочтительные варианты выполнения и усовершенствования изобретения обеспечиваются при использовании признаков, указанных в зависимых пунктах.
С помощью устройства согласно изобретению можно проводить флуоресцентные иммунотесты в различных процессах (анализах) и другие количественные анализы сродства с помощью флуоресцентных меток. При этом возникает возможность проведения конкурентных анализов, а также использования методик типа “сэндвич” и других известных форм анализа.
С устройством согласно изобретению работают так же, как с другими устройствами, известными в данной области. При этом в качестве маркировочного материала используют флуорофор, которым наносят метки на антитела, специфические для анализируемого компонента. Связанный флуорофор возбуждается возбуждающим кратковременным полем, и интенсивность флуоресцентного излучения, возникающего при этом, позволяет установить количество меченых антител и, соответственно, количественно определять анализируемый компонент.
В устройстве согласно изобретению свет от источника направляют под углом  к поверхности раздела двух сред, имеющих различные коэффициенты преломления. При этом выбирают такой источник, который излучает почти монохроматический свет с одной длиной волны, способный возбудить маркировочный материал, в данном случае – флуорофор. В качестве источника излучения предпочтительными являются лазерные диоды, поскольку они обеспечивают соответствующий профиль излучения и обладают достаточной мощностью излучения при малых конструктивных размерах и незначительном потреблении энергии.
Однако могут быть использованы и другие источники монохроматического излучения.
При этом необходимо обращать внимание на то, чтобы все оптически прозрачные элементы были прозрачными для излучения с используемой длиной волны.
Глубину проникновения d кратковременного поля определяют угол к поверхности раздела двух сред, имеющих различные коэффициенты преломления. При этом выбирают такой источник, который излучает почти монохроматический свет с одной длиной волны, способный возбудить маркировочный материал, в данном случае – флуорофор. В качестве источника излучения предпочтительными являются лазерные диоды, поскольку они обеспечивают соответствующий профиль излучения и обладают достаточной мощностью излучения при малых конструктивных размерах и незначительном потреблении энергии.
Однако могут быть использованы и другие источники монохроматического излучения.
При этом необходимо обращать внимание на то, чтобы все оптически прозрачные элементы были прозрачными для излучения с используемой длиной волны.
Глубину проникновения d кратковременного поля определяют угол  , под которым излучаемый свет падает на поверхность раздела, коэффициенты преломления материала, расположенного перед поверхностью раздела по ходу луча, и смежного с ним материала, а также длина волны излучения. При этом коэффициент преломления n1 материала, расположенного перед поверхностью раздела по ходу луча, должен обеспечивать полное внутреннее отражение у поверхности раздела и поэтому должен быть больше, чем коэффициент преломления n2 другого, расположенного за ним материала при длинах волн применяемых источников излучения. Угол , под которым излучаемый свет падает на поверхность раздела, коэффициенты преломления материала, расположенного перед поверхностью раздела по ходу луча, и смежного с ним материала, а также длина волны излучения. При этом коэффициент преломления n1 материала, расположенного перед поверхностью раздела по ходу луча, должен обеспечивать полное внутреннее отражение у поверхности раздела и поэтому должен быть больше, чем коэффициент преломления n2 другого, расположенного за ним материала при длинах волн применяемых источников излучения. Угол  предпочтительно выбирают таким образом, чтобы обеспечить справедливость неравенства: sin ( предпочтительно выбирают таким образом, чтобы обеспечить справедливость неравенства: sin ( ) > n2/n1. Если это условие выполняется, то весь свет отражается на поверхности раздела и тем самым обеспечивается полное отражение. Однако практически даже при выполнении этого условия относительно малая часть света проходит через поверхность раздела в материал, который расположен за поверхностью раздела по ходу луча, что вызывает появление кратковременного поля. Глубину проникновения d определяют как расстояние от поверхности раздела, на котором интенсивность кратковременного поля уменьшается в 1/e раз, где e – основание натуральных логарифмов. Глубину проникновения d можно рассчитать при помощи следующего уравнения: ) > n2/n1. Если это условие выполняется, то весь свет отражается на поверхности раздела и тем самым обеспечивается полное отражение. Однако практически даже при выполнении этого условия относительно малая часть света проходит через поверхность раздела в материал, который расположен за поверхностью раздела по ходу луча, что вызывает появление кратковременного поля. Глубину проникновения d определяют как расстояние от поверхности раздела, на котором интенсивность кратковременного поля уменьшается в 1/e раз, где e – основание натуральных логарифмов. Глубину проникновения d можно рассчитать при помощи следующего уравнения: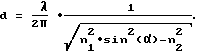 При длине волны  = 700 нм, коэффициенте преломления n1 = 1,51 и коэффициенте преломления n2 = 1,34 для угла падения луча = 700 нм, коэффициенте преломления n1 = 1,51 и коэффициенте преломления n2 = 1,34 для угла падения луча  = 65o глубина проникновения d получается равной около 400 нм, а для угла падения луча = 65o глубина проникновения d получается равной около 400 нм, а для угла падения луча  = 80o глубина проникновения d составляет около 173 нм. Из этого следует, что кратковременное поле может оптически возбуждать только такие маркировочные материалы, которые находятся в непосредственной близости от поверхности раздела. При проведении иммунных тестов, следовательно, могут возбуждаться только маркировочные материалы антител или антигенов, которые связаны на поверхности раздела. Поэтому интенсивность флуоресцентного излучения таких флуорофоров прямо пропорциональна концентрации связанных на поверхности меченых антител и в зависимости от применяемого биохимического анализа прямо или обратно пропорциональна концентрации антигенов.
Таким образом, в устройстве согласно изобретению используют по меньшей мере один источник, который излучает почти монохроматический свет, направляемый на прозрачный для этого света экран под заданным углом = 80o глубина проникновения d составляет около 173 нм. Из этого следует, что кратковременное поле может оптически возбуждать только такие маркировочные материалы, которые находятся в непосредственной близости от поверхности раздела. При проведении иммунных тестов, следовательно, могут возбуждаться только маркировочные материалы антител или антигенов, которые связаны на поверхности раздела. Поэтому интенсивность флуоресцентного излучения таких флуорофоров прямо пропорциональна концентрации связанных на поверхности меченых антител и в зависимости от применяемого биохимического анализа прямо или обратно пропорциональна концентрации антигенов.
Таким образом, в устройстве согласно изобретению используют по меньшей мере один источник, который излучает почти монохроматический свет, направляемый на прозрачный для этого света экран под заданным углом  , обеспечивающим глубину проникновения d для кратковременного поля. Коэффициент преломления n1 экрана должен быть более 1,33. С другой стороны экрана под покровной пластиной имеется полость в форме кюветы. Между экраном и полостью в форме кюветы находится указанная поверхность раздела, поэтому кратковременное поле, которое проникает на заданную глубину d внутрь полости, имеющей форму кюветы, может воздействовать на связанного на поверхности, меченого химического или биохимического партнера рецепторно-лигандной системы и возбуждать флуорофор, применяемый в качестве маркировочного материала.
Соответствующую интенсивность вызванной при этом флуоресценции измеряют с помощью детектора. Для этого детектор располагают с той же стороны экрана, что и источник излучения.
В качестве детектора можно использовать отдельный светочувствительный детектор, а также линейную или плоскостную схему расположения, включающую несколько светочувствительных детекторов.
Хотя при использовании лазерных диодов излучаемый свет является почти монохроматическим, однако в лазерном излучении все-таки наблюдается флуоресцентный фон с небольшой шириной спектра. По этой причине между источником света и экраном предпочтительно установить узкополосный фильтр для возбуждающего излучения, который предпочтительно имеет ширину полосы спектра < 10 нм и пропускает излучение источника только в этом узко ограниченном диапазоне длин волн.
Предпочтительно также установить перед детектором второй фильтр с относительно широкой полосой пропускания (эмиссионный фильтр). Этот фильтр препятствует попаданию на детектор излучения, рассеянного в материале экрана и на поверхности раздела при отражении, и предотвращает искажение результатов измерения. В качестве обоих фильтров предлагается использовать соответствующие интерференционные фильтры, краевые фильтры или комбинацию этих двух вариантов.
Особенно предпочтительно облучать анализируемые образцы поляризованным светом. Для этого после источника света на траектории излучения можно установить поляризатор.
При возбуждении поляризованным светом и детектировании предпочтительно ограничить подвижность флуорофоров, которыми помечены антитела, прочно связанные на поверхности. В этом случае их флуоресцентное излучение ориентируется точно в той же плоскости поляризации, что и излучение возбуждения, и его интенсивность может быть измерена детектором.
В противоположность этому флуоресцентное излучение флуорофоров химических или биохимических веществ (антител), которые не связаны с поверхностью и вследствие этого могут свободно перемещаться, ориентировано в других плоскостях поляризации. При использовании поляризованного света для возбуждения можно подавлять флуоресцентное излучение флуорофоров, связанных с антителами или антигенами и находящихся в пределах досягаемости кратковременного поля, однако не связанных с поверхностью. Достоинства поляризованного возбуждения и детектирования становятся понятными, если учесть, что размер антитела составляет около 10 нм, в то время как глубина проникновения кратковременного поля рассматривается примерно до 500 нм. Поляризация при возбуждении и детектировании, когда перед детектором также устанавливают поляризатор, может улучшать отношение полезного сигнала к фону.
Устройство, созданное согласно изобретению, обладает рядом значительных преимуществ по сравнению с применявшимися ранее устройствами. Оно имеет очень простую конструкцию, не предъявляет высоких требований к применяемым оптическим компонентам и, что особенно важно, не ставит никаких специальных условий для ввода излучения возбуждения флуорофора и/или вывода флуоресцентного излучения. Кроме того, устройство позволяет проводить всевозможные биохимические исследования, а изготовление основных узлов устройства не требует высоких затрат, поэтому даже одноразовое использование по меньшей мере его отдельных деталей является возможным. При этом обеспечивается необходимое отделение химических компонентов из объема образца от компонентов, связанных на поверхности.
Это достигается, в частности, за счет изготовления экрана и покровной пластины, а также установленных между ними прокладок из простых и недорогих материалов, которые можно обрабатывать по стандартной технологии. Так, для экрана и покровной пластины можно использовать пластмассу, а для прокладок – биологически совместимую пленку в соответствующей форме, клейкую с обеих сторон.
Прокладка имеет толщину от 0,001 до 10 мм, предпочтительно – от 0,001 до 0,5 мм, и особенно предпочтительно – 50 мкм, и за счет выреза образует приемную полость, заполняемую образцом.
Способ согласно изобретению в основном базируется на том, что образец определенного объема пропускают через полость, имеющую форму кюветы, и подвергают его там воздействию возбуждающего кратковременного поля, как описано выше. Для пропускания определенного объема образца через полость можно использовать силы всасывания и давления, а также капиллярные силы.
При соединении в проточной системе химического или биохимического компонента с его комплементарным химическим или биохимическим компонентом, иммобилизованным на какой-либо поверхности, следует учитывать два механизма переноса вещества, а именно, конвекцию и диффузию. При этом толщина пограничного диффузионного слоя (которая зависит от скорости потока и вязкости) оказывает значительное влияние на процесс соединения, особенно с точки зрения количественных характеристик и скорости. Если диффузионный механизм переноса вещества преобладает при относительно высокой толщине пограничного слоя, то может происходить также разложение уже связанных химических или биохимических компонентов, которое искажает результаты измерения. Изобретение позволяет устранить эту проблему за счет того, что свободное поперечное сечение кюветообразной полости, заполняемой образцом, поддерживается относительно малым, особенно в высоту. С учетом сохранения скорости потока это приводит к тому, что диффузионный пограничный слой непосредственно в зоне детектирования является пренебрежимо тонким. За счет этого измерение можно произвести значительно быстрее с достаточной или даже более высокой чем ранее точностью. Во многих случаях можно даже отказаться от определения по конечной точке, то есть не обязательно учитывать весь объем образца.
В предпочтительном варианте выполнения изобретения в покровной пластине предусмотрена по меньшей мере одна возможность присоединения, по меньшей мере частично представляющая собой отверстие, в которое вставляется или на котором размещается контейнер с образцом, при этом отверстие в покровной пластине расположено с возможностью соединения между контейнером с образцом и кюветообразной полостью. Дополнительно в качестве другой возможности присоединения имеется второе отверстие, которое также связано с кюветообразной полостью.
Второе отверстие также может быть предусмотрено в покровной пластине. К этому второму отверстию может быть подключен внешний насос или использован собственный насос. При этом собственный насос предпочтительно состоит из цилиндрического полого тела, которое вставляется во второе отверстие. В основании цилиндрического полого тела размещен всасывающий материал, например, волокнистая масса или бумага. Цилиндрическое полое тело может быть закрыто пробкой, крышкой или пленкой. При удалении пробки или крышки, а также при проколе отверстия в пленке активируется процесс откачивания.
Изобретение может быть модифицировано далее путем установки в указанный контейнер с образцом гильзы, которая может быть закрыта снизу специальной мембраной. При этом >на мембране могут быть иммобилизованы предпочтительные антигены, а на внутренней стенке гильзы находятся меченые специфические к анализируемому веществу антитела, необходимые для проведения анализа.
Ниже приведено более подробное описание примера осуществления изобретения.
На прилагаемых фигурах показано: , обеспечивающим глубину проникновения d для кратковременного поля. Коэффициент преломления n1 экрана должен быть более 1,33. С другой стороны экрана под покровной пластиной имеется полость в форме кюветы. Между экраном и полостью в форме кюветы находится указанная поверхность раздела, поэтому кратковременное поле, которое проникает на заданную глубину d внутрь полости, имеющей форму кюветы, может воздействовать на связанного на поверхности, меченого химического или биохимического партнера рецепторно-лигандной системы и возбуждать флуорофор, применяемый в качестве маркировочного материала.
Соответствующую интенсивность вызванной при этом флуоресценции измеряют с помощью детектора. Для этого детектор располагают с той же стороны экрана, что и источник излучения.
В качестве детектора можно использовать отдельный светочувствительный детектор, а также линейную или плоскостную схему расположения, включающую несколько светочувствительных детекторов.
Хотя при использовании лазерных диодов излучаемый свет является почти монохроматическим, однако в лазерном излучении все-таки наблюдается флуоресцентный фон с небольшой шириной спектра. По этой причине между источником света и экраном предпочтительно установить узкополосный фильтр для возбуждающего излучения, который предпочтительно имеет ширину полосы спектра < 10 нм и пропускает излучение источника только в этом узко ограниченном диапазоне длин волн.
Предпочтительно также установить перед детектором второй фильтр с относительно широкой полосой пропускания (эмиссионный фильтр). Этот фильтр препятствует попаданию на детектор излучения, рассеянного в материале экрана и на поверхности раздела при отражении, и предотвращает искажение результатов измерения. В качестве обоих фильтров предлагается использовать соответствующие интерференционные фильтры, краевые фильтры или комбинацию этих двух вариантов.
Особенно предпочтительно облучать анализируемые образцы поляризованным светом. Для этого после источника света на траектории излучения можно установить поляризатор.
При возбуждении поляризованным светом и детектировании предпочтительно ограничить подвижность флуорофоров, которыми помечены антитела, прочно связанные на поверхности. В этом случае их флуоресцентное излучение ориентируется точно в той же плоскости поляризации, что и излучение возбуждения, и его интенсивность может быть измерена детектором.
В противоположность этому флуоресцентное излучение флуорофоров химических или биохимических веществ (антител), которые не связаны с поверхностью и вследствие этого могут свободно перемещаться, ориентировано в других плоскостях поляризации. При использовании поляризованного света для возбуждения можно подавлять флуоресцентное излучение флуорофоров, связанных с антителами или антигенами и находящихся в пределах досягаемости кратковременного поля, однако не связанных с поверхностью. Достоинства поляризованного возбуждения и детектирования становятся понятными, если учесть, что размер антитела составляет около 10 нм, в то время как глубина проникновения кратковременного поля рассматривается примерно до 500 нм. Поляризация при возбуждении и детектировании, когда перед детектором также устанавливают поляризатор, может улучшать отношение полезного сигнала к фону.
Устройство, созданное согласно изобретению, обладает рядом значительных преимуществ по сравнению с применявшимися ранее устройствами. Оно имеет очень простую конструкцию, не предъявляет высоких требований к применяемым оптическим компонентам и, что особенно важно, не ставит никаких специальных условий для ввода излучения возбуждения флуорофора и/или вывода флуоресцентного излучения. Кроме того, устройство позволяет проводить всевозможные биохимические исследования, а изготовление основных узлов устройства не требует высоких затрат, поэтому даже одноразовое использование по меньшей мере его отдельных деталей является возможным. При этом обеспечивается необходимое отделение химических компонентов из объема образца от компонентов, связанных на поверхности.
Это достигается, в частности, за счет изготовления экрана и покровной пластины, а также установленных между ними прокладок из простых и недорогих материалов, которые можно обрабатывать по стандартной технологии. Так, для экрана и покровной пластины можно использовать пластмассу, а для прокладок – биологически совместимую пленку в соответствующей форме, клейкую с обеих сторон.
Прокладка имеет толщину от 0,001 до 10 мм, предпочтительно – от 0,001 до 0,5 мм, и особенно предпочтительно – 50 мкм, и за счет выреза образует приемную полость, заполняемую образцом.
Способ согласно изобретению в основном базируется на том, что образец определенного объема пропускают через полость, имеющую форму кюветы, и подвергают его там воздействию возбуждающего кратковременного поля, как описано выше. Для пропускания определенного объема образца через полость можно использовать силы всасывания и давления, а также капиллярные силы.
При соединении в проточной системе химического или биохимического компонента с его комплементарным химическим или биохимическим компонентом, иммобилизованным на какой-либо поверхности, следует учитывать два механизма переноса вещества, а именно, конвекцию и диффузию. При этом толщина пограничного диффузионного слоя (которая зависит от скорости потока и вязкости) оказывает значительное влияние на процесс соединения, особенно с точки зрения количественных характеристик и скорости. Если диффузионный механизм переноса вещества преобладает при относительно высокой толщине пограничного слоя, то может происходить также разложение уже связанных химических или биохимических компонентов, которое искажает результаты измерения. Изобретение позволяет устранить эту проблему за счет того, что свободное поперечное сечение кюветообразной полости, заполняемой образцом, поддерживается относительно малым, особенно в высоту. С учетом сохранения скорости потока это приводит к тому, что диффузионный пограничный слой непосредственно в зоне детектирования является пренебрежимо тонким. За счет этого измерение можно произвести значительно быстрее с достаточной или даже более высокой чем ранее точностью. Во многих случаях можно даже отказаться от определения по конечной точке, то есть не обязательно учитывать весь объем образца.
В предпочтительном варианте выполнения изобретения в покровной пластине предусмотрена по меньшей мере одна возможность присоединения, по меньшей мере частично представляющая собой отверстие, в которое вставляется или на котором размещается контейнер с образцом, при этом отверстие в покровной пластине расположено с возможностью соединения между контейнером с образцом и кюветообразной полостью. Дополнительно в качестве другой возможности присоединения имеется второе отверстие, которое также связано с кюветообразной полостью.
Второе отверстие также может быть предусмотрено в покровной пластине. К этому второму отверстию может быть подключен внешний насос или использован собственный насос. При этом собственный насос предпочтительно состоит из цилиндрического полого тела, которое вставляется во второе отверстие. В основании цилиндрического полого тела размещен всасывающий материал, например, волокнистая масса или бумага. Цилиндрическое полое тело может быть закрыто пробкой, крышкой или пленкой. При удалении пробки или крышки, а также при проколе отверстия в пленке активируется процесс откачивания.
Изобретение может быть модифицировано далее путем установки в указанный контейнер с образцом гильзы, которая может быть закрыта снизу специальной мембраной. При этом >на мембране могут быть иммобилизованы предпочтительные антигены, а на внутренней стенке гильзы находятся меченые специфические к анализируемому веществу антитела, необходимые для проведения анализа.
Ниже приведено более подробное описание примера осуществления изобретения.
На прилагаемых фигурах показано:Фиг. 1 принцип измерения конкурентных образцов. Фиг. 2 принцип измерения флуоресцентного излучения с возбуждением кратковременным полем меченых антител, связанных на поверхности. Фиг. 3 принцип проведения измерения по методике “сэндвич”. Фиг. 4 принцип проведения усовершенствованного конкурентного анализа. Фиг. 5 часть устройства для проведения проточного анализа согласно изобретению. Фиг. 6 схематическое изображение одного из вариантов выполнения устройства с одним источником света согласно изобретению. Фиг. 7 схематическое изображение второго варианта выполнения устройства с двумя источниками света согласно изобретению. Фиг. 8 схематическое изображение другого варианта выполнения устройства с одним источником света согласно изобретению. Фиг. 9 другой вариант выполнения устройства, изображенного на фиг. 6. Фиг. 10 размещение контейнера с образцом и насоса в устройстве согласно изобретению. Фиг. 11 усовершенствование устройства, показанного на фиг. 10, с дополнительно установленной гильзой. Фиг. 12 усовершенствованный вариант исполнения экрана с прокладкой. На фиг. 1 схематично показан принцип проведения измерения при конкурентном испытании. Известное количество специфических к анализируемому веществу антител Ak, меченных флуорофором, смешали с неизвестным определяемым количеством антигенов Ag. При этом количество антител Ak должно быть заведомо больше количества антигенов Ag. Меченые специфические антитела Ak соединяются с антигенами Ag и, поскольку количество меченых антител Ak больше, чем антигенов Ag, несвязанные меченые специфические антитела Ak остаются в избытке. Образующаяся при этом смесь несвязанных, или свободных, меченых специфических антител Ak вступает в контакт с поверхностью (О), на которой был иммобилизован антиген Ag. Для большей наглядности эта фаза анализа отделена на схеме штриховой линией. С иммобилизованными антигенами Ag соединяются свободные меченые антитела Ak, специфические для анализируемого вещества, в то время как уже связанные остаются в растворе над указанной поверхностью. Количество специфических антител Ak, которые связаны с иммобилизованным на поверхности антигеном Ag, обратно пропорционально искомой концентрации антигенов. Количество связанных на поверхности меченых специфических антител Ak можно определить путем возбуждения кратковременным полем и измерения интенсивности флуоресценции. Такой принцип измерения представлен на фиг. 2. Здесь через среду, имеющую коэффициент преломления n1 и обозначенную ниже при описании фиг. 5 – 9 как экран 1, направляют параллельный луч света с длиной волны, которая может возбуждать флуорофор, используемый как маркировочный материал, под углом  по отношению к поверхности 20, действующей как поверхность раздела, на которой связаны иммобилизованные антигены. Среда с коэффициентом преломления n1 показана здесь под поверхностью раздела 20.
От этой поверхности, которая служит в качестве поверхности раздела 20, происходит полное отражение, и над этой поверхностью образуется кратковременное поле, которое вызывает возбуждение флуорофора.
На фиг. 2 показана также кривая 21 зависимости интенсивности I кратковременного поля от расстояния X от поверхности 20, действующей как поверхность раздела, при этом однозначно видно, что интенсивность 21 экспоненциально уменьшается при увеличении расстояния.
На фиг. 3 схематично показан ход исследования другого формата, так называемой методики “сэндвич”, при этом отдельные фазы также разделены штриховой линией. Предпосылкой этой методики является существование пары специфических к анализируемому веществу антител Ak, которая одновременно может связывать антиген Ag таким образом, что указанные специфические антитела Ak не мешают друг другу. При этом одно из двух специфических антител Ak метят флуорофором. Другое специфическое антитело Ak иммобилизуют на поверхности. После прохождения реакции и связывания второго антитела на поверхности, флуорофор возбуждают излучением определенной длины волны, вырабатывая флуоресцентный сигнал, который при этой форме иммунотеста прямо пропорционален концентрации антигена. Достоинством этого является появление фиксируемого сигнала даже при сравнительно малой концентрации антигенов, а также возможность определения даже малых изменений концентраций антигенов.
В отличие от этого недостатком уже описанного конкурентного анализа (см. фиг. 1) является появление большого сигнала при малой концентрации антигена, что, соответственно, затрудняет измерение малых изменений концентрации.
Общеизвестно, что при методике “сэндвич” пределы обнаружения меньше, а чувствительность больше, чем при конкурентном анализе. Однако недостатком методики “сэндвич” является необходимость наличия второго специфического антитела Ak, а это возможно только в том случае, когда масса моля антигена Ag значительно больше 200 дальтонов. Вследствие этого низкомолекулярные антигены, в том числе вещества, вредные для окружающей среды, определяются с трудом или не определяются вообще.
Из этого следует, что конкурентные анализы более универсальны с точки зрения применяемости, однако имеют более низкую чувствительность, в то время как методика “сэндвич” лучше с этой точки зрения, хотя может применяться не во всех случаях.
На фиг. 4 показан принцип новой методики, к которой относятся также близкие варианты выполнения изобретения, в частности устройство, изображенное на фиг. 11. Основой этой новой методики также является конкурентный анализ. Смесь свободных и связанных меченых антител Ak, специфических к анализируемому веществу, пропускают через мембрану 22, на поверхности которой иммобилизованы антигены Ag. В качестве материала мембраны можно использовать, например, нитроцеллюлозу. С иммобилизованными на ней антигенами Ag соединяются исключительно свободные меченые специфические антитела Ak, в то время как уже связанные проходят через мембрану 22. Жидкость, находящаяся у мембраны, вступает в контакт с поверхностью O, на которой иммобилизован белок P. Этот белок может распознавать и связывать применяемое меченое антитело Ak независимо от его специфичности. В качестве белка P можно использовать, например, A-белок или анти-антитело. Получаемый при этом сигнал интенсивности флуоренсценции изменяется в соответствии с методикой “сэндвич”, вследствие чего чувствительность увеличивается, а возможные пределы определения, соответственно, сужаются.
На фиг. 5 изображена принципиальная схема части устройства согласно изобретению. Показанные три детали – экран 1, прокладка 4 и покровная пластина 3 – могут быть соединены друг с другом непосредственно перед проведением флуоресцентного иммунотеста или поставлены в виде полностью собранного узла, соответствующего по конструкции проточной ячейке и измерительной кювете.
При этом экран 1 изготавливают из прозрачного материала с высоким коэффициентом преломления, например, из стекла или пластмассы, в частности из полимера (полиметилметакрилата или поликарбоната) с коэффициентом преломления n1 > 1,33. Толщина экрана может быть в пределах от 0,01 до 10 мм, предпочтительно – от 0,5 до 1 мм.
Прокладка 4 предпочтительно представляет собой тонкую фольгу, снабженную с двух сторон клеящей пленкой, или тонкую клеящую пленку, которая приклеивается одной стороной к экрану 1, а другой стороной – к покровной пластине 3. Общая толщина прокладки, включая применяемый клей, предпочтительно находится в пределах от 0,001 до 0,5 мм, особенно предпочтительной является толщина 50 мкм. В прокладке 4 сделан вырез, который образует полость 2, имеющую форму кюветы.
На фиг. 5 показана также покровная пластина 3, в которой сделаны два сквозных отверстия 9 и 11, в данном примере – сверленые отверстия. Их функция будет пояснена ниже. Отверстия 9 и 11 расположены таким образом, что по меньшей мере частично перекрывают зону приемной полости 2 прокладки 4. Прокладка 4 предпочтительно выполнена из биологически совместимой клейкой ленты, на обе стороны которой предпочтительно нанесен съемный защитный слой, и является коммерчески доступной.
На фиг. 6 показана принципиальная схема устройства согласно изобретению. В соответствии со схемой излучение от лазерного диода 7 проходит через поляризатор 18 и фильтр 19 возбуждающего излучения, который выделяет узкую оптическую полосу, через приемную полость 2, выполненную в прокладке 4, и через экран 1. За счет полного отражения на поверхности раздела 20 между экраном 1 и приемной полостью 2 в приемной полости 2 происходит возбуждение кратковременного поля, которое вызывает флуоресценцию флуорофора, используемого в качестве маркировочного материала. Флуоресцентное излучение проходит через линзу 16 и широкополосный фильтр 8, препятствующий попаданию в детектор 5 рассеянного излучения лазерного диода 7. Далее флуоресцентное излучение проходит через поляризатор 6 и линзу 16′ на детектор 5, перед которым установлена диафрагма 17. Детектор 5 измеряет интенсивность флуоресцентного излучения, что позволяет проводить флуоресцентный иммунотест и соответствующее количественное определение.
В примере на фиг. 6 излучение предпочтительно от лазерного диода 7, как указано выше, поступает через поляризатор 18, фильтр возбуждающего излучения 19, оптически прозрачное тело 25 и экран 1 на поверхность раздела 20. Разумеется, при отсутствии поляризатора 18 и фильтра возбуждающего излучения 19 излучение можно направить непосредственно на торцевую поверхность 24 прозрачного тела 25. Прозрачное тело 25 изготавливают из материала с более высоким коэффициентом преломления, чем у материала, который находится над поверхностью раздела 20. При этом прозрачное тело 25 предпочтительно имеет такой же коэффициент преломления, как экран 1.
В качестве прозрачного тела 25 предпочтительно использовать стеклянную или пластмассовую усеченную призму, при этом можно применять различные пластмассы с указанным коэффициентом преломления и другими благоприятными оптическими свойствами.
Прозрачное тело 25 можно соединить с помощью клея с экраном 1, при этом предпочтительно применять клей с аналогичными оптическими свойствами. Другая возможность получения оптимального оптического контакта между оптически прозрачным телом 25 с высоким коэффициентом преломления и экраном 1 заключается в нанесении между ними очень тонкой пленки 26 (согласующая жидкость), при этом в наиболее благоприятном случае коэффициент преломления жидкости совпадает с коэффициентами преломления экрана 1 и прозрачного тела 25. Клей или пленка образуют оптический слой 26, обеспечивающий оптический контакт между телом 25 и экраном 1.
Применение прозрачного тела 25 создает возможность поступления основной части света от лазерного диода 7 на поверхность раздела 20 между экраном 1 и приемной полостью 2 для полного отражения.
При этом особенно предпочтительно, чтобы торцевая поверхность 24 или 24′ была выполнена и направлена таким образом, чтобы свет от лазерного диода 7 попадал на торцевую поверхность 24 или 24′ ортогонально, чтобы обеспечить максимальное использование излучения для полного отражения на поверхности раздела 20.
В простейшем случае экран 1 и прозрачное тело 25 можно выполнить в виде единой детали, чтобы отказаться от применения описанного выше соединения или применения очень тонкой пленки 26 между прозрачным телом 25 и экраном 1.
В этом примере предпочтительно также использовать коллиматор (линзу) 16, 16′, который может концентрировать флуоресцентное излучение и направлять его на детектор 5. В указанном примере коллиматор состоит из двух отдельных линз 16 и 16′, которые расположены напротив друг друга и между которыми могут находиться фильтр 8 и поляризатор 6. Очевидно, что в качестве коллиматора 16 можно использовать и одиночную линзу.
Для показанного на фиг. 8 случая интервал 9 между прозрачным телом 25 или экраном 1, когда они представляют собой единую деталь, и линзой 16 должен лежать в пределах от 0 до примерно 1000 мм.
Пример выполнения устройства согласно изобретению, показанный на фиг. 7, в значительной степени соответствует описанному выше примеру, который показан на фиг. 6. Отличие состоит только в дополнительной установке второго источника света 7′, фильтра 19′ и поляризатора 18′. Источник 7′ излучает свет, длина волны которого отличается от излучения первого источника 7. В этом примере также предпочтительно использовать поляризованный свет. Устройство, показанное на фиг. 7, можно успешно применять в тех случаях, когда используют разные маркировочные материалы, возбуждаемые при различных длинах волн. В качестве примера можно привести флуорофоры Cy5 и Cy7. При этом для возбуждения флуорофора Cy5 используют лазерный диод, излучающий свет с длиной волны от 635 до 655 нм, а для флуорофора Cy5 – лазерный диод, излучающий свет с длиной волны от 730 до 780 нм.
Измерение в данном варианте выполнения устройства проводят таким образом, что либо попеременно включают диоды 7 и 7′, либо используют, например, соответствующий синхронизированный оптический модулятор, обеспечивающий поступление на образец возбуждающего излучения поочередно только от источника 7 или 7′, чтобы не вызывать искажений.
Поскольку при этом через один фильтр должны проходить два различных флуоресцентных сигнала, нельзя применять широкополосный фильтр 8. Необходимо последовательно установить два фильтра 8 и 8′, селективно отсекающие длины волн излучения возбуждения от источников света 7 и 7′. Для этой цели можно применять, например, узкополосные режекторные фильтры. Другая возможность состоит в том, чтобы механически вводить в траекторию лучей между линзами 16 и 16′ или выводить из нее соответствующий фильтр, синхронизированный с оптическим модулятором лазерных диодов или с их включением-выключением. Еще одна возможность заключается в том, чтобы держать источники света постоянно включенными, а соответствующие фильтры 8 и 8′ поочередно механически вводить в траекторию лучей между линзами 16и 16′ или выводить из нее.
С помощью такой схемы можно получать опорный сигнал, который обеспечивает внутреннюю калибровку измеряемого сигнала. Для базового измерения используют калибровочные антитела, которые не направлены против антигенов из образца. Предварительно проводят количественное определение калибровочного антитела и с помощью какого-либо другого маркировочного материала делают его отличным от определяемого антитела Ak, специфичного к анализируемому веществу. Количество калибровочного антитела, фактически связанного на поверхности, можно определить с помощью второго источника света 7′, который вызывает флуоресцентное излучение другого маркировочного материала, второго фильтра 8′ рассеянного света и детектора 5. Это определение позволяет учесть потери не связанных на поверхности меченых специфических антител Ak и антигенов Ag.
Параллельно с получением опорного сигнала можно проводить два независимых друг от друга иммунотеста, при этом их отличие обуславливают разные флуорофоры.
Предпочтительным является линейное или плоскостное расположение светочувствительных детекторов, применяемых в качестве детектора 5. Это позволяет проводить параллельное определение нескольких анализируемых веществ, если в разных участках приемной полости 2 в зависимости от методики биохимического анализа иммобилизованы либо разные антигены при конкурентном анализе, либо разные специфические к анализируемому веществу антитела при методике “сэндвич”, а в контейнере 10 находятся различно меченые специфические антитела в соответствии с количеством разных антигенов или антител. Различно меченые специфические антитела в соответствии с методикой биохимического анализа связываются в различных местах приемной полости 2, и их локально детектируют по испусканию флуоресцентного излучения, которое поступает через коллиматор 16 на линейную или плоскостную схему из нескольких светочувствительных детекторов. Это позволяет проводить независимые параллельные количественные определения нескольких компонентов из одного образца при помощи только одного маркировочного материала, например, Cy5. Представленный на фигурах детектор 5 получают путем соответствующего размещения нескольких светочувствительных детекторов.
Пример конструктивного исполнения, представленный на фиг. 8, в значительной степени соответствует примеру, приведенному на фиг. 6. Однако в данном случае конструкция несколько упрощена за счет того, что экран 1 выполняет функции прозрачного тела 25 и имеет, соответственно, увеличенные размеры.
Экран 1, показанный в данном примере, имеет прямоугольное поперечное сечение, что вызывает определенные потери при сопряжении, однако снижает трудоемкость изготовления. Экран 1, разумеется, может быть выполнен таким же образом, как прозрачное тело 25, показанное на фиг. 6, при этом его торцевые поверхности 24 и 24′ имеют такой угол наклона, чтобы лучи света от лазерного диода 7 могли падать на них ортогонально.
На фиг. 9 показан другой вариант выполнения устройства согласно изобретению. За основу здесь взят пример, показанный на фиг. 6, однако другие варианты исполнения также могут быть модифицированы аналогичным образом. В данном примере использована диафрагма 17, которая может перемещаться относительно детектора 5 и экрана 1.
Размеры отверстия диафрагмы 17 могут быть выбраны в зависимости от конкретных условий применения, при этом в диафрагме 17 можно сделать выборки круглой, овальной или щелевидной формы. Дополнительно выбираемым параметром является размер свободного поперечного сечения диафрагмы.
При постоянном свободном поперечном сечении диафрагмы 17 может оказаться благоприятной схема размещения диафрагмы 17 и/или детектора 5, которая позволяет изменять расстояние между ними. Дополнительная возможность заключается в том, чтобы предусмотреть установку поворотного тела с несколькими диафрагмами 17, которые имеют различные размеры и/или расположение, для того, чтобы охватывать разные зоны приемной полости 2 и локально анализировать их с помощью детектора 5.
Поскольку применение диафрагмы 17 позволяет направлять лишь часть флуоресцентного излучения на детектор 5, на фиг. 9 показана сдвижная диафрагма.
Предпочтительно располагать диафрагму 17 в плоскости 28 изображения фокусирующей системы, включающей полулинзы 16 и 16′, перед детектором 5 на траектории флуоресцентного излучения.
За счет сдвига диафрагмы 17 можно последовательно зондировать поверхность приемной полости 2.
При проведении биохимических исследований, когда в различных местах приемной полости 2 иммобилизованы разные или одинаковые химические или биохимические компоненты, и в соответствии с присутствующим там количеством иммобилизованных компонентов, а в контейнере 10 с образцом содержатся комплементарные меченые химические или биохимические вещества, можно локально фиксировать соединение комплементарных и меченых веществ. Это происходит благодаря тому, что диафрагма 17 перемещается параллельно и/или перпендикулярно плоскости изображения, покрывая при этом всю площадь приемной полости 2.
На фиг. 10 показано расположение контейнера 10 с образцом относительно отверстия 9 в покровной пластине 3, которое обеспечивает возможность сообщения между контейнером 10 и приемной полостью 2 через отверстие 9. При этом контейнер 10 представляет собой резервуар, в котором известное количество меченых маркировочным флуорофором антител Ak смешаны с анализируемым образцом. Предпочтительно всегда заполнять контейнер 10 одним и тем же количеством, чтобы получать воспроизводимые результаты. При этом наиболее предпочтительно всегда заполнять его максимально. Для всех реализуемых методик анализа специфическое антитело Ak может находиться на поверхности контейнера 10, а при контакте с жидким образцом оно будет смыто с поверхности и поступит в образец. Простая и уже известная ранее методика заключается в том, чтобы нанести лиофилизированное антитело на поверхность контейнера 10. При этом оказывается возможным относительно длительное хранение образца перед непосредственным проведением иммунотеста. Приемная полость 2 определяет поверхность экрана 1, на которой в соответствии с методикой анализа иммобилизируют конкретные химические или биохимические вещества.
На фиг. 10 показано также предпочтительно цилиндрическое полое тело 12, которое содержит поршень 13 или другую соответствующую крышку (заглушку, колпак, пленку), при этом оба указанные элемента образуют насос. Если поршень 13 выдвинуть из цилиндрического полого тела 12, то возникает разрежение, которое вызывает всасывание материала образца из контейнера 10 через приемную полость 2 в направлении цилиндрического полого тела 12. За счет капиллярных сил в приемной полости 2 и материала, впитывающего жидкость и расположенного в нижней части цилиндрического полого тела 12, поддерживают течение жидкости до тех пор, пока весь объем образца не пройдет через приемную полость 2. Цилиндрическое полое тело 12 имеет насадку или цилиндрическое отверстие в основании, обеспечивающие соединение с приемной полостью 2. Возможность соединения можно реализовать за счет второго отверстия 11 в покровной пластине 3. Если покровная пластина 3 не применяется, то соединение может быть образовано и иным образом.
Можно также подключить к отверстию 11 другой внешний насос.
После установки образца (в контейнере 10) необходимо выждать некоторое время, чтобы обеспечить полное прохождение желаемого связывания между антигенами Ag и мечеными антителами Ak. Затем необходимо включить насос 12, 13 и выждать, пока вся жидкость будет перекачана через приемную полость 2. После возбуждения источником излучения 7 или источниками излучения 7 и 7′ можно определять концентрацию антигенов, при этом следует использовать устройство согласно изобретению, показанное на фиг. 6 и 7.
Устройство, показанное и описанное выше, можно использовать для всевозможных биохимических анализов.
При конкурентном анализе в контейнере 10 находятся неиммобилизованные меченные флуорофором антитела Ak, специфические к анализируемому веществу, а в приемной полости 2 на экране 1, изготовленном из стекла с высоким коэффициентом преломления, полимера или другого подходящего синтетического материала, иммобилизованы соответствующие антигены Ag.
Затем контейнер 10 заполняют образцом, и анализируемое вещество соединяется с меченым антителом Ak. После окончания реакции включают насос 12, 13, при этом оставшиеся свободными меченые антитела соединяются с иммобилизованными антигенами Ag в приемной полости 2 экрана 1. Соответствующее количество меченых специфических антител Ak можно определить путем измерения интенсивности флуоресцентного излучения, как это описано выше.
Другой биохимический анализ можно провести следующим образом. В основание контейнера 10 помещают мембрану (не показана), на которой иммобилизован антиген Ag, а на стенках контейнера 10 находятся лиофилизированные антитела Ak, специфические для анализируемого компонента. На поверхности экрана 1, который изготовлен из указанного выше материала, иммобилизованы, например, анти-антитело или A-белок, которые направлены против меченого флуорофором антитела Ak, специфического для анализируемого компонента. Затем контейнер 10 заполняют образцом и антитела Ak соединяются с анализируемым веществом. После окончания реакции включают насос 12, 13, при этом оставшиеся свободными меченые антитела соединяются на мембране с иммобилизованными антигенами Ag. Антитела, соединенные с анализируемым веществом, связываются на поверхности приемной полости 2, и их соответствующее количество можно определить при помощи возбуждения кратковременным полем, как описано выше.
Для всех биохимических анализов важно, чтобы достаточно большой объем образца, находящегося в контейнере 10, был полностью прокачан через малую измерительную поверхность приемной полости 2. Поскольку высота приемной полости 2 является относительно малой, можно исходить из того, что соответствующие антитела Ak (свободные при конкурентных анализах и связанные при методике “сэндвич”) будут гарантированно поступать на поверхность вследствие процессов конвекции и диффузии, что относится к широкому диапазону скоростей потока жидкости. Благодаря этому можно обеспечить скопление антител Ak на поверхности и стабильность протекания процесса, что делает его практически независимым от скорости потока.
На фиг. 11 показан другой возможный вариант выполнения устройства, позволяющего проводить биохимические исследования, как принципиально описано при рассмотрении фиг. 4.
В данном случае дополнительно применяют гильзу 15, запрессованную в контейнер 10. Гильза 15 закрыта снизу мембраной 23. На внутренней поверхности гильзы 15 находится лиофилизированное антитело, специфическое к анализируемому веществу, и при необходимости соответствующее калибровочное антитело, а на поверхности мембраны иммобилизован соответствующий антиген. В таком состоянии все это может сохраняться достаточно длительное время. Для проведения такого теста согласно фиг. 4 и 9 предпочтительно применять устройство, показанное на фиг. 7, при этом разные антитела Ak и калибровочные антитела метят разными флуорофорами. Затем проводят количественное определение по описанной выше методике.
В примере на фиг. 11 также можно использовать цилиндрическое полое тело 12 с вставленным поршнем 13, как описано в примере, показанном на фиг. 8.
На фиг. 12 показан другой вариант выполнения устройства согласно изобретению, где с двух сторон от приемной полости 2 имеются соединения 27 и 27′, через которые анализируемые химические или биохимические вещества подают в приемную полость 2 и выводят из нее, как описано в приведенных выше примерах. Прокладку 4, показанную на фиг. 12, можно простым способом изготовить с помощью штамповки, при этом вся деталь изготавливается за один прием. Дополнительно предусмотрено отверстие 12 для цилиндрического полого тела 12, выполненного как целое с покровной пластиной 3, в основании которого находится материал, всасывающий жидкость, или отверстие 11, в котором находится материал, впитывающий жидкость, которое снабжено покрытием 13 из пленки, в исходном состоянии герметично закрывающей отверстие 11 или отверстие цилиндрического полого тела 12. При простом прорыве пленки 13 поток образца может быть пропущен через приемную полость 2. по отношению к поверхности 20, действующей как поверхность раздела, на которой связаны иммобилизованные антигены. Среда с коэффициентом преломления n1 показана здесь под поверхностью раздела 20.
От этой поверхности, которая служит в качестве поверхности раздела 20, происходит полное отражение, и над этой поверхностью образуется кратковременное поле, которое вызывает возбуждение флуорофора.
На фиг. 2 показана также кривая 21 зависимости интенсивности I кратковременного поля от расстояния X от поверхности 20, действующей как поверхность раздела, при этом однозначно видно, что интенсивность 21 экспоненциально уменьшается при увеличении расстояния.
На фиг. 3 схематично показан ход исследования другого формата, так называемой методики “сэндвич”, при этом отдельные фазы также разделены штриховой линией. Предпосылкой этой методики является существование пары специфических к анализируемому веществу антител Ak, которая одновременно может связывать антиген Ag таким образом, что указанные специфические антитела Ak не мешают друг другу. При этом одно из двух специфических антител Ak метят флуорофором. Другое специфическое антитело Ak иммобилизуют на поверхности. После прохождения реакции и связывания второго антитела на поверхности, флуорофор возбуждают излучением определенной длины волны, вырабатывая флуоресцентный сигнал, который при этой форме иммунотеста прямо пропорционален концентрации антигена. Достоинством этого является появление фиксируемого сигнала даже при сравнительно малой концентрации антигенов, а также возможность определения даже малых изменений концентраций антигенов.
В отличие от этого недостатком уже описанного конкурентного анализа (см. фиг. 1) является появление большого сигнала при малой концентрации антигена, что, соответственно, затрудняет измерение малых изменений концентрации.
Общеизвестно, что при методике “сэндвич” пределы обнаружения меньше, а чувствительность больше, чем при конкурентном анализе. Однако недостатком методики “сэндвич” является необходимость наличия второго специфического антитела Ak, а это возможно только в том случае, когда масса моля антигена Ag значительно больше 200 дальтонов. Вследствие этого низкомолекулярные антигены, в том числе вещества, вредные для окружающей среды, определяются с трудом или не определяются вообще.
Из этого следует, что конкурентные анализы более универсальны с точки зрения применяемости, однако имеют более низкую чувствительность, в то время как методика “сэндвич” лучше с этой точки зрения, хотя может применяться не во всех случаях.
На фиг. 4 показан принцип новой методики, к которой относятся также близкие варианты выполнения изобретения, в частности устройство, изображенное на фиг. 11. Основой этой новой методики также является конкурентный анализ. Смесь свободных и связанных меченых антител Ak, специфических к анализируемому веществу, пропускают через мембрану 22, на поверхности которой иммобилизованы антигены Ag. В качестве материала мембраны можно использовать, например, нитроцеллюлозу. С иммобилизованными на ней антигенами Ag соединяются исключительно свободные меченые специфические антитела Ak, в то время как уже связанные проходят через мембрану 22. Жидкость, находящаяся у мембраны, вступает в контакт с поверхностью O, на которой иммобилизован белок P. Этот белок может распознавать и связывать применяемое меченое антитело Ak независимо от его специфичности. В качестве белка P можно использовать, например, A-белок или анти-антитело. Получаемый при этом сигнал интенсивности флуоренсценции изменяется в соответствии с методикой “сэндвич”, вследствие чего чувствительность увеличивается, а возможные пределы определения, соответственно, сужаются.
На фиг. 5 изображена принципиальная схема части устройства согласно изобретению. Показанные три детали – экран 1, прокладка 4 и покровная пластина 3 – могут быть соединены друг с другом непосредственно перед проведением флуоресцентного иммунотеста или поставлены в виде полностью собранного узла, соответствующего по конструкции проточной ячейке и измерительной кювете.
При этом экран 1 изготавливают из прозрачного материала с высоким коэффициентом преломления, например, из стекла или пластмассы, в частности из полимера (полиметилметакрилата или поликарбоната) с коэффициентом преломления n1 > 1,33. Толщина экрана может быть в пределах от 0,01 до 10 мм, предпочтительно – от 0,5 до 1 мм.
Прокладка 4 предпочтительно представляет собой тонкую фольгу, снабженную с двух сторон клеящей пленкой, или тонкую клеящую пленку, которая приклеивается одной стороной к экрану 1, а другой стороной – к покровной пластине 3. Общая толщина прокладки, включая применяемый клей, предпочтительно находится в пределах от 0,001 до 0,5 мм, особенно предпочтительной является толщина 50 мкм. В прокладке 4 сделан вырез, который образует полость 2, имеющую форму кюветы.
На фиг. 5 показана также покровная пластина 3, в которой сделаны два сквозных отверстия 9 и 11, в данном примере – сверленые отверстия. Их функция будет пояснена ниже. Отверстия 9 и 11 расположены таким образом, что по меньшей мере частично перекрывают зону приемной полости 2 прокладки 4. Прокладка 4 предпочтительно выполнена из биологически совместимой клейкой ленты, на обе стороны которой предпочтительно нанесен съемный защитный слой, и является коммерчески доступной.
На фиг. 6 показана принципиальная схема устройства согласно изобретению. В соответствии со схемой излучение от лазерного диода 7 проходит через поляризатор 18 и фильтр 19 возбуждающего излучения, который выделяет узкую оптическую полосу, через приемную полость 2, выполненную в прокладке 4, и через экран 1. За счет полного отражения на поверхности раздела 20 между экраном 1 и приемной полостью 2 в приемной полости 2 происходит возбуждение кратковременного поля, которое вызывает флуоресценцию флуорофора, используемого в качестве маркировочного материала. Флуоресцентное излучение проходит через линзу 16 и широкополосный фильтр 8, препятствующий попаданию в детектор 5 рассеянного излучения лазерного диода 7. Далее флуоресцентное излучение проходит через поляризатор 6 и линзу 16′ на детектор 5, перед которым установлена диафрагма 17. Детектор 5 измеряет интенсивность флуоресцентного излучения, что позволяет проводить флуоресцентный иммунотест и соответствующее количественное определение.
В примере на фиг. 6 излучение предпочтительно от лазерного диода 7, как указано выше, поступает через поляризатор 18, фильтр возбуждающего излучения 19, оптически прозрачное тело 25 и экран 1 на поверхность раздела 20. Разумеется, при отсутствии поляризатора 18 и фильтра возбуждающего излучения 19 излучение можно направить непосредственно на торцевую поверхность 24 прозрачного тела 25. Прозрачное тело 25 изготавливают из материала с более высоким коэффициентом преломления, чем у материала, который находится над поверхностью раздела 20. При этом прозрачное тело 25 предпочтительно имеет такой же коэффициент преломления, как экран 1.
В качестве прозрачного тела 25 предпочтительно использовать стеклянную или пластмассовую усеченную призму, при этом можно применять различные пластмассы с указанным коэффициентом преломления и другими благоприятными оптическими свойствами.
Прозрачное тело 25 можно соединить с помощью клея с экраном 1, при этом предпочтительно применять клей с аналогичными оптическими свойствами. Другая возможность получения оптимального оптического контакта между оптически прозрачным телом 25 с высоким коэффициентом преломления и экраном 1 заключается в нанесении между ними очень тонкой пленки 26 (согласующая жидкость), при этом в наиболее благоприятном случае коэффициент преломления жидкости совпадает с коэффициентами преломления экрана 1 и прозрачного тела 25. Клей или пленка образуют оптический слой 26, обеспечивающий оптический контакт между телом 25 и экраном 1.
Применение прозрачного тела 25 создает возможность поступления основной части света от лазерного диода 7 на поверхность раздела 20 между экраном 1 и приемной полостью 2 для полного отражения.
При этом особенно предпочтительно, чтобы торцевая поверхность 24 или 24′ была выполнена и направлена таким образом, чтобы свет от лазерного диода 7 попадал на торцевую поверхность 24 или 24′ ортогонально, чтобы обеспечить максимальное использование излучения для полного отражения на поверхности раздела 20.
В простейшем случае экран 1 и прозрачное тело 25 можно выполнить в виде единой детали, чтобы отказаться от применения описанного выше соединения или применения очень тонкой пленки 26 между прозрачным телом 25 и экраном 1.
В этом примере предпочтительно также использовать коллиматор (линзу) 16, 16′, который может концентрировать флуоресцентное излучение и направлять его на детектор 5. В указанном примере коллиматор состоит из двух отдельных линз 16 и 16′, которые расположены напротив друг друга и между которыми могут находиться фильтр 8 и поляризатор 6. Очевидно, что в качестве коллиматора 16 можно использовать и одиночную линзу.
Для показанного на фиг. 8 случая интервал 9 между прозрачным телом 25 или экраном 1, когда они представляют собой единую деталь, и линзой 16 должен лежать в пределах от 0 до примерно 1000 мм.
Пример выполнения устройства согласно изобретению, показанный на фиг. 7, в значительной степени соответствует описанному выше примеру, который показан на фиг. 6. Отличие состоит только в дополнительной установке второго источника света 7′, фильтра 19′ и поляризатора 18′. Источник 7′ излучает свет, длина волны которого отличается от излучения первого источника 7. В этом примере также предпочтительно использовать поляризованный свет. Устройство, показанное на фиг. 7, можно успешно применять в тех случаях, когда используют разные маркировочные материалы, возбуждаемые при различных длинах волн. В качестве примера можно привести флуорофоры Cy5 и Cy7. При этом для возбуждения флуорофора Cy5 используют лазерный диод, излучающий свет с длиной волны от 635 до 655 нм, а для флуорофора Cy5 – лазерный диод, излучающий свет с длиной волны от 730 до 780 нм.
Измерение в данном варианте выполнения устройства проводят таким образом, что либо попеременно включают диоды 7 и 7′, либо используют, например, соответствующий синхронизированный оптический модулятор, обеспечивающий поступление на образец возбуждающего излучения поочередно только от источника 7 или 7′, чтобы не вызывать искажений.
Поскольку при этом через один фильтр должны проходить два различных флуоресцентных сигнала, нельзя применять широкополосный фильтр 8. Необходимо последовательно установить два фильтра 8 и 8′, селективно отсекающие длины волн излучения возбуждения от источников света 7 и 7′. Для этой цели можно применять, например, узкополосные режекторные фильтры. Другая возможность состоит в том, чтобы механически вводить в траекторию лучей между линзами 16 и 16′ или выводить из нее соответствующий фильтр, синхронизированный с оптическим модулятором лазерных диодов или с их включением-выключением. Еще одна возможность заключается в том, чтобы держать источники света постоянно включенными, а соответствующие фильтры 8 и 8′ поочередно механически вводить в траекторию лучей между линзами 16и 16′ или выводить из нее.
С помощью такой схемы можно получать опорный сигнал, который обеспечивает внутреннюю калибровку измеряемого сигнала. Для базового измерения используют калибровочные антитела, которые не направлены против антигенов из образца. Предварительно проводят количественное определение калибровочного антитела и с помощью какого-либо другого маркировочного материала делают его отличным от определяемого антитела Ak, специфичного к анализируемому веществу. Количество калибровочного антитела, фактически связанного на поверхности, можно определить с помощью второго источника света 7′, который вызывает флуоресцентное излучение другого маркировочного материала, второго фильтра 8′ рассеянного света и детектора 5. Это определение позволяет учесть потери не связанных на поверхности меченых специфических антител Ak и антигенов Ag.
Параллельно с получением опорного сигнала можно проводить два независимых друг от друга иммунотеста, при этом их отличие обуславливают разные флуорофоры.
Предпочтительным является линейное или плоскостное расположение светочувствительных детекторов, применяемых в качестве детектора 5. Это позволяет проводить параллельное определение нескольких анализируемых веществ, если в разных участках приемной полости 2 в зависимости от методики биохимического анализа иммобилизованы либо разные антигены при конкурентном анализе, либо разные специфические к анализируемому веществу антитела при методике “сэндвич”, а в контейнере 10 находятся различно меченые специфические антитела в соответствии с количеством разных антигенов или антител. Различно меченые специфические антитела в соответствии с методикой биохимического анализа связываются в различных местах приемной полости 2, и их локально детектируют по испусканию флуоресцентного излучения, которое поступает через коллиматор 16 на линейную или плоскостную схему из нескольких светочувствительных детекторов. Это позволяет проводить независимые параллельные количественные определения нескольких компонентов из одного образца при помощи только одного маркировочного материала, например, Cy5. Представленный на фигурах детектор 5 получают путем соответствующего размещения нескольких светочувствительных детекторов.
Пример конструктивного исполнения, представленный на фиг. 8, в значительной степени соответствует примеру, приведенному на фиг. 6. Однако в данном случае конструкция несколько упрощена за счет того, что экран 1 выполняет функции прозрачного тела 25 и имеет, соответственно, увеличенные размеры.
Экран 1, показанный в данном примере, имеет прямоугольное поперечное сечение, что вызывает определенные потери при сопряжении, однако снижает трудоемкость изготовления. Экран 1, разумеется, может быть выполнен таким же образом, как прозрачное тело 25, показанное на фиг. 6, при этом его торцевые поверхности 24 и 24′ имеют такой угол наклона, чтобы лучи света от лазерного диода 7 могли падать на них ортогонально.
На фиг. 9 показан другой вариант выполнения устройства согласно изобретению. За основу здесь взят пример, показанный на фиг. 6, однако другие варианты исполнения также могут быть модифицированы аналогичным образом. В данном примере использована диафрагма 17, которая может перемещаться относительно детектора 5 и экрана 1.
Размеры отверстия диафрагмы 17 могут быть выбраны в зависимости от конкретных условий применения, при этом в диафрагме 17 можно сделать выборки круглой, овальной или щелевидной формы. Дополнительно выбираемым параметром является размер свободного поперечного сечения диафрагмы.
При постоянном свободном поперечном сечении диафрагмы 17 может оказаться благоприятной схема размещения диафрагмы 17 и/или детектора 5, которая позволяет изменять расстояние между ними. Дополнительная возможность заключается в том, чтобы предусмотреть установку поворотного тела с несколькими диафрагмами 17, которые имеют различные размеры и/или расположение, для того, чтобы охватывать разные зоны приемной полости 2 и локально анализировать их с помощью детектора 5.
Поскольку применение диафрагмы 17 позволяет направлять лишь часть флуоресцентного излучения на детектор 5, на фиг. 9 показана сдвижная диафрагма.
Предпочтительно располагать диафрагму 17 в плоскости 28 изображения фокусирующей системы, включающей полулинзы 16 и 16′, перед детектором 5 на траектории флуоресцентного излучения.
За счет сдвига диафрагмы 17 можно последовательно зондировать поверхность приемной полости 2.
При проведении биохимических исследований, когда в различных местах приемной полости 2 иммобилизованы разные или одинаковые химические или биохимические компоненты, и в соответствии с присутствующим там количеством иммобилизованных компонентов, а в контейнере 10 с образцом содержатся комплементарные меченые химические или биохимические вещества, можно локально фиксировать соединение комплементарных и меченых веществ. Это происходит благодаря тому, что диафрагма 17 перемещается параллельно и/или перпендикулярно плоскости изображения, покрывая при этом всю площадь приемной полости 2.
На фиг. 10 показано расположение контейнера 10 с образцом относительно отверстия 9 в покровной пластине 3, которое обеспечивает возможность сообщения между контейнером 10 и приемной полостью 2 через отверстие 9. При этом контейнер 10 представляет собой резервуар, в котором известное количество меченых маркировочным флуорофором антител Ak смешаны с анализируемым образцом. Предпочтительно всегда заполнять контейнер 10 одним и тем же количеством, чтобы получать воспроизводимые результаты. При этом наиболее предпочтительно всегда заполнять его максимально. Для всех реализуемых методик анализа специфическое антитело Ak может находиться на поверхности контейнера 10, а при контакте с жидким образцом оно будет смыто с поверхности и поступит в образец. Простая и уже известная ранее методика заключается в том, чтобы нанести лиофилизированное антитело на поверхность контейнера 10. При этом оказывается возможным относительно длительное хранение образца перед непосредственным проведением иммунотеста. Приемная полость 2 определяет поверхность экрана 1, на которой в соответствии с методикой анализа иммобилизируют конкретные химические или биохимические вещества.
На фиг. 10 показано также предпочтительно цилиндрическое полое тело 12, которое содержит поршень 13 или другую соответствующую крышку (заглушку, колпак, пленку), при этом оба указанные элемента образуют насос. Если поршень 13 выдвинуть из цилиндрического полого тела 12, то возникает разрежение, которое вызывает всасывание материала образца из контейнера 10 через приемную полость 2 в направлении цилиндрического полого тела 12. За счет капиллярных сил в приемной полости 2 и материала, впитывающего жидкость и расположенного в нижней части цилиндрического полого тела 12, поддерживают течение жидкости до тех пор, пока весь объем образца не пройдет через приемную полость 2. Цилиндрическое полое тело 12 имеет насадку или цилиндрическое отверстие в основании, обеспечивающие соединение с приемной полостью 2. Возможность соединения можно реализовать за счет второго отверстия 11 в покровной пластине 3. Если покровная пластина 3 не применяется, то соединение может быть образовано и иным образом.
Можно также подключить к отверстию 11 другой внешний насос.
После установки образца (в контейнере 10) необходимо выждать некоторое время, чтобы обеспечить полное прохождение желаемого связывания между антигенами Ag и мечеными антителами Ak. Затем необходимо включить насос 12, 13 и выждать, пока вся жидкость будет перекачана через приемную полость 2. После возбуждения источником излучения 7 или источниками излучения 7 и 7′ можно определять концентрацию антигенов, при этом следует использовать устройство согласно изобретению, показанное на фиг. 6 и 7.
Устройство, показанное и описанное выше, можно использовать для всевозможных биохимических анализов.
При конкурентном анализе в контейнере 10 находятся неиммобилизованные меченные флуорофором антитела Ak, специфические к анализируемому веществу, а в приемной полости 2 на экране 1, изготовленном из стекла с высоким коэффициентом преломления, полимера или другого подходящего синтетического материала, иммобилизованы соответствующие антигены Ag.
Затем контейнер 10 заполняют образцом, и анализируемое вещество соединяется с меченым антителом Ak. После окончания реакции включают насос 12, 13, при этом оставшиеся свободными меченые антитела соединяются с иммобилизованными антигенами Ag в приемной полости 2 экрана 1. Соответствующее количество меченых специфических антител Ak можно определить путем измерения интенсивности флуоресцентного излучения, как это описано выше.
Другой биохимический анализ можно провести следующим образом. В основание контейнера 10 помещают мембрану (не показана), на которой иммобилизован антиген Ag, а на стенках контейнера 10 находятся лиофилизированные антитела Ak, специфические для анализируемого компонента. На поверхности экрана 1, который изготовлен из указанного выше материала, иммобилизованы, например, анти-антитело или A-белок, которые направлены против меченого флуорофором антитела Ak, специфического для анализируемого компонента. Затем контейнер 10 заполняют образцом и антитела Ak соединяются с анализируемым веществом. После окончания реакции включают насос 12, 13, при этом оставшиеся свободными меченые антитела соединяются на мембране с иммобилизованными антигенами Ag. Антитела, соединенные с анализируемым веществом, связываются на поверхности приемной полости 2, и их соответствующее количество можно определить при помощи возбуждения кратковременным полем, как описано выше.
Для всех биохимических анализов важно, чтобы достаточно большой объем образца, находящегося в контейнере 10, был полностью прокачан через малую измерительную поверхность приемной полости 2. Поскольку высота приемной полости 2 является относительно малой, можно исходить из того, что соответствующие антитела Ak (свободные при конкурентных анализах и связанные при методике “сэндвич”) будут гарантированно поступать на поверхность вследствие процессов конвекции и диффузии, что относится к широкому диапазону скоростей потока жидкости. Благодаря этому можно обеспечить скопление антител Ak на поверхности и стабильность протекания процесса, что делает его практически независимым от скорости потока.
На фиг. 11 показан другой возможный вариант выполнения устройства, позволяющего проводить биохимические исследования, как принципиально описано при рассмотрении фиг. 4.
В данном случае дополнительно применяют гильзу 15, запрессованную в контейнер 10. Гильза 15 закрыта снизу мембраной 23. На внутренней поверхности гильзы 15 находится лиофилизированное антитело, специфическое к анализируемому веществу, и при необходимости соответствующее калибровочное антитело, а на поверхности мембраны иммобилизован соответствующий антиген. В таком состоянии все это может сохраняться достаточно длительное время. Для проведения такого теста согласно фиг. 4 и 9 предпочтительно применять устройство, показанное на фиг. 7, при этом разные антитела Ak и калибровочные антитела метят разными флуорофорами. Затем проводят количественное определение по описанной выше методике.
В примере на фиг. 11 также можно использовать цилиндрическое полое тело 12 с вставленным поршнем 13, как описано в примере, показанном на фиг. 8.
На фиг. 12 показан другой вариант выполнения устройства согласно изобретению, где с двух сторон от приемной полости 2 имеются соединения 27 и 27′, через которые анализируемые химические или биохимические вещества подают в приемную полость 2 и выводят из нее, как описано в приведенных выше примерах. Прокладку 4, показанную на фиг. 12, можно простым способом изготовить с помощью штамповки, при этом вся деталь изготавливается за один прием. Дополнительно предусмотрено отверстие 12 для цилиндрического полого тела 12, выполненного как целое с покровной пластиной 3, в основании которого находится материал, всасывающий жидкость, или отверстие 11, в котором находится материал, впитывающий жидкость, которое снабжено покрытием 13 из пленки, в исходном состоянии герметично закрывающей отверстие 11 или отверстие цилиндрического полого тела 12. При простом прорыве пленки 13 поток образца может быть пропущен через приемную полость 2.
Формула изобретения
 , определяющим заданную глубину проникновения d кратковременного поля, на поверхность раздела (20) между оптически прозрачным экраном (1) из материала с коэффициентом преломления n1, большим коэффициента преломления n2 материала, расположенного над поверхностью раздела (20), отличающееся тем, что излучение направлено через экран (1) на поверхность раздела (20) приемной полости (2), выполненной в форме кюветы и имеющей толщину 0,001 – 0,5 мм, при этом контейнер (10) с образцом расположен так, чтобы обеспечить первое возможное соединение (9), которое по меньшей мере частично представляет собой отверстие между выполненной в форме кюветы приемной полостью (2) и контейнером (10) с образцом, и второе возможное соединение (11) с приемной полостью (2), выполненной в форме кюветы, причем приемная полость (2) закрыта покровной пластиной (3) со стороны, противоположной экрану (1), и с той стороны экрана (1), где расположен источник света (7), размещают детектор (5) для регистрации флуоресцентного излучения.
2. Устройство по п.1, отличающееся тем, что экран (1) и покровную пластину (3) соединяют прокладкой (4), в которой образована приемная полость (2) в форме кюветы.
3. Устройство по п. 2, отличающееся тем, что прокладка (4) является клейкой пленкой или фольгой.
4. Устройство по любому из пп.1 – 3, отличающееся тем, что излучение от источника/источников (7, 7′) поступает в экран (1) по меньшей мере через одну торцевую поверхность (24, 24′) экрана (1) или соединенного с экраном (1) оптически прозрачного тела (25), выполненного из материала с более высоким коэффициентом преломления, чем у материала над поверхностью раздела (20).
5. Устройство по п.4, отличающееся тем, что между экраном (1) и прозрачным телом (25) имеется оптически прозрачный слой (26), коэффициент преломления которого совпадает с коэффициентом преломления экрана (1) или прозрачного тела (25), либо указанный коэффициент преломления находится между коэффициентами преломления экрана (1) и прозрачного тела (25).
6. Устройство по любому из пп. 1 – 5, отличающееся тем, что источник/источники излучения (7, 7′) представляют собой одно или более лазерных диодов.
7. Устройство по любому из пп. 1 – 5, отличающееся тем, что источник/источники (7, 7′) излучают поляризованный свет либо после источников (7, 7′) излучения установлен поляризатор (18, 18′), а перед детектором (5) установлен поляризатор (6).
8. Устройство по любому из пп.1 – 7, отличающееся тем, что на траектории излучения непосредственно после источника/источников (7, 7′) соответственно установлено по одному оптическому фильтру (19, 19′).
9. Устройство по любому из пп.1 – 8, отличающееся тем, что перед детектором (5) установлен по меньшей мере один оптический фильтр (8, 8′).
10. Устройство по любому из пп.1 – 9, отличающееся тем, что оптические фильтры (8, 8′) выполнены с возможностью поочередного введения в траекторию излучения между экраном (1) и детектором (5) и выведения из нее.
11. Устройство по любому из пп.1 – 10, отличающееся тем, что на траектории излучения установлен один или несколько оптических модуляторов.
12. Устройство по любому из пп.1 – 11, отличающееся тем, что детектор (5) представляет собой линейную или плоскостную схему, содержащую несколько светочувствительных детекторов.
13. Устройство по любому из пп.1 – 12, отличающееся тем, что на траектории излучения перед детектором (5) установлена по меньшей мере одна линза (16, 16′).
14. Устройство по любому из пп.1 – 13, отличающееся тем, что на траектории излучения между экраном (1) и детектором (5) установлена диафрагма (17).
15. Устройство по п.14, отличающееся тем, что диафрагма (17) является подвижной.
16. Устройство по п.1, отличающееся тем, что содержит второй источник (7′) излучения, который излучает свет с длиной волны, вызывающей флуоресценцию второго маркировочного материала, и свет от обоих источник (7 и 7′) поочередно направляют на приемную полость (2).
17. Устройство по любому из пп.1 – 16, отличающееся тем, что маркировочный материал/материалы является/являются флуорофорами.
18. Устройство по любому из пп.1 – 17, отличающееся тем, что экран (1) изготовлен из оптически прозрачного материала, в частности из стекла или пластмассы.
19. Устройство по любому из пп.1 – 18, отличающееся тем, что второе соединительное отверстие (11) выполнено с возможностью присоединения к нему насоса или введения насоса в него.
20. Устройство по п.19, отличающееся тем, что в качестве насоса использовано полое тело (12) с поршнем (13).
21. Устройство по п.20, отличающееся тем, что в основании полого тела (12) помещен материал (14), впитывающий жидкость.
22. Устройство по любому из пп.1 – 21, отличающееся тем, что контейнер (10), предназначенный для образца, выполнен с возможностью введения в него полого тела (15), на внутренней стенке которого находятся антитела.
23. Устройство по п.22, отличающееся тем, что полое тело (15) закрыто снизу мембраной (23), на которой иммобилизованы антигены.
24. Способ проведения флуоресцентных иммунотестов посредством возбуждения кратковременным полем, отличающийся тем, что весь объем образца из контейнера (10) пропускают через приемную полость (2), имеющую форму кюветы, под действием сил всасывания, давления или капиллярных сил и в зависимости от биохимического анализа определяемые меченые химические или биохимические компоненты соединяются с соответствующими комплементарными химическими или биохимическими компонентами, иммобилизованными на поверхности приемной полости (2), при этом детектором (5) измеряют флуоресцентное излучение, возбуждаемое кратковременным полем, полученным с помощью света от источника/источников (7, 7′).
25. Способ по п.24, отличающийся тем, что проводят калибровочное измерение с химическим или биохимическим калибровочным компонентом, которые не определяет анализируемое в образце вещество и имеет другую метку, отличную от химического или биохимического компонента, используемого для определения анализируемого вещества, при этом количество химического или биохимического калибровочного компонента определяют детектором (5) с помощью второго источника излучения (7′) и второго оптического фильтра (8′).
26. Способ по п.24, отличающийся тем, что проводят количественный анализ двух разных химических или биохимических компонентов, меченных различными маркировочными материалами, с помощью двух источников излучения (7, 7′), которые излучают свет с длинами волн, вызывающими флуоресценцию соответствующих маркировочных материалов, так что количественно определяют два разных анализируемых вещества в одном образце по измерению интенсивности соответствующего флуоресцентного излучения.
27. Способ по любому из пп.24 – 26, отличающийся тем, что для определения интенсивности флуоресцентного излучения разных меток лучи от источников света (7, 7′) поочередно направляют на приемную полость (2), имеющую форму кюветы, или лучи от источников света (7, 7′) непрерывно направляют на приемную полость (2), имеющую форму кюветы, а фильтры (8, 8′) поочередно вводят в траекторию лучей между экраном (1) и детектором (5) и удаляют из нее.
28. Способ по п.24, отличающийся тем, что на различных местах поверхности приемной полости (2), имеющей форму кюветы, в соответствии с выбранной методикой биохимического анализа иммобилизируют разные или одинаковые химические или биохимические компоненты и в соответствии с количеством иммобилизованных компонентов в контейнере (10) с образцом содержатся комплементарные химические или биохимические компоненты, при этом путем измерения в различных местах разной интенсивности флуоресцентного излучения с помощью детектора (5), представляющего собой линейную или плоскостную схему светочувствительных детекторов, проводят количественное определение различных анализируемых веществ в образце.
29. Способ по п.24, отличающийся тем, что на различных местах поверхности приемной полости (2), имеющей форму кюветы, в соответствии с выбранной методикой биохимического анализа иммобилизируют разные или одинаковые химические или биохимические компоненты и в соответствии с количеством иммобилизованных компонентов в контейнере (10) с образцом содержатся комплементарные химические или биохимические компоненты, при этом в различных местах локально измеряют интенсивность флуоресцентного излучения путем перемещения диафрагмы (17), размер отверстия которой устанавливают в соответствии с желаемым геометрическим разрешением, охватывая всю поверхность приемной полости (2) детектором (5), для количественного определения различных анализируемых веществ в образце.
30. Способ по п.25, отличающийся тем, что на различных местах поверхности приемной полости (2) в соответствии с выбранной методикой биохимического анализа иммобилизируют разные или одинаковые химические или биохимические компоненты и в соответствии с количеством иммобилизованных компонентов в контейнере (10) с образцом содержатся комплементарные химические или биохимические компоненты, при этом в различных местах локально измеряют интенсивность флуоресцентного излучения путем перемещения диафрагмы (17), размер отверстия которой устанавливают в соответствии с желаемым геометрическим разрешением, охватывая всю поверхность приемной полости (2) детектором (5), для количественного определения различных анализируемых веществ в образце. , определяющим заданную глубину проникновения d кратковременного поля, на поверхность раздела (20) между оптически прозрачным экраном (1) из материала с коэффициентом преломления n1, большим коэффициента преломления n2 материала, расположенного над поверхностью раздела (20), отличающееся тем, что излучение направлено через экран (1) на поверхность раздела (20) приемной полости (2), выполненной в форме кюветы и имеющей толщину 0,001 – 0,5 мм, при этом контейнер (10) с образцом расположен так, чтобы обеспечить первое возможное соединение (9), которое по меньшей мере частично представляет собой отверстие между выполненной в форме кюветы приемной полостью (2) и контейнером (10) с образцом, и второе возможное соединение (11) с приемной полостью (2), выполненной в форме кюветы, причем приемная полость (2) закрыта покровной пластиной (3) со стороны, противоположной экрану (1), и с той стороны экрана (1), где расположен источник света (7), размещают детектор (5) для регистрации флуоресцентного излучения.
2. Устройство по п.1, отличающееся тем, что экран (1) и покровную пластину (3) соединяют прокладкой (4), в которой образована приемная полость (2) в форме кюветы.
3. Устройство по п. 2, отличающееся тем, что прокладка (4) является клейкой пленкой или фольгой.
4. Устройство по любому из пп.1 – 3, отличающееся тем, что излучение от источника/источников (7, 7′) поступает в экран (1) по меньшей мере через одну торцевую поверхность (24, 24′) экрана (1) или соединенного с экраном (1) оптически прозрачного тела (25), выполненного из материала с более высоким коэффициентом преломления, чем у материала над поверхностью раздела (20).
5. Устройство по п.4, отличающееся тем, что между экраном (1) и прозрачным телом (25) имеется оптически прозрачный слой (26), коэффициент преломления которого совпадает с коэффициентом преломления экрана (1) или прозрачного тела (25), либо указанный коэффициент преломления находится между коэффициентами преломления экрана (1) и прозрачного тела (25).
6. Устройство по любому из пп. 1 – 5, отличающееся тем, что источник/источники излучения (7, 7′) представляют собой одно или более лазерных диодов.
7. Устройство по любому из пп. 1 – 5, отличающееся тем, что источник/источники (7, 7′) излучают поляризованный свет либо после источников (7, 7′) излучения установлен поляризатор (18, 18′), а перед детектором (5) установлен поляризатор (6).
8. Устройство по любому из пп.1 – 7, отличающееся тем, что на траектории излучения непосредственно после источника/источников (7, 7′) соответственно установлено по одному оптическому фильтру (19, 19′).
9. Устройство по любому из пп.1 – 8, отличающееся тем, что перед детектором (5) установлен по меньшей мере один оптический фильтр (8, 8′).
10. Устройство по любому из пп.1 – 9, отличающееся тем, что оптические фильтры (8, 8′) выполнены с возможностью поочередного введения в траекторию излучения между экраном (1) и детектором (5) и выведения из нее.
11. Устройство по любому из пп.1 – 10, отличающееся тем, что на траектории излучения установлен один или несколько оптических модуляторов.
12. Устройство по любому из пп.1 – 11, отличающееся тем, что детектор (5) представляет собой линейную или плоскостную схему, содержащую несколько светочувствительных детекторов.
13. Устройство по любому из пп.1 – 12, отличающееся тем, что на траектории излучения перед детектором (5) установлена по меньшей мере одна линза (16, 16′).
14. Устройство по любому из пп.1 – 13, отличающееся тем, что на траектории излучения между экраном (1) и детектором (5) установлена диафрагма (17).
15. Устройство по п.14, отличающееся тем, что диафрагма (17) является подвижной.
16. Устройство по п.1, отличающееся тем, что содержит второй источник (7′) излучения, который излучает свет с длиной волны, вызывающей флуоресценцию второго маркировочного материала, и свет от обоих источник (7 и 7′) поочередно направляют на приемную полость (2).
17. Устройство по любому из пп.1 – 16, отличающееся тем, что маркировочный материал/материалы является/являются флуорофорами.
18. Устройство по любому из пп.1 – 17, отличающееся тем, что экран (1) изготовлен из оптически прозрачного материала, в частности из стекла или пластмассы.
19. Устройство по любому из пп.1 – 18, отличающееся тем, что второе соединительное отверстие (11) выполнено с возможностью присоединения к нему насоса или введения насоса в него.
20. Устройство по п.19, отличающееся тем, что в качестве насоса использовано полое тело (12) с поршнем (13).
21. Устройство по п.20, отличающееся тем, что в основании полого тела (12) помещен материал (14), впитывающий жидкость.
22. Устройство по любому из пп.1 – 21, отличающееся тем, что контейнер (10), предназначенный для образца, выполнен с возможностью введения в него полого тела (15), на внутренней стенке которого находятся антитела.
23. Устройство по п.22, отличающееся тем, что полое тело (15) закрыто снизу мембраной (23), на которой иммобилизованы антигены.
24. Способ проведения флуоресцентных иммунотестов посредством возбуждения кратковременным полем, отличающийся тем, что весь объем образца из контейнера (10) пропускают через приемную полость (2), имеющую форму кюветы, под действием сил всасывания, давления или капиллярных сил и в зависимости от биохимического анализа определяемые меченые химические или биохимические компоненты соединяются с соответствующими комплементарными химическими или биохимическими компонентами, иммобилизованными на поверхности приемной полости (2), при этом детектором (5) измеряют флуоресцентное излучение, возбуждаемое кратковременным полем, полученным с помощью света от источника/источников (7, 7′).
25. Способ по п.24, отличающийся тем, что проводят калибровочное измерение с химическим или биохимическим калибровочным компонентом, которые не определяет анализируемое в образце вещество и имеет другую метку, отличную от химического или биохимического компонента, используемого для определения анализируемого вещества, при этом количество химического или биохимического калибровочного компонента определяют детектором (5) с помощью второго источника излучения (7′) и второго оптического фильтра (8′).
26. Способ по п.24, отличающийся тем, что проводят количественный анализ двух разных химических или биохимических компонентов, меченных различными маркировочными материалами, с помощью двух источников излучения (7, 7′), которые излучают свет с длинами волн, вызывающими флуоресценцию соответствующих маркировочных материалов, так что количественно определяют два разных анализируемых вещества в одном образце по измерению интенсивности соответствующего флуоресцентного излучения.
27. Способ по любому из пп.24 – 26, отличающийся тем, что для определения интенсивности флуоресцентного излучения разных меток лучи от источников света (7, 7′) поочередно направляют на приемную полость (2), имеющую форму кюветы, или лучи от источников света (7, 7′) непрерывно направляют на приемную полость (2), имеющую форму кюветы, а фильтры (8, 8′) поочередно вводят в траекторию лучей между экраном (1) и детектором (5) и удаляют из нее.
28. Способ по п.24, отличающийся тем, что на различных местах поверхности приемной полости (2), имеющей форму кюветы, в соответствии с выбранной методикой биохимического анализа иммобилизируют разные или одинаковые химические или биохимические компоненты и в соответствии с количеством иммобилизованных компонентов в контейнере (10) с образцом содержатся комплементарные химические или биохимические компоненты, при этом путем измерения в различных местах разной интенсивности флуоресцентного излучения с помощью детектора (5), представляющего собой линейную или плоскостную схему светочувствительных детекторов, проводят количественное определение различных анализируемых веществ в образце.
29. Способ по п.24, отличающийся тем, что на различных местах поверхности приемной полости (2), имеющей форму кюветы, в соответствии с выбранной методикой биохимического анализа иммобилизируют разные или одинаковые химические или биохимические компоненты и в соответствии с количеством иммобилизованных компонентов в контейнере (10) с образцом содержатся комплементарные химические или биохимические компоненты, при этом в различных местах локально измеряют интенсивность флуоресцентного излучения путем перемещения диафрагмы (17), размер отверстия которой устанавливают в соответствии с желаемым геометрическим разрешением, охватывая всю поверхность приемной полости (2) детектором (5), для количественного определения различных анализируемых веществ в образце.
30. Способ по п.25, отличающийся тем, что на различных местах поверхности приемной полости (2) в соответствии с выбранной методикой биохимического анализа иммобилизируют разные или одинаковые химические или биохимические компоненты и в соответствии с количеством иммобилизованных компонентов в контейнере (10) с образцом содержатся комплементарные химические или биохимические компоненты, при этом в различных местах локально измеряют интенсивность флуоресцентного излучения путем перемещения диафрагмы (17), размер отверстия которой устанавливают в соответствии с желаемым геометрическим разрешением, охватывая всю поверхность приемной полости (2) детектором (5), для количественного определения различных анализируемых веществ в образце.
РИСУНКИ
MM4A – Досрочное прекращение действия патента СССР или патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 12.07.2006
Извещение опубликовано: 20.10.2007 БИ: 29/2007
|
||||||||||||||||||||||||||
