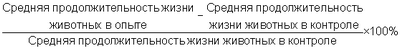Патент на изобретение №2308966
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
(54) АНТИМЕТАСТАТИЧЕСКАЯ КОМПОЗИЦИЯ
(57) Реферат:
Изобретение относится к области медицины. Композиция содержит соли серотонина с фармацевтически приемлемыми кислотами и мелиттин в соотношении 0.5-25 молей соли серотонина на 1 моль мелиттина, 10 моль соли серотонина на 1 моль мелиттина. Изобретение позволяет получить композицию, обладающую широким диапазоном антиметастатического действия. 1 з.п. ф-лы, 5 табл.
Данное изобретение относится к медицине, новым фармакологически активным композициям на основе природного пептида мелиттина и серотонина, в совокупности обладающим новой фармакологической активностью, а именно активностью в отношении метастазирующих злокачественных новообразований. Онкологические заболевания различной локализации широко распространены и являются одной из основных причин смертности населения всех возрастов. Опухолевый рост представляет собой сложный многостадийный процесс. Возникновение и прогрессирующее развитие опухоли зависит как от свойств раковых клеток, так и от состояния иммунологической реактивности организма (Batchelor J.R., Immunol. Today, 1989, 10, N 2, p.37-40; Pollock R.E., Sem. Surg. Oncol., 1989, 5, p.414-419). Этим определяется многообразие подходов к воздействию на рак. При лечении злокачественных новообразований используется один или несколько основных методов: хирургическое вмешательство, лучевая терапия, химиотерапия и иммунокоррекция. Цель большинства методов лечения – сократить до минимума массу опухолевых клеток. При солидных опухолях это, как правило, достигается хирургическим удалением опухоли. При лейкемиях и других генерализованных заболеваниях эта цель достигается с помощью массированной лучевой или химиотерапии. Однако ни один метод в отдельности не в состоянии уничтожить все опухолевые клетки и достичь радикального результата. Поэтому современная онкология почти всегда использует сочетанное воздействие нескольких методов лечения для элиминации оставшихся клеток опухоли. Окончательная судьба этих клеток, и, следовательно, судьба больного зависит от специфической активности механизмов противоопухолевого иммунитета (Takeda Y., J. Cancer Res. Clin. Oncol., 1989, 115, p.221-228; Ehrke M., Minich E., Reticuloendothel. Syst. Compr. Treatise, 1985, v.8, p.309-347). В соответствии с “Методическими рекомендациями по доклиническому изучению средств, обладающих способностью ингибировать процесс метастазирования и повышать эффективность цитостатической терапии злокачественных опухолей” Г.К.Герасимова, В.Е.Гольдберг, A.M.Козлов, и др., Москва, 1992, стр.2-5; антиметастатические препараты должны учитывать следующие особенности. Метастазирование злокачественной опухоли – каскад селективных биологических процессов, включающий специфическое взаимодействие опухолевых клеток с высоким метастатическим потенциалом с клетками и компонентами экстрацеллюлярного матрикса микроокружения, инвазию прилежащих нормальных тканей, проникновение опухолевых клеток в лимфу и кровь, транспортировку их с током биологических жидкостей, адгезию к клеточным и субклеточным субстратам в органах-мишенях и вторичную пролиферацию в зонах вторичного роста. Под антиметастатической активностью следует понимать способность фармакологического средства, воздействуя на те или иные биологические процессы, играющие существенную роль в механизме метастазирования злокачественной опухоли, препятствовать реализации признаков метастатического фенотипа опухолевых клеток. Отбор препаратов проводят на животных с перевиваемыми опухолями, при этом оценивают действие исследуемого вещества как на выраженность метастатического процесса, так и на эффективность цитостатического лечения. Соединения, характеризуемые как обладающие антиметастатической активностью и перспективные для апробации в клинике, должны обладать способностью эффективно ингибировать процесс спонтанного метастазирования перевиваемых опухолей (35-75% ингибирования). В настоящее время при лечении злокачественных новообразований наиболее часто используют циклофосфамид (S. Haga, T. Shimizu, H. Imamura, О. Watanabe, J. Kinoshita, М. Fukushima and Т. Kajiwara, Antitumor efficacy of combination chemotherapy with UFT and cyclophosphamide against human breast cancer xenografts in nude mice. Anticancer Res, May 1, 1999; 19 (3A): 1791-6). Однако он наиболее активен в комбинированной хемотерапии. Клиническим препаратом, наиболее близким по своим свойствам, по характеру и направлению действия, является единственный широко применяемый к настоящему времени антиметастатический препарат – разоксан (J.P.Braybrooke, K.J.O’Byrne, D.J.Propper, A.Blann, М.Saunders, N.Dobbs, C.Han, J.Woodhull, K.Mitchell, J.Crew, K.Smith, R.Stephens, T.S.Ganesan, D.C.Talbot, A.L.Harris. A Phase II Study of Razoxane. December 2000 Clinical Cancer Research, Vol.6, 4697-4704)
Использование разоксана в качестве антиметастатического препарата основано на следующих его особенностях. Разоксан способен ингибировать каталитическую активность топоизомеразы 2 в микромолярных концентрациях. Разоксан является активным ингибитором ангиогенеза; усиливает эффект цисплатина на основе способности усиливать антипролиферативный эффект цисплатина. Разоксан исследовался на различных моделях опухолей животных. Диапазон применяемых доз – 25-80 мг/кг (Gilbert J.M., Thompson E.M., Slavin G., Kark A.E. Inhibition of experimental calorectal cancer by razoxane (ICRF-159). Br.J.Surg., 1984, vol.71, pp.600-603; Lazo J.S., Ingber D.E., Sartorelli A.C. Enhancement of experimental lung metastases by cultured В16 melanoma cells treated with ICRF-159. Cancer Res., 1978, 38, pp.2263-2270; Giraldi Т. et. al. Selectivity of the antimetastatic and cytotoxic effects of 1-p-(3,3-dimethyl-1-triazeno)benzoic acid potassium salt, 1,2-di(3,5-dioxopiperazin-1-yl)propane in mice bearing Lewis Lung Carcinoma. Cancer Res., 1981, 41, pp.2524-2528; Bellet R.E. et. al. ICRF-159: current status and clinical prospects. Europ. J. Cancer, 1977, vol.13, pp.1293-1298). Более высокие концентрации являются токсическими, более низкие – неактивными. Следует отметить, что во всем диапазоне активных концентраций разоксан работает с примерно одинаковой эффективностью – ингибирование метастазирования практически не отличается в концентрации 30 мг/кг от ингибирования при концентрации 50-60 мг/кг (Giraldi Т. et. al. Selectivity of the antimetastatic and cytotoxic effects of 1-p-(3,3-dimethyl-1-triazeno)benzoic acid potassium salt, 1,2-di(3,5-dioxopiperazin-1-yl)propane in mice bearing Lewis Lung Carcinoma. Cancer Res., 1981, 41, pp.2524-2528). Известно использование серотонина Однако использование серотонина при лечении злокачественных опухолей требует довольно высокой концентрации его в лекарственном препарате. В то же время не обнаружено фактов применения серотонина в качестве препарата антиметастатического действия противоопухолевой терапии. Задачей, на решение которой направлено заявляемое изобретение, является расширение арсенала средств, которые могут быть использованы в качестве препаратов, активных в отношении метастазирующих злокачественных новообразований. Техническим результатом, который может быть получен при осуществлении изобретения, является получение нового антиметастатического препарата на основе пептида мелиттина и соли серотонина с фармацевтически приемлемыми кислотами. Поставленная задача достигается созданием биологически активной композиции, содержащей соли серотонина с фармацевтически приемлемыми кислотами, новизна которой заключается в том, что она дополнительно содержит мелиттин в соотношении 0.5-25 молей соли серотонина на 1 моль мелиттина, обладающей широким диапазоном антиметастатического действия. Структура мелиттина – Gly-Ile-Gly-Ala-Val-Leu-Lys-Val-Leu-Thr-Thr-Gly-Leu-Pro-Ala-Leu-Ile-Ser-Trp-Ile-Lys-Arg-Lys-Arg-Gln-Gln-NH2 описана в статье (Habermann E., Jentsch J. Sequence analysis of melittin from tryptic and peptic degradation products. Hoppe Seylers Z Physiol Chem 1967 Jan 348:1 37-50). В некоторых экспериментальных работах показана противоопухолевая активность мелиттина в отношении ряда культур опухолевых клеток (Bechinger В. J Membr Biol 156: 197-211, 1997, Kourie J. I. and Shorthouse A. A. Am J Physiol Cell Physiol, 2000, 278: C 1063 – C 1087). Имеются экспериментальные данные о том, что мелиттин специфически избирателен против клеток с высоким уровнем экспрессии онкогена ras (Sharma S.V. Melittin resistance: A counterselection for ras transformation., Oncogene, 1992 Vol.7 No.2 pp.193-201). Однако к настоящему времени отсутствуют какие-либо данные, свидетельствующие о наличии у него антиметастатической активности. Предлагаемые композиции, состоящие из пептида мелиттина и солей серотонина с фармацевтически приемлемыми кислотами, в совокупности обладают новой фармакологической активностью, а именно активностью в отношении метастазирующих злокачественных новообразований. Наиболее высокой антиметастатической активностью и более высоким терапевтическим индексом обладает биологически активная композиция, содержащая 10 моль соли серотонина на 1 моль мелиттина. В качестве солей серотонина с фармацевтически приемлемыми кислотами берут любую из коммерчески доступных в настоящее время солей, например креатинин сульфат, адипинат, гидрохлорид, малеат, оксалат. Использование в композиции серотонина в виде соли связано с неустойчивостью его основания. Композиция активна в отношении метастазирующих опухолей в диапазоне концентраций 0.001 до 2.5 мг/кг. Наиболее предпочтительным является диапазон концентраций 0.001 – 0.125 мг/кг. Приведенные примеры подтверждают, но не исчерпывают, предлагаемое изобретение. Пример 1. Способ получения композиции. Пептид мелиттин получают с использованием известной для получения пептидов (Хроматография. Практическое приложение метода. Под ред. Э.Хефтмана, М., Мир, 1986, ч.1, стр.43-68) одноступенчатой высокоэффективной препаративной обращенно-фазовой хроматографии на препаративных колонках большого диаметра. Используются колонки 50×250 мм и большего диаметра, заполненные носителем Диасорб 130 С16Т или аналогичным. Выделение пептида проходит в градиентном режиме. Преимуществом данного метода является возможность получения пептида высокой чистоты (до 99%) за одну хроматографию без использования сложной аппаратуры или многоступенчатых методов. Далее пептид лиофилизуют в лиофильной сушке. Антиметастатическую композицию получают стандартным для получения композиций, обладающих биологической активностью, способом, заключающимся в смешивании в необходимой пропорции с любой из коммерчески доступных в настоящее время солей серотонина, например креатинин-сульфата серотонина, растворении полученной смеси в бидистиллированной воде, с последующей обработкой раствора ультразвуком в течение 5-20 минут и удалением воды в лиофильной сушке. Лиофилизованный препарат хранится при комнатной температуре без потери активности. Перед его использованием препарат растворяют в физиологическом растворе, доводя до необходимой концентрации препарата. Проведение эксперимента Исследования проводили, используя следующие виды опухолей: лейкемия Р 388, меланома В16, метастазирующая опухоль легких Льюиса, аденокарцинома Са 755. Опухоль легких Льюиса, меланома В16, аденокарцинома Са 755 поддерживаются на мышах C57BL/6 или DBA/2 или BDF1 (DBA/2×C57BL/6) (во всех случаях используются самки). Для опытов трансплантируется по 105 клеток – в случае с опухолью легких Льюиса внутримышечно, для меланомы В16 – подкожно. Аденокарцинома Са 755 трансплантируется по 0.3 мл гомогената опухолевой ткани в разведении 1:2 s.c. Экспериментальные животные рассаживаются по клеткам и используются в опытах, начиная с первого дня после перевивки опухоли. Исследуемые соединения вводятся внутрибрюшинно в физиологическом растворе объемом не более 0.2 мл на животное. Для оценки влияния исследуемых соединений на различные этапы опухолевого роста его вводят в разные сроки с момента трансплантации опухолевых клеток. Животные с опухолью легких Льюиса и меланомой В16 забиваются на 23-25 сутки после трансплантации. Пример 2. Сравнительная антилейкемическая активность серотонина, мелиттина и композиции, состоящей из природного пептида мелиттина и креатинин-сульфата серотонина в мольном отношении 1:10. Проведение эксперимента. Эксперименты проводились на самках мышей-гибридов первого поколения BDF1 (DBA/2×C57BL/6), имеющих вес 18-22 г. Лейкемия Р388 прививалась внутрибрюшинно по 1×106 клеток в объеме 0,2 мл. Возраст инокулума во всех экспериментах составлял 7 суток. Все препараты исследовались при двух основных схемах введения: однократно, только через 24 часа после трансплантации лейкемии, и многократно, ежедневно с 1-х по 9-е сутки после трансплантации. Композиции использовали в водных растворах, объем введенного раствора не превышал 0,5 мл на мышь. Место инъекции обрабатывалось 96%-ным этиловым спиртом. В качестве контрольных использовались животные с лейкемией Р388, которым не вводили препаратов. Средняя продолжительность жизни не леченного контроля составляла 10,5-11,5 суток. Во всех экспериментах у контрольных животных в 100% случаев наблюдалась гибель от развития лейкозного процесса. Каждая доза препаратов испытывалась на группе из 6 животных, все эксперименты повторялись дважды. Оценка результатов проводилась через 60 суток после трансплантации экспериментальной лейкемии. Животные, дожившие до 60 суток, без признаков опухолевого роста, считались выжившими. Дополнительно определяли увеличение продолжительности жизни /ILS/, как отношение:
Пример 3. Активность композиции, состоящей из природного пептида мелиттина и креатинин-сульфата серотонина в мольном отношении 1:10, в отношении опухоли легких Льюиса.
Характерной особенностью разоксана является его эффективность только в определенные периоды развития метастазирования. Наиболее эффективен разоксан при его применении, начиная с первого дня после перевивки опухоли. При применении разоксана в более поздние сроки его эффективность заметно снижается (Giraldi Т. et. al. Selectivity of the antimetastatic and cytotoxic effects of 1-p-(3,3-dimethyl-1-triazeno)benzoic acid potassium salt, 1,2-di(3,5-dioxopiperazin-1-yl)propane in mice bearing Lewis Lung Carcinoma. Cancer Res., 1981, 41, pp.2524-2528, К.Hellmann, К.Burrage, Control of malignant metastases by ICRF159, Nature, 1969, 224, pp.273-275), в то время как эффективность предлагаемой композиции не зависит от времени применения и имеет более широкий временной диапазон эффективности. Пример 4. Активность композиции, состоящей из природного пептида мелиттина и креатинин-сульфата серотонина в мольном отношении 1:10, в отношении метастазирующей меланомы В16. В качестве препаратов сравнения используют антиметастатический препарат разоксан и стандартную комбинированную химиотерапию в виде циклофосфана и нитрозометилмочевины (НММ).
Пример 5. Активность композиции, состоящей из природного пептида мелиттина и креатинин-сульфата серотонина в мольном отношении 1:10, в отношении рецидивирующей аденокарциномы 755. Аденокарцинома Са 755 поддерживается на мышах С57ВС/6, для опытов трансплантируется по 0.3 мл гомогената опухолевой ткани в разведении 1:2 s.c. В качестве препаратов сравнения используют циклофосфан.
Пример 6. Активность композиции, состоящей из природного пептида мелиттина и креатинин-сульфата серотонина в разных мольных сочетаниях, в отношении опухоли легких Льюиса.
Из анализа экспериментальных данных примеров действия композиций следует, что композиция, состоящая из пептида мелитина и серотонина в мольном соотношении 1:10, показывает высокую эффективность в большом временном диапазоне и в большом диапазоне концентраций не только в отношении противоопухолевой активности (см. таблицы 1, 3, 4), но и как антиметастатическая (см. таблицы 2, 3, 5). Наиболее оптимальные результаты получают при мольном соотношении пептида мелитина и серотонина, равном 1:10. Отличительной и важной особенностью действия композиции является низкая действующая концентрация: необходимая для достижения эффекта концентрация более чем в 1500 раз ниже, чем у известного антиметастатического препарата разоксана или более чем в 800 раз ниже, чем у известного противоопухолевого препарата циклофосфана (таблицы 1-5).
Формула изобретения
1. Биологически активная композиция, содержащая соли серотонина с фармацевтически приемлемыми кислотами, отличающаяся тем, что она дополнительно содержит мелиттин в соотношении от 0,5 до 25 моль соли серотонина на 1 моль мелиттина, обладающая широким диапазоном антиметастатического действия. 2. Биологически активная композиция по п.1, отличающаяся тем, что она содержит 10 моль серотонина на 1 моль мелиттина.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

 для лечения злокачественных опухолей (М.Д.Машковский «Лекарственные средства», М. «Медицина» 1993, ч.1, стр.366). Однако известен и отрицательный эффект от его применения – стимуляция роста опухолей (Е. Vicaut, E. Laemmel and О. Stucker. Impact of serotonin on tumour growth. Ann Med, April 1, 2000; 32 (3): 187-94). Имеются данные о том, что при некоторых формах опухолей увеличивается концентрация серотонина в тромбоцитах и, вероятно, в плазме крови и экскреция с мочой его метаболитов (I.P. Kema, E.G. de Vries, M.J. Slooff, В. Biesma, and F.A. Muskiet. Serotonin, catecholamines, histamine, and their metabolites in urine, platelets, and tumor tissue of patients with carcinoid tumors. Clin. Chem., Jan 1994; 40: 86-95).
для лечения злокачественных опухолей (М.Д.Машковский «Лекарственные средства», М. «Медицина» 1993, ч.1, стр.366). Однако известен и отрицательный эффект от его применения – стимуляция роста опухолей (Е. Vicaut, E. Laemmel and О. Stucker. Impact of serotonin on tumour growth. Ann Med, April 1, 2000; 32 (3): 187-94). Имеются данные о том, что при некоторых формах опухолей увеличивается концентрация серотонина в тромбоцитах и, вероятно, в плазме крови и экскреция с мочой его метаболитов (I.P. Kema, E.G. de Vries, M.J. Slooff, В. Biesma, and F.A. Muskiet. Serotonin, catecholamines, histamine, and their metabolites in urine, platelets, and tumor tissue of patients with carcinoid tumors. Clin. Chem., Jan 1994; 40: 86-95).