Патент на изобретение №2158915
|
||||||||||||||||||||||||||
(54) СПОСОБ ОПРЕДЕЛЕНИЯ ГИДРОФОБИЗИРУЮЩИХ СВОЙСТВ ХИМРЕАГЕНТОВ
(57) Реферат: Изобретение относится к способам контроля гидрофобизации твердой поверхности природных и техногенных пористых сред при применении химреагентов-гидрофобизаторов и может быть использовано в различных отраслях промышленности, в том числе в нефтяной. В способе определения гидрофобизирующих свойств химреагентов по отношению к поверхности пористых сред, включающем определение интенсивности процессов адсорбции химреагентов на поверхности пористой среды из водного раствора, последовательно пористую среду приводят в контакт с водным раствором электролита, дожидаются равновесия процесса образования на поверхности пористой среды гидрофильного ионно-гидратного слоя, вносят в подготовленную систему химреагенты и их гидрофобизирующие свойства определяют по интенсивности процессов десорбции электроактивных компонентов гидрофильного ионно-гидратного слоя, электрохимически сопряженных с процессами его разрушения при адсорбции химреагентов на поверхности пористой среды. Технический результат – повышение эффективности определения гидрофобизирующих свойств химреагентов. 2 з.п. ф-лы, 7 ил. Изобретение относится к способам контроля гидрофобизации твердой поверхности природных и техногенных пористых сред при применении химреагентов-гидрофобизаторов и может быть использовано в различных отраслях промышленности, в том числе в нефтяной. Известны способы определения гидрофобизирующих свойств химреагентов путем определения скорости смачивания бентонитовой глины на приборе Жигача-Ярова [1]. Основным недостатком известного способа является то, что определение осуществляется на пробах глины, связано со скоростью ее набухания и не подходит для исследования реагентов на песчаных и карбонатных пористых средах. Известны способы оценки гидрофобизирующих свойств химреагентов путем определения краевого угла смачивания в системе жидкость – твердая поверхность [2]. Недостатком известного способа является то, что он не пригоден для исследования гидрофобизирующих свойств реагентов в пористых средах. Наиболее близка по существу решаемой задачи заявляемого способа методика, основанная на измерении кинетики пропитки, которая позволяет определить среднюю скорость впитывания воды в исследуемом интервале времени и максимальную массу воды, впитавшуюся в пористую среду за то же время [3], до и после контакта образца пористой среды с гидрофобизатором. Главный недостаток способа по прототипу заключается в необходимости использования весового метода измерения массы адсорбированной воды для каждой исследуемой концентрации реагента (опыт – “точка”), что связано с необходимостью многократного реального определения массы образца пористой среды до и после пропитки, в процессе которого его необходимо доводить до постоянной массы. Трудоемкость и недостаточная точность такого рода методов широко известна. Другим существенным недостатком использования гравиметрического метода в известном способе является “интегральность” показателя массы и несвязанность его напрямую с физико-химическими механизмами проявления гидрофильных и гидрофобных свойств поверхности. Энергетические и кинетические параметры адсорбционных процессов в этом случае не определяются. Указанные недостатки показывают недостаточную эффективность известного метода. Решаемой задачей заявляемого способа является повышение эффективности определения гидрофобизирующих свойств химреагентов по отношению к поверхности пористых сред. Ожидаемым техническим результатом изобретения является упрощение известного способа определения гидрофобизирующих свойств химреагентов и повышение надежности их установления при обработке реагентами поверхности пористых сред. Определение изменения гидрофильности и гидрофобности поверхности пористой среды проводят путем количественной оценки термодинамических и кинетических параметров создания и разрушения ионно-гидратного комплекса на поверхности пористой среды при адсорбции его компонентов из жидкой фазы (раствора электролита) и последующей десорбции в процессе контакта с химреагентами. Поставленная задача решается тем, что последовательно пористую среду приводят в контакт с водным раствором электролита, дожидаются равновесия процесса образования на поверхности пористой среды гидрофильного ионно-гидратного слоя, вносят в подготовленную систему химреагенты, и их гидрофобизирующие свойства определяют по интенсивности процессов десорбции электроактивных компонентов гидрофильного ионно-гидратного слоя, электрохимически сопряженных с процессами его разрушения при адсорбции химреагентов на поверхности пористой среды. В качестве водного раствора электролита используют нефтепромысловую воду или ее модель. Интенсивность процессов десорбции электроактивных компонентов гидрофильного ионно-гидратного слоя определяют потенциометрически с использованием анионобратимых концентрационных электрохимических цепей, сопряженных с процессами десорбции. С учетом электроактивности компонентов ионно-гидратного слоя, изменение их концентрации в растворе определяют с использованием сопряженной электрохимической системы – анионобратимой концентрационной цепи, количественные определения компонентов которой проводят потенциометрически. Сопоставительный анализ существенных признаков предлагаемого технического решения и прототипа позволяет сделать вывод о соответствии заявляемого изобретения критерию “новизна”. Определение гидрофобизирующей способности химреагентов по изменению концентрации электроактивных компонентов ионно- гидратного слоя, вытесняемых гидрофобизатором из пористой среды в процессе его адсорбции на ее поверхности, ранее не предлагалось. В настоящее время гидрофобизирующие свойства химреагентов исследуются в рамках определения изменения смачивающей способности поверхности пористой среды дистиллированной водой, массу или объем которой определяют дискретно, после обработки поверхности конкретной концентрацией химреагента. При этом получают ряд точек, дающих в итоге кривую зависимости гидрофобизирующей способности реагентов от их концентрации. Следует отметить, что дистиллированная вода в прототипе играет роль “рабочего тела”, выполняющего функции индикатора изменения свойств поверхности – гидрофильности или гидрофобности. В реальных нефтепромысловых условиях смачивание пористых сред (коллекторов) пластовыми водами, имеющими различный катионно- анионный состав (минерализацию), приводит к созданию ионно- гидратного слоя, определяющего гидрофильные свойства поверхности. Таким образом, смачивание (и его количественное определение) дистиллированной водой пористых сред не может служить полностью объективным критерием гидрофобизирующей способности химреагентов. Что касается “изобретательского уровня”, то соответствие ему заявляемого технического решения определяется тем, что для определения гидрофобизирующих свойств химреагентов по отношению к пористой среде используется электродный потенциал, определяемый в системе раствор – реагент – пористая среда с помощью специальной проточной электрохимической системы. “Неожиданность” технического решения по предлагаемому способу заключается в том, что непосредственное измерение ЭДС позволяет определить необходимые энергетические и кинетические параметры процесса гидрофобизации гидрофильной поверхности пористой среды. Кроме того, чисто технические возможности гравиметрической и объемной методик, адаптированных к определению смачиваемости, не позволяют провести автоматизацию процессов испытаний ввиду особенностей цепочки последовательности операций. В противоположность прототипу, заявляемый способ поддается автоматизации в форме записи электрического сигнала самопишущим потенциометром, непосредственно подключенным к высокоомному милливольтметру, осуществляющему измерение ЭДС концентрационной цепи, сопряженной с переносом электроактивных компонентов ионно-гидратного слоя. В отличие от прототипа, заявляемое техническое решение предполагает прямое непрерывное непосредственное определение гидрофобизирующей способности химреагентов в зависимости от их концентрации в кинетическом режиме, по ходу испытаний, без замены растворов и образца пористой среды для каждой концентрации. Способ осуществляют следующей последовательностью операций. 1. Отбор образца нефтепромысловой (пластовой) воды или приготовление ее модели. 2. Подготовка образца породы продуктивного пласта (дезинтегрированного керна). 3. Приведение в контакт керна и нефтепромысловой воды. 4. Потенциометрическое определение кинетики создания гидрофильного ионно-гидратного слоя в процессе адсорбции его электроактивных компонентов на поверхности пористой среды до установления равновесного значения ЭДС сопряженной концентрационной цепи. 5. Внесение в систему химреагента-гидрофобизатора и потенциометрическое определение кинетики разрушения гидрофильного ионно-гидратного слоя в процессе десорбции его электроактивных компонентов с поверхности пористой среды путем установления нового равновесного значения ЭДС сопряженной концентрационной цепи под влиянием изменяющейся концентрации гидрофобизаторов, адсорбирующихся на поверхности пористой среды. Осуществление способа предполагает использование проточной электрохимической системы, фиг. 1, состоящей из термостата 1, электрохимической ячейки 2, содержащей емкость-отсек для песка (керна) 3, электродную пару (4 – электрод сравнения, 5 – рабочий электрод); циркуляцию жидкой фазы задают перистальтическим насосом 6, измерение ЭДС проводят высокоомным милливольтметром – электрометром 7. Автоматизирующее устройство в заявляемом способе представлено реле времени 8, управляющим работой насоса и электромеханического дозатора 9. Регистрацию ЭДС осуществляют самопишущим потенциометром 10, сигнал на который поступает с выхода электрометра. Ниже представлено описание последовательности осуществления способа в автоматизированном режиме. Ход эксперимента. Электрохимическую ячейку заполняют исследуемой жидкой фазой (нефтепромысловая или модельная вода) в объеме 100 см3, после чего термостатируют при заданной температуре, осуществляя циркуляцию жидкости с помощью перистальтического насоса. Для определения ЭДС ячейки используют высокоомный милливольтметр, тока через ячейку – микроамперметр аналогичного типа, не создающие гальванической связи и нагрузки на электроды. После достижения стационарности потенциала и отсутствия тока осуществляют загрузку емкости керном. Отрицательное избыточное давление за счет работы насоса приводит к плотному распределению керна на поверхности фильтра с образованием слоя, через который осуществляют фильтрацию жидкости. Показатели адсорбции измеряют как функцию электродного потенциала (ЭДС), концентрацию ионов рассчитывают в виде относительной мольной доли электролита, удаленного из раствора. После выхода на стационарный уровень электродного потенциала проводят исследование влияния химреагентов-гидрофобизаторов, для чего их последовательно вносят в систему, увеличивая концентрацию по мере достижения стационарных уровней ЭДС. Реагенты-гидрофобизаторы, формально диссоциирующие на ионную пару по типу [Kat][An]<——> Kat+ + An–, не вносят вклада в общую ЭДС при избытке фонового электролита ввиду низкой подвижности “органического” иона и связанного с этим низким числом переноса, т.е. гидрофобизатор-электролит ведет себя как “ионный двойник”-асоциированный сольватированный комплекс [4] и не влияет на концентрацию фоновых электроактивных частиц – ионов. В этом отношении его электрохимическое поведение аналогично электронейтральным молекулярным реагентам. О завершенности эксперимента судят по степени выхода ионов из пористой среды в раствор, т.е. по постепенному возвращению системы к исходному значению разности потенциалов. Масса образца дезинтегрированного керна – 1,5 г. Чувствительность метода – до 10-6 моль (в реальном опыте не требовалось более 10-3 от статистического значения числа Авогадро). Математическую обработку данных эксперимента (расчет свободных энергий и энергий активации) ведут стандартными методами. В реализации способа использовано отечественное оборудование и измерительные системы (электрохимическая ячейка “Биопром”, Пущине, хлорсеребряные электроды ЭХСВ-1 с полимерной мембраной, электрометры В7-35 и В7-38, перистальтический насос типа 304, реле времени 2РВМ). Физико-химическая интерпретация экспериментальных данных. Термодинамическая характеристика процесса адсорбции электроактивных частиц (ионов) из жидкой фазы на поверхность твердой может быть найдена из выражения:  G = -RTlnK, (1) G = -RTlnK, (1)где  G – изменение изобарно-изотермического потенциала (энергии Гиббса), G – изменение изобарно-изотермического потенциала (энергии Гиббса),R – универсальная газовая постоянная, Т – заданная абсолютная температура, К – константа равновесия. Последовательность теоретического расчета константы К следующая. В качестве исходного уравнения используют известное выражение:  G = -nFE, (2) G = -nFE, (2)где n – заряд иона, F – постоянная Фарадея (электрохимическая константа), Е – ЭДС электрохимической цепи, сопряженной с потенциалопределяющей реакцией. Ввиду поликомпонентности электролита (нефтепромысловой воды) n – не определено. Однако, мольная доля молекул, диссоциирующих на ионы, будет равна: X = Ni/  Ni, (3) Ni, (3)где Ni – количество молекул, диссоциирующих на ионы, моль;  Ni – общее количество молей растворенных частиц.
Изменение химического потенциала системы на 1 моль при постоянных температуре и давлении равно изменению энергии Гиббса: Ni – общее количество молей растворенных частиц.
Изменение химического потенциала системы на 1 моль при постоянных температуре и давлении равно изменению энергии Гиббса:  = =  G/ G/ Ni = Ni =  G. (4) G. (4)Поскольку частицы несут заряд (ионы), работа по их переносу сопровождается изменением электрического потенциала системы, что тождественно равно изменению ЭДС. Учитывая равнораспределение энергии (4) по числу частиц (3), оценивают изменение относительной концентрации по “долевому участию” сортов частиц в формировании одного моля, т.е. в количестве числа Авогадро (NA = 6,022  1023).
Согласно уравнению Нернста для концентрационных цепей, ЭДС равна: 1023).
Согласно уравнению Нернста для концентрационных цепей, ЭДС равна: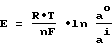 (5) (5)где a0 – активность ионов в исследуемой системе, ai – активность ионов в системе сравнения. После нормализации уравнения, необходимой для исключения влияния начальных условий на величину исходной ЭДС, (In a0/ai =1)=>2,303 lg10/1. Нормированное значение ЭДС (EN) равно: 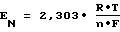 , (6) , (6)с учетом того, что a0 – изменяется в процессе сорбции, а = const, то Ex ~ lgX, (7) что означает направленность химической работы на изменение мольной доли электроактивных частиц в растворе. Тогда: 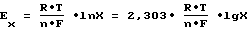 , (8) , (8)Отношение Ex/EN=lgX, что соответствует искомой мольной доле (концентрации) сорбированных (удаленных из раствора) электроактивных частиц-ионов. Проведение преобразований приводит к выражению для  G: G: G = -2,303 G = -2,303 R R T T lgX, или -2,303 lgX, или -2,303 R R T T (Ex/EN)=-2,303 (Ex/EN)=-2,303 8,314(273,15+to) 8,314(273,15+to) (Ex/EN) (Ex/EN)и окончательно:  G = -19,147 G = -19,147 (273,15+to)-(Ex/EN), (кДж/моль) (9) (273,15+to)-(Ex/EN), (кДж/моль) (9)где Ex – текущее измеряемое значение ЭДС, EN – нормированное значение ЭДС до начала опыта. Суммарный энергетический профиль рассчитывают по формуле:  G = -19,147 G = -19,147 (273,15+to) (273,15+to) lgX lgX 10-3. (10) 10-3. (10)Изложенный подход характеризуется наиболее полным использованием возможных энергий взаимодействия внутри рассматриваемой системы. Энергию активации находят по формуле 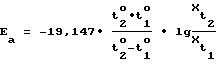 (11) (11)подставляя 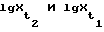 , полученные при температурах t2o и t1o.
Способ иллюстрируется следующими примерами.
Пример 1. Определение основных характеристик создания гидрофильного ионно-гидратного слоя при адсорбции его на поверхности пористой среды.
В реальных нефтепромысловых условиях смачиваемость пород пластов – коллекторов осуществляется водами различной минерализации – растворами электролитов. Содержание электроактивных компонентов (ионов) в нефтепромысловых водах позволяет использовать заявляемый способ для оценки адсорбционной способности исследуемой пористой среды. Одновременно решают и две другие задачи – устанавливают реальную адсорбционную “емкость” центров связывания на поверхности пористой среды, что имеет существенное значение для последующего экспериментального применения концентрации гидрофобизирующих реагентов при эквивалентном “вытеснении” ими гидрофильных компонентов и определяют расчетным методом термодинамические и кинетические параметры создания гидрофильного ионно-гидратного слоя для его эффективного разрушения химреагентами.
Эксперимент проведен с образцами минерализованной нефтепромысловой воды и дезинтегрированного керна пласта БС4 Приразломного нефтяного месторождения. На фиг. 2 представлены кинетические кривые изменения мольной доли сорбированного электролита в процессе адсорбции на поверхности пористой среды при различных температурах.
Равновесная мольная доля сорбированного электролита увеличивается с температурой (активированная адсорбция). Процесс сорбции характеризуется невысокой энергией активации в пределах таковой для вязкого течения воды (энергия разрыва водородных связей) и имеет реальный энергетический выход, рассчитанный по формуле 11, составляет 15 кДж/моль. Результаты эксперимента позволяют сделать следующие практически значимые заключения: , полученные при температурах t2o и t1o.
Способ иллюстрируется следующими примерами.
Пример 1. Определение основных характеристик создания гидрофильного ионно-гидратного слоя при адсорбции его на поверхности пористой среды.
В реальных нефтепромысловых условиях смачиваемость пород пластов – коллекторов осуществляется водами различной минерализации – растворами электролитов. Содержание электроактивных компонентов (ионов) в нефтепромысловых водах позволяет использовать заявляемый способ для оценки адсорбционной способности исследуемой пористой среды. Одновременно решают и две другие задачи – устанавливают реальную адсорбционную “емкость” центров связывания на поверхности пористой среды, что имеет существенное значение для последующего экспериментального применения концентрации гидрофобизирующих реагентов при эквивалентном “вытеснении” ими гидрофильных компонентов и определяют расчетным методом термодинамические и кинетические параметры создания гидрофильного ионно-гидратного слоя для его эффективного разрушения химреагентами.
Эксперимент проведен с образцами минерализованной нефтепромысловой воды и дезинтегрированного керна пласта БС4 Приразломного нефтяного месторождения. На фиг. 2 представлены кинетические кривые изменения мольной доли сорбированного электролита в процессе адсорбции на поверхности пористой среды при различных температурах.
Равновесная мольная доля сорбированного электролита увеличивается с температурой (активированная адсорбция). Процесс сорбции характеризуется невысокой энергией активации в пределах таковой для вязкого течения воды (энергия разрыва водородных связей) и имеет реальный энергетический выход, рассчитанный по формуле 11, составляет 15 кДж/моль. Результаты эксперимента позволяют сделать следующие практически значимые заключения:1) при контакте нефтепромысловой воды с породой на последней формируется ионно-гидратный гидрофильный слой, создание которого энергетически выгодно; 2) для разрушения этого слоя химреагентами – гидрофобизаторами требуется избыточная энергия около 30 кДж/моль (расчет по формуле (10)); 3) создание и разрушение гидрофильного ионно-гидратного слоя на поверхности пористой среды (породы) может служить надежным индикатором изменения смачиваемости реальными минерализованными нефтепромысловыми водами (пластовыми, пресными, сточными). Пример 2. Определение гидрофобизирующих свойств низкомолекулярных химреагентов. В качестве низкомолекулярного гидрофобизирующего реагента использовано производное уротропина. Уротропин и его алкилпроизводное – гексаметилентетраминаллилхлорид, препарат ЛПЭ-11 (ТУ 6-01-1012949- 08-89) применяются в нефтепромысловой практике в качестве бактерицидов для подавления сульфатредукции. Одновременно они обладают гидрофобизирующей способностью по отношению к поверхности породы, адсорбируясь на ней. Заявляемый способ позволяет оценить параметры адсорбции реагентов ряда уротропина. На фиг. 3 и 4 приведены результаты реализации заявляемого способа при адсорбции собственно уротропина как индивидуального химического соединения и его производного ЛПЭ-11в. При температурах пласта около 80oC, характерных для Западно-Сибирских месторождений нефти, концентрация уротропина, эффективно разрушающая ионно-гидратный слой, составляет более 0,1 мас.% и не дает полного вытеснения вплоть до 1,0%, в то время как ЛПЭ-11 дает эффект в концентрациях 0,02-0,10 мас.%. При более низких температурах ввиду понижения прочности адсорбционной связи ионно-гидратного слоя с породой, уротропин более эффективно разрушает гидрофильный комплекс поверхности породы – в концентрациях от 0,05 мас. %. Что касается ЛПЭ-11в, то его эффективность зависит от температуры слабее. Полученный результат позволяет определить гидрофобизирующие свойства химреагентов непосредственно в процессе адсорбции по снижению содержания гидратных компонентов на поверхности породы. Пример 3. Определение гидрофобизирующей способности реагента – гидрофобизатора ГКЖ-11. Кремнийорганическое соединение – ГКЖ-11 применяется в нефтяной промышленности непосредственно как типичный гидрофобизатор. На фиг. 5 отображены результаты проведенных экспериментов. Начальной эффективной концентрацией ГКЖ-11 в качестве гидрофобизатора является 0,02 мас.%, конечная составляет около 0,05 мас.%. По эффективности разрушения гидрофильного слоя ГКЖ-11 занимает промежуточное место между уротропиновыми основаниями и полимерами. Пример 4. Определение гидрофобизирующих свойств полимеров при адсорбции на поверхности пористой среды. В нефтяной промышленности используются полимеры ВПК-402 (ТУ 6-05-2009-86) в качестве биостойкого загустителя и полиакриламиды различных молекулярных масс для выравнивания фронта закачиваемой в пласт воды. Адсорбционные свойства таких реагентов следует определять и в аспекте их способности к гидрофобизации поверхности пород. Заявляемый способ позволяет оценить гидрофобизирующую способность полимеров по характеристикам разрушения ими гидрофильного ионно- гидратного слоя, компоненты которого оказываются “вытесненными” в свободную фазу в процессе конкурентной адсорбции химреагентами – полимерами. На фиг. 6 и 7 представлены результаты применения заявляемого способа с использованием ВПК-402 производства АО “Каустик” (г.Стерлитамак) и полиакриламида марки DKS-ORP 25N фирмы “Иточу” (Япония). Кинетика адсорбции полимеров, регистрируемая как сопряженная с выходом электроактивных компонентов ионно-гидратного слоя величина, характеризуется высокой интенсивностью. Конечной эффективной концентрацией ВПК-402, обеспечивающей полное разрушение гидрофильного слоя, является 0,05 мас.%. Для полиакриламида она составляет 0,01 мас.%. Высокая адсорбционная способность полимеров связана, очевидно, с большим числом ионогенных групп, несущих нескомпенсированный электрический заряд и взаимодействующих с активными связывающими центрами на поверхности породы. Результаты показывают, что замещение полимерами поверхностной “емкости” пористой среды приводит к снижению смачиваемости, т.е. эффекту гидрофобизации. Таким образом, заявляемый способ действительно позволяет определить гидрофобизирующие свойства химреагентов по эффективности разрушения гидрофильного ионно-гидратного слоя. Способ менее трудоемок по сравнению с прототипом, поддается автоматизации, эффективен и промышленно применим, т.к. для его реализации используют доступное оборудование и материалы. Источники информации 1. Городнов В. Д. Физико-химические методы предупреждения осложнений в бурении.- М: Недра, 1984. 2. Григоров О.Н., Карпова И.Ф., Козьмина З.П. и др. Руководство к практическим работам по коллоидной химии.-М., Л.: Химия, 1964. – С.133-141. 4. Антропов Л.И. Теоретическая электрохимия. – М.: Высш. шк., 1984, 519 с. Формула изобретения
РИСУНКИ
PC4A – Регистрация договора об уступке патента Российской Федерации на изобретение
Прежний патентообладатель:
(73) Патентообладатель:
Дата и номер государственной регистрации перехода исключительного права: 16.03.2004 № 18713
Извещение опубликовано: 10.08.2004 БИ: 22/2004
PC4A – Регистрация договора об уступке патента Российской Федерации на изобретение
Прежний патентообладатель:
(73) Патентообладатель:
Дата и номер государственной регистрации перехода исключительного права: 04.10.2005 № РД0002515
Извещение опубликовано: 20.12.2005 БИ: 35/2005
MM4A – Досрочное прекращение действия патента СССР или патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 21.12.2005
Извещение опубликовано: 20.02.2007 БИ: 05/2007
|
||||||||||||||||||||||||||
