|
|
(21), (22) Заявка: 2004103072/15, 02.07.2001
(24) Дата начала отсчета срока действия патента:
02.07.2001
(43) Дата публикации заявки: 27.03.2005
(46) Опубликовано: 27.10.2007
(56) Список документов, цитированных в отчете о
поиске:
WO 0127135 А2, 19.04.2001. WO 0041545 А2, 20.07.2000. WO 9952534 A1, 21.10.1999. TAIPALE ET AL: “Effects of oncogenic mutations in Smoothened and Patched can be reversed by cyclopamine”, NATURE, MACMILLAN JOURNALS LTD. LONDON, GB, vol. 406, no 6799, 31 August 2000, abstract. Chen W., Burgess S., Hopkins N.: «Analysis of the zebrafish smoothened
(85) Дата перевода заявки PCT на национальную фазу:
02.02.2004
(86) Заявка PCT:
TR 01/00027 (02.07.2001)
(87) Публикация PCT:
WO 02/078703 (10.10.2002)
Адрес для переписки:
119034, Москва, Пречистенский пер., 14, стр.1, 4 этаж, “Гоулингз Интернэшнл Инк.”, В.Н.Дементьеву
|
(72) Автор(ы):
АВСИ Октай (TR)
(73) Патентообладатель(и):
ТАШ Шинан (TR)
|
(54) ПРИМЕНЕНИЕ ЦИКЛОПАМИНА ДЛЯ ЛЕЧЕНИЯ БАЗАЛЬНО-КЛЕТОЧНОЙ ЭПИТЕЛИОМЫ (КАРЦИНОМЫ) И ДРУГИХ ОПУХОЛЕЙ
(57) Реферат:
Заявленное изобретение включает применение ингибиторов. Данное изобретение относится к применению циклопамина и его фармацевтически приемлемой соли для изготовления фармацевтического средства для индукции апоптоза опухолевых клеток, которые используют передачу сигнала Hedgehog/Smoothened, для предупреждения апоптоза. Циклопамин вызывает апоптоз не по генотоксическому механизму и тем отличается от лучевой терапии и большинства современных противораковых химиотерапевтических средств, которые действуют, повреждая ДНК. Эти новые эффекты, не достижимые ранее в химиотерапии рака, делают в высшей степени желательным применение циклопамина в терапии рака, при лечении ВСС и других опухолей, которые используют путь сигнальной трансдукции hedgehog/smoothened белка для пролиферации и предупреждения апоптоза, 5 з.п. ф-лы, 1 табл., 7 ил.
(56) (продолжение):
CLASS=”b560m”mutant reveals conserved and divergent functions of hedgehog activity». Development. 2001 Jun; 128(12):2385-96, abstract.
Данное изобретение относится к применению in vivo – для достижения терапевтического эффекта в отношении базально-клеточной эпителиомы (карциномы, ВСС) – циклопамина, вызывающего дифференцировку опухолевых клеток и в то же самое время апоптотическую гибель и удаление этих опухолевых клеток при сохранении нормальных клеток ткани, включая недифференцированные клетки нормального эпидермального базального слоя и волосяных фолликул. Циклопамин вызывает апоптоз не по генотоксическому механизму и тем отличается от лучевой терапии и большинства современных противораковых химиотерапевтических средств, которые действуют, повреждая ДНК. Эти новые эффекты, не достижимые ранее в химиотерапии рака, делают в высшей степени желательным применение циклопамина в терапии рака, при лечении ВСС и других опухолей, которые используют путь сигнальной трансдукции hedgehog/smoothened белка для пролиферации и предупреждения апоптоза.
Базально-клеточная эпителиома (карцинома) является обычной эпителиальной опухолью. С возрастом она встречается все чаще. Современные методы лечения ВСС включают хирургическое иссечение опухоли вместе с пограничной нормальной тканью и, когда хирургическая операция невозможна или нежелательна, разрушение опухолевых клеток под действием ионизирующего излучения или другими способами. Хотя возможными побочными эффектами являются образование шрамов и неэстетический вид, хирургическая операция, при которой не остается опухолевых клеток, может привести к излечению. Лучевая терапия вызывает значительное безвозвратное повреждение ДНК, которое, в свою очередь, включает механизм апоптотической гибели опухолевых клеток. Этот способ действия лучевой терапии, т.е. апоптоз вторичен по отношению к повреждению ДНК, аналогичен способам действия многих химиотерапевтических агентов, применяемых в настоящее время для лечения рака. Однако как лучевая терапия, так и цитотоксические противораковые химиотерапевтические средства способны вызывать повреждение ДНК в нормальных клетках пациентов помимо опухолевых клеток. В результате этого эффективность и пригодность этих методов в терапии рака в значительной степени ограничена. Дополнительным затруднением, возникающим при применении облучения и генотоксических противораковых химиотерапевтических веществ, является тот тревожный факт, что даже когда достигается излечение первичной опухоли, у больных заметно повышается риск развития новых случаев рака вследствие повреждения ДНК и мутаций в результате лечения первичной опухоли. Следовательно, селективная индукция апоптоза в опухолевых клетках негенотоксическим способом является наиболее желательной в области терапии рака.
В ВСС часто наблюдаются инактивирующие мутации гена patched, который кодирует трансмембранный белок, действующий как рецептор белков hedgehog, идентифицируемых прежде всего по своему действию на структурирование ткани в процессе развития. Не будучи связанным в качестве лиганда с белком hedgehog, белок patched действует, ингибируя внутриклеточную сигнальную трансдукцию по механизму другого трансмембранного белка, smoothened. Связывание hedgehog с patched вызывает ослабление этого ингибирования. Затем внутриклеточная сигнальная трансдукция по ослабленному пути белка smoothened инициирует ряд клеточных событий, приводящих в конце концов к изменениям экспрессии целевых генов hedgehog и поведения клетки. Общие особенности hedgehog/smoothened пути сигнальной трансдукции, первоначально идентифицированные в Drosophila (в дрозофиле), сохраняются в разнообразных живых организмах от Drosophila до Человека. Однако путь становится более сложным в прогрессивных организмах (например, присутствие в организме человека более одного гена, проявляющего значительное сходство с единичным геном patched дрозофилы). Найдено, что инактивирующие мутации в patched вызывают конститутивную (без лиганда) передачу сигнала по hedgehog/smoothened пути. Сверхактивность hedgehog/smoothened пути, являющаяся результатом мутаций patched и/или дополнительных элементов 5′-3’пути, обнаружена во всех ВСС. Синдром невоидной базально-клеточной эпителиомы (NBCCS) является результатом гаплонедостаточности patched. У пациентов с NBCCS вследствие наличия уже мутантного patched во всех клетках с возрастом развивается множественная ВСС.
Циклопамин, стероидный алкалоид, имеет показанную ниже химическую формулу:
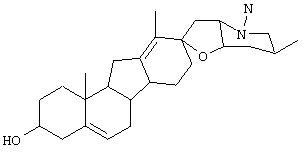
Он находится в природе в лилии Veratrum californicum и получается очисткой из нее и других источников. Ингибирование hedgehog/smoothened пути циклопамином было обнаружено в эмбрионах цыплят и в культивированных клетках мыши.
В международной заявке WO 01/27135A2 раскрыто применение ингибиторов передачи сигнала hedgehog/ smoothened (Hh/Smo), в частности циклопамина, для ингибирования клеточной пролиферации (включая пролиферацию опухолевых клеток). В отличие от указанного аналога в настоящем изобретении циклопамин или его фармацевтически приемлемые соли применяются для апоптоза опухолевых клеток in vivo, что позволяет добиться быстрого уменьшения и исчезновения пролеченной опухоли.
Для местного применения циклопамин можно растворять в этаноле или в другом подходящем растворителе и смешивать с соответствующей основой кремовой, мазевой или гелевой основой. Циклопамин может также входить в состав гидрогелей или других фармацевтических форм, допускающих контролируемое высвобождение, и может абсорбироваться на кожных пластырях. Результаты, изображенные на Фигурах 1A-1D, Фиг.2А-2F, Фиг.3А-3G и Фиг.4А-4D, достигнуты в результате применения препарата, полученного при смешении раствора циклопамина в этаноле с кремовой основой таким образом, чтобы достичь конечной концентрации 18 мМ циклопамина в креме. Используемая кремовая основа состоит, главным образом, из тяжелого парафинового масла (10 вес.%), вазелина (10 вес.%), стеарилового спирта (8 вес.%), полиоксистеарата-40 (3 вес.%) и воды (69 вес.%), но возможна также кремовая основа, приготовленная другим подходящим способом. На оптимальную концентрацию циклопамина в фармацевтической форме, а также оптимальные дозы и схемы применения, очевидно, могут влиять такие факторы, как конкретная фармацевтическая форма, локализация и характеристики кожи, содержащей опухоль (например, толщина эпидермиса) и размер опухоли; однако их можно определить следующими хорошо известными опубликованными методами оптимизации. Дозировка и схемы применения для лечения опухолей, изображенных на Фиг.1А (ВСС на носогубной складке, площадь 4×5 мм) и Фиг.1С (ВСС на лбу, площадь 4×4 мм), следующие: 10±2 мкл крема наносят непосредственно на ВСС стальным шпателем четыре раза в день, начиная с -9.00 утра, с интервалами 3,5 часа. В ночное время вместо аппликаций, избегаемых по этой схеме из-за возможной потери крема вследствие попадания его с кожи на постельное белье, используют подходящие кожные пластыри. Сохранение недифференцированных клеток в нормальном эпидермисе и в волосяных фоликулах после экспозиции с циклопатином, как показано в данном описании, дает также информацию о переносимых дозах при других способах применения; например при непосредственной инъекции внутрь опухоли водного раствора или при системном применении того же циклопамина, помещенного в липосомы.
На Фиг.1А, Фиг.1В, Фиг.1С и Фиг.1D показана быстрая клиническая регрессия ВСС после экспозиции с циклопамином. Помимо визуального исчезновения нескольких участков (областей) опухоли за время экспозиции с циклопамином менее недели наблюдается утраты обычно прозрачного внешнего вида ВСС, что видно при сравнении Фиг.1В с Фиг.1А и Фиг.1D с Фиг.1С.
На Фиг.2А-2F показан внешний вид под микроскопом участков опухоли, подвергающихся хирургическому иссечению, с пограничной нормальной тканью на пятый или шестой день применения аппликаций циклопамина, когда ВСС утратил основную часть предварительно обработанных участков, но все же содержит несколько областей, хотя заметно уменьшившихся в весе, но не полностью исчезнувших и, следовательно, имеющих остаточные опухолевые клетки для анализа под микроскопом.
На Фиг.2А и 2В показаны на срезах ткани участки кожи, соответствующие визуально исчезающим узелкам опухоли. Видно, что опухоли исчезают, оставляя после себя обширные кистозные структуры, содержащие внутри немного материала и не содержащие различимых опухолевых клеток.
На Фиг.2С показан вид под микроскопом участка кожи, содержащего все еще видимую ВСС in vivo. Видно, что эти области содержат выявляющие остаточные ВСС большие кисты в центре опухоли и меньшие кистозные структуры различных размеров, локализованные среди остаточных клеток ВСС, по направлению к периферии.
На фиг.2D и 2Е показан при увеличении 1000х вид изнутри и периферические палисадные участки этих остаточных ВСС и показана мощная апоптотическая активность в остаточных клетках ВСС вне зависимости от области опухоли. Такое большое увеличение позволяет увидеть значительно повышенную частоту встречаемости клеток ВСС, выявляющих алоптотическую морфологию, и образование кистозных структур при апоптотическом удалении клеток, как показано на Фиг.2D, путем соединения трех кист меньшего размера в одну кисту большего размера при удалении апоптотических септальных клеток.
На Фиг.2F показано, что в ВСС, обработанной кремом плацебо (т.е. препаратом крема, идентичного крему циклопамина, за исключением того, что в плацебо отсутствует циклопамин), напротив, наблюдаются типичные неопластические клетки ВСС и нет заметной апоптотической активности.
Известно, что клетки, претерпевающие апоптоз, в нормальных тканях удаляются с помощью макрофагов и близлежащих клеток и что количественное определение апоптотической активности с помощью морфологических критериев на окрашенных гематоксилен-эозином срезах дает заниженные результаты (недооценка). Несмотря на это количественные данные, представленные в Таблице I, показывают повышенную апоптотическую активность, стимулируемую циклопамином в остаточных клетках ВСС.
Утрата прозрачности в обработанных циклопамином ВСС указывает на интересную возможность дифференцировки ВСС под влиянием циклопамина. Найдено, что эта возможность, которую можно проверять с помощью иммунохимических анализов ВСС, осуществляется в данном изобретении. В нормальном эпидермисе дифференцировка клеток базального слоя в клетки высших слоев сопровождается утратой мечения моноклональным антителом Ber-Ер4. Ber4-Ер4 также метит клетки ВСС и является известным маркером для этих новообразований. Фиг.3А, Фиг.3В и количественные данные в Таблице I показывают, что хотя Ber-Ер4 четко метит все периферические удлиненные клетки палисадной ткани и более 90% внутренних клеток обработанной плацебо ВСС, ни одна из остаточных периферических или внутренних клеток обработанной циклопамином ВСС не метится с помощью Ber-Ер4. Дифференцировка ВСС под влиянием циклопамина, неизвестная до настоящего времени при применении любых других способов и в высшей степени необычная, так как она достигается in vivo и во всех клетках, судя по иммуногистохимическим показателям, имеет независимое значение при лечении рака.
Другой маркер дифференцировки, лектин Ulex Europaeus тип 1, обычно не метит ВСС или клетки базального слоя нормального эпидермиса, но метит дифференцированные клетки верхних слоев. На Фиг.3С, изображающей гетерогенное мечение этим пектином остаточных клеток обработанной циклопамином ВСС, показана дифференцировка некоторых клеток ВСС на стадии дифференцировки, обнаруживаемой с помощью Ber-Ер4, до стадии, обнаруживаемой с помощью Ulex Europaeus тип 1.
р53 является главным белком – регулятором клеточного ответа на повреждение ДНК. Известно, что количество этого белка увеличивается в клеточном ядре после экспозиции с генотоксическим агентом. Когда повреждение ДНК превышает предел, р53 способствует апоптотической гибели клеток. Лучевая терапия при раковых заболеваниях и генотоксические химиотерапевтические противораковые средства, обычные в настоящее время, в основном действуют по этому механизму, т.е. вызывая апоптоз, вторичный по отношению к поражению ДНК. Моноклональное антитело DO-7 может связывать как нормальную, так и миссенс-мутантную (т.е. нефункциональную) формы р53, и известно, что DO-7 способно обнаруживать увеличение р53 в клетках после экспозиции с агентами, повреждающими ДНК.
Фиг.3D, Фиг.3Е и количественные данные, приведенные в Таблице I, показывают, что как интенсивность мечения DO-7, так и частота (встречаемость) меченых клеток заметно уменьшаются в ВСС, обработанной циклопамином, по сравнению с ВСС, обработанной плацебо. Следовательно, циклопамин не увеличение, но скорее уменьшение р53 в ядрах клеток ВСС, обработанных циклопамином. Как известно, уровень экспрессии р53 понижается в эпидермальных клетках при дифференцировке, поэтому пониженное мечение обработанной циклопамином ВСС с помощью DO-7, по-видимому, является вторичным по отношению к индуцированной циклопамином дифференцировке клеток ВСС. В любом случае мощная апоптотическая активность в обработанной циклопамином ВСС несмотря на заметно пониженную экспрессию р53 означает, что индуцированный циклопамином апоптоз этих опухолевых клеток обусловлен негенотоксическим механизмом.
Известно, что угнетение пролиферации ВСС связано с их ретракцией из стромы. Хотя ретракция из стромы может также быть вызвана как артефакт (как результат деятельности человека) за счет неправильной фиксации и обработки тканей, точность соблюдения опубликованных технических условий гарантирует возможность избежать таких артефактов. Как показано на Фиг.ЗР и ЗО, обработанные циклопамином, но не плацебо, ВСС постоянно втягиваются из стромы. Следовательно, экспозиция ВСС с циклопамином, по-видимому, также связана с подавлением пролиферации.
На Фиг.4А-4D показано мечение с помощью Ber-Ер4 нормальной кожной ткани, находящейся на и вокруг ВСС, обработанной циклопамином. Различные эпидермальные участки, которые обрабатывались циклопамином, как видно на Фиг.4А, 4В и 4С, дают нормальный отпечаток мечения с помощью Ber-Ер4, т.е. мечение клеток базального слоя. Аналогично, на фиг.4В показано нормальное мечение с помощью Ber-Ер4 волосяных фолликул, экспонированных с циклопамином. Следовательно, недифференцированные клетки нормального эпидермиса и волосяных фолликул сохраняются несмотря на экспозицию по той же схеме и с теми же дозами циклопамина, что и ВСС.
То, что циклопамин вызывает высокоэффективную дифференцировку и апоптоз опухолевых клеток in vivo в дозах, при которых сохраняются недифференцированные клетки ткани, является достижением, до настоящего момента не известным, которое наряду с негенотоксическим действием циклопамина подтверждает возможность применения циклопамина не только для ВСС, но также для таких внутренних опухолей, которые используют hedgehog/smoothened путь для пролиферации и для предупреждения апоптоза и/или дифференцирован.
Специально рассматриваются те случаи, когда молекулы могут быть образованы из циклопамина или синтезированы таким образом, что они имеют структурные особенности, позволяющие проявлять аналогичные циклопамину характеристики рецептурного связывания и биологические/терапевтические свойства. Такие молекулы в данном описании называются “производные циклопамина” и определяются следующим образом. Молекула, которая содержит группу атомов молекулы циклопамина, требующуюся для связывания циклопамина с его биологической мишенью, но включает также такие модификации в молекуле исходного циклопамина, что вновь образованная молекула сохраняет способность специфически связываться с той же самой биологической мишенью, проявляя биологические свойства циклопамина, представленные в данном описании. Такие модификации циклопамина могут включать одну или более допустимых замен или делеций молекулярной группы в молекуле циклопамина или добавлений молекулярной группы (в частности, малой молекулярной группы, такой как метильная группа) к молекуле циклопамина, при условии что полученная в результате молекула устойчива и обладает способностью специфического связывания с той же самой биологической мишенью, что и циклопамин, проявляя представленный в данном описании биологический эффект. Дериватизапию таких новых молекул из циклопамина могут легко провести специалисты в данной области техники, а наличие или отсутствие биологических свойств циклопамина во вновь полученной молекуле также могут легко определить специалисты в данной области техники путем проверки на представленное в данном описании биологическое действие.
Дополнительные примеры
На Фиг.5А показана большая изъязвленная ВСС в верхней области носа 68-летнего мужчины перед началом лечения. Крем циклопамина (18 мМ циклопамина в описанной выше кремовой основе) наносят на нижнюю половину ВСС, показанной на Фиг.5А. Через каждые три часа – 20 мкл крема наносят непосредственно на нижнюю половину, а верхнюю половину оставляют нетронутой. Таким образом, опухолевые клетки верхней части (Фиг.5А), что маловероятно, получают циклопамин за счет возможной диффузии из области, на которую циклопамин наносится непосредственно, и экспонируются со значительно более низкими концентрациями циклопамина, если вообще с ними экспонируются. На Фиг.5В показана опухоль через 54 часа обработки перед хирургическим иссечением для исследования. В то время как быстрая регрессия опухоли в нижней половине, на которую наносят циклопамин, очевидна, ясно, что участок опухоли, наиболее удаленный от половины непосредственного нанесения, остался сравнительно неизменньм (Фиг.5В; область ближе к верхнему углу фигуры). На Фиг.5С показан окрашенный гематоксилен-эозином срез нижней (обработанной циклопамином) части иссеченной ткани. Видны многочисленный апоптотические клетки с кистами различных размеров, которые образуются в результате гибели и удаления опухолевых клеток (Фиг.5С). В противоположность этому в необработанной области той же самой опухоли, наиболее удаленной от обработанной циклопамином половины, видна твердая опухолевая ткань с митотическими фигурами и отсутствуют заметные апоптотические клетки (Фиг.5В). На Фиг.5Е и 5F показаны окрашенные иммуногистохимически срезы ткани, соответственно обработанной и не обработанной циклопамином области опухоли, полученные с моноклональным антителом Ki-S5 (Dako A/S, Glostrup, Denmark) против антигена Ki-67. Антиген Ki-67, известный маркер пролиферирующих клеток, больше не экспрессирует в обработанной циклопамином области опухоли (Фиг.5Е), тогда как опухолевые клетки, наиболее далеко расположенные от области с непосредственно нанесенным циклопамином, четко выявляют пролиферативную активность (Фиг.5F). Таким образом, окрашивание срезов ткани антителом против антигена Ki-67 снова показывает угнетение пролиферации опухолевых клеток циклопамином в описанных условиях.
Трихоэпителиома является другой опухолью, связанной с генетическими изменениями, которые вызывают усиленную передачу hedgehog/smoothened сигнала (Vorechovsky I. et al. (1997) Cancer Res. 57:4677-4681; Nilsson M. et al. (2000) Proc. Natl. Acad. Sci. USA 97:3438-3443). На Фиг.6А показана трихоэпителиома на щеке 82-летнего мужчины перед началом лечения, а на Фиг.бВ показана та же область кожи после лишь 24 часов экспозиции с кремом циклопамина (18 мМ циклопамина в кремовой основе; – 25 мкл крема наносят каждые три часа непосредственно на область опухоли). Вследствие быстрой регрессии лечение прекращают через 24 часа и весь участок кожи, соответствующий первоначальной опухоли, иссекают для исследования. На Фиг.6С и Фиг.6D показаны участки кожи, которые содержат остаточные опухолевые клетки через 24 часа и показывают заметную алоптотическую активность среди этих остаточных опухолевых клеток. Видны кистозные участки, возникающие в результате апоптотического удаления опухолевых клеток (Фиг.6С, 6В), а также инфильтрация опухоли мононуклеарными клетками (Фиг.6D). Другим заслуживающим внимания у этого пациента является уменьшение размера и пигментация невуса, расположенного рядом с обработанной опухолью, через 24 часа обработки (Фиг.6В в сравнении с Фиг.6А). Так как циклопамин, возможно, диффундирует из прилегающей области, на которую его наносили, невус (доброкачественная амеланотическая опухоль), по-видимому, чувствителен к сравнительно низким концентрациям циклопамина.
На Фиг.7А показана пигментированная ВСС на нижнем веке 59-летнего мужчины перед началом лечения. Крем циклопамина (18 мМ циклопамина в кремовой основе) наносят на все узлы за исключением одного, помеченного стрелкой. Этот узелок, который, по-видимому, получал циклопамин лишь диффузией из прилегающей обработанной области, экспонируют с циклопамином в сравнительно низкой концентрации. Так как пигментированный характер этой опухоли облегчает наблюдение за клиническим течением, лечение (нанесение – 20 мкл крема циклопамина каждые четыре часа) прерывают на третий день, когда опухоль в обрабатываемой области значительно регрессирует, но все еще содержит видимые части (Фиг.7В). Затем опухоль наблюдают без обработки с целью изучения возможных поздних эффектов. Четкая дальнейшая клиническая регрессия в отсутствие обработки не наблюдается, и область кожи, соответствующую первоначальной опухоли, иссекают на шестой день врачебного наблюдения (девятый день с начала лечения). В окрашенных гематоксилен-эозином срезах обработанной области опухоли наблюдается много кистозных участков, в которых отсутствуют опухолевые клетки (Фиг.7С). Отсутствие эпителия, сглаживающего эти кисты (Фиг.7С), согласуется с представлением о том, что эти кисты представляют собой участки ткани, которые раньше занимали опухолевые клетки. В то же время (шестой день последующего врачебного наблюдения без обработки) срезы тканей показывают сравнительно малое количество апоптотических клеток (Фиг.7С), что согласуется с известной быстротой очистки живых тканей от апоптотических клеток. С другой стороны, остаточные опухолевые клетки, особенно близ краев кисты, показывают необычайно высокую частоту клеток, проявляющих свойства дифференцировки spinous (например, область по направлению влево вниз на Фиг.7С; более четко видно при более высоком увеличении, как видно на примере другой области на Фиг.7D). Аналогичные области дифференцировки или кисты отсутствуют в материале, полученном иссечением с помощью дерматома из той же самой опухоли перед началом лечения (Фиг.7Е). Опухолевый узел, который получает циклопамин сравнительно низкой концентрации (отмечен стрелкой на Фиг.7А), на шестой день последующего врачебного наблюдения содержит большой кистозный центр (Фиг.7F). Остальная периферия узла, однако, продолжает содержать клетки с типичной морфологией ВСС, хотя частота клеток с признаками дифференцировки (например, с увеличенной и более эозинофильной цитоплазмой) снова повышается и в этой периферической области существуют кисты меньшего размера (Фиг.7F). Таким образом, тогда как ответ опухоли на оптимальные концентрации циклопамина является сравнительно быстрым, при экспозиции с концентрациями ниже оптимальных остаются опухолевые клетки, которые упорно продолжают сохраняться во время последующего наблюдения.
Эти дополнительные примеры демонстрируют эффективность описанного лечения для достижения быстрой клинической регрессии ВСС и других опухолей, у которых наблюдается усиленная передача hedgehog/smoothened сигнала. Видно, что клиническая регрессия связана с вызванной циклопамином дифференцировкой и апоптозом опухолевых клеток. Кроме того, также предупреждается пролиферация опухолевых клеток. Эффективность в отношении нескольких независимых опухолей у пациентов, не являющихся родственниками, с различными генотипами соответствует общему характеру полезности описанного лечения.
Циклопамин был открыт как тератогенный компонент растений Veratrum (Keeler R.F. (1969) Phyto chemistry 8:223-225). Сообщалось, что он ингибирует дифференцировку предшественников вентральных клеток при развитии мозга (Incardona J.P. et al. (1998) Development 125:3553-3562; Cooper M.K. et al. (1998) Science 280:1603-1607). Сообщалось, что циклопамин также блокирует клеточную дифференцировку в других системах, включая также дифференцировку клеток костного мозга в эритроидные клетки (Detmer К. et al. (2000) Dev. Biol. 222:242) и дифференцировку мочеполового синуса в простату (Berman D.M. et al. (2000) J. Urol. 163:204). Однако в данном изобретении было найдено, что в случае экспонирования опухолевых клеток с циклопамином верным является противоположное утверждение. Наряду с вызываемой циклопамином дифференцировкой опухолевых клеток стимулируется также апоптоз опухолевых клеток. Показано, что также ранее не описанная индукция апоптоза опухолевых клеток циклопамином является высокоэффективной. К тому же индукция апоптоза циклопамином не сопровождается генотоксическим эффектом и исключительно специфична; даже клетки внешней оболочки корней волосяных фолликул и нормальные базальные клетки эпидермиса, прилегающие к опухолевым клеткам, сохраняются, тогда как опухолевые клетки дифференцируются и подвергаются алоптозу. Отсутствие вредного побочного эффекта описанного лечения подтверждается также присутствием клинически нормально выглядящей здоровой кожи у пациента в местах наложения циклопамина (наибольшая продолжительность последующего врачебного наблюдения за больным человеком составляет более 15 месяцев во время написания этой работы и показывает безопасность лечения также в течение длительного времени). Суммированные выше характерные особенности описанного в данном изобретении способа лечения делают его в высшей степени желательным в терапии рака и предоставляют решение задач, давно стоящих перед терапией рака.
Описание Фигур
Фиг.1А, 1В, 1С, 1D: Быстрая регрессия обработанных циклопамином ВСС, что видно по исчезающим областям опухоли (показано стрелками), заметно уменьшающемуся весу поверхности кожи и по утрате прозрачности менее чем за неделю. 1А: ВСС, расположенная на левой носогубной складке, до начала лечения. 1В: Та же ВСС на пятый день местного применения циклопамина. 1С: ВСС, расположенная на лбу, до начала лечения. 1D: Та же ВСС на шестой день местного применения циклопамина.
Фиг.2А, 2В, 2С, 2D, 2Е, 2F: Вид под микроскопом ВСС, обрабатываемых циклопамином и плацебо, наглядно показывающий индуцированную циклопамином алоптотическую гибель и удаление опухолевых клеток и исчезновение опухолевых узлов, оставляющих после себя кистозные участки, на которых отсутствуют опухолевые клетки. Участки кожи, соответствующие положениям ВСС до обработки, иссекают хирургическим путем на пятый и шестой дни экспозиции с циклопамином вместе с пограничной нормальной тканью и подвергают обычной фиксации, делают срезы, окрашивают гематоксилен-эозином и изучают под микроскопом. 2А: Большая киста в дерме, соответствующая положению исчезнувшего опухолевого узла, остаточные опухолевые клетки отсутствуют. 2В: Аналогичная киста в другой области кожи, которая содержала ВСС до, но не после обработки циклопамином. 2С: Вид при малом увеличении области ВСС, показанной на Фиг.1D, показывающий остаточные клетки и образование большой кисты за счет соединения многочисленных кист меньшего размера между этими клетками. 2D: Вид при большом увеличении со стороны внутренней области той же самой остаточной ВСС, что и на Фиг.2С, показывающий значительно возросшую частоту апоптотических клеток и образование, а также увеличение кист при алоптотическом удалении клеток ВСС. 2Е: Вид при большом увеличении из периферической области той же самой остаточной ВСС, что и на Фиг.2С, также показывающий значительно возросшую частоту апоптотических клеток и образование кист за счет апоптотического удаления клеток ВСС. 2F: Вид при большом увеличении со стороны внутренней области ВСС, обработанной плацебо, показывающий типичные неопластические клетки этой опухоли и отсутствие апоптоза. Увеличение 100Х для 2А, 2В, 2С и 1000Х для 2D, 2Е, 2F.
Фиг.3А, 3В, 3С, 3D, 3Е, 3F, 3G: Иммуногистохимический анализ ВСС, обработанных циклопамином и плацебо, показывающий дифференцировку всех остаточных клеток ВСС под влиянием циклопамина и понижение экспрессии р53 в ВСС после экспозиции с циклопамином. 3А и 3В: Отсутствие окрашивания моноклональным антителом Ber-Ер4 во всех остаточных клетках обработанной циклопамином ВСС (3А) контрастирует с интенсивным окрашиванием в ВСС, обработанной плацебо (3В), это показывает, что все остаточные клетки в ВСС, обработанной циклопамином, являются дифференцированными до или выше степени, обнаруживаемой с помощью Ber-Ер4. Ber-Ер4 является известным маркером дифференцировки, который окрашивает клетки ВСС, а также недифференцированные клетки базального слоя нормального эпидермиса и волосяных фолликул, но не дифференцированные клетки верхнего слоя нормального эпидермиса. 3С: Гетерогенное мечение остаточных клеток ВСС, обработанного циклопамином, с помощью лектина Ulex Europaeus тип 1, показывающее дифференцировку некоторых клеток ВСС до стадии, обнаруживаемой с помощью этого лектина, который обычно не метит клетки ВСС или клетки базального слоя нормального эпидермиса, но метит дифференцированные клетки верхних слоев. 3D и 3Е: Пониженная экспрессия р53, обнаруживаемая моноклональным антителом DO-7 в ВСС, обработанной циклопамином (3D), в сравнении с ВСС, обработанной плацебо (3Е). Известно, что экспрессия р53 понижает дифференцировку эпидермальных базальных клеток и дифференцировку культивированных кератиноцитов. Известно также, что количество р53, обнаруживаемого с помощью DO-7, увеличивается в клетках, когда они экспонируются с агентами, повреждающими ДНК. 3F и 3G: Непрерывная ретракция ВСС из стромы, которая, как известно, связана с угнетением пролиферации опухолевых клеток, наблюдаемой в опухолях, обрабатываемых циклопамином (3F, стрелка показывает место ретракции), но не плацебо (3G) (различие между ВСС, обработанной циклопамином и плацебо, с точки зрения ретракции из стромы видно также на 3D, 2С в сравнении с 3В, 3Е). Увеличение 400Х для 3А, 3В, 3D, 3Е, 1000Х для 3С и 100Х для 3F, 3G. Все операции по введению иммуногистохимической метки проводят со стрептавидином, конъюгированным с пероксидазой, связывающимся с биотинилированным вторичным антителом; введение метки показано окрашиванием в коричневый цвет. Срезы, показанные на Фиг.3F и 3G, окрашены периодной кислотой – основанием Шиффа и алцианом голубым.
Фиг.4А, 4В, 4С, 4С: Нормальный отпечаток мечения обработанной циклопамином нормальной кожи с помощью Ber-Ер4, показывающий, что недифференцированные клетки нормального эпидермиса и волосяных фолликул сохраняются несмотря на то, что их экспонируют по той же схеме и с теми же дозами циклопамина, что и ВСС. 4А: Введение метки Ber-Ер4 в клетки базального слоя эпидермиса, обработанного циклопамином. 4В и 4С: Вид при большем увеличении с различных областей эпидермиса, обработанных циклопамином, показывающий мечение базальных клеток с помощью Ber-Ep4. 4D: Вид при большом увеличении волосяных фолликул, обработанных циклопамином, но все еще показывающий нормальное мечение с помощью Ber-Ep4. Увеличение 400Х для 4А и 100Х для 4В, 4С, 4D. Метод иммуногистохимического обнаружения тот же самый, что и на Фиг.3А, 3В; мечение показано коричневым цветом.
На Фиг.5А показана изъязвленная ВСС в верхней назальной области у 68-летнего мужчины до начала лечения.
На Фиг.5В показана та же самая ВСС, что и на Фиг.5А, через 54 часа нанесения циклопамина на ее нижнюю половину.
На Фиг.5С показан срез половины ВСС, на которую наносили циклопамин, через 54 часа. Окрашивание с помощью гематоксилен-эозина (Н&Е), увеличение 400Х.
На Фиг.5В показан срез необработанной области той же самой ВСС. Н&Е, увеличение 400Х.
На Фиг.5Е показан срез половины ВСС, на которую наносили циклопамин, через 54 часа; иммуногистохимическое окрашивание на антиген Ki-67. Увеличение 200Х.
На Фиг.6А показана трихоэпителиома на щеке 82-летнего мужчины перед началом лечения.
На Фиг.6В показан тот же самый участок кожи, что и на Фиг.6А, после 24 часов обработки циклопамином.
На Фиг.6С показан срез иссеченного участка кожи, изображенного на Фиг.6В, с остаточными опухолевыми клетками. Н&Е, увеличение 400Х.
На фиг.6D показана другая область той же ткани, что и на Фиг.6С. Помимо многочисленных алоптотических клеток и образования кистозных структур при их удалении видно инфильтрация опухоли мононуклеарными клетками. Н&Е, увеличение 200Х.
На Фиг.7А показана пигментированная ВСС на нижнем веке 59-летнего мужчины до начала лечения.
На Фиг.7В показана та же самая ВСС, что и на Фиг.7А, на третий день обработки циклопамином.
На Фиг.7С показан срез обработанной области ВСС, изображенной на Фиг.7В. Н&Е, увеличение 200Х.
На Фиг.7D крупным планом показана область остаточных опухолевых клеток в срезе обработанного участка ВСС, изображенного на Фиг 7В. Н&Е, увеличение 400Х.
На Фиг.7Е показан срез материала с помощью дерматома, полученный из ВСС, изображенной на Фиг.7А, перед началом лечения. Н&Е, увеличение 400Х.
На Фиг.7Р показан срез, содержащий часть узла ВСС, помеченного стрелкой на Фиг.7А. Иссечение ткани производят после 3 дней обработки и 6 дней последующего врачебного наблюдения без обработки. Н&Е, увеличение 100Х.
Таблица 1: Индукция дифференцировки и апоптоза клеток базально – клеточной эпителиомы с помощью местного применения циклопамина.
| |
Периферические удлиненные клетки палисадной ткани ВСС, обработанные |
Клетки непалисадной ткани ВСС, обработанные |
| |
Плацпебо |
Циклоп |
Плацебо |
Циклоп |
| |
|
амином |
|
амином |
% Клеток, проявляющих  2 2 |
|
|
|
|
| морфологических признаков |
|
|
|
|
| апоптоза в Н&Е окрашенных срезах |
0±0 |
20±8 |
0.2±0.4 |
18±11 |
| ткани |
|
|
|
|
| % Клеток, меченных Ber-Ер4 |
100±0 |
0±0 |
91±8 |
0±0 |
| % Клеток, меченных DO-7 |
58±27 |
1б±11 |
67±22 |
5±3 |
Показано среднее±стандартное отклонение из, по меньшей мере, 16 произвольно выбранных при большом увеличении (1000Х) участков срезов ткани каждой группы опухолей, р<0.001 для плацебо по сравнению с обработанными циклопамином для всех параметров, как для периферических клеток палисадной ткани, так и непалисадных (внутренних) областей опухоли.
Формула изобретения
1. Применение циклопамина или его фармацевтически приемлемой соли для изготовления фармацевтического средства для индукции апоптоза опухолевых клеток, которые используют передачу сигнала Hedgehog/Smoothened, для предупреждения апоптоза.
2. Применение по п.1 для изготовления фармацевтического средства для противоопухолевой терапии.
3. Применение по п.1 для изготовления фармацевтического средства в форме водного раствора или встроенного в липосомы.
4. Применение по п.1 для изготовления фармацевтического средства пролонгированного действия.
5. Применение по п.1 для изготовления фармацевтического средства для местного применения.
6. Применение по п.4 для изготовления фармацевтического средства в виде крема, мази, геля или гидрогеля.
РИСУНКИ
|
|