|
|
(21), (22) Заявка: 2003127750/15, 12.02.2002
(24) Дата начала отсчета срока действия патента:
12.02.2002
(30) Конвенционный приоритет:
13.02.2001 EP 01102852.9
(43) Дата публикации заявки: 10.03.2005
(46) Опубликовано: 27.10.2007
(56) Список документов, цитированных в отчете о
поиске:
МЕТЕЛИЦА В.И. Справочник по клинической фармакологии сердечно-сосудистых лекарственных средств. – М.: Медпрактика, 1996, с.154-390, 511, 534, 617-622, 728. TRIGO-ROCHA F. et al. Nitric oxide and cGMP: mediators of pelvic nerve-stimulated erection in dogs. Am J Physiol. 1993 Feb; 264(2Pt 2):H419-22. WO 00/51970 A1 08.09.2000. WO 98/52906 A1 26.11.1998.
(85) Дата перевода заявки PCT на национальную фазу:
15.09.2003
(86) Заявка PCT:
EP 02/01443 (12.02.2002)
(87) Публикация PCT:
WO 02/064146 (22.08.2002)
Адрес для переписки:
129010, Москва, ул. Б.Спасская, 25, стр.3, ООО “Юридическая фирма Городисский и Партнеры”, пат.пов. Е.Е.Назиной
|
(72) Автор(ы):
ВОЛЬФАРТ Паулус (DE),
СУЗУКИ Тери (US),
ДХАРАНИПРАГАДА Рамалинга М. (US),
САФАРОВА Алена (US),
ВАЛЬЗЕР Армин (US),
ШТРОБЕЛЬ Хартмут (DE)
(73) Патентообладатель(и):
САНОФИ-АВЕНТИС ДОЙЧЛАНД ГМБХ (DE)
|
(54) 4-ФТОР-N-ИНДАН-2-ИЛБЕНЗАМИД И ЕГО ПРИМЕНЕНИЕ В КАЧЕСТВЕ ФАРМАЦЕВТИЧЕСКОГО АГЕНТА
(57) Реферат:
Настоящее изобретение относится к применению 4-фтор-N-индан-2-ил-бензамида формулы (I) в качестве фармацевтического агента для стимуляции экспрессии эндотелиальной NO-синтазы, для лечения и профилактики ряда сердечно-сосудистых заболеваний (таких как стенокардия, острый коронарный синдром, сердечная недостаточность, инфаркт миокарда, инсульт, тромбоз, окклюзиивное заболевание периферических артерий, атеросклероз, рестеноз и т.д.), а также к фармацевтическим композициям того же назначения. Ранее соединение формулы (I) благодаря холинергической активности использовали для лечения заболеваний центральной нервной системы. Показано, что соединение формулы (I) повышало транскрипцию eNOS, достоверно снижало давление крови крыс с гиперлипопротеинемией, вдвое уменьшало патологическое образование неоинтимы, показало противоишемический эффект. 4 н. и 6 з.п. ф-лы.
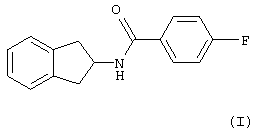
Настоящее изобретение относится к 4-фтор-N-индан-2-илбензамиду формулы (I) и его применению в качестве фармацевтического агента.
 |
(I) |
Эндотелиальная NO-синтаза (eNOS, NOS-III) принадлежит к группе из трех изоферментов, которые продуцируют оксид азота (NO) окислением аргинина. NO, высвобождаемый эндотелием, имеет центральное значение для ряда ключевых сердечно-сосудистых механизмов. Он обладает сосудорасширяющим действием и ингибирует агрегацию тромбоцитов, адгезию лейкоцитов к эндотелию и пролиферацию гладкомышечных клеток интимы.
Эндотелиальная NO-синтаза представляет собой объект физиологической и патофизиологической регуляции как на транскрипционном, так и на посттранскрипционном уровне. Фермент, который уже находится в эндотелии, может претерпевать кальций-зависимую и кальций-независимую активацию посредством фосфорилирования определенных аминокислот, но также путем прямых взаимодействий с определенными белками. Стимуляторами данного, обычно преходящего, высвобождения NO являются внеклеточный аргинин, 17 -эстроген и механический раздражитель, возникающий на обращенной в просвет поверхности эндотелия, в результате воздействия кровотока (касательное напряжение). Последний фактор дополнительно приводит к регуляции eNOS на транскрипционном уровне. Так, например, Sessa et al. (Circ. Research 74 (1994) 349-353) смогли получить выраженное увеличение количества ecNOS посредством физических нагрузок и связанного с ними повышения касательного напряжения. -эстроген и механический раздражитель, возникающий на обращенной в просвет поверхности эндотелия, в результате воздействия кровотока (касательное напряжение). Последний фактор дополнительно приводит к регуляции eNOS на транскрипционном уровне. Так, например, Sessa et al. (Circ. Research 74 (1994) 349-353) смогли получить выраженное увеличение количества ecNOS посредством физических нагрузок и связанного с ними повышения касательного напряжения.
Не существует недвусмысленных доказательств существования регуляции на посттранскрипционном уровне in vivo. Так, например, введение большой дозы аргинина приводит только к временному улучшению расширения сосудов, зависящего от эндотелия, у пациентов с коронарной болезнью сердца.
С другой стороны, научно признана значимость повышающей регуляции белка eNOS. Так, существуют данные, которые показывают, что защитные свойства ингибитора HMG-CoA-редуктазы, симвастатина, могут вносить свой вклад, помимо снижения уровня липидов, также, частично, в увеличение экспрессии eNOS in vivo (Endres et al., Proc. Natl. Acad. Sci. USA 95 (1998) 8880-8885). Известно также, что одиночные точечные мутации в 5′-фланкирующей области гена eNOS (“промотора eNOS”) и связанное с ними уменьшение скорости транскрипции гена eNOS у населения Японии связаны с повышением риска возникновения спазмов коронарных сосудов (Nakayama et al., Circulation 99 (1999) 2864-2870).
Таким образом, в настоящее время предполагают, что транскрипционные и посттранскрипционные механизмы регуляции eNOS серьезно нарушаются при большом ряде нарушений, особенно сердечно-сосудистых заболеваний. Даже на очень ранних стадиях обширного ряда сердечно-сосудистых заболеваний возможно, что дисфункция данного типа в эндотелиальном слое кровеносных сосудов приводит к дефициту биологически активного NO, что проявляется по мере прогрессирования заболевания в форме поддающихся измерению патофизиологических и морфологических изменений. Так, уменьшение высвобождения эндотелиального NO ускоряет критические стадии при раннем атерогенезе, такие как, например, окисление липопротеинов низкой плотности, рекруитмент и накопление моноцитов в интиме сосудов и пролиферация клеток интимы. Следствием атерогенеза является образованием бляшек на внутренней поверхности кровеносных сосудов, которые в свою очередь могут приводить, через уменьшение касательного напряжения, к дальнейшему сокращению высвобождения эндотелиального NO и дальнейшему ухудшению патологии. Поскольку эндотелиальный NO представляет собой также вазодилататор, уменьшение его количества часто приводит к гипертензии, которая может, в качестве независимого фактора риска, вызывать дальнейшее повреждение органов.
Целью терапевтического подхода к лечению данных заболеваний, соответственно, должно быть прерывание указанной цепи событий путем увеличения экспрессии эндотелиального NO. Эксперименты с переносом генов, которые in vitro приводили к избыточной экспрессии NO-синтазы в ранее поврежденных сосудах, фактически способны противодействовать описанным процессам и, таким образом, являются доказательством правильности указанного подхода (Varenne et al., Hum. Gene Ther. 11 (2000) 1329).
Некоторые низкомолекулярные соединения, которые в культурах клеток могут оказывать прямое действие на транскрипцию и экспрессию eNOS, описаны в научной литературе. Статины, которые уже упоминались, однако, представляют собой единственные вещества, для которых до настоящего времени было возможным показать указанное повышение eNOS in vivo в качестве побочного эффекта. С точки зрения известного спектра побочных эффектов для данного класса веществ, однако не ясно, в какой степени присутствует указанный эффект при не проблематичной, с токсикологической точки зрения, дозе.
Liao et al. заявляют в WO 99/47153 и WO 00/03746 применение ингибиторов rhoGTP-азы и агентов, которые влияют на организацию актинового цитоскелета, для увеличения уровня eNOS в эндотелиальных клетках и для лечения различных расстройств, таких как, например, инсульты или легочная гипертензия, не указывая, однако, конкретного пути для достижения упомянутых целей.
Таким образом, существует настоятельная потребность в лекарственном средстве, который осуществляет повышающую регуляцию экспрессии eNOS в эндотелиальных клетках. Целью настоящего изобретения является разработка соединения, обладающего указанной способностью.
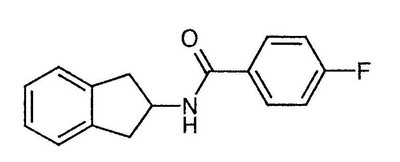
Данная цель достигается применением 4-фтор-N-индан-2-илбензамида формулы (I)
 |
(I) |
для изготовления лекарственного средства для стимуляции экспрессии эндотелиальной NO-синтазы.
Данная целью достигается также с помощью фармацевтического препарата для стимуляции экспрессии эндотелиальной NO-синтазы, включающего эффективную дозу 4-фтор-N-индан-2-илбензамида и фармацевтически приемлемый носитель.
Настоящее изобретение включает также применение всех сольватов соединения формулы (I), например, гидратов, аддуктов со спиртами, активных метаболитов соединения формулы (I), а также производных и пролекарств соединения формулы (I), которые содержат физиологически переносимые и расщепляемые группы, например, сложные эфиры, амиды и соединения, в которых N-H группа, изображенная в формуле (I), заменена на N-алкильную группу, такую как N-метил, или на N-ацильную группу, такую как N-ацетил или N-аргининил, включая фармацевтически приемлемые соли, образованные функциональными группами, присутствующими в N-ацильной группе.
WO 00/51970 описывает получение и применение 4-фтор-N-индан-2-илбензамида в качестве лекарственного средства. Данное соединение оказывает сильное потенцирующее действие на холинергическую активность и является пригодным для лечения и/или профилактики заболеваний центральной нервной системы у млекопитающих и, более конкретно, амнезии, деменции, например, сенильной деменции, деменции Альцгеймера, деменции, связанной с различными заболеваниями, такой как церебральная сосудистая деменция, церебральная посттравматическая деменция, деменция, связанная с опухолью головного мозга, деменция, связанная с хронической субдуральной гематомой, деменция, связанная с нормотонической гидроцефалией, постменингитная деменция, деменция по типу болезни Паркинсона и подобные. Ожидается, что соединение будет пригодным в качестве терапевтического и/или профилактического агента при шизофрении, депрессии, ударе, повреждении головы, никотиновой абстиненции, повреждении спинного мозга, тревожности, поллакиурии, недержании мочи, миотонической дистрофии, гиперактивности при дефиците внимания, чрезмерной дневной сонливости (нарколепсии), болезни Паркинсона или аутизме. WO 00/51970 не описывает и не предлагает применение 4-фтор-N-индан-2-илбензамида для повышающей регуляции экспрессии эндотелиальной МО-синтазы, в частности для лечения сердечно-сосудистых заболеваний, стабильной или нестабильной стенокардии, коронарной болезни сердца, стенокардии Принцметалла, острого коронарного синдрома, сердечной недостаточности, инфаркта миокарда, инсульта, тромбоза, окклюзивного заболевания периферических артерий, эндотелиальной дисфункции, атеросклероза, рестеноза, повреждения эндотелия после подкожной транслюминальной коронарной ангиопластики (РТСА), гипертензии, гипертонической болезни, легочной гипертензии, вторичной гипертензии, реноваскулярной гипертензии, хронического гломерулонефрита, эректильной дисфункции, желудочковой аритмии, диабета или осложнений диабета, нефропатии, ретинопатии, ангиогенеза, бронхиальной астмы, хронической почечной недостаточности, цирроза печени, остеопороза, снижения памяти, снижения способности к обучению или снижения риска возникновения сердечно-сосудистых заболеваний у женщин в постменопаузе или после приема контрацептивов.
Соединение формулы (I) можно получить исходя из 2-инданиламина, который известен в научной литературе. 2-инданиламин может взаимодействовать в форме свободного основания или его соли с 4-фторбензоилхлоридом в присутствии основания, такого как, например, триэтиламин. Реакцию обычно осуществляют в растворителе, таком как дихлорметан, тетрагидрофуран, толуол или диоксан, и предпочтительно при комнатной температуре. Альтернативно, соединение формулы (I) можно получить реакцией сочетания указанного 2-инданиламина с 4-фторбензойной кислотой в присутствии основания, такого как, например, диизопропилэтиламин, и применением подходящего агента сочетания, такого как, например, карбодиимиды, HATU или TOTU.
Другие реакции для синтеза соединения формулы (I) очевидны или хорошо известны для специалиста и могут осуществляться в стандартных условиях согласно или аналогично методикам, описанным в литературе, например, в Houben-Weyl, Methoden der Organischen Chemie (Methods of Organic Chemistry), Thieme-Verlag, Stuttgart или Organic Reactions, John Wiley & Sons, Нью-Йорк. Если желательно, соединение формулы (I) можно очистить с помощью обычных методик очистки, например перекристаллизации или хроматографии. Исходные соединения для получения соединения формулы (I) являются коммерчески доступными или их можно получить согласно или аналогично методикам, описанным в литературе.
Соединение формулы (I) можно применять для повышающей регуляции экспрессии эндотелиальной NO-синтазы, и оно представляет собой полезное фармацевтическое соединение для лечения различных заболевании. В контексте настоящего изобретения лечение включает терапию, а также профилактику соответствующих заболеваний.
Примеры заболеваний, которые можно лечить соединением (I) по настоящему изобретению, включают сердечно-сосудистые заболевания, такие как стабильная и нестабильная стенокардия, коронарная болезнь сердца, стенокардия Принцметалла (спазм), острый коронарный синдром, сердечная недостаточность, инфаркт миокарда, инсульт, тромбоз, окклюзивное заболевание периферических артерий (PAOD), эндотелиальная дисфункция, атеросклероз, рестеноз, повреждение эндотелия после РТСА, гипертензия, включая гипертоническую болезнь, легочную гипертензию и вторичную гипертензию (реноваскулярную гипертензию, хронический гломерулонефрит), эректильную дисфункцию, желудочковую аритмию и снижение риска возникновения сердечно-сосудистых заболеваний у женщин в постменопаузе или после приема контрацептивов.
Соединение (I) может дополнительно применяться для лечения и профилактики диабета и осложнений диабета (нефропатии, ретинопатии), ангиогенеза, бронхиальной астмы, хронической почечной недостаточности, цирроза печени, остеопороза, снижения памяти или снижения способности к обучению.
Предпочтительными показаниями являются стабильная стенокардия, коронарная болезнь сердца, гипертензия, эндотелиальная дисфункция, атеросклероз и осложнения диабета.
Соединение формулы (I) можно также применять в комбинации с другими фармацевтически активными соединениями, предпочтительно соединениями, которые способны усиливать эффект соединения формулы (I). Примеры указанных соединений включают: статины, ингибиторы АПФ (АСЕ), антагонисты AT1, ингибиторы аргининазы, V-ингибиторы ФДЭ (PDE), антагонисты Са, альфа-блокаторы, бета-блокаторы, метимазол и аналогичные соединения, аргинин, тетрагидробиоптерин, витамины, в частности витамин С и витамин В6, ниацин.
Соединение (I), необязательно, в комбинации с другими фармацевтически активными соединениями можно вводить животным, предпочтительно млекопитающим и, в частности, человеку, в чистом виде как лекарственное средство или в форме фармацевтических препаратов. Еще одной целью настоящего изобретения являются фармацевтические препараты (или фармацевтические композиции), которые включают эффективную дозу соединения формулы (I) и фармацевтически приемлемый носитель, т.е., один или более фармацевтически приемлемых веществ-носителей и/или вспомогательных веществ. Указанный фармацевтический препарат используют для стимуляции экспрессии эндотелиальной NO-синтазы и, в частности, в качестве лекарственного средства для лечения и профилактики упомянутых выше синдромов.
Лекарственное средство по настоящему изобретению можно вводить перорально, например, в форме пилюль, таблеток, таблеток, покрытых лаком, таблеток, покрытых сахаром, гранул, твердых и мягких желатиновых капсул, водных, спиртовых или масляных растворов, сиропов, эмульсий или суспензий или ректально, например, в форме суппозиториев. Введение можно также осуществлять парентерально, например подкожно, внутримышечно или внутривенно, в форме растворов для инъекций или инфузии. Другими подходящими формами введения являются, например, чрескожное или местное введение, например, в форме мазей, настоек, спреев или чрескожных терапевтических систем, или ингаляционное введение в форме назальных спреев или аэрозольных смесей, или, например, микрокапсул, имплантатов или палочек. Предпочтительная форма введения зависит, например, от заболевания, по поводу которого осуществляется лечение, и от его тяжести.
Количество соединения формулы (I) в фармацевтических препаратах обычно находится в пределах от 0,2 до 800 мг, предпочтительно от 0,5 до 500 мг, в частности от 1 до 200 мг, на дозу, но, в зависимости от типа фармацевтического препарата, оно может быть также больше. Фармацевтические препараты обычно содержат от 0,5 до 90 мас. процентов соединения формулы (I). Изготовление фармацевтических препаратов можно осуществлять известными способами. В этом случае соединение формулы (I) вместе с одним или более твердым или жидким фармацевтическим носителем и/или добавками (или вспомогательными веществами) и, если желательно, в комбинации с другими фармацевтически активными соединениями, обладающими терапевтическим или профилактическим действием, изготавливают в виде подходящей формы для введения или лекарственной формы, которую затем можно применять в качестве лекарственного средства в медицине или ветеринарии.
Для изготовления пилюль, таблеток, покрытых сахаром, и твердых желатиновых капсул возможно использовать, например, лактозу, крахмал, например кукурузный крахмал, или производные крахмала, тальк, стеариновую кислоту или ее соли и подобные. Носителями для мягких желатиновых капсул и суппозиториев являются, например, жиры, воски, полутвердые и жидкие многоатомные спирты, натуральные или отвержденные масла и подобные. Подходящими носителями для изготовления растворов, например растворов для инъекций, или эмульсий, или сиропов, являются, например, вода, физиологический раствор хлорида натрия, спирты, такие как этанол, глицерин, многоатомные спирты, сахароза, инвертный сахар, глюкоза, маннит, растительные масла и подобные. Возможна также лиофильная сушка соединения формулы (I) и применение полученных лиофилизатов, например, для изготовления препаратов для инъекций или инфузии. Подходящими носителями для микрокапсул, имплантатов или палочек являются, например, сополимеры гликолевой кислоты и молочной кислоты.
Помимо соединения (I) и носителей фармацевтические препараты могут также содержать добавки, например наполнители, разрыхлители, связывающие агенты, смазывающие агенты, увлажняющие агенты, стабилизаторы, эмульгаторы, диспергирующие агенты, консерванты, подсластители, красители, корригенты, ароматизаторы, загустители, разбавители, буферные вещества, растворители, солибилизирующие агенты, агенты для получение эффекта депо, соли для изменения осмотического давления, агенты для покрытия или антиоксиданты.
Доза соединения формулы (I), которую следует вводить, зависит от каждого отдельного случая и, как это обычно происходит, подбирается для индивидуальных обстоятельств, чтобы достигнуть оптимального эффекта. Так, она зависит от характера и тяжести заболевания, по поводу которого осуществляют лечение, а также от пола, возраста, массы тела и индивидуальной чувствительности человека или животного, которого лечат, от продолжительности действия соединения (I), от того, является ли лечение острым или хроническим или профилактическим, или от того, вводятся ли другие активные соединения, кроме соединения формулы (I). Обычно суточная доза составляет приблизительно от 0,01 до 100 мг/кг, предпочтительно от 0,1 до 10 мг/кг, в частности от 0,3 до 5 мг/кг (в каждом случае, мг на кг массы тела), является подходящей для введения взрослому человеку с массой тела около 75 кг, чтобы получить желаемые результаты. Суточную дозу можно вводить в виде однократной дозы или, в частности, когда вводят большие количества, можно разделить ее на несколько, например две, три или четыре отдельные дозы. В некоторых случаях, в зависимости от индивидуальной чувствительности, может возникнуть необходимость превышения или уменьшения данной суточной дозы.
Соединение формулы (I) можно применять также для других целей, отличающихся от ранее указанных. Неограничивающие примеры включают диагностические цели, применение в качестве биохимических инструментов и в качестве промежуточных веществ для получения других соединений, например фармацевтически активных соединений.
Настоящее изобретение далее иллюстрируется следующим примером:
Пример:
Получение 4-фтор-N-(индан-2-ил)бензамида
43,70 г (258 ммоль) гидрохлорида 2-аминоиндана и 53,43 г (528 ммоль) триэтиламина смешивали с 250 мл тетрагидрофурана, добавляли 42,89 г (270 ммоль) 4-фторбензоилхлорида и смесь перемешивали в течение 2 ч при комнатной температуре.
Полученную смесь затем выливали в смесь лед/HCl, полученный осадок фильтровали, промывали раствором NaHCO3 и водой и сушили в вакууме. Сырой продукт кристаллизовали из метанола. Получали 47,8 г (73%) белого кристаллического продукта.
Т.пл.: 167°С
MS: М+Н+: 256,1
1Н-ЯМР: (300 мгц, d6-DMSO): 2,96 (дд, 2Н, Н1/Н3), 3,25 (дд, 2Н, Н3/Н1), 4,70 (секстет, 1Н, Н2), 7,12-7,19 (м, 2Н, Н4,7/5,6), 7,20-7,28 (м, 2Н, Н5,6/4,7), 7,30 (т, 2Н, Н3′,5′), 7,95 (дд, 2Н, Н2′,6′), 8,68 (д, 1Н, NH)
Измерение активации транскрипции eNOS
Активацию транскрипции eNOS измеряли, как подробно описано в Li et al. “Activation of protein kinase C alpha and/or epsilon enhances transcription of the human endothelial nitric oxide synthase gene”, Mol. Pharmacol. 1998; 53:630-637.
Кратко, клонировали фрагмент 5′ исходного кодона гена eNOS длиной 3,5 т.п.н., секвенировали и клонировали в экспрессионные плазмиды люциферазы светляка, чтобы фиксировать активацию промотора eNOS посредством активности гена-репортера. Для тестирования соединения использовали клеточную линию эндотелия человека, стабильно трансфектированную и экспрессирующую данную конструкцию промотор-репортер. Клетки инкубировали в течение 18 ч с соединением (I).
Перед этим соединение растворяли в стерильном DMSO. Конечная концентрация DMSO в полной среде составляла 0,5%. Индукцию экспрессии гена-репортера в указанных клетках измеряли с использованием стандартной системы анализа с люциферазой (Promega, кат.№ Е150) согласно инструкции производителя. Индукцию люциферазы в клетках, инкубированных с соединением (I), сравнивали с тем же показателем для клеток, инкубированных только с растворителем. Соотношение обеих величин активности (соотношении индукции транскрипции, TIR) наносили на график зависимости от концентрации соединения. Обычно величины TIR начинались при низких концентрациях с соотношения 1, указывая на отсутствие эффекта соединения, и возрастали до максимума величины TIR (TIRmax), который указывал на повышение транскрипции eNOS. Величины ЕС50 соотношений индукции транскрипции, в зависимости от концентрации соединения, определяли графически.
Влияние соединения (I) на транскрипцию eNOS подтверждали в ходе второго анализа, основанного на обнаружении белка eNOS. Эндотелиальные клетки первичного тяжа пупочной вены человека (HUVEC) выделяли и культивировали согласно стандартным процедурам. Сливающиеся клетки инкубировали с соединением (I) в течение 18 ч, и определяли влияние на экспрессию белка eNOS путем количественного анализа вестерн-блот. После инкубации соединения (I) HUVEC лизировали в ледяном лизирующем буфере, содержавшем 10 мМ Tris-HCl, рН 8,0, 1% SDS и ингибиторы протеаз. Лизат подвергали стандартному денатурирующему электрофорезу в полиакриламидном геле и проводили блоттинг на нитроцеллюлозных мембранах. Используя специфичные первичные моноклональные антитела (Transduction Laboratories, UK) и вторичные антитела, меченные щелочной фосфатазой (Jackson Labs), визуализировали специфичную полосу белка eNOS и определяли его количество на основе методики хемофлюоресцентного обнаружения.
Для соединения (I) величина ЕС50 составляла 0,8 мкМ, величина TIR(max) составляла 4,10.
Экспериментальные животные
Все эксперименты на животных выполняли в соответствии с законом Германии о защите животных и руководством по использованию экспериментальных животных, представленным в Guide for the care and Use of Laboratory Animals of the US National Institutes of Health.
Животные и лечение (эксперименты А-С)
Использовали мышей с дефицитом АроЕ и eNOS (линия C57BL/6J, Jackson Laboratory, Bar Harbor, Me). Все животные имели возраст 10-12 недель и массу тела от 22 до 28 г. За три дня до оперативного вмешательства мышей разделяли на 4 группы (контроль ароЕ, n=10-12; ароЕ с соединением (I), n=10-12; контроль eNOS, n=10-12; eNOS с соединением (I), n=10-12), и они получали или стандартный сухой корм для грызунов (содержащий 4% жиров и 0,001% холестерина; далее обозначается как группа плацебо) или стандартный сухой корм для грызунов + соединение (I) (10 или 30 мг/кг в день п/о).
А Антигипертензивный эффект у мышей с дефицитом АроЕ
Кровяное давление у бодрствующих мышей измеряли с помощью компьютеризированной системы с хвостовой манжетой.
Для соединения (I), после 4 месяцев лечения мышей с дефицитом АроЕ кровяное давление достоверно (p < 0,05) снижалось в группе, получавшей 30 мг/кг в день, по сравнению с группой плацебо (92±5 мм рт.ст. против 115±2 мм рт.ст.). После 4 недель лечения у мышей с дефицитом eNOS при аналогичных дозах снижения кровяного давления не наблюдалось.
В Ингибирование образования неоинтимы и атерогенеза (манжета на бедренной артерии)
После 3 дней лечения мышей с дефицитом АроЕ соединением (I) (10 мг/кг в день, в запрессованном в корм виде) животным давали наркоз путем внутрибрюшинной инъекции пентобарбитала (60 мг/кг) с последующей внутримышечной инъекцией ксилазина (2 мг/кг) и помещали манжету вокруг бедренной артерии, как описано у Moroi et al. (J. Clin. Invest. 101:1225-32, 1998). Кратко, рассекали левую бедренную артерию. Неокклюзивную 2,0 мм полиэтиленовую манжету, изготовленную из катетера РЕ-50 (внутренний диаметр 0,56 мм, внешний диаметр 0,965 мм, Becton Dickinson, Mountain View, Ca), помещали вокруг артерии и закрепляли двумя швами 7-0. Изолировали правую бедренную артерию от окружающих тканей, но манжету не накладывали. Лечение соединением (I) продолжали в течение 14 дней после оперативного вмешательства. Затем животных умерщвляли. Извлекали аорту для определения экспрессии сосудистой eNOS путем количественного вестерн-блоттинга. Извлекали обе бедренные артерии, фиксировали в формалине и заливали в парафин. Нарезали 20 поперечных срезов (10 мкм) из той части левой бедренной артерии, на которую была наложена манжета, и из соответствующего сегмента правой артерии. Срезы стандартно окрашивали гематоксилином и эозином. Осуществляли морфометрические анализы с использованием компьютерной программы для анализа изображения (LeicaQWin, Leica Imaging Systems, Cambridge, GB). Для каждого поперечного среза определяли площадь просвета, неоинтимы и средней части. С этой точки зрения неоинтиму определяли как площадь между просветом и внутренней эластичной пластинкой, а среднюю часть определяли как площадь между внутренней и внешней эластичной пластинкой. Соотношение между площадью неоинтимы и площадью средней части выражали как соотношение неоинтима/средняя часть.
Соединение (I) уменьшало патологическое адаптационное образование неоинтимы в два раза, уменьшая соотношение неоинтимы и средней части от 0,39±0,07 в группе плацебо до 0,170±0,04 в группе, получавшей соединение. Параллельно экспрессия сосудистой eNOS увеличивалась в 2,1 раза. Не удалось продемонстрировать эффект соединения (I) в аналогичном эксперименте с использованием мышей с дефицитом eNOS вместо мышей с дефицитом АроЕ.
С Предотвращение образование атеросклеротических бляшек при длительном лечении
Мышей с дефицитом АроЕ лечили в течение 16 недель соединением (I), запрессованным в корм, и, в конечном итоге, умерщвляли. У всех мышей извлекали аорту, фиксировали в формалине и заливали в парафин. Образование бляшек измеряли посредством липидных повреждений в аорте (от дуги аорты до диафрагмы) и анализировали с помощью окрашивания красителем масляный красный О. Для количественного определения влияния соответствующего соединения на экспрессию сосудистой eNOS в данном эксперименте использовали бедренные артерии.
Соединение (I) по настоящему изобретению достоверно уменьшало образование бляшек (5,2±1% против 13,3±2,6 в группе плацебо, величины представляют собой суммарный размер бляшек в % от общей поверхности). Установлено, что экспрессия сосудистой eNOS в экспериментальной группе повысилась в 1,75 раза.
D Улучшение коронарной функции у больных мышей с дефицитом АроЕ
В экспериментах использовали старых самцов мышей дикого типа С57BL/6J (Charles River Wiga GmbH, Sulzfeld) и мышей с дефицитом АроЕ (линия C57BL/6J, Jackson Laboratory, Bar Harbor, Me) в возрасте 6 месяцев и с массой тела от 28 до 35 г. Мышей разделяли на 3 группы (С57BL/6, n=8; контроль ароЕ, n=8; ароЕ c соединением (I), n=8), и они получали в течение 8 недель или стандартный сухой корм для грызунов (содержащий 4% жиров и 0,001% холестерина) или стандартный сухой корм для грызунов + соединение (I) (30 мг/кг в день п/о).
Мышам давали наркоз пентобарбитоном натрия (100 мг/кг в/б) и быстро вырезали сердце и помещали его в ледяной перфузионный буфер. В аорту вставляли канюлю и подсоединяли к перфузионному аппарату (HUGO SACHS ELECTRONICS, Freiburg, Германия), который немедленно приводили в действие при постоянном перфузионном давлении 60 мм рт.ст. Сердца перфузировали ретроградным образом модифицированным бикарбонатным буфером Креббса, уравновешенным 95% О2 и 5% СО2, при поддержании температуры 37,5°С.
Малый катетер с заостренным срезом (РЕ 50) пропускали через легочную вену в левый желудочек и проталкивали сквозь стенку желудочка, закрепляли на верхушке сердца за сборенный конец и соединяли с игольчатым микроманометром (Millar 1.4 French). В левое предсердие помещали канюлю через ту же легочную вену, и сердце приводили в рабочее состояние с постоянным давлением преднагрузки 10 мм рт.ст. и давлением постнагрузки 60 мм рт.ст. Отток из аорты и приток в предсердие непрерывно измеряли с использованием ультразвуковых поточных зондов (HSE/Transonic Systems Inc.). Коронарный поток рассчитывали как разницу между предсердным потоком и аортальным потоком. Все гемодинамические данные подвергали цифровой обработке при скорости записи параметров 1000 Гц и записывали на ПК с использованием специальной программы (HEM, Notocord).
Сердца оставляли для стабилизации в течение 30 мин. Все функциональные гемодинамические данные измеряли в состоянии паузы и во время нагрузки объемом и давлением.
Кривые функции левого желудочка строили путем изменения давления преднагрузки. Для получения кривых преднагрузки постнагрузку устанавливали на уровне 60 мм рт.ст., а преднагрузку изменяли с шагом в 5 мм рт.ст. в пределах от 5 до 25 мм рт.ст. Сердца оставляли для стабилизации при исходных условиях между нагрузкой давлением и объемом.
Изолированные сердца от мышей с дефицитом АроЕ показали более низкий коронарный поток при данных условиях эксперимента по сравнению с мышами дикого типа C57B16 (3,6 мл/мин против 4,95 мл/мин). Лечение животных с дефицитом АроЕ соединением (I) по настоящему изобретению увеличивало коронарный поток до 5 мл/мин, по сравнению с уровнями здоровых мышей дикого типа. Соединение (I) также улучшало зависимый от преднагрузки коронарный поток и снижало частоту желудочковых аритмий, что является показателем противоишемической эффективности.
Формула изобретения
1. Применение 4-фтор-N-индан-2-илбензамида формулы (I)
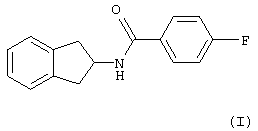
для изготовления лекарственного средства для стимуляции экспрессии эндотелиальной NO-синтазы.
2. Применение 4-фтор-N-индан-2-илбензамида для изготовления лекарственного средства для лечения стабильной или нестабильной стенокардии, коронарной болезни сердца, стенокардии Принцметалла, острого коронарного синдрома, сердечной недостаточности, инфаркта миокарда, тромбоза, окклюзивного заболевания периферических артерий, эндотелиальной дисфункции, атеросклероза, рестеноза, повреждения эндотелия после РТСА, гипертензии, гипертонической болезни, легочной гипертензии, вторичной гипертензии, реноваскулярной гипертензии, хронического гломерулонефрита, эректильной дисфункции, желудочковой аритмии, диабета или осложнений диабета, нефропатии, ретинопатии, бронхиальной астмы, хронической почечной недостаточности, остеопороза, или для воздействия на ангиогенез, или для снижения риска возникновения сердечно-сосудистых заболеваний у женщин в постменопаузе или после приема контрацептивов.
3. Применение по п.1 или 2, при котором лекарственное средство предназначено для лечения эндотелиальной дисфункции, гипертензии, коронарной болезни сердца, стабильной стенокардии, осложнений диабета или атеросклероза.
4. Применение по п.1 или 2, при котором лекарственное средство предназначено для лечения нестабильной стенокардии, острого коронарного синдрома, сердечной недостаточности, инфаркта миокарда, тромбоза, окклюзивного заболевания периферических артерий, рестеноза, повреждения эндотелия после РТСА.
5. Применение по п.1 или 2, при котором лекарственное средство предназначено для лечения коронарной болезни сердца.
6. Применение по п.1 или 2, при котором лекарственное средство предназначено для лечения атеросклероза.
7. Применение по п.1 или 2, при котором лекарственное средство предназначено для лечения сердечной недостаточности.
8. Фармацевтический препарат для стимуляции экспрессии эндотелиальной NO-синтазы, включающий эффективное количество 4-фтор-N-индан-2-илбензамида и фармацевтически приемлемый носитель.
9. Фармацевтический препарат для лечения стабильной или нестабильной стенокардии, коронарной болезни сердца, стенокардии Принцметалла, острого коронарного синдрома, сердечной недостаточности, инфаркта миокарда, тромбоза, окклюзивного заболевания периферических артерий, эндотелиальной дисфункции, атеросклероза, рестеноза, повреждения эндотелия после РТСА, гипертензии, гипертонической болезни, легочной гипертензии, вторичной гипертезнии, реноваскулярной гипертензии, хронического гломерулонефрита, эректильной дисфункции, желудочковой аритмии, диабета или осложнений диабета, нефропатии, ретинопатии, бронхиальной астмы, хронической почечной недостаточности, остеопороза или для воздействия на ангиогенез или для снижения риска возникновения сердечно-сосудистых заболеваний у женщин в постменопаузе или после приема контрацептивов, где указанный препарат включает эффективное количество 4-фтор-N-индан-2-илбензамида и фармацевтически приемлемый носитель.
10. Фармацевтический препарат по п.8 или 9 в форме пилюли, таблетки, таблетки, покрытой лаком, таблетки, покрытой сахаром, гранулы, твердой и мягкой желатиновой капсулы, водного, спиртового или масляного раствора, сиропа, эмульсии или суспензии, суппозитория, раствора для инъекций или инфузии, мази, настойки, спрея, чрескожной терапевтической системы, назального спрея, аэрозольной смеси, микрокапсулы, имплантата или палочки.
|
|