|
|
(21), (22) Заявка: 2006115637/15, 10.05.2006
(24) Дата начала отсчета срока действия патента:
10.05.2006
(46) Опубликовано: 27.10.2007
(56) Список документов, цитированных в отчете о
поиске:
RU 2193395 С2 27.11.2002. GB 2280604 A1 08.02.1995. EP 0397025 A1 14.11.1990. CN 1568986 A1 26.01.2005.
Адрес для переписки:
115172, Москва, ул. Б. Каменщики, 9, ОАО “Мосхимфармпрепараты” им. Н.А. Семашко
|
(72) Автор(ы):
Кучугурин Владимир Александрович (RU),
Бариленко Ирина Ивановна (RU),
Лазарева Ольга Алексеевна (RU),
Караванин Юрий Вячеславович (RU)
(73) Патентообладатель(и):
Открытое акционерное общество “Московское производственное химико-фармацевтическое объединение им. Н.А. Семашко” (RU)
|
(54) ТВЕРДАЯ ЛЕКАРСТВЕННАЯ ФОРМА, ОБЛАДАЮЩАЯ ГИСТАМИНОПОДОБНЫМ ДЕЙСТВИЕМ, И СПОСОБ ЕЕ ПОЛУЧЕНИЯ
(57) Реферат:
Изобретение относится к области медицины, в частности к фармации, и касается твердой лекарственной формы средства для профилактики и устранения головокружения и способа его получения, содержащей в качестве активного фармацевтического ингредиента бетагистин и целевые добавки при следующем соотношении ингредиентов, мас.%: бетагистина гидрохлорид – 4-16; микрокристаллическая целлюлоза – 25-70; кислотный стабилизатор – 1-3; аэросил – 1-10; вещество-дезинтегрант – 2-10; скользящие вещества – 1,2-5; сахар молочный – остальное. Изобретение обеспечивает хорошую распадаемость и прочность таблетки, упрощение получения лекарственной формы. 2 н. и 6 з.п. ф-лы, 2 табл., 2 ил.
Изобретение относится к области медицины, в частности к фармации, и касается твердой лекарственной формы средства для профилактики и устранения головокружения (синтетического аналога гистамина) и содержит в качестве активного фармацевтического ингредиента бетагистин и целевые добавки: микрокристаллическую целлюлозу, сахар молочный, кислотный стабилизатор, вещество-дезинтегрант, аэросил, скользящие вещества в определенном соотношении. Изобретение обеспечивает хорошую распадаемость и прочность таблетки, упрощение получения лекарственной формы.
Бетагистин – агонист H1-рецепторов сосудов внутреннего уха и антагонист Н3-рецепторов вестибулярных ядер ЦНС; улучшает микроциркуляцию и проницаемость капилляров, нормализует давление эндолимфы в лабиринте и улитке, увеличивает кровоток в базиллярной артерии, нормализует проводимость в нейронах вестибулярных ядер на уровне ствола головного мозга. Снижает частоту и интенсивность головокружения, уменьшает шум в ушах, улучшает слух при его снижении. Стабильный терапевтический эффект наступает через 14 дней.
Применяется при болезни и синдроме Меньера (в т.ч. шум в ушах и нарушения слуха), вестибулярных головокружениях различного генеза (вертебробазилярная недостаточность, посттравматическая энцефалопатия, атеросклероз сосудов головного мозга, вестибулярный неврит, лабиринтит, доброкачественное позиционное головокружение после нейрохирургических операций).
Абсорбируется быстро, связь с белками плазмы – низкая. Максимальная концентрация достигается через 3 часа. Практически полностью выводится почками в виде метаболита (2-пиридилуксусной кислоты) в течение 24 ч. Период полувыведения – 3-4 ч. [1]
В химическом отношении бетагистин – 2-[2-метиламино)этил]пиридин:
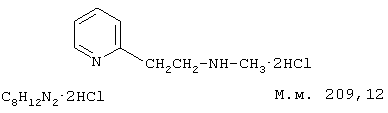
Бетагистин и его соли представляют собой белые или белые с коричневатыми оттенками порошки, легко комкующиеся и, как правило, высокогигроскопичные. В присутствии влаги происходит постепенное окисление бетагистина с образованием фармацевтически неактивных продуктов распада.
В патентном фонде РФ обнаружен документ RU 2248791 С2 от 28.02.2000, Италия, Фармачеутичи Форменти, касающийся состава на основе бетагистина, получаемого гранулированием из расплава бетагистина и жирового компонента, смешением гранулята с гидрофильным соединением и подходящими вспомогательными ингредиентами. По мнению автора изобретения, такая таблетная форма обеспечивает контролируемое высвобождение бетагистина.
Имеется международная заявка WO 2005/004850 с описанием таблетной формы бетагистина с двухслойным покрытием, Италия, Фармачеутичи Форменти.
В состав этих композиций включены сложные соединения, а способ получения композиций представляет сложную многослойную технологию приготовления таблетки.
Известно лекарственное средство «Бетасерк» производства Солвей Фарма, Нидерланды, содержащее активный фармацевтический ингедиент – бетагистина гидрохлорид и вспомогательные вещества: микрокристаллическую целлюлозу, маннитол, кислоту лимонную, диоксид кремния, тальк. [2]
Данное средство имеет широкие пределы растворимости, поэтому концентрация активного фармацевтического ингредиента в плазме крови не достаточно предсказуема у различных пациентов. Этот фактор требует особенно тщательного подбора дозы для различных пациентов с целью достижения ожидаемого терапевтического эффекта и сведения к минимуму побочных эффектов.
Поэтому по-прежнему актуальным является создание твердой лекарственной формы препарата для профилактики и устранения головокружения с использованием вспомогательных веществ, присутствующих на сырьевом рынке РФ, которая удовлетворяет всем требованиям на фармацевтическое средство.
Задачей изобретения является создание устойчивой твердой лекарственной формы бетагистина, которая удовлетворяет всем требованиям на фармацевтическое средство в течение срока годности препарата. Лекарственная форма должна легко высвобождать основное вещество, обеспечивать высокую биодоступность, быть безопасной для здоровья, иметь хороший внешний вид. (Показатели по повышению биодоступности представлены в примере 5).
Поставленная задача решается тем, что в твердой лекарственной форме средства для профилактики и устранения головокружения, содержащей в качестве активного фармацевтического начала бетагистин, содержатся целевые добавки: микрокристаллическая целлюлоза, сахар молочный, аэросил, кислотный стабилизатор, вещество-дезинтегрант, скользящие вещества при следующем соотношении ингредиентов, мас.%:
| Бетагистина гидрохлорид |
4-16 |
| Микрокристаллическая целлюлоза |
25-70 |
| Кислотный стабилизатор |
1-3 |
| Аэросил |
1-10 |
| Вещество-дезинтегрант |
2-10 |
| Скользящие вещества |
1,2-5 |
| Сахар молочный |
Остальное. |
В качестве веществ-дезинтегрантов, т.е. веществ, улучшающих проникновение водной среды в лекарственную форму и приводящих ее к быстрому набуханию и дезинтеграции, что приводит к ускорению высвобождения действующего вещества, вводятся такие вещества, как прежелатинизированный крахмал, гидроксипропилметилцеллюлоза (ГПМЦ), кросскармелоза, кросповидон, кислота альгиновая в виде соли или их смеси.
В качестве скользящих веществ используются тальк или магния, и/или кальция стеарат, или их смеси, суммарное содержание – от 1,2 до 5%. Предпочтительно использовать смесь магния и/или кальция стеарата и талька, причем магния и/или кальция стеарата 0,2-1,0% и талька 1,0-3,0%.
Кислотный стабилизатор (кислота лимонная, ее гидратированные формы, их смесь или кислота аскорбиновая) выполняет роль стабилизатора бетагистина за счет дополнительного связывания неподеленной электронной пары азота, входящего в состав молекулы бетагистина, что приводит к снижению его реакционоспособности, и как следствие, большую устойчивость к воздействию компонентов воздуха в присутствии влаги.
Аэросил (коллоидный оксид кремния) является компонентом, улучшающим распределение компонентов в массе технологической смести.
Молочный сахар (лактоза) является наиболее оптимальным наполнителем для композиций с бетагистином. Введение его в заявленном количестве не оказывает раздражающее действие на желудочно-кишечный тракт и способствует лучшей распадаемости готовой лекарственной формы.
Микрокристаллическая целлюлоза (МКЦ) представляет собой многоцелевой компонент, обеспечивающий необходимые прочностные характеристики готовой лекарственной формы и увеличивающий биодоступность бетагистина.
Техническим результатом заявленного изобретения является получение отечественной лекарственной формы лекарственного средства гистаминоподобного действия для лечения головокружений и снижения слуха различного генеза, упрощение технологии производства ГЛС за счет оптимизации состава и последовательности проводимых операций и технологических параметров, прочностных характеристик, стабильности во времени, удешевления готового продукта при обеспечении гарантированных для пациентов значений показателей оценки биодоступности (растворение, распадаемость), обеспечение более быстрого наступления терапевтического эффекта по сравнению с препаратом-аналогом.
Заявляемая пропорция ингредиентов является оптимальной, найдена экспериментально и обеспечивает необходимое качество композиции, ее соответствие требованиям ГФ XI и срок годности более 3 лет.
Пример 1.
1. Бетагистина гидрохлорид – от 4 до 16%
2. МКЦ – от 55,2 до 66,2%
3. Маннит – 20%
4. Кислота лимонная – 2%
5. Аэросил – 2%
6. Тальк – 4,8%
Компоненты 1-3 и 5 (1/2 часть) смешивают, увлажняют раствором компонента 4, гранулируют, сушат с использованием калориферной сушки при температуре от (45±10)°С до остаточной влажности не более 6%. Полученный гранулят опудривают смесью компонентов 5 (1/2 часть) и 6 и таблетируют.
Выводы: полученный препарат обладает высокой неоднородностью распределения действующего вещества по массе таблеток. Внешний вид – не удовлетворяет требованию по причине наличия мраморности и окрашенных пятен.
Пример 2.
1. Бетагистина гидрохлорид – от 5 до 16%
2. МКЦ – от 55,2 до 66,2%
3. Маннит – 20%
4. Кислота лимонная – 2%
5. Аэросил – 2%
6. Тальк – 4,8%
Компоненты 1 и 4 растворяют в незначительном объеме воды. Компоненты 2, 3 и 5 смешивают, полученную смесь увлажняют приготовленным раствором компонентов 1 и 4, проводят влажную грануляцию и сушат гранулят в сушке калориферной при температуре (45±10)°С до остаточной влажности не более 6%. Высушенный гранулят опудривают смесью компонентов 5 и 6 и таблетируют. Средняя масса таблетки 0,25 г.
Выводы: препарат удовлетворяет предъявляемьм требованиям.
Пример 3.
Замена маннита на лактозу как на более распространенный и более дешевый ингредиент.
1. Бетагистина гидрохлорид – от 5 до 16%
2. МКЦ – от 55,2 до 66,2%
3. Лактоза – 20%
4. Кислота лимонная – 2%
5. Аэросил – 2%
6. Тальк – 4,8%
Компоненты 1 и 4 растворяют в незначительном объеме воды. Компоненты 2, 3 и 5 смешивают, полученную смесь увлажняют приготовленным раствором компонентов 1 и 4, проводят влажную грануляцию и сушат гранулят в сушке калориферной при температуре (45±10)°С до остаточной влажности не более 6%. Высушенный гранулят опудривают смесью компонентов 5 и 6 и таблетируют. Средняя масса таблетки 0,25 г.
Выводы: препарат удовлетворяет предъявляемьм требованиям.
Пример 4.
Изменение состава с целью снижения расходных норм при сохранении качества.
1. Бетагистина гидрохлорид – от 6 до 16%
2. МКЦ – от 55 до 65%
3. Лактоза – от 15 до 25%
4. Кислота лимонная – 2%
5. Аэросил – 2%
6. Тальк – 4,8%
Компоненты 1 и 4 растворяют в незначительном объеме воды. Компоненты 2, 3 и 5 смешивают, полученную смесь увлажняют приготовленным раствором компонентов 1 и 4, проводят влажную грануляцию и сушат гранулят в сушке калориферной при температуре (45±10)°С до остаточной влажности не более 6%. Высушенный гранулят опудривают смесью компонентов 5, 6 и таблетируют. Средняя масса таблетки 0,20 г.
Выводы: Снижение затрат компонентов на 20%. Препарат удовлетворяет предъявляемым требованиям, однако показатели биодоступности снижены по сравнению с примером 3 (распадаемость – до 15 мин, растворение – не менее 80%). Для поддержания необходимой высоты таблетки давление прессования подобрано так, чтобы конечная прочность полученных таблеток соответствовала предъявляемым требованим. Последнее негативно сказывается на работу пресс-инструмента и увеличивает его износ.
Пример 5.
1. Бетагистина гидрохлорид – от 4 до 16%
2. МКЦ – от 30 до 65%
3. Лактоза – от 10 до 45%
4. Кислота лимонная – от 1 до 5%
5. Кросповидон – от 2 до 10%
6. Аэросил – от 1,5 до 10%
7. Тальк – от 1 до 6%
Компоненты 1 и 4 предварительно растворяют в воде. Компоненты 2, 3, 5 и 6 смешивают, полученную смесь увлажняют приготовленным раствором компонентов 1 и 4, проводят влажную грануляцию и сушат гранулят в сушке калориферной при температуре (45±10)°С до остаточной влажности не более 6%. Высушенный гранулят опудривают смесью компонентов 5, 6 и 7 и таблетируют. Средняя масса таблетки 0,20 г.
Тальк (компонент 7) заменяется частично или полностью на стеарат магния или стеарат кальция или их смесью.
Выводы: Препарат удовлетворяет предъявляемым требованиям.
Различные варианты для комбинации состава в соответствии с примером 5 представлены в таблице 1. Так же приведены данные показателей качества биодоступности препарата (распадаемость, растворение, время достижения 90% растворения).
Таблица 1.
| Наименование компонента |
Содержание в процентах |
| Бетагистина гидрохлорид |
4 |
8 |
8 |
10 |
14 |
16 |
4 |
8 |
16 |
| МКЦ |
51,9 |
54 |
49 |
63,5 |
52,5 |
36,7 |
36 |
35,4 |
31,6 |
| Лактоза |
31 |
25,8 |
25,5 |
10,5 |
15 |
30 |
40,5 |
42,1 |
26,1 |
| Кислота лимонная |
2 |
2,2 |
1,9 |
2,5 |
2 |
4,5 |
1,6 |
3 |
3,8 |
| Кросповидон |
4,7 |
3,2 |
10 |
8 |
3 |
2,6 |
6,1 |
2,4 |
10 |
| Аэросил |
3 |
3,8 |
3,6 |
4,5 |
10 |
8 |
10 |
4,1 |
6,8 |
| Тальк |
2,5 |
1,5 |
1 |
0 |
1 |
1,5 |
1 |
2 |
4,5 |
| Магния стеарат |
0,9 |
1 |
1 |
0,5 |
1 |
0,5 |
0 |
1,5 |
0,2 |
| Кальция стеарат |
0 |
0,5 |
0 |
0,5 |
1,5 |
0,2 |
0,8 |
1,5 |
1 |
| |
| Распадаемость, мин (не более 15 мин) |
от 1 до 6 |
От 1 до 4 |
от 1 до 5 |
от 1 до 6 |
от 1 до 7 |
от 1 до 3 |
от 2 до 8 |
от 2 до 4 |
от 2 до 7 |
| Растворение, % (не менее 75%) |
99,4 |
99,36 |
99,99 |
99,1 |
98,44 |
99,64 |
95,64 |
96,46 |
98,4 |
| Время достижения 90% уровня растворения, мин |
менее 5 |
менее 10 |
менее 5 |
менее 5 |
менее 10 |
менее 10 |
менее 5 |
менее 10 |
менее 5 |
| Внешний вид |
удовл. |
удовл. |
удовл. |
удовл. |
удовл. |
удовл. |
удовл. |
удовл. |
удовл. |
| Средняя масса |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
| Срок годности, лет |
более 2,5 |
более 3 |
более 3 |
3,5 |
более 2,5 |
более 2 |
более 3 |
3,5 |
более 2,5 |
Для сравнения опыта 5 (вторая колонка, с содержанием дезинтегранта на уровне 3,2%) проведено изучения кинетики высвобождения активного ингредиента из готовой лекарственной формы по сравнению с препаратом-аналогом (Бетасерк, производства фирмы Солвей Фарма) на конце срока наблюдения – 3 года.
Сравнительные данные показывают, что кривая высвобождения активного фармацевтического ингредиента из заявленного препарата характеризуется более высокой скоростью – время достижения уровня высвобождения более 95% достигается за время около 8 минут, в то время как из препарата-аналога достижение заданного значения достигается за время около 20 мин.
Кривая изменения концентрации характеризуется быстрым ростом и выходом на стабильный уровень концентрации уже на 10-й минуте, в то время как препарат-аналог показывает первоначальный скачок концентрации и дальнейший ее постепенный рост без выхода на плато. Разброс значений значительно снижен для заявленного препарата в сравнении с препаратом-аналогом, что показывает снижение вариабельности активной концентрации бетагистина в плазме крови (оценочно – не менее чем в три раза) и стабилизацию фармакокинетических показателей.
Это показано на графиках динамики высвобождения бетагистина из разработанного препарата (фиг.1) и динамики высвобождения бетагистина из препарата «Батасерк» (фиг.2).
Пример 6.
1. Бетагистина гидрохлорид – от 6 до 16%
2. МКЦ – от 55 до 65%
3. Лактоза – от 15 до 25%
4. Кислота лимонная – 2%
5. Аэросил – 2%
6. Тальк – 4,8%
Компоненты 1 и 4 растворяют в незначительном объеме воды. Компоненты 2, 3 и 5 смешивают, полученную смесь увлажняют приготовленным раствором компонентов 1 и 4, проводят влажную грануляцию и сушат гранулят в сушке калориферной при температуре (45±10)°С до остаточной влажности не более 6 %. Высушенный гранулят опудривают смесью компонентов 5, 6 и рассыпают в капсулы.
Препарат по стабильности эквивалентен таковому в таблетной форме – не менее 3 лет. В отличие от таблеток капсулы относятся к лекарственной форме, обладающей по сравнению с таблетками большей биодоступностью и удобством в применении.
Пример 7.
То же, что в примере 4. Процесс увлажнения и процесс сушки гранулята проводят на установках с кипящим слоем, далее опудривают и таблетируют или рассыпают в капсулы твердые желатиновые.
Выводы: препарат удовлетворяет предъявляемым требованиям в течение срока хранения не менее 3 лет.
Пример 8.
В качестве вещества-дезинтегранта кросповидон заменяется на ГПМЦ или крахмал прежелатинизированный или кроскармелозу или альгиновую кислоту (в виде соли натрия или калия).
Тальк заменяется частично или полностью на стеарат магния или стеаратом кальция или их смесью.
Таблица 2.
| Бетагистина гидрохлорид |
8 |
8 |
8 |
8 |
8 |
8 |
8 |
8 |
| МКЦ |
31,5 |
33,4 |
34,5 |
35,9 |
39,4 |
44,35 |
52 |
32,5 |
| Лактоза |
41 |
37,6 |
34,5 |
36,1 |
37,6 |
30,65 |
27,8 |
44,5 |
| Кислота лимонная |
3 |
3 |
3 |
3 |
3 |
3 |
3 |
3 |
| ГПМЦ |
10 |
0 |
0 |
0 |
4 |
0 |
0 |
0 |
| Крахмал прежелатинизированный |
0 |
10 |
0 |
0 |
0 |
5 |
0 |
0 |
| Кросскармелоза |
0 |
0 |
10 |
0 |
0 |
0 |
2 |
0 |
| Кислота альгиновая в виде соли |
0 |
0 |
0 |
10 |
0 |
0 |
0 |
1 |
| Аэросил |
1,5 |
3 |
5 |
2 |
3 |
4 |
6 |
6 |
| Тальк |
3 |
0 |
0 |
0 |
2 |
2 |
1,2 |
2 |
| Кальция стеарат |
2 |
2 |
0 |
3 |
3 |
0 |
0 |
1,5 |
| Магния стеарат |
0 |
3 |
5 |
2 |
0 |
3 |
0 |
1,5 |
| |
| Распадаемость на конец срока годности, мин (не более 15 мин) |
не более 8 |
не более 8 |
не более 8 |
не более 7 |
не более 9 |
не более 9 |
не более 10 |
не более 13 |
| Растворение на конец срока годности, % (не менее 75%) |
не менее 90 |
не менее 95 |
не менее 90 |
не менее 90 |
не менее 95 |
не менее 90 |
не менее 90 |
не менее 90 |
| Время достижения 90% уровня растворения, мин |
менее 10 |
менее 10 |
менее 10 |
менее 10 |
менее 10 |
менее 10 |
менее 10 |
менее 10 |
| Внешний вид |
удовл. |
удовл. |
удовл. |
удовл. |
удовл. |
удовл. |
удовл. |
удовл. |
| Средняя масса |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
Литература
1. Машковский М.Д. Лекарственные средства. В двух томах. – Изд. 13-е, новое- Харьков: Торсинг, 1997. Том 1, с.275.
2. Энциклопедия лекарственных средств. – 12-й вып./Гл. ред. Г.Л.Вышковский. – М.: РЛС-2005. С.168-169, 1086.
4. The Merck Index, 12-edition, MERCK & CO., Inc., Whetehouse Station, NJ, 1996, p.197.
5. Отчет об экспериментальном изучении токсичности препарата «Бетагистин» производства ОАО «Московское производственное химико-фармацевтическое объединение им. Н.А.Семашко» и зарегистрированного препарата-аналога «Бетасерк®», ФГУН Институт токсикологии, Санкт-Петербург, 2006 г.
7. Афанасьева С.А., Горбацева Ф.Е., Натяжкина Г.М. Неврол. журн. 2003; 4 (8): 38-42.
Формула изобретения
1. Твердая лекарственная форма средства для лечения головокружений и снижения слуха, содержащая в качестве активного фармацевтического ингредиента бетагистин и целевые добавки, отличающаяся тем, что в качестве целевых добавок содержит микрокристаллическую целлюлозу (МКЦ), лактозу (сахар молочный), кислотный стабилизатор, аэросил, вещество-дезинтегрант, скользящее, выбранное из группы, включающей тальк, магния стеарат, кальция стеарат или их смеси при следующем соотношении ингредиентов, мас.%:
| Бетагистин гидрохлорида |
4-16 |
| Микрокристаллическая целлюлоза |
25-70 |
| Кислотный стабилизатор |
1-3 |
| Аэросил |
1-10 |
| Вещество-дезинтегрант |
2-10 |
| Скользящие вещества |
1,2-5 |
| Сахар молочный |
остальное |
2. Лекарственная форма по п.1, отличающаяся тем, что в качестве стабилизатора кислотности содержит кислоту лимонную или кислоту аскорбиновую.
3. Лекарственная форма по п.1, отличающаяся тем, что в качестве вещества-дезинтегранта содержит прежелатинизированный крахмал, гидроксипропил-метилцеллюлозу (ГПМЦ), кросскармелозу, кросповидон, кислоту альгиновую в виде соли или их смеси.
4. Лекарственная форма по п.1, отличающаяся тем, что в качестве скользящих содержит тальк в количестве 1-3%.
5. Лекарственная форма по п.1, отличающаяся тем, что она представляет собой твердую желатиновую капсулу, в которой размещены активный фармацевтический ингредиент и целевые добавки.
6. Способ получения твердой лекарственной формы средства для лечения головокружений и снижения слуха по п.1, содержащей в качестве активного фармацевтического ингредиента бетагистин и целевые добавки, включающий смешение, гранулирование и формование смеси, отличающийся тем, что смешивают порошок МКЦ, лактозы и аэросила и части вещества-дезинтегранта, увлажняют смесь раствором, содержащим бетагистин, кислотный стабилизатор, часть вещества-дезинтегранта, осуществляют влажное гранулирование смеси, сушку и опудривание гранулята скользящим, выбранным из группы, включающей тальк, магния стеарат, кальция стеарат или их смеси.
7. Способ по п.6, отличающийся тем, что процесс увлажнения и сушки гранулята проводят в установке с кипящим слоем.
8. Способ по п.6, отличающийся тем, что при опудривании дополнительно вводится 3-6% вещества-дезинтегранта от общего количества вещества-дезинтегранта.
РИСУНКИ
|
|