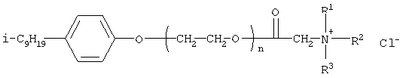Патент на изобретение №2308468
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
(54) 1,2,3-ТРИС[(АММОНИО)МЕТИЛКАРБОНИЛОКСИПОЛИ(АЛКИЛЕНОКСИ)]ПРОПАН ТРИХЛОРИДЫ, ОБЛАДАЮЩИЕ БАКТЕРИЦИДНОЙ И ФУНГИЦИДНОЙ АКТИВНОСТЬЮ, И СПОСОБ ИХ ПОЛУЧЕНИЯ
(57) Реферат:
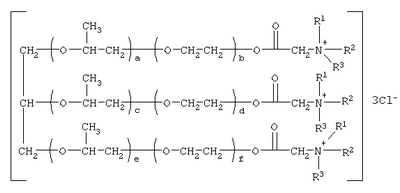
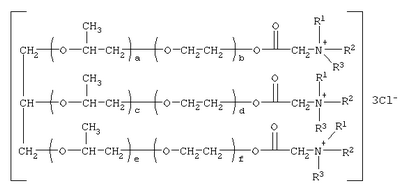
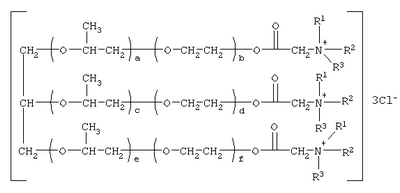
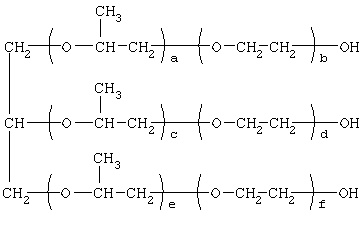
Изобретение относится к соединениям, обладающим бактерицидной и фунгицидной активностью, а именно к 1,2,3-трис[(аммонио)метилкарбонилоксиполи(алкиленокси)]пропан трихлоридам общей формулы где при R1=R2=H, R3=алифатический углеводородный радикал, содержащий 10-16 атомов углерода, а+с+е=49, b+d+f=9; при R1=R2=Н, R3=алифатический углеводородный радикал, содержащий 10-16 атомов углерода, а+с+е=55, b+d+f=10; при R1=R2=H, R3=С16H33, а+с+е=49, b+d+f=9; при R1=R2=H, R3=С16Н33, а+с+е=55, b+d+f=10; при R1=R2=CH3, R3=алифатический углеводородный радикал, содержащий 10-16 атомов углерода, а+с+е=49, b+d+f=9; при R1=R2=СН3, R3=алифатический углеводородный радикал, содержащий 10-16 атомов углерода, а+с+е=55, b+d+f=10; при R1=R2=H, R3=алифатический углеводородный радикал, содержащий 17-20 атомов углерода, а+с+е=66, b+d+f=15; при R1=R2=H, R3=алифатический углеводородный радикал, содержащий 17-20 атомов углерода, а+с+е=76, b+d+f=18. Также изобретение относится к способу получения этих соединений путем взаимодействия 1,2,3-трис[гидроксиполи(алкиленокси)]пропанов с монохлоруксусной кислотой в присутствии кислотного катализатора в среде кипящего органического растворителя с азеотропным удалением образующейся воды и с последующей обработкой при нагревании полученного продукта реакции в среде полярного растворителя аминосоединениями, R1R2R3N, где R1=R2=H, СН3; R3=С16Н33, алифатический углеводородный радикал, содержащий 10-16 либо 17-20 атомов углерода, и молярных соотношениях реагентов – гидроксильные производные пропана : монохлоруксусная кислота : аминосоединение=1,0:3,0-3,2:3,0-3,2 соответственно. Технический результат – синтез новых 1,2,3-трис[(аммонио)метилкарбонилоксиполи(алкиленокси)]пропан трихлоридов, обладающих бактерицидной и фунгицидной активностью, и способ их получения. 2 н. и 5 з.п. ф-лы, 2 табл.
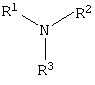
Изобретение относится к органической химии, а именно к синтезу неизвестных ранее 1,2,3-трис[(аммонио)метилкарбонилоксиполи(алкиленокси)]пропан трихлоридов, обладающих бактерицидной и фунгицидной активностью, которые могут быть использованы для борьбы с грибковыми и бактериальными поражениями в медицине, ветеринарии и сельском хозяйстве. Особенностью предлагаемого ряда аммониевых соединений является то, что они содержат [(аммонио)метилкарбонилоксиполи(алкиленоксильные)]радикалы общей формулы содержащие одновременно сложноэфирные и полиоксиалкильные фрагменты. Известны четвертичные аммониевые соединения, содержащие сложноэфирные группировки с алифатическими длинноцепочечными углеводородными радикалами, представляющие собой N,N,N-триэтил-N-[алкилоксикарбонилметил]аммоний хлориды формулы
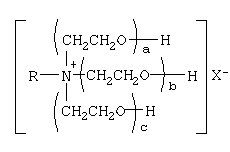
Известны также четвертичные аммониевые соединения, содержащие один или несколько полиоксиэтильных фрагментов. Такими, например, являются четвертичные аммониевые соединения, включающие в структуру аммонийного катиона три полиоксиэтильных фрагмента и имеющие общую формулу
[Плетнев М.Ю. Косметико-гигиенические моющие средства. – М.: Химия, 1990, 272 с.]. Наиболее близкими по структуре к предлагаемым соединениям являются N-[изононилфеноксиполи(этиленокси)карбонилметил]аммоний хлориды общей формулы [Патент 1531416 РФ. МПК С07С 87/30. Опубл. 1995.04.10. Фахретдинов П.С., Романов Г.В. и др. Способ получения ингибиторов коррозии углеводородных сталей в минерализованных сероводородсодержащих водных средах, проявляющих фунгистатическое и бактериостатическое и дезинфицирующее действие] Недостатком известного решения является сравнительно невысокая бактерицидная активность заявленных соединений в отношении грамположительных и грамотрицательных бактерий, а также отсутствие фунгицидной активности в отношении различного вида грибов, например возбудителя аскосфероза (болезни расплода пчел). Технический результат настоящего изобретения – синтез новых 1,2,3-трис[(аммонио)метилкарбонилоксиполи(алкиленокси)]пропан трихлоридов, обладающих бактерицидной и фунгицидной активностью, и способ их получения. Предлагаются 1,2,3-трис[(аммонио)метилкарбонилоксиполи(алкиленокси)]пропан трихлориды, содержащие одновременно сложноэфирные и полиоксиалкильные (полиоксиэтильные и/или полиоксипропильные) фрагменты общей формулы где при R1=R2=H; R3 = алифатический углеводородный радикал, содержащий 10-16 атомов углерода; а+с+е = общая степень оксипропилирования, равная 49; b+d+f = общая степень оксиэтилирования, равная 9; при R1=R2=H; R3 = алифатический углеводородный радикал, содержащий 10-16 атомов углерода; а+с+е = общая степень оксипропилирования, равная 55; b+d+f = общая степень оксиэтилирования, равная 10; при R1=R2=H; R3=С16Н33; а+с+е = общая степень оксипропилирования, равная 49; b+d+f = общая степень оксиэтилирования, равная 9; при R1=R2=H; R3 = C16H33; а+с+е = общая степень оксипропилирования, равная 55; b+d+f = общая степень оксиэтилирования, равная 10; при R1=R2=CH3; R3 = алифатический углеводородный радикал, содержащий 10-16 атомов углерода; а+с+е = общая степень оксипропилирования, равная 49; b+d+f = общая степень оксиэтилирования, равная 9; при R1=R2=СН3; R3 = алифатический углеводородный радикал, содержащий 10-16 атомов углерода; а+с+e = общая степень оксипропилирования, равная 55; b+d+f = общая степень оксиэтилирования, равная 10; при R1=R2=H; R3 = алифатический углеводородный радикал, содержащий 17-20 атомов углерода; а+с+е = общая степень оксипропилирования, равная 66; b+d+f = общая степень оксиэтилирования, равная 15; при R1=R2=H; R3 = алифатический углеводородный радикал, содержащий 17-20 атомов углерода; а+с+е = общая степень оксипропилирования, равная 76; b+d+f = общая степень оксиэтилирования, равная 18. Заявляемые 1,2,3-трис[(аммонио)метилкарбонилоксиполи(алкиленокси)]пропан трихлориды являются новыми, неизвестными ранее соединениями, обладающими бактерицидной и фунгицидной активностью. Известен способ получения четвертичных аммониевых соединений, содержащих сложноэфирные и полиоксиэтиленовые группировки, например N-[изононилфеноксиполи(этиленокси)карбонилметил]аммоний хлоридов общей формулы где R1=R2=СН3, алкил фракции C7-С9; R3 = алкил фракции C7-С9, алкил фракции С10-C16, алкил фракции C15-C18; n=3, 10; путем взаимодействия монохлоруксусной кислоты со спиртовой компонентой, которой являются изононилфеноксиполиэтиленгликоли общей формулы
где n=3, 10, с последующей обработкой аминами общей формулы
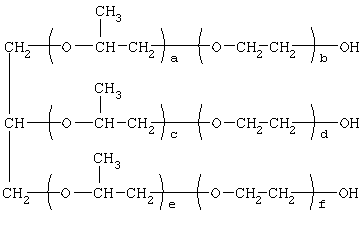
где R1=R2=СН3, алкил фракции C7-C9; R3 = алкил фракции C7-C9, алкил фракции С10-С16, алкил фракции C15-C18 [Патент 1531416 РФ. МПК С 07 С 87/30. Опубл. 1995.04.10]. Для заявляемых нами 1,2,3-трис[(аммонио)метилкарбонилоксиполи(алкиленокси)]пропан трихлоридов предлагается способ их получения путем взаимодействия 1,2,3-трис[гидроксиполи(алкиленокси)]пропанов формулы
где а+с+е = общая степень оксипропилирования, равная 49-76; b+d+f = общая степень оксиэтилирования, равная 0-18, с монохлоруксусной кислотой в присутствии кислотного катализатора в среде кипящего органического растворителя с азеотропным удалением образовавшейся воды и с последующей обработкой при нагревании полученного продукта реакции в среде полярного растворителя аминосоединениями формулы
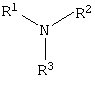
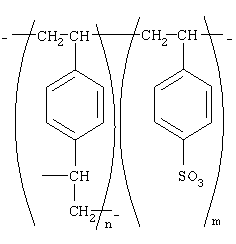
где R1=R2=H, CH3; R3=С16Н33, алифатический углеводородный радикал, содержащий 10-16 либо 17-20 атомов углерода, и молярных соотношениях реагентов – гидроксильное производное пропана : монохлоруксусная кислота : аминосоединение =1,0:3,0-3,2:3,0-3,2 соответственно. В качестве исходных 1,2,3-трис[гидроксиполи(алкиленокси)]пропанов, наряду с индивидуальными соединениями, можно использовать выпускаемые нефтехимической промышленностью различные оксиалкилированные глицерины, в том числе: Лапрол 3003 (ТУ 2226-022-10488057-95) с общей степенью оксипропилирования, равной 49-55, и общей степенью оксиэтилирования, равной 0; Лапрол 3603-2-12 (ТУ 2226-015-10488057-94) с общей степенью оксипропилирования, равной 49-55, и общей степенью оксиэтилирования, равной 9-10; Лапрол 5003-2-15 (ТУ 2226-006-10488057-94) с общей степенью оксипропилирования, равной 66-76, и общей степенью оксиэтилирования, равной 15-18. Монохлоруксусная кислота используется в виде индивидуального соединения или технического продукта по ТУ 2431-288-05763441-99. В качестве кислотного катализатора используют Н+-форму катионообменной смолы КУ-2-8, которая представляет собой твердые, ограничено набухающие высокомолекулярные полисульфокислоты сополимера стирола с дивинилбензолом общей формулы
и выпускается в различных модификациях, отличающихся количеством дивинилбензола в сополимере. Например, марки катионообменной смолы КУ-2-8 и КУ-2-10 содержат 8% и 10% дивинилбензола соответственно [Салдадзе К.М., Пашков А.Б., Титов B.C. Ионообменные высокомолекулярные соединения / Под ред. Салдадзе К.М. Москва: Гос. научн.-техн. изд. хим. лит., 1960, с.112-114]. Катионобменная смола КУ-2-8 выпускается по ГОСТ 20298-74. В качестве ароматических углеводородных растворителей для реакции взаимодействия гидроксильного производного пропана с монохлоруксусной кислотой используют растворитель, выбираемый из толуола, ксилола, Нефраса А-120/200 и др. В качестве полярного растворителя для обработки аминосоединениями продукта реакции гидроксильного производного пропана с монохлоруксусной кислотой используют низкомолекулярные спирты, например этанол, изопропанол. Химической промышленностью под условным обозначением Нефрас А-120/200 выпускается сольвент нефтяной тяжелый по ТУ 38-101809-90, получаемый из продуктов каталитического риформинга и содержащий смесь ароматических углеводородов C8-C9 (ксилолы, пропилбензолы, метилэтилбензолы, мезитилен, псевдокумол и др.). Предлагаемый способ получения новых, неизвестных ранее соединений – 1,2,3-трис[(аммонио)метилкарбонилоксиполи(алкиленокси)]пропан трихлоридов – имеет некоторое сходство со способом получения других рядов четвертичных аммониевых соединений, например N-[изононилфеноксиполи(этиленокси)карбонилметил]аммоний хлоридов [Патент 1531416 РФ. МКИ С07С 87/30. Фахретдинов П.С., Романов Г.В. и др. Способ получения ингибиторов коррозии углеродистых сталей в минерализованных сероводородсодержащих водных средах, проявляющих фунгистатическое, бактериостатическое и дезинфицирующее действие]. Но и различия этих двух способов являются существенными. В известном способе в качестве спиртовой компоненты используют изононилфеноксиполиэтиленгликоли общей формулы
а в качестве аминосоединений – длинноцепочечные алифатические третичные амины типа N,N,N-триалкиламинов фракции С7-С9, N,N-диметил-N-алкиламинов фракции С10-C16 или фракции С15-C18. В предлагаемом способе в качестве спиртовой компоненты используют гидроксилсодержащие производные пропана, представляющие собой 1,2,3-трис[гидроксиполи(алкиленокси)]пропаны общей формулы
где а+с+е = общая степень оксипропилирования, равная 49-76; b+d+f = общая степень оксиэтилирования, равная 0-18. Для обработки продукта взаимодействия гидроксилсодержащего производного пропана с монохлоруксусной кислотой используют аминосоединения формулы
где R1=R2=H, CH3; R3 = С16Н33, алифатический углеводородный радикал, содержащий 10-16 либо 17-20 атомов углерода, при молярных соотношениях реагентов – гидроксильное производное пропана : монохлоруксусная кислота : аминосоединение=1,0:3,0-3,2:3,0-3,2 соответственно. Обработку продукта взаимодействия гидроксильного производного пропана с монохлоруксусной кислотой аминосоединениями ведут при температуре 60-80°С в среде полярного растворителя. В качестве полярного растворителя используют низкомолекулярные спирты, например этанол, изопропанол и др. Следовательно, предлагаемый способ получения 1,2,3-трис[(аммонио)метилкарбонилоксиполи(алкиленокси)]пропан трихлоридов существенно отличается от существующих способов получения известных рядов четвертичных аммониевых соединений Таким образом, способ получения ранее неизвестных 1,2,3-трис[(аммонио)метилкарбонилоксиполи(алкиленокси)]пропан трихлоридов, обладающих бактерицидной и фунгицидной активностью, является новым. Приводим конкретные примеры выполнения изобретения. Пример 1. 1,2,3-Трис[(N-алкиламмонио)метилкарбонилоксиполи(этиленокси)поли(2-метилэтиленокси)]пропан трихлориды фракции C10-C16 с общей степенью оксипропилирования, равной 49, и общей степенью оксиэтилирования, равной 9. Смесь 70,0 г (2,1·10-2 г-моля) 1,2,3-трис[гидроксиполи(этиленокси)поли(2-метилэтиленокси)]пропана с общей степенью оксипропилирования, равной 49, и общей степенью оксиэтилирования, равной 9; 6,0 г (6,3·10-2 г-моля) монохлоруксусной кислоты и 140 мл толуола; 2,1 г (3,0% от веса гидроксильного производного пропана) Н+-формы катионообменной смолы КУ-2-8 (в качестве кислотного катализатора) кипятят с ловушкой Дина – Старка и обратным холодильником до полного прекращения выделения воды и снижения кислотного числа реакционной массы до величин, меньших или равных 2 мг КОН/г. Величины кислотного числа в пробах определяют титрованием спиртовым раствором КОН. Время реакции 15 часов. Отфильтровывают реакционную массу от катализатора. В вакууме удаляют органический растворитель (толуол) и не вступившую в реакцию монохлоруксусную кислоту. Полученный продукт реакции смешивают с раствором 12,6 г (6,3·10-2 г-моля) алкиламинов фракции C10-C16 в 95 мл изопропанола и нагревают при перемешивании и температуре 60-80°С в течение 10 часов. Контроль реакции ведут титрометрически, определяя содержание свободных аминов потенциометрическим титрованием спиртовым раствором соляной кислоты. Реакцию прекращают при остаточном содержании свободных аминов менее 0,3%. Растворитель удаляют в вакууме. Выход 86,3 г (99,0% от теор.) вязкой жидкости светло-желтого цвета. ИК-спектр: Пример 2. 1,2,3-Трис[(N-алкиламмонио)метилкарбонилоксиполи(этиленокси)поли(2-метилэтиленокси)] пропан трихлорид фракции C10-C16 с общей степенью оксипропилирования, равной 55, и общей степенью оксиэтилирования, равной 10. Получен аналогично примеру 1 из 75,0 г (2,0·10-2 г-моля) 1,2,3-трис [гидроксиполи(этиленокси)поли(2-метилэтиленокси)]пропана с общей степенью оксипропилирования, равной 55, и общей степенью оксиэтилирования, равной 10; 6,1 г (6,4·10-2 г-моля) монохлоруксусной кислоты; 150 мл ксилола, 3,8 г (5,0% от веса гидроксильного производного пропана) Н+-формы катионообменной смолы КУ-2-8 (в качестве кислотного катализатора); 12,8 г (6,4·10-2 г-моля) алкиламинов фракции C10-C16 и 100 мл этанола. Выход 90,9 г (99,5% от теор.) вязкой жидкости светло-желтого цвета. ИК-спектр: Пример 3. 1,2,3-Трис[(N-гексадециламмонио)метилкарбонилоксиполи(этиленокси)поли(2-метилэтиленокси)]пропан трихлориды с общей степенью оксипропилирования, равной 49, и общей степенью оксиэтилирования, равной 9. Получен аналогично примеру 1 из 65,0 г (2,0·10-2 г-моля) 1,2,3-трис[гидроксиполи(этиленокси)поли(2-метилэтиленокси)]пропана с общей степенью оксипропилирования, равной 49, и общей степенью оксиэтилирования, равной 9; 5,5 г (5,9·10-2 г-моля) монохлоруксусной кислоты и 130 мл нефраса А-120/200; 2,0 г (3,1% от веса гидроксильного производного пропана) Н+-формы катионообменной смолы КУ-2-8 (в качестве кислотного катализатора); 14,1 г (5,9·10-2 г-моля) гексадециламина и 90 мл изопропанола. Выход 83,0 г (99,8% от теор.) вязкой жидкости светло-желтого цвета. ИК-спектр: Пример 4. 1,2,3-Трис[(N-гексадециламмонио)метилкарбонилоксиполи(этиленокси)поли(2-метилэтиленокси)]пропан трихлориды с общей степенью оксипропилирования, равной 55, и общей степенью оксиэтилирования, равной 10. Получен аналогично примеру 1 из 68,0 г (1,8·10-2 г-моля) 1,2,3-трис[гидроксиполи(этиленокси)поли(2-метилэтиленокси)]пропана с общей степенью оксипропилирования, равной 55, и общей степенью оксиэтилирования, равной 10; 5,5 г (5,89·10-2 г-моля) монохлоруксусной кислоты; 140 мл толуола; 3,4 г (5,0% от веса гидроксильного производного пропана) H+-формы катионообменной смолы КУ-2-8 (в качестве кислотного катализатора); 14,1 г (5,8·10-2 г-моля) гексадециламина и 92 мл изопропанола. Выход 85,0 г (99,6% от теор.) вязкой жидкости светло-желтого цвета. ИК-спектр: Пример 5. 1,2,3-Трис[(N,N-диметил-N-алкиламмонио)метилкарбонилоксиполи(этиленокси)поли(2-метилэтиленокси)]пропан трихлорид фракции C10-C16 с общей степенью оксипропилирования, равной 49, и общей степенью оксиэтилирования, равной 9. Получен аналогично примеру 1 из 73,0 г (2,2·10-2 г-моля) 1,2,3-трис[гидроксиполи(этиленокси)поли(2-метилэтиленокси)]пропана с общей степенью оксипропилирования, равной 49, и общей степенью оксиэтилирования, равной 9; 6,2 г (6,6·10-2 г-моля) монохлоруксусной кислоты; 150 мл ксилола; 2,2 г (3,0% от веса гидроксильного производного пропана) H+-формы катионообменной смолы КУ-2-8 (в качестве кислотного катализатора); 14,9 г (6,6·10-2 г-моля) N,N-диметил-N-алкиламинов фракции C10-C16 и 100 мл изопропанола. Выход 92,4 г (99,9% от теор.) вязкой жидкости светло-желтого цвета. ИК-спектр: Пример 6. 1,2,3-Трис[(N,N-диметил-N-алкиламмонио)метилкарбонилоксиполи(этиленокси)поли(2-метилэтиленокси)]пропан трихлорид фракции C10-C16 с общей степенью оксипропилирования, равной 55, и общей степенью оксиэтилирования, равной 10. Получен аналогично примеру 1 из 75,0 г (2,0·10-2 г-моля) 1,2,3-трис[гидроксиполи(этиленокси)поли(2-метилэтиленокси)]пропана с общей степенью оксипропилирования, равной 55, и общей степенью оксиэтилирования, равной 10; 6,1 г (6,4·10-2 г-моля) монохлоруксусной кислоты; 150 мл нефраса А-120/200; 3,8 г (5,0% от веса гидроксильного производного пропана) Н+-формы катионообменной смолы КУ-2-8 (в качестве кислотного катализатора); 14,6 г (6,4·10-2 г-моля) N,N-диметил-N-алкиламинов фракции C10-C16 и 100 мл этанола. Выход 92,5 г (99,7% от теор.) вязкой жидкости светло-желтого цвета. ИК-спектр: Пример 7. 1,2,3-Трис[(N-алкиламмонио)метилкарбонилоксиполи(этиленокси)поли(2-метилэтиленокси)]пропан трихлорид фракции С17-С20 с общей степенью оксипропилирования, равной 66, и общей степенью оксиэтилирования, равной 15. Получен аналогично примеру 1 из 72,0 г (1,6·10-2 г-моля) 1,2,3-трис-[гидроксиполи(этиленокси)поли(2-метилэтиленокси)]пропана с общей степенью оксипропилирования, равной 66, и общей степенью оксиэтилирования, равной 15; 4,5 г (4,7·10-2 г-моля) монохлоруксусной кислоты; 144 мл ксилола, 2,2 г (3,1% от веса гидроксильного производного пропана) H+-формы катионообменной смолы КУ-2-8 (в качестве кислотного катализатора); 13,0 г (4,7·10-2 г-моля) алкиламинов фракции С17-С20 и 100 мл этанола. Выход 88,0 г (99,7% от теор.) вязкой жидкости светло-коричневого цвета. ИК-спектр: Пример 8. 1,2,3-Трис[(N-алкиламмонио)метилкарбонилоксиполи(этиленокси)поли(2-метилэтиленокси)]пропан трихлорид фракции C17-C20 с общей степенью оксипропилирования, равной 76, и общей степенью оксиэтилирования, равной 18. Получен аналогично примеру 1 из 74,0 г (1,4·10-2 г-моля) 1,2,3-трис[гидроксиполи(этиленокси)поли(2-метилэтиленокси)]пропана с общей степенью оксипропилирования, равной 76, и общей степенью оксиэтилирования, равной 18; 4,2 г (4,5·10-2 г-моля) монохлоруксусной кислоты; 150 мл толуола, 3,7 г (5,0% от веса гидроксильного производного пропана) Н+-формы катионообменной смолы КУ-2-8 (в качестве кислотного катализатора); 12,35 г (4,5·10-2 г-моля) алкиламинов фракции C17-C20 и 100 мл изопропанола. Выход 88,1 г (99,4% от теор.) вязкой жидкости светло-коричневого цвета. ИК-спектр: Предлагаемый способ получения 1,2,3-трис[(аммонио)метилкарбонилоксиполи(алкиленокси)]пропан трихлоридов является несложным, не требующим особых условий и специального оборудования и может быть осуществлен практически на любом химическом производстве. Определение бактерицидной активности соединений (препаратов) в отношении грамположительных и грамотрицательных бактерий. Бактерицидную активность предлагаемых соединений изучали в отношении представителя грамположительной группы бактерий – золотистого стафилококка Staphylococcus aureus штамм Р-209 и грамотрицательной группы – кишечной палочки Escherichia coli штамм 7904 по общепринятой в бактериологии методике [Методы экспериментальной химиотерапии/ Под. ред. Першина Г.Н. М.: Медицина, 1973, с.318-320; Ведьмина Е.А., Фурер Н.М. Руководство по микробиологии, клинике и эпидемиологии инфекционных болезней. М.: Медицина, 1964, с.608-610]. Пользуясь оптическим методом стандарта мутности готовили взвесь микроорганизмов в физиологическом растворе с бактериальной нагрузкой 500000 микробных тел в 1 мл. Бактериальную взвесь разливали в пробирки, содержащие определенные концентрации исследуемых препаратов. Контрольные пробирки содержали такое же количество стерильного физиологического раствора. Экспозиция при этом составляла 0,5; 1,0; 1,5; 2,0 и 3,0 часа. По истечении срока экспозиции как опытные, так и контрольные материалы высевали на элективные питательные среды: E.coli – на среду Эндо; St. aureus – на солевой агар. Инкубацию проводили в термостате при 37°С. Наблюдение за посевами вели в течение 7 суток. Результаты испытаний приведены в таблице 1. В качестве эталона сравнения бактерицидной активности использовали структурный аналог – Препарат Ф-761, представляющий собой N,N – диметил – N – алкил – N – [изононилфеноксиполи(этиленокси)карбонилметил]аммоний хлорид фракции C10-C16 формулы где R1=R2=CH3, R3 – алифатический углеводородный радикал, содержащий 10-16 атомов углерода; n=10 [Патент 1531416 РФ. МПК С07С 87/30. Опубл. 1995.04.10]. Препарат Ф-761 наряду с тем, что является структурным аналогом предлагаемых в настоящем изобретении соединений, обладает теми же видами активности (антибактериальным и антигрибковым действием.) Данные таблицы 1 свидетельствуют о том, что предлагаемые соединения проявляют более высокую бактерицидную активность, чем структурный аналог. Так, в отношении представителя грамположительных бактерий Staphylococcus aureus минимальные бактерицидные концентрации (МБЦК) составляют 0,125-0,25%, в то время как для структурного аналога МБЦК составляют 0,5% (при одинаковом времени экспозиции). В отношении представителя грамотрицательных бактерий – Eschrechia coli МБЦК заявляемых соединений составляет 0,125-0,5%, в то время как для структурного аналога МБЦК составляет 1,0%. Таким образом, предлагаемые 1,2,3-трис[(аммонио)метилкарбонилоксиполи(алкиленокси)]пропан трихлориды по бактерицидной активности в отношении грамположительных и грамотрицательных бактерий значительно превосходят структурный аналог. Определение фунгицидной активности. Фунгицидную активность предлагаемых соединений исследовали на примере возбудителя аскосфероза (болезни расплода пчел) Ascosphaera apis, штамм ВГ-8. Испытания проводили по общепринятой в микробиологии методике серийных разведений [Методы экспериментальной химиотерапии / Под ред. Першина Г.Н. М.: Медицина, 1973 с.318-320; Ведьмина Е.А., Фурер Н.М. Руководство по микробиологии, клинике и эпидемиологии инфекционных болезней. М.: Медицина, 1964, с.608-610]. Для опытов использовали взвесь грибов с грибковой нагрузкой 200000 грибковых тел в 1 мл физиологического раствора. Грибковую взвесь разливали в пробирки, содержащие определенные концентрации исследуемых препаратов, в пропорции 1 часть грибковой взвеси на 1 часть раствора препарата. В качестве эталона сравнения использовали структурный аналог – Препарат Ф-761 (Патент РФ №.1531416), строение которого приведено выше. В качестве контроля используют то же количество стерильного физиологического раствора. Экспозиции при этом составляют 5, 10, 30, 60 и 120 мин. После экспозиции проводят посев опытных и контрольных материалов на элективную питательную среду – сусло-агар. Инкубацию проводят в термостате при температуре 37°С и наблюдение ведут в течение 14 суток. Результаты исследований фунгицидной активности предлагаемых соединений и эталона сравнения представлены в таблице 2. Данные таблицы 2 свидетельствуют, что заявляемые соединения проявляют фунгицидную активность в отношении возбудителя аскосфероза Ascosphaera apis. Минимальные фунгицидные концентрации этих соединений составляют 0,25-2,0% при экспозиции 2 часа, в то время как структурный аналог Препарат Ф-761, проявляя фунгицистатическое действие, фунгицидной активностью не обладает. Представленные данные подтверждают преимущества предлагаемых 1,2,3-трис[(аммонио)метилкарбонилоксиполи(алкиленокси)]пропан трихлоридов перед структурным аналогом по фунгицидной активности. Таким образом, предлагаемые 1,2,3-трис[(аммонио)метилкарбонилоксиполи(алкиленокси)]пропан трихлориды являются новыми и способ их получения также является новым. Представленные данные по бактерицидной и фунгицидной активности предлагаемых соединений показывают их более высокую эффективность и явные преимущества перед структурным аналогом, обладающим антибактериальным и антигрибковым действием. Предлагаемый способ получения заявляемых соединений является несложным, не требующим особых условий и специального оборудования и может быть осуществлен практически на любом химическом производстве.
Формула изобретения
1. 1,2,3-Трис[(аммонио)метилкарбонилоксиполи(алкиленокси)]пропан трихлориды, общей формулы где при R1=R2=H; R3=алифатический углеводородный радикал, содержащий 10-16 атомов углерода; а+с+е=общая степень оксипропилирования, равная 49; b+d+f=общая степень оксиэтилирования, равная 9; при R1=R2=H; R3=алифатический углеводородный радикал, содержащий 10-16 атомов углерода; а+с+е=общая степень оксипропилирования, равная 55; b+d+f=общая степень оксиэтилирования, равная 10; при R1=R2=H; R3=С16Н33; а+с+е=общая степень оксипропилирования, равная 49; b+d+f=общая степень оксиэтилирования, равная 9; при R1=R2=H; R3=С16Н33; а+с+е=общая степень оксипропилирования, равная 55; b+d+f=общая степень оксиэтилирования, равная 10; при R1=R2=СН3; R3=алифатический углеводородный радикал, содержащий 10-16 атомов углерода; а+с+е=общая степень оксипропилирования, равная 49; b+d+f=общая степень оксиэтилирования, равная 9; при R1=R2=СН3; R3=алифатический углеводородный радикал, содержащий 10-16 атомов углерода; а+с+е=общая степень оксипропилирования, равная 55; b+d+f=общая степень оксиэтилирования, равная 10; при R1=R2=H; R3=алифатический углеводородный радикал, содержащий 17-20 атомов углерода; а+с+е=общая степень оксипропилирования, равная 66; b+d+f=общая степень оксиэтилирования, равная 15; при R1=R2=H; R3=алифатический углеводородный радикал, содержащий 17-20 атомов углерода; а+с+е=общая степень оксипропилирования, равная 76; b+d+f=общая степень оксиэтилирования, равная 18; 2. Соединения по п.1, обладающие бактерицидной и фунгицидной активностью. 3. Способ получения соединений по п.1, заключающийся во взаимодействии 1,2,3-трис[гидроксиполи(алкиленокси)]пропанов, формулы
а+с+е=общая степень оксипропилирования, равная 49-76; b+d+f=общая степень оксиэтилирования, равная 9-18, с монохлоруксусной кислотой в присутствии кислотного катализатора в среде кипящего органического растворителя с азеотропным удалением образующейся воды и с последующей обработкой при нагревании полученного продукта реакции в среде полярного растворителя аминосоединениями, формулы
где R1=R2=H, СН3; R3=С16Н33; алифатический углеводородный радикал, содержащий 10-16, либо 17-20 атомов углерода; и молярных соотношениях реагентов – гидроксильные производные пропана: монохлоруксусная кислота: аминосоединение=1,0:3,0-3,2:3,0-3,2 соответственно. 4. Способ по п.3, отличающийся тем, что в качестве кислотного катализатора используют Н+-форму катионообменной смолы КУ-2-8, взятую в количестве 3-5% от веса исходного гидроксильного производного пропана. 5. Способ по п.3, отличающийся тем, что в качестве органического растворителя при взаимодействии гидроксильного производного пропана с монохлоруксусной кислотой используют ароматический углеводородный растворитель, например толуол, ксилол, нефрас А-120/200. 6. Способ по п.3, отличающийся тем, что обработку аминосоединением продукта реакции гидроксильного производного пропана с монохлоруксусной кислотой ведут при температуре 60-80°С. 7. Способ по п.3, отличающийся тем, что в качестве полярного растворителя при обработке аминосоединением продукта реакции гидроксильного производного пропана с монохлоруксусной кислотой используют низкомолекулярные спирты, например этанол, изопропанол.
MM4A – Досрочное прекращение действия патента СССР или патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 07.07.2007
Извещение опубликовано: 20.02.2009 БИ: 05/2009
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

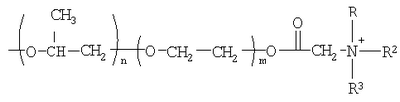
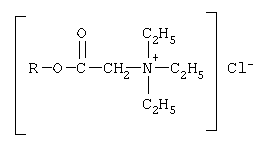
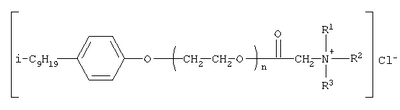
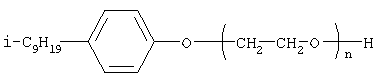
 (c=o)=1747 см-1;
(c=o)=1747 см-1;