|
(21), (22) Заявка: 2003128530/04, 21.02.2002
(24) Дата начала отсчета срока действия патента:
21.02.2002
(30) Конвенционный приоритет:
21.02.2001 (пп.5, 8-24) JP 2001-45430
05.10.2001 (пп.1-4, 6 и 7) JP 2001-309322
(43) Дата публикации заявки: 27.03.2005
(46) Опубликовано: 20.10.2007
(56) Список документов, цитированных в отчете о
поиске:
US 5391745 А, 21.02.1995. WO 94/11376 A1, 26.05.1994. ЕР 845464 А2, 03.06.1998. Hubert JOSIEN et al. A general synthetic approach to the (20S)-camptothecin family of antitumor agents by a regiocontrolled cascade radical cyclization of aryl isonitriles. Chemistry. European Journal, 1998, vol. 4, № 1, p.67-83. Kevin E. HENEGAR et al. Practical
(85) Дата перевода заявки PCT на национальную фазу:
22.09.2003
(86) Заявка PCT:
JP 02/01538 (21.02.2002)
(87) Публикация PCT:
WO 02/066416 (29.08.2002)
Адрес для переписки:
103064, Москва, ул. Казакова,16, НИИР Канцелярия “Патентные поверенные Квашнин, Сапельников и партнеры”, Квашнину В.П.
|
(72) Автор(ы):
ОГАВА Таканори (JP),
НИШИЯМА Хироюки (JP),
УЧИДА Миюки (JP),
САВАДА Сейго (JP)
(73) Патентообладатель(и):
КАБУШИКИ КАИША ЯКУЛТ ХОНША (JP)
|
(54) СПОСОБ СИНТЕЗА КАМПТОТЕЦИНСВЯЗАННЫХ СОЕДИНЕНИЙ
(57) Реферат:
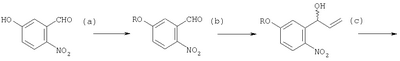
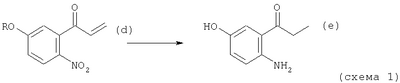
Изобретение относится к области синтеза аналогов камптотецина из 2‘-амино-5′-гидроксипропиофенона, соответствующего АВ-кольцевой части структуры СРТ и трициклического кетона, превращающегося в CDE-кольцевую часть в структуре СРТ. Описан способ получения 2′-амино-5′-гидроксипропиофенона, в котором способ содержит следующие этапы: (1) этап получения соединения (b) путем смешивания соединения (а), бензилирующего агента и основания и перемешивания указанной смеси в растворителе при нагревании с обратным холодильником; (2) этап получения соединения (с) путем добавления по каплям реактива Гриньяра к соединению (b) в атмосфере инертного газа; (3) этап получения соединения (d) путем смешивания соединения (с) с окисляющим агентом и перемешивания смеси; и (4) этап получения соединения (е) путем каталитического восстановления соединения (d) (схема 1). Описаны промежуточные соединения (с’) и (d’). Описан также способ получения трициклического кетона для обеспечения эффективного полного синтеза СРТ, являющегося исходным соединением для иринотекана гидрохлорида и различных типов производных камптотецина, а также для стабильного получения СРТ и его производных. 5 н. и 19 з.п. ф-лы, 17 табл.
(56) (продолжение):
CLASS=”b560m”Asymmetric Synthesis of (S)-4-ethyl-6,7,8,10-tetrahydro-4-hydroxy-1H-pyrano [3,4-f]indolizine-3,6,10(4H)trione. A Key Intermediate for the Synthesis of Irinotecan and Other Camptothecin Analogs. J. Org. Chem., 1997, vol.62, № 19, p.6588-6597. RU 2061678 C1, 10.06.1996. RU 2164917 C2, 10.04.2001. RU 2138503 C1, 27.09.1999.
Текст описания приведен в факсимильном виде                                                                        
Формула изобретения
1. Способ получения 2′-амино-5′-гидроксипропиофенона для синтеза аналогов камптотецина, в котором из соединения (а):
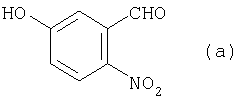
получают соединение (b):
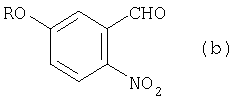
из соединения (b) получают соединение (с):
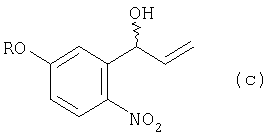
из соединения (с) получают соединение (d):
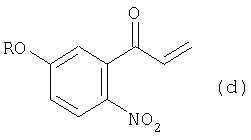
а из соединения (d) получают соединение (е):
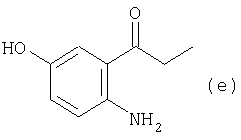
при этом данный способ содержит следующие этапы:
(1) этап получения соединения (b) путем смешивания соединения (а), бензилирующего агента и основания и перемешивания указанной смеси в растворителе при нагревании с обратным холодильником;
(2) этап получения соединения (с) путем добавления по каплям реактива Гриньяра к соединению (b) в атмосфере инертного газа;
(3) этап получения соединения (d) путем смешивания соединения (с) с окисляющим агентом и перемешивания смеси;
(4) этап получения соединения (е) путем каталитического восстановления соединения (d);
где R означает одну из защитных групп бензилэфирного типа и защитных групп бензилкарбонатного типа, которую удаляют каталитическим восстановлением.
2. Способ по п.1, в котором защитной группой, удаляемой каталитическим восстановлением, является бензильная группа.
3. Способ по п.1, в котором на этапе (1) растворителем является диметилформамид.
4. Способ по п.1, в котором на этапе (2) реактивом Гриньяра является винилмагнийбромид.
5. Способ по п.1, в котором на этапе (3) окисляющим агентом является реагент Джонса, диоксид марганца или ТЕМПО-натрия гипохлорит.
6. Соединение, представляемое формулой (с’):
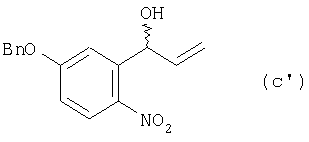
где Bn означает бензильную группу.
7. Соединение, представляемое формулой (d’):
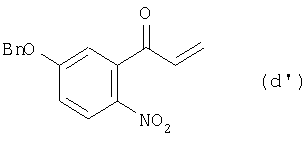
где Bn означает бензильную группу.
8. Способ получения 2′-амино-5′-гидроксипропиофенона для синтеза аналогов камптотецина, в котором из соединения (а):
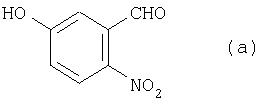
получают соединение (с”):
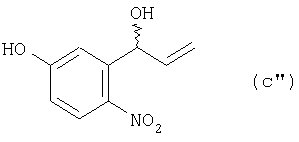
из соединения (с”) получают соединение (d”):
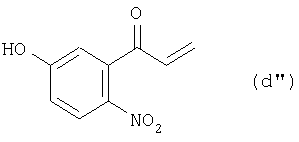
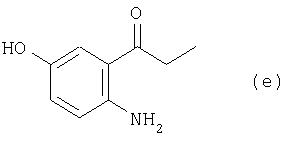
а из соединения (d”) получают соединение (е):
при этом данный способ содержит следующие этапы:
(1) этап получения соединения (с”) путем добавления по каплям реактива Гриньяра к соединению (а) в атмосфере инертного газа;
(2) этап получения соединения (d”) путем смешивания соединения (с”) и окисляющего агента и перемешивания смеси; и
(3) этап получения соединения (е) путем каталитического восстановления соединения (d”).
9. Способ по п.8, в котором на этапе (1) реактивом Гриньяра является винилмагнийбромид.
10. Способ по п.8, где на этапе (2) окисляющим агентом является реагент Джонса, диоксид марганца или ТЕМРО-натрия гипохлорит.
11. Способ получения трициклического кетона для синтеза аналогов камптотецина, в котором из соединения (k):
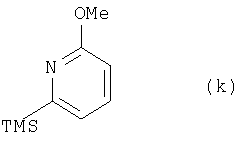
где TMS означает триметилсилильную, a Me – метальную группу, или соединения (v):
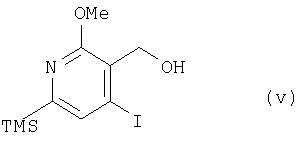
где TMS означает триметилсилильную, a Me – метальную группу, получают соединение (1):
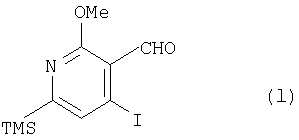
где TMS означает триметилсилильную, a Me – метальную группу, из соединения (1) получают соединение (m):
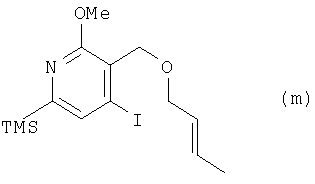
где TMS означает триметилсилильную, a Me – метальную группу, из соединения (m) получают соединение (n):
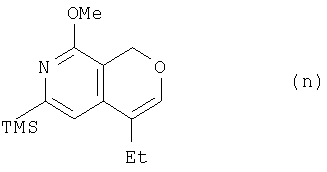
где TMS означает триметилсилильную, Me – метальную, a Et – этильную группу, а из соединения (n) получают соединение (о):
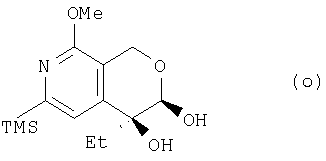
где TMS означает триметилсилильную, Me – метальную, а Et – этильную группу, из соединения (о) получают соединение (р):
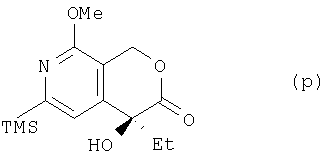
где TMS означает триметилсилильную, Me – метальную, а Et – этильную группу, из соединения (р) получают соединение (q):
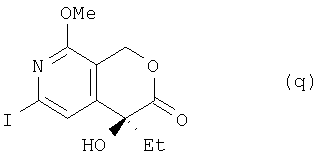
где Me означает метальную, a Et – этильную группу, из соединения (q) получают соединение (r):
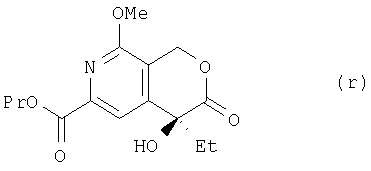
где Me означает метальную, Et – этильную, a Pr – пропильную группу, из соединения (г) получают соединение (s):
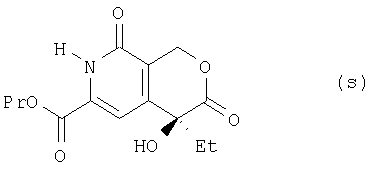
где Et означает этильную, а Pr – пропильную группу, из соединения (s) получают соединение (t):
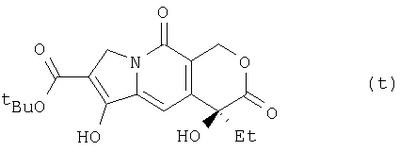
где Et означает этильную, a tBu – третбутильную группу, а из соединения (t) получают соединение (h):
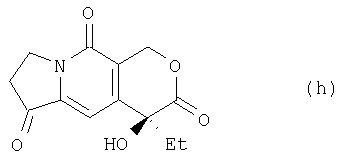
где Et означает этильную группу,
причем данный способ содержит следующие этапы:
(1) этап получения соединения (1) путем смешивания соединения (k), н-бутиллития, формилирующего агента и йодирующего агента, где температура реакции является постоянной и находится в пределах от -30 до -40°С;
(2) этап получения соединения (т) путем смешивания соединения (1), кротилового спирта, триэтилсилана и кислоты и проведения реакции без использования растворителя;
(3) этап получения соединения (1) путем смешивания соединения (v), побочного продукта этапа (2), с окисляющим агентом и основанием;
(4) этап получения соединения (n) путем смешивания соединения (m), палладиевого катализатора, основания и катализатора фазового переноса и нагревания указанной смеси в растворителе с обратным холодильником;
(5) этап получения соединения (о) путем смешивания соединения (n), осмиевого катализатора, соокисляющего агента, основания и асимметричного реагента;
(6) этап получения соединения (р) путем смешивания соединения (о), основания и йода и нагревания указанной смеси с обратным холодильником в жидкой смеси спирта и воды;
(7) этап получения соединения (q) путем смешивания соединения (р) и десилилирующего-йодирующего реагента;
(8) этап получения соединения (r) путем смешивания соединения (q), палладиевого катализатора и основания и проведения реакции в 1-пропаноле в атмосфере газообразного монооксида углерода;
(9) этап получения соединения (s) путем смешивания соединения (r) и деметилирующего реагента и проведения реакции при комнатной температуре;
(10) этап получения Соединения (t) путем введения в реакцию Соединения (s) в присутствии т-бутилакрилата и основания.
12. Способ по п.11, в котором на этапе (3) окисляющим агентом является ТЕМРО-натрия гипохлорит.
13. Способ по п.11, в котором на этапе (4) основанием является карбонат калия или диизопропилэтиламин.
14. Способ по п.11 или 13, в котором на этапе (4) растворителем является тетрагидрофуран или жидкая смесь диизопропиловый эфир – ацетонитрил – вода.
15. Способ по п.11, в котором на этапе (5) осмиевым катализатором является калия осмат (VI).
16. Способ по п.11, в котором на этапе (6) количество йода по отношению к соединению (о) составляет 4 эквивалента.
17. Способ по п.11, в котором на этапе (7) десилилирующим-йодирующим реагентом является йод-трифторацетат серебра или N-хлорсукцинимид-йодид натрия.
18. Способ по п.11 или 17, в котором соединение (q) очищают химически посредством этапов очистки, включающих этап добавления продукта реакции получения соединения (q) из соединения (р) к водному раствору щелочи и перемешивания; этап добавления органического растворителя и перемешивания с последующим удалением органического слоя; этап подкисления водного слоя и экстрагирования органическим растворителем.
19. Способ по п.18, в котором водным раствором щелочи является водный раствор гидроксида натрия.
20. Способ по п.18, в котором органическим растворителем является хлороформ.
21. Способ по п.11 или 17, в котором соединение (q) оптически очищают посредством этапов очистки, включающих этап растворения продукта реакции получения соединения (q) из соединения (р) в высокополярном растворителе с последующим наслаиванием низкополярного растворителя и этап отфильтровывания осадка с последующим концентрирование фильтрата досуха при пониженном давлении.
22. Способ по п.21, в котором высокополярным растворителем является хлороформ.
23. Способ по п.21, в котором низкополярным растворителем является н-гексан.
24. Способ по п.11, где на этапе (10) основанием является карбонат калия.
Приоритет по пунктам:
05.10.2001 – пп.1-4, 6 и 7
21.02.2001 – пп.5, 8-24
|