|
|
(21), (22) Заявка: 2005137323/13, 06.05.2004
(24) Дата начала отсчета срока действия патента:
06.05.2004
(30) Конвенционный приоритет:
01.05.2003 JP 2003-126267
(43) Дата публикации заявки: 10.06.2006
(46) Опубликовано: 27.09.2007
(56) Список документов, цитированных в отчете о
поиске:
JP 08-023808 А, 30.01.1996. JP 63-192379 А, 09.08.1988. JP 2001-269163 А, 02.10.2001. JP 2001-106637 А, 17.04.2001. JP 2000-191545 А, 11.07.2000. JP 11-209301 А, 03.08.1999. JP 08-259602 А, 08.10.1996. JP 2001-321191 А, 20.11.2001. JP 2002-371004 А, 26.12.2002.
(85) Дата перевода заявки PCT на национальную фазу:
01.12.2005
(86) Заявка PCT:
JP 2004/006418 (06.05.2004)
(87) Публикация PCT:
WO 2004/097007 (11.11.2004)
Адрес для переписки:
129010, Москва, ул. Б.Спасская, 25, стр.3, ООО “Юридическая фирма Городисский и Партнеры”, пат.пов. А.В.Миц
|
(72) Автор(ы):
ВАТАНАБЕ Тецуо (JP)
(73) Патентообладатель(и):
МАЙКОЛОДЖИ ТЕКНО. КОРП. (JP)
|
(54) БАЗИДИОМИЦЕТЫ, ЭКСТРАКТ БАЗИДИОМИЦЕТОВ, ДИЕТИЧЕСКИЕ ПРОДУКТЫ, ИММУНОСТИМУЛЯТОРЫ И СЪЕДОБНЫЕ БАЗИДИОМИЦЕТЫ
(57) Реферат:
Базидиомицеты-X FERM BP-10011 представляют собой новую разновидность грибов, обладают высокой антиоксидантной активностью и иммуномоделирующим действием. Предназначены для получения экстракта базидиомицетов с помощью растворителя для экстракции при нагревании или под воздействием давления. Экстракт базидиомицетов в качестве действующего начала применяется для получения диетических продуктов и иммуностимуляторов, которые обладают фармакологической активностью. Масса гиф, образованная при культивировании базидиомицетов, съедобна. Изобретения могут быть использованы, например, при профилактике старения. 5 н. и 1 з.п. ф-лы, 5 ил., 17 табл.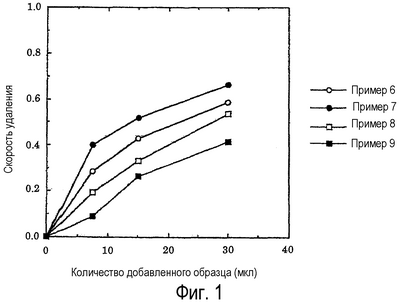
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к базидиомицетам, которые представляют собой новую разновидность грибов (грибы и грибки в дальнейшем совместно называются грибами) и обладают такими свойствами, как иммуномодулирующее действие, а также к композициям экстрактов базидиомицетов, диетическим продуктам и иммуномодуляторам, в которых применяются композиции экстрактов базидиомицетов.
УРОВЕНЬ ТЕХНИКИ
С древних времен грибы находят широкое применение в качестве пищевого сырья, имеющего специфический вкус и запах. Кроме этого, они применялись в Китае в качестве растительного лекарственного средства благодаря их активирующему воздействию на физиологические функции, например для улучшения иммунокомпетентности, противомикробной активности, регулирования биоритмов, предотвращения старения или, как в народной медицине, для лечения определенных типов заболеваний. Исследования фармакологических ингредиентов, имеющих отношение к грибам, находятся в стадии развития, приводя к обнаружению ингредиентов, демонстрирующих антибактериальное или противовирусное действие, кардиотоническое действие, гипогликемическое действие, понижающее действие на уровень холестерина, противотромботическое действие и противогипертоническое действие.
Предлагались композиции, которые применимы в качестве лекарственных средств, диетических продуктов и т.д. и которые содержат смесь сухих продуктов или экстрактов двух или нескольких грибов, выбранных из съедобных грибов из числа базидиомицетов, в особенности Lentinus edodes (Berk.) Sing., Pleurotus ostreatus (Jacq. Ex Fr.) Quel., Pholiota nameko (T. Ito) S. Ito et Imai, Grifola frondosa, Flammulina velutipes (Curt. Ex Fr.) Sing. и Hypsizigus marmoreus (см. Выложенная заявка на патент Японии No. 1999-152230).
В последние годы Agaricum Blazei Murill (далее именуемый грибом agaricus), Phellinius linteus (Berk. Et Curt), Tehg (далее именуемый mesimacobu) и другие разновидности привлекли к себе внимание благодаря наличию противораковых свойств.
Например, было выдвинуто предложение о способе высокопродуктивной культивации грибов рода Phellinus, как, например, mesimacobu (см. Выложенная заявка на патент Японии №.1999-262329), способ культивирования мицелия mesimacobu для получения значительных количеств мицелия mesimacobu (см. Выложенная заявка на патент Японии No. 2001-178448) и способ эффективной экстракции ингредиентов, содержащихся в грибе agaricus, с применением ультразвуковых волн (см. Выложенная заявка на патент Японии No. 2001-278805).
Как описано выше, различным грибам уделяли внимание из-за их противоракового действия и т.д. Однако они не дают требуемого результата, и желательно выявление грибов, обеспечивающих лучший результат.
РАСКРЫТИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Настоящее изобретение было выполнено в свете упомянутых выше обстоятельств.
Цель настоящего изобретения заключается в том, чтобы предоставить базидиомицеты, которые представляют собой новую разновидность грибов, имеющую отличное иммуностимулирующее действие и т.д., композиции экстракта базидиомицетов, диетические продукты и иммуностимуляторы, в которых применяются композиции экстрактов базидиомицетов.
Для достижения указанной выше цели, первый аспект настоящего изобретения относится к базидиомицетам, которые отличаются отсутствием способности образовывать базидии.
Второй аспект настоящего изобретения относится к базидиомицетам по первому аспекту, отличающимся тем, что базидиомицеты представляют собой базидиомицеты-X FERM BP-10011.
Третий аспект настоящего изобретения относится к композиции экстрактов базидиомицетов, отличающихся тем, что экстракты получают из базидиомицетов, у которых отсутствует способность образовывать базидии, причем растворитель для экстракции включает, как минимум, один растворитель, выбранный из воды и гидрофильных растворителей.
Четвертый аспект настоящего изобретения относится к композиции экстракта базидиомицетов по третьему аспекту, отличающихся тем, что базидиомицеты представляют собой базидиомицеты-X FERM BP-10011.
Пятый аспект настоящего изобретения относится к композиции экстракта базидиомицетов по третьему или четвертому аспектам, отличающихся тем, что композиция экстракта базидиомицетов получена путем нагревания и экстракции.
Шестой аспект настоящего изобретения относится к композициям экстракта базидиомицетов по любому из пунктов с третьего по пятый, отличающихся тем, что композиция на основе экстракта базидиомицетов получена путем воздействия высокого давления и экстракции.
Седьмой аспект настоящего изобретения относится к диетическим продуктам, которые отличаются тем, что содержат в качестве действующего начала композиции экстракта базидиомицетов, выделенного из базидиомицетов, у которых отсутствует способность образовывать базидии.
Восьмой аспект настоящего изобретения относится к диетическим продуктам по седьмому аспекту, которые отличаются тем, что базидиомицеты представляют собой базидиомицеты-X FERM BP-10011.
Девятый аспект настоящего изобретения относится к диетическим продуктам по седьмому или восьмому аспектам, которые отличаются тем, что диетические продукты представляют собой продукты в форме, выбранной из формы напитка, формы легкой закуски, формы концентрированного экстракта, порошка, гранул, таблеток и капсул.
Десятый аспект настоящего изобретения относится к иммуностимуляторам, которые отличаются тем, что в качестве действующего начала содержат композицию экстракта базидиомицетов, выделенного из базидиомицетов, не обладающих способностью образовывать базидии.
Одиннадцатый аспект настоящего изобретения относится к иммуностимуляторам по десятому аспекту, которые отличаются тем, что базидиомицеты представляют собой базидиомицеты-X FERM BP-10011.
Двенадцатый аспект настоящего изобретения относится к съедобным базидиомицетам, содержащим массу гиф, образованную культивированием базидиомицетов по первому или второму аспекту.
Описанные выше базидиомицеты-X по настоящему изобретению содержат большие количества полисахаридов ( -D-глюкана) и обладают высокой антиоксидантной активностью, активностью в отношении удаления радикалов OH, а также иммуномодулирующим действием. Данные организмы являются предпочтительными при применении в диетических продуктах и иммуностимуляторах, от которых можно ожидать проявления фармакологической эффективности, как, например, профилактики старения. -D-глюкана) и обладают высокой антиоксидантной активностью, активностью в отношении удаления радикалов OH, а также иммуномодулирующим действием. Данные организмы являются предпочтительными при применении в диетических продуктах и иммуностимуляторах, от которых можно ожидать проявления фармакологической эффективности, как, например, профилактики старения.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг.1 представляет собой отображение результатов измерений в тестовом примере 1.
Фиг.2 представляет собой отображение результатов измерений в тестовом примере 2.
Фиг.3 представляет собой отображение результатов измерений в тестовом примере 3.
Фиг.4 представляет собой схему, показывающую способ введения препаратов в тестовом примере 4.
Фиг.5 представляет собой отображение результатов измерений в тестовом примере 4.
НАИЛУЧШИЙ СПОСОБ ОСУЩЕСТВЛЕНИЯ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Базидиомицеты, к которым относится настоящее изобретение, представляют собой такие базидиомицеты, которые не обладают способностью образовывать базидии, хотя наблюдаются клювовидные отростки (пряжки). В этом отношении данные базидиомицеты отличаются от других базидиомицетов. Т.е. даже при культивировании базидиомицеты не образуют базидии и образуют только склероции (массы гиф).
Такие базидиомицеты были получены в результате поиска микроорганизмов в природе. Они были выделены и помещены в Международный Патентный Депозитарий Микроорганизмов Национального Института Передовой Промышленной Науки и Технологии как базидиомицеты-X (инвентарный номер FERM BP-10011).
Микроорганизмы по настоящему изобретению не образуют конидии, т.е. не обладают способностью к бесполому размножению.
Т.е. если данные микроорганизмы культивируют на среде картофель-глюкоза-агар, культивированные гифы имеют пряжки и являются гладкими, но не образуют конидии и не образуют плодовые тела. При наблюдении за формой и цветом поверхности колонии выясняется, что в колонии образуется светло-розовая масса гиф. Если в колонии, которая росла концентрично от места инокуляции (посева), сформировано множество масс гиф, эти массы соединены мицеллиальными нитями. Цвет обратной стороны колонии – светло-розовый.
Если эти микроорганизмы культивируют на среде глюкоза-сухие дрожжи-агар, культивированные гифы имеют пряжки и являются гладкими, но не образуют конидии и не образуют плодовые тела. При наблюдении за формой и цветом поверхности колонии можно заметить, что в колонии формируются массы гиф от светло-розового до белого. Если местом инокуляции является центр, образуются массы гиф толщиной от 5 до 6 мм. Цвет обратной стороны колонии – от светло-розового до белого.
Оптимальными условиями роста микроорганизмов по настоящему изобретению являются, например, pH от 5,0 до 6,0 и температура от 22 до 26°C. Диапазон, в котором происходит рост, например, pH от 4,0 до 7,5 и температура от 5 до 30°C.
Базидиомицеты, т.е. микроорганизмы по настоящему изобретению, могут быть культивированы обычным способом, и способ их культивирования не ограничен.
Композиция экстракта базидиомицетов по настоящему изобретению может представлять собой любое содержимое клеток, экстрагированное из массы гиф, которые получены культивированием базидиомицетов, причем способ экстракции не ограничен. Для экстракции содержимого клеток из массы гиф с высокой эффективностью предпочтительно повреждать стенки клеток, например, путем замораживания массы гиф, если это желательно, оттаивать замороженную массу и затем измельчать ее при помощи миксера или подобного прибора с последующей экстракцией. Способ экстракции не ограничен, но экстракцию осуществляют при комнатной температуре либо при нагревании, либо под давлением с применением воды или низших спиртов или подобных растворителей, или растворителя для экстракции, дополнительно включающего кислоту, щелочь или другую добавку. Как правило, с целью экстракции продукт с разрушенными стенками клеток варят в горячей воде, или же продукт, смешанный с водой или спиртом, или с водой, содержащей щелочь, экстрагируют под давлением, например, порядка от 100 до 700 МПа, предпочтительно от 300 до 600 МПа.
Ниже приведено описание примера экстракции в горячей воде. Например, замороженные массы гиф базидиомицетов-X оттаивают при комнатной температуре и измельчают с помощью миксера. Соотношение разрушенной массы гиф базидиомицетов-X к воде, взятой в качестве растворителя для экстракции, установлено, например, 1:5. Например, 50 граммов разрушенной массы гиф базидиомицетов-X помещают в стеклянную бутыль, добавляют 250 мл воды и стеклянную бутыль закрывают крышкой. На дно поддона помещают полотенце, наливают воду выше уровня полотенца и на полотенце помещают стеклянную бутыль, заполненную измельченной массой гиф, после чего осуществляют нагревание и кипячение. После закипания нагревание продолжают в течение 90 минут. После охлаждения для получения экстракта базидиомицетов-X разделяют твердые и жидкие компоненты. Значения pH экстракта составляют, например, от 6,3 до 6,5.
Для получения композиции на основе экстракта базидиомицетов образовавшийся экстракт, в случае необходимости, концентрируют. Процесс концентрации экстракта не ограничен, но концентрация осуществляется, например, следующим способом:
Полученный экстракт базидиомицетов-X переносят в химический стакан и подвергают нагреванию и выпариванию с целью концентрации. В это время экстракт приобретает цвет от бежевого до коричневого и начинает энергично пузыриться. Однако выпаривание и концентрацию продолжают далее, причем процесс концентрации завершают, например, в тот момент, когда концентрированный экстракт становится похожим на деготь при pH 4,9 и плотности 1,25 г/см3. Концентрированный экстракт издает запах, напоминающий запах соевого соуса. Выход концентрированного экстракта из массы гиф базидиомицетов-X в этот момент времени составляет в среднем 12%.
Полученный подобным способом концентрированный экстракт становится очень вязким при охлаждении. Следовательно, концентрированный экстракт следует перенести в емкость для хранения сразу же после завершения процесса концентрации. Перенесенный в емкость для хранения концентрированный экстракт предпочтительно охлаждают, как он есть, и затем сохраняют в охлажденном или замороженном состоянии.
Композиция экстракта базидиомицетов по настоящему изобретению может быть применена в диетических продуктах питания или лекарственных средствах, таких как иммуностимуляторы, в форме, например, напитков, легких закусок, концентрированных экстрактов, порошков, гранул, таблеток или капсул. Количество добавленной композиции на основе экстракта базидиомицетов не ограничено и может быть установлено по обстоятельствам, в зависимости от применения.
Кроме того, массы гиф, полученных культивированием базидиомицетов, которые являются микроорганизмами по настоящему изобретению, могут применяться для пищевых целей, причем они обладают отличным вкусом и органолептическим восприятием.
При культивировании базидиомицетов по настоящему изобретению образуется масса гиф, соответствующая окружающей среде, в которой производится культивирование. Т.е. когда базидиомицеты культивируют в сосуде предварительно определенной формы, получают массу гиф в форме этого сосуда. Таким способом получают съедобные базидиомицеты, удобные для применения в пищевых целях. Полученные съедобные базидиомицеты могут применяться в качестве пищевого продукта сырыми или их можно применять в качестве пищевого продукта в замороженном или высушенном виде, но предпочтительно применять в виде сырого или замороженного вещества.
Что касается способа культивирования, базидиомицеты можно культивировать, как констатировалось выше, любым обычным способом, причем способ культивирования не ограничен. Например, среду агара, среду опилок или жидкую среду, которую дополняют подходящим источником питательных веществ и стерилизуют, асептически инокулируют культивируемым штаммом микроорганизмов по настоящему изобретению или посеянный микроорганизм и инокулят культивируют при подходящих температурных условиях, в результате чего может быть получена масса гиф базидиомицетов-X.
Способ приготовления съедобных базидиомицетов, применяемых в качестве продукта питания, не ограничен. Тем не менее, съедобные базидиомицеты без всяких ограничений могут быть приготовлены самыми разными способами, которые аналогичны способам приготовления обычных грибов, такими как варка, жарение на сковородке, жарение на огне, жарение во фритюре. Поскольку съедобные базидиомицеты дают отличные органолептические ощущения и не имеют характерного вкуса, их можно широко применять при приготовлении различных блюд.
Нет необходимости говорить, что употребление в пищу съедобных базидиомицетов предполагает получение того же самого результата, что и в случае употребления в пищу композиций экстракта базидиомицетов.
ПРИМЕРЫ
Далее настоящее изобретение будет описано более конкретно со ссылкой на предложенные ниже примеры. Примеры 1-4 представляют собой примеры культивирования базидиомицетов-X и примеры 5-9 представляют собой примеры экстракции.
(Пример 1) Отделение от массы гиф
(1) Получение культуральной среды
Культуральные среды PSA и PDA получают в соответствии с рецептурами, показанными в таблице 1. Каждую из культуральных сред распределяют по пробиркам или колбам Эрленмейера. Затем накладывают силиконовые колпачки или ватные пробки и закрытые емкости подвергают стерилизации паром при высоком давлении в автоклаве в течение 20 минут при 121°C. Затем, пока пробирки остаются горячими после стерилизации, их наклоняют для формирования скошенной питательной среды. С другой стороны, колбы Эрленмейера оставляют для формирования плоской питательной среды.
| Таблица 1 |
| Культуральная среда PSA |
Культуральная среда PDA |
| Экстракт из 200 г картофеля, который кипел в течение 20 минут |
Экстракт из 200 г картофеля, который кипел в течение 20 минут |
| 20 г сахарозы |
20 г глюкозы |
| 15 г агара |
15 г агара |
| Общее количество 1 литр |
Общее количество 1 литр |
(2) Отделение от массы гиф
Более крупные массы гиф базидиомицетов-X разделяют на части вручную и от полученных частей базидиомицетов-X отрезают срезы с помощью скальпеля, который стерилизован на огне и затем охлажден. Каждую их скошенных питательных сред PDA и PSA по п. (1) инокулируют срезами базидиомицетов-X, применяя щипчики, которые предварительно стерилизованы и охлаждены. Данную процедуру осуществляют в асептических условиях, в асептическом боксе или на чистом лабораторном столе.
(3) Культивирование
Инокуляты культивируют в инкубаторе при 24°C и оставляют для генерирования микроорганизмов на 24-48 часов. После образования микроорганизмов, культуру оставляют при 24°C. Гифы вырастают на питательной агаровой среде в течение 14 дней.
(Пример 2) Культивирование на среде опилок для получения массы гиф.
(1) Культивирование посевного материала микроорганизмов.
К 1 л опилок добавляют воду, 15 г обезжиренных отрубей, 15 г пшеничных отрубей и 5 г SUNPEARL (активатор гиф, Nippon Paper Industries), после чего смесь энергично перемешивают. Состав смеси для культивирования подбирают таким образом, чтобы при сильном нажатии выступала вода (содержание влаги в смеси около 70%), и в результате получают среду на основе опилок. Эту культуральную среду помещают в колбу Эрленмейера, которую закрывают силиконовой крышкой. Затем колбу Эрленмейера подвергают стерилизации паром высокого давления в автоклаве в течение 40 минут при 121°C. Через 24 часа после стерилизации, гифы базидиомицетов-X, культивированные на скошенной питательной среде примера 1, инокулируют в питательную среду на основе опилок в асептическом боксе с помощью асептической процедуры. Инокуляцию выполняют таким образом, чтобы не вызвать повреждения гиф, с помощью стерилизованного треугольного ножа, который используют для отделения части скошенной питательной среды. Плотность засева составляет от 20 до 30% площади поверхности питательной среды на основе опилок. Если инокулят культивируют при 24°C, микроорганизмы генерируются в течение 3 дней (последние – в течение 5 дней). По истечении периода времени 30 дней питательная среда на основе опилок в колбе Эрленмейера наполняется микроорганизмами.
(2) Генерация массы гиф
Питательную среду на основе опилок получают аналогично (1). Эту культуральную среду помещают в полипропиленовую бутыль, бутыль закрывают и подвергают стерилизации паром высокого давления в автоклаве в течение 40 минут при 121°C. Через 24 часа после стерилизации посевной материал микроорганизмов, культивированных согласно (1), инокулируют в питательную среду в полипропиленовой бутыли с помощью асептической процедуры в асептическом боксе, подвергнутом асептической обработке. Плотность засева такова, что площадь поверхности питательной среды на основе опилок почти полностью покрыта инокулятом. Если инокулят культивируют при 24°C, микроорганизмы генерируются в течение 48 часов. По истечении периода времени 60 дней внутреннее пространство питательной среды на основе опилок в полипропиленовой бутыли заполняется гифами. Еще через 40-50 дней гифы распространяются на внутреннюю стенку полипропиленовой бутыли, образуя мицелиальные нити. Если культивирование продолжают далее, образуются массы гиф.
(Пример 3) Культивирование на жидкой питательной среде для получения массы гиф.
Картофель (200 г), разрезанный на квадратные куски размером 1 сантиметр, заливают очищенной водой, доводят до кипения и затем нагревают в течение 20 минут. После охлаждения разделяют твердые и жидкие составляющие, к образовавшемуся картофельному отвару добавляют 20 г сахарозы и дистиллированную воду до общего объема 1 литр, тем самым, получая жидкую питательную среду. Эту жидкую питательную среду разливают в пробирки в количестве 5 мл в каждую. Пробирки закрывают силиконовыми колпачками и стерилизуют (стерилизация паром высокого давления в течение 20 минут при или стерилизация паром при атмосферном давлении в течение 8 часов при 100°C). Затем жидкую питательную среду инокулируют с помощью асептической процедуры в асептическом боксе после асептической обработки, таким образом, чтобы нижние концы срезов скошенных культур базидиомицетов-X примера 1 соприкасались с жидкой средой. Если инокулят культивируют при 24°C, микроорганизмы генерируются в течение 48 часов. При дальнейшем культивировании в месте соприкосновения с жидкой питательной средой образуются массы гиф.
(Пример 4) Культивирование на питательной агаровой среде для получения массы гиф.
Картофель (200 г), разрезанный на квадратные куски размером 1 сантиметр, заливают очищенной водой, доводят до кипения и затем нагревают в течение 20 минут. После охлаждения разделяют твердые и жидкие компоненты, к образовавшемуся картофельному отвару добавляют 20 г сахарозы, 1 г (0,1%) агара и дистиллированную воду до общего объема 1 литр, получая, тем самым, питательную агаровую среду. Как правило, для приготовления агаровой среды добавляют от 1,5 до 2% агара (от 15 до 20 г на 1 литр общего объема питательной среды), но в данном случае добавляют 0,1% агара для облегчения отделения массы гиф от агаровой среды после культивирования, а также для поддержания стабильности жидкой среды, т.к. срезы базидиомицетов-X имеют склонность оседать в жидкой питательной среде. Полученную 0,1% агаровую среду разливают в пробирки, в количестве 5 мл в каждую. Пробирки закрывают силиконовыми колпачками и затем подвергают стерилизации паром высокого давления в течение 20 минут при 121°C. Затем отделяют срезы от масс базидиомицетов-X, полученных при культивировании на скошенной питательной среде в примере 1, и инокулируют в 0,1% агаровую среду, при помощи асептической процедуры в асептическом боксе после асептической обработки. Если инокулят культивируют при 24°C, микроорганизмы образуются в течение 48 часов. При дальнейшем культивировании образуются массы гиф.
(Пример 5) Получение концентрированной композиции на основе экстракта базидиомицетов-X при отваривании.
Для повреждения стенок клеток гифы и облегчения вываривания содержимого клеток свежую массу гиф базидиомицетов-X охлаждают или замораживают. Замороженные массы гиф базидиомицетов-X оттаивают при комнатной температуре и измельчают с применением миксера. Измельченную массу гиф базидиомицетов-X (50 г) помещают в стеклянную бутыль, добавляют 250 мл воды и закрывают бутыль крышкой. На дно поддона помещают полотенце, наливают воду так, чтобы она покрывала полотенце и на полотенце помещают стеклянную бутыль, заполненную измельченной массой гиф, после чего осуществляют нагревание и кипячение. После закипания нагревание продолжают в течение 90 минут. После охлаждения разделяют твердые и жидкие компоненты для получения композиции на основе экстракта базидиомицетов-X. pH экстракта находится в диапазоне от 6,3 до 6,5.
Полученную композицию на основе экстракта базидиомицетов-X переносят в химический стакан и концентрируют при нагревании и выпаривании. Композиция на основе экстракта приобретает цвет от светло-бежевого до коричневого и начинает энергично пузыриться. Однако нагревание и концентрацию продолжают дальше, причем процесс завершают в тот момент, когда концентрированная композиция на основе экстракта становится похожей на деготь при pH 4,9 и плотности 1,25 г/см3. Концентрированная композиция на основе экстракта базидиомицетов-X издает запах, напоминающий соевый соус. В этот момент времени выход концентрированной композиции на основе экстракта базидиомицетов-X из массы гиф базидиомицетов-X составляет в среднем 12%. Композиция на основе экстракта базидиомицетов-X становится очень вязкой при охлаждении. Следовательно, одновременно с завершением процесса концентрации концентрат переносят в емкость для хранения и, после охлаждения, сохраняют, как он есть в охлажденном или замороженном состоянии.
(Пример 6) Получение композиции экстракта базидиомицетов-X при отваривании.
Для повреждения стенок клеток гифы и облегчения вываривания содержимого клеток свежую массу гиф базидиомицетов-X охлаждают или замораживают. Затем замороженные массы гиф базидиомицетов-X оттаивают при комнатной температуре.
Массу гиф базидиомицетов-X (вес во влажном состоянии 20 г) после оттаивания взвешивают, режут на квадраты 0,5 см и помещают в химический стакан. После добавления воды содержимое стакана осторожно варят при 90°C, после чего раствор упаривают до половины исходного объема. Затем добавляют воду до восстановления исходного объема. Раствор фильтруют через марлю для удаления твердых компонентов. После этого фильтрат закрывают и хранят в холодильнике для применения в качестве композиции экстракта базидиомицетов-X из примера 6.
(Пример 7) Получение композиции экстракта базидиомицетов-X при обработке высоким давлением.
Массу гиф базидиомицетов-X (вес во влажном состоянии 20 г), обработанную по способу примера 6, помещают в виниловый пакет и добавляют 100 мл воды. Затем из винилового пакета удаляют воздух при пониженном давлении и пакет закрывают. Пакет помещают в аппарат для создания сверхвысокого давления (производства Kobe Steel; способен развивать давление до 700 МПа) и выдерживают в течение 10 минут под гидростатическим давлением 400 МПа. Обработанную смесь фильтруют через марлю и фильтрат хранят в охлажденном состоянии для применения в качестве композиции экстракта базидиомицетов-X из примера 7.
(Пример 8) Получение композиции экстракта базидиомицетов-X при обработке высоким давлением.
Композицию, полученную способом, аналогичным способу примера 7, за исключением того, что гидростатическое давление составляет 600 МПа, помещают на хранение для применения в качестве композиции экстракта базидиомицетов-X из примера 8.
(Пример 9) Получение композиции экстракта базидиомицетов-X при обработке высоким давлением.
Композицию, полученную способом, аналогичным способу примера 8, за исключением того, что вместо 100 мл воды применяют 100 мл 0,1% водного раствора KCl, помещают на хранение для применения в качестве композиции экстракта базидиомицетов-X из примера 9.
(Тестовый пример 1) Измерение активности в отношении удаления активного кислорода (гидроксильных радикалов).
Активность в отношении удаления гидроксильных радикалов измеряют способом ESR (электронного спинового резонанса), применяя H2O2/UV (ультрафиолетовое излучение) в качестве источника, генерирующего гидроксильные радикалы, и диметилпирролин-N-оксид (DMPO) в качестве спиновой ловушки.
К постоянному количеству композиции на основе экстракта базидиомицетов-X из примеров 6-9 добавляют DMPO (40 мМ), 20 мМ пероксида водорода и затем добавляют воду до общего количества 300 мкл. Смесь облучают UV (ширина полосы 20 нм) с длиной волны 245 нм и наблюдают продукт присоединения гидроксильного радикала к DMPO с помощью сигнала ESR. На основании изменения интенсивности сигналов определяют активность композиции на основе экстракта в отношении удаления гидроксильных радикалов. Результаты представлены на фиг.1.
Как показано на фиг.1, чем больше количество композиции экстракта базидиомицетов-X, тем выше становится скорость удаления гидроксильных радикалов. Композиция из примера 7, полученная путем экстракции при обработке высоким давлением 400 МПа в водном растворителе, приводит к получению наиболее высокой скорости удаления гидроксильных радикалов.
(Тестовый пример 2) Измерение активности в отношении удаления активного кислорода (пероксидных анион-радикалов).
Активность в отношении удаления пероксидных анион-радикалов измеряют способом ESR (электронного спинового резонанса) в соответствии с методикой спиновой ловушки, применяя окислительную систему ксантин-ксантин в качестве системы, генерирующей пероксидные анион-радикалы, и DMPO в качестве спиновой ловушки.
К постоянному количеству композиции на основе экстракта базидиомицетов-X из примеров 6-9 добавляют DMPO (0,3 мМ), 0,5 мМ гипоксантина и 1 мМ диэтилентриаминпентауксусной кислоты (DTPA), после чего добавляют 0,2М PBS до общего количества 300 мкл. Добавляют ксантиноксидазу в концентрации 0,1 ед./мл и наблюдают образование DMPO-OOH (продукта присоединения пероксидного анион-радикала к DMPO) с помощью сигнала ESR. На основании изменения интенсивности сигналов определяют активность композиции на основе экстракта в отношении удаления пероксидных анион-радикалов. Результаты представлены на фиг.2.
Как показано на фиг.2, чем больше количество композиции экстракта, тем выше становится скорость удаления пероксидных анион-радикалов. Композиция из примера 7, полученная путем экстракции при обработке высоким давлением 400 МПа в водном растворителе, приводит к получению наиболее высокой скорости удаления пероксидных анион-радикалов. Эти результаты аналогичны результатам тестового примера 1.
(Тестовый пример 3) Измерение активности в отношении удаления активного кислорода (гидроксильных радикалов).
Активность в отношении удаления гидроксильных радикалов измеряют способом ESR спиновой ловушки, применяя реакцию Фентона в качестве источника гидроксильных радикалов и DMPO в качестве спиновой ловушки.
К постоянному количеству (10 или 20 мкл) каждого из экстрактов, полученных путем вываривания и экстракции сушеных грибов agaricus (продукт Truffle Japan) способом примера 6, вываривания и экстракции сушеных грибов reishi (Ganoderma lucidum (Leyss.ex Fr) Karst.; продукт Truffle Japan) способом примера 6, а также композиций на основе экстракта базидиомицетов-X по каждому из примеров 6-9 добавляют диметилпирролин-N-оксид (DMPO) (20 мМ), 10 мМ пероксида водорода и 0,1 мМ FeSO4. Затем добавляют очищенную воду до общего количества 300 мкл и полученную смесь используют в качестве образца для анализа. Активность препаратов в отношении удаления гидроксильных радикалов определяют на основании изменения интенсивности сигнала DMPO-OH (продукта присоединения гидроксильного радикала к DMPO) через минуту после добавления FeSO4. Результаты представлены на фиг.3.
Как видно из фиг.3, в случае композиции примера 6, которая получена экстракцией путем вываривания, тщательные измерения активности в отношении удаления гидроксильных радикалов не приводят к успеху, т.к. экстракт примера 6 при низкой концентрации взаимодействует с ионами железа, как и экстракт из грибов reishi, что, скорее, вызывает усиление сигналов DMPO-OH, а не их исчезновение. В случае использования экстракта из примера 6 при высокой концентрации, он оказывает минимальное влияние на сигналы и показывает активность в отношении удаления гидроксильных радикалов, сравнимую с активностью экстракта agaricus. Экстракты из примеров 7-9, полученные экстракцией при действии высокого давления, демонстрируют более высокую активность, чем экстракты грибов agaricus и reishi.
(Тестовый пример 4) Измерение иммуномодулирующего воздействия.
Используют мышей C3H/HeJ от CLEA Japan. В преклонном возрасте мыши C3H/HeJ демонстрируют ухудшение иммунитета. В настоящем исследовании в качестве пожилых мышей используют «пенсионеров» (в возрасте от 20 до 30 недель). В качестве базидиомицетов-X применяют концентрированную композицию экстракта базидиомицетов-X из примера 5. Данный анализ был выполнен в сотрудничестве с профессором Akira Yanagava, Applied Pharmacology Lab., 3-rd Dept., Institute of Medical Science, St. Marianna Univ. School of Medicine.
Пожилых мышей разделяют на группы по 10 особей и выделяют группу для обработки базидиомицетами-X, которой вводят концентрированную композицию экстракта базидиомицетов-X в количестве 0,2 мл один раз в день, в то время как контрольная группа один раз в день получает физиологический раствор в количестве 0,2 мл. Базидиомицеты-X или физиологический раствор вводят перорально, с помощью желудочной трубки в течение 14 следующих друг за другом дней.
Через 10 дней после начала введения препаратов, мышам интраперитонеально вводят 0,1 мл 10% овечьих красных кровяных телец (SRBC), разбавленных фосфатным буферным физиологическим раствором (PBS) (т.е. итоговое количество телец 2×108). По истечении 4,5 дней отделяют клетки селезенки мышей и подсчитывают число бляшкообразующих клеток (PFC) с помощью методики Jerne. Количество PFC сравнивают с контрольной группой. Результаты подсчета количества PFC в контрольной группе показаны в таблице 2, и результаты подсчета количества PFC в группе, которой вводили базидиомицеты-X, показаны в таблице 3. Схематическое изображение режимов введения базидиомицетов-X или физиологического раствора и SRBC приведено на фиг.4. Результаты анализа показаны на фиг.5.
| Таблица 2 |
| № |
Количество клеток в клеточной суспензии (×106 клеток/мл) |
Высеяно клеточной суспензии в чашку Петри (мл) |
PFC (/чашку Петри)* |
PFC (/106 клеток) |
| Индивидуальные значения |
Среднее |
Стандартное отклонение |
| 1 |
31 |
0,2 |
0 |
0 |
|
|
| 2 |
51,25 |
0,03 |
10,33 |
6,72 |
|
|
| 3 |
59,75 |
0,03 |
198,98 |
110,98 |
|
|
| 4 |
53,65 |
0,03 |
150,68 |
93,59 |
|
|
| 5 |
76,15 |
0,03 |
162,54 |
71,13 |
|
|
| |
|
|
|
|
75,399 |
62,98075 |
| 6 |
42 |
0,2 |
0 |
0 |
|
|
| 7 |
62,65 |
0,03 |
148,76 |
79,13 |
|
|
| 8 |
26,25 |
0,03 |
126,36 |
160,36 |
|
|
| 9 |
38,25 |
0,03 |
203,42 |
177,12 |
|
|
| 10 |
63,45 |
0,03 |
104,64 |
54,96 |
|
|
| *PFC/чашку Петри – (клеточная суспензия, высеянная в чашку Петри × количество клеток в клеточной суспензии) = индивидуальное количество PFC. |
| Таблица 3 |
| № |
Количество клеток в клеточной суспензии (×106 клеток/мл) |
Высеяно клеточной суспензии в чашку Петри (мл) |
PFC (/чашку Петри) |
PFC (/106 клеток) |
| Индивидуальные значения |
Среднее |
Стандартное отклонение |
| 1 |
20 |
0,03 |
263,33 |
438,88 |
|
|
| 2 |
30,75 |
0,2 |
8078,4 |
1077,12 |
|
|
| 3 |
55,25 |
0,2 |
4125,6 |
373,36 |
|
|
| 4 |
41,5 |
0,03 |
483 |
387,95 |
|
|
| 5 |
32 |
0,03 |
565,33 |
588,89 |
|
|
| |
|
|
|
|
1345,9 |
1495,324 |
| 6 |
43,5 |
0,03 |
826,34 |
633,21 |
|
|
| 7 |
62 |
0,2 |
6236,42 |
502,9 |
|
|
| 8 |
53,45 |
0,03 |
7326,6 |
4567,77 |
|
|
| 9 |
36,5 |
0,2 |
9236,6 |
1265,53 |
|
|
| 10 |
79,75 |
0,03 |
8672 |
3626,39 |
|
|
Как видно из таблиц 2 и 3, группа, которую подвергают действию базидиомицетов-X, демонстрирует значение PFC 1345,9 и значение стандартного отклонения 1495,324, причем эти значения приблизительно в 20 раз больше, чем у контрольной группы, которая показывает среднее значение PFC, равное 75,399 при величине среднего отклонения 62,98075. Двухсторонний тест, соответствующий равному распределению в Т-тесте Стьюдента, показывает, что базидиомицеты-X значительно увеличивают количество PFC при P=0,023363 (p<0,05).
Эксперименты по настоящему исследованию демонстрируют, что концентрированная композиция на основе экстрактов базидиомицетов-X значительно увеличивает количество PFC в контрольной группе по сравнению с физиологическим раствором. Экспериментальная методика, основанная на подсчете PFC с использованием мышей C3H/HeJ, представляет собой способ, обычно применяемый в качестве стандартного способа скрининга при испытании потенциальных возможностей иммуномодуляторов. Увеличение количества PFC у мышей пожилого возраста показывает, что концентрированная композиция экстракта базидиомицетов улучшает нарушенную иммунокомпетентность.
(Тестовый пример 5) Изменение параметров иммунокомпетентности у больных раком
Изменение параметров иммунокомпетентности у раковых больных (случай 1-случай 6) наблюдают в ходе воздействия концентрированной композиции экстракта базидиомицетов-X из примера 5 с целью исследования иммуностимулирующего действия концентрированной композиции экстракта базидиомицетов-X. Данное исследование было выполнено в сотрудничестве с адъюнкт-профессором Akira Yanagava, Applied Pharmacology Lab., 3-rd Dept., Institute of Medical Science, St. Marianna Univ. School of Medicine.
Конкретно, 1 мл очищенной воды добавляют к 1 мл концентрированной композиции на основе экстракта базидиомицетов-X и полученную смесь вводят перорально 3 раза в день после каждого приема пищи. Введение препарата продолжают в течение 3 недель.
Для выявления параметров иммунокомпетентности авторы попросили BML (BML, Inc.) измерить ряд показателей перед введением композиции и после введения в режиме слепого тестирования. Результаты показаны в таблицах 4-15. Все шесть пациентов различались по первичному поражению раком. Поскольку для этих шести пациентов не имеет смысла рассчитывать средние значения, приведены численные значения параметров для отдельных пациентов.
В качестве показателя для клеток NK (Natural Killer):
Два цвета (как оценка активности клеток NK)
CD57+CD16+(%) умеренная NK-активность
CD57+CD16-(%) слабая NK-активность
CD57-CD16+(%) сильная NK-активность
CD57-CD16-(%)
В качестве показателя общего количества активированных клеток NK:
CD3+HLA-DR+(%) активированные клетки CD3
Кроме того, измеряют количество лейкоцитов, лимфоциты (%) и количество лимфоцитов в определении лейкоцитарной формулы. Дополнительно пациентов просили совместно заносить в дневники изменения в симптоматике по ходу введения препаратов.
(Случай 1) В июле 2000 года была выполнена полная сигмоидэктомия по причине рака сигмовидной ободочной кишки. В 2002 году в ходе операции по поводу рубцовой пристеночной грыжи было подтверждено наличие рецидива карциномы. Затем часто наблюдалась непроходимость кишечника.
| Таблица 4 |
| Система NK-клеток |
| Два цвета (оценка активности NK-клеток) |
| |
До введения препарата (количество лимфоцитов: LC) |
После введения препаратов (LC) |
| CD57+CD16+(%) Умеренная NK-активность |
6,6% (149) |
8,0% (250) |
| CD57+CD16-(%) Слабая NK-активность |
17,6% (396) |
17,6% (549) |
| CD57-CD16+(%) Сильная NK-активность |
4,6% (104) |
4,1% (128) |
| CD57-CD16-(%) |
71,2% |
70,3% |
| Таблица 5 |
| В качестве показателя общего количества активированных NK-клеток |
| |
До введения препарата (количество лимфоцитов: LC) |
После введения препаратов (LC) |
| CD3+HLA-DR+(%) |
9,9% (223) |
10,6% (331) |
| Активированные клетки CD3 |
В случае 1 лимфоциты, имеющие умеренную и слабую NK-клеточную активность, заметно возрастают по сравнению с уровнями, наблюдавшимися до введения препарата. Клетки CD57-CD16+, обладающие сильной NK-активностью, после введения препарата демонстрируют значение 4,1%, что, по-видимому, указывает на уменьшение значения в %. Однако действительное количество лимфоцитов возрастает со 104 до 128. Что касается клеток CD3+HLA-DR+, которые являются объектом, позволяющим анализировать всю совокупность параметров клеток NK, то значение после введения препарата составляет 10,6% (331), демонстрируя рост по отношению к значению до введения 9,9% (223).
(Случай 2) Полное удаление рака левой груди было осуществлено в октябре 1999 г. Затем имел место рецидив карциномы и в настоящее время опухоль метастазировала в легкие, кости, мозг и мозговую оболочку. Даже после радиационной терапии с целью менингеальной диссеминации, паралич черепных нервов привел к тому, что пациентка остается прикованной к постели. Метастазы в спинном мозге также вызывали прогрессирующий паралич правой верхней конечности. Общее состояние для конечной стадии рака является тяжелым.
| Таблица 6 |
| Система NK-клеток |
| Два цвета (оценка активности NK-клеток) |
| |
До введения препарата
(количество лимфоцитов: LC) |
После введения препаратов (LC) |
| CD57+CD16+(%) Умеренная NK-активность |
12,6% (136) |
9,4% (111) |
| CD57+CD16-(%) Слабая NK-активность |
5,76% (62) |
6,8% (80) |
| CD57-CD16+(%) Сильная NK-активность |
9,4% (102) |
7,0% (83) |
| CD57-CD16-(%) |
72,3% |
76,8% |
| Таблица 7 |
| Система NK-клеток |
| Два цвета (оценка активности NK-клеток) |
| |
До введения препарата (количество лимфоцитов: LC) |
После введения препаратов (LC) |
| CD3+HLA-DR+(%) |
5,7% (62) |
3,6% (43) |
| Активированные клетки CD3 |
В случае 2 воздействие концентрированной композиции экстракта базидиомицетов-X на NK-клетки не наблюдается.
(Случай 3) В августе 2001 года вынужденное удаление слизистой цистаденокарциномы и двухсторонней метастатической опухоли яичников. Затем карциноматозная перитонеальная диссеминация и карциноматозное воспаление, которое привело к значительным асцитическим скоплениям. В настоящее время пациентка прикована к постели из-за конечной стадии рака.
| Таблица 8 |
| Система NK-клеток |
| Два цвета (оценка активности NK-клеток) |
| |
До введения препарата (количество лимфоцитов: LC) |
После введения препаратов (LC) |
| CD57+CD16+(%) Умеренная NK-активность |
5,5% |
5,8% |
| CD57+CD16-(%) Слабая NK-активность |
21,8% |
16,0% |
| CD57-CD16+(%) Сильная NK-активность |
7,7% |
6,8% |
| CD57-CD16-(%) |
65,0% |
71,4% |
| Таблица 9 |
| В качестве показателя общего количества активированных NK-клеток |
| |
До введения препарата (количество лимфоцитов: LC) |
После введения препаратов (LC) |
| CD3+HLA-DR+(%) |
15,5% |
13,1% |
| Активированные клетки CD3 |
В случае 3 наблюдается небольшое увеличение количества лимфоцитов CD57+CD16+, обладающих умеренной NK-активностью.
(Случай 4) В 2001 году по случаю легочной карциномы были проведены химиотерапия и радиотерапия (Карцинома чешуйчатых клеток, T2N3M0). Затем была проведена операция полного удаления левого легкого. В 2002 году появление метастатической опухоли мозга (церебральный метастаз рака легкого) вынудило удаление метастатической опухоли мозга. Однако в этом же году в качестве осложнения возникли множественные церебральные метастазы.
| Таблица 10 |
| Система NK-клеток |
| Два цвета (оценка активности NK-клеток) |
| |
До введения препарата (количество лимфоцитов: LC) |
После введения препаратов (LC) |
| CD57+CD16+(%) Умеренная NK-активность |
5,3% |
2,6% |
| CD57+CD16-(%) Слабая NK-активность |
1,1% |
0,6% |
| CD57-CD16+(%) Сильная NK-активность |
8,8% |
5,9% |
| CD57-CD16-(%) |
84,8% |
90,9% |
| Таблица 11 |
| В качестве показателя общего количества активированных NK-клеток |
| |
До введения препарата (количество лимфоцитов: LC) |
После введения препаратов (LC) |
| CD3+HLA-DR+(%) |
5,2% |
4,7% |
| Активированные клетки CD3 |
У данного пациента не наблюдается влияния концентрированной композиции экстракта базидиомицетов-X на возрастание количества NK-клеток.
(Случай 5) В октябре 2001 года был отмечен легочный рак (аденокарцинома). Согласно диагнозу наблюдались метастазы в правом шейном лимфатическом узле, причем метастазы ворот лимфатических узлов были осложнены синдромом полой верхней вены. Терапия включала 60 Гр радиационного облучения области правой стороны шеи и химиотерапию (CBDCA + Tay 4 курса). Полая верхняя вена оставалась полностью закупоренной, и одновременно наблюдался карциноматозный плеврит. В полость легких часто вводились лекарственные средства, но они уменьшали поражение лишь в небольшой степени. Кроме этого, в последнее время при компьютерной томографии было подтверждено образование метастазов в мозге.
| Таблица 12 |
| Система NK-клеток |
| Два цвета (оценка активности NK-клеток) |
| |
До введения препарата (количество лимфоцитов: LC) |
После введения препаратов (LC) |
| CD57+CD16+(%) Умеренная NK-активность |
12,1% (256) |
17,5% (431) |
| CD57+CD16-(%) Слабая NK-активность |
36,5% (773) |
44,6% (1099) |
| CD57-CD16+(%) Сильная NK-активность |
4,3% (91) |
6,0% (148) |
| CD57-CD16-(%) |
47,0% |
31,9% |
| Таблица 13 |
| В качестве показателя общего количества активированных NK-клеток |
| |
До введения препарата (количество лимфоцитов: LC) |
После введения препаратов (LC) |
| CD3+HLA-DR+(%) |
22,2% (469) |
32,3% (796) |
| Активированные клетки CD3 |
В данном случае выросли все параметры, относящиеся к NK-клеткам, причем пероральное введение концентрированной композиции экстракта базидиомицетов-X увеличило активность NK-клеток и их число. Данный случай оценен, как случай отличного отклика на действие препарата.
(Случай 6) В июле 2002 года был обнаружен рак желудка (желудочная карцинома типа Borrmann I в преддверии желудка). Однако пациент не пожелал проводить операцию, и рак дошел до состояния конечной стадии.
| Таблица 14 |
| Система NK-клеток |
| Два цвета (оценка активности NK-клеток) |
| |
До введения препарата (количество лимфоцитов: LC) |
После введения препаратов (LC) |
| CD57+CD16+(%) Умеренная NK-активность |
30,1% |
30,9% |
| CD57+CD16-(%) Слабая NK-активность |
7,8% |
7,1% |
| CD57-CD16+(%) Сильная NK-активность |
6,2% |
6,7% |
| CD57-CD16-(%) |
55,9% |
55,3% |
| Таблица 15 |
| В качестве показателя общего количества активированных NK-леток |
| |
До введения препарата (количество лимфоцитов: LC) |
После введения препаратов (LC) |
| CD3+HLA-DR+(%) |
9,9% |
9,1% |
| Активированные клетки CD3 |
В данном случае выросли показатели CD57-CD16+(%) (сильная NK-активность) и CD57+CD16+(%) (умеренная NK-активность).
Даже среди пациентов с конечной стадией рака имеется два типа пациентов: пациенты, которые живут обычной повседневной жизнью и прикованные к постели пациенты в конечной стадии. Ожидалось, что при приеме концентрированной композиции экстракта базидиомицетов-X, заметное влияние на улучшение иммунитета (увеличение NK-клеток) будет достигнуто даже у пациентов первого типа, т.е. пациентов с конечной стадией рака, которые могут жить повседневной жизнью. С другой стороны, допускали наличие некоторой взаимосвязи между обнаружением раковых патологий и концентрированной композицией экстракта базидиомицетов-X. У пациентов с аденокарциномами, как в случае 1 с раком толстой кишки (аденокарцинома), случае 3 слизистой цистаденокарциномы (разновидность аденокарциномы), случае 5 рака легких (аденокарцинома) и случае 6 рака желудка (аденокарцинома), наблюдается некоторое изменение в параметрах NK-клеток после воздействия концентрированной композиции на основе экстракта базидиомицетов-X. Однако случай 4, который также представляет собой случай рака легких, был диагностирован как относящийся к карциноме чешуйчатых клеток. У данного пациента концентрированная композиция на основе экстракта базидиомицетов-X не оказывает влияния на любой из динамических параметров NK-клеток.
(Тестовый пример 6) Изменение параметров иммунокомпетентности у больных раком (при 8-месячном введении препарата).
В случае 3 и случае 1 из тестового примера 5 смесь 1 мл концентрированной композиции на основе экстракта базидиомицетов-X и 1 мл очищенной воды вводят перорально 3 раза в день после каждого приема пищи, в последовательности тестового примера 5. Изменения иммунологических параметров после более чем 6-месячного приема препаратов показаны в таблицах 16 и 17.
(Случай 3)
| Таблица 16 |
| |
До введения препарата (количество лимфоцитов: LC) |
После введения препарата в течение 3 недель (LC) |
После введения препарата в течение 8 месяцев (LC) |
| Количество WBC |
3100 |
3000 |
2900 |
| Количество RBC |
3420000 |
3340000 |
3430000 |
| Hb |
11,6 |
11,1 |
10,4 |
| Ht |
34,7 |
33,5 |
32,6 |
| CD57+CD16+(%) Умеренная NK-активность |
5,5% |
5,8% |
3,1% |
| CD57+CD16-(%) Слабая NK-активность |
21,8% |
16,0% |
13,4% |
| CD57-CD16+(%) Сильная NK-активность |
7,7% |
6,8% |
5,3% |
| CD3+HLA-DR+(%) Активированные клетки CD3 |
15,5% |
13,1% |
31,6% |
У данного пациента по мере развития конечной стадии рака проявляется NK-активность от умеренной до сильной.
Количество лимфоцитов постепенно снижается. С другой стороны, активированные лимфоциты заметно не изменяются после 3 недель введения препарата, но увеличиваются до 31,6% в течение 8 месяцев. Таким образом, наблюдается возрастание лимфоцитов (активированных), аналогичное возрастанию после LAK-терапии (LAK – активированный лимфокином киллер).
(Случай 1)
| Таблица 17 |
| |
До введения препарата (количество лимфоцитов: LC) |
После введения препарата в течение 3 недель (LC) |
После введения препарата в течение 8 месяцев (LC) |
| Количество WBC |
7800 |
7500 |
14400 |
| Количество RBC |
4170000 |
3720000 |
3760000 |
| Hb |
11,5 |
10,1 |
9,1 |
| Ht |
35,0 |
30,5 |
28,9 |
| CD57+CD16+(%) Умеренная NK-активность |
6,6% (149) |
8,0% (250) |
5,0% |
| CD57+CD16-(%) Слабая NK-активность |
17,6% (396) |
17,6% (549) |
26,6% |
| CD57-CD16+(%) Сильная NK-активность |
4,6% (104) |
4,1% (128) |
2,9% |
| CD3+HLA-DR+(%) Активированные клетки CD3 |
9,9% (223) |
10,6% (331) |
22,7% |
У данного пациента клетки CD57+CD16+ с умеренной NK-активностью возрастают через 3 недели перорального введения препарата. Далее, клетки CD57+CD16- со слабой NK-активностью возрастают после 8 месяцев перорального введения. Дополнительно, активированные клетки CD3 возрастают до 10,6% через 3 недели введения препарата и до 22,7% через 8 месяцев введения.
Наконец, NK-активность после введения препарата немного возрастает по сравнению с активностью до введения.
Заслуживают внимания данные, показывающие, что клетки CD3+HLA-DR+, т.е. маркеры активированных T лимфоцитов, после перорального введения возрастают замечательным образом. Этот итог обычно наблюдается после LAK-терапии и, несомненно, рассматривается как выдающийся результат применения композиции экстракта базидиомицетов-X.
У пациентов, которым долговременно вводят композицию экстракта базидиомицетов-X, наблюдается заметное возрастание активированных лимфоцитов, аналогичное возрастанию лимфоцитов после LAK-терапии, хотя это представляет собой результат введения препарата лишь 2 пациентам. По-видимому, на основе этих данных необходимы дальнейшие исследования на примере большего числа пациентов. Однако предполагается, что композиция на основе экстракта базидиомицетов-X обладает возможностью увеличения активированных Т лимфоцитов и нацеливания иммунной системы на уничтожение рака у пациентов с конечной стадией рака.
(Пример 10)
Блюда с применением съедобных базидиомицетов приготовляют в соответствии с приведенными ниже рецептами. Во всех блюдах органолептические ощущения от съедобных базидиомицетов являются удовлетворительными, их вкус является хорошим и хорошо сочетается со вкусом блюд.
Паста
Только что сваренные макароны и нарезанные ломтиками съедобные базидиомицеты слегка обжаривают на сковороде в оливковом масле. Затем смесь предпочтительно приправляют специями, такими как соль или перец. Как только съедобные базидиомицеты обжарены, блюдо готово.
Пицца
Ломтики сырых съедобных базидиомицетов раскладывают на тесте для изготовления пиццы, посыпают сыром и полученный продукт запекают в печи. Как только сыр равномерно расплавится, блюдо готово.
Жаренное во фритюре приправленное мясо или рыба
Цыплят или рыбу предварительно приправляют соевым соусом или сладкой приправой на основе сакэ. Предварительно приправленных цыплят или рыбу посыпают крахмалом Erythronium japonicum и слегка замачивают во взбитых яйцах. Затем нарезанные ломтиками сырые съедобные базидиомицеты равномерно закладывают в цыплят или рыбу и обработанных подобным образом цыплят или рыбу зажаривают во фритюре в масле. Как только съедобные базидиомицеты покрываются хрустящей корочкой, блюдо готово.
Омлет
Взбивают яйца и желательным способом приправляют такими приправами, как соль или перец. Добавляют мелко нарезанные сырые съедобные базидиомицеты, после чего дополнительно перемешивают. Затем взбитые яйца и прочие компоненты выливают на сковороду, нагретую до такой степени, чтобы масло слегка дымилось. Взбитые яйца перемешивают, пока они не станут твердыми и пламя выключают. Когда поверхность яичной массы затвердевает за счет оставшегося в сковороде тепла, полученную массу сворачивают. Когда поверхность становится золотисто-коричневой и внутренность яичной массы наполовину зажарена, блюдо готово.
ПРОМЫШЛЕННАЯ ПРИМЕНИМОСТЬ
Как было описано выше, настоящее изобретение способно предоставить базидиомицеты, которые представляют собой новую разновидность грибов, обладающую отличным иммуностимулирующим действием, композицию на основе экстрактов базидиомицетов, диетические продукты и иммуностимуляторы, в которых применяется композиция экстрактов базидиомицетов, а также съедобные базидиомицеты.
СВЕДЕНИЯ О МИКРООРГАНИЗМАХ
Наименование депонирующего органа: Интернациональный Патентный депозитарий микроорганизмов, Национальный Институт Передовой промышленной науки и технологии.
Адрес депонирующего органа: Chuo Dai-6, Higashi 1-1-1, Tsukuba City, Ibaragi Prefecture, Japan (почтовый индекс 305-8566).
Дата депонирования в депонирующем органе: 27 февраля 2003 г.
Инвентарный номер, присвоенный депонирующим органом при депонировании: FERM BP-10011.
Имя депозитора: Y.Tsuno, представительный директор, технический специалист по микологии Kabushiki Kaisha.
Адрес депозитора: Bandai 4-3-20, Niigata City, Niigata Prefecture, Japan (почтовый индекс 950-0088).
Депонированные микроорганизмы были депонированы 27 Февраля 2003 года в Международном Патентном депозитарии микроорганизмов Национального Института Передовой Промышленной Науки и Технологии (инвентарный номер: FERM P-19241) и перемещены в международное депонирование (инвентарный номер: FERM BP-1001) 15 Апреля 2004 года.
Прочая информация об особенностях микроорганизмов:
Тип микроорганизма: плесневый грибок.
Место в классификации: базидиомицеты, склероций (масса гиф), не идентифицированный по виду.
Условия культивирования:
Наименование культуральной среды: питательная среда картофель-глюкоза-агар.
Состав культуральной среды: отвар 200 г картофеля, 20 г глюкозы, 20 г агара на 1000 мл культуральной среды.
pH культуральной среды: 5,6.
Условия стерилизации культуральной среды: 121°C, 20 минут в автоклаве.
Температура культивирования: 24°C.
Срок культивирования: 5 дней.
Требования к наличию кислорода: аэробные.
Способ культивирования: аэробный.
Требования к свету: не является необходимым.
Условия хранения субкультуры (культуры для посева, инокулята): срок перемещения 3 месяца, хранение при температуре 5°C в прохладном темном месте.
Условия хранения:
Сохранение путем заморозки-высушивания: не допускается.
Сохранение путем лиофильного высушивания: не допускается.
Сохранение путем заморозки (около -80°C): не допускается.
Способ хранения, если указанные выше способы не доступны: хранение в виде субкультуры (срок перемещения 3 месяца, хранение при температуре 5°C в прохладном темном месте).
Образование спор (конидий): Нет.
Формула изобретения
1. Базидиомицеты, отличающиеся тем, что представляют собой базидиомицеты-X PERM BP-10011, обладающие иммуностимулирующей активностью.
2. Экстракт базидиомицетов, обладающий иммуностимулирующей активностью, отличающийся тем, что экстракт выделен из базидиомицетов, которые являются базидиомицетами-Х FERM BP-10011, с помощью растворителя для экстракции, включающего, по крайней мере, один растворитель, выбранный из воды и гидрофильного растворителя, при нагревании или давлении.
3. Диетический пищевой продукт, отличающийся тем, что в качестве действующего начала содержит экстракт базидиомицетов, выделенный из базидиомицетов, которые представляют собой базидиомицеты-Х FERM ВР-10011.
4. Диетический продукт по п.3, отличающийся тем, что продукт представляет собой продукт, выбранный из напитка, легкой закуски, концентрированного экстракта, порошка, гранул, таблеток и капсул.
5. Иммуностимулятор, отличающийся тем, что содержит в качестве действующего начала экстракт базидиомицетов, который выделен из базидиомицетов, которые представляют собой базидиомицеты-X FERM ВР-10011.
6. Съедобные базидиомицеты, содержащие массу гиф, образованную путем культивирования базидиомицетов по п.1.
РИСУНКИ
|
|