Патент на изобретение №2158734
|
||||||||||||||||||||||||||
(54) ПРОИЗВОДНЫЕ ТРИАЗОЛИЛА, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФУНГИЦИДНОЕ СРЕДСТВО
(57) Реферат: Описываются новые производные триазолила общей формулы I, где R1 означает линейный алкил с 1-6 атомами углерода, замещенный галоидфенилом или галоидфеноксигруппой, фенил, замещенный галоидом или галоидалкоксигруппой; R2 означает циклоалкил с 3-7 атомами углерода, замещенный галоидом или цианогруппой, линейный или разветвленный алкил с 1-6 атомами углерода, который может быть замещен галоидом, алкоксиминогруппой с 1-4 атомами углерода или галоидфеноксигруппой, или фенил, замещенный галоидом; Х означает группировки -SH, -SR3, -SO3Н или -SO3H, где R3 означает линейный алкил с 1-6 атомами углерода или фенилрадикал, и их кислотно-аддитивные соли или комплексы с солями металлов. Соединения проявляют фунгицидную активность. Описывается также способ их получения, а также фунгицидное средство на основе соединений общей формулы I. 3 с. и 1 з.п.ф-лы, 2 табл. 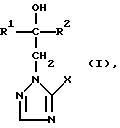
Изобретение относится к новым азотсодержащим гетероциклическим соединениям, обладающим биологической активностью, в частности фунгицидной активностью, более конкретно к производным триазолила, способу их получения и фунгицидному средству. Известны производные триазолила, обладающие биологической активностью, в частности фунгицидной активностью (см. заявку EP N 251 086, C 07 D 249/08, 07.01.1988 г.). Задачей изобретения является расширение производных триазолила, обладающих биологической активностью, в частности фунгицидной активностью. Поставленная задача решается предлагаемыми производными формулы (I) 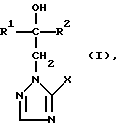 где R1 означает линейный алкил с 1-6 атомами углерода, замещенный галоидфенилом или галоидфеноксигруппой, фенил, замещенный галоидом или галоидалкоксигруппой, R2 означает циклоалкил с 3-7 атомами углерода, замещенный галоидом или цианогруппой, линейный или разветвленный алкил с 1-6 атомами углерода, который может быть замещен галоидом, алкоксиминогруппой с 1 – 4 атомами углерода или галоидфеноксигруппой, или фенил, замещенный галоидом, X означает группировки -SH, -SR3, -SO2R3 или -SO3H, где R3 означает линейный алкил с 1-6 атомами углерода или фенилрадикал. Предпочтительным производным триазолила формулы (I) является 2-(1-хлорциклопропил)-1-(2-хлорфенил)-3-(5-меркапто-1,2,4- триазол-1-ил)-пропан-2-ол. Для образования кислотно-аддитивных солей предпочтительно используют галогенводородные кислоты, например хлористоводородную кислоту и бромистоводородную кислоту, в частности хлористоводородную кислоту, далее фосфорную кислоту, азотную кислоту, одно- и двухосновные карбоновые кислоты и гидроксикарбоновые кислоты, например уксусную кислоту, малеиновую кислоту, янтарную кислоту, фумаровую кислоту, винную кислоту, лимонную кислоту, салициловую кислоту, сорбиновую кислоту и молочную кислоту, а также сульфокислоты, например п-толуолсульфокислоту и 1,5-нафталиндисульфокислоту, а также сахарин и тиосахарин. Предпочтительными комплексами с солями металлов являются продукты присоединения солей металлов II-IV основной группы и I и II, а также IV-VIII побочных групп периодической системы элементов и тех производных триазолила формулы I, у которых R1, R2 и X имеют вышеуказанные значения. При этом особенно предпочтительными являются соли меди, цинка, марганца, магния, олова, железа и никеля. Анионами этих солей могут быть такие, которые образованы от кислот, дающих физиологически переносимые продукты присоединения. Особенно предпочтительными кислотами такого вида являются галогенводородные кислоты, например хлористоводородная кислота и бромистоводородная кислота, далее фосфорная кислота, азотная кислота и серная кислота. Производные триазолила формулы (I), у которых X означает -SH-группу, могут находиться в “меркапто”-форме 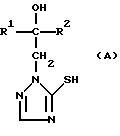 или в таутомерной “тионо”-форме OH 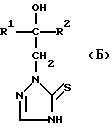 Ради простоты каждый раз будет указываться только “меркапто”-форма. Производные триазолила формулы (I) относятся к категории металло-токсичных веществ. Производные триазолила формулы (I), у которых X означает группировку -SR3, где R3 означает фенилрадикал, и их кислотно-аддитивные соли или комплексы с солями металлов получают за счет того, что соединение формулы (II) 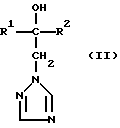 где R1 и R3 имеют указанные выше значения, подвергают последовательному взаимодействию с сильным основанием и дифенил-дисульфидом формулы (III) R4S-S-R4, (III) где R4 означает фенил, в присутствии разбавителя с последующим выделением целевого продукта в свободном виде или в виде кислотно-аддитивной соли или комплекса с солью металла. Данный способ является дополнительным объектом данной заявки. Производные триазолила формулы (I), где R1, R2 и X имеют вышеуказанные значения, можно получать следующим образом. (a) Гидроксиэтил-триазолы формулы (II) 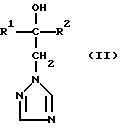 где R1 и R2 имеют указанные выше значения, или  ) последовательно подвергают превращению с сильным основанием и серой в присутствии разбавителя и затем гидролизуют водой, при необходимости в присутствии кислоты, ) последовательно подвергают превращению с сильным основанием и серой в присутствии разбавителя и затем гидролизуют водой, при необходимости в присутствии кислоты,или  ) подвергают взаимодействию с серой в присутствии высококипящего разбавителя и затем обрабатывают водой, а также при необходимости с кислотой, и при необходимости полученные по вариантам ( ) подвергают взаимодействию с серой в присутствии высококипящего разбавителя и затем обрабатывают водой, а также при необходимости с кислотой, и при необходимости полученные по вариантам (  ) и ( ) и (  ) соединения формулы (Ia) ) соединения формулы (Ia)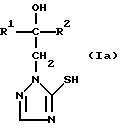 в которой R1 и R2 имеют указанные выше значения, подвергают взаимодействию с галогеновыми соединениями формулы (IV) R5-Hal, (IV) в которой R5 означает линейный алкил с 1 – 6 атомами углерода или фенил, Hal означает хлор, бром или иод, в присутствии связывающего кислоту средства и в присутствии разбавителя, и полученные при этом соединения формулы (Iб) 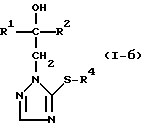 в которой R1, R2 и R5 имеют указанные выше значения, при необходимости подвергают взаимодействию с окисляющими средствами в присутствии разбавителя, б) Производные триазолила формулы (Iа) 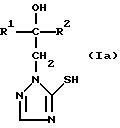 в которой R1 и R2 имеют указанные выше значения, подвергают взаимодействию с перманганатом калия в присутствии разбавителя, и в заключение, при необходимости, к полученным соединениям формулы (I) присоединяют кислоты или соль металла. Предлагаемый способ получения производных триазолила формулы (I), у которых X означает группировки SR3, поясняется в нижеследующем. Если используют в качестве исходного соединения 2-(1-хлор-циклопропил)-1-(2-хлорфенил)-3-(1,2,4-триазол-1-ил)-пропан-2-ол, н-бутиллитий в качестве сильного основания и дифенилдисульфид в качестве реагента, то протекание реакции можно изобразить следующей схемой: 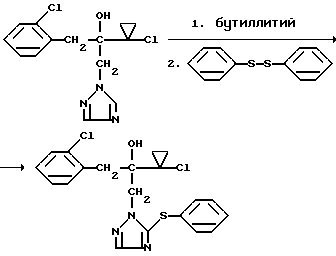 Гидроксиэтил-триазолы формулы (II) и дифенил-дисульфиды формулы (III) известны или могут быть получены известными способами. В качестве сильных оснований используются все обычные для такого типа реакций сильные основания на основе щелочных металлов. Предпочтительно применяются н-бутиллитий, литий-диизопропил-амид, гидрид натрия, амид натрия и калий-трет.-бутилат в смеси с тетраметилэтилен-диамином. В качестве разбавителей используются все обычные для такого типа реакций органические растворители. Предпочтительными являются простые эфиры, такие как тетрагидрофуран, диоксан, диэтиловый эфир и 1,2-диметоксиэтан, далее жидкий аммиак или сильно полярные растворители, такие как диметилсульфоксид. Температуры реакции могут варьироваться в широком интервале. Обычно работают при температурах между -70oC и +20oC, предпочтительно между -70oC и 0oC. При проведении предлагаемого способа работают обычно при нормальном давлении. Но можно также работать при повышенном или пониженном давлении. Упомянутые выше способы (а) и (б), которые не являются объектом изобретения, поясняются в нижеследующем. Если используют в качестве исходного соединения 2-(1-хлор- циклопропил)-1-(2-хлорфенил)-3-(1,2,4-триазол-1-ил)-пропан-2-ол, н-бутиллитий в качестве сильного основания и порошок серы в качестве реагента, то протекание первой стадии способа (а), вариант (  ), можно изобразить следующей схемой: ), можно изобразить следующей схемой: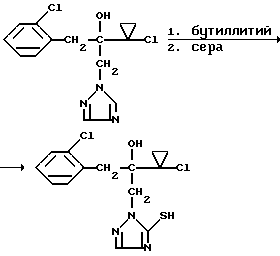 Если используют в качестве исходного соединения 2-(1-хлор- циклопропил)- 1-(2-хлорфенил)-1-(1,2,4-триазол-1-ил)-пропан-2-ол, порошок серы в качестве реагента и N-метил-пирролидон в качестве разбавителя, то протекание первой стадии способа (а), вариант (  ), можно изобразить следующей схемой: ), можно изобразить следующей схемой: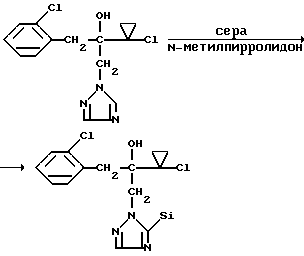 Если используют в качестве исходного соединения 2-(1- хлор-циклопропил)- 1-(2-хлорфенил)-3-(5-меркапто-1,2,4-триазол-1- ил)-пропан-2-ол и метилйодид в качестве реагента, то протекание второй стадии способа (а) можно изобразить следующей схемой: 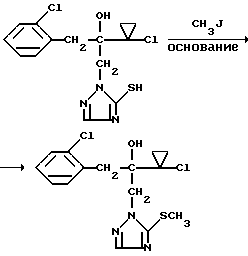 Если используют в качестве исходного соединения 2-(1-хлор- циклопропил)-1-(2-хлорфенил)-3-5-метилтио-1,2,4-триазол-1- ил)пропан-2-ол и избыток перекиси водорода в качестве окислителя, то протекание третьей стадии способа (а) можно изобразить следующей схемой: 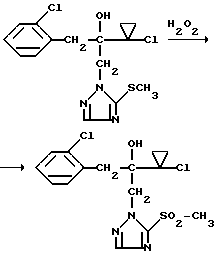 Если используют в качестве исходного соединения 2-(1- хлор-циклопропил)-1-(2-хлорфенил)-3-(5-меркапто-1,2,4-триазол-1- ил)-пропан-2-ол и в качестве окислителя перманганат калия, то протекания способа (б) можно изобразить следующей схемой: 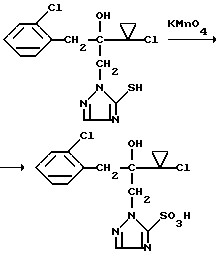 Сера используется предпочтительно в виде порошка. Для гидролиза при проведении первой стадии способа (а), вариант (  ), используют воду, при необходимости в присутствии кислоты. При этом используются все обычные для такого типа реакций неорганические или органические кислоты. Предпочтительно используются уксусная кислота, разбавленная серная кислота и разбавленная соляная кислота. Однако возможно также проводить гидролиз с водным раствором хлорида аммония.
При проведении первой стадии способа (а) по варианту ( ), используют воду, при необходимости в присутствии кислоты. При этом используются все обычные для такого типа реакций неорганические или органические кислоты. Предпочтительно используются уксусная кислота, разбавленная серная кислота и разбавленная соляная кислота. Однако возможно также проводить гидролиз с водным раствором хлорида аммония.
При проведении первой стадии способа (а) по варианту ( ) вводят обычно на один моль гидроксиэтил-триазола формулы (II) от двух до трех эквивалентов, предпочтительно 2,0 – 2,5 эквивалента, сильного основания и затем эквивалентное количество или также избыток серы. Взаимодействие может происходить в атмосфере инертного газа, например в среде аргона или азота. Работают при такой же температуре и таком же давлении, что и при проведении предлагаемого способа. Переработка происходит обычными методами. Обычно поступают таким образом, что реакционную смесь экстрагируют слабо растворимым в воде органическим растворителем, сушат объединенные органические фазы, сгущают и оставшийся остаток очищают при необходимости перекристаллизацией и/или хроматографией.
При проведении первой стадии способа (а), вариант ( ) вводят обычно на один моль гидроксиэтил-триазола формулы (II) от двух до трех эквивалентов, предпочтительно 2,0 – 2,5 эквивалента, сильного основания и затем эквивалентное количество или также избыток серы. Взаимодействие может происходить в атмосфере инертного газа, например в среде аргона или азота. Работают при такой же температуре и таком же давлении, что и при проведении предлагаемого способа. Переработка происходит обычными методами. Обычно поступают таким образом, что реакционную смесь экстрагируют слабо растворимым в воде органическим растворителем, сушат объединенные органические фазы, сгущают и оставшийся остаток очищают при необходимости перекристаллизацией и/или хроматографией.
При проведении первой стадии способа (а), вариант ( ),, используются в качестве разбавителей все обычные для такого типа реакций высококипящие органические растворители. Предпочтительными являются амиды, такие как диметилформамид и диметилацетамид, кроме того гетероциклические соединения, такие как N-метил-пирролидон, и также простые эфиры, такие как дифениловый эфир.
При проведении первой стадии способа (а), вариант ( ),, используются в качестве разбавителей все обычные для такого типа реакций высококипящие органические растворители. Предпочтительными являются амиды, такие как диметилформамид и диметилацетамид, кроме того гетероциклические соединения, такие как N-метил-пирролидон, и также простые эфиры, такие как дифениловый эфир.
При проведении первой стадии способа (а), вариант ( ), серу используют обычно в виде порошка. После взаимодействия можно при необходимости проводить обработку водой или кислотой. Переработку проводят так же, как гидролиз при проведении первой стадии способа (а) по варианту ( ), серу используют обычно в виде порошка. После взаимодействия можно при необходимости проводить обработку водой или кислотой. Переработку проводят так же, как гидролиз при проведении первой стадии способа (а) по варианту ( ).
Температуры реакции при проведении первой стадии способа (а) по варианту ( ).
Температуры реакции при проведении первой стадии способа (а) по варианту ( ) могут варьироваться в широком интервале. Обычно работают при температурах между 150oC и 300oC, предпочтительно между 180oC и 250oC.
При проведении первой стадии способа (а) по варианту ( ) могут варьироваться в широком интервале. Обычно работают при температурах между 150oC и 300oC, предпочтительно между 180oC и 250oC.
При проведении первой стадии способа (а) по варианту ( ) вводят обычно на один моль гидрокиэтил-триазола формулы (II) от одного до пяти молей, предпочтительно 1,5-3 моля, серы. Переработка происходит обычными методами. Обычно поступают таким образом, что реакционную смесь экстрагируют слабо растворимым в воде органическим растворителем, сушат объединенные органические фазы, сгущают и оставшийся остаток очищают при необходимости перекристаллизацией и/или хроматографией.
Галогеновые производные формулы (IV) известны.
В качестве связывающего кислоту средства используют при проведении второй стадии способа (а) все обычные неорганические или органические основания. Предпочтительно применяют гидроокиси щелочных или щелочноземельных металлов, такие как гидроокись натрия, гидроокись калия, гидроокись кальция, или также гидроокись аммония, карбонаты щелочных металлов, такие как карбонат натрия, карбонат калия, бикарбонат калия, бикарбонат натрия, ацетаты щелочных или щелочноземельных металлов, такие как ацетат натрия, ацетат калия, ацетат кальция, а также третичные амины, такие как триметиламин, трибутиламин, N, N-диметиланилин, пиридин, N-метилпиперидин, диазабициклооктан, диазабициклононен или диазабициклоундецен.
В качестве разбавителя применяют при проведении второй стадии способа (а) все обычные для таких реакций инертные органические растворители. Предпочтительно применяют простые эфиры, например диэтиловый эфир, метил-трет.-бутиловый эфир, диметиловый эфир этиленгликоля, тетрагидрофуран или диоксан, далее нитрилы, например ацетонитрил, и, кроме того, высокополярные растворители, например диметилсульфоксид или диметилформамид.
Температуры реакции при проведении второй стадии способа (а) могут варьироваться в широком интервале. Обычно работают при температурах между 0oC и 120oC, предпочтительно между 20oC и 100oC.
При проведении второй стадии способа (а) вводят обычно на один моль производного триазолила формулы (Iа) от одного до двух молей галогенового соединения формулы (IV), а также эквивалентное количество или избыток связывающего кислоту средства. Обработка происходит обычными методами. Обычно поступают таким образом, что реакционную смесь смешивают с водным основанием и слабо смешиваемым с водой органическим растворителем, отделяют органическую фазу, сушат и сгущают. Полученный продукт очищают от имеющихся примесей, при необходимости перекристаллизацией.
В качестве окислителя используют при проведении третьей стадии способа (а) все применимые для окисления серы вещества. Предпочтительно используют перекись водорода и надкислоты, например надуксусную кислоту и мета-хлор-надбензойную кислоту, и, кроме того, неогранические соли, например перманганат калия.
В качестве разбавителя используют при проведении третьей стадии способа (а) все обычные для таких реакций растворители. Если используют перекись водорода или надкислоты в качестве окислителя, то в качестве разбавителя используют предпочтительно уксусную кислоту или ледяную уксусную кислоту. Если работают с перманганатом калия в качестве окислителя, то используют также воду или спирты, например трет.-бутанол.
Температуры реакции при проведении третьей стадии способа (а) могут варьироваться в широком интервале. Обычно работают при температурах между 0oC и 100oC, предпочтительно между 10oC и 100oC.
При проведении третьей стадии способа (а) вводят обычно на один моль соединения формулы (Iб) эквивалентное количество или избыток окислителя. Если хотят получить SO-соединения, то работают с эквимолярными количествами. Если хотят получить SO2-соединения, то берут избыток окислителя. Обработка происходит обычными методами. Обычно поступают таким образом, что разбавляют льдом или водой, при необходимости подщелачивают добавкой основания, экстрагируют слабо смешиваемым с водой органическим растворителем, сушат объединенные органические фазы, сгущают и полученный продукт при необходимости перекристаллизовывают. Если работают с перманганатом калия в водном растворе, то поступают таким образом, что твердое вещество отфильтровывают, промывают и сушат.
Получаемые согласно вышеописанным способам производные триазола формулы (I) могут быть переведены в соли присоединения кислот или в комплексы с солями металлов.
Соли соединений формулы (I) с кислотами получают простым способом обычными методами, например растворением соединения формулы (I) в подходящем инертном растворителе и добавлением кислоты, например, хлористоводородной кислоты, и известным способом, например фильтрацией, выделяют и при необходимости очищают путем промывки инертным органическим растворителем.
Комплексы соединений формулы (I) с солями металлов могут быть простым способом получены известными методами, например растворением соли металла в спирте, например этаноле, и добавлением к соединениям формулы (I). Комплексы известным способом, например фильтрацией, выделяют и при необходимости очищают перекристаллизацией.
Как уже указывалось выше, производные триазола формулы (I) проявляют фунгицидную активность.
Поэтому дальнейшим объектом изобретения является фунгицидное средство, отличающееся содержанием производного триазолила формулы (I) или его кислотно-аддитивной соли или комплекса с солью металла.
Производные триазолила формулы (I) в дальнейшем обозначается как “активные вещества”.
Активные вещества могут применяться как таковые, в виде их концентратов или в виде приготовляемых из них рабочих форм, как, например, готовые к употреблению растворы, эмульгируемые концентраты, эмульсии, пены, суспензии, порошки для опрыскивания, пасты, растворимые порошки, препараты для опыливания и грануляты. Применение происходит обычным образом, например поливом, опрыскиванием, разбрасыванием, распылением, намазыванием и т.д. Также возможно наносить активные вещества ультранизкообъемным методом или композицию с активным веществом или само активное вещество вносить в почву. Также можно обрабатывать посевной материал.
При обработке частей растений концентрации активного вещества в форме, готовой для применения, варьируются в широком интервале: обычно они составляют от 1 до 0,0001 вес.%, предпочтительно от 0,5 до 0,001 вес.%.
При обработке посевного материала количество активного вещества составляет обычно от 0,001 до 50 г на кг семян, предпочтительно от 0,01 до 10 г.
При обработке почвы концентрация активного вещества в местах применения составляет от 0,00001 до 0,1 вес.%, предпочтительно от 0,0001 до 0,02 вес.%.
Концентрация при применении активных веществ зависит от вида и происхождения грибков, а также от состава защищаемого материала. Оптимальное количество определяют путем ряда опытов. Обычно концентрации применения составляют от 0,001 до 5 вес.%, предпочтительно от 0,05 вес.% до 1,0 вес.%, считая на защищаемый материал.
Получение производных триазолила формулы (I) иллюстрируется следующими примерами.
Пример 1 ) вводят обычно на один моль гидрокиэтил-триазола формулы (II) от одного до пяти молей, предпочтительно 1,5-3 моля, серы. Переработка происходит обычными методами. Обычно поступают таким образом, что реакционную смесь экстрагируют слабо растворимым в воде органическим растворителем, сушат объединенные органические фазы, сгущают и оставшийся остаток очищают при необходимости перекристаллизацией и/или хроматографией.
Галогеновые производные формулы (IV) известны.
В качестве связывающего кислоту средства используют при проведении второй стадии способа (а) все обычные неорганические или органические основания. Предпочтительно применяют гидроокиси щелочных или щелочноземельных металлов, такие как гидроокись натрия, гидроокись калия, гидроокись кальция, или также гидроокись аммония, карбонаты щелочных металлов, такие как карбонат натрия, карбонат калия, бикарбонат калия, бикарбонат натрия, ацетаты щелочных или щелочноземельных металлов, такие как ацетат натрия, ацетат калия, ацетат кальция, а также третичные амины, такие как триметиламин, трибутиламин, N, N-диметиланилин, пиридин, N-метилпиперидин, диазабициклооктан, диазабициклононен или диазабициклоундецен.
В качестве разбавителя применяют при проведении второй стадии способа (а) все обычные для таких реакций инертные органические растворители. Предпочтительно применяют простые эфиры, например диэтиловый эфир, метил-трет.-бутиловый эфир, диметиловый эфир этиленгликоля, тетрагидрофуран или диоксан, далее нитрилы, например ацетонитрил, и, кроме того, высокополярные растворители, например диметилсульфоксид или диметилформамид.
Температуры реакции при проведении второй стадии способа (а) могут варьироваться в широком интервале. Обычно работают при температурах между 0oC и 120oC, предпочтительно между 20oC и 100oC.
При проведении второй стадии способа (а) вводят обычно на один моль производного триазолила формулы (Iа) от одного до двух молей галогенового соединения формулы (IV), а также эквивалентное количество или избыток связывающего кислоту средства. Обработка происходит обычными методами. Обычно поступают таким образом, что реакционную смесь смешивают с водным основанием и слабо смешиваемым с водой органическим растворителем, отделяют органическую фазу, сушат и сгущают. Полученный продукт очищают от имеющихся примесей, при необходимости перекристаллизацией.
В качестве окислителя используют при проведении третьей стадии способа (а) все применимые для окисления серы вещества. Предпочтительно используют перекись водорода и надкислоты, например надуксусную кислоту и мета-хлор-надбензойную кислоту, и, кроме того, неогранические соли, например перманганат калия.
В качестве разбавителя используют при проведении третьей стадии способа (а) все обычные для таких реакций растворители. Если используют перекись водорода или надкислоты в качестве окислителя, то в качестве разбавителя используют предпочтительно уксусную кислоту или ледяную уксусную кислоту. Если работают с перманганатом калия в качестве окислителя, то используют также воду или спирты, например трет.-бутанол.
Температуры реакции при проведении третьей стадии способа (а) могут варьироваться в широком интервале. Обычно работают при температурах между 0oC и 100oC, предпочтительно между 10oC и 100oC.
При проведении третьей стадии способа (а) вводят обычно на один моль соединения формулы (Iб) эквивалентное количество или избыток окислителя. Если хотят получить SO-соединения, то работают с эквимолярными количествами. Если хотят получить SO2-соединения, то берут избыток окислителя. Обработка происходит обычными методами. Обычно поступают таким образом, что разбавляют льдом или водой, при необходимости подщелачивают добавкой основания, экстрагируют слабо смешиваемым с водой органическим растворителем, сушат объединенные органические фазы, сгущают и полученный продукт при необходимости перекристаллизовывают. Если работают с перманганатом калия в водном растворе, то поступают таким образом, что твердое вещество отфильтровывают, промывают и сушат.
Получаемые согласно вышеописанным способам производные триазола формулы (I) могут быть переведены в соли присоединения кислот или в комплексы с солями металлов.
Соли соединений формулы (I) с кислотами получают простым способом обычными методами, например растворением соединения формулы (I) в подходящем инертном растворителе и добавлением кислоты, например, хлористоводородной кислоты, и известным способом, например фильтрацией, выделяют и при необходимости очищают путем промывки инертным органическим растворителем.
Комплексы соединений формулы (I) с солями металлов могут быть простым способом получены известными методами, например растворением соли металла в спирте, например этаноле, и добавлением к соединениям формулы (I). Комплексы известным способом, например фильтрацией, выделяют и при необходимости очищают перекристаллизацией.
Как уже указывалось выше, производные триазола формулы (I) проявляют фунгицидную активность.
Поэтому дальнейшим объектом изобретения является фунгицидное средство, отличающееся содержанием производного триазолила формулы (I) или его кислотно-аддитивной соли или комплекса с солью металла.
Производные триазолила формулы (I) в дальнейшем обозначается как “активные вещества”.
Активные вещества могут применяться как таковые, в виде их концентратов или в виде приготовляемых из них рабочих форм, как, например, готовые к употреблению растворы, эмульгируемые концентраты, эмульсии, пены, суспензии, порошки для опрыскивания, пасты, растворимые порошки, препараты для опыливания и грануляты. Применение происходит обычным образом, например поливом, опрыскиванием, разбрасыванием, распылением, намазыванием и т.д. Также возможно наносить активные вещества ультранизкообъемным методом или композицию с активным веществом или само активное вещество вносить в почву. Также можно обрабатывать посевной материал.
При обработке частей растений концентрации активного вещества в форме, готовой для применения, варьируются в широком интервале: обычно они составляют от 1 до 0,0001 вес.%, предпочтительно от 0,5 до 0,001 вес.%.
При обработке посевного материала количество активного вещества составляет обычно от 0,001 до 50 г на кг семян, предпочтительно от 0,01 до 10 г.
При обработке почвы концентрация активного вещества в местах применения составляет от 0,00001 до 0,1 вес.%, предпочтительно от 0,0001 до 0,02 вес.%.
Концентрация при применении активных веществ зависит от вида и происхождения грибков, а также от состава защищаемого материала. Оптимальное количество определяют путем ряда опытов. Обычно концентрации применения составляют от 0,001 до 5 вес.%, предпочтительно от 0,05 вес.% до 1,0 вес.%, считая на защищаемый материал.
Получение производных триазолила формулы (I) иллюстрируется следующими примерами.
Пример 1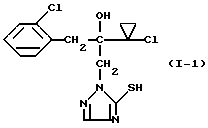 Вариант  Смесь из 3,12 г (10 ммолей) 2-(1-хлор-циклопропил)- 1-(2-хлорфенил)-3-(1,2,4-триазол-1-ил)-пропан-2-ола и 45 мл абсолютного тетрагидрофурана смешивают при 20oC с 8,4 мл (21 ммоль) н-бутиллития в гексане и перемешивают 30 минут при 0oC. Затем охлаждают реакционную смесь до -70oC, смешивают с 0,32 г (10 ммолей) порошка серы и перемешивают 30 минут при -70oC. Нагревают до -10oC, смешивают с ледяной водой и устанавливают значение pH 5 добавлением разбавленной серной кислоты. Многократно экстрагируют этилацетатом, сушат объединенные органические фазы сульфатом натрия и сгущают при пониженном давлении. Получают таким образом 3,2 г (93% от теории) 2-(1-хлор-циклопропил)- 1-(2-хлорфенил)-3-(5-меркапто-1,2,4-триазол-1-ил)-пропан-2-ола в виде твердого вещества, которое после перекристаллизации плавится при 138-139oC. Вариант  Смесь из 3,12 г (10 ммолей) 2-(1-хлор-циклопропил)- 1-(2-хлорфенил)-3-(1,2,4-триазол-1-ил)-пропан-2-ола, 0,96 г (30 ммолей) порошка серы и 20 мл абсолютного N-метил-пирролидона нагревают при перемешивании 44 часа при 200oC. Затем реакционную смесь сгущают при пониженном давлении (0,2 мбар). Полученный сырой продукт (3,1 г) перекристаллизовывают из толуола. Получают 0,7 г (20% от теории) 2-(1-хлор-циклопропил)-1-(2-хлор-фенил)-3-(5- меркапто-1,2,4-триазол-1-ил)-пропан-2-ола в виде твердого вещества, которое плавится при 138-139oC. Пример 2 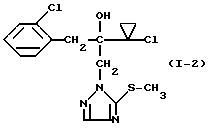 Смесь из 3,43 г (10 ммолей) 2-(1-хлор-циклопропил)-1-(2- хлорфенил)-3-(5-меркапто-1,2,4-триазол-1-ил)-пропан-2-ола, 20 мл абсолютного ацетонитрила и 1,38 г (10 ммолей) карбоната калия смешивают с 0,93 мл (15 ммолей) метилиодида и 5 ч перемешивают при 40oC. После этого реакционную смесь смешивают с насыщенным водным раствором карбоната натрия и многократно экстрагируют этилацетатом. Объединенные органические фазы сушат и сгущают при пониженном давлении. Получают таким образом 3,4 г (95% от теории) 2-(1- хлор-циклопропил)-1-(2-хлорфенил)-3-(5-меркапто-1,2,4-триазол 1-ил)- пропан-2-ола в виде масла. 1H-ЯМР-спектр (200 мГц; дейтерохлороформ, ТМС)  = 0,6-1,05 (м, 4 Н); 2,7 (с, 3 Н); 3,35 (АБ, 2 Н); 4,4 (AB, 2H); 4,7 (OH); 7,2-7,6 (м, 4H); 7,9(с,1 H). = 0,6-1,05 (м, 4 Н); 2,7 (с, 3 Н); 3,35 (АБ, 2 Н); 4,4 (AB, 2H); 4,7 (OH); 7,2-7,6 (м, 4H); 7,9(с,1 H).
 = 0,6-1,05 (м, 4H); 2,7 (с, 3H); 3,35 (AB, 2H); 4,4 (AB, 2H); 4,7 (OH); 7,2-7,6 (м, 4H); 7,9 (с, 1 H).
Пример 3 = 0,6-1,05 (м, 4H); 2,7 (с, 3H); 3,35 (AB, 2H); 4,4 (AB, 2H); 4,7 (OH); 7,2-7,6 (м, 4H); 7,9 (с, 1 H).
Пример 3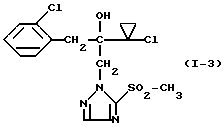 Раствор 3,57 г (10 ммолей) 2-(1-хлор-циклопропил)-1-(2- хлорфенил)-3-(5-метилтио-1,2,4-триазол-1-ил)-пропан-2-ола в 40 мл ледяной уксусной кислоты смешивают по каплям при 90oC и при перемешивании с 4 мл водного раствора перекиси водорода (35%-ная). Реакционную смесь перемешивают после окончания прибавления еще 30 минут при 90oC, затем охлаждают до комнатной температуры, смешивают со льдом и подщелачивают добавлением водной натриевой щелочи. Экстрагируют многократно этилацетатом, сушат объединенные органические фазы сульфатом натрия и сгущают при пониженном давлении. Оставшийся медленно кристаллизующийся продукт отфильтровывают. Получают 2,0 г (51% от теории) 2-(1-хлор-циклопропил)-1-(2-хлорфенил)-3-(5- метилсульфонил-1,2,4-триазол-1-ил)-пропан-2-ола в виде твердого вещества, которое имеет т. пл. 125-128oC. Пример 4 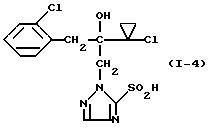 Смесь из 1,71 г (5 ммолей) 2-(1-хлорциклопропил)-1-(2- хлорфенил)-3-(5-меркапто-1,2,4-триазол-1-ил)-пропан-2-ола, 1,58 г (10 ммолей) перманганата калия и 20 мл воды перемешивают 30 минут при комнатной температуре. После этого отсасывают твердое вещество, промывают водой и сушат. Получают 2,0 г (100% от теории) 2-(1-хлорциклопропил)-1-(2-хлорфенил)-3-(5-сульфо-1,2,4-триазол- 1-ил)-пропан-2-ола в виде твердого вещества с т. пл. 68-70oC. Пример 5 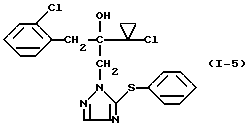 Смесь из 3,12 г (10 ммолей) 2-(1-хлорциклопропил)-1-(2- хлорфенил)-3-(1,2,4-триазол-1-ил)-пропан-2-ола и 45 мл абсолютного тетрагидрофурана смешивают при -20oC с 8,4 мл (21 ммолей) н-бутиллития в гексане и перемешивают 30 минут при 0oC. Затем реакционную смесь охлаждают до -70oC, смешивают с 2,18 г (10 ммолей) дифенил-дисульфида и медленно доводят до комнатной температуры. Перемешивают еще 19 часов при комнатной температуре, разбавляют этилацетатом и несколько раз встряхивают с насыщенным водным раствором карбоната натрия. Органическую фазу сушат сульфатом натрия и сгущают при пониженном давлении. Полученный остаток 4,2 г хроматографируют через 500 г силикагеля со смесью растворителей петролейный эфир/этилацетат при соотношении 2: 1. После упаривания элюата получают 3,5 г (84% от теории) 2-(1- хлорциклопропил)-1-(2-хлорфенил)-3-(5-фенилтио-1,2,4-триазол-1- ил)-пропан-2-ола в виде масла. Масс-спектр (Cl): 420 (M+H–) Аналогично получают соединения, приведенные в таблице 1. Нижеследующие примеры иллюстрируют фунгицидную активность производных триазолила формулы (I). Пример 19 Испытание защитной активности против Erysiphe в ячмене. 1 вес. часть активного вещества N I-1 смешивают с 10 вес. частями N-метил-пирролидона в качестве растворителя и 0,6 вес. частей алкиларилполигликолевого эфира в качестве эмульгатора и полученный концентрат разбавляют водой до желаемой концентрации. Для испытания защитной активности опрыскивают молодые растения получаемым средством при расходе активного вещества, равном 250 г/га. После высыхания нанесенного налета растения опыляют спорами Erysiphe graminis f. sp. hordei. Растения помещают в теплицу при температуре около 20oC и относительной влажностью воздуха около 80% для благоприятствования развитию пустул мучнистой росы. Спустя 7 дней после инокуляции производят процентную оценку. При этом устанавливают 100%-ную активность по сравнению с необработанными контрольными растениями. Пример 20 Испытание защитной активности против Erysiphe в пшенице. 1 вес. часть активного вещества N I-1 смешивают с 10 вес. частями N-метил-пирролидона в качестве растворителя и 10 вес. частями алкиларилполигликолевого эфира в качестве эмульгатора и полученный концентрат разбавляют водой до желаемой концентрации. Для испытания защитной активности опрыскивают молодые растения получаемым средством при расходе активного вещества, равном 250 г/га. После высыхания нанесенного налета растения опыляют спорами Erysiphe graminis f. sp. tritici. Растения помещают в теплицу при температуре около 20oC и относительной влажностью воздуха около 80% для благоприятствования развитию пустул мучнистой росы. Спустя 7 дней после инокуляции производят процентную оценку. При этом устанавливают 100%-ную активность по сравнению с необработанными контрольными растениями. Пример 21 Испытание защитной активности против Pseudocerosporella herpotrichoides в пшенице. 1 вес. часть активного вещества N I-1 смешивают с 10 вес. частями N-метил-пирролидона в качестве растворителя и 0,6 вес. частями алкиларилполигликолевого эфира в качестве эмульгатора и полученный концентрат разбавляют водой до желаемой концентрации. Для испытания защитной активности опрыскивают молодые растения получаемым средством при расходе активного вещества, равном 250 г/га. После высыхания нанесенного налета растения опыляют спорами Pseudocerosporella herpotrichoides. Растения помещают в теплицу при температуре около 20oC и относительной влажности воздуха около 80% для благоприятствования развитию пустул мучнистой росы. Спустя 21 день после инокуляции производят процентную оценку. При этом устанавливают 100%-ную активность по сравнению с необработанными контрольными растениями. Пример 22 Испытание защитной активности против Fusarium nivale (var. nivale) в пшенице. 1 вес. часть активного вещества N I-1 смешивают с 10 вес. частями N-метил-пирролидона в качестве растворителя и 0,6 вес. частями алкиларилполигликолевого эфира в качестве эмульгатора и полученный концентрат разбавляют водой до желаемой концентрации. Для испытания защитной активности опрыскивают молодые растения получаемым средством при расходе активного вещества, равном 250 г/га. После высыхания нанесенного налета растения опыляют спорами Fusarium nivale (var. nivale). Растения помещают в теплицу под светопроницаемой инкубационной сеткой при температуре около 15oC и относительной влажности воздуха около 100%. Спустя 21 день после инокуляции производят процентную оценку. При этом устанавливают 100%-ную активность по сравнению с необработанными контрольными растениями. Пример 23 Испытание защитной активности против Fusarium culmorum в пшенице. 1 вес. часть активного вещества N I-1 и N I-15 соответственно смешивают с 10 вес. частями N-метил-пирролидона в качестве растворителя и 0,6 вес. частями алкиларилполигликолевого эфира в качестве эмульгатора и полученный концентрат разбавляют водой до желаемой концентрации. Для испытания защитной активности опрыскивают молодые растения получаемым средством при расходе активного вещества, равном 250 г/га. После высыхания нанесенного налета растения опыляют спорами Fusarium culmorum. Растения помещают в теплицу под светопроницаемой инкубационной сеткой при температуре около 20oC и относительной влажностью воздуха около 100%. Спустя 4 дня после инокуляции производят процентную оценку. Устанавливают, что активное вещество N I-1 проявляет 100%-ную фунгицидную активность по сравнению с необработанными контрольными растениями, а активное вещество N I-15 – 75%-ную фунгицидную активность. Пример 24 Повторяют пример 23 с той лишь разницей, что применяют активное вещество N I-16 при расходе 125 г/га. При этом устанавливают 100%-ную активность по сравнению с необработанными контрольными растениями. Пример 25 Испытание защитной активности против Pellicularia в рисе. 1 вес. часть активного вещества N I-1 смешивают с 12,5 вес. частями ацетона в качестве растворителя и 0,3 вес. частями алкиларилполигликолевого эфира в качестве эмульгатора и полученный концентрат разбавляют водой до желаемой концентрации активного вещества, равной 0,025 вес.%. Для испытания защитной активности опрыскивают молодые растения получаемым средством. После высыхания нанесенного налета растения инокулируют Pellicularia sasakii и выдерживают при 25oC и относительной влажности 100%. Через 8 дней после инокуляции производят процентную оценку. При этом устанавливают 100%-ную активность по сравнению с необработанными контрольными растениями. Пример 26 Испытание защитной активности против Sphaerotheca в огурцах. 1 вес. часть активного вещества N I-1 смешивают с 4,7 вес. частями ацетона в качестве растворителя и 0,3 вес. частями алкиларилполигликолевого эфира в качестве эмульгатора и полученный концентрат разбавляют водой до желаемой концентрации активного вещества, равной 1 ч/мл. Для испытания защитной активности опрыскивают молодые растения до образования капель. После высыхания нанесенного налета растения опыляют конидиями грибка Sphaerotheca fulidinea. Растения помещают в теплицу при температуре около 23 – 24oC и относительной влажности воздуха около 75% для благоприятствования развитию пустул мучнистой росы. Через 10 дней после инокуляции производят процентную оценку. При этом устанавливают 100%-ную активность по сравнению с необработанными контрольными растениями. Пример 27 Испытание защитной активности против Botrytis в бобовых культурах. 1 вес. часть указанного в таблице 2 активного вещества смешивают с 47 вес. частями ацетона в качестве растворителя и 3 вес. частями алкиларилполигликолевого эфира в качестве эмульгатора и полученный концентрат разбавляют водой до желаемой концентрации. Для испытания защитной активности опрыскивают молодые растения полученным средством при расходе активного вещества, равном 500 г/га. После высыхания нанесенного налета на каждый лист кладут два агаровых куска с выращенным на них грибком Botrytis cinerea. Инокулированные растения помещают в темную теплицу при температуре около 23 – 24oC и относительной влажности воздуха 100. Спустя 2 дня после инокуляции производят процентную оценку путем грибков на листьях. При этом 0% означает степень действия, соответствующую степени действия на необработанных контрольных растениях, а 100% означает, что поражения не наблюдается. Активные вещества и результаты опыта показаны в таблице 2. Формула изобретения
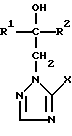 где R1 означает линейный алкил с 1 – 6 атомами углерода, замещенный галоидфенилом или галоидфеноксигруппой, фенил, замещенный галоидом или галоидалкоксигруппой; R2 означает циклоалкил с 3 – 7 атомами углерода, замещенный галоидом или цианогруппой, линейный или разветвленный алкил с 1 – 6 атомами углерода, который может быть замещен галоидом, алкоксиминогруппой с 1 – 4 атомами углерода или галоидфеноксигруппой, или фенил, замещенный галоидом; X означает группировки -SH, -SR3, -SO3R3 или -SO3H, где R3 означает линейный алкил с 1 – 6 атомами углерода или фенилрадикал, и их кислотно-аддитивные соли или комплексы с солями металлов. 2. Производное триазолила формулы I по п.1, представляющее собой 2-(1-хлорциклопропил)-1-(2-хлорфенил)-3-(5-меркапто-1,2,4-триазол-1-ил)-пропан-2-ол. 3. Способ получения производных триазола формулы I 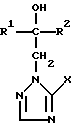 где R1 означает линейный алкил с 1 – 6 атомами углерода, замещенный галоидфенилом или галоидфеноксигруппой, фенил, замещенный галоидом или галоидалкоксигруппой; R2 означает циклоалкил с 3 – 7 атомами углерода, замещенный галоидом или цианогруппой, линейный или разветвленный алкил с 1 – 6 атомами углерода, который может быть замещен галоидом, алкоксиминогруппой с 1 – 4 атомами углерода или галоидфеноксигруппой, или фенил, замещенный галоидом; X группировка -SR3, где R3 означает фенилрадикал, или их кислотно-аддитивных солей или комплексов с солями металлов, отличающийся тем, что соединение формулы II 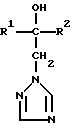 где R1 и R2 имеют указанные выше значения, подвергают последовательному взаимодействию с сильным основанием и дифенил-дисульфидом формулы III R4-S-SR4, где R4 означает фенил, в присутствии разбавителя с последующим выделением целевого продукта в свободном виде или в виде кислотно-аддитивной соли или комплекса с солью металла. 4. Фунгицидное средство, отличающееся содержанием производного триазолила формулы I по п.1 или его кислотно-аддитивной соли или комплекса с солью металла. РИСУНКИ
|
||||||||||||||||||||||||||
