|
|
(21), (22) Заявка: 2006104427/15, 15.02.2006
(24) Дата начала отсчета срока действия патента:
15.02.2006
(46) Опубликовано: 27.09.2007
(56) Список документов, цитированных в отчете о
поиске:
RU 2252029 C1, 20.05.2005. RU 2161488 С2, 10.01.2001. RU 2143269 C1, 27.12.1999. US 5714473, 03.02.1998.
Адрес для переписки:
119021, Москва, Оболенский пер., 7, кв.145, С.В.Луценко
|
(72) Автор(ы):
Луценко Елена Валерьевна (RU),
Луценко Сергей Викторович (RU),
Фельдман Наталья Борисовна (RU)
(73) Патентообладатель(и):
Автономная некоммерческая организация Научно-технический центр “Фармбиопресс” (RU)
|
(54) ПРОФИЛАКТИЧЕСКАЯ КОМПОЗИЦИЯ НА ОСНОВЕ ВЕЩЕСТВ ФЕНОЛЬНОЙ ПРИРОДЫ И ФОСФОЛИПИДОВ
(57) Реферат:
Изобретение относится к области фармакологии и медицины, конкретно к новому комплексному препарату в липосомной форме, характеризующемуся высокой гидрофильностью, улучшенной биодоступностью и терапевтическими свойствами по сравнению со свободными биофлафоноидами и другими веществами фенольной природы. Профилактическая композиция, применяемая для предупреждения или лечения патологических процессов и поддержания высокого уровня функциональной активности организма, включающая комбинации одного или нескольких экстрактов лекарственных растений, содержащих вещества фенольной природы, и фосфолипид, вещества фенольной природы заключены в оболочку из фосфолипида, выбранного из группы: фосфолипиды из бычьего или свиного мозга, или кожи, фосфатидилхолин, фосфатидилсерин, фосфатидилэтаноламин, содержащие одинаковые или различные ацильные группы, яичный лецитин, при этом оболочка выполнена в форме липосом, содержащих холестерол в количестве 11-40%. При этом вещества фенольной природы выбраны из группы: 5,6,7,4 -тетраоксифлавон, 5,6,7-триоксифлавон, g-схизандрин, апигенин, астрагалин, ауреузидин, виснагин, виснадин, гесперидин, гиперозид, дезоксисхизандрин, дигидросамидин, дигидросилибин, изоликвиритигенин, изорамнитин, инокостерон, кверцетин, кверцитрин, квинквелозид, келлин, кемпферол, лептозидин, ликвиритигенин, лютеолин, мирицетин, нарингенин, пиранокумарин, розавин, рутин, салидрозид, силидианин, силибинин, силикристин, скополетин, сульфуретин, схизандрин, схизандрол, тилирозид, трицин, умбеллиферон, 6-метокси-7,8-диоксикумарин, фурокумарин, экдистерон, энтеграстероны, 6,7-диоксикумарин и их производные. Средство обладает способностью к образованию стабильных водных микродисперсий, которые в отличие от ранее предлагаемых липофильных препаратов могут быть использованы для парентерального введения и обладают более высокой терапевтической активностью. 1 з.п. ф-лы, 1 ил., 3 табл. -тетраоксифлавон, 5,6,7-триоксифлавон, g-схизандрин, апигенин, астрагалин, ауреузидин, виснагин, виснадин, гесперидин, гиперозид, дезоксисхизандрин, дигидросамидин, дигидросилибин, изоликвиритигенин, изорамнитин, инокостерон, кверцетин, кверцитрин, квинквелозид, келлин, кемпферол, лептозидин, ликвиритигенин, лютеолин, мирицетин, нарингенин, пиранокумарин, розавин, рутин, салидрозид, силидианин, силибинин, силикристин, скополетин, сульфуретин, схизандрин, схизандрол, тилирозид, трицин, умбеллиферон, 6-метокси-7,8-диоксикумарин, фурокумарин, экдистерон, энтеграстероны, 6,7-диоксикумарин и их производные. Средство обладает способностью к образованию стабильных водных микродисперсий, которые в отличие от ранее предлагаемых липофильных препаратов могут быть использованы для парентерального введения и обладают более высокой терапевтической активностью. 1 з.п. ф-лы, 1 ил., 3 табл.
Изобретение относится к области фармакологии и медицины, конкретно к новому комплексному препарату в липосомной форме, характеризующемуся высокой гидрофильностью, улучшенной биодоступностью и терапевтическими свойствами по сравнению со свободными биофлафоноидами и другими веществами фенольной природы.
В широко распространенное среди лекарственных растений семейство флавоноидов входит обширный собирательный класс полифенолов. Флавоноидные соединения подразделяются на основные группы флавонов, флавонолов, флаванонов, флаванонолов, катехинов и антоцианов. Флавоноиды обладают широким спектром биологической и антиоксидантной активности. В настоящее время хорошо изучены и задокументированы такие фармакологические свойства флавоноидов, как антиоксидантная, периферическая, вазодилаторная активности, вазопротекторная активность (влияние на хрупкость и проницаемость капилляров), противовоспалительное, антиспазмолитическое, антигистаминное и противоопухолевое действия.
Несмотря на многообещающие перспективы клинического применения флавоноидов, их терапевтическая эффективность часто оказывается недостаточной при местном и пероральном применении. При пероральном применении наблюдается слабая абсорбция флавоноидов в кишечнике, обусловленная бактериальной деградацией и формированием не всасывающихся в кишечнике комплексов флавоноидов с другими веществами пищеварительного тракта. Поскольку флавоноиды практически нерастворимы в воде, их парентеральное применение также оказывается затруднительным. Для целей практической медицины несомненную актуальность приобретает поиск путей повышения биодоступности и терапевтической эффективности препаратов, основой которых являются флавоноиды. Одним из таких путей является применение липофильных комплексов флавоноидов с фосфолипидами, разработанных авторами патента США №5043323.
Хотя безусловной заслугой авторов является некоторое повышение биодоступности флавоноидов за счет улучшения их абсорбции в кишечнике при применении per os, высокая липофильность комплексов служит серьезным препятствием для парентерального применения препаратов, необходимого для более радикальной терапии ряда патологий.
В патенте РФ №2161488 описано применение липофильных комплексов флаволигнанов, представляющих собой смесь силибинина, силидианина и силикристина с натуральными или синтетическими фосфолипидами для терапии опухолей женской половой сферы. Авторам удалось добиться выраженного терапевтического эффекта при пероральном применении препаратов, однако дальнейшее повышение терапевтической эффективности флаволигнанов в данном случае также ограничено высокой липофильностью препаратов, создающей препятствия для их парентерального применения.
Наиболее близким техническим решением является профилактическая композиция, применяемая для предупреждения или лечения патологических процессов и поддержания высокого уровня функциональной активности организма, включающая комбинации одного или нескольких экстрактов лекарственных растений, содержащих вещества фенольной природы, и фосфолипид (пат. РФ №2252029). В качестве фосфолипида использовался соевый фосфолипидный комплекс.
Таким образом, авторами приведенных выше работ частично решена задача повышения биодоступности флавоноидов за счет увеличения их абсорбции в кишечнике в виде комплексов с фосфолипидами, однако проблема повышения растворимости флаволигнанов в водных растворах с целью создания инъекционных форм остается нерешенной.
Изобретательской задачей является создание гидрофильной, липосомной композиции с повышенной биодоступностью, обладающей более высокой терапевтической активностью, способностью к образованию стабильных водных микродисперсий, которая в отличие от ранее предлагаемых липофильных препаратов может быть использована для парентерального введения и обладает более высокой терапевтической активностью.
Изобретательская задача решается тем, что предлагается профилактическая композиция, применяемая для предупреждения или лечения патологических процессов и поддержания высокого уровня функциональной активности организма, включающая комбинации одного или нескольких экстрактов лекарственных растений, содержащих вещества фенольной природы, и фосфолипид, вещества фенольной природы заключены в оболочку из фосфолипида, выбранного из группы: фосфолипиды из бычьего или свиного мозга, или кожи, фосфатидилхолин, фосфатидилсерин, фосфатидилэтаноламин, содержащие одинаковые или различные ацильные группы, яичный лецитин, при этом оболочка выполнена в форме липосом, содержащих холестерол в количестве 11-40%.
При этом вещества фенольной природы выбраны из группы: 5,6,7,4′-тетраоксифлавон, 5,6,7-триоксифлавон, g-схизандрин, апигенин, астрагалин, ауреузидин, виснагин, виснадин, гесперидин, гиперозид, дезоксисхизандрин, дигидросамидин, дигидросилибин, изоликвиритигенин, изорамнитин, инокостерон, кверцетин, кверцитрин, квинквелозид, келлин, кемпферол, лептозидин, ликвиритигенин, лютеолин, мирицетин, нарингенин, пиранокумарин, розавин, рутин, салидрозид, силидианин, силибинин, силикристин, скополетин, сульфуретин, схизандрин, схизандрол, тилирозид, трицин, умбеллиферон, 6-метокси-7,8-диоксикумарин, фурокумарин, экдистерон, энтеграстероны, 6,7-диоксикумарин и их производные.
Данные композиции могут быть получены методами ультразвуковой обработки, экструзии, инжекции эфирных или спиртовых растворов смесей, содержащих компоненты в заявляемых соотношениях.
При получении водного раствора предлагаемой композиции образуется стабильная дисперсия микровезикул, которые могут быть использованы для получения инъекционных или инфузионных лекарственных форм.
В основе изобретения лежит новая липосомная композиция, которая может содержать одно или несколько веществ фенольной природы или один или несколько содержащих данные вещества экстрактов лекарственных растений и фосфолипиды, отличающаяся способностью к образованию стабильных водных микродисперсий, которая в отличие от ранее предлагаемых липофильных препаратов может быть использована для парентерального введения и обладает более высокой терапевтической активностью.
Составы предлагаемой липосомной композиции сведены в таблицу 1.
| Таблица 1 |
| №№ |
Соотношение активное вещество/фосфолипид |
Активное вещество |
Фосфолипид |
Оболочка, содержащая холестерол, % |
| 1 |
1:10 |
кверцетин |
фосфатидилхолин |
10 |
| 2 |
1:5 |
гиперозид |
смесь фосфатидилхолин/фосфатидилсерин |
38 |
| 3 |
1:0,5 |
силимарин |
соевый лецитин |
11 |
| 4 |
1:1 |
экстракт расторопши пятнистой |
соевый лецитин |
15 |
| 5 |
1:20 |
экстракты расторопши пятнистой и эхинацеи |
фосфатидилхолин |
12 |
| 6 |
1:50 |
рутин |
фосфолипид из бычьего мозга |
40 |
| 7 |
1:30 |
5,6,7-триоксифлавон |
фосфолипид свиного мозга |
35 |
| 8 |
1:15 |
g-схизандрин |
фосфолипид из кожи |
32 |
| 9 |
1:25 |
апигенин |
фосфатидилсерин |
20 |
| 10 |
1:40 |
астрагалин |
фосфатидилэтаноламин |
30 |
| 11 |
1:10 |
Ауреузидин |
яичный лецитин |
16 |
Аналогично были получены композиции с остальными веществами фенольной природы, указанные выше. Заявляемый препарат, включающий комплексы исходных веществ фенольной природы или содержащих их растительных экстрактов и фосфолипидов, отличается способностью в водных растворах образовывать стабильные дисперсии микровезикул. Стабильность и гидрофильность заявляемого препарата подтверждается отсутствием осадка при длительном хранении, а также данными микроскопии (чертеж).
Пример 1. Антиоксидантная активность полученных композиций.
Антиоксидантную активность композиций оценивали по их влиянию на генерацию активных форм кислорода у макрофагов, вызванную хризотил-асбестом.
В измерительную кювету хемилюминометра помещали 0,85 мл среды, содержащей 110 мМ NaCl, 10 мМ Трис-HCl, рН 7.4, 5 мМ глюкозы, 2.5 мМ MgCl2, 0.65 мМ люминола, рН 7.4. Затем в кювету добавляли 0,1 мл суспензии макрофагов (5·106 клеток/мл) и регистрировали интенсивность хемилюминесценции клеток при 37°С и постоянном перемешивании. Через 5 мин измеряли уровень спонтанной хемилюминесценции макрофагов. Затем в кювету вводили 0,05 мл исследуемых комплексов (концентрация вещества фенольной природы во всех случаях составляла 0,1 мг/мл), а через 3 мин добавляли 0,05 мл физ. раствора, содержащего 0,3 мг хризотил-асбеста. Через 5 мин измеряли максимальный уровень люминесценции макрофагов (ХЛОП). В качестве контрольного образца использовали аналогичную систему, не содержащую исследуемых препаратов (ХЛК). Антиоксидантную активность исследуемых комплексов оценивали в процентах по формуле: 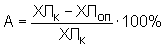 (0% – отсутствие антиоксидантной активности). В качестве препаратов сравнения использовали смеси фосфолипидов с веществами фенольной природы или содержащими их растительными экстрактами. (0% – отсутствие антиоксидантной активности). В качестве препаратов сравнения использовали смеси фосфолипидов с веществами фенольной природы или содержащими их растительными экстрактами.
Результаты исследования приведены в таблице 2.
| Таблица 2 |
| Липосомные композиции |
Антиоксидантная активность, % |
| Комплексный препарат |
Смесь |
| кверцетин/фосфатидилхолин |
46,8 |
30,6 |
| гиперозид/фосфатидилхолин/фосфатидилсерин |
38,0 |
27,9 |
| силимарин/соевый лецитин |
51,9 |
35,8 |
| экстракт расторопши пятнистой/экстракт эхинацеи/фосфатидилхолин |
58,4 |
41,3 |
Как видно из таблицы 2, антиоксидантная активность веществ фенольной природы или содержащих их экстрактов может быть значительно повышена при включении их в состав заявляемого комплексного препарата. При этом антиоксидантная активность заявляемых комплексных препаратов существенно превышает активность простых смесей веществ фенольной природы с фосфолипидами.
Аналогичные результаты были получены при исследовании антиоксидантной активности других вышеперечисленных веществ фенольной природы, входящих в состав комплексных препаратов с фосфолипидами.
Пример 2. Специфическая гепатозащитная активность липосомной композиции, включающей силибинин и фосфатидилхолин.
Исследование специфической гепатозащитной активности композиций проводили на модели острого токсического гепатита у мышей. В экспериментах были использованы белые беспородные мыши в половозрелом возрасте. Водный раствор препарата вводили внутрижелудочно с помощью зонда в дозе 100 мг/кг по силибинину. В качестве гепатотропного средства использовали парацетамол (модель лекарственного гепатита). Животным вводили препарат впервые за 1 ч до введения парацетамола, а затем еще 5 раз ежедневно. В качестве препарата сравнения использовали простую смесь силибинина и фосфатидилхолина в виде водной суспензии, которую вводили по соответствующей схеме в дозе 100 мг/кг по силибинину. Контрольным животным вводили только парацетамол. Через сутки после последнего введения препаратов животных декапитировали и проводили вскрытие и изучение биохимических показателей крови. Активность аланинаминотрансферазы (АЛАТ) и аспартатаминотрансферазы (АСАТ) определяли по методу Райтмана-Френкеля. Общий белок определяли с помощью биуретового реактива. Относительная масса печени у контрольных животных с гепатитом была увеличена по сравнению со здоровыми интактными животными на 45,6%; у экспериментальных животных этот показатель составлял 23,1% (30,2% при приеме простой смеси). Таким образом, степень выраженности воспалительных процессов у животных, получавших заявленный липосомный комплексный препарат, заметно снижалась. Исследование активности трансаминаз в сыворотке крови показало, что у контрольных животных с гепатитом уровни аланинаминотрансферазы (АЛАТ) и аспартатаминотрансферазы (АСАТ) были повышены по сравнению с интактными животными на 432,9% и 211,5%; у мышей, получавших заявляемый комплексный препарат, эти показатели снижались до 208,6% и 52,3% соответственно (267,3% и 76,0% при приеме простой смеси). Уровень общего белка в сыворотке крови больных гепатитом контрольных мышей снижался до 63,2% (100% – у интактных здоровых животных), в то время как применение заявляемого препарата увеличивало этот показатель до 89,7%. При применении простой смеси уровень общего белка составлял лишь 79,1% от такового для здоровых контрольных животных.
Таким образом, применение предлагаемого препарата положительно влияло на дезинтоксикационные функции печени животных с острым лекарственным гепатитом. При этом эффект от комплексного препарата превышал эффект от препарата сравнения (простой смеси силибинина и фосфатидилхолина).
Пример 3. Противоопухолевая активность липосомной композиции, включающей экстракты расторопши пятнистой и эхинацеи и соевый лецитин.
Исследование противоопухолевой активности композиций проводили на модели меланомы линии В16 у мышей C57BI/6. Для индукции солидных опухолей мышам вводили подкожно клеточную суспензию (2·105 клеток в 0,1 мл физиологического раствора). Экспериментальным животным внутривенно вводили заявляемый комплексный препарат в физиологическом растворе. В качестве препарата сравнения использовали водную суспензию простой смеси, содержащей экстракты расторопши и эхинацеи и соевый лецитин в тех же количествах, вводимую внутрижелудочно через зонд. Препараты вводили один раз в неделю, всего три приема, начиная с 3 дня после прививки опухоли. Каждая экспериментальная группа состояла из шести животных, контрольная – из десяти. Размер солидных опухолей измеряли один раз в 2-3 дня. Объем опухоли вычисляли по формуле 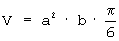 , где а – короткий, b – длинный диаметр опухоли. Относительный размер опухолей (ОРО) определяли по формуле: , где а – короткий, b – длинный диаметр опухоли. Относительный размер опухолей (ОРО) определяли по формуле: 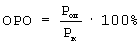 , где Роп – средний размер опухолей в опытной группе, Рк – средний размер опухолей у контрольных животных. Увеличение продолжительности жизни леченых животных по сравнению с контролем определяли по формуле: , где Роп – средний размер опухолей в опытной группе, Рк – средний размер опухолей у контрольных животных. Увеличение продолжительности жизни леченых животных по сравнению с контролем определяли по формуле: 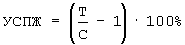 , где Т – СПЖ леченых животных, дни, С – СПЖ контрольных животных, дни. , где Т – СПЖ леченых животных, дни, С – СПЖ контрольных животных, дни.
Результаты исследования приведены в таблице 3. Как видно из таблицы, противоопухолевый эффект от применения простой смеси был слабовыраженным. В то же время применение заявляемого липосомного комплексного препарата оказывало значительный ингибирующий эффект в отношении роста опухолей, а также приводило к существенному увеличению продолжительности жизни животных по сравнению с контролем.
| Таблица 3 |
| Препарат |
ОРО, % |
УСПЖ, % |
| Физ. раствор (контроль) |
100 |
– |
| Смесь [экстракт расторопши пятнистой/экстракт эхинацеи/соевый лецитин], водная суспензия внутрижелудочно |
76,2 |
20,3 |
| Липосомная композиция, те же компоненты, водный раствор внутривенно |
51,9 |
52,0 |
Таким образом, применение веществ фенольной природы, входящих в состав заявляемого комплексного препарата, значительно увеличивает их противоопухолевый эффект за счет повышенной биодоступности и применения в виде инъекционной формы.
Формула изобретения
1. Профилактическая композиция, применяемая для предупреждения или лечения патологических процессов и поддержания высокого уровня функциональной активности организма, включающая комбинации одного или нескольких экстрактов лекарственных растений, содержащих вещества фенольной природы, и фосфолипид, отличающаяся тем, что вещества фенольной природы заключены в оболочку из фосфолипида, выбранного из группы: фосфолипиды из бычьего или свиного мозга или кожи, фосфатидилхолин, фосфатидилсерин, фосфатидилэтаноламин, содержащие одинаковые или различные ацильные группы, яичный лецитин, при этом оболочка выполнена в форме липосом, содержащих холестерол в количестве 11-40%.
2. Профилактическая композиция по п.1, отличающаяся тем, что вещества фенольной природы выбраны из группы: 5,6,7,4 -тетраоксифлавон, 5,6,7-триоксифлавон, g-схизандрин, апигенин, астрагалин, ауреузидин, виснагин, виснадин, гесперидин, гиперозид, дезоксисхизандрин, дигидросамидин, дигидросилибин, изоликвиритигенин, изорамнитин, инокостерон, кверцетин, кверцитрин, квинквелозид, келлин, кемпферол, лептозидин, ликвиритигенин, лютеолин, мирицетин, нарингенин, пиранокумарин, розавин, рутин, салидрозид, силидианин, силибинин, силикристин, скополетин, сульфуретин, схизандрин, схизандрол, тилирозид, трицин, умбеллиферон, 6-метокси-7,8-диоксикумарин, фурокумарин, экдистерон, энтеграстероны, 6,7-диоксикумарин и их производные. -тетраоксифлавон, 5,6,7-триоксифлавон, g-схизандрин, апигенин, астрагалин, ауреузидин, виснагин, виснадин, гесперидин, гиперозид, дезоксисхизандрин, дигидросамидин, дигидросилибин, изоликвиритигенин, изорамнитин, инокостерон, кверцетин, кверцитрин, квинквелозид, келлин, кемпферол, лептозидин, ликвиритигенин, лютеолин, мирицетин, нарингенин, пиранокумарин, розавин, рутин, салидрозид, силидианин, силибинин, силикристин, скополетин, сульфуретин, схизандрин, схизандрол, тилирозид, трицин, умбеллиферон, 6-метокси-7,8-диоксикумарин, фурокумарин, экдистерон, энтеграстероны, 6,7-диоксикумарин и их производные.
РИСУНКИ
PC4A – Регистрация договора об уступке патента СССР или патента Российской Федерации на изобретение
Прежний патентообладатель:
Автономная некоммерческая организация Научно-технический центр “Фармбиопресс”
(73) Патентообладатель:
Луценко Сергей Викторович
(73) Патентообладатель:
Луценко Елена Валерьевна
Договор № РД0041315 зарегистрирован 25.09.2008
Извещение опубликовано: 10.11.2008 БИ: 31/2008
|
|