Патент на изобретение №2158712
|
||||||||||||||||||||||||||
(54) СПОСОБ ПОЛУЧЕНИЯ ГИДРИДА ЦЕРИЯ
(57) Реферат: Изобретение относится к способу получения гидрида церия различных составов и фаз. Результат способа: расширение технологических возможностей получения гидрида церия состава СеН2 для использования в различных технологических процессах. Безводный хлорид церия и гидрид лития нагревают при 700-1000°С в инертной атмосфере. Реакционную массу выгружают в охлажденную воду. Сушат продукт спиртом. При термообработке при 700-740°С получают гидрид церия состава СеН2,73. Если термообработку ведут при 720°С с последующим повышением температуры до 1000°С, то получают СеН2, содержащий  и и  -фазы. 2 з.п. ф-лы. -фазы. 2 з.п. ф-лы.
Изобретение относится к способу получения гидридов переходных металлов, а именно к получению гидрида церия различных составов и фаз, таких как CeH2 (  – и – и  – фазы) и CeH3.
Разработка способов получения высокодисперсного церия (ВДЦ) представляет практический интерес. В качестве источника ВДЦ может использоваться гидрид церия. Промышленные металлургические способы приводят к получению компактного металла в виде слитков, диспергирование которых представляет большие трудности.
ВДЦ может найти применение в синтезе различных соединений церия, таких как, например: – фазы) и CeH3.
Разработка способов получения высокодисперсного церия (ВДЦ) представляет практический интерес. В качестве источника ВДЦ может использоваться гидрид церия. Промышленные металлургические способы приводят к получению компактного металла в виде слитков, диспергирование которых представляет большие трудности.
ВДЦ может найти применение в синтезе различных соединений церия, таких как, например:  -Ce2S3, интерметаллидов. На основе -Ce2S3, интерметаллидов. На основе  -Ce2S3 получены пигменты, используемые в пластиках, резине, красках, косметике, красителях и покровных материалах (ЕР 680930, М.кл. C 01 F 17/00, 1995 [1]). Интерметаллиды, содержащие церий, предложены в качестве металлогидридных электродов высокоемких и стабильных к циклированию аккумуляторов (Петрий О.А., Васина С.Я., Коробов И.И., Успехи химии, т. 65, вып. 3, 195 (1996) [2]).
Теоретический и практический интерес представляют магнитные свойства интерметаллидов церия (Физика и химия редкоземельных элементов. Справочник. М. : Металлургия, 1982, 336 с. [3]).
Традиционно используемый метод синтеза ди- и тригидрида церия связан с применением вакуумной установки Сивертса. В реактор установки загружают измельченный церий (куски массой 1 – 3 г), тщательно очищенные от поверхностных окислов, систему вакуумируют до давления 10-3-10-4 Тор, затем заполняют очищенным водородом. Температура составляет 700-800oC для синтеза дигидрида церия (Михеева В.И., Кост М.Е., Журнал неорган. химии, т. 3, 260 (1958) [4]; Mulford R. N. R., Holley C.E., J. Phys. Chem., 59, 1222 (1955) [5]) и 150-200oC для тригидрида церия (Михеева В.И., Кост М.Е., ДАН СССР, т. 115, N 1, 100 (1957) [6]).
Для получения дигидрида церия также применяют получасовое нагревание тригидрида при 400oC и непрерывном откачивании выделяющегося водорода (Кост М.Е., Журнал неорган. химии, т. 2, 2689 (1957) [7]).
По своей термической устойчивости тригидрид церия резко отличается от дигидрида церия. В то время как разложение тригидрида начинается при ~ 200oC, дигидрид практически устойчив до 800-900oC. Его интенсивное разложение наступает лишь после плавления при 1080oC, но даже при 1200oC водород еще не удаляется полностью (Михеева В.И., Кост М.Е., Успехи химии, т. 29, вып. 1, 55 (1960) [8]).
Дигидрид церия менее активен в реакциях с водой и кислотами, чем тригидрид (Кост М.Е., Журнал неорган. химии, т. 2, 2689 (1957) [7]).
Меньшая активность дигидрида согласно гипотезе (Libowitz G.G., Gibb T.R. R., J. Phys. Chem., 60, 510 (1956) [9]) обусловлена тем, что в дигидриде выше содержание металлической связи по сравнению с тригидридом.
При прямом взаимодействии водорода с церием обнаружены две фазы гидрида церия состава CeH2, имеющие кубические гранецентрированные решетки с периодами 5.581 -Ce2S3 получены пигменты, используемые в пластиках, резине, красках, косметике, красителях и покровных материалах (ЕР 680930, М.кл. C 01 F 17/00, 1995 [1]). Интерметаллиды, содержащие церий, предложены в качестве металлогидридных электродов высокоемких и стабильных к циклированию аккумуляторов (Петрий О.А., Васина С.Я., Коробов И.И., Успехи химии, т. 65, вып. 3, 195 (1996) [2]).
Теоретический и практический интерес представляют магнитные свойства интерметаллидов церия (Физика и химия редкоземельных элементов. Справочник. М. : Металлургия, 1982, 336 с. [3]).
Традиционно используемый метод синтеза ди- и тригидрида церия связан с применением вакуумной установки Сивертса. В реактор установки загружают измельченный церий (куски массой 1 – 3 г), тщательно очищенные от поверхностных окислов, систему вакуумируют до давления 10-3-10-4 Тор, затем заполняют очищенным водородом. Температура составляет 700-800oC для синтеза дигидрида церия (Михеева В.И., Кост М.Е., Журнал неорган. химии, т. 3, 260 (1958) [4]; Mulford R. N. R., Holley C.E., J. Phys. Chem., 59, 1222 (1955) [5]) и 150-200oC для тригидрида церия (Михеева В.И., Кост М.Е., ДАН СССР, т. 115, N 1, 100 (1957) [6]).
Для получения дигидрида церия также применяют получасовое нагревание тригидрида при 400oC и непрерывном откачивании выделяющегося водорода (Кост М.Е., Журнал неорган. химии, т. 2, 2689 (1957) [7]).
По своей термической устойчивости тригидрид церия резко отличается от дигидрида церия. В то время как разложение тригидрида начинается при ~ 200oC, дигидрид практически устойчив до 800-900oC. Его интенсивное разложение наступает лишь после плавления при 1080oC, но даже при 1200oC водород еще не удаляется полностью (Михеева В.И., Кост М.Е., Успехи химии, т. 29, вып. 1, 55 (1960) [8]).
Дигидрид церия менее активен в реакциях с водой и кислотами, чем тригидрид (Кост М.Е., Журнал неорган. химии, т. 2, 2689 (1957) [7]).
Меньшая активность дигидрида согласно гипотезе (Libowitz G.G., Gibb T.R. R., J. Phys. Chem., 60, 510 (1956) [9]) обусловлена тем, что в дигидриде выше содержание металлической связи по сравнению с тригидридом.
При прямом взаимодействии водорода с церием обнаружены две фазы гидрида церия состава CeH2, имеющие кубические гранецентрированные решетки с периодами 5.581 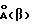 и 5.645 и 5.645  0.003 0.003 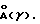 Образование двух фаз связано с различным расположением водорода в решетке церия: в Образование двух фаз связано с различным расположением водорода в решетке церия: в  -фазе заняты все тетраэдрические пустоты решетки, тогда как -фазе заняты все тетраэдрические пустоты решетки, тогда как  -фаза характеризуется размещением атомов водорода в октаэдрических положениях (Ayphassorho C., C.r., 244, N 13, 1766 (1957) [10]).
Недостатком известных способов (Михеева В.И., Кост М.Е., Журнал неорган. химии, т. 3, 260 (1958) [4]; Mulford R.N.R., Holley C.E., J. Phys. Chem., 59, 1222 (1955) [5]; Михеева В.И., Кост М. Е., ДАН СССР, т: 115, N 1, 100 (1957) [6] ) является то, что для приготовления гидрида церия требуется получение чистого мелкораздробленного порошка металлического церия, очищенного от поверхностных окислов, специальные вакуумные установки (вакуум 10-3 – 10-4 Тор), очищенный молекулярный водород в температурном интервале 200-800oC.
Наиболее близким способом-прототипом является получение порошков гидридов скандия, иттрия и эрбия взаимодействием хлоридов указанных металлов с гидридом лития при 800-900oC (Камарзин А.А., Соколов В.В., Трушникова Л.Н., Савельева М.В., Стонога Ю.А. Пат. РФ N 2013460 от 21.08.1992, опубл. Б.И. N 10, с. 77 (1994) [11]).
Недостаток способа состоит в том, что он ограничен примерами получения редкоземельных металлов скандия, иттрия и эрбия, при этом гипотеза об образовании промежуточных гидридов указанных металлов не подтверждена экспериментально: отсутствуют данные рентгенофазового анализа, подтверждающие состав этих соединений.
Задачей изобретения является расширение технологических возможностей получения гидрида церия состава CeH2, имеющего большую химическую устойчивость по сравнению с CeH3, с целью обеспечения возможности использования в различных технологических процессах как CeH3, так и CeH2.
Поставленная задача решается тем, что термическую обработку смеси безводного хлорида церия с гидридом лития проводят при 720-1000oC с последующим выщелачиванием водой и высушиванием целевого продукта. При этом получают гидрид церия состава CeH2, представленного -фаза характеризуется размещением атомов водорода в октаэдрических положениях (Ayphassorho C., C.r., 244, N 13, 1766 (1957) [10]).
Недостатком известных способов (Михеева В.И., Кост М.Е., Журнал неорган. химии, т. 3, 260 (1958) [4]; Mulford R.N.R., Holley C.E., J. Phys. Chem., 59, 1222 (1955) [5]; Михеева В.И., Кост М. Е., ДАН СССР, т: 115, N 1, 100 (1957) [6] ) является то, что для приготовления гидрида церия требуется получение чистого мелкораздробленного порошка металлического церия, очищенного от поверхностных окислов, специальные вакуумные установки (вакуум 10-3 – 10-4 Тор), очищенный молекулярный водород в температурном интервале 200-800oC.
Наиболее близким способом-прототипом является получение порошков гидридов скандия, иттрия и эрбия взаимодействием хлоридов указанных металлов с гидридом лития при 800-900oC (Камарзин А.А., Соколов В.В., Трушникова Л.Н., Савельева М.В., Стонога Ю.А. Пат. РФ N 2013460 от 21.08.1992, опубл. Б.И. N 10, с. 77 (1994) [11]).
Недостаток способа состоит в том, что он ограничен примерами получения редкоземельных металлов скандия, иттрия и эрбия, при этом гипотеза об образовании промежуточных гидридов указанных металлов не подтверждена экспериментально: отсутствуют данные рентгенофазового анализа, подтверждающие состав этих соединений.
Задачей изобретения является расширение технологических возможностей получения гидрида церия состава CeH2, имеющего большую химическую устойчивость по сравнению с CeH3, с целью обеспечения возможности использования в различных технологических процессах как CeH3, так и CeH2.
Поставленная задача решается тем, что термическую обработку смеси безводного хлорида церия с гидридом лития проводят при 720-1000oC с последующим выщелачиванием водой и высушиванием целевого продукта. При этом получают гидрид церия состава CeH2, представленного  – и – и  -фазами.
При 700-740oC и аналогичной вышеприведенной обработке получают гидрид церия состава CeH2.73. Наблюдаемая примесная фаза CeO2, вероятно, образуется в результате гидролиза и окисления неустойчивого и химически активного CeH2.73.
Отличительными признаками изобретения являются: один из реагентов, последовательность и режимы термической обработки, получение конечного продукта гидрида церия двух составов – CeH2 в виде -фазами.
При 700-740oC и аналогичной вышеприведенной обработке получают гидрид церия состава CeH2.73. Наблюдаемая примесная фаза CeO2, вероятно, образуется в результате гидролиза и окисления неустойчивого и химически активного CeH2.73.
Отличительными признаками изобретения являются: один из реагентов, последовательность и режимы термической обработки, получение конечного продукта гидрида церия двух составов – CeH2 в виде  – и – и  -фаз и CeH2.73.
Заявляемый интервал температур подобран экспериментально и является оптимальным.
Применимость способа иллюстрируется примерами.
Пример 1. Получение гидрида церия состава CeH2.73 -фаз и CeH2.73.
Заявляемый интервал температур подобран экспериментально и является оптимальным.
Применимость способа иллюстрируется примерами.
Пример 1. Получение гидрида церия состава CeH2.73Тигель из стали (марка 1Х18Н9Т) с перемешанной шихтой, состоящей из безводного хлорида церия (III) (3.50 г, 0.014 г/мол) и гидрида лития (0.51 г, 0.064 г/мол), помещают в кварцевый реактор и устанавливают в печь. Реактор во время процесса продувают очищенным инертным газом. Температуру печи повышают в течение 90 мин до 740oC и после выдержки при этой температуре в течение 50 мин нагрев отключают. После охлаждения образовавшуюся реакционную смесь порциями выгружают в воду, охлажденную льдом. Порошок целевого продукта отфильтровывают, вытесняют из него воду спиртом, затем гексаном. Продукт хранят под гексаном. По данным рентгенофазового анализа идентифицирована единственная фаза гидрида церия состава CeH2.73 с примесью CeO2. Параметры решеток, 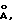 отн. %: отн. %:CeH2.73 – 5.525 – 79% CeO2 – 5.403 – 21% Литературные данные: CeH2.73 a = 5.53 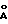 Кост М.Е., Гольдер Г.А., Журнал неорган, химии, т. 7, 1488 (1959) [12]); CeO2 a = 5.4110 Кост М.Е., Гольдер Г.А., Журнал неорган, химии, т. 7, 1488 (1959) [12]); CeO2 a = 5.4110  (PDF. Inorganic Phases. Alphabetical Index. International Centre for Diffraction Data. USA. 4-0593 (1988) [13]).
Пример 2. Получение гидрида церия состава CeH2 ( (PDF. Inorganic Phases. Alphabetical Index. International Centre for Diffraction Data. USA. 4-0593 (1988) [13]).
Пример 2. Получение гидрида церия состава CeH2 ( – и – и  -фазы) -фазы)Состав шихты: безводный хлорид церия (III) (4.00 г, 0.0162 г/мол) и гидрид лития (1.00 г, 0.126 г/мол). Процесс проводят аналогично примеру 1. Температуру печи повышают в течение 40 мин до 720oC и после выдержки при этой температуре в течение 75 мин снова повышают в течение 30 мин до 1000oC, затем нагрев отключают. По данным рентгенофазового анализа идентифицированы две фазы гидрида церия CeH2 (  и и  ) с параметрами решеток, ) с параметрами решеток, 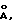 отн. %: отн. %:(  ) – 5.564 – 68% ) – 5.564 – 68%(  ) – 5.637 – 32% ) – 5.637 – 32%Литературные данные для фаз, 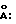 (  ) – 5.581 ) – 5.581(  ) – 5.645 (Ayphassorho C., C. r., 244, N 13, 1766 (1957) ) – 5.645 (Ayphassorho C., C. r., 244, N 13, 1766 (1957)[10]). Оксиды церия не обнаружены. Формула изобретения
 и и  фазы, термообработку ведут вначале при 720oC, а затем повышают температуру до 1000oC. фазы, термообработку ведут вначале при 720oC, а затем повышают температуру до 1000oC.
MM4A Досрочное прекращение действия патента из-за неуплаты в установленный срок пошлины за
Дата прекращения действия патента: 29.12.2008
Дата публикации: 10.05.2011
|
||||||||||||||||||||||||||
