Патент на изобретение №2306315
|
||||||||||||||||||||||||||
(54) СПОСОБ ПОЛУЧЕНИЯ E-2-АРОИЛМЕТИЛЕН-1-ФЕНИЛ-1,2,3,4-ТЕТРАГИДРОХИНАЗОЛИН-4-ОНОВ
(57) Реферат:
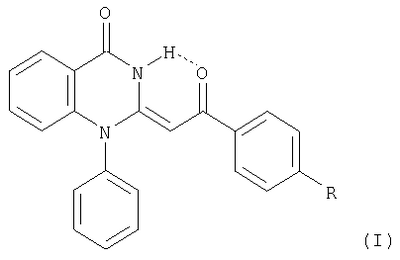
Изобретение относится к новому способу получения новых Е-2-ароилметилен-1-фенил-1,2,3,4-тетрагидрохиназолин-4-онов общей формулы (I), которые обладают флуоресцентными свойствами и могут быть использованы в качестве веществ для маркировки, копирования, распознавания и в качестве добавок для светоотражающих красок, а также как промежуточные соединения для получения новых гетероциклических соединений. В соединениях общей формулы (I) R означает: Н(а), СН3(б), Cl(в). Способ их получения заключается в том, что 5-арил-2,3-дигидро-2,3-фурандионы подвергают взаимодействию с амидом N-фенилантраниловой кислоты в среде инертного апротонного растворителя с последующим выделением целевых продуктов. Предпочтительно, процесс ведут при 79-80°С с использованием в качестве инертного растворителя бензола. 1 н. и 2 з.п. ф-лы.
(56) (продолжение): CLASS=”b560m”al. Troponoids.3-Syntesis and Antiallergy Activiti of N-Troponyloxamic Acid Esters. J.Med.Chem., 1979, v.22, №10, p.1184. НОВИКОВ А.А. и др. Гетероциклизация амида N,N-фенилантраниловой кислоты под действием ароилкетенов. ЖОрХ, 2005, т.41, вып.8, с.1234-1235.
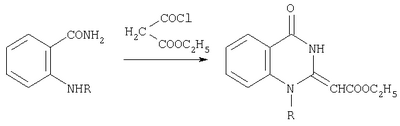
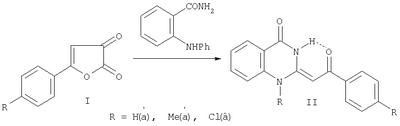
Изобретение относится к области органической химии, а именно к новым индивидуальным соединениям класса хиназолинонов и к способу их получения, которые проявляют флуоресцентные свойства и могут быть использованы в качестве исходных продуктов для синтеза, новых гетероциклических систем, а также в качестве веществ для маркировки образцов и добавок для светоотражающих красок. Известны бензоксазин-4-оны с ароилметиленовой группой в положении 2, обладающие устойчивой флуоресценцией, которые могут найти применение в качестве меток для защиты документов и добавок в светоотражающие краски (см. пат. РФ №2240333, опубл. 20.11.04 г.). Известны производные хиназолин-4-она с арильными заместителями в положении 2 или хиноксалины, сэтоксикарбонилметиленовой группой в положении 2, обладающие устойчивой флуоресценцией (см. Б.М.Красовицкий, Б.М.Болотин «Органические люминофоры», изд. Химия, Москва, с.112-114). Из литературы известны структурные аналоги заявленных соединений Е-2-этоксикарбонилметилен-1-замещенные-1,2,3,4-тетрагидрохиназолин-4-оны (Chem. Pharm. Bull. 1983. Vol.31. No. 7. Р. 2234-2243). Синтез осуществляется по следующей схеме: Данным способом невозможно получить Е-2-ароилметилен-1-фенил-1,2,3,4-тетрагидрохиназолин-4-оны, проявляющие флуоресцентные свойства. Задачей изобретения является разработка простого, одностадийного способа получения не описанных в литературе Е-2-ароилметилен-1-фенил-1,2,3,4-тетрагидрохиназолин-4-онов, проявляющих флуоресцентные свойства, а также расширение арсенала средств, используемых в качестве меток для защиты документов от копирования и добавок в светоотражающие краски. Поставленная задача осуществляется путем кипячения 5-фенил-2,3-дигидро-2,3-фурандиона с амидом N-фенилантраниловой кислоты в инертном апротонном растворителе по схеме: Процесс ведут при температуре 79-80°С, а в качестве инертного апротонного растворителя используют бензол. Соединения II (а-в) в твердом состоянии обладают устойчивой флуоресценцией (излучение в области желтого света при Из патентной и технической литературы не были выявлены способы получения Е-2-ароилметилен-1-фенил-1,2,3,4-тетрагидрохиназолин-4-онов, на основании чего можно сделать вывод о соответствии заявленного технического решения критериям патентоспособности “новизна” и “изобретательский уровень”. Изобретение иллюстрируется следующими примерами. Пример 1. Е-2-Фенацилиден-1-фенил-1,2,3,4-тетрагидро-4-хиназолон. Раствор 1.42 г (8.15 ммоль) 5-фенил-2,3-дигидро-2,3-фурандиона (соединение Ia) и 1.73 г (8.15 ммоль) амида N-фенилантраниловой кислоты в 25 мл абсолютного бензола кипятят в течение 3 ч, охлаждают, выпавший осадок отфильтровывают, кристаллизуют из бензола. Получают 1.22 г (44%). Соединение IIa. C22H16N2О2. Тпл 299-300°С. Найдено, %: С 77.60; Н 4.75; N 8.25. Вычислено, %: С 77.63; Н 4.74; N 8.23. Пример 2. Е-2-п-Толуоилметилен-1-фенил-1,2,3,4-тетрагидро-4-хиназолон. Раствор 1.53 г (8.15 ммоль) 5-п-толил-2,3-дигидро-2,3-фурандиона (соединение Ia) и 1.73 г (8.15 ммоль) амида N-фенилантраниловой кислоты в 25 мл абсолютного бензола кипятят в течение 3 ч, охлаждают, выпавший осадок отфильтровывают, кристаллизуют из бензола. Получают 1.30 г (46%). Соединение IIб. C23H18N2О2. Тпл 253-255°С. Найдено, %: С 77.95; Н 5.13; N 7.92. Вычислено, %: С 77.93; Н 5.12; N 7.90. Пример 3. Е-2-п-Хлорбензоилметилен-1-фенил-1,2,3,4-тетрагидро-4-хиназолон. Раствор 1.70 г (8.15 ммоль) 5-фенил-2,3-дигидро-2,3-фурандиона (соединение Ia) и 1.73 г (8.15 ммоль) амида N-фенилантраниловой кислоты в 25 мл абсолютного бензола кипятят в течение 3 ч, охлаждают, выпавший осадок отфильтровывают, кристаллизуют из бензола. Получают 1.12 г (37%). Соединение IIв. C22H15ClN2О2. Тпл 250-251°С (из бензола). Найдено, %: С 70.48; Н 4.04; Cl 9.50; N 7.50. Вычислено, %: С 70.50; Н 4.03; Cl 9.46; N 7.47. Соединения II (а-в) – бесцветные высокоплавкие кристаллические вещества, хорошо растворимые в ДМСО, ДМФА, труднорастворимые в бензоле, спирте, нерастворимые в воде и алканах. В ПК спектрах соединений II (а-в), снятых в вазелиновом масле, присутствуют широкая полоса валентных колебаний группы NH, вовлеченной в образование ВВС Н-хелатного типа, в области 3060-3080 см-1, полоса поглощения лактамной карбонильной группы хиназолинового цикла в области 1670-1690 см-1, широкая полоса поглощения ароильной карбонильной группы, вовлеченной в образование внутримолекулярной водородной связи Н-хелатного типа, в области 1605-1615 см-1. В спектрах ЯМР 1Н соединений II (а-в), снятых в растворе в ДМСО-d6, помимо группы сигналов ароматических протонов в области 6.43-8.24 м.д. присутствуют синглет винильного протона в области 4.90-4.99 м.д., синглет протона группы NH в области 14.59-14.71 м.д. и синглет протонов метильной группы при 2.33 м.д. (соединение IIб). В спектре ЯМР 13С соединения IIa наряду с сигналами атомов углерода ароматических колец в области 123.84-142.91 м.д. имеются сигнал винильного атома углерода фенацилиденового фрагмента при 79.29 м.д., сигналы атомов углерода хиназолонового цикла при 116.88 (С4a), 142.60 (С8a), 154.56 (С4), 158.49 (С2) и кетонного карбонила COPh при 186.08 м.д., что хорошо согласуется с предложенной структурой. Предлагаемый способ прост в осуществлении, одностадиен и позволяет получить неописанные в литературе Е-2-ароилметилен-1-фенил-1,2,3,4-тетрагидрохиназолин-4-оны с выходом 37-46%. Оптическая активность предлагаемых соединений позволяет использовать их в индивидуальном виде и в составах для нанесения флуоресцирующих меток, невидимых при обычном освещении, на денежных купюрах или документах, требующих защиты от копирования. В смеси с красителями они могут использоваться для изготовления флуоресцирующих красок, свечение которых вызывается УФ и коротковолновым видимым излучением.
Формула изобретения
1. Способ получения Е-2-ароилметилен-1-фенил-1,2,3,4-тетрагидрохиназолин-4-онов общей формулы где R-Н(а),СН3(б),Cl(в), отличающийся тем, что 5-арил-2,3-дигидро-2,3-фурандионы подвергают взаимодействию с амидом N-фенилантраниловой кислоты в среде инертного апротонного растворителя с последующим выделением целевых продуктов. 2. Способ по п.1, отличающийся тем, что процесс ведут при 79-80°С. 3. Способ по п.1 или 2, отличающийся тем, что в качестве инертного растворителя используют бензол.
MM4A – Досрочное прекращение действия патента СССР или патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 01.02.2008
Извещение опубликовано: 20.09.2009 БИ: 26/2009
|
||||||||||||||||||||||||||

 =580-595 нм) при облучении УФ лампой
=580-595 нм) при облучении УФ лампой