|
|
(21), (22) Заявка: 2004132163/14, 05.11.2004
(24) Дата начала отсчета срока действия патента:
05.11.2004
(43) Дата публикации заявки: 20.04.2006
(46) Опубликовано: 20.09.2007
(56) Список документов, цитированных в отчете о
поиске:
РЯБОВ С. В. и др., «Обезболивание на догоспитальном этапе», Вестник интенсивной терапии, 2004, №1, стр.25-28. RU 2107488 C1, 27.03.1998. ГРЕБЕНЧИКОВ О.А. и др., «Компьютерный мониторинг ЭЭГ при анестезии с использованием даларгина», Применение малых регуляторных пептидов в анестезиологии и интенсивной терапии. М., 1999, стр.15-17. PEDERSEN СВ. et
Адрес для переписки:
143040, Московская обл., Одинцовский р-н, г. Голицыно, Петровское ш., 48, Главный клинический военный госпиталь ФСБ России
|
(72) Автор(ы):
Кичин Владимир Владимирович (RU),
Рябов Сергей Валентинович (RU)
(73) Патентообладатель(и):
Главный клинический военный госпиталь ФСБ России (RU)
|
(54) СПОСОБ ОБЕЗБОЛИВАНИЯ РАНЕНЫХ И ПОСТРАДАВШИХ НА ДОГОСПИТАЛЬНОМ ЭТАПЕ ПРИ ДЛИТЕЛЬНОЙ МЕДИЦИНСКОЙ ЭВАКУАЦИИ СОЧЕТАННЫМ ВВЕДЕНИЕМ ТОРАДОЛА И ДАЛАРГИНА
(57) Реферат:
Изобретение относится к медицине, а именно к анестезиологии, реаниматологии, полевой хирургии, медицине катастроф, и может быть использовано с целью обезболивания раненых и пострадавших на догоспитальном этапе при длительной медицинской эвакуации. Для этого осуществляют сочетанное внутримышечное введение торадола и даларгина. При этом торадол вводят 30 мг каждые 4-6 часов, а даларгин вводят по 1 мг каждые 2-3 часа. Способ позволяет достичь быстрого адекватного обезболивания в любых условиях за счет оптимально подобранного сочетания препаратов, а также режимов и способов их введения. 8 ил., 5 табл.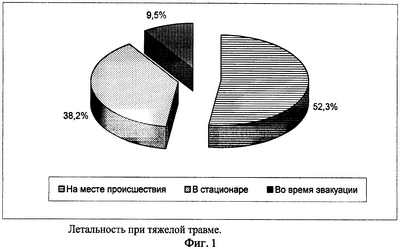
(56) (продолжение):
CLASS=”b560m”al. Emergency prehospitalization treatment of cardiac arrest in the municipality of Copenhagen. Ugeskr Laeger. 1991 Jul 29; 153(31):2184-6., реферат.
Изобретение относится к способу обезболивания раненых и пострадавших на догоспитальном этапе при длительной медицинской эвакуации сочетанным введением торадола и даларгина.
Ухудшение состояния пациентов на догоспитальном этапе, как правило, связано с перерывом (или уменьшением объема) в проведении интенсивной терапии, недостаточным мониторингом, неэффективным обезболиванием (3, 5, 9, 11, 15). Последняя проблема особенно актуальна для раненых и пострадавших, т.к. именно у данной группы пациентов особенно велик риск развития травматического шока в результате неэффективного обезболивания (3,10,14).
Вместе с тем травматический шок является одной из основных причин до- и ранней госпитальной летальности у пострадавших с тяжелой травмой (6, 7, 11).
Проведенный анализ (по данным ГКВГ ФСБ России) показал, что 52,3% летальных исходов при тяжелой травме наступают на месте происшествия, 9,5% – при транспортировке пострадавших и 38,2% – в стационаре (фиг.1). Таким образом, 61,8% пострадавших погибает на догоспитальном этапе.
Основными причинами высокой летальности на догоспитальном этапе являются – в 82,6% случаях отсутствие оказания помощи на месте происшествия и во время транспортировки, в 66,3% пострадавшие гибнут от неоказания первой медицинской помощи.
Если медицинская помощь оказана в период до 30 минут от момента получения повреждений, летальность среди пострадавших составляет 11%, если медицинская помощь не оказывалась в течение двух часов и более, летальность возрастает до 72%.
Оказание медицинской помощи на догоспитальном этапе всегда носит чрезвычайный характер, как правило, сводится к мероприятиям противошоковой терапии, но как показывают данные, вследствие различных причин медицинская помощь на догоспитальном этапе зачастую оказывается не в полном объеме или не оказывается вообще.
Основными причинами этого являются – в 68% случаев недостаточная квалификация оказывающих первую медицинскую помощь (не владениями навыками проведения в/в инфузии), в 24% характер полученной травмы (отсутствие доступа к периферическим венам), массовое поступление раненых и пострадавших в условиях дефицита квалифицированных медицинских кадров. Снижение летальности при тяжелых травмах возможно при повышении эффективности противошоковой терапии, при обеспечении простоты и доступности используемых для этого способов.
Авторы поставили перед собой задачу повысить эффективность противошоковой терапии на догоспитальном этапе при медицинской эвакуации и невозможности проведения внутривенной инфузии.
Предлагаемое изобретение относится к медицине и может быть использовано в анестезиологии и реаниматологии, полевой хирургии, медицине катастроф, скорой медицинской помощи.
Сущность изобретения в том, что раненым и пострадавшим каждые 4-6 часов вводят внутримышечно по 30 мг торадола и каждые 2-3 часа также внутримышечно по 1 мг даларгина.
Известные ранее способы анальгезии раненых и пострадавших на догоспитальном этапе при медицинской эвакуации, аналоги предложенному изобретению, основаны на использовании наркотических анальгетиков различных групп (1, 4, 8,1 4).
Применение наркотических анальгетиков на догоспитальном этапе медицинской эвакуации характеризуется высоким числом осложнений, количество которых значительно увеличивается при длительной эвакуации вследствие увеличения дозы вводимых препаратов, что в конечном итоге повышает процент летальности (1, 10, 11).
В качестве прототипа изобретения выбран способ (13) анальгезии на догоспитальном этапе сочетанным использованием торадола и даларгина.
| Таблица 1 |
| Прототип |
Сразу после ранения вводят 30 мг торадола в/м, при необходимости, инъекции повторяют каждые 4-6 часов. Сразу после ранения вводят 1 мг даларгина в/м и начинают в/в инфузию со скоростью 40-50 мкг/кг·мин. |
| Предложенный способ |
Сразу после ранения в/м вводят 30 мг торадола и 1 мг даларгина. Инъекции 30 мг в/м торадола повторяют каждые 4-6 часов, инъекции 1 мг в/м даларгинаповторяют каждые 2-3 часа на всем протяжении догоспитального этапа медицинской эвакуации. |
Недостатками прототипа является следующее.
1. Способ требует владениями навыками внутривенных инфузий, следовательно, применим только квалифицированными медицинскими кадрами.
2. В полевых условиях, при массовом поступлении раненых, в условиях недостатка медицинских специалистов невозможно обеспечить наблюдение за процессом внутривенной инфузии.
3. Вследствие специфичных условий догоспитального этапа медицинской эвакуации и транспортировки, зачастую не представляется возможным обеспечить внутривенный путь введения препаратов.
4. Невозможность проведения внутривенной инфузии, вследствие характера полученной травмы или ранения; например: ранения конечностей с обширными участками размозжения мягких тканей, обширные термические или химические ожоги, кровоостанавливающие жгуты на конечностях и др., делающие невозможным доступ к периферическим венам.
5. Не отработана временная схема и цикличность внутримышечного введения даларгина при эвакуации данной категории пострадавших с поля боя, места катастрофы или происшествия, что повышает риск возможных осложнений и соответственно летальных исходов на догоспитальном этапе.
В изобретении решена задача повышения и доступности проведения эффективной противошоковой терапии, снижения риска возможных осложнений и летальности, при догоспитальной эвакуации и невозможности проведения внутривенной инфузии даларгина.
Указанная задача решена тем, что внутримышечно вводят каждые 4-6 часов по 30 мг торадола и каждые 2-3 часа по 1 мг даларгина.
Способ выполняется в следующей последовательности: раненым или пострадавшим, например, с массивным размозжением мягких тканей конечностей или термическими и химическими ожогами кожных покровов в местах доступа к периферическим венам каждые 4-6 часов внутримышечно вводят 30 мг торадола. За время менее 4 часов наблюдают стойкий анальгетический эффект. При интервале введения более 6 часов анальгетический эффект снижается (2).
Одновременно внутримышечно, но каждые 2-3 часа, вводят 1 мг даларгина.
Циклы введения препаратов по представленной в изобретении схеме повторяют на всем протяжении догоспитальной медицинской эвакуации.
Целесообразность режима внутримышечного введения даларгина по 1 мг через 2-3 часа в сочетании с торадолом по 30 мг каждые 4-6 часов на всем протяжении догоспитального этапа медицинской эвакуации получено авторами в наблюдениях (экспериментально), на основании изучения концентраций в крови раненых и пострадавших АКТГ, кортизола и оценке интенсивности боли по ВАШ.
В процессе проведения исследования авторы применяли несколько режимов сочетанного внутримышечного введения даларгина у 28 пострадавших, через: 4-6 часов (n-3), 3-4 часа (n-5), 2-3 часа (n-12) и каждый час (n-8).
Полученные результаты отраженны в фиг. 2,3,4.
Из полученных результатов (фиг.2) видно, что при внутримышечном введении даларгина с интервалом 4-6 часов суммарная оценка интенсивности боли в оцениваемой группе составила 6,2±2,9 балла. Данный результат никак нельзя признать удовлетворительным, т.к. согласно распространенному мнению боль интенсивностью более 4 баллов считается достаточно сильной.
При интервале введения 3-4 часа средняя оценка интенсивности боли составила 4,8±1,1 балла, что также является неудовлетворительным результатом.
Наилучший обезболивающий эффект был достигнут в группах больных, которым даларгин вводился через 2-3 часа и каждый час. Оценка интенсивности боли по ВАШ снизилась до 2,7±0,3 баллов при интервале введения 2-3 часа, и 2,7±0,2 баллов при интервале введения ежечасно. Процесс транспортировки не оказывал существенного влияния на изучаемый показатель.
Изменения содержания АКТГ при интервале введения даларгина через 4-6 часов не носили статистически значимого характера, так как соответствовали показателям с монотерапией торадолом. Уменьшение интервала введения до 3-4 часов приводил к уменьшению уровня АКТГ на 47% (р<0,05), тогда как введение даларгина через 2-3 часа и ежечасно приводило к снижению обсуждаемого показателя на 57% (р<0,01) от исходного (фиг.3).
Стоит отметить также, что в абсолютном выражении – 28±1,9 пМоль/л уровень АКТГ в группах больных, получавших даларгин через 2-3 часа и ежечасно, не превышал нормальных значений.
Уровень кортизола во всех исследуемых группах после получения травмы превышал нормальные значения более чем в два раза (10,1±0,3). Тенденция к его снижению под влиянием обезболивания отмечена во всех исследуемых группах, однако статистически значимый характер она носила только в группах введения даларгина через 2-3 часа и ежечасно (4,4±0,14 и 4,5±0,25 соответственно), где уровень кортизола достиг верхней границы нормы, снизившись по отношению к исходу на 56.5% (р<0.05) (фиг.4).
Таким образом, полученные данные указывают, что наибольшей эффективностью, при сочетанном внутримышечном введении 30 мг торадола и 1 мг даларгина обладает режим введения даларгина с интервалом 2-3 часа. Интервал введения даларгина ежечасно не может быть признан целесообразным, так как ведет к увеличению количества инъекций препарата и соответственно его расхода без повышения эффективности обезболивания и стресс-протекции.
После определения режима внутримышечного введения даларгина разработанный способ обезболивания раненых и пострадавших с тяжелой травмой на догоспитальном этапе при медицинской эвакуации применен в 55 случаях.
Исследуя эффективность оказания помощи на догоспитальном этапе медицинской эвакуации, авторы обследовали 146 пострадавших в возрасте от 22 до 67 лет (средний возраст 44,3 года), которым по тем или иным причинам в процессе эвакуации невозможно было обеспечить в/в инфузию. Мужчины составили 71%. Всем пострадавшим проводились мероприятия по остановке кровотечения, поддержания проходимости дыхательных путей, транспортная иммобилизация.
Пострадавшие были разделены на группы в зависимости от вида обезболивания.
1. Сразу после получения травмы вводили 20 мг промедола в/м, при необходимости инъекции повторяли каждые 4-6 часов (54 пациента).
2. Сразу после получения травмы вводили 30 мг торадола в/м, при необходимости инъекции повторяли каждые 4-6 часов (37 пациентов).
3. Сразу после получения травмы вводили 30 мг торадола и 1 мг даларгина в/м, при необходимости инъекции повторяли каждые 4-6 часов по 30 мг торадола, и каждые 2-3 часа по 1 мг даларгина (55 пациентов).
Оценку тяжести шока проводили в соответствии с “Рекомендациями по оказанию скорой медицинской помощи в Российской Федерации”. На месте происшествия шок I степени диагностирован у 67 человек (46%), шок II степени – у 38 человек (26%), шок II степени – у 41 человека (28%).
Таблица 2
Данные обследования на месте происшествия |
| Показатели |
Норма |
Шок I (n 67) |
Шок II (n 38) |
Шок III (n 41) |
| Баллы по шкале Глазго |
15 |
14,25±1,30 |
9,33±1,35 |
5,20±1,40 |
| Среднее АД мм рт.ст. |
70-105 |
90,25±4,48 |
75,59±2,38 |
58,75±3,93 |
| ЧСС уд/мин |
60-90 |
95,00±7,71 |
112,67±4,48 |
143,40±5,08 |
| Шоковый индекс Альговера |
0,5 |
0,82±0,17 |
1,16±0,16 |
1,91±0,10 |
В стационар в живых доставлено 132 пострадавших, 14 человек погибли, общая летальность в процессе эвакуации составила 9,5%.
Таблица 3
Основные показатели пострадавших 1 группы при поступлении в стационар |
| Показатели |
Норма |
Шок I (n 22) |
Шок II (n 12) |
Шок III (n 13) |
| Баллы по шкале Глазго |
15 |
13,4±1,20 |
8,13±1,42 |
5,00±1,60 |
| Среднее АД мм рт.ст. |
70-105 |
92,20±4,60 |
70,43±2,07 |
56,25±3,58 |
| ЧСС уд/мин |
60-90 |
86,48±7,33 |
95,93±4,29 |
112,38±4,29 |
| Шоковый индекс Альговера |
0,5 |
0,78±0,15 |
1,02±0,14 |
1,38±0,25 |
В 1 группе в состоянии шока I степени доставлено в стационар 47% пострадавших, в состоянии шока II степени 25%, в состоянии шока III степени 28%, что практически не отличается от исходных данных. Использование промедола характеризовалось высоким числом осложнений, связанных с анальгезией (фиг.5).
Летальность в группе составила 13% (7 человек) (фиг.6).
Таблица 4
Основные показатели пострадавших 2 группы при поступлении в стационар |
| Показатели |
Норма |
Шок I (n 15) |
Шок II (n 9) |
Шок III (n 8) |
| Баллы по шкале Глазго |
15 |
15,00±0,00 |
13,50±0,50 |
5,00±1,50 |
| Среднее АД мм рт.ст. |
70-105 |
100,25±5,25 |
84,50±7,50 |
75,00±7,50 |
| ЧСС уд/мин |
60-90 |
90,38±8,51 |
102,67±7,23 |
118,52±5,72 |
| Шоковый индекс Альговера |
0,5 |
0,72±0,25 |
0,96±0,18 |
1,14±0,37 |
Во 2 группе в состоянии шока I степени доставлено в стационар 47% пострадавших, в состоянии шока II степени 28%, в состоянии шока III степени 25%, что также мало отличается от исходных данных. Введение торадола характеризуется меньшим числом осложнений, связанных с анальгезией, но явно оказывает недостаточный стресс-протективный эффект.
Летальность в группе составила 11% (4 человека) (фиг.6).
Таблица 5
Основные показатели пострадавших 3 группы при поступлении в стационар |
| Показатели |
Норма |
Шок I (n 32) |
Шок II (n 12) |
Шок III (n 9) |
| Баллы по шкале Глазго |
15 |
15,00±0,00 |
14,50±0,40 |
6,00±1,80 |
| Среднее АД мм рт.ст. |
70-105 |
100,50±6,92 |
91,75±7,75 |
80,25±5,50 |
| ЧСС уд/мин |
60-90 |
72,00±10,00 |
80,00±5,20 |
92,25±5,50 |
| Шоковый индекс Альговера |
0,5 |
0,57±0,17 |
0,72±0,16 |
0,97±0,18 |
В 3 группе в состоянии шока I степени доставлено в стационар 60% пострадавших, в состоянии шока II степени 23%, в состоянии шока III степени 17%, что указывает на эффективность противошоковой терапии предлагаемым способом, при минимуме побочных эффектов (фиг. 5).
Летальность при эвакуации в группе была минимальной и составила 5,5% (3 человека), снизившись по отношению к общей на 42% (фиг.6).
Клинический пример №1.
Группа военнослужащих выполняла боевое задание в горных условиях. В ходе проводимой операции 3-е военнослужащих подорвались на мине «ловушке», в результате получили минно-взрывную травму (МВТ).
1 военнослужащий – МВТ, тяжелая сочетанная травма (ТСТ), травматический шок тяжелой степени, закрытая черепно-мозговая травма (ЧМТ), ушиб головного мозга тяжелой степени, ушиб органов грудной клетки, ушиб органов брюшной полости, оскольчатое ранение шеи с перерывом левой наружной сонной артерии, внутренней яремной вены слева, множественные оскольчатые ранения мягких тканей, баротравма.
2 военнослужащий – МВТ, ТСТ, травматический шок тяжелой степени, закрытая ЧМТ, ушиб головного мозга тяжелой степени, ушиб органов грудной клетки, ушиб органов брюшной полости, оскольчатое проникающее ранение брюшной полости с повреждением тонкого кишечника, перитонит, множественные оскольчатые ранения мягких тканей, баротравма.
3 военнослужащий – МВТ, ТСТ, закрытая ЧМТ, травматический шок тяжелой степени, ушиб головного мозга тяжелой степени, ушиб органов грудной клетки, ушиб органов брюшной полости, травматический отрыв правой нижней конечности на уровне средней трети голени, множественные оскольчатые ранения мягких тканей, баротравма.
Группу сопровождал штатный санитарный инструктор – стрелок, который оказывал им первую медицинскую помощь, которая включала в себя: остановку активного кровотечения, иммобилизацию, наложения асептических повязок, обезболивание. Поскольку санитарные инструкторы готовятся для оказания первой медицинской помощи, они не владеют техникой внутривенных инфузий, и соответственно их медицинские укладки не комплектуются соответствующими приспособлениями и инфузионными средами.
Обезболивание раненых проводилось путем внутримышечного введения торадола и даларгина. Сразу после ранения вводят 30 мг торадола и 1 мг даларгина внутримышечно.
В силу характера местности (горные тропы, отсутствие места для посадки вертолета) и боевых условий (высокий риск обстрела) эвакуация раненых проводилась их сослуживцами до места посадки вертолета, которая составила около 23 часов. Эвакуация вертолетом осуществлялась до аэропорта в течение 2 часов, с последующей эвакуацией самолетом в сопровождении врача, где раненым оказывалась первая врачебная помощь, в госпиталь раненые доставлены через 29 часов с момента получения ранения.
Оценка боли по визуально аналоговой шкале боли (ВАШ) проводилась раненым сразу после ранения, но до начала обезболивания и в последующем каждые 2 часа на всем протяжении периода эвакуации.
Для оценки уровня кортизола (гормона «индикатора стресса») у раненых в процессе эвакуации отбирались пробы крови «из пальца» в специальные пластиковые пробирки из иммунолюминометрического набора. Первая проба бралась сразу после ранения, но до начала обезболивания, последующие по возможности ежечасно. Анализ проб осуществлялся в лаборатории госпиталя иммунолюминометрическим методом.
В процессе эвакуации через 4 часа оценка боли по шкале ВАШ вырастала в среднем на 20 – 30%, что требовало последующего внутримышечного введения 30 мг торадола (фиг.7).
Как показал анализ проведенных проб, уровень кортизола в крови раненых начинал нарастать через 2 часа после внутримышечного введения даларгина, что требовало последующего внутримышечного введения 1 мг даларгина, соблюдение данной цикличности внутримышечного введения препарата позволяло удержать уровень кортизола в крови раненых на субнормальных цифрах на всем протяжении эвакуации, что говорит о высоком уровне стресс-протекции (фиг.8).
При поступлении данной группы раненых в госпиталь не было выявлено осложнений, связанных с обезболиванием, несмотря на длительность и сложность догоспитального периода эвакуации.
Клинический пример №2.
Военнослужащий N при проведении работ в автопарке, в результате несоблюдения мер безопасности при работе с горючесмазочными материалами получил ожоги обеих верхних конечностей II-III ст.
В медицинском пункте фельдшер ввел 30 мг торадола и 1 мг даларгина внутримышечно одновременно. Санитарным автомобилем пострадавший в течение 6 часов транспортирован в госпиталь.
В процессе транспортировки оценка интенсивности боли по шкале ВАШ, составляющая 2,5 балла, выросла на 4 часе до 3,4. Потребовалось последующее введение 30 мг торадола и 1 мг даларгина внутримышечно. Оценка интенсивности боли снизилась до 2,4 балла и оставалась на этом уровне до поступления пострадавшего в госпиталь, вследствие чего дополнительного догоспитального обезболивания пострадавшему не требовалось. В процессе транспортировки у пострадавшего параметры гемодинамики и внешнего дыхания находились в нормальных пределах, он доставлен в госпиталь в ясном сознании.
Предложенный способ позволяет следующие.
1. Проводить эффективную противошоковую терапию пострадавшим с тяжелой травмой при невозможности обеспечения внутривенной инфузии.
2. Исключить опасные для жизни расстройства дыхания и кровообращения, вследствие проводимой анальгезии.
3. Снизить летальность на догоспитальном этапе медицинской эвакуации пострадавших с тяжелой травмой на 42%.
4. Способ прост и доступен в применении, не требует высокой квалификации медицинского персонала, применим при массовом поступлении раненых, позволяет проводить одномоментную транспортировку нескольких раненых одной медицинской бригадой, т.к. не требует постоянного мониторинга жизненно важных функций.
5. При промышленном выпуске данных препаратов в форме шприц-тюбиков и комплектовании ими индивидуальных аптечек проводить эффективную противошоковую терапию в виде само- и взаимопомощи на месте происшествия.
Список литературы.
1. Беляков В.А. Соловьев И.К. Наркотические анальгетики. -Нижний Новгород.: Нижегородская ярмарка, 2001.
2. Беляков В.А. Соловьев И.К. Ненаркотические анальгетики. -Нижний Новгород.: Нижегородская ярмарка, 2001.
3. Вартапетов М.Г. Интенсивная терапия пострадавших в дорожно-транспортных происшествиях на догоспитальном этапе. Автореферат диссертации на соискание ученой степени кандидата медицинских наук. М., 1997, 32 с.
4. Дарбинян Т.М., Звягин А.А., Цитовский Ю.И. Анестезия и реанимация на этапах медицинской эвакуации. М.: Медицина, 1984.
10. Мельников А.А., Маковик М.В., Агалаков В.Н., Ульяновская Л.И. Анестезия и интенсивная терапия при тяжелой сочетанной травме на догоспитальном этапе в условиях специализированной бригады скорой медицинской помощи. 2 Научно-практическая конференция “Анестезия и интенсивная терапия в неприспособленных условиях”. Голицыно, 1999, с.91-93.
12. Рябов Г.А. Семенов В.Н. Терентьева Л.Н. Экстренная анестезиология. – М.: – Медицина, 1983.
14. Стажадзе Л.Л., Бобринская И.Г., Александрова А.В., Максимов В.Р., Мельникова Л.А., Тишков Е.А.. “Современные проблемы обезболивания при скелетной травме нижних конечностей и таза на догоспитальном этапе”. Анестезиология и реанимация. 1997, №4, с.83-89.
15. Элькис И.А., Вартапетов М.Г. Мониторинг и интенсивная терапия пострадавших с тяжелой транспортной травмой на догоспитальном этапе. Вестник интенсивной терапии. М., 1997, №4, с.8-9.
16. Цибуляк В.Н., Цибуляк Г.Н.. Травма, боль, анестезия. М.: Медицина, 1994.
Формула изобретения
Способ обезболивания раненых и пострадавших на догоспитальном этапе при медицинской эвакуации сочетанным внутримышечным введением 30 мг торадола каждые 4-6 ч и даларгина, отличающийся тем, что даларгин вводят по 1 мг каждые 2-3 ч.
РИСУНКИ
|
|