Патент на изобретение №2305681
|
||||||||||||||||||||||||||
(54) ПРОИЗВОДНЫЕ БЕНЗОТИАДИАЗЕПИНА, СПОСОБ ИХ ПОЛУЧЕНИЯ (ВАРИАНТЫ)
(57) Реферат:
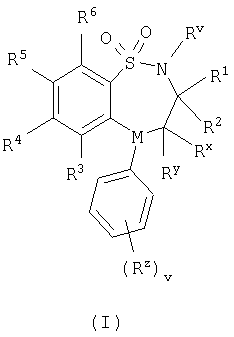
Настоящее изобретение относится к производным бензотиадиазепина общей формулы (I)
в которой М представляет собой -N-, один из R4 и R5 представляет собой группу формулы
кольцо А представляет собой арил, их фармацевтически приемлемым солям, сольватам, сольватам таких солей или их сложным эфирам и амидам, которые способны к гидролизу в условиях in vivo. Соединения могут быть использованы в качестве ингибиторов переноса желчных кислот в подвздошной кишке (IBAT) для лечения гиперлипемии. Описаны также способы получения соединений формулы I. 6 н. и 8 з.п. ф-лы.
Настоящее изобретение относится к производным бензотиазепина и бензотиадиазепина, или к их фармацевтически приемлемым солям, сольватам, сольватам таких солей и их пролекарствам. Эти бензотиазепины и бензотиадиазепины обладают ингибирующим действием по отношению к переносу желчных кислот в подвздошной кишке (IBAT) и, таким образом, являются ценными при лечении болезненных состояний, связанных с гиперлипемическими условиями, и эти соединения являются полезными в способах лечения теплокровного животного, такого как человек. Изобретение также относится к способам получения указанных производных бензотиазепина и бензотиадиазепина, к фармацевтическим композициям, которые их содержат, и к их применению для приготовления лекарственных средств для ингибирования переноса желчных кислот в подвздошной кишке (IBAT) у теплокровного животного, такого как человек. В настоящее время хорошо известно, что гиперлипемические состояния, связанные с повышенными концентрациями общего холестерина и липопротеина низкой плотности, холестерина, являются главными факторами риска при сердечно-сосудистых атеросклеротических заболеваниях (например, “Coronary Heart Disease: Reducing the Risk; a Worldwide View” Assman G., Carmena R. Cullen P. и др.; Circulation 1999, 100, 1930-1938 и “Diabetes and Cardiovascular Disease: A Statement for Healthcare Professionals from the American Heart Association” Grundy S, Benjamin I., Burke G., и др.; Circulation, 1999, 100, 1134-46). Было обнаружено, что нарушение циркуляции желчных кислот в полости кишечника уменьшает уровень холестерина. Известные подходы к лечению для уменьшения концентрации холестерина предусматривают, например, лечение при помощи ингибиторов HMG-CoA редуктазы, предпочтительно статинов, таких как симвастатин и флувастатин, или лечение при помощи веществ, которые связывают желчные кислоты, таких как смолы. Обычно применяемые вещества, которые связывают желчную кислоту, представляют собой, например, холестирамин и холестирол. В последнее время был предложен еще один подход к лечению (“Bile Acids and Lipoprotein Metabolism: a Renaissance for Bile Acids in the Post Statin Era” Angelin B, Eriksson M, Rudling M; Current Opinion on Lipidology, 1999, 10, 269-74), который предусматривает применение веществ, которые обладают ингибирующим действием по отношению к переносу желчных кислот в подвздошной кишке (IBAT). Обратное всасывание желчных кислот из желудочно-кишечного тракта представляет собой естественный физиологический процесс, который происходит преимущественно в подвздошной кишке при помощи механизма переноса желчных кислот в подвздошной кишке (IBAT). Ингибиторы IBAT могут применятся для лечения гиперхолестеринемии (см., например, “Interaction of bile acids and cholesterol with nonsystemic agents having hypocholesterolaemic properties”, Biochemica et Biophysica Acta, 1210 (1994) 255-287). Таким образом, подходящие соединения, которые обладают такой ингибиторной активностью по отношению к IBAT, также являются пригодными для лечения гиперлипемических состояний. Замещенные соединения, обладающие такой ингибирующей активностью по отношению к IBAT, описаны, см., например, гиполипемические соединения, описанные в международных заявках WO 93/16055, WO 94/18183, WO 94/18184, WO 96/05188, WO 96/08484, WO 96/16051, WO 97/33882, WO 98/38182, WO 99/35135, WO 98/40375, WO 99/35153, WO 99/64409, WO 99/64410, WO 00/01687, WO 00/47568, WO 00/61568, WO 01/68906, DE 19825804, WO 00/38725, WO 00/38726, WO 00/38727, WO 00/38728, WO 00/38729, WO 01/68906 и ЕР 0864582. Дальнейшим объектом настоящего изобретения является применение соединений по изобретению для лечения дислипидемических состояний и расстройств, таких как гиперлипемия, гипертриглицеридемия, гипербеталипопротеинемия (повышение содержания липопротеинов низкой плотности), гиперпребеталипопротеинемия (повышение содержания липопротеинов очень низкой плотности), гиперхиломикронемия, гиполипопротеинемия, гиперхолестеринемия, гиперлипопротеинемия и гипоальфалипопротеинемия (понижение содержания липопротеинов высокой плотности). Кроме того, предполагают, что эти соединения полезны для профилактики и лечения разных клинических состояний, таких как атеросклероз, артериосклероз, аритмия, гипертромботические состояния, нарушения функции сосудов, нарушения функции эндотелия, сердечная недостаточность, заболевания коронарных сосудов, сердечно-сосудистые заболевания, инфаркт миокарда, стенокардия, заболевания периферических сосудов, воспаление сердечно-сосудистых тканей, таких как сердца, клапанов, сосудистой сети, артерий и вен, аневризмы, стенозы, рестенозы, образование бляшек на стенках сосудов, образование полосок жировых отложений на стенках сосудов, инфильтрация лейкоцитами, моноцитами и/или макрофагами, утолщение внутренней оболочки сосудов, истончение средней оболочки сосудов, инфекции и хирургические травмы и тромбозы сосудов, удар и переходящие нарушения мозгового кровообращения. Настоящее изобретение основывается на открытии того, что определенные бензотиазепиновые и бензотиадиазепиновые соединения неожиданно ингибируют IBAT. Предполагают, что такие свойства являются ценными для лечения болезненных состояний, связанных с гиперлипемическими условиями. Таким образом, настоящее изобретение относится к соединению формулы (I):
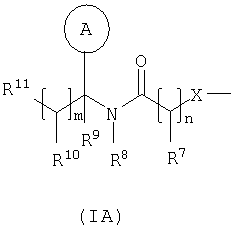
в которой Rv выбран из водорода или C1-С6-алкила; один из R1 и R2 выбран из водорода, C1-С6-алкила или С2-С6-алкенила, а другой выбран из C1-С6-алкила или С2-С6-алкенила; Rx и Ry независимо выбраны из водорода, гидроксильной группы, аминогруппы, меркаптогруппы, C1-С6-алкила, C1-С6-алкокси, N-(C1-С6-алкил)амино, N,N-(C1-С6-алкил)2амино, C1-С6-алкилS(O)а, где а представляет собой 0-2; М выбран из -N- или -СН-; Rz выбран из галогена, нитрогруппы, цианогруппы, гидроксильной группы, аминогруппы, карбоксильной группы, карбамоила, меркаптогруппы, сульфамоила, C1-С6-алкила, C1-С6-алкенила, С2-С6-алкинила, C1-С6-алкокси, C1-С6-алканоила, C1-С6-алканоилокси, N-(C1-С6-алкил)амино, N,N-(C1-С6-алкил)2амино, C1-С6-алканоиламино, N-(C1-С6-алкил)карбамоила, N,N-(C1-С6-алкил)2карбамоила, C1-С6-алкилS(O)а, где а представляет собой 0-2, C1-С6-алкоксикарбонила, N-(C1-С6-алкил)сульфамоила и N,N-(C1-С6-алкил)2сульфамоила; v представляет собой 0-5; один из R4 и R5 представляет собой группу формулы (IA):
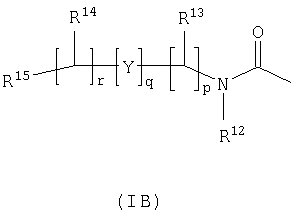
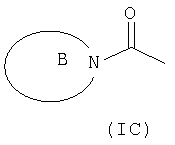
R3 и R6 и другой R4 и R5 независимо выбраны из водорода, галогена, нитрогруппы, цианогруппы, гидроксильной группы, аминогруппы, карбоксильной группы, карбамоила, меркаптогруппы, сульфамоила, С1-С4-алкила, С2-С4-алкенила, С2-С4-алкинила, С1-С4-алкокси, С1-С4-алканоила, С1-С4-алканоилокси, N-(С1-С4-алкил)амино, N,N-(С1-С4-алкил)2амино, С1-С4-алканоиламино, N-(С1-С4-алкил)карбамоила, N,N-(С1-С4-алкил)2карбамоила, С1-С4-алкилS(O)а, где а представляет собой 0-2, С1-С4-алкоксикарбонила, N-(С1-С4-алкил)сульфамоила и N,N-(С1-С4-алкил)2сульфамоила; где R3 и R6 и другой R4 и R5 необязательно могут быть замещены у атома углерода одним или несколькими R16; Х представляет собой -О-, -N(Ra)-, -S(O)b– или -СН(Ra)-; где Ra представляет собой водород или C1-С6-алкил и b представляет собой 0-2; кольцо А представляет собой арил или гетероарил; где кольцо А необязательно замещено одним или несколькими заместителями, выбранными из R17; R7 представляет собой водород, С1-С4-алкил, карбоцикл или гетероцикл; где R7 необязательно замещен одним или несколькими заместителями, выбранными из R18; R8 представляет собой водород или С1-С4-алкил; R9 представляет собой водород или С1-С4-алкил; R10 представляет собой водород, С1-С4-алкил, карбоцикл или гетероцикл; где R10 необязательно замещен одним или несколькими заместителями, выбранными из R19; R11 представляет собой карбоксильную группу, сульфогруппу, сульфиногруппу, фосфоногруппу, -P(O)(ORc)(ORd), -P(O)(OH)(ORc), -P(O)(OH)(Rd) или -P(O)(ORc)(Rd), где Rc и Rd независимо выбраны из C1-С6-алкила; или R11 представляет собой группу формулы (IB) или (IC):
в которой: Y представляет собой -N(Rn)-, -N(Rn)C(O)-, -N(Rn)C(O)(CRsRt)v(Rn)C(O)-, -O-, и -S(O)a-; где а представляет собой 0-2, v представляет собой 1-2, Rs и Rt независимо выбраны из водорода или С1-С4-алкила, необязательно замещенного R26, и Rn представляет собой водород или С1-С4-алкил; R12 представляет собой водород или С1-С4-алкил; R13 и R14 независимо выбраны из водорода, C1-С6-алкила, карбоцикла или гетероцикла; и когда q равен 0, R14 дополнительно может быть выбран из гидроксильной группы; где R13 и R14 необязательно независимо могут быть замещены одним или несколькими заместителями, выбранными из R20; R15 представляет собой карбоксильную группу, сульфогруппу, сульфиногруппу, фосфоногруппу, -P(O)(ORe)(ORf), -P(O)(OH)(ORe), -P(O)(OH)(ORe), или -P(O)(ORe)(ORf), где Re и Rf независимо выбраны из C1-С6-алкила; р представляет собой 1-3; где значения R13 могут быть одинаковыми или разными; q представляет собой 0-1; r представляет собой 0-3; где значения R14 могут быть одинаковыми или разными; m представляет собой 0-2; где значения R10 могут быть одинаковыми или разными; n представляет собой 1-3; где значения R7 могут быть одинаковыми или разными. Кольцо В представляет собой гетероцикл, связанный с атомом азота, замещенный у атома углерода одной группой, выбранной из R23, и необязательно дополнительно замещен у атома углерода одним или несколькими R24; и в котором, если указанный гетероцикл, связанный с атомом азота, содержит -NH- часть, то тот атом азота необязательно может быть замещен группой, выбранной из R25; R16, R17 и R18 независимо выбраны из галогена, нитрогруппы, цианогруппы, гидроксильной группы, аминогруппы, карбоксильной группы, карбамоила, меркаптогруппы, сульфамоила, С1-С4-алкила, С2-С4-алкенила, С2-С4-алкинила, С1-С4-алкокси, С1-С4-алканоила, С1-С4-алканоилокси, N-(С1-С4-алкил)амино, N,N-(С1-С4-алкил)2амино, С1-С4-алканоиламино, N-(С1-С4-алкил)карбамоила, N,N-(С1-С4-алкил)2карбамоила, С1-С4-алкилS(O)а, где а представляет собой 0-2, С1-С4-алкоксикарбонила, N-(С1-С4-алкил)сульфамоила и N,N-(С1-С4-алкил)2 сульфамоила; где R16, R17 и R18 независимо необязательно могут быть замещены у атома углерода одним или несколькими R21; R19, R20, R24 и R26 независимо выбраны из галогена, нитрогруппы, цианогруппы, гидроксильной группы, аминогруппы, карбоксильной группы, карбамоила, меркаптогруппы, сульфамоила, С1-С4-алкила, С2-С4-алкенила, С2-С4-алкинила, С1-С4-алкокси, С1-С4-алканоила, С1-С4-алканоилокси, N-(С1-С4-алкил)амино, N,N-(С1-С4-алкил)2амино, С1-С4-алканоиламино, N-(С1-С4-алкил)карбамоила, N,N-(С1-С4-алкил)2карбамоила, С1-С4-алкилS(O)а, где а представляет собой 0-2, С1-С4-алкоксикарбонила, N-(С1-С4-алкил)сульфамоила, N,N-(С1-С4-алкил)2сульфамоила, карбоцикла, гетероцикла, бензилоксикарбониламино, (С1-С4-алкил)3силила, сульфогруппы, сульфиногруппы, амидиногруппы, фосфоногруппы, P(O)(ORa)(ORb), -P(O)(OH)(ORa), -Р(О)(ОН)(Ra) или -P(O)(ORa)(Rb), где Ra и Rb независимо выбраны из C1-С6-алкила; где R19, R20, R24 и R26 независимо необязательно могут быть замещены у атома углерода одним или несколькими R22; R21 и R22 независимо выбраны из галогена, гидроксильной группы, цианогруппы, карбамоила, уреидогруппы, аминогруппы, нитрогруппы, карбоксильной группы, карбамоила, меркаптогруппы, сульфамоила, трифторметильной группы, трифторметоксигруппы, метила, этила, метокси, этокси, винила, аллила, этинила, метоксикарбонила, формила, ацетила, формамидо, ацетиламино, ацетокси, метиламино, диметиламино, N-метилкарбамоила, N,N-диметилкарбамоила, метилтио, метилсульфинила, мезила, N-метилсульфамоила и N-диметилсульфамоила; R23 представляет собой карбоксильную группу, сульфогруппу, сульфиногруппу, фосфоногруппу, -P(O)(ORg)(ORh), -Р(O)(ОН)(ORg), -Р(O)(ОН)(Rg) или -P(O)(ORg)(Rh), где Rg и Rh независимо выбраны из C1-С6-алкила; R25 выбран из C1-С6-алкила, C1-С6-алканоила, C1-С6-алкилсульфонила, C1-С6-алкоксикарбонила, карбамоила, N-(C1-С6-алкил)карбамоила, N,N-(C1-С6-алкил)карбамоила, бензила, бензилоксикарбонила, бензоила и фенилсульфонила; или его фармацевтически приемлемой соли, сольвату, сольвату такой соли или его пролекарству. В соответствии с другим вариантом осуществления настоящее изобретение относится к соединению формулы (I):
в которой: Rv выбран из водорода или C1-С6-алкила; один из R1 и R2 выбран из водорода или C1-С6-алкила, а другой выбран из C1-С6-алкила; Rx и Ry независимо выбраны из водорода, гидроксильной группы, аминогруппы, меркаптогруппы, C1-С6-алкила, C1-С6-алкокси, N-(C1-С6-алкил)амино, N,N-(C1-С6-алкил)2амино, C1-С6-алкилS(O)а, где а представляет собой 0-2; М выбран из -N- или -СН-; Rz выбран из галогена, нитрогруппы, цианогруппы, гидроксильной группы, аминогруппы, карбоксильной группы, карбамоила, меркаптогруппы, сульфамоила, C1-С6-алкила, С2-С6-алкенила, С2-С6-алкинила, C1-С6-алканоила, C1-С6-алканоилокси, N-(C1-С6-алкил)амино, N,N-(C1-С6-алкил)2амино, C1-С6-алканоиламино, N-(C1-С6-алкил)карбамоила, N,N-(C1-С6-апкил)2карбамоила, C1-С6-алкилS(O)а, где а представляет собой 0-2, C1-С6-алкоксикарбонила, N-(C1-С6-алкил)сульфамоила и N,N-(C1-С6-алкил)2сульфамоила; v представляет собой 0-5; один из R4 и R5 представляет собой группу формулы (IA):
R3 и R6 и другой R4 и R5 независимо выбраны из водорода, галогена, нитрогруппы, цианогруппы, гидроксильной группы, аминогруппы, карбоксильной группы, карбамоила, меркаптогруппы, сульфамоила, С1-С4-алкила, С2-С4-алкенила, С2-С4-алкинила, С1-С4алкокси, С1-С4-алканоила, С1-С4-алканоилокси, N-(С1-С4-алкил)амино, N,N-(С1-С4-алкил)2амино, С1-С4-алканоиламино, N-(С1-С4-алкил)карбамоила, -N,N-(С1-С4-алкил)2карбамоила, С1-С4-алкилS(O)а, где а представляет собой 0-2, С1-С4-алкоксикарбонила, N-(С1-С4-алкил)сульфамоила и N,N-(С1-С4-алкил)2 сульфамоила; где R3 и R6 и другой R4 и R5 необязательно могут быть замещены у атома углерода одним или несколькими R16; Х представляет собой -О-, -N(Ra)-, -S(O)b– или -СН(Ra)-; где Ra представляет собой водород или C1-С6-алкил и b представляет собой 0-2; кольцо А представляет собой арил или гетероарил; где кольцо А необязательно замещено одним или несколькими заместителями, выбранными из R17; R7 представляет собой водород, С1-С4-алкил, карбоцикл или гетероцикл; где R7 необязательно замещен одним или несколькими заместителями, выбранными из R18; R8 представляет собой водород или С1-С4-алкил; R9 представляет собой водород или С1-С4-алкил; R10 представляет собой водород, С1-С4-алкил, карбоцикл или гетероцикл; где R10 необязательно замещен одним или несколькими заместителями, выбранными из R19; R11 представляет собой карбоксильную группу, сульфогруппу, сульфиногруппу, фосфоногруппу, -Р(O)(ORc)(ORd), -P(O)(OH)(ORc), -Р(O)(ОН)(Rd) или -P(O)(ORc)(Rd), где Rc и Rd независимо выбраны из C1-С6-алкила; или R11 представляет собой группу формулы (IB):
в которой: Y представляет собой -N(Rn)-, -N[(Rn)C(O)-, -О-, и -S(O)a-; где а представляет собой 0-2 и Rn представляет собой водород или С1-С4-алкил; R12 представляет собой водород или С1-С4-алкил; R13 и R14 независимо выбраны из водорода, С1-С4-алкила, карбоцикла или гетероцикла; где R13 и R14 необязательно независимо могут быть замещены одним или несколькими заместителями, выбранными из R20; R15 представляет собой карбоксильную группу, сульфогруппу, сульфиногруппу, фосфоногруппу, -P(O)(ORe)(ORf), -P(OH)(ORe), -P(O)(OH)(Re) или -P(O)(ORe)(Rf), где Re и Rf независимо выбраны из C1-С6-алкила; р представляет собой 1-3; где значения R13 могут быть одинаковыми или разными; q представляет собой 0-1; r представляет собой 0-3; где значения R14 могут быть одинаковыми или разными; m представляет собой 0-2; где значения R10 могут быть одинаковыми или разными; n представляет собой 1-3; где значения R7 могут быть одинаковыми или разными; R16, R17 и R18 независимо выбраны из галогена, нитрогруппы, цианогруппы, гидроксильной группы, аминогруппы, карбоксильной группы, карбамоила, меркаптогруппы, сульфамоила, С1-С4-алкила, С2-С4-алкенила, С2-С4-алкинила, С1-С4-алкокси, С1-С4-алканоила, С1-С4-алканоилокси, N-(С1-С4-алкил)амино, N,N-(С1-С4-алкил)2амино, С1-С4-алканоиламино, N-(С1-С4-алкил)карбамоила, N,N-(С1-С4-алкил)2карбамоила, С1-С4-алкилS(O)а, где а представляет собой 0-2, С1-С4-алкоксикарбонила, N-(С1-С4-алкил)сульфамоила и N,N-(С1-С4-алкил)2сульфамоила; где R16, R17 и R18 независимо необязательно могут быть замещены у атома углерода одним или несколькими R21; R19 и R20 независимо выбраны из галогена, нитрогруппы, цианогруппы, гидроксильной группы, аминогруппы, карбоксильной группы, карбамоила, меркаптогруппы, сульфамоила, С1-С4-алкила, С2-С4-алкенила, С2-С4-алкинила, С1-С4-алкокси, С1-С4-алканоила, С1-С4-алканоилокси, N-(С1-С4-алкил)амино, N,N-(С1-С4-алкил)2амино, С1-С4-алканоиламино, N-(С1-С4-алкил)карбамоила, N,N(С1-С4-алкил)2карбамоила, С1-С4-алкилS(O)а, где а представляет собой 0-2, С1-С4-алкоксикарбонила, N-(С1-С4-алкил)сульфамоила, N,N-(С1-С4-алкил)2сульфамоила, карбоцикла, гетероцикла, сульфогруппы, сульфиногруппы, амидиногруппы, фосфоногруппы, -P(О)(ORa)(ORb), -P(OH)(ORa), -P(O)(OH)(Ra) или -P(O)(ORa)(Rb), где Ra и Rb независимо выбраны из C1-С6-алкила; где R19 и R20 независимо необязательно могут быть замещены у атома углерода одним или несколькими R22; R21 и R22 независимо выбраны из галогена, гидроксильной группы, цианогруппы, карбамоила, уреидогруппы, аминогруппы, нитрогруппы, карбоксильной группы, карбамоила, меркаптогруппы, сульфамоила, трифторметильной группы, трифторметоксигруппы, метила, этила, метокси, этокси, винила, аллила, этинила, метоксикарбонила, формила, ацетила, формамидо, ацетиламино, ацетокси, метиламино, диметиламино, N-метилкарбамоила, N,N-диметилкарбамоила, метилтио, метилсульфинила, мезила, N-метилсульфамоила и N,N-диметилсульфамоила; или его фармацевтически приемлемой соли, сольвату, сольвату такой соли или его пролекарству. В соответствии с другим вариантом осуществления, настоящее изобретение относится к соединению формулы (I):
в которой: Rv выбран из водорода или C1-С6-алкила; один из R1 и R2 выбран из водорода или C1-С6-алкила, а другой выбран из C1-С6-алкила; Rx и Ry независимо выбраны из водорода, гидроксильной группы, аминогруппы, меркаптогруппы, C1-С6-алкила, C1-С6-алкокси, N-(C1-С6-алкил)амино, N,N-(C1-С6-алкил)2амино, C1-С6-алкилS(O)а, где а представляет собой 0-2; М выбран из -N- или -СН-; Rz выбран из галогена, нитрогруппы, цианогруппы, гидроксильной группы, аминогруппы, карбоксильной группы, карбамоила, меркаптогруппы, сульфамоила, C1-С6-алкила, С2-С6-алкенила, С2-С6-алкинила, C1-С6-алкокси, C1-С6-алканоила, C1-C6-алканоилокси, N-(C1-С6-алкил)амино, N,N-(C1-С6-алкил)2амино, C1-С6-алканоиламино, N-(C1-С6-алкил)карбамоила, N,N-(C1-С6-алкил)2карбамоила, C1-С6-алкилS(O)а, где а представляет собой 0-2, C1-С6-алкоксикарбонила, N-(C1-С6-алкил)сульфамоила и N,N-(С1-С6-алкил)2сульфамоила; v представляет собой 0-5; один из R4 и R5 представляет собой группу формулы (IA):
R3 и R6 и другой R4 и R5 независимо выбраны из водорода, галогена, нитрогруппы, цианогруппы, гидроксильной группы, аминогруппы, карбоксильной группы, карбамоила, меркаптогруппы, сульфамоила, С1-С4-алкила, С2-С4-алкенила, C2-С4-алкинила, С1-С4-алкокси, С1-С4-алканоила, С1-С4-алканоилокси, N-(С1-С4-алкил)амино, N,N-(С1-С4-алкил)2амино, С1-С4-алканоиламино, N-(С1-С4-алкил)карбамоила, N,N-(С1-С4-алкил)2карбамоила, С1-С4-алкилS(O)а, где а представляет собой 0-2, С1-С4-алкоксикарбонила, N-(С1-С4-алкил)сульфамоила и N,N-(С1-С4-алкил)2 сульфамоила; где R3 и R6 и другой R4 и R5 необязательно могут быть замещены у атома углерода одним или несколькими R16; Х представляет собой -О-, -N(Ra)-, -S(O)b– или -CH(Ra)-; где Ra представляет собой водород или C1-С6-алкил и b представляет собой 0-2; кольцо А представляет собой арил или гетероарил; где кольцо А необязательно замещено одним или несколькими заместителями, выбранными из R17; R7 представляет собой водород, С1-С4-алкил, карбоцикл или гетероцикл; где R7 необязательно замещен одним или несколькими заместителями, выбранными из R18; R8 представляет собой водород или С1-С4-алкил; R9 представляет собой водород или С1-С4-алкил; R10 представляет собой водород, С1-С4-алкил, карбоцикл или гетероцикл; где R10 необязательно замещен одним или несколькими заместителями, выбранными из R19; R11 представляет собой карбоксильную группу, сульфогруппу, сульфиногруппу, фосфоногруппу, -P(ORc)(ORd), -Р(O)(ОН)(ORc), -Р(O)(ОН)(Rd) или -P(O)(ORc)(Rd), где Rc и Rd независимо выбраны из C1-С6-алкила; или R11 представляет собой группу формулы (IB) или (IC):
в которой: Y представляет собой -N(Rn)-, -N(Rn)C(O)-, -N(Rn)C(O)(CRsRt)vN(Rn)C(O)-, -О-, и -S(O)a-; где а представляет собой 0-2, v представляет собой 1-2, Rs и Rt независимо выбраны из водорода или С1-С4-алкила, необязательно замещенного R26, и Rn представляет собой водород или С1-С4-алкил; R12 представляет собой водород или С1-С4-алкил; R13 и R14 независимо выбраны из водорода, С1-С4-алкила, карбоцикла или гетероцикла; и когда q равен О, R14 дополнительно может быть выбран из гидроксильной группы; где R13 и R14 необязательно независимо могут быть замещены одним или несколькими заместителями, выбранными из R20; R15 представляет собой карбоксильную группу, сульфогруппу, сульфиногруппу, фосфоногруппу, -P(O)(ORe)(ORf), -P(O)(OH)(ORe), -P(O)(OH)(Re) или -P(O)(ORe)(Rf), где Re и Rf независимо выбраны из C1-С6-алкила; р представляет собой 1-3; где значения R13 могут быть одинаковыми или разными; q представляет собой 0-1; r представляет собой 0-3; где значения R14 могут быть одинаковыми или разными; m представляет собой 0-2; где значения R10 могут быть одинаковыми или разными; n представляет собой 1-3; где значения R7 могут быть одинаковыми или разными. Кольцо В представляет собой гетероцикл, связанный с атомом азота, замещенный у атома углерода одной группой, выбранной из R23, и необязательно дополнительно замещен у атома углерода одним или несколькими R24; и в котором, если указанный гетероцикл, связанный с атомом азота, содержит -NH-часть, то тот атом азота необязательно может быть замещен группой, выбранной из R25; R16, R17 и R18 независимо выбраны из галогена, нитрогруппы, цианогруппы, гидроксильной группы, аминогруппы, карбоксильной группы, карбамоила, меркаптогруппы, сульфамоила, С1-С4-алкила, С2-С4-алкенила, С2-С4-алкинила, С1-С4-алкокси, С1-С4-алканоила, С1-С4-алканоилокси, N-(С1-С4-алкил)амино, N,N-(C1-C7алкил)2амино, С1-С4-алканоиламино, N-(С1-С4-алкил)карбамоила, N,N-(С1-С4-алкил)2карбамоила, С1-С4-алкилS(O)а, где а представляет собой 0-2, С1-С4-алкоксикарбонила, N-(С1-С4-алкил)сульфамоила и N-(С1-С4-алкил)2сульфамоила; где R16, R17 и R18 независимо необязательно могут быть замещены у атома углерода одним или несколькими R21; R19, R20, R24 и R26 независимо выбраны из галогена, нитрогруппы, цианогруппы, гидроксильной группы, аминогруппы, карбоксильной группы, карбамоила, меркаптогруппы, сульфамоила, С1-С4-алкила, С2-С4-алкенила, С2-С4-алкинила, С1-С4-алкокси, С1-С4-алканоила, С1-С4-алканоилокси, N-(С1-С4-алкил)амино, -N,N-(С1-С4-алкил)2амино, С1-С4-алканоиламино, N-(С1-С4-алкил)карбамоила, N,N-(С1-С4-алкил)2карбамоила, С1-С4-алкилS(O)а, где а представляет собой 0-2, С1-С4-алкоксикарбонила, N-(С1-С4-алкил)сульфамоила, N,N-(С1-С4-алкил)2сульфамоила, карбоцикла, гетероцикла, бензилоксикарбониламино, сульфогруппы, сульфиногруппы, амидиногруппы, фосфоногруппы, -P(O)(ORa)(ORb), -P(O)(OH)(ORa), -Р(О)(ОН)(Ra) или -P(O)(ORa)(Rb), где Ra и Rb независимо выбраны из C1-С6-алкила; где R19, R20, R24 и R26 независимо необязательно могут быть замещены у атома углерода одним или несколькими R22; R21 и R22 независимо выбраны из галогена, гидроксильной группы, цианогруппы, карбамоила, уреидогруппы, аминогруппы, нитрогруппы, карбоксильной группы, карбамоила, меркаптогруппы, сульфамоила, трифторметильной группы, трифторметоксигруппы, метила, этила, метокси, этокси, винила, аллила, этинила, метоксикарбонила, формила, ацетила, формамидо, ацетиламино, ацетокси, метиламино, диметиламино, N-метилкарбамоила, N,N-диметилкарбамоила, метилтио, метилсульфинила, мезила, N-метилсульфамоила и N,N-диметилсульфамоила; R23 представляет собой карбоксильную группу, сульфогруппу, сульфиногруппу, фосфоногруппу, -P(O)(ORg)(ORh), -Р(O)(ОН)(ORg), -Р(O)(ОН)(Rg) или -Р(О)(ORg)(Rh), где Rg и Rh независимо выбраны из C1-С6-алкила; R25 выбран из C1-С6-алкила, C1-С6-алканоила, C1-С6-алкилсульфонила, C1-С6-алкоксикарбонила, карбамоила, N-(C1-С6-алкил)карбамоила, N,N-(C1-С6-алкил) карбамоила, бензила, бензилоксикарбонила, бензоила и фенилсульфонила; или его фармацевтически приемлемой соли, сольвату, сольвату такой соли или его пролекарству. В настоящем изобретении понятие “алкил” включает как алкильные группы с прямой цепью, так и с разветвленной цепью, однако относительно конкретных алкильных групп, таких как “пропил”, имеются в виду только группы с прямой цепью. Например, “C1-С6-алкил” включает С1-С4-алкил, C1-С3-алкил, пропил, изопропил и трет-бутил. Однако относительно конкретных алкильных групп, таких как ‘пропил’, подразумеваются только группы с прямой цепью, и относительно отдельных алкильных групп с разветвленной цепью, таких ‘изопропил’ подразумеваются только группы с разветвленной цепью. Аналогичное условие применяется и относительно других радикалов, например, “фенилC1-С6-алкил” может включать фенилC1-С6-алкил, бензил, 1-фенилэтил и 2-фенилэтил. Под понятием “галоген” подразумевают фтор, хлор, бром и йод. Если необязательных заместителей выбирают из “одной или нескольких” групп, то под этим подразумевают, что такое определение включает всех заместителей, которые могут быть выбраны из одной из указанных групп, или заместителей, которые могут быть выбраны из двух или нескольких указанных групп. “Гетероарил” представляет собой полностью ненасыщенную, моно- или бициклическую структуру, которая содержит 3-12 атомов, из которых по крайней мере один атом выбран из азота, серы или кислорода, который может, если специально не указанно иначе, быть связанным с атомом углерода или азота. Предпочтительно “гетероарил” относится к полностью ненасыщенной, моноциклической структуре, которая содержит 5 или 6 атомов, или к бициклической структуре, которая содержит 9 или 10 атомов, из которых по крайней мере один атом выбран из азота, серы или кислорода, который может, если специально не указано иначе, быть связанным с атомом углерода или азота. Примерами и подходящими значениями для понятия “гетероарил” являются тиенил, изоксазолил, имидазолил, пирролил, тиадиазолил, изотиазолил, триазолил, пиранил, индолил, пиримидил, пиразинил, пиридазинил, пиридил и хинолил. Предпочтительно понятие “гетероарил” относится к тиенилу или индолилу. “Арил” представляет собой полностью ненасыщенную, моно- или бициклическую углеродную структуру, которая содержит 3-12 атомов. Предпочтительно “арил” представляет собой моноциклическую структуру, которая содержит 5 или 6 атомов, или бициклическую структуру, которая содержит 9 или 10 атомов. Подходящими значениями для “арила” являются фенил или нафтил. В частности, “арил” представляет собой фенил. “Гетероцикл” представляет собой насыщенную, частично насыщенную или ненасыщенную, моно- или бициклическую структуру, которая содержит 3-12 атомов, из которых по крайней мере один атом выбран из азота, серы или кислорода, который может, если специально не указано иначе, быть связанным с атомом углерода или азота, где -СН2-группа необязательно может быть заменена группой -С(O)-, или кольцевой атом серы необязательно может быть окислен до S-оксидов. Предпочтительно “гетероцикл” представляет собой насыщенную, частично насыщенную или ненасыщенную, моно- или бициклическую структуру, которая содержит 5 или 6 атомов, из которых по крайней мере один атом выбран из азота, серы или кислорода, который может, если специально не указано иначе, быть связанным с атомом углерода или азота, где -СН2-группа необязательно может быть заменена группой -С(O)-, или кольцевой атом серы необязательно может быть окислен до S-оксида(ов). Примерами и подходящими значениями для понятия “гетероцикл” являются тиазолидинил, пирролидинил, пирролинил, 2-пирролидонил, 2,5-диоксопирролидинил, 2-бензоксазолинонил, 1,1-диоксотетрагидротиенил, 2,4-диоксоимидазолидинил, 2-оксо-1,3,4-(4-триазолинил), 2-оксазолидинонил, 5,6-дигидроурацилил, 1,3-бенздиоксолил, 1,2,4-оксадиазолил, 2-азабицикло[2.2.1]гептил, 4-тиазолидонил, морфолино, 2-оксотетрагидрофуранил, тетрагидрофуранил, 2,3-дигидробензофуранил, бензтиенил, тетрагидропиранил, пиперидил, 1-оксо-1,3-дигидроизоиндолил, пиперазинил, тиоморфолино, 1,1-диоксотиоморфолино, тетрагидропиранил, 1,3-диоксоланил, гомопиперазинил, тиенил, изоксазолил, имидазолил, пирролил, тиадиазолил, изотиазолил, 1,2,4-триазолил, 1,3,4-триазолил, пиранил, индолил, пиримидил, тиазолил, пиразинил, пиридазинил, пиридил, 4-пиридонил, хинолил и 1-изохинолонил. “Гетероцикл, связанный с атомом азота” представляет собой насыщенную, частично насыщенную или ненасыщенную, моно- или бициклическую структуру, которая содержит 3-12 атомов, из которых по крайней мере один атом представляет собой азот и гетероцикл, связанный с карбонильной группой формулы (IC) при помощи этого атома азота, которая дополнительно может содержать дополнительные гетероатомы, выбранные из азота, серы или кислорода, где -CH2-группа необязательно может быть заменена группой -С(O)-, или кольцевой атом серы необязательно может быть окислен до S-оксидов. Предпочтительно “гетероцикл, связанный с атомом азота” представляет собой насыщенную, частично насыщенную или ненасыщенную, моно- или бициклическую структуру, которая содержит 5 или 6 атомов, из которых по крайней мере один представляет собой азот и гетероцикл связанный с карбонильной группой формулы (IC) при помощи этого атома азота, которая дополнительно может содержать дополнительные гетероатомы, выбранные из азота, серы или кислорода, где -СН2-группа необязательно может быть заменена группой -С(O)-, или кольцевой атом серы необязательно может быть окислен до S-оксидов. Примерами и подходящими значениями для понятия “гетероцикл, связанный с атомом азота” являются морфолино, пирролидин-1-ил, имидазол-1-ил, пиразолидин-1-ил, пиперидин-1-ил и пиперазин-1-ил. В частности, “гетероцикл, связанный с атомом азота” представляет собой пирролидин-1-ил. “Карбоцикл” представляет собой насыщенную, частично насыщенную или ненасыщенную, моно- или бициклическую углеродную структуру, которая содержит 3-12 атомов; где -СН2-группа необязательно может быть заменена группой -С(O)-. Предпочтительно “карбоцикл” представляет собой моноциклическую структуру, которая содержит 5 или 6 атомов, или бициклическую структуру, которая содержит 9 или 10 атомов. Подходящими значениями для “карбоцикла” являются циклопропил, циклобутил, 1-оксоциклопентил, циклопентил, циклопентенил, циклогексил, циклогексенил, фенил, нафтил, тетралинил, инданил или 1-оксоинданил. В частности, “карбоцикл” представляет собой циклопропил, циклобутил, 1-оксоциклопентил, циклопентил, циклопентенил, циклогексил, циклогексенил, фенил или 1-оксоинданил. Примерами “C1-С6-алканоилокси” и “С1-С4-алканоилокси” является ацетокси. Примеры “C1-С6-алкоксикарбонила” и “С1-С4-алкоксикарбонила” включают метоксикарбонил, этоксикарбонил, н- и трет-бутоксикарбонил. Примеры “C1-С6-алкокси” и “С1-С4-алкокси” включают метокси, этокси и пропокси. Примеры “C1-С6-алканоиламино” и “С1-С4-алканоиламино” включают формамидо, ацетамидо и пропиониламино. Примеры “C1-С6-алкилS(O)а, где а представляет собой 0-2″ и “С1-С4-алкилS(O)а, где а представляет собой 0-2″ включают метилтио, этилтио, метилсульфинил, этилсульфинил, мезил и этилсульфонил. Примеры “C1-С6-алканоила” и “С1-С4-алканоила” включают пропионил и ацетил. Примеры “N-(C1-С6-алкил)амино” и “N-(С1-С4-алкил)амино” включают метиламино и этиламино. Примеры “N,N-(C1-С6-алкил)2амино” и “N,N-(С1-С4-алкил)2амино” включают ди-N-метиламино, ди-(N-этил)амино и N-этил-N-метиламино. Примерами “С2-С6-алкенила” и “С2-С4-алкенила” являются винил, аллил и 1-пропенил. Примерами “С2-С6-алкинила” и “С2-С4-алкинила” являются этинил, 1-пропинил и 2-пропинил. Примерами “N-(C1-С6-алкил)сульфамоила” и “N-(С1-С4-алкил)сульфамоила” являются N-(С1-С3-алкил)сульфамоил, N-(метил)сульфамоил и N-(этил)сульфамоил. Примерами “N-(C1-С6-алкил)2сульфамоила” и “N-(С1-С4-алкил)2сульфамоила” являются N,N-(диметил)сульфамоил и N-(метил)-N-(этил)сульфамоил. Примерами “N-(C1-С6-алкил)карбамоила” и “N-(С1-С4-алкил)карбамоила” являются метиламинокарбонил и этиламинокарбонил. Примерами “N,N-(C1-С6-алкил)2карбамоила” и “N,N-(С1-С4-алкил)2карбамоила” являются диметиламинокарбонил и метилэтиламинокарбонил. Примерами “C1-С6-алкилсульфонила” являются мезил и этилсульфонил. Примеры “(С1-С4-алкил)3силила” включают триметилсилил и метилдиэтилсилил. Подходящая фармацевтически приемлемая соль соединения по изобретению представляет собой, например, кислото-аддитивную соль соединения по изобретению, которая является достаточно основной, например кислото-аддитивная соль, например, с неорганической или органической кислотой, например соляной, бромисто-водородной, серной, фосфорной, трифтоуксусной, лимонной, уксусной или малеиновой кислотой. Кроме того, подходящая фармацевтически приемлемая соль соединения по изобретению, которая является достаточно кислотной, представляет собой соль щелочного металла, например натриевую или калиевую соль, соль щелочно-земельного металла, например кальциевую или магниевую соль, соль аммония, или соль с органическим основанием, которое образует физиологически приемлемый катион, например соль с метиламином, диметиламином, триметиламином, пиперидином, морфолином или трис-(2-гидроксиэтил)амином. Соединения формулы (I) могут вводиться в виде пролекарств, которые распадаются в организме человека или животного с получением соединения формулы (I). Примеры пролекарств включают сложные эфиры соединения формулы (I), которые способны к гидролизу в условиях in vivo, и амиды соединения формулы (I), которые способны к гидролизу в условиях in vivo. Сложный эфир соединения формулы (I), который способен к гидролизу в условиях in vivo, содержащий карбоксильную или гидроксильную группу, представляет собой, например, фармацевтически приемлемый сложный эфир, который гидролизируется в организме человека или животного с образованием исходной кислоты или спирта. Подходящие фармацевтически приемлемые сложные эфиры для карбоксильной группы включают C1-С6-алкоксиметиловые сложные эфиры, например метоксиметил, C1-С6-алканоилоксиметиловые сложные эфиры, например пивалоилоксиметиловый, фталидиловые сложные эфиры, С3-C8-циклоалкоксикарбонилоксиC1-С6-алкиловые сложные эфиры, например 1-циклогексилкарбонилоксиэтил; 1,3-диоксолен-2-онилметиловые сложные эфиры, например 5-метил-1,3-диоксолен-2-онилметил; и C1-С6-алкоксикарбонилоксиэтиловые сложные эфиры, например 1-метоксикарбонилоксиэтил, и могут образовываться любой карбоксильной группой соединений согласно настоящему изобретению. Сложный эфир соединения формулы (I), который способен к гидролизу в условиях in vivo, содержащий гидроксильную группу, включает неорганические сложные эфиры, такие как фосфатные сложные эфиры и Подходящим значениям для амида соединения формулы (I), который способен к гидролизу в условиях in vivo, содержащего карбоксильную группу, является, например, N-C1-С6-алкил или N-ди-C1-С6-алкиламид, такой как N-метил, N-этил, N-пропил, N,N-диметил, N-этил-N-метил или N,N-диэтиламид. Некоторые соединения формулы (I) могут иметь хиральные центры и/или геометрически изомерные центры (Е- и Z-изомеры), и подразумевается, что изобретение охватывает все такие оптические формы, диастереоизомеры и геометрические изомеры, которые обладают ингибирующим действием по отношению к переносу желчных кислот в подвздошной кишке (IBAT). Изобретение относится к любой и всем таутомерным формам соединений формулы (I), которые обладают ингибирующим действием по отношению к переносу желчных кислот в подвздошной кишке (IBAT). Также подразумевается, что определенные соединения формулы (I) могут существовать в виде сольватов, а также в виде несольватированных форм, таких как, например, гидратированные формы. Также подразумевается, что под объем изобретения подпадают все такие сольватированные формы, которые обладают ингибирующим действием по отношению к переносу желчных кислот в подвздошной кишке (IBAT). Предпочтительными значениями являются следующие. Такие значения могут использоваться в соответствии с любыми определениями, пунктами формулы или вариантами осуществления изобретения, указанными ранее в настоящее изобретении или в дальнейшем. Rv представляет собой водород. R1 и R2 представляют собой С1-С4-алкил. R1 и R2 оба представляют собой бутил. Один из R1 и R2 представляет собой этил, а другой представляет собой бутил. Один из Rx и Ry представляет собой водород, а другой представляет собой гидроксильную группу. Rx и Ry оба представляют собой водород. М представляет собой -N-. М представляет собой -СН-. v представляет собой 0 или 1. v представляет собой 0. Rz представляет собой С1-С4-алкил. R3 и R6 представляют собой водород. R4 представляет собой метилтио или бром. R4 представляет собой метилтио. R4 представляет собой галоген, С1-С4-алкил или С1-С4-алкилS(O)а, где а представляет собой 0. R4 представляет собой бром, метил или метилтио. R5 представляет собой группу формулы (IA) (как изображено выше), в которой: Х представляет собой -О-; кольцо А представляет собой фенил, необязательно замещенный одним или несколькими заместителями, выбранными из R17; n представляет собой 1; R7 представляет собой водород; R8 представляет собой водород; R9 представляет собой водород; m представляет собой 0; R11 представляет собой группу формулы (IB) (как изображено выше), в которой: R12 представляет собой водород; р представляет собой 1 или 2; R13 представляет собой водород; q представляет собой 0; r представляет собой 0; R15 представляет собой карбоксильную группу или сульфогруппу; и R17 представляет собой гидроксильную группу. R5 представляет собой N-{(R)- R5 представляет собой группу формулы (IA), (как изображено выше), в которой: Х представляет собой -О-; кольцо А представляет собой фенил, необязательно замещенный одним или несколькими заместителями, выбранными из R17; n представляет собой 1; R7 представляет собой водород; R8 представляет собой водород; R9 представляет собой водород; m представляет собой 0; R11 представляет собой карбоксильную группу, группу формулы (IB) (как изображено выше) или группу формулы (IC) (как изображено выше), в которой: R12 представляет собой водород или С1-С4-алкил; р представляет собой 1 или 2; R13 представляет собой водород или С1-С4-алкил, необязательно замещенный R20, где R20 представляет собой гидроксильную группу, карбамоил, аминогруппу, бензилоксикарбониламино или С1-С4-алкилS(O)а , где а представляет собой 0; R14 представляет собой водород или гидроксильную группу; q представляет собой 0; r представляет собой 0 или 1; R15 представляет собой карбоксильную группу или сульфогруппу; R17 представляет собой гидроксильную группу; и кольцо В представляет собой пирролидин-1-ил, замещенный у атома углерода одной группой, выбранной из R23; где R23 представляет собой карбоксильную группу. R5 представляет собой N-{(R)- R5 представляет собой группу формулы (IA) (как изображено выше), в которой: Х представляет собой -О-; кольцо А представляет собой фенил, необязательно замещенный одним или несколькими заместителями, выбранными из R17; n представляет собой 1; R7 представляет собой водород; R8 представляет собой водород; R9 представляет собой водород; m представляет собой 0; R11 представляет собой карбоксильную группу, группу формулы (IB) (как изображено выше) или группу формулы (IC) (как изображено выше), в которой: R12 представляет собой водород или С1-С4-алкил; р представляет собой 1 или 2; R13 представляет собой водород или C1-С6-алкил, необязательно замещенный R20, где R20 представляет собой гидроксильную группу, карбамоил, аминогруппу, бензилоксикарбониламино, С1-С4-алкилS(O)а, где а представляет собой 0, или (С1-С4-алкил)3силил; R14 представляет собой водород, или гидроксильную группу, или C1-С6-алкил; где R14 необязательно может быть замещен одним или несколькими заместителями, выбранными из R20; Y представляет собой -N(Rn)C(O)-, где Rn представляет собой водород; q представляет собой 0 или 1; r представляет собой 0 или 1; R15 представляет собой карбоксильную группу или сульфогруппу; R17 представляет собой гидроксильную группу; и R20 выбран из гидроксильной группы; кольцо В представляет собой пирролидин-1-ил или азетидинил, замещенный у атома углерода одной группой, выбранной из R23, и необязательно дополнительно замещен у атома углерода одним или несколькими R24; где R23 представляет собой карбоксильную группу и R24 представляет собой гидроксильную группу. R5 представляет собой N-{(R)- R5 представляет собой водород. R4 представляет собой группу формулы (IA). R5 представляет собой группу формулы (IA). Таким образом, согласно другому варианту осуществления объектом изобретения является соединение формулы (I) (как изображено выше), в которой: Rv представляет собой водород; R1 и R2 представляют собой С1-С4-алкил; Rx и Rу оба представляют собой водород; М представляет собой -N-; v представляет собой 0; R3 и R6 представляют собой водород; R4 представляет собой галоген, С1-С4-алкил или С1-С4-алкилS(O)а, где а представляет собой 0; R5 представляет собой группу формулы (IA) (как изображено выше), в которой: Х представляет собой -О-; кольцо А представляет собой фенил, необязательно замещенный одним или несколькими заместителями, выбранными из R17; n представляет собой 1; R7 представляет собой водород; R8 представляет собой водород; R9 представляет собой водород; m представляет собой 0; R11 представляет собой карбоксильную группу, группу формулы (IB) (как изображено выше) или группу формулы (IC) (как изображено выше), в которой: R12 представляет собой водород или С1-С4-алкил; р представляет собой 1 или 2; R13 представляет собой водород или C1-С6-алкил, необязательно замещенный R20, где R20 представляет собой гидроксильную группу, карбамоил, аминогруппу, бензилоксикарбониламино, С1-С4-алкилS(O)а, где а представляет собой 0, или (С1-С4-алкил)3силил; R14 представляет собой водород, или гидроксильную группу, или C1-С6-алкил; где R14 необязательно может быть замещен одним или несколькими заместителями, выбранными из R20; Y представляет собой -N(Rn)C(O)-, где Rn представляет собой водород; q представляет собой 0 или 1; r представляет собой 0 или 1; R15 представляет собой карбоксильную группу или сульфогруппу; R17 представляет собой гидроксильную группу; и R20 выбран из гидроксильной группы; и кольцо В представляет собой пирролидин-1-ил или азетидинил, замещенный у атома углерода одной группой, выбранной из R23, и необязательно дополнительно замещен у атома углерода одним или несколькими R24; где R23 представляет собой карбоксильную группу и R24 представляет собой гидроксильную группу; или его фармацевтически приемлемая соль, сольват, сольват такой соли или его пролекарство. Таким образом, согласно другому варианту осуществления объектом изобретения является соединение формулы (I) (как изображено выше), в которой: Rv представляет собой водород; R1 и R2 оба представляют собой бутил; Rx и Rу оба представляют собой водород; М представляет собой -N-; v представляет собой 0; R3 и R6 представляют собой водород; R4 представляет собой бром, метил или метилтио; и R5 представляет собой N-{(R)- или его фармацевтически приемлемая соль, сольват, сольват такой соли или его пролекарство. Согласно другому варианту осуществления изобретения предпочтительными соединениями по изобретению является любое из соединений, описанных в примерах 5, 6, 7, 9, 11, 14, 15, 26, 27, 28, 30 или 33 или его фармацевтически приемлемая соль, сольват, сольват такой соли или его пролекарство. Согласно другому варианту осуществления изобретения предпочтительными соединениями по изобретению является любое из соединений, описанных в любом из примеров, или его фармацевтически приемлемая соль, сольват, сольват такой соли или его пролекарство. Предпочтительными вариантами осуществления изобретения являются такие, которые относятся к соединению формулы (I) или его фармацевтически приемлемой соли. Другим объектом настоящего изобретения является способ получения соединения формулы (I) или его фармацевтически приемлемой соли, сольвата, сольвата такой соли или его пролекарства, при этом способ (где изменяемые группы имеют значения, указанные для формулы (I), если специально не указано иначе) предусматривает: Способ 1): для соединений формулы (I), где Х представляет собой -О-, -NRa или -S-; реакцию соединения формулы (IIa) или (IIb): с соединением формулы (III):
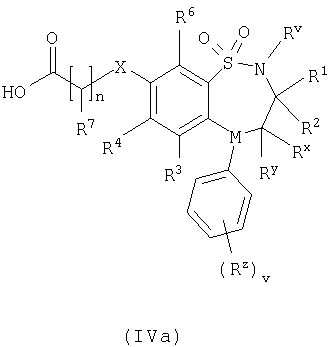
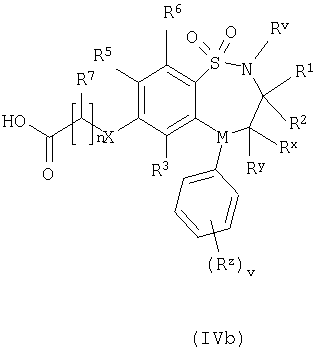
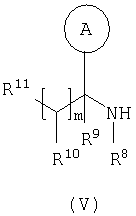
где L представляет собой вытесняемую группу; Способ 2): реакцию кислоты формулы (IVa) или (IVb): или ее активированного производного; с амином формулы (V):
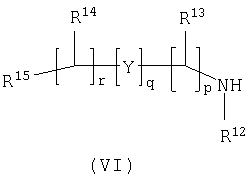
Способ 3): для соединений формулы (I), где R11 представляет собой группу формулы (IB); реакцию соединения формулы (I), где R11 представляет собой карбоксильную группу, с амином формулы (VI):
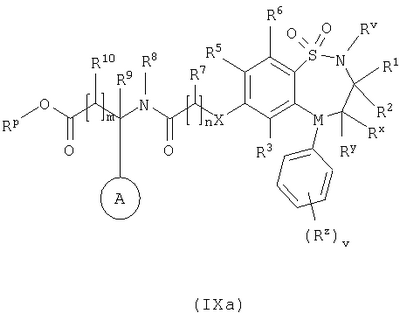
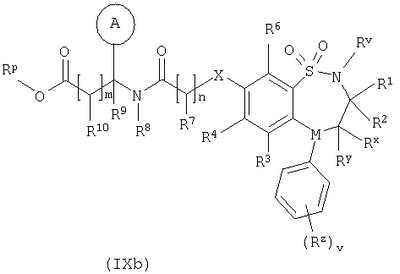
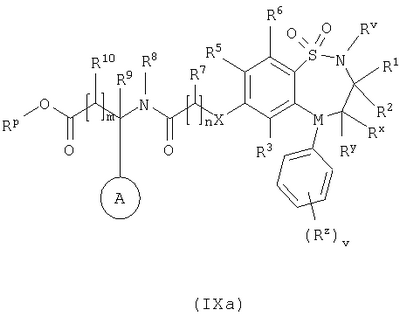
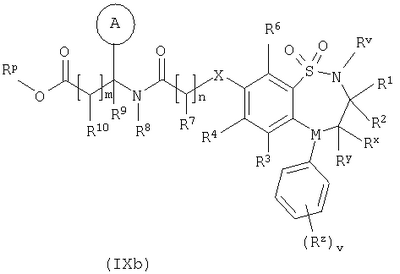
Способ 4) для соединений формулы (I), где один из R4 и R5 независимо выбран из C1-С6-алкилтио, который необязательно замещенный у атома углерода одним или несколькими R17; реакцию соединения формулы (VIIa) или (VIIb): где L представляет собой вытесняемую группу; с тиолом формулы (VIII):
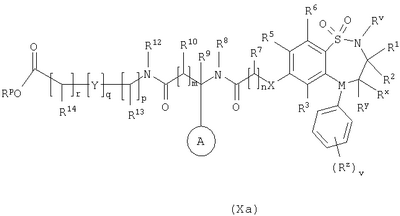
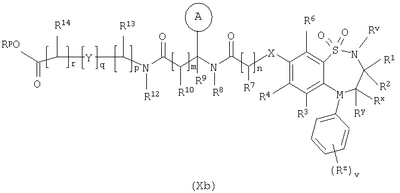
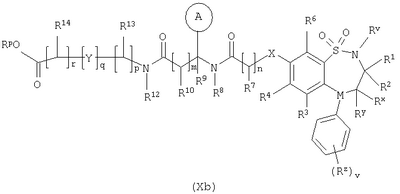
в которой Rm представляет собой C1-С6-алкилтио, который необязательно замещенный у атома углерода одним или несколькими R16; Способ 5): для соединений формулы (I), где R11 представляет собой карбоксильную группу; снятие защиты с соединения формулы (IXa): или (IXb): в которой Rp совместно с группой -ОС(O)-, к которой он присоединен, образует сложный эфир; Способ 6): для соединений формулы (I), где R11 представляет собой группу формулы (IB) и R15 представляет собой карбоксильную группу; снятие защиты с соединения формулы (Ха): или (Xb): в которой Rp совместно с группой -ОС(O)-, к которой он присоединен, образует сложный эфир; Способ 7): для соединений формулы (I), где R11 представляет собой группу формулы (IB) и N(Rn)C(O)-; реакцию кислоты формулы (XIa): или (XIb): или ее активированного производного; с амином формулы (XII):
и затем, если это необходимо или желательно: i) превращение соединения формулы (I) в другое соединение формулы (I); ii) удаление любых защитных групп; iii) образование фармацевтически приемлемой соли, сольвата, сольвата такой соли или пролекарства. L представляет собой вытесняемую группу, подходящими значениями для L являются, например, галоген или сульфонилоксигруппа, например хлор, бром, метансульфонилокси или толуол-4-сульфонилокси группа. Rp совместно с группой -ОС(O)-, к которой он присоединен, образует сложный эфир. Предпочтительно Rp представляет собой метил или этил. Более предпочтительно Rp представляет собой метил. Согласно другому варианту осуществления изобретения Rp представляет собой C1-С6-алкил или фенилС1-С6-алкил, предпочтительно С1-С4-алкил или бензил, более предпочтительно трет-бутил, метил, этил или бензил. Конкретными условиями для вышеуказанных реакций являются следующие. Бициклические структуры согласно настоящему изобретению могут быть получены в соответствии со Схемой 1а или Схемой Ib. Для специалиста в данной области очевидно, что любые из вышеуказанных промежуточных значений R4 или R5 в следующих схемах могут быть заменены соответствующей группой. Например, для синтеза соединения формулы (IIa) R4 может иметь значение НХ в следующей схеме. Схема 1а где FGI представляет собой функциональное взаимопревращение Br в другие значения R4 при помощи способов, известных специалисту в данной области техники. Соединения формулы (А) и (D) являются коммерчески доступными, или они известны из литературы, или они могут быть получены при помощи традиционных способов, известных в данной области техники. Схема 1b Способ 1): Соединения формулы (IIa) или (IIb) могут подвергаться реакции с соединениями формулы (III) в присутствии основания, например неорганического основания, такого как карбонат натрия, или органического основания, такого как основание Хьюнига, в присутствии подходящего растворителя, такого как ацетонитрил, дихлорметан или тетрагидрофуран, при температуре в диапазоне от 0°С до температуры флегмы, предпочтительно при температуре флегмы или около температуры флегмы. Соединения формулы (III) являются коммерчески доступными соединениями, или они известны из литературы, или они могут быть получены при помощи традиционных способов, известных в данной области техники. Способ 2), и Способ 3), и Способ 7): Кислоты и амины могут связываться в присутствии подходящего связующего реагента. В качестве подходящих связующих реагентов могут применятся стандартные пептидные связующие реагенты, известные в данной области, или, например, карбонилдиимидазол и дициклогексил-карбодиимид, необязательно в присутствии катализатора, такого как диметиламинопиридин или 4-пирролидинопиридин, необязательно в присутствии основания, например триэтиламина, пиридина или 2,6-ди-алкил-пиридинов, таких как 2,6-лутидин или 2,6-ди-трет-бутилпиридин. Подходящими растворителями являются диметилацетамид, дихлорметан, бензол, тетрагидрофуран и диметилформамид. Реакция связывания обычно может осуществляться при температуре в интервале от -40 до 40°С. Подходящими активированными производными кислот являются галогенангидриды кислот, например хлорангидриды, и активные сложные эфиры, например, сложные пентафторфениловые эфиры. Реакция соединений этих типов с аминами хорошо известна в данной области техники, например, они могут взаимодействовать в присутствии основания, такого как указанные выше, и в подходящем растворителе, таком как указанные выше. Реакция обычно может осуществляться при температуре в интервале от -40 до 40°С. Соединения формулы (IVa) или (IVb), в которых Х=-О-, -NRa, -S-, могут быть получены в соответствии со Схемой 2: Схема 2 где L в (VIIa) и (VIIb) представляет собой вытесняемую группу, например бром, хлор, фтор, мезил или тозил и где Х представляет собой -О-, -S-, NRa (необязательно для -SO- и -SO2– с последующим этапом окисления согласно Способу 1). Соединения формулы (IVa) и (IVb), где Х представляет собой -SO- или -SO2– могут быть получены путем окисления полученных соединений формулы (IVa) и (IVb) согласно Схеме 2, где Х представляет собой -S-. Соединения формулы (Va) или (Vb), в которых Х представляет собой -СН2– и n представляет собой 1, могут быть получены в соответствии со Схемой 3. Схема 3 Для специалиста в данной области очевидно, что вышеприведенная схема реакций может быть изменена для получения соединений формулы (Va) или (Vb), где n представляет собой 2 или 3. Соединения формулы (XIa) и (XIb) могут быть получены при помощи процедур, известных специалисту в данной области, согласно способам, описанным в настоящем изобретении. Соединения формулы (IVc), (V), (VI), (XII) и (VII) являются коммерчески доступными соединениями, или они известны из литературы, или они могут быть получены при помощи традиционных способов, известных в данной области техники. Способ 4): Соединения формулы (VIIa) и (VIIb) могут подвергаться реакции с тиолами формулы (VIII) в присутствии основания, например неорганического основания, такого как карбонат натрия, или органического основания, такого как основание Хьюнига, в присутствии подходящего растворителя, такого как ДМФА или ТГФ при температуре в интервале от 0°С до температуры флегмы. Соединения формулы (VIIa) и (VIIb) могут быть получены при помощи любой из процедур, описанных выше для получения соединений формулы (I), но где один из R4 и R5 представляет собой L. Соединения формулы (VIII) являются коммерчески доступными соединениями, или они известны из литературы, или они могут быть получены при помощи традиционных способов, известных в данной области техники. Способ 5) и Способ 6): Со сложных эфиров формулы (IXa), (IXb), (Ха) и (Xb) может быть снята защита в стандартных условиях, таких как описаны далее, например, с них может быть снята защита путем реагирования с гидроокисью натрия в метаноле при комнатной температуре. Сложные эфиры формулы (IXa), (IXb), (Ха) и (Xb) могут быть получены при помощи любой из процедур, описанных выше для получения соединений формулы (I), но где R11 или R15 представляет собой С1-С4-алкоксикарбонил. Также является очевидным, что разные заместители в кольцевых структурах в соединениях согласно настоящему изобретению могут быть введены при помощи стандартных реакций ароматического замещения или получены путем модификации обычных функциональных групп как перед, так и непосредственно после способов, описанных выше, и по существу включены в объем настоящего изобретения. Такие реакции и модификации включают, например, введение заместителя при помощи реакции ароматического замещения, восстановление заместителей, алкилирование заместителей и окисление заместителей. Реагенты и условия реакции для таких методик хорошо известны в области химии. Частными примерами реакций ароматического замещения является введение нитрогруппы при помощи концентрированной азотной кислоты, введение ацильной группы при помощи, например, ацилгалогенида и кислоты Льюиса (такой как трихлорид алюминия) в условиях Фриделя Крафта; введение алкильной группы при помощи алкилгалогенида и кислоты Льюиса (такой как трихлорид алюминия) в условиях Фриделя Крафта; и введение галогеновой группы. Частными примерами модификаций являются восстановление нитрогруппы до аминогруппы при помощи, например, каталитической гидрогенизации с никелевым катализатором или обработки железом в присутствии соляной кислоты при нагревании; окисление алкилтиогруппы до алкилсульфинила или алкилсульфонила. Также является очевидным, что для некоторых реакций, описанных в настоящем изобретении, может являться необходимым/желательным защищать любые чувствительные группы соединений. Случаи, когда такая защита является необходимой или желательной, а также походящие способы для такой защиты известны специалисту в данной области техники. Частным примером, когда может понадобиться применение защитной группы, является защита атома азота во 2-м положении бензотиадиазепинового кольца при синтезе определенных промежуточных продуктов. Обычные защитные группы могут применятся в соответствии с общепринятой практикой (например, см. T.W. Greene, Protective Groups in Organic Synthesis, John Wiley и Sons, 1999). Таким образом, если реагирующие вещества содержат такие группы, как аминогруппа, карбоксильная группа или гидроксильная группа, может являться желательным защитить такую группу в некоторых реакциях, описанных в настоящем изобретении. Подходящей защитной группой для аминогруппы или алкиламиногруппы является, например, ацильная группа, например алканоильная группа, такая как ацетил, алкоксикарбонильная группа, например метоксикарбонильная, этоксикарбонильная или трет-бутоксикарбонильная группа, арилметоксикарбонильная группа, например бензилоксикарбонил, или ароильная группа, например бензоил. Условия снятия защиты для вышеупомянутых защитных групп главным образом зависят от выбора защитной группы. Так, например, ацильная группа, такая как алканоильная или алкоксикарбонильная группа, или ароильная группа могут быть отщеплены, например, путем гидролиза с подходящим основанием, таким как гидроокись щелочного металла, например гидроокись лития или натрия. Альтернативно, ацильная группа, такая как трет-бутоксикарбонильная группа может быть отщеплена, например, путем обработки подходящей кислотой, такой как соляная, серная или фосфорная кислота или трифторуксусная кислота и арилметоксикарбонильная группа, такая как бензилоксикарбонильная группа, может быть отщеплена, например, путем гидрирования в присутствии катализатора, такого как палладий на угле, или путем обработки кислотой Льюиса, например трис(трифторацетатом) бора. Подходящей альтернативной защитной группой для первичной аминогруппы является, например, фталоильная группа, которая может быть отщеплена путем обработки с алкиламином, например, диметиламинопропиламином, или с гидразином. Подходящей защитной группой для гидроксильной группы является, например, ацильная группа, например алканоильная группа, такая как ацетил, ароильная группа, например бензоил, или арилметильная группа, например бензил. Условия снятия защиты для вышеупомянутых защитных групп главным образом будут зависеть от выбора защитной группы. Так, например, ацильная группа, такая как алканоильная или ароильная группа, может быть отщеплена, например, при помощи гидролиза с подходящим основанием, таким как гидроокись щелочного металла, например гидроокись лития или натрия. Альтернативно, арилметильная группа, такая как бензильная группа, может быть отщеплена, например, путем гидрирования в присутствии катализатора, такого как палладий на угле. Подходящей защитной группой для карбоксильной группы является, например, эстерифицированная группа, например метильная или этильная группа, которая может быть отщеплена, например, путем гидролиза с основанием, таким как гидроокись натрия, или, например, трет-бутильная группа, которая может быть отщеплена, например, путем обработки кислотой, например органической кислотой, такой как трифторуксусная кислота, или, например, бензильная группа, которая может быть отщеплена, например, путем гидрирования в присутствии катализатора, такого как палладий на угле. Защитные группы могут быть отщеплены на любой подходящей стадии синтеза при помощи обычных методик, хорошо известных в области химии. Как указывалось выше, соединения согласно настоящему изобретению обладают ингибирующим действием по отношению к переносу желчных кислот в подвздошной кишке (IBAT). Эти свойства могут быть оценены, например, при помощи изучения в условиях in vitro действия на поглощение желчных кислот у IBAT-трансфектированных клетках (Smith L., Price-Jones M.J., Hugnes К.Т. и Jones N.R.A.; J Biomolecular Screening, 3, 227-230) или в условиях in vivo путем изучения действия на абсорбцию радиоактивно меченных желчных кислот у мышей/крыс (Lewis M.С., Brieaddy L.E. и Root С., L, J Lip Res 1995, 36, 1098-1105). В соответствии с другим вариантом осуществления, настоящее изобретение обеспечивает фармацевтическую композицию, которая содержит соединение формулы (I), или его фармацевтически приемлемую соль, сольват, сольват такой соли или его пролекарство, как описано здесь выше, в сочетании с фармацевтически приемлемым растворителем или носителем. Композиция может находиться в форме, подходящей для перорального введения, например, в виде таблетки или капсулы, для парентерального введения (включая внутривенное, подкожное, внутримышечное, внутрисосудистое введение или инфузию) в виде стерильного раствора, суспензии или эмульсии, для местного введения, в виде мази или пасты, или для ректального введения, в виде суппозитория. В целом, вышеприведенные композиции могут быть приготовлены обычным способом при использовании обычных наполнителей. Соединение формулы (I), или его фармацевтически приемлемая соль, сольват, сольват такой соли или его пролекарство, обычно вводится теплокровному животному в стандартной дозе в диапазоне 5-5000 мг на м2 поверхности тела животного, то есть приблизительно 0,02-100 мг/кг, предпочтительно 0,02-50 мг/кг и обычно она является терапевтически эффективной дозой. Стандартная дозированная форма, такая как таблетка или капсула, обычно включает, например, 1-250 мг активного компонента. Предпочтительно применяемая дневная доза находится в диапазоне 1-50 мг/кг, более предпочтительно 0,1-10 мг/кг. Согласно другому варианту воплощения дневная доза находится в диапазоне 0,02-20 мг/кг. Однако дневная доза обязательно зависит от организма, который подвергается лечению, особенности пути введения и тяжести заболевания, которое поддается лечению. Следовательно, оптимальная доза может быть определена лечащим врачом индивидуально для каждого пациента. В соответствии с другим вариантом осуществления настоящее изобретение относится к соединению формулы (I), или его фармацевтически приемлемой соли, сольвату, сольвату такой соли или его пролекарству, как описано здесь выше, для применения в способе профилактики или терапевтического лечения теплокровного животного, такого как человек. Нами было обнаружено, что соединения, раскрытые в настоящем изобретении, или их фармацевтически приемлемая соль, сольват, сольват такой соли или их пролекарство, являются эффективными ингибиторами переноса желчных кислот в подвздошной кишке (IBAT), и, таким образом, являются ценными при лечении болезненных состояний, связанных с гиперлипемическими условиями. Другим вариантом осуществления настоящего изобретения является соединение формулы (I), или его фармацевтически приемлемая соль, сольват, сольват такой соли или его пролекарство, как описано здесь выше, для применения в качестве лекарственного средства. Таким образом, другим вариантом осуществления изобретения является применение соединения формулы (I), или его фармацевтически приемлемой соли, сольвата, сольвата такой соли или его пролекарства, как описано здесь выше, для приготовления лекарственного средства для применения для ингибирования переноса желчных кислот в подвздошной кишке (IBAT) у теплокровного животного, такого как человек. Таким образом, другим вариантом осуществления изобретения является применение соединения формулы (I), или его фармацевтически приемлемой соли, сольвата, сольвата такой соли или его пролекарства, как описано здесь выше, для приготовления лекарственного средства для применения для лечения гиперлипемических состояний у теплокровного животного, такого как человек. Таким образом, другим вариантом осуществления изобретения является применение соединения формулы (I), или его фармацевтически приемлемой соли, сольвата, сольвата такой соли или его пролекарства, как описано здесь выше, для приготовления лекарственного средства для применения для лечения дислипидемических состояний и расстройств, таких как гиперлипемия, гипертриглицеридемия, гипербеталипопротеинемия (повышение содержания липопротеинов низкой плотности), гиперпребеталипопротеинемия (повышение содержания липопротеинов очень низкой плотности), гиперхиломикронемия, гиполипопротеинемия, гиперхолестеринемия, гиперлипопротеинемия и гипоальфалипопротеинемия (понижение содержания липопротеинов высокой плотности) у теплокровного животного, такого как человек. Таким образом, другим вариантом осуществления изобретения является применение соединения формулы (I), или его фармацевтически приемлемой соли, сольвата, сольвата такой соли или его пролекарства, как описано здесь выше, для приготовления лекарственного средства для применения для лечения разных клинических состояний, таких как атеросклероз, артериосклероз, аритмия, гипертромботические состояния, нарушения функции сосудов, нарушения функции эндотелия, сердечная недостаточность, заболевания коронарных сосудов, сердечно-сосудистые заболевания, инфаркт миокарда, стенокардия, заболевания периферических сосудов, воспаление сердечно-сосудистых тканей, таких как сердца, клапанов, сосудистой сети, артерий и вен, аневризмы, стенозы, рестенозы, образование бляшек на стенках сосудов, образование полосок жировых отложении на стенках сосудов, инфильтрация лейкоцитами, моноцитами и/или макрофагами, утолщение внутренней оболочки сосудов, истончение средней оболочки сосудов, инфекции и хирургические травмы и тромбозы сосудов, удар и переходящие нарушения мозгового кровообращения у теплокровного животного, такого как человек. Таким образом, другим вариантом осуществления изобретения является применение соединения формулы (I), или его фармацевтически приемлемой соли, сольвата, сольвата такой соли или его пролекарства, как описано здесь выше, для приготовления лекарственного средства для применения для лечения атеросклероза, заболеваний коронарных сосудов, инфаркта миокарда, стенокардии, заболеваний периферических сосудов, удара и переходящих нарушений мозгового кровообращения у теплокровного животного, такого как человек. В соответствии с другим вариантом осуществления изобретение обеспечивает способ ингибирования переноса желчных кислот в подвздошной кишке (IBAT) у теплокровного животного, такого как человек, которое нуждается в таком лечении, который включает введение указанному животному эффективного количества соединения формулы (I), или его фармацевтически приемлемой соли, сольвата, сольвата такой соли или его пролекарства. В соответствии с другим вариантом осуществления изобретение обеспечивает способ лечения гиперлипемических состояний у теплокровного животного, такого как человек, которое нуждается в таком лечении, который включает введение указанному животному эффективного количества соединения формулы (I), или его фармацевтически приемлемой соли, сольвата, сольвата такой соли или его пролекарства. В соответствии с другим вариантом осуществления изобретение обеспечивает способ лечения дислипидемических состояний и расстройств, таких как гиперлипемия, гипертриглицеридемия, гипербеталипопротеинемия (повышение содержания липопротеинов низкой плотности), гиперпребеталипопротеинемия (повышение содержания липопротеинов очень низкой плотности), гиперхиломикронемия, гиполипопротеинемия, гиперхолестеринемия, гиперлипопротеинемия и гипоальфалипопротеинемия (понижение содержания липопротеинов высокой плотности) у теплокровного животного, такого как человек, которое нуждается в таком лечении, который включает введение указанному животному эффективного количества соединения формулы (I), или его фармацевтически приемлемой соли, сольвата, сольвата такой соли или его пролекарства. В соответствии с другим вариантом осуществления изобретение обеспечивает способ лечения разных клинических состояний, таких как атеросклероз, артериосклероз, аритмия, гипертромботические состояния, нарушения функции сосудов, нарушения функции эндотелия, сердечная недостаточность, заболевания коронарных сосудов, сердечно-сосудистые заболевания, инфаркт миокарда, стенокардия, заболевания периферических сосудов, воспаление сердечно-сосудистых тканей, таких как сердца, клапанов, сосудистой сети, артерий и вен, аневризмы, стенозы, рестенозы, образование бляшек на стенках сосудов, образование полосок жировых отложений на стенках сосудов, инфильтрация лейкоцитами, моноцитами и/или макрофагами, утолщение внутренней оболочки сосудов, истончение средней оболочки сосудов, инфекции и хирургические травмы и тромбозы сосудов, удар и переходящие нарушения мозгового кровообращения у теплокровного животного, такого как человек, которое нуждается в таком лечении, который включает введение указанному животному эффективного количества соединения формулы (I), или его фармацевтически приемлемой соли, сольвата, сольвата такой соли или его пролекарства. В соответствии с другим вариантом осуществления изобретение обеспечивает способ лечения атеросклероза, заболеваний коронарных сосудов, инфаркта миокарда, стенокардии, заболеваний периферических сосудов, удара и переходящих нарушений мозгового кровообращения у теплокровного животного, такого как человек, которое нуждается в таком лечении, который включает введение указанному животному эффективного количества соединения формулы (I), или его фармацевтически приемлемой соли, сольвата, сольвата такой соли или его пролекарства. Также является очевидным, что ингибитор переноса желчных кислот в подвздошной кишке (IBAT) потенциально может быть пригодным для лечения и/или профилактики желчных конкрементов. В соответствии с другим вариантом осуществления изобретение обеспечивает способ лечения и/или профилактики желчных конкрементов у теплокровного животного, такого как человек, которое нуждается в таком лечении, который включает введение указанному животному эффективного количества соединения формулы (I), или его фармацевтически приемлемой соли, сольвата, сольвата такой соли или его пролекарства. Величина дозы, необходимой для терапевтического или профилактического лечения конкретного болезного состояния обязательно зависит от организма, который подвергается лечению, пути введения и тяжести заболевания, которое поддается лечению. Применяемая стандартная доза находится в диапазоне, например, 1-50 мг/кг, предпочтительно 0,1-10 мг/кг. Ингибирующее действие по отношению к переносу желчных кислот в подвздошной кишке (IBAT), как описано здесь выше, может применятся в виде единичной терапии или можно применять, дополнительно к соединению по изобретению, одно или несколько других веществ и/или лечений. Такое комплексное лечение может осуществляться путем одновременного, последовательного или раздельного введения отдельных компонентов, которые применяются для лечения. В соответствии с этим вариантом осуществления изобретение обеспечивает фармацевтический продукт, содержащий соединение формулы (I), или его фармацевтически приемлемую соль, сольват, сольват такой соли или его пролекарство, как описано здесь выше, и дополнительное вещество, которое ингибирует перенос желчных кислот в подвздошной кишке (IBAT), как описано здесь выше, и дополнительное гиполипемическое средство для комплексного лечения гиперлипемии. Согласно другому варианту осуществления изобретения соединение формулы (I), или его фармацевтически приемлемая соль, сольват, сольват такой соли или его пролекарство, может вводиться в сочетании с ингибитором HMG Со-А редуктазы, или их фармацевтически приемлемыми солями, сольватами, сольватами таких солей или их пролекарствами. Подходящими ингибиторами HMG Со-А редуктазы, их фармацевтически приемлемыми солями, сольватами, сольватами таких солей или их пролекарствами, являются статины, хорошо известные в данной области. Предпочтительными статинами являются флувастатин, ловастатин, правастатин, симвастатин, аторвастатин, церивастатин, бервастатин, далвастатин, мевастатин и (Е)-7-[4-(4-фторфенил)-6-изопропил-2-[метил(метилсульфонил)амино]пиримидин-5-ил](3R,5S)-3,5-дигидроксигепт-6-еновая кислота (росувастатин), или его фармацевтически приемлемая соль, сольват, сольват такой соли или его пролекарство. Предпочтительным статином является аторвастатин, или его фармацевтически приемлемая соль, сольват, сольват такой соли или его пролекарство. Более предпочтительным статином является кальциевая соль аторвастатина. Также предпочтительным статином является (Е)-7-[4-(4-фторфенил)-6-изопропил-2-[метил(метилсульфонил)амино]пиримидин-5-ил](3R,5S)-3,5-дигидроксигепт-6-еновая кислота (росувастатин), или его фармацевтически приемлемая соль, сольват, сольват такой соли или его пролекарство. Более предпочтительным статином является кальциевая соль росувастатина. Согласно дополнительному варианту осуществления изобретения соединение формулы (I), или его фармацевтически приемлемая соль, сольват, сольват такой соли или его пролекарство может вводиться в сочетании с ингибитором HMG Со-А редуктазы, или его фармацевтически приемлемой солью, сольватом, сольватом такой соли или его пролекарством, и/или веществом, которое связывает желчную кислоту, таким образом избегая возможного риска избытка желчных кислот в ободочной кишке, которое вызывается ингибированием системы переноса желчных кислот. Избыточная концентрация желчных кислот во внутреннем содержимом может вызывать диарею. Таким образом, настоящее изобретение также обеспечивает лечение возможных побочных действий, таких как диарея, у пациентов на протяжении лечения, которое включает соединение формулы (I), или его фармацевтически приемлемую соль, сольват, сольват такой соли или его пролекарство. Ингибитор HMG СоА-редуктазы, или его фармацевтически приемлемая соль, сольват, сольват такой соли или его пролекарство вследствие их действия будут снижать доступность эндогенного холестерина для синтеза желчных кислот и обладают дополнительным действием в сочетании с соединением формулы (I), или его фармацевтически приемлемой солью, сольватом, сольватом такой соли или его пролекарством для снижения концентрации липидов. Подходящими веществами, которые связывают желчные кислоты, для такого совместного лечения являются смолы, такие как холестирамин и холестирол. Одним из преимуществ является то, что доза вещества, которое связывает желчные кислоты, может быть меньше терапевтической дозы для лечения холестеринемии при отдельном лечении при помощи только вещества, которое связывает желчную кислоту. Путем снижения дозы вещества, которое связывает желчную кислоту, также можно избежать возникновения любых побочных действий, вызванных недостаточной чувствительностью пациента к терапевтической дозе. Следовательно, согласно дополнительному варианту осуществления изобретения обеспечивается способ ингибирования переноса желчных кислот в подвздошной кишке (IBAT) у теплокровного животного, такого как человек, которое нуждается в таком лечении, который включает введение указанному животному эффективного количества соединения формулы (I), или его фармацевтически приемлемой соли, сольвата, сольвата такой соли или его пролекарства при одновременном, последовательном или раздельном введении эффективного количества ингибитора HMG Со-А редуктазы, или его фармацевтически приемлемой соли, сольвата, сольвата такой соли или его пролекарства. Следовательно, согласно дополнительному варианту осуществления изобретения обеспечивается способ ингибирования переноса желчных кислот в подвздошной кишке (IBAT) у теплокровного животного, такого как человек, которое нуждается в таком лечении, который включает введение указанному животному эффективного количества соединения формулы (I), или его фармацевтически приемлемой соли, сольвата, сольвата такой соли или его пролекарства при одновременном, последовательном или раздельном введении с веществом, которое связывает желчную кислоту. Следовательно, согласно дополнительному варианту осуществления изобретения обеспечивается способ ингибирования переноса желчных кислот в подвздошной кишке (IBAT) у теплокровного животного, такого как человек, которое нуждается в таком лечении, который включает введение указанному животному эффективного количества соединения формулы (I), или его фармацевтически приемлемой соли, сольвата, сольвата такой соли или его пролекарства при одновременном, последовательном или раздельном введении эффективного количества ингибитора HMG Со-А редуктазы, или его фармацевтически приемлемой соли, сольвата, сольвата такой соли или его пролекарства, при одновременном, последовательном или раздельном введении с веществом, которое связывает желчную кислоту. Следовательно, согласно дополнительному варианту осуществления изобретение обеспечивает способ лечения гиперлипемических состояний у теплокровного животного, такого как человек, которое нуждается в таком лечении, который включает введение указанному животному эффективного количества соединения формулы (I), или его фармацевтически приемлемой соли, сольвата, сольвата такой соли или его пролекарства при одновременном, последовательном или раздельном введении эффективного количества ингибитора HMG Со-А редуктазы, или его фармацевтически приемлемой соли, сольвата, сольвата такой соли или его пролекарства. Следовательно, согласно дополнительному варианту осуществления изобретение обеспечивает способ лечения гиперлипемических состояний у теплокровного животного, такого как человек, которое нуждается в таком лечении, который включает введение указанному животному эффективного количества соединения формулы (I), или его фармацевтически приемлемой соли, сольвата, сольвата такой соли или его пролекарства при одновременном, последовательном или раздельном введении эффективного количества вещества, которое связывает желчную кислоту. Следовательно, согласно дополнительному варианту осуществления изобретение обеспечивает способ лечения гиперлипемических состояний у теплокровного животного, такого как человек, которое нуждается в таком лечении, который включает введение указанному животному эффективного количества соединения формулы (I), или его фармацевтически приемлемой соли, сольвата, сольвата такой соли или его пролекарства при одновременном, последовательном или раздельном введении эффективного количества ингибитора HMG Со-А редуктазы, или его фармацевтически приемлемой соли, сольвата, сольвата такой соли или его пролекарства, при одновременном, последовательном или раздельном введении с веществом, которое связывает желчную кислоту. Согласно другому варианту осуществления изобретение обеспечивает фармацевтическую композицию, которая содержит соединение формулы (I), или его фармацевтически приемлемую соль, сольват, сольват такой соли или его пролекарство, и ингибитор HMG Со-А редуктазы, или его фармацевтически приемлемую соль, сольват, сольват такой соли или его пролекарство, в сочетании с фармацевтически приемлемым растворителем или носителем. В соответствии с другим вариантом осуществления настоящее изобретение обеспечивает фармацевтическую композицию, которая содержит соединение формулы (I), или его фармацевтически приемлемую соль, сольват, сольват такой соли или его пролекарство, и вещество, которое связывает желчную кислоту, в сочетании с фармацевтически приемлемым растворителем или носителем. В соответствии с другим вариантом осуществления настоящее изобретение обеспечивает фармацевтическую композицию, которая содержит соединение формулы (I), или его фармацевтически приемлемую соль, сольват, сольват такой соли или его пролекарство, и ингибитор HMG Со-А редуктазы, или его фармацевтически приемлемую соль, сольват, сольват такой соли или его пролекарство, и вещество, которое связывает желчную кислоту, в сочетании с фармацевтически приемлемым растворителем или носителем. В соответствии с другим вариантом осуществления настоящее изобретение обеспечивает набор, содержащий соединение формулы (I), или его фармацевтически приемлемую соль, сольват, сольват такой соли или его пролекарство, и ингибитор HMG Со-А редуктазы, или его фармацевтически приемлемую соль, сольват, сольват такой соли или его пролекарство. В соответствии с другим вариантом осуществления настоящее изобретение обеспечивает набор, содержащий соединение формулы (I), или его фармацевтически приемлемую соль, сольват, сольват такой соли или его пролекарство, и вещество, которое связывает желчную кислоту. В соответствии с другим вариантом осуществления настоящее изобретение обеспечивает набор, содержащий соединение формулы (I), или его фармацевтически приемлемую соль, сольват, сольват такой соли или его пролекарство, и ингибитор HMG Со-А редуктазы, или его фармацевтически приемлемую соль, сольват, сольват такой соли или его пролекарство, и вещество, которое связывает желчную кислоту. В соответствии с другим вариантом осуществления настоящее изобретение обеспечивает набор, содержащий: a) соединение формулы (I), или его фармацевтически приемлемую соль, сольват, сольват такой соли или его пролекарство, в первой единичной дозированной форме; b) ингибитор HMG Со-А редуктазы, или его фармацевтически приемлемую соль, сольват, сольват такой соли или его пролекарство, во второй единичной дозированной форме; и c) емкость, в которой содержатся указанные первая и вторая дозированные формы. В соответствии с другим вариантом осуществления настоящее изобретение обеспечивает набор, содержащий: a) соединение формулы (I), или его фармацевтически приемлемую соль, сольват, сольват такой соли или его пролекарство, в первой единичной дозированной форме; b) вещество, которое связывает желчную кислоту, во второй единичной дозированной форме; и c) емкость, в которой содержатся указанные первая и вторая дозированные формы. В соответствии с другим вариантом осуществления настоящее изобретение обеспечивает набор, содержащий: a) соединение формулы (I), или его фармацевтически приемлемую соль, сольват, сольват такой соли или его пролекарство, в первой единичной дозированной форме; b) ингибитор HMG Со-А редуктазы, или его фармацевтически приемлемую соль, сольват, сольват такой соли или его пролекарство, во второй единичной дозированной форме; c) вещество, которое связывает желчную кислоту, в третьей единичной дозированной форме; и d) емкость, в которой содержатся указанные первая, вторая и третья дозированные формы. В соответствии с другим вариантом осуществления настоящее изобретение обеспечивает набор, содержащий: a) соединение формулы (I), или его фармацевтически приемлемую соль, сольват, сольват такой соли или его пролекарство, совместно с фармацевтически приемлемым растворителем или носителем, в первой единичной дозированной форме; b) ингибитор HMG Со-А редуктазы, или его фармацевтически приемлемую соль, сольват, сольват такой соли или его пролекарство, во второй единичной дозированной форме; и c) емкость, в которой содержатся указанные первая и вторая дозированные формы. В соответствии с другим вариантом осуществления настоящее изобретение обеспечивает набор, содержащий: a) соединение формулы (I), или его фармацевтически приемлемую соль, сольват, сольват такой соли или его пролекарство, совместно с фармацевтически приемлемым растворителем или носителем, в первой единичной дозированной форме; b) вещество, которое связывает желчную кислоту, во второй единичной дозированной форме; и c) емкость, в которой содержатся указанные первая и вторая дозированные формы. В соответствии с другим вариантом осуществления настоящее изобретение обеспечивает набор, содержащий: а) соединение формулы (I), или его фармацевтически приемлемую соль, сольват, сольват такой соли или его пролекарство, совместно с фармацевтически приемлемым растворителем или носителем, в первой единичной дозированной форме; b) ингибитор HMG Co-A редуктазы, или его фармацевтически приемлемую соль, сольват, сольват такой соли или его пролекарство, во второй единичной дозированной форме; и c) вещество, которое связывает желчную кислоту, в третьей единичной дозированной форме; и d) емкость, в которой содержатся указанные первая, вторая и третья дозированные формы. Таким образом, другим вариантом осуществления изобретения является применение соединения формулы (I), или его фармацевтически приемлемой соли, сольвата, сольвата такой соли или его пролекарства, и ингибитора HMG Co-A редуктазы, или его фармацевтически приемлемой соли, сольвата, сольвата такой соли или его пролекарства, для приготовления лекарственного средства для применения для ингибирования переноса желчных кислот в подвздошной кишке (IBAT) у теплокровного животного, такого как человек. Следовательно, другим вариантом осуществления изобретения является применение соединения формулы (I), или его фармацевтически приемлемой соли, сольвата, сольвата такой соли или его пролекарства, и вещества, которое связывает желчную кислоту, для приготовления лекарственного средства для применения для ингибирования переноса желчных кислот в подвздошной кишке (IBAT) у теплокровного животного, такого как человек. Таким образом, другим вариантом осуществления изобретения является применение соединения формулы (I), или его фармацевтически приемлемой соли, сольвата, сольвата такой соли или его пролекарства, и ингибитора HMG Co-A редуктазы, или его фармацевтически приемлемой соли, сольвата, сольвата такой соли или его пролекарства, и вещества, которое связывает желчную кислоту, для приготовления лекарственного средства для применения для ингибирования переноса желчных кислот в подвздошной кишке (IBAT) у теплокровного животного, такого как человек. Таким образом, другим вариантом осуществления изобретения является применение соединения формулы (I), или его фармацевтически приемлемой соли, сольвата, сольвата такой соли или его пролекарства, ингибитора HMG Co-A редуктазы, или его фармацевтически приемлемой соли, сольвата, сольвата такой соли или его пролекарства, для приготовления лекарственного средства для применения для лечения гиперлипемических состояний у теплокровного животного, такого как человек. Таким образом, другим вариантом осуществления изобретения является применение соединения формулы (I), или его фармацевтически приемлемой соли, сольвата, сольвата такой соли или его пролекарства, вещества, которое связывает желчную кислоту, для приготовления лекарственного средства для применения для лечения гиперлипемических состояний у теплокровного животного, такого как человек. Таким образом, другим вариантом осуществления изобретения является применение соединения формулы (I), или его фармацевтически приемлемой соли, сольвата, сольвата такой соли или его пролекарства, ингибитора HMG Со-А редуктазы, или его фармацевтически приемлемой соли, сольвата, сольвата такой соли или его пролекарства, и вещества, которое связывает желчную кислоту, для приготовления лекарственного средства для применения для лечения гиперлипемических состояний у теплокровного животного, такого как человек. Следовательно, согласно дополнительному варианту осуществления изобретение обеспечивает комбинированное лечение, которое включает введение эффективного количества соединения формулы (I), или его фармацевтически приемлемой соли, сольвата, сольвата такой соли или его пролекарства, необязательно совместно с фармацевтически приемлемым растворителем или носителем, с одновременным, последовательным или раздельным введением эффективного количества ингибитора HMG Со-А редуктазы, или его фармацевтически приемлемой соли, сольвата, сольвата такой соли или его пролекарства, необязательно совместно с фармацевтически приемлемым растворителем или носителем теплокровному животному, такому как человек, которое нуждается в таком лечении. Следовательно, согласно дополнительному варианту осуществления изобретение обеспечивает комбинированное лечение, которое включает введение эффективного количества соединения формулы (I), или его фармацевтически приемлемой соли, сольвата, сольвата такой соли или его пролекарства, необязательно совместно с фармацевтически приемлемым растворителем или носителем, с одновременным, последовательным или раздельным введением эффективного количества вещества, которое связывает желчную кислоту, необязательно совместно с фармацевтически приемлемым растворителем или носителем теплокровному животному, такому как человек, которое нуждается в таком лечении. Следовательно, согласно дополнительному варианту осуществления изобретение обеспечивает комбинированное лечение, которое включает введение эффективного количества соединения формулы (I), или его фармацевтически приемлемой соли, сольвата, сольвата такой соли или его пролекарства, необязательно совместно с фармацевтически приемлемым растворителем или носителем, с одновременным, последовательным или раздельным введением эффективного количества ингибитора HMG Со-А редуктазы, или его фармацевтически приемлемой соли, сольвата, сольвата такой соли или его пролекарства, необязательно совместно с фармацевтически приемлемым наполнителем, с одновременным, последовательным или раздельным введением эффективного количества вещества, которое связывает желчную кислоту, необязательно совместно с фармацевтически приемлемым растворителем или носителем теплокровному животному, такому как человек, которое нуждается в таком лечении. Следовательно, согласно дополнительному варианту осуществления изобретение обеспечивает комбинированное лечение, которое включает введение эффективного количества соединения формулы (I), или его фармацевтически приемлемой соли, сольвата, сольвата такой соли или его пролекарства, необязательно совместно с фармацевтически приемлемым растворителем или носителем, с одновременным, последовательным или раздельным введением одного или нескольких следующих веществ, выбранных из группы, включающей: – ингибиторы СЕТР (белка, переносящего сложный эфир холестерина), например, те, на которые ссылаются и которые описаны в заявке WO 00/38725, стр.7, строка 22 – стр.10, строка 17, которые включены в настоящее изобретение путем ссылки; – антагонисты абсорбции холестерина, например азетидиноны, такие как SCH 58235 и те, которые описаны в патенте US 5767115, которые включены в настоящее изобретение путем ссылки; – ингибиторы МТР (микросомального переносящего белка), например, те, которые описаны в Science, 282, 751-54, 1998, которые включены в настоящее изобретение путем ссылки; – производные фибровой кислоты, например клофибрат, гемфиброзил, фенофибрат, ципрофибрат и безафибрат; – производные никотиновой кислоты, например никотиновая кислота (ниацин), аципимокс и ницеритрол; – фитостерольное соединение, например станолы; – пробукол; – соединение для лечения ожирения, например орлистат (ЕР 129748) и сибутрамин (GB 2184122 и US 4929629); – противогипертоническое соединение, например ингибитор ангиотензинпревращающего фермента, антагонист рецептора ангиотензина II, адренергический блокатор, альфа-адренергический блокатор, бета-адренергический блокатор, смешанный альфа/бета адренергический блокатор, адренергический стимулятор, блокатор кальциевых каналов, мочегонное средство или сосудорасширяющее средство; – инсулин; – сульфонилмочевины, включая глибенкламид, толбутамид; – метформин; и/или – акарбоза; или его фармацевтически приемлемую соль, сольват, сольват такой соли или его пролекарство, необязательно совместно с фармацевтически приемлемым растворителем или носителем теплокровному животному, такому как человек, которое нуждается в таком лечении. Предпочтительными ингибиторами АСЕ или их фармацевтически приемлемыми солями, сольватами, сольватами таких солей или их пролекарствами, включая активные метаболиты, которые могут применятся в сочетании с соединением формулы (I), являются, но не ограничиваясь, следующие соединения: алацеприл, алатриоприл, алтиоприл кальция, анковенин, беназеприл, гидрохлорид беназеприла, беназеприлат, бензоилкаптоприл, каптоприл, каптоприл-цистеин, каптоприл-глутатион, церанаприл, цераноприл, церонаприл, цилазаприл, цилазаприлат, делаприл, делаприл-дикислота, эналаприл, эналаприлат, энаприл, эпикаптоприл, фороксимитин, фосфеноприл, фосеноприл, фосеноприл натрия, фосинорил, фосиноприл натрия, фосиноприлат, фосиноприловая кислота, гликоприл, геморфин-4, идраприл, имидаприл, индолаприл, индолаприлат, либензаприл, лизиноприл, лициумин А, лициумин В, миксанприл, моексиприл, моексиприлат, мовелтиприл, мурацеин А, мурацеин В, мурацеин С, пентоприл, периндоприл, периндоприлат, пивалоприл, пивоприл, хинаприл, гидрохлорид хинаприла, хинаприлат, рамиприл, рамиприлат, спираприл, гидрохлорид спираприла, спираприлат, спироприл, гидрохлорид спироприла, темокаприл, гидрохлорид темокаприла, тепротид, трандолаприл, трандолаприлат, утибаприл, забициприл, забициприлат, зофеноприл и зофеноприлат. Предпочтительными ингибиторами АСЕ для применения согласно настоящему изобретению являются рамиприл, рамиприлат, лизиноприл, эналаприл и эналаприлат. Более предпочтительными ингибиторами АСЕ для применения согласно настоящему изобретению являются рамиприл и рамиприлат. Предпочтительными антагонистами ангиотензина II, их фармацевтически приемлемыми солями, сольватами, сольватами таких солей или их пролекарствами для применения в сочетании с соединением формулы (I) являются, но не ограничиваясь, соединения: кандесартан, кандесартан цилексетил, лосартан, валсартан, ирбесартан, тазосартан, телмисартан и эпросартан. Более предпочтительными антагонистами ангиотензина II или их фармацевтически приемлемыми производными для применения согласно настоящему изобретению являются кандесартан и кандесартан цилексетил. Согласно другому варианту осуществления изобретения соединение формулы (I), или его фармацевтически приемлемая соль, сольват, сольват такой соли или его пролекарство, может вводиться в сочетании с агонистом PPAR альфа и/или гамма, или их фармацевтически приемлемыми солями, сольватами, сольватами таких солей или их пролекарствами. Подходящие агонисты PPAR альфа и/или гамма, их фармацевтически приемлемые соли, сольваты, сольваты таких солей или их пролекарства хорошо известны в данной области. Такими соединениями являются соединения, описанные в международных заявках WO 01/12187, WO 01/12612, WO 99/62870, WO 99/62872, WO 99/62871, WO 98/57941, WO 01/40170, J Med Chem, 1996, 39, 665, Экспертиза терапевтических патентов, 10 (5), 623-634 (в частности, соединения, описанные в заявках на патент, перечисленные на странице 634) и J Med Chem, 2000, 43, 527, которые все включены в настоящее изобретение путем ссылки. Предпочтительньми агонистами PPAR альфа и/или гамма являются WY-14643, клофибрат, фенофибрат, безафибрат, GW 9578, троглитазон, пиоглитазон, розиглитазон, эглитазон, проглитазон, BRL-49634, KRP-297, JTT-501, SB 213068, GW 1929, GW 7845, GW 0207, L-796449, L-165041 и GW 2433. Более предпочтительным агонистом PPAR альфа и/или гамма является (S)-2-этокси-3-[4-(2-{4-метансульфонилоксифенил}этокси)фенил]пропионовая кислота и ее фармацевтически приемлемые соли. Дополнительными подходящими агонистами PPAR альфа и/или гамма являются NN622/Рагаглитазар и BMS 298585. Следовательно, согласно дополнительному варианту осуществления изобретение обеспечивает способ ингибирования переноса желчных кислот в подвздошной кишке (IBAT) у теплокровного животного, такого как человек, которое нуждается в таком лечении, который включает введение указанному животному эффективного количества соединения формулы (I), или его фармацевтически приемлемой соли, сольвата, сольвата такой соли или его пролекарства при одновременном, последовательном или раздельном введении эффективного количества агониста PPAR альфа и/или гамма, или его фармацевтически приемлемой соли, сольвата, сольвата такой соли или его пролекарства. Следовательно, согласно дополнительному варианту осуществления изобретение обеспечивает способ лечения гиперлипемических состояний у теплокровного животного, такого как человек, которое нуждается в таком лечении, который включает введение указанному животному эффективного количества соединения формулы (I), или его фармацевтически приемлемой соли, сольвата, сольвата такой соли или его пролекарства при одновременном, последовательном или раздельном введении эффективного количества агониста PPAR альфа и/или гамма, или его фармацевтически приемлемой соли, сольвата, сольвата такой соли или его пролекарства. Согласно другому варианту осуществления изобретение обеспечивает фармацевтическую композицию, которая содержит соединение формулы (I), или его фармацевтически приемлемую соль, сольват, сольват такой соли или его пролекарство, и агонист PPAR альфа и/или гамма, или его фармацевтически приемлемую соль, сольват, сольват такой соли или его пролекарство, в сочетании с фармацевтически приемлемым растворителем или носителем. Согласно другому варианту осуществления настоящее изобретение обеспечивает набор, содержащий соединение формулы (I), или его фармацевтически приемлемую соль, сольват, сольват такой соли или его пролекарство, и агонист PPAR альфа и/или гамма, или его фармацевтически приемлемую соль, сольват, сольват такой соли или его пролекарство. Согласно другому варианту осуществления настоящее изобретение обеспечивает набор, содержащий: a) соединение формулы (I), или его фармацевтически приемлемую соль, сольват, сольват такой соли или его пролекарство, в первой единичной дозированной форме; b) агонист PPAR альфа и/или гамма, или его фармацевтически приемлемую соль, сольват, сольват такой соли или его пролекарство, во второй единичной дозированной форме; и c) емкость, в которой содержатся указанные первая и вторая дозированные формы. Согласно другому варианту осуществления настоящее изобретение обеспечивает набор, содержащий: a) соединение формулы (I), или его фармацевтически приемлемую соль, сольват, сольват такой соли или его пролекарство, совместно с фармацевтически приемлемым растворителем или носителем, в первой единичной дозированной форме; b) агонист PPAR альфа и/или гамма, или его фармацевтически приемлемую соль, сольват, сольват такой соли или его пролекарство, во второй единичной дозированной форме; и c) емкость, в которой содержатся указанные первая и вторая дозированные формы. Таким образом, другим вариантом осуществления изобретения является применение соединения формулы (I), или его фармацевтически приемлемой соли, сольвата, сольвата такой соли или его пролекарства, и агониста PPAR альфа и/или гамма, или его фармацевтически приемлемой соли, сольвата, сольвата такой соли или его пролекарства, для приготовления лекарственного средства для применения для ингибирования переноса желчных кислот в подвздошной кишке (IBAT) у теплокровного животного, такого как человек. Таким образом, другим вариантом осуществления изобретения является применение соединения формулы (I), или его фармацевтически приемлемой соли, сольвата, сольвата такой соли или его пролекарства, агониста PPAR альфа и/или гамма, или его фармацевтически приемлемой соли, сольвата, сольвата такой соли или его пролекарства, для приготовления лекарственного средства для применения для лечения гиперлипемических состояний у теплокровного животного, такого как человек. Следовательно, согласно дополнительному варианту осуществления изобретение обеспечивает комбинированное лечение, которое включает введение эффективного количества соединения формулы (I), или его фармацевтически приемлемой соли, сольвата, сольвата такой соли или его пролекарства, необязательно совместно с фармацевтически приемлемым растворителем или носителем, с одновременным, последовательным или раздельным введением эффективного количества агониста PPAR альфа и/или гамма, или его фармацевтически приемлемой соли, сольвата, сольвата такой соли или его пролекарства, необязательно совместно с фармацевтически приемлемым растворителем или носителем теплокровному животному, такому как человек, которое нуждается в таком лечении. Дополнительно к их применению в терапевтической медицине, соединения формулы (I), или их фармацевтически приемлемые соли, сольваты, сольваты таких солей или их пролекарства, также полезны в качестве фармацевтических средств для развития и стандартизации тестируемых систем в условиях in vitro и in vivo для оценки действий ингибиторов переноса желчных кислот в подвздошной кишке (IBAT) у лабораторных животных, таких как коты, собаки, кролики, обезьяны, крысы и мыши, для поиска новых терапевтических средств. Многие промежуточные продукты, описанные в настоящем изобретении, являются новыми, и, следовательно, они являются объектом настоящего изобретения. Например, соединения формулы (IXa), (IXb), (Ха) и (Xb) обнаруживают ингибирующее действие по отношению к переносу желчных кислот в подвздошной кишке (IBAT), при исследовании в вышеупомянутых испытаниях в условиях in vitro, и поэтому они заявляются в качестве одного из предпочтительных вариантов осуществления изобретения. Таким образом, согласно дополнительному варианту осуществления объектом изобретения является соединение формулы (IXa), (IXb), (Ха) или (Xb), или его фармацевтически приемлемая соль, сольват, сольват такой соли или его пролекарство. Согласно дополнительному варианту осуществления изобретение обеспечивает фармацевтическую композицию, которая содержит соединение формулы (IXa), (IXb), (Ха) или (Xb), или его фармацевтически приемлемую соль, сольват, сольват такой соли или его пролекарство, как описано здесь выше, в сочетании с фармацевтически приемлемым растворителем или носителем. В соответствии с дополнительным вариантом осуществления объектом настоящего изобретения является соединение формулы (IXa), (IXb), (Ха) или (Xb), или его фармацевтически приемлемая соль, сольват, сольват такой соли или его пролекарство, как описано здесь выше, для применения в способе профилактики или терапевтического лечения теплокровного животного, такого как человек. Таким образом, в соответствии с этим вариантом осуществления объектом изобретения является соединение формулы (IXa), (IXb), (Ха) и (Xb), или его фармацевтически приемлемая соль, сольват, сольват такой соли или его пролекарство, как описано здесь выше, для применения в качестве лекарственного средства. Другим вариантом осуществления изобретения является применение соединения формулы (IXa), (IXb), (Ха) или (Xb), или его фармацевтически приемлемой соли, сольвата, сольвата такой соли или его пролекарства, как описано здесь выше, для приготовления лекарственного средства для применения для ингибирования переноса желчных кислот в подвздошной кишке (IBAT) у теплокровного животного, такого как человек. Другим вариантом осуществления изобретения является применение соединения формулы (IXa), (IXb), (Xa) или (Xb), или его фармацевтически приемлемой соли, сольвата, сольвата такой соли или его пролекарства, как описано здесь выше, для приготовления лекарственного средства для применения для лечения гиперлипемических состояний у теплокровного животного, такого как человек. Согласно дополнительному варианту осуществления изобретение обеспечивает способ ингибирования переноса желчных кислот в подвздошной кишке (IBAT) у теплокровного животного, такого как человек, которое нуждается в таком лечении, который включает введение указанному животному эффективного количества соединения формулы (IXa), (IXb), (Xa) или (Xb), или его фармацевтически приемлемой соли, сольвата, сольвата такой соли или его пролекарства. Согласно дополнительному варианту осуществления изобретение обеспечивает способ лечения гиперлипемических состояний у теплокровного животного, такого как человек, которое нуждается в таком лечении, который включает введение указанному животному эффективного количества соединения формулы (IXa), (IXb), (Xa) или (Xb), или его фармацевтически приемлемой соли, сольвата, сольвата такой соли или его пролекарства. В других вышеуказанных вариантах фармацевтической композиции, способа, метода, применения и приготовления лекарственного средства также применяются альтернативные и предпочтительные варианты осуществления соединений, описанные в настоящем изобретении. Примеры Далее изобретение иллюстрируется следующими примерами, которые не ограничивают его объем, в которых могут применятся стандартные методики, известные специалисту в области химии, и методики, аналогичные описанным в примерах настоящего изобретения, если они являются соответствующими, и в которых, если специально не указано иначе: (i) испарение осуществляют на роторном испарителе в вакууме и процедуру обработки осуществляют после удаления остатков твердых веществ, таких как осушители, путем фильтрации; (ii) все реакции осуществляют в инертной атмосфере при температуре окружающей среды, обычно в диапазоне 18-25°С, с растворителями уровня ВЭЖХ в безводных условиях, если специально не указано иначе; (iii) колоночную хроматографию (при помощи флеш-методики) осуществляют на силикагелевой колонке 40-63 мкм (Merck); (iv) выходы представлены только с целью иллюстрации, и необязательно, что могут быть достигнуты максимальные значения; (v) структуру конечных продуктов формулы (I), как правило, подтверждали при помощи ядерного (как правило, протонного) магнитного резонанса (ЯМР) и масс-спектральных методов; значения химического сдвига магнитного резонанса измеряли в обработанном дейтерием CD3OD (если специально не указано иначе) на дельта-шкале (част. на млн, относительно тетраметилсилана); приводили данные протонов, если специально не указано иначе; спектры регистрировали на спектрометре Varian Mercury-300 МГц, Varian Unity plus-400 МГц, Varian Unity plus-600 МГц или на Varian Inova-500 МГц; и пики мультиплетности представляли следующим образом: s, синглет; d, дублет; dd, дублет дублетов; t, триплет; tt, тройной триплет; q, квартет; tq, тройной квартет; m, мультиплет; br, широкий; LCMS регистрировали на Waters ZMD, LC колонка xTerra MS C8 (Waters), регистрировали с комплектом оборудования HP 1100 MS-детекторным полупроводниковым диодом; масс-спектрометрию (MS) (петлевую) регистрировали на VG Platform II (приборы Fisons) с комплектом оборудования HP-1100 MS-детекторным полупроводниковым диодом; если специально не указано иначе, масс-ион обозначали как (МН+); (vi) если в тексте не указано более подробно, аналитическую высокоэффективную жидкостную хроматографию (ВЭЖХ) осуществляли на Prep LC 2000 (Waters), Kromasil C8, 7 мкм, (Akzo Nobel); MeCN и деионизированную воду 100 мМ ацетат аммония использовали в качестве подвижных фаз, с подходящим составом; (vii) промежуточные продукты, как правило, не были полностью охарактеризованы и чистоту определяли при помощи тонкослойной хроматографии (ТСХ), ВЭЖХ, инфракрасного (ИК), MS или ЯМР анализов; (viii) если растворы высушивали, в качестве осушителя использовали сульфат натрия; (ix) если приведена ссылка на колонку “ISOLUTE”, то под этим подразумевается, что колонка содержит 2 г диоксида кремния, диоксид кремния заключен в 6 мл одноразового шприца и поддерживается мембраной с размерами пор 54 Å, полученную от International Sorbent Technology под наименованием “ISOLUTE”; “ISOLUTE” является зарегистрированным товарным знаком; (х) следующие сокращения могут использоваться выше и в дальнейшем:
Пример 1 1.1-Диоксо-3,3-дибутил-5-фенил-7-бром-8-(N{R- К раствору 1,1-диоксо-3,3-дибутил-5-фенил-7-бром-8-карбоксиметокси-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепина (Способ 2; 0,020 г, 3,71·10-5 моль) в ДХМ (4 мл) добавляли (R)- Пример 2 1,1-Диоксо-3,3-дибутил-5-фенил-7-метилтио-8-(N-{(R)- К раствору 1,1-диоксо-3,3-дибутил-5-фенил-7-метилтио-8-карбоксиметокси-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепина (Способ 3; 0,016 г, 3,16·10-5 моль) в ДХМ (4 мл) добавляли (R)- Пример 3 1,1-Диоксо-3,3-дибутил-5-фенил-7-бром-8-(N-{(R)- К раствору 1,1-диоксо-3,3-дибутил-5-фенил-7-бром-8-карбоксиметокси-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепина (Способ 2; 0,050 г, 9,27·10-5 моль) в ДМФА (6 мл) добавляли 2-{[(2R)-2-амино-2-(4-гидроксифенил)этаноил]амино}этансульфоновую кислоту (Способ 6; 0,033 г, 1,20·10-4 моль) и N-метилморфолин (0,041 мл, 3,72·10-4 моль). Смесь перемешивали в течение 10 мин и затем добавляли TBTU (0,039 г, 1,21·10-4 моль). Реакционную смесь перемешивали всю ночь, и растворитель удаляли при пониженном давлении. Остаток очищали путем препаративной ВЭЖХ, используя в качестве элюента MeCN/аммоний-ацетатный буфер, и сушили вымораживанием, получая 0,039 г указанного в заглавии соединения (53%) в виде белого твердого вещества. ЯМР (400 МГц, ДМСО-d6) 0,60-0,80 (m, 6H), 0,80-1,60 (m, 12H), 2,40-2,60 (m, 2H), 3,10-3,50 (m, 2H), 3,85 (brs, 2H), 4,70 (d (AB), 1H), 4,75 (d (AB), 1H), 5,25 (d, 1H), 6,70 (s, 1H), 6,75 (s, 1H), 6,85-7,80 (m, 10Н), 8,15-8,25 (m, 1H), 8,45 (d, 1H), 9,40 (brs, 1H). Пример 4 1,1-Диоксо-3,3-дибутил-5-фенил-7-метилтио-8-(N-{(R)- Раствор 1,1-диоксо-3,3-дибутил-5-фенил-7-метилтио-8-карбоксиметокси-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепина (Способ 3; 0,050 г, 0,099 ммоль), трет-бутил N-[(2R)-2-амино-2-фенилэтаноил]-о-(трет-бутил)-L-серината (Способ 14; 0,042 г, 0,120 ммоль) и N-метилморфолина (0,033 мл, 0,299 ммоль) в ДХМ (4 мл) перемешивали при комнатной температуре в течение 10 мин, после чего добавляли TBTU (0,041 г, 0,128 ммоль)). Через 8 часов превращение завершилось; m/z: 839,7. Добавляли ТФК (2 мл) и реакционную смесь перемешивали в течение 12 часов. Раствор переносили в делительную воронку и дважды промывали водой и затем концентрировали. Остаток очищали путем препаративной ВЭЖХ, используя градиент 40-60% MeCN в 0,1 М аммоний-ацетатном буфере в качестве элюента. Получали 0,045 г указанного в заглавии соединения (63%) в виде белого твердого вещества. ЯМР (400 МГц, ДМСО-d6): 0,60-0,80 (6Н, m), 0,85-1,60 (12Н, m), 2,10 (3Н, s), 3,40-3,65 (2Н, m), 3,85 (2Н, brs), 4,10-4,20 (1Н, m), 4,70 (1H, d(AB)), 4,75 (1H, d(AB)), 5,70 (1H, d), 6,60 (1H, s), 6,85-7,50 (12H, m), 8,50 (1H, d), 8,60 (1H, d); m/z: 839,7. Пример 5 1,1-Диоксо-3,3-дибутил-5-фенил-7-метилтио-8-(N-{(R)- Раствор 1,1-диоксо-3,3-дибутил-5-фенил-7-метилтио-8-[N-((R)-карбоксибензил)карбамоилметокси]-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепина (Пример 25; 0,055 г, 0,086 ммоль), L-аланина, 1,1-диметилэтилсложного эфира, гидрохлорида (0,017 г, 0,098 ммоль) и N-метилморфолина (0,028 мл, 0,254 ммоль) в ДХМ (5 мл) перемешивали при комнатной температуре в течение 10 мин, после чего добавляли TBTU (0,033 г, 0,103 ммоль). Через 16 часов превращение завершилось; m/z: 767,4. Добавляли ТФК (2,5 мл) и реакционную смесь перемешивали на протяжении 2 часов. Раствор разводили толуолом и затем концентрировали. Остаток очищали путем препаративной ВЭЖХ, используя градиент 40-60% MeCN в 0,1 М аммоний-ацетатном буфере в качестве элюента. Получали 0,044 г указанного в заглавии соединения (72%) в виде белого твердого вещества. ЯМР (400 МГц): 0,70-0,85 (6Н, m), 0,90-1,70 (12H, m), 1,30 (3Н, d), 2,10 (3Н, s), 3,95 (2Н, brs), 4,25-4,40 (1H, m), 4,60 (1H, d(AB)), 4,65 (1H, d(AB)), 5,60 (1H, s), 6,60 (1H, s), 6,95-7,50 (11H, m); m/z: 767,4. Пример 6 1,1-Диоксо-3,3-дибутил-5-фенил-7-метилтио-8-(N-{(R)- Раствор 1,1-диоксо-3,3-дибутил-5-фенил-7-метилтио-8-[N-((R)- Пример 7 1,1-Диоксо-3,3-дибутил-5-фенил-7-метилтио-8-(N-{(R)- Раствор 1,1-диоксо-3,3-дибутил-5-фенил-7-метилтио-8-[N-((R)- Пример 8 1,1-Диоксо-3,3-дибутил-5-фенил-7-метилтио-8-(N-{(R)- N-Метилморфолин (0,034 мл, 0,314 ммоль), TBTU (0,033 г, 0,103 ммоль) и L-аспарагин, 1,1-диметилэтилсложный эфир, моногидрохлорид (0,021 г, 0,093 ммоль) последовательно добавляли к раствору 1,1-диоксо-3,3-дибутил-5-фенил-7-метилтио-8-[N-((R)- Пример 9 Аммониевая соль 1,1-диоксо-3,3-дибутил-фенил-метилтио-8-(N-{(R)- Указанное в заглавии соединение синтезировали, используя методику согласно примеру 3, исходя из 1,1-диоксо-3,3-дибутил-5-фенил-7-метилтио-8-карбоксиметокси-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепина (Способ 3; 43 мг, 0,085 ммоль). Растворитель выпаривали через 3 часа и неочищенный продукт очищали путем препаративной ВЭЖХ (С8 колонка, 50×250 мм), используя градиент (40/60 до 60/40) MeCN/0,1 M аммоний-ацетатного буфера в качестве элюента. При лиофилизации получали 38 мг (выход 57%) указанного в заглавии соединения. ЯМР (400 МГц): 0,8 (t, 6Н), 1,0-1,2 (m, 6Н), 1,25-1,4 (m, 2H), 1,4-1,5 (m, 2Н), 1,55-1,7 (m, 2H), 2,1 (s, 3H), 2,8-3,0 (m, 2H), 3,55-3,7 (m, 2H), 3,95 (brs, 2H), 4,6 (ABq, 2H), 5,35 (s, 1H), 6,6 (s, 1H), 6,75 (d, 2H), 7,05 (t, 1H), 7,15-7,4 (m, 7H), 8,15 (t, 1H); m/z: 763. Пример 10 1,1-Диоксо-3,3-дибутил-5-фенил-7-метилтио-8-(N-{(R)- 1,1-Диоксо-3,3-дибутил-5-фенил-7-метилтио-8-[N-((R)- Пример 11 1,1-Диоксо-3,3-дибутил-5-фенил-7-метилтио-8-(N-{(R)- Указанное в заглавии соединение синтезировали, используя методику, описанную в примере 10, исходя из 1,1-диоксо-3,3-дибутил-5-фенил-7-метилтио-8-[N-((R)- Пример 12 1,1-Диоксо-3,3-дибутил-5-фенил-7-метилтио-8-(N-{(R)- Указанное в заглавии соединение синтезировали, используя методику, описанную в примере 10, исходя из 1,1-диоксо-3,3-дибутил-5-фенил-7-метилтио-8-|N-((R)- Пример 13 Аммониевая соль 1,1-диоксо-3,3-дибутил-5-фенил-7-метилтио-8-(N-{(R)- 1,1-Диоксо-3,3-дибутил-5-фенил-7-метилтио-8-[N-((R)- Пример 14 1,1-Диоксо-3,3-дибутил-5-фенил-7-метилтио-8-(N-{(R)- 1,1-Диоксо-3,3-дибутил-5-фенил-7-метилтио-8-[N-((R)- Пример 15 1,1-Диоксо-3,3-дибутил-5-фенил-7-метилтио-8-(N-{(R)- 1,1-Диоксо-3,3-дибутил-5-фенил-7-метилтио-8-[N-((R)- Пример 16 1,1-Диоксо-3,3-дибутил-5-фенил-7-метилтио-8-(N-{(R)- Указанное в заглавии соединение синтезировали согласно методике, приведенной в примере 15, исходя из 1,1-диоксо-3,3-дибутил-5-фенил-7-метилтио-8-[N-((R)- Пример 17 1,1-Диоксо-3,3-дибутил-5-фенил-7-метилтио-8-(N-{(R)- Указанное в заглавии соединение синтезировали согласно методике, приведенной в примере 15, исходя из 1,1-диоксо-3,3-дибутил-5-фенил-7-метилтио-8-[N-((R)- Пример 18 1,1-Диоксо-3,3-дибутил-5-фенил-7-метилтио-8-[N-((R)- 1,1-Диоксо-3,3-дибутил-5-фенил-7-метилтио-8-карбоксиметокси-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин (Способ 3; 295 мг, 0,58 ммоль) растворяли в 10 мл ДХМ. Последовательно добавляли 4-(1-(R)-трет-бутоксикарбонил-1-аминометил)фенол (Способ 7; 160 мг, 0,72 ммоль), 2,6-лутидин (140 мкл, 1,20 ммоль) и TBTU (230 мг, 0,72 ммоль). Смесь перемешивали в течение 3 часов. Дополнительно добавляли 4-(1-(R)-трет-бутоксикарбонил-1-аминометил)фенол (10 мг, 0,04 ммоль) и продолжали перемешивать в течение 2 часов. Добавляли ДХМ (20 мл), и раствор промывали с NaHCO3 (5%, 20 мл), KHSO4 (0,3 М; 20 мл), соляным раствором (20 мл) перед тем, как высушивали и концентрировали до объема 10 мл. Подтверждали получение трет-бутилового эфира указанного в заглавии соединения; m/z: 729 (М+18 (NH4 +)). Добавляли ТФК (1,3 мл), и смесь перемешивали в течение 4,5 часов и концентрировали. Неочищенный продукт очищали путем препаративной ВЭЖХ, используя С8 колонку (50×500 мм) и градиент (40/60 до 70/30 в течение 40 минут) MeCN/0,1 M аммоний-ацетатного буфера в качестве элюента. При лиофилизации получали указанное в заглавии соединение при выходе 77,5% (302 мг). ЯМР (400 МГц) 0,8 (t, 6Н), 1,0-1,2 (m, 6Н), 1,25-1,4 (m, 2H), 1,4-1,5 (m, 2Н), 1,55-1,7 (m, 2H), 2,1 (s, 3Н), 3,95 (brs, 2H), 4,6 (ABq, 2H), 5,3 (s, 1H), 6,6 (s, 1H), 6,75 (d, 2H), 7,05 (t, 1H) 7,15-7,4 (m, 7H); m/z: 673 (М+18 (NH4 +)). Пример 19 1,1-Диоксо-3,3-дибутил-5-фенил-7-метилтио-8-(N-{(R)- 1,1-Диоксо-3,3-дибутил-5-фенил-7-метилтио-8-[N-((R)- Пример 20 1,1-Диоксо-3,3-дибутил-5-фенил-7-метилтио-8-(N-{(R)- 1,1-Диоксо-3,3-дибутил-5-фенил-7-метилтио-8-[N-((R)- Пример 21 1,1-Диоксо-3,3-дибутил-5-фенил-7-метилтио-8-(N-[(R)- 1,1-Диоксо-3,3-дибутил-5-фенил-7-метилтио-8-(N-{(R)- Пример 22 1,1-Диоксо-3,3-дибутил-5-фенил-7-метилтио-8-(N-{(R)- Указанное в заглавии соединение синтезировали из 1,1-диоксо-3,3-дибутил-5-фенил-7-метилтио-8-(N-{(R)- Пример 23 1,1-Диоксо-3,3-дибутил-5-фенил-7-метилтио-8-(N-{(R)- Указанное в заглавии соединение синтезировали из 1,1-диоксо-3,3-дибутил-5-фенил-7-метилтио-8-[N-((R)- Пример 24 Аммониевая соль 1,1-диоксо-3,3-дибутил-5-фенил-7-метилтио-8-(N-{(R)- 1,1-Диоксо-3,3-дибутил-5-фенил-7-метилтио-8-[N-((R)- Пример 25 1,1-Диоксо-3,3-дибутил-5-фенил-7-метилтио-8-[N-((R)- 1,1-Диоксо-3,3-дибутил-5-фенил-7-метилтио-8- {N-[(R)- Пример 26 1,1-Диоксо-3,3-дибутил-5-фенил-7-метилтио-8-(N-{(R)- 1,1-Диоксо-3,3-дибутил-5-фенил-7-метилтио-8-[N-((R)- Пример 27 1,1-Диоксо-3,3-дибутил-5-фенил-7-метилтио-8-(N-{(R)- Указанное в заглавии соединение синтезировали, используя методику, описанную в примере 26, исходя из 1,1-диоксо-3,3-дибутил-5-фенил-7-метилтио-8-[N-((R)- Пример 28 1,1-Диоксо-3,3-дибутил-5-фенил-7-метилтио-8-(N-{(R)- Указанное в заглавии соединение синтезировали, используя методику, описанную в примере 26, исходя из 1,1-диоксо-3,3-дибутил-5-фенил-7-метилтио-8-[N-((R)- Пример 29 1,1-Диоксо-3,3-дибутил-5-фенил-7-метилтио-8-(N-{(R)- Раствор 1,1-диоксо-3,3-дибутил-5-фенил-7-метилтио-8-[N-((R)- Пример 30 1,1-Диоксо-3,3-дибутил-5-фенил-7-метилтио-8-(N-{(R)- Раствор 1,1-диоксо-3,3-дибутил-5-фенил-7-метилтио-8-[N-((R)- Пример 31 1,1-Диоксо-3,3-дибутил-5-фенил-7-метил-8-(N-{(R)- Раствор 1,1-диоксо-3,3-дибутил-5-фенил-7-метил-8-карбоксиметокси-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепина (Способ 5; 0,050 г, 0,105 ммоль), (R)- Пример 32 1,1-Диоксо-3,3-дибутил-5-фенил-7-метил-8-(N-{(R)- Раствор 1,1-диоксо-3,3-дибутил-5-фенил-7-метил-8-карбоксиметокси-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепина (Способ 16; 0,050 г, 0,105 ммоль), (R)- Пример 33 1,1-Диоксо-3,3-дибутил-5-фенил-7-метилтио-8-(N-{(R)- 1,1-Диоксо-3,3-дибутил-5-фенил-7-метилтио-8-(N-{(R)- Пример 34 1,1-Диоксо-3,3-дибутил-5-фенил-7-метилтио-8-(N-{(R)- 1,1-Диоксо-3,3-дибутил-5-фенил-7-метилтио-8-(N-{(R)- Пример 35 1,1-Диоксо-3,3-дибутил-5-фенил-7-метилтио-8-(N-{(R)- 1,1-Диоксо-3,3-дибутил-5-фенил-7-метилтио-8-(N-{(R)- Пример 36 1,1-Диоксо-3,3-дибутил-5-Фенил-7-метилтио-8-(N-{(R)- 1,1-Диоксо-3,3-дибутил-5-фенил-7-метилтио-8-(N-{(R)- Пример 37 1,1-Диоксо-3,3-дибутил-5-фенил-7-метилтио-8-(N-{(R)- 1,1-Диоксо-3,3-дибутил-5-фенил-7-метилтио-8-(N-{(R)- 1,1-Диоксо-3,3-дибутил-3-фенил-7-метилтио-8-[N-((R)- Пример 38 1,1-Диоксо-3,3-дибутил-5-фенил-7-метилтио-8-(N-{(R)- Указанное в заглавии соединение получали при помощи методики согласно примеру 37, исходя из 1,1-диоксо-3,3-дибутил-5-фенил-7-метилтио-8-|N-((R)- Пример 39 1,1-Диоксо-3,3-дибутил-5-фенил-7-метилтио-8-[N-((R)- 1,1-Диоксо-3,3-дибутил-5-фенил-7-метилтио-8-[N-((R)- 1,1-Диоксо-3,3-дибутил-5-фенил-7-метилтио-8-[N-((R)- Получение исходных веществ Исходные вещества для вышеприведенных примеров являются либо коммерчески доступными, либо они легко могут быть получены при помощи стандартных способов из известных веществ. Например, следующие реакции приведены с целью иллюстрации, но никоим образом не ограничивают объем изобретения, для некоторых исходных веществ, которые используются в вышеприведенных реакциях. Способ 1 1,1-Диоксо-3,3-дибутил-5-фенил-7-бром-8-этоксикарбонилметокси-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин и 1,1-Диоксо-3,3-дибутил-5-фенил-7-метилтио-8-этоксикарбонилметокси-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин К суспензии 1,1-диоксо-3,3-дибутил-5-фенил-7-бром-8-метокси-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепина (полученного в соответствии с заявкой WO 98/38182; 0,218 г, 5,65·10-4 моль) в ДМФА (5 мл) добавляли NaSMe (0,210 г, 2,83 ммоль, 95%), и смесь перемешивали в течение 5 часов при 120°С. Растворитель удаляли при пониженном давлении, и остаток разделяли между EtOAc и 0,5 М HCl. Водный слой экстрагировали еще дважды с EtOAc, и объединенные органические экстракты высушивали (MgSO4) и концентрировали. Остаток растворяли в MeCN (7 мл) и добавляли этилбромацетат (0,063 мл, 5,65·10-4 моль), бромид тетрабутиламмония (0,018 г, 5,65·10-5 моль) и карбонат натрия (0,250 г, 2,36 ммоль). Смесь перемешивали в течение ночи при 80°С. Растворитель удаляли при пониженном давлении, и остаток разделяли между EtOAc и 0,5 М HCl. Органический слой промывали с соляным раствором, высушивали (MgSO4) и концентрировали. При флеш-хроматографии на силикагеле (Нех:EtOAc-6:1) получали указанные в заглавии соединения в виде бесцветных масел: 1,1-диоксо-3,3-дибутил-5-фенил-7-бром-8-этоксикарбонилметокси-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин, 0,187 г (58%). ЯМР (400 МГц, CDCl3) 0,70-0,80 (m, 6Н), 0,90-1,70 (m, 15Н), 3,90 (brs, 2H), 4,25 (q, 2Н), 4,35 (brs, 1H), 4,65 (s, 2H), 6,95-7,40 (m, 7H); и 1,1-диоксо-3,3-дибутил-5-фенил-7-метилтио-8-этоксикарбонилметокси-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин, 0,024 г (8%). ЯМР (400 М Гц, CDCl3) 0,70-0,85 (m, 6H), 0,90-1,70 (m, 15H), 2,10 (s, 3Н), 3,90 (brs, 2H), 4,20 (brs, 1H), 4,25 (q, 2H), 4,65 (s, 2H), 6,55 (s, 1H), 6,95-7,35 (m, 6H). Способ 2 1,1-Диоксо-3.3-дибутил-5-фенил-7-бром-8-карбоксиметокси-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин К раствору 1,1-диоксо-3,3-дибутил-5-фенил-7-бром-8-этоксикарбонилметокси-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепина (Способ 1; 0,184 г, 3,24·10-4 моль) в EtOH (7 мл) добавляли NaOH (0,052 г, 1,30 ммоль), и смесь перемешивали всю ночь. Растворитель удаляли при пониженном давлении, и остаток разделяли между EtOAc, и 0,5 М HCl. Водный слой экстрагировали еще дважды с EtOAc, и объединенные органические экстракты промывали с соляным раствором и концентрировали. Неочищенный продукт очищали путем препаративной ВЭЖХ, используя в качестве элюента MeCN/аммоний-ацетатный буфер и сушили вымораживанием, получая 0,173 г указанного в заглавии соединения (99%) в виде белого твердого вещества. ЯМР (400 МГц, CD3OD) 0,70-0,85 (m, 6H), 0,95-1,70 (m, 12H), 3,90 (brs, 2H), 4,50 (s, 2H), 6,90-7,40 (m, 7H). Способ 3 1,1-Диоксо-3,3-дибутил-5-фенил-7-метилтио-8-карбоксиметокси-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин К раствору 1,1-диоксо-3,3-дибутил-5-фенил-7-метилтио-8-этоксикарбонил-метокси-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепина (Способ 1; 0,024 г, 4,49·10-5 моль) в EtOH (3 мл) добавляли NaOH (0,007 г, 1,80·10-4 моль), и смесь перемешивали в течение ночи. Растворитель удаляли при пониженном давлении, и остаток очищали путем препаративной ВЭЖХ, используя в качестве элюента MeCN/аммоний-ацетатный буфер, и сушили вымораживанием. Получали 0,021 г указанного в заглавии соединения (92%) в виде белого твердого вещества. ЯМР (400 МГц, CD3OD) 0,70-0,85 (m, 6Н), 1,00-1,70 (m, 12H), 2,10 (s, 3Н), 3,90 (brs, 2H), 4,55 (s, 2H), 6,60 (s, 1H), 6,90-7,35 (m, 6H). Способ 3 1,1-Диоксо-3,3-дибутил-5-фенил-7-метилтио-8-карбоксиметокси-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин (альтернативное приготовление) 1,1-Диоксо-2-(4-метоксибензил)-3,3-дибутил-5-фенил-7-метилтио-8-(трет-бутоксикарбонилметокси)-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин (Способ 25; 6,902 г, 10,11 ммоль) растворяли в смеси ТФК (50 мл) и Et3Si (8 мл) и раствор перемешивали в течение 90 минут при комнатной температуре. Растворитель удаляли при пониженном давлении, и остаток растворяли в трет-BuOMe (100 мл). Органическую фазу промывали водой (20 мл) и затем трижды экстрагировали с разведенным NaOH (2×50 мл 0,5 М). Объединенные органические экстракты подкисляли разведенной HCl (70 мл, 1 М) (рН 1-2) и затем дважды экстрагировали с трет-BuOMe (2×50 мл). Эфирный слой промывали с соляным раствором, высушивали над MgSO4 и концентрировали. Получали 4,694 г (92%) требуемого продукта в виде коричневого масла. ЯМР (400 МГц, CD3OD): 0,70-0,85 (m, 6H), 1,00-1,25 (m, 6H), 1,25-1,50 (m, 4H), 1,55-1,70 (m, 2H), 2,10 (s, 3Н), 3,90 (brs, 2H), 4,55 (s, 2H), 6,60 (s, 1H), 6,95-7,35 (m, 6H). Способ 4 (R)-N-Бензилоксикарбонил- (2R)-{[(Бензилокси)карбонил]амино}(фенил)уксусную кислоту (10 г, 35,0 ммоль) и гидрохлорид трет-бутилглицина (6,3 г, 37,4 ммоль) растворяли в ДХМ (200 мл) с 2,6-лутидином (8,2 мл, 70,4 ммоль). После перемешивания на протяжении 5 минут при 0°С добавляли TBTU (12,4 г, 38,6 ммоль) и продолжали перемешивать в течение 1,5 часов при 0°С и 3,75 часа при комнатной температуре. Реакционную смесь промывали водой (2×100 мл), высушивали (MgSO4) и очищали путем флеш-хроматографии (ДХМ:EtOAc 7:1 Способ 5 (R)- (R)-N-Бензилоксикарбонил- Способ 6 2-{[(2R)-2-Амино-2-(4-гидроксифенил)этаноил]амино}этансульфоновая кислота N-Вос-(D)-4-гидроксифенилглицин (1,00 г, 3,21 ммоль) растворяли в ДМФА (5 мл) и добавляли таурин тетрабутиламмония (2,36 г, 6,42 ммоль) вместе с дополнительными 5 мл ДМФА. Полученную суспензию охлаждали на льду и добавляли TBTU (1,24 г, 3,85 ммоль). Ледяную баню удаляли через 30 минут, и смесь перемешивали на протяжении 2 часов перед тем, как фильтровали и концентрировали. Добавляли ТФК в ДХМ (20%, 20 мл), и реакционную смесь перемешивали в течение ночи. Добавляли этанол (20 мл), и растворители выпаривали. Неочищенный продукт кипятили в колбе с обратным холодильником в этаноле (100 мл) в течение 1 часа. При фильтрации получали чистое указанное в заглавии соединение в виде белого твердого вещества, 626 мг (71%). ЯМР (ДМСО-d6): 2,4-2,6 (m, 2H), 3,2-3,4 (m, 2H), 4,79 (s, 1H), 6,78 (d, 2H), 7,23 (d, 2H), 8,22 (t, 1H), 8,4 (brs, 3Н), 9,7 (s, 1H). Способ 7 4-(1-(R)-трет-Бутоксикарбонил-1-аминометил)фенол Серную кислоту (конц., 1 мл) добавляли к раствору D-(R)-4-гидроксифенилглицина (1,0 г, 6,0 ммоль) в 1,4-диоксане (8 мл), который находится в колбе Teflon®. Колбу охлаждали до -78°С и добавляли изобутилен (8 г, 142,6 ммоль, конденсированный при -78°С). Колбу помещали в автоклав при комнатной температуре и перемешивали в течение 15 часов. Автоклав охлаждали на льду перед открытием. Избыток изобутилена добавляли для выпаривания, и оставшийся раствор вливали в водный NaOH (2 M, 20 мл) и экстрагировали с диэтиловым эфиром для удаления образованного побочного продукта. Водную фазу немного подкисляли для достижения рН=10, используя 2 M HCl и экстрагировали с диэтиловым эфиром (3×75 мл). Органическую фазу промывали соляным раствором, высушивали и концентрировали. Полученный продукт перекристаллизовывали в диэтиловом эфире/гексане. Масса: 0,55 г (41%). ЯМР (600 МГц, CDCl3) 1,45 (s, 9H), 4,45 (s, 1H), 6,8 (d, 2H), 7,25 (d, 2H); m/z: 224. Способ 8 1,1-Диоксо-3,3-дибутил-5-фенил-7-метилтио-8- [N-((R)- 1,1-Диоксо-3,3-дибутил-5фенил-7-метилтио-8-[N-((R)- Способ 9 1,1-Диоксо-3,3 -дибутил-5-фенил-7-метилтио-8- {N-[(R)- 1,1-Диоксо-3,3-дибутил-5-фенил-7-метилтио-8-карбоксиметокси-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин (Способ 3; 627 мг, 1,24 ммоль) растворяли в ДХМ (25 мл), добавляли трет-бутил (2R)-амино(фенил)ацетат (308 мг, 1,48 ммоль), 2,6-диметилпиридин (288 мкл, 2,47 ммоль) и TBTU (477 мг, 1,48 ммоль). Смесь перемешивали в течение 3,5 часов. Реакционную смесь выпаривали при пониженном давлении. Продукт очищали, используя колонку Isolute (10 г, диоксид кремния). Продукт элюировали при помощи ступенчатого градиента, используя ДХМ:EtOAc 100:0, затем 95:5. Собирали приблизительно 694 мг чистого соединения. Другую фракцию очищали второй раз, используя колонку Isolute (10 г, диоксид кремния). Продукт элюировали при помощи ступенчатого градиента, используя ДХМ:EtOAc 100:0,95:5, затем 90:10. Чистую фракцию добавляли к первой фракции, получая 787 мг (91%) указанного в заглавии соединения. ЯМР (400 МГц, CDCl3) 0,78 (t, 6H), 0,92-1,12 (m, 4H), 1,12-1,46 (m, 6H), 1,54 (s, 9H), 1,58-1,72 (m, 2H), 2,14 (s, 3H), 3,8-4,05 (m, 2H), 4,32 (brs, NH), 4,56 (ABq, 2H), 5,56 (d, 1H), 6,56 (s, 1H), 7,04 (t, 1H), 7,10 (brd, 2H) 7,24-7,42 (m, 8H), 7,84 (d, NH); m/z 694,7 (M-H)–. Способ 10 1,1-Диоксо-3,3-дибутил-5-фенил-7-метилтио-8-(N-{(R)- 1,1-Диоксо-3,3-дибутил-5-фенил-7-метилтио-8-[N-((R)- Способ 11 1,1-Диоксо-3,3-дибутил-5-фенил-7-метилтио-8-(N-{(R)- 1,1-Диоксо-3,3-дибутил-5-фенил-7-метилтио-8-[N-((R)- Способ 12 1,1-Диоксо-3,3-дибутил-5-фенил-7-метилтио-8-[N-((R)- 1,1-Диоксо-3,3-дибутил-5-фенил-7-метилтио-8-[N-((R)- Способ 13 трет-Бутил N-((2R)-2-{[(бензилокси)карбонил]амино}-2-фенилэтаноил)-о-трет-бутил)-L-серинат (2R)-{[(Бензилокси)карбонил]амино}(фенил)уксусную кислоту (2,0 г, 7,0 ммоль) и трет-бутил O-(трет-бутил)-L-серинат (2,0 г, 7,9 ммоль) и 2,6-лутидин растворяли в ДХМ (30 мл). После перемешивания в течение 5 минут при 0°С добавляли TBTU (2,5 г, 7,8 ммоль) и продолжали перемешивать 30 минут при 0°С и 4 часа при комнатной температуре. Реакционную смесь промывали водой (2×100 мл), высушивали и очищали путем флеш-хроматографии (ДХМ), получая указанное в заглавии соединение (3,3 г, 97%). ЯМР (300 МГц): 1,05 (s, 9Н), 1,45 (s, 9Н), 3,4-3,8 (m, 2H), 4,5 (brs, 1H), 4,85 (s, 2H), 5,1 (s, 2H), 5,4 (s, 1H), 7,25-7,5 (m, 10Н). Способ 14 трет-Бутил N-[(2R)-2-амино-2-фенилэтаноил]-о-(трет-бутил)-L-серинат трет-Бутил N-((2R)-2-{[(бензилокси)карбонил]амино}-2-фенилэтаноил)-о-(трет-бутил)-L-серинат (Способ 13; 3,3 г, 6,8 ммоль) растворяли в EtOH (95%, 30 мл) и добавляли каталитическое количество Pd/C (5%)(50% в воде), и гидрирование осуществляли при атмосферном давлении в течение 3 часов при комнатной температуре. Реакционную смесь фильтровали через диатомовую землю, и растворитель выпаривали, получая указанное в заглавии соединение (2,35 г, 98%). ЯМР (500 МГц): 1,1 (s, 9H), 1,45 (s, 9H), 3,45-3,8 (m, 2H), 4,5 (t, 1H), 4,55 (s, 1H), 4,85 (s, 2H), 7,3-7,5 (m, 5H). Способ 15 1,1-Диоксо-2-(4-метоксибензил)-3,3-дибутил-5-фенил-7-метил-8-метокси-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин К охлажденному раствору (-78°С) 1,1-диоксо-2-(4-метоксибензил)-3,3-дибутил-5-фенил-7-бром-8-метокси-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепина (Способ 23; 2,10 г, 3,41 ммоль) в ТГФ (50 мл) по каплям добавляли раствор н-BuLi (2,35 мл, 3,75 ммоль, 1,6 М в гексане). После перемешивания при -78°С в течение 20 минут, добавляли MeI (2,42 г, 17,1 ммоль). Смесь перемешивали при -78°С в течение 10 минут и в течение 18 часов при комнатной температуре. Диэтиловый эфир (50 мл) добавляли и органическую фазу промывали с 10% NH4Cl (водн., 50 мл) и соляным раствором (50 мл). После высушивания, фильтрации и концентрирования неочищенный продукт подвергали флеш-хроматографии (Гексан:EtOAc – 95:5), получая 0,4 г (21%) указанного в заглавии продукта в виде бесцветного масла. ЯМР (300 МГц, CDCl3): 0,60-0,70 (m, 6H), 0,70-0,90 (m, 4Н), 0,90-1,35 (m, 8H), 2,00 (s, 3Н), 3,70 (s, 3H), 3,80 (s, 3Н), 4,00-4,20 (m, 2H), 4,35-4,60 (m, 2H), 6,65-6,85 (m, 3Н), 6,90-7,10 (m, 3H), 7,15-7,30 (m, 5H). Способ 16 1,1-Диоксо-3,3-дибутил-5-фенил-7-метил-8-карбоксиметокси-2,3 4,5-тетрагидро-1,2,5-бензотиадиазепин К раствору (0°С) трифторуксусной кислоты (30 мл) и триэтилсилана (1,03 г, 8,85 ммоль) добавляли раствор 1,1-диоксо-2-(4-метоксибензил)-3,3-дибутил-5-фенил-7-метил-8-метокси-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепина (Способ 15; 0,92 г, 1,77 ммоль) в ДХМ (2 мл). Реакционную смесь перемешивали при комнатной температуре в течение 30 минут. После концентрирования реакционной смеси остаток растворяли в диэтиловом эфире (50 мл) и промывали водой (25 мл) и бикарбонатом натрия (10%, 25 мл). После высушивания, фильтрации и концентрирования неочищенный продукт подвергали флеш-хроматографии на силикагеле (Гексан:EtOAc – 90:10), получая 0,58 г серого твердого вещества. К раствору (0°С) этого твердого вещества в дихлорметане (30 мл) по каплям добавляли BBr3 в ДХМ (1 М в ДХМ, 10,2 мл, 10,2 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 45 минут, и затем ее промывали бикарбонатом натрия (10%, 25 мл) и водой (25 мл). После высушивания, фильтрации и концентрирования неочищенный продукт (0,55 г, серое твердое вещество) растворяли в MeCN (30 мл). К раствору добавляли К2СО3 (0,22 г, 1,58 ммоль) и бромид тетра-н-бутил аммония (10 мг) и затем этилбромацетат (0,25 г, 1,51 ммоль). Реакционную смесь перемешивали при 80°С в течение 1,5 часа и затем выпаривали при пониженном давлении. Остаток растворяли в EtOAc (50 мл) и промывали с NH4Cl (водн., 10%) и соляным раствором. После высушивания, фильтрации и концентрирования неочищенный продукт подвергали флеш-хроматографии (Hex:EtOAc 9:1-8:2), получая 0,58 г не совсем белого твердого вещества. Твердое вещество растворяли в ТГФ:Н2О (4:1, 25 мл) и добавляли LiOH (0,097 г, 2,31 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 40 минут. Смесь выпаривали при пониженном давлении, растворяли в воде (50 мл) и подкисляли 1 М HCl. Водный слой экстрагировали дважды с диэтиловым эфиром. При выпаривании растворителя при пониженном давлении получали 0,46 г (55%) указанного в заглавии соединения. ЯМР (300 МГц, ацетон-d6); 0,70-0,90 (m, 6H), 0,95-1,80 (m, 12Н);2,15 (s, 3Н), 3,85-4,15 (m, 2Н), 4,85 (s, 2H), 6,00 (s, 1H), 6,80 (s, 1H), 6,90-7,05 (m, 1H), 7,10-7,45 (m, 5H). Способ 17 (R)-N-Бензилоксикарбонил- (R)-n-Гидроксифенилглицин (5,00 г, 29,9 ммоль) смешивали с водой (50 мл). К взвеси добавляли бикарбонат натрия (6,3 г, 75,0 ммоль) и получали белую суспензию через 10 минут перемешивания. Из капельной воронки добавляли бензилхлорформиат (5,1 мл, 33,9 ммоль) в течение 20 минут, и смесь энергично перемешивали. Через 2 часа добавляли воду (300 мл), и суспензию экстрагировали с эфиром (200 мл). Белое твердое вещество не растворяли и добавляли дополнительно воду и простой эфир. LC/MS указывало на то, что твердое вещество представляет собой продукт. Прозрачную часть водной фазы собирали и подкисляли до тех пор, пока не образовывался белый осадок. Эту смесь оставляли на выходные и затем отфильтровывали. Оставшуюся водную фазу, содержащую нерастворенное вещество, также подкисляли и экстрагировали с EtOAc (3х). Также здесь осадок оставался между фазами. Его собирали с органического слоя. EtOAc фазу выпаривали. Дважды добавляли толуол для удаления воды. Одновременно добавляли две фракции белого твердого вещества и перекристаллизовывали в ДХМ (200 мл). Охлажденную смесь фильтровали и получали 4,77 г (53%) белого твердого вещества. ЯМР (400 МГц, ДМСО-d6): 5,00 (1H, d), 5,00 (2H, s), 6,70 (2H, d), 7,05-7,50 (7H, m), 7,90 (1H, d). Способ 18 (R)-N-Бензилоксикарбонил- Раствор (R)-N-бензилоксикарбонил- Способ 19 (R)- Смесь (R)-N-Бензилоксикарбонил- Способ 20 1,1-Диоксо-3,3-дибутил-5-фенил-7-метилтио-8-(N-{(R)- 1,1-Диоксо-3,3-дибутил-5-фенил-7-метилтио-8-(N-{(R)- Способ 21 1,1-Диоксо-3,3-дибутил-5-фенил-7-метилтио-8-(N-{(R)- 1,1-Диоксо-3,3-дибутил-фенил-7-метилтио-8-[N-((R)- Способ 22 1,1-Диоксо-3,3-дибутил-5-фенил-7-метилтио-8-(N-{(R)- 1,1-Диоксо-3,3-дибутил-5-фенил-7-метилтио-8-[N-((R)- Способ 23 1,1-Диоксо-2-(4-метоксибензил)-3,3-дибутил-5-фенил-7-бром-8-метокси-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин К раствору 1,1-диоксо-3,3-дибутил-5-фенил-7-бром-8-метокси-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепина (полученного в соответствии с заявкой WO 98/38182; 0,200 г, 0,404 ммоль) в MeCN (5 мл) добавляли хлорид п-метоксибензила (0,066 мл, 0,486 ммоль), Csl (0,010 г, 0,038 ммоль) и Cs2СО3 (0,263 г, 0,807 ммоль), и смесь перемешивали при 60°С в течение 4 часов. Растворитель удаляли при пониженном давлении, и остаток разделяли между EtOAc и 0,5 М HCl (водн.). Органический слой промывали с соляным раствором, высушивали над MgSO4 и концентрировали. Остаток фильтровали через силикагель (ДХМ:EtOAc – 9:1), получая 0,257 г указанного в заглавии соединения ( количество) в виде не совсем белого твердого вещества. ЯМР (400 МГц, CDCl3): 0,60-0,75 (m, 6Н), 0,75-1,20 (m, 8H), 1,25-1,45 (m, 2H), 1,80-2,00 (m, 2H), 3,80 (s, 3Н), 3,90 (s, 3Н), 4,05-4,30 (m, 2H), 4,45-4,65 (m, 2H), 6,70-7,45 (m, 11Н). Способ 24 1,1-Диоксо-2-(4-метоксибензил)-3,3-дибутил-5-фенил-7-метилтио-8-гидрокси-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин NaSMe (0,150 г, 2,03 ммоль, 95%) добавляли к раствору 1,1-диоксо-2-(4-метоксибензил)-3,3-дибутил-5-фенил-7-бром-8-метокси-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепина (Способ 23; 0,249 г, 0,404 ммоль) в ДМФА (5 мл). Смесь перемешивали при комнатной температуре в течение 2 часов, после чего температуру повышали до 80°С и добавляли снова NaSMe (0,090 г, 1,22 ммоль). Через 20 часов при 80°С к смеси добавляли воду (5 мл) и 1 М HCl (водн.) (рН4). Раствор трижды экстрагировали с Et2O, и объединенные органические слои промывали с соляным раствором, высушивали над MgSO4 и концентрировали. Неочищенный продукт очищали путем флеш-хроматографии на силикагеле (Hex:EtOAc – 4:1), получая указанное в заглавии соединение в количестве 0,188 г (82%) в виде желтовато-коричневого твердого вещества. ЯМР (500 МГц, CDCl3): 0,60-0,75 (m, 6H), 0,75-1,20 (m, 8H), 1,25-1,40 (m, 2H), 1,80-2,00 (m, 2H), 2,20 (s, 3Н), 3,80 (s, 3Н), 4,20 (brs, 2H), 4,50 (brs, 2H), 6,05 (brs, 1H), 6,75-6,85 (m, 3Н), 7,00-7,10 (m, 3Н), 7,20-7,35 (m, 4H), 7,50 (s, 1H). Способ 25 1,1-Диоксо-2-(4-метоксибензил)-3,3-дибутил-5-фенил-7-метилтио-8-(трет-бутоксикарбонилметокси)-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин К раствору 1,1-диоксо-2-(4-метоксибензил)-3,3-дибутил-5-фенил-7-метилтио-8-гидрокси-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепина (Способ 24; 4,487 г, 7,889 ммоль) в MeCN (100 мл) добавляли трет-бутил бромид (0,262 г, 0,813 ммоль), трет-бутил бромацетат (1,46 мл, 9,880 ммоль) и карбонат калия (безводный, 3,28 г, 23,7 ммоль) в таком порядке. Смесь нагревали до 55°С в течение 2,5 часов, после чего ее охлаждали до комнатной температуры и оставляли перемешиваться в течение ночи. Растворитель выпаривали, пока не оставалась желтоватая взвесь, которую экстрагировали между диэтиловым эфиром (150 мл) и водой (100 мл). Водную фазу промывали с простым эфиром (100 мл), и объединенные эфирные слои промывали с 0,1 М KHSO4 (водн., 100 мл), соляным раствором (100 мл) и высушивали. Эфир удаляли при пониженном давлении, и полученное бежевое твердое вещество высушивали при пониженном давлении в течение 4 часов (5,355 г, 99%). ЯМР (400 МГц, CDCl3): 0,60-1,25 (m, 14H), 1,25-1,40 (m, 2H), 1,50 (s, 9Н), 1,75-2,00 (m, 2Н), 2,10 (s, 3H), 3,80 (s, 3Н), 4,20 (brs, 2H), 4,50 (brs, 2H), 4,60 (s, 2H), 6,45 (s, 1H), 6,75-6,85 (m, 2H), 7,00-7,15 (m, 3Н), 7,20-7,40 (m, 5Н). Способ 26 1,1-Диоксо-3,3-дибутил-5-фенил-7-метиилтио-8-(N-{(R)- 1,1-Диоксо-3,3-дибутил-5-фенил-7-метилтио-8-[N-((R)- Способ 27 трет-Бутил 4-метиллейцинат 4-Метиллейцин (500 мг, 3,44 ммоль) суспендировали в 10 мл трет-бутил ацетата. Добавляли перхлорную кислоту (0,2 мл, 3,49 ммоль), и колбу закрывали пробкой и перемешивали в течение ночи. Анализ осуществляли при помощи ТСХ (ДХМ:МеОН, 9:1; окрашивая раствором нингидрин/EtOH). Раствор вливали в колбу, содержащую 30 мл EtOAc и 30 мл 5% Na2CO3. Водный слой делали кислым и добавляли 2 М NaOH до тех пор, пока значение рН составляло приблизительно 7. Фазы разделяли, и водную фазу промывали дважды с 30 мл EtOAc. Объединенные органические фазы промывали с соляным раствором, высушивали с Na2SO4 и выпаривали. Получали масло, которое со-выпаривали с толуолом и затем с диэтиловым эфиром, перед тем как его помещали в вакуум на два дня. Масса 665 мг (96% выход). ЯМР (CDCl3): 1,0 (s, 9H), 1,5 (s, 9H), 1,65-1,95 (m, 2H), 3,82 (t, 1H). Способ 28 Метил 3-(триметилсилил)аланинат 3-Триметилсилил аланин (J. Organomet. Chem., 628, (2001), 183-194; 19 мг, 0,118 ммоль) смешивали с 3 мл BF3-МеОН (14%, 3,7 ммоль) в герметической трубке и нагревали до 70°С. Анализ осуществляли при помощи ТСХ (МеОН:ДХМ 1:9, окрашивая с нингидрином в этаноле). Смесь нагревали в течение 3 часов и затем охлаждали до температуры окружающей среды. Смесь вливали в смесь 3 мл EtOAc и 2 мл воды, содержащей Na2CO3. Добавляли снова Na2CO3 (5% – водн.) до значения рН 7. Водную фазу промывали с EtOAc (2×3 мл). Объединенные органические слои промывали с соляным раствором (1 мл), высушивали с Na2SO4 и выпаривали. Получали продукт в виде белой пленки. Масса: 19 мг (92% выход). ЯМР (CDCl3): 0,1 (s, 9H), 1,2-1,4 (m, 2H), 3,8 (s, 3H), 4,2 (brs, 1H).
Формула изобретения
1. Соединение формулы (I)
в которой Rv обозначает водород; один из R1 и R2 выбран из C1-С6алкила и другой выбран из С1-С6алкила; Rx и Ry обозначают водород; М представляет собой -N-; v означает 0; один из R4 и R5 представляет собой группу формулы (IA)
R3 и R6 и другой из R4 и R5 независимо выбраны из водорода, галогена, С1-С4алкила или С1-С4алкилS(О)а, где а означает 0; X представляет собой -О-; кольцо А представляет собой арил, причем кольцо А необязательно замещено одним или несколькими заместителями, выбранными из R17; R7 обозначает водород; R8 представляет собой водород; R9 представляет собой водород; R11 обозначает карбоксильную группу или R11 представляет собой группу формулы (IB) или (IC)
в которой Y представляет собой -N(Rn)C(O)-, где Rn обозначает водород; R12 представляет собой водород или С1-С4алкил; R13 и R14 независимо выбраны из водорода или С1-С6алкила, и когда q равен 0, R14 дополнительно может быть выбран из гидроксильной группы причем R13 и R14 необязательно независимо могут быть замещены одним или несколькими заместителями, выбранными из R20; R15 представляет собой карбоксильную группу или сульфогруппу; р представляет собой 1 или 2 причем значения R13 могут быть одинаковыми или разными; q представляет собой 0; r представляет собой 0 или 1; m представляет собой 0; n представляет собой 1; кольцо В представляет собой гетероциклил, связанный с атомом азота, замещенный у атома углерода одной группой, выбранной из R23, и необязательно дополнительно замещен у атома углерода одним или несколькими R24; R17 обозначает гидроксильную группу; R20 и R24 независимо выбраны из гидроксильной группы, аминогруппы, карбамоила, С1-С4алкилS(О)а, где а означает 0, бензилоксикарбониламино или (С1-С4алкил)3силил; R23 представляет собой карбоксильную группу; или его фармацевтически приемлемая соль, сольват, сольват такой соли или его сложные эфиры и амиды, которые способны к гидролизу в условиях in vivo. 2. Соединение формулы (I) по п.1, в котором R1 и R2 оба представляют собой бутил, или его фармацевтически приемлемая соль, сольват, сольват такой соли или его сложные эфиры и амиды, которые способны к гидролизу в условиях in vivo. 3. Соединение формулы (I) по п.1, в котором R3 и R6 представляют собой водород, или его фармацевтически приемлемая соль, сольват, сольват такой соли или его сложные эфиры и амиды, которые способны к гидролизу в условиях in vivo. 4. Соединение формулы (I) по п.1, в котором R4 представляет собой бром, метил или метилтио, или его фармацевтически приемлемая соль, сольват, сольват такой соли или его сложные эфиры и амиды, которые способны к гидролизу в условиях in vivo. 5. Соединение формулы (I) по п.1, в котором R5 представляет собой группу формулы (IA) (как изображено в п.1), в которой: X представляет собой -О-; кольцо А представляет собой фенил, необязательно замещенный одним или несколькими заместителями, выбранными из R17; n представляет собой 1; R7 представляет собой водород; R8 представляет собой водород; R9 представляет собой водород; m представляет собой 0; R11 представляет собой карбоксильную группу, группу формулы (IB) (как изображено выше) или группу формулы (IC) (как изображено выше), в которой: R12 представляет собой водород или С1-С4алкил; р представляет собой 1 или 2; R13 представляет собой водород или С1-С6алкил, необязательно замещенный R20, где R20 представляет собой гидроксильную группу, карбамоил, аминогруппу, бензилоксикарбониламино, С1-С4алкилS(О)а, где а представляет собой 0, или (С1-С4алкил)3силил; R14 представляет собой водород или гидроксильную группу или С1-С6алкил; где R14 необязательно может быть замещен одним или несколькими заместителями, выбранными из R20; Y представляет собой -N(Rn)C(O)-, где Rn представляет собой водород; q представляет собой 0 или 1; r представляет собой 0 или 1; R15 представляет собой карбоксильную группу или сульфогруппу; R17 представляет собой гидроксильную группу, и R20 выбран из гидроксильной группы; кольцо В представляет собой пирролидин-1-ил или азетидинил, замещенный у атома углерода одной группой, выбранной из R23, и необязательно дополнительно замещен у атома углерода одним или несколькими R24, где R23 представляет собой карбоксильную группу и R24 представляет собой гидроксильную группу; или его фармацевтически приемлемая соль, сольват, сольват такой соли или его сложные эфиры и амиды, которые способны к гидролизу в условиях in vivo. 6. Соединение формулы (I) по п.1, где Rv представляет собой водород; R1 и R2 оба представляют собой бутил; Rx и Ry оба представляют собой водород; М представляет собой -N-; v представляет собой 0; R3 и R6 представляют собой водород; R4 представляет собой бром, метил или метилтио; и R5 представляет собой N-{(R)- или его фармацевтически приемлемая соль, сольват, сольват такой соли или его сложные эфиры и амиды, которые способны к гидролизу в условиях in vivo. 7. Соединение формулы (I) по п.1, выбранное из: 1,1-диоксо-3,3-дибутил-5-фенил-7-метилтио-8-(N-{(R)- 1,1-диоксо-3,3-дибутил-5-фенил-7-метилтио-8-(N-{(R)- 1,1-диоксо-3,3-дибутил-5-фенил-7-метилтио-8-(N-{(R)- 1,1-диоксо-3,3-дибутил-5-фенил-7-метилтио-8-(N-{(R)- 1,1-диоксо-3,3-дибутил-5-фенил-7-метилтио-8-(N-{(R)- 1,1-диоксо-3,3-дибутил-5-фенил-7-метилтио-8-(N-{(R)- 1,1-диоксо-3,3-дибутил-5-фенил-7-метилтио-8-(N-{(R)- 1,1-диоксо-3,3-дибутил-5-фенил-7-метилтио-8-(N-{(R)- 1,1-диоксо-3,3-дибутил-5-фенил-7-метилтио-8-(N-{(R)- 1,1-диоксо-3,3-дибутил-5-фенил-7-метилтио-8-(N-{(R)- 1,1-диоксо-3,3-дибутил-5-фенил-7-метилтио-8-(N-{(R)- 1,1-диоксо-3,3-дибутил-5-фенил-7-метилтио-8-(N-{(R)- или его фармацевтически приемлемой соли, сольвата, сольвата такой соли или его сложные эфиры и амиды, которые способны к гидролизу в условиях in vivo. 8. Соединение формулы (I) по п.1, выбранное из: 1,1-диоксо-3,3-дибутил-5-фенил-7-метилтио-8-(Н-{(R)- 1,1-диоксо-3,3-дибутил-5-фенил-7-метилтио-8-[N-((R)- или его фармацевтически приемлемой соли, сольвата, сольвата такой соли или его сложных эфиров и амидов, которые способны к гидролизу в условиях in vivo. 9. Способ получения соединения формулы (I) по пп.1-8 или его фармацевтически приемлемой соли, сольвата, сольвата такой соли или его сложных эфиров и амидов, которые способны к гидролизу в условиях in vivo, который включает реакцию кислоты формулы (IVa) или (IVb)
или ее активированного производного с амином формулы (V)
и затем, если это необходимо или желательно: i) превращение соединения формулы (I) в другое соединение формулы (I); ii) удаление любых защитных групп; iii) образование фармацевтически приемлемой соли, сольвата, сольвата такой соли или сложных эфиров и амидов, которые способны к гидролизу в условиях in vivo. 10. Способ получения соединения формулы (I) по пп.1-8 или его фармацевтически приемлемой соли, сольвата, сольвата такой соли или его сложных эфиров и амидов, которые способны к гидролизу в условиях in vivo, который включает: для соединений формулы (I), где R11 представляет собой группу формулы (IB), реакцию соединения формулы (I), где R11 представляет собой карбоксильную группу, с амином формулы (VI)
и затем, если это необходимо или желательно: i) превращение соединения формулы (I) в другое соединение формулы (I); ii) удаление любых защитных групп; iii) образование фармацевтически приемлемой соли, сольвата, сольвата такой соли или сложных эфиров и амидов, которые способны к гидролизу в условиях in vivo. 11. Способ получения соединения формулы (I) по пп.1-8 или его фармацевтически приемлемой соли, сольвата, сольвата такой соли или его сложных эфиров и амидов, которые способны к гидролизу в условиях in vivo, который включает: для соединений формулы (I), где R11 представляет собой карбоксильную группу, снятие защиты с соединения формулы (IXa) или (IXb) в которой Rp совместно с группой -ОС(О)-, к которой он присоединен, образует сложный эфир; и затем, если это необходимо или желательно: i) превращение соединения формулы (I) в другое соединение формулы (I); ii) удаление любых защитных групп; iii) образование фармацевтически приемлемой соли, сольвата, сольвата такой соли или сложных эфиров и амидов, которые способны к гидролизу в условиях in vivo. 12. Способ получения соединения формулы (I) по пп.1-8 или его фармацевтически приемлемой соли, сольвата, сольвата такой соли или его сложных эфиров и амидов, которые способны к гидролизу в условиях in vivo, который включает: для соединений формулы (I), где R11 представляет собой группу формулы (IB) и R15 представляет собой карбоксильную группу; снятие защиты с соединения формулы (Ха) или (Xb) в которой Rp совместно с группой -ОС(О)-, к которой он присоединен, образует сложный эфир; и затем, если это необходимо или желательно: i) превращение соединения формулы (I) в другое соединение формулы (I); ii) удаление любых защитных групп; iii) образование фармацевтически приемлемой соли, сольвата, сольвата такой соли или сложных эфиров и амидов, которые способны к гидролизу в условиях in vivo. 13. Соединение формулы (I) или его фармацевтически приемлемая соль, сольват, сольват такой соли или его сложные эфиры и амиды, которые способны к гидролизу в условиях in vivo по любому из пп.1-8, для применения в качестве лекарственного средства, обладающего ингибирующим действием по отношению к переносу желчных кислот в подвздошной кишке, в частности, для лечения гиперлипемических состояний. 14. Соединение, выбранное из группы, включающей соединение формулы (IXa) в которой Rv обозначает водород; один из R1 и R2 выбран из С1-С6алкила и другой выбран из C1-C6алкила; Rx и Ry обозначают водород; М представляет собой -N-; v означает 0; R3, R5 и R6 независимо выбраны из водорода, галогена, С1-С4алкила или С1-С4алкилS(О)а, где а означает 0; X представляет собой -О-; кольцо А представляет собой арил, причем кольцо А необязательно замещено одним или несколькими гидроксильными группами; R7 обозначает водород; R8 представляет собой водород; R9 представляет собой водород; m представляет собой 0; n представляет собой 1; Rp совместно с группой -ОС(О)-, к которой он присоединен, образует сложный эфир; его фармацевтически приемлемая соль, сольват или сольват такой соли и его сложные эфиры и амиды, которые способны к гидролизу в условиях in vivo; соединение формулы (IXb) в которой Rv, R1, R2, Rx, Ry, M, R3, R6, X, кольцо A, R7, R8, R9, Rp, v, m и n определены выше для формулы (IXa), a R4 независимо выбран из водорода, галогена, С1-С4алкила или С1-С4алкилS(О)а, где а означает 0; и его фармацевтически приемлемая соль, сольват или сольват такой соли и его сложные эфиры и амиды, которые способны к гидролизу в условиях in vivo; соединение формулы (Ха) в которой Rv, R1, R2, Rx, Ry, M, R3, R5, R6, X, кольцо A, R7, R8, R9, Rp, v, m и n определены выше для формулы (IXa), a Y представляет собой -N(Rn)C(O)-, где Rn обозначает водород; R12 представляет собой водород или С1-С4алкил; R13 и R14 независимо выбраны из водорода или С1-С6алкила, и когда q равен 0, R14 дополнительно может быть выбран из гидроксильной группы, причем R13 и R14 необязательно независимо могут быть замещены одним или несколькими заместителями, выбранными из R20; R20 независимо выбран из гидроксильной группы, аминогруппы, карбамоила, С1-С4алкилS(О)а, где а означает 0, бензилоксикарбониламино или (С1-С4алкил)3силил; р представляет собой 1 или 2, причем значения R13 могут быть одинаковыми или разными; q представляет собой 0; r представляет собой 0 или 1, а также его фармацевтически приемлемая соль, сольват или сольват такой соли и его сложные эфиры и амиды, которые способны к гидролизу в условиях in vivo; или соединение формулы (Xb) в которой Rv, R1, R2, Rx Ry, M, R3, R6, X, кольцо A, R7, R8, R9, Rp, v, m и n определены выше для формулы (IXa), R4 определен выше для формулы (IXb), a Y, R12, R13, R14, р, q и r определены выше для формулы (Ха), а также его фармацевтически приемлемая соль, сольват или сольват такой соли и его сложные эфиры и амиды, которые способны к гидролизу в условиях in vivo.
|
||||||||||||||||||||||||||

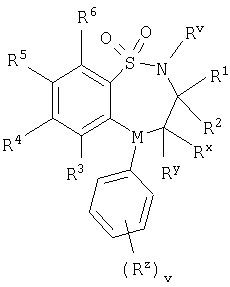
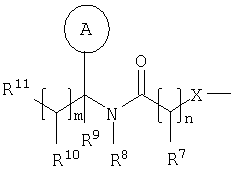
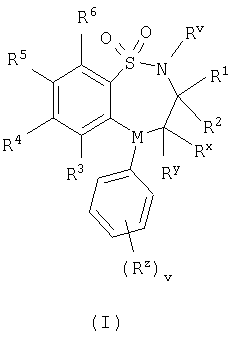
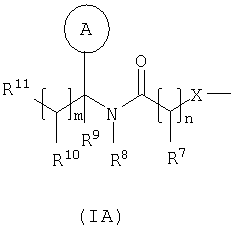
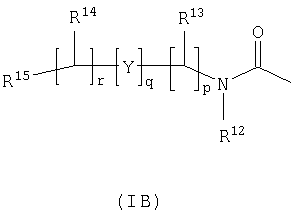
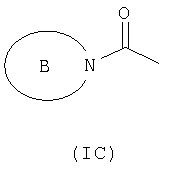
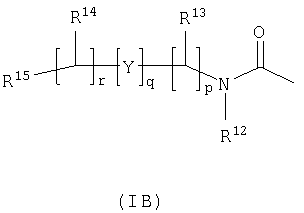
 -ацилоксиалкиловые простые эфиры и соответствующие соединения, которые в результате расщепления эфира при гидролизе в условиях in vivo образуют исходную гидроксильную группу. Примеры
-ацилоксиалкиловые простые эфиры и соответствующие соединения, которые в результате расщепления эфира при гидролизе в условиях in vivo образуют исходную гидроксильную группу. Примеры 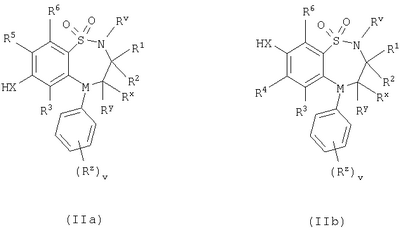
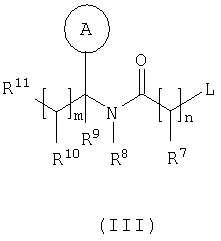
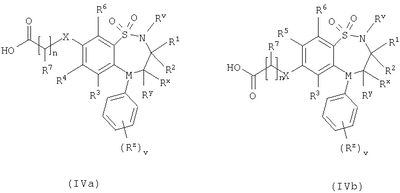
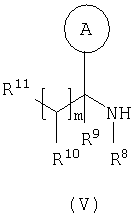
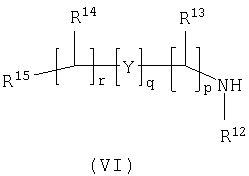
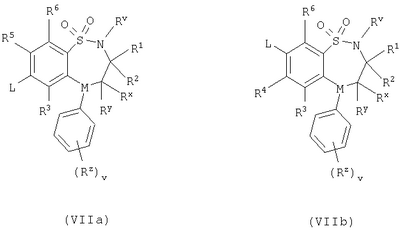

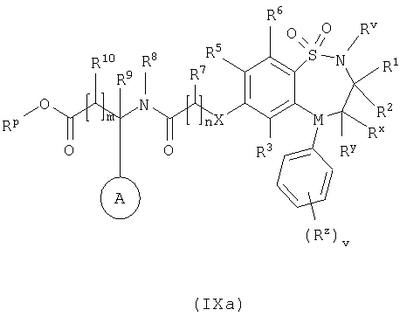
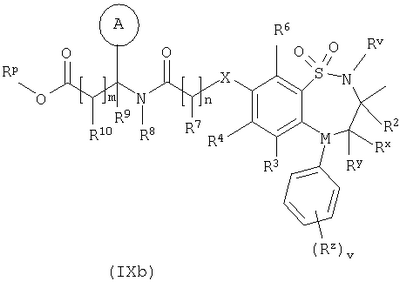
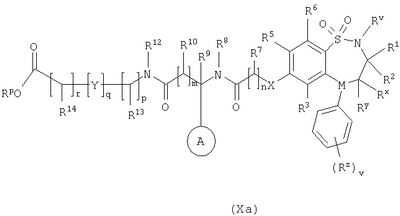
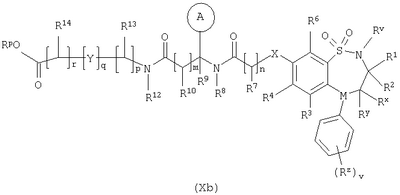
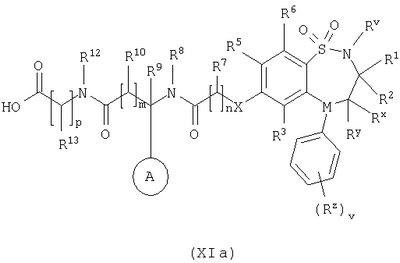
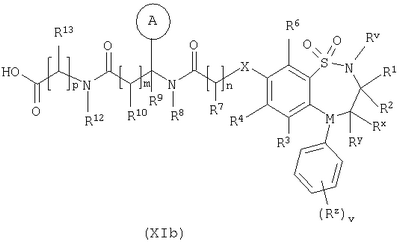
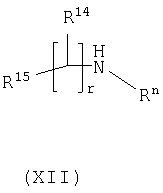
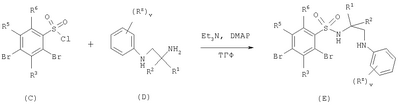
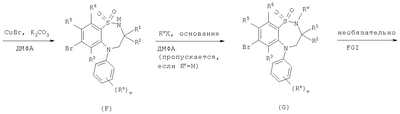
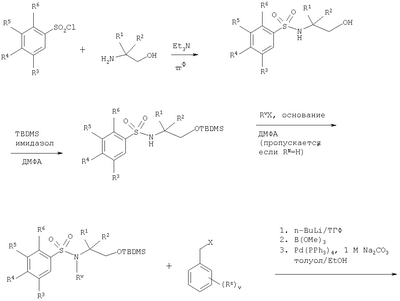
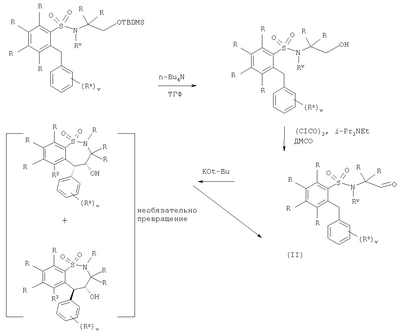
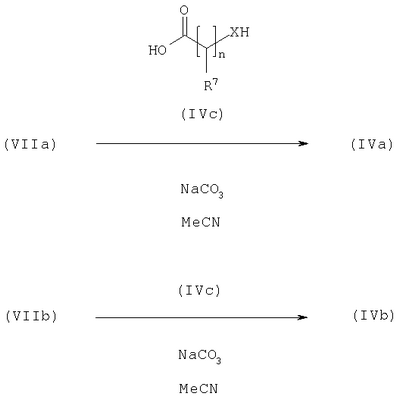
 5:1), получая указанное в заглавии соединение (13 г, 94%). ЯМР (500 МГц, CDCl3): 1,45 (s, 9Н), 3,84 (d, 1H), 4,00 (dd, 1H), 5,10 (m, 2H), 5,28 (brs, 1H), 6,13 (brs, 1H), 6,23 (brs, 1H), 7,30-7,44 (m, 10Н).
5:1), получая указанное в заглавии соединение (13 г, 94%). ЯМР (500 МГц, CDCl3): 1,45 (s, 9Н), 3,84 (d, 1H), 4,00 (dd, 1H), 5,10 (m, 2H), 5,28 (brs, 1H), 6,13 (brs, 1H), 6,23 (brs, 1H), 7,30-7,44 (m, 10Н).