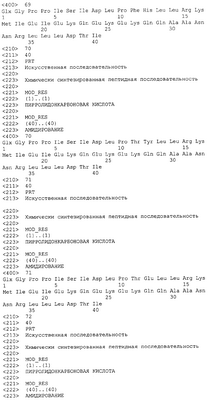
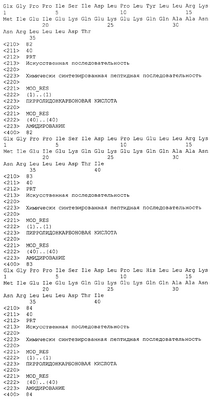
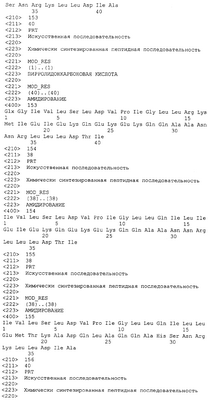
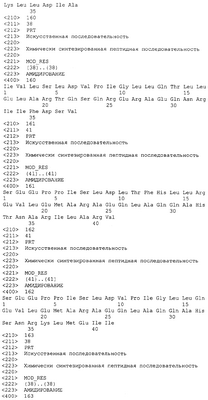
Патент на изобретение №2305110
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
(54) АГОНИСТЫ РЕЦЕПТОРА КОРТИКОТРОПИН-РИЛИЗИНГ ФАКТОРА 2 И ИХ ПРИМЕНЕНИЕ
(57) Реферат:
Изобретение относится к биотехнологии и может быть использовано для получения агониста рецептора кортикотропин-рилизинг фактора 2 (CRF2R). Белок агониста CRF2R получают как производное CRF, урокортина I, урокортина II, урокортина III, саувагина, уротензина I и других родственных пептидов, производя аминокислотные замены в последовательностях белков. Полученный агонист CRF2R применяют в составе фармацевтической композиции для профилактики и лечения нарушений, вызываемых CRF2R, у хозяина. Изобретение позволяет разрабатывать эффективные средства для профилактики и лечения расстройств, модулируемых рецептором кортикотропин-рилизинг фактора 2, таких как мышечная дистрофия. 10 н. и 15 з.п. ф-лы, 3 табл.
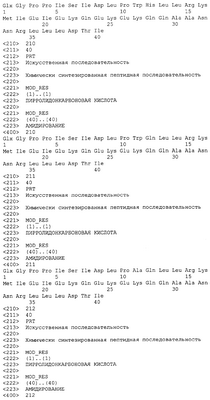
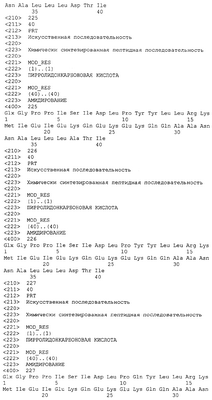
ОБЛАСТЬ ИЗОБРЕТЕНИЯ Данное изобретение относится к применению новых пептидов и кодирующих их нуклеиновых кислот для лечения расстройств, модулируемых CRF2R. ПЕРЕКРЕСТНЫЕ ССЫЛКИ НА РОДСТВЕННЫЕ ЗАЯВКИ Приоритетными для настоящей заявки являются временная заявка США 60/349117, временная заявка, поданная 16 января 2002, временная заявка США 60/376337, поданная 29 апреля 2002, временная заявка США 60/388895, поданная 14 июня 2002, и временная заявка США 60/411988, поданная 19 сентября 2002, каждая из которых приведена здесь в качестве ссылки в полном объеме. ПРЕДПОСЫЛКА CRFR и лиганды Существует, по меньшей мере, два идентифицированных до настоящего времени рецептора кортикотропин-рилизинг фактора (CRF1R и CRF2R), которые относятся к классу рецепторов, связанных с G-белком (GPCR). Активация агонистами CRF1R или CRF2R приводит к G Клонированы CRF1R и CRF2R человека, крысы, мыши, цыпленка, коровы, сома, лягушки и овцы. Каждый из CRF1R и CRF2R имеет уникальный характер распределения. Клонированы три изоформы рецептора CRF2R, альфа, бета и гамма человека. Гомологи альфа- и бета-CRF2R идентифицированы у крыс. Известны несколько лигандов/агонистов CRFR, и они включают кортикотропин-рилизинг фактор (или гормон, CRF, CRH), урокортин I, урокортин II (или пептид, родственный стресскопину), урокортин III (или стресскопин), уротензин I, саувагин и другие родственные пептиды. Кортикотропин-рилизинг фактор связывается и активирует CRF1R и CRF2R. CRF является основным модулятором реакций организма на стресс. Указанный 41-аминокислотный пептид осуществляет контроль над множеством нервных, эндокринных и иммунных процессов в качестве первичного регулятора гипоталамо-гипофизарно-надпочечниковой гормональной оси (HPA-оси). Кроме того, имеет место значительная гомология последовательностей между всеми известными лигандами CRFR. Более того, идентифицированы два избирательных лиганда CRF2R, урокортин II (или родственный стресскопину пептид) и урокортин III (стресскопин). Указанные пептиды идентифицированы у множества видов млекопитающих и рыб. Рецепторы CRF можно отличить от не-CRFR фармакологически, используя избирательные агонисты и антагонисты рецепторов. Указанные избирательные агонисты и антагонисты, а также нокаутированные по CRFR мыши применялись для определения того, какой рецептор CRF опосредует конкретный биологический ответ. Роль CRF1R довольно хорошо установлена. Мыши, у которых ген CRF1R нарушен (нокаут по CRF1R), проявляли ослабленную стресс-реакцию и ослабленное поведение, подобное состоянию тревоги. CRF1R является основным медиатором HPA-оси. В частности, CRF, который высвобождается из гипоталамуса и транспортируется в передний гипофиз через гипоталамо-гипофизарную воротную систему, взаимодействует с CRF1R, присутствующим на клетках, расположенных в переднем гипофизе. Активация CRF1R агонистами приводит к высвобождению АКТГ из клеток переднего гипофиза в круг кровообращения. Высвобождаемый АКТГ связывает рецептор АКТГ, присутствующий на клетках, расположенных в коре надпочечников, приводя к высвобождению адренальных гормонов, включая кортикостероиды. Кортикостероиды опосредуют множество эффектов, включая, но не ограничиваясь указанным, супрессию иммунной системы посредством механизма, в который вовлечена атрофия тимуса и селезенки. Таким образом, активация CRF1R опосредованно приводит к понижающей регуляции иммунной системы через активацию HPA-оси. Роль CRF2R установлена хуже. Мыши, у которых был нарушен ген CRF2R (нокаут по CRF2R), проявляют ослабленное или сниженное потребление пищи после стимуляции урокортином, отсутствие вазодилатации, но нормальную стресс-реакцию. Эксперименты с CRF2R показали, что CRF2R ответственен за гипотензивное/сосудорасширяющее действия агонистов CRFR и за снижение потребления пищи, наблюдаемое после обработки мышей агонистами CRFR. Атрофия и гипертрофия скелетных мышц Кроме того, CRF2R вовлечен в модулирование атрофии скелетных мышц и индукцию гипертрофии. Скелетная мышца является пластичной тканью, которая легко адаптируется к изменениям либо в физиологических потребностях для работы, либо в метаболических потребностях. Гипертрофия относится к увеличению массы скелетной мышцы, тогда как атрофия скелетной мышцы относится к уменьшению массы скелетной мышцы. Острая атрофия скелетной мышцы может быть вызвана несколькими причинами, включая, но не ограничиваясь указанным: прекращение использования вследствие хирургического вмешательства, постельного режима или перелома костей; денервацию/повреждение нервов вследствие повреждения спинного мозга, аутоиммунного заболевания или инфекционной болезни; использование глюкокортикоидов в случае несвязанных состояний; сепсис в результате инфекции или по другим причинам; ограничение питательных веществ из-за болезни или голодания; и космические полеты. Атрофия скелетных мышц происходит в ходе нормальных биологических процессов, однако в некоторых медицинских случаях указанный нормальный биологический процесс приводит к уровню мышечной атрофии, ослабляющему здоровье. Например, острая атрофия скелетных мышц дает существенное ограничение при реабилитации пациентов от иммобилизации, включая, но не ограничиваясь указанным, иммобилизацию, сопровождающую ортопедическую процедуру. В таких случаях период реабилитации, требуемый для того, чтобы устранить атрофию скелетной мышцы, часто намного длиннее, чем период времени, необходимый для восстановления исходного повреждения. Такая острая атрофия в случае прекращения использования является особой проблемой для пожилого человека, который уже может страдать от значительного связанного с возрастом дефицита мышечной функции и массы, так как такая атрофия может приводить к стойкой нетрудоспособности и преждевременной смертности. Атрофия скелетных мышц также может быть результатом хронических состояний, таких как кахексия при злокачественной опухоли, хроническое воспаление, кахексия, связанная со СПИДом, хроническое обструктивное легочное заболевание (COPD), застойная сердечная недостаточность, генетические заболевания, например мышечная дистрофия, нейродегенеративные заболевания и саркопения (связанная с возрастом потеря мышечной массы). В случае указанных хронических состояний атрофия скелетных мышц может приводить к преждевременной потере подвижности, добавляемой к заболеваемости, связанной с болезнью. Мало известно о молекулярных процессах, которые контролируют атрофию или гипертрофию скелетной мышцы. Несмотря на то что запускающий механизм инициации атрофии скелетной мышцы различен в случае разных событий, инициирующих атрофию, в пораженном волокне скелетной мышцы происходит несколько общих биохимических изменений, включая уменьшение синтеза белка и увеличение деградации белка и изменения изоформ как сократительных белков, так и белков метаболических ферментов, характерные для переключения с медленных волокон (высокий окислительный метаболизм/медленные изоформы сократительных белков) на быстрые волокна (высокий гликолитический метаболизм/быстрые изоформы сократительных белков). Дополнительные изменения в скелетной мышце, которые имеют место, включают потерю сосудов и ремоделирование внеклеточного матрикса. И в быстрой и в медленной мышце в соответствующих условиях наблюдается атрофия, при этом относительная потеря мышечной массы зависит от конкретных стимулов атрофии или условий. Важно, что все указанные изменения регулируются согласованно и включаются и выключаются в зависимости от изменений в физиологических и метаболических потребностях. Процессы, благодаря которым возникает атрофия или гипертрофия, консервативны среди видов млекопитающих. Многие исследования показали, что при атрофии и у грызунов и у человека происходят одни и те же основные молекулярные, клеточные и физиологические процессы. Таким образом, модели атрофии скелетных мышц на грызунах успешно использовали для понимания и предсказания атрофических реакций у человека. Например, атрофия, индуцированная множеством способов у грызунов и человека, приводит к сходным изменениям в анатомии мышц, площади поперечного сечения, функции, переключении типов волокон, экспрессии сократительных белков и гистологии. Кроме того, показано, что несколько агентов регулируют атрофию скелетных мышц как у грызунов, так и у человека. К указанным агентам относятся анаболические стероиды, гормон роста, инсулиноподобный фактор роста I, бета-адренергические агонисты и агонисты CRF2R. Указанные данные вместе взятые свидетельствуют о том, что атрофия скелетных мышц является результатом общих механизмов как у грызунов, так и у человека. Хотя показано, что некоторые агенты регулируют атрофию скелетных мышц и одобрены для применения на человеке в случае такого показания, указанные агенты обладают нежелательными побочными эффектами, такими как гипертрофия сердечной мышцы, неоплазия, гирсутизм и андрогенизация у женщин, повышенная заболеваемость и смертность, повреждение печени, гипогликемия, скелетно-мышечная боль, повышенный тканевой тургор, тахикардия и отек. В настоящее время не существует высокоэффективных и избирательных способов лечения ни острой, ни хронической атрофии скелетных мышц. Таким образом, остается необходимость в идентификации других терапевтических средств, которые лечат атрофию скелетных мышц. Мышечная дистрофия Мышечная дистрофия охватывает группу наследственных, прогрессирующих мышечных заболеваний, клинически отличающихся избирательным распределением слабости скелетной мышцы. Двумя наиболее распространенными формами мышечной дистрофии являются дистрофия Дюшенна и дистрофия Бекера, каждая из которых возникает в результате наследования мутации в гене дистрофина, который локализован в локусе Xp21. Другие дистрофии включают, но не ограничены указанным, мышечную дистрофию Лейдена, которая возникает в результате мутации множественных генетических локусов, включая локусы калпаина p94, адхалина, СУЩНОСТЬ ИЗОБРЕТЕНИЯ В данном изобретении предлагаются изолированные пептиды, которые являются агонистами CRF2R. В частности, в изобретении предлагается изолированный пептид или кодирующая его нуклеиновая кислота, которые являются производными CRF, урокортина I, урокортина II, урокортина III, саувагина, уротензина I или родственных пептидов. Изобретение также относится к фармацевтической композиции, содержащей безопасное и эффективное количество изолированного пептида согласно данному изобретению и фармацевтически приемлемый эксципиент. Изобретение, кроме того, относится к набору, содержащему изолированный пептид в дозированной лекарственной форме, и инструкции по применению. Введение пептида или нуклеиновой кислоты, кодирующей пептид, фармацевтической композиции или набора согласно данному изобретению, нуждающемуся в этом субъекту эффективно для лечения модулируемых CRF2R расстройств, таких как атрофия или истощение мышц. Изобретение также относится к антителу, которое специфично по отношению к пептидам согласно данному изобретению. Наконец изобретение относится к применению пептида согласно данному изобретению или кодирующей его нуклеиновой кислоты для производства лекарственного средства для лечения, модулируемого CRF2R, расстройства у нуждающегося в этом субъекта. В одном из вариантов осуществления изобретение относится к аминокислотной последовательности: ZGPPISIDLPX11X12LLRKX17IEIEKQEKEKQQAX31X32NAX35X36LX38X39X40 (SEQ ID NO: 531) где: X11 выбран из F, Y, L, I и Т; X12 выбран из Q, W и Y; X17 выбран из V и М; Х31 выбран из Т и А; Х32 выбран из N и Т; Х35 выбран из R и L; Х36 выбран из L и I; Х38 выбран из D и А; Х39 выбран из Т и R; и Х40 выбран из I и V. Изобретение также относится к изолированным ненативным пептидам формулы (I): где: (a) альфа содержит последовательность формулы X1X2X3X4X5X6, где: каждый из X1, X2 и Х3 выбран из группы, состоящей из нуля, А, Е, D, G, N, Р, Q, S, Т и Z; Х4 выбран из группы, состоящей из F, I, L, Р, Т и V; X5 выбран из группы, состоящей из А, I, Р, S, Т и V; Х6 выбран из группы, состоящей из I, L, M и N; (b) бета содержит последовательность формулы SX8DX10; где: каждый из X8 и X10 независимо выбран из группы, состоящей из I, L и V; (c) гамма содержит последовательность формулы X11X12X13; где: X11 выбран из группы, состоящей из Р, Т, V и S, и каждый из X12 и X13 независимо выбран из группы, состоящей из А, нафтилаланина (изображенного в виде В), С, D, Е, F, G, Н, I, K, L, M, N, Р, Q, R, S, Т, V, W и Y; (d) дельта содержит последовательность формулы X14X15X16, где: X14 выбран из группы, состоящей из I, L и M; X15 выбран из группы, состоящей из L и M; и X16 выбран из группы, состоящей из S, N, Q и R; (e) эпсилон содержит последовательность формулы X17X18X19X20X21, где: X17 выбран из группы, состоящей из V, I, L, Т, K, Е, N и Q; X18 выбран из группы, состоящей из L, M, V, А и Т; X19 выбран из группы, состоящей из I, F, L и M; Х20 выбран из группы, состоящей из D, Е, N и Н; и X21 выбран из группы, состоящей из L, V, I, Q, M и R; (f) дзета содержит последовательность формулы X22X23X24X25, где: Х22 выбран из группы, состоящей из нуля. A, D, Е, S и Т; Х23 выбран из группы, состоящей из нуля, K и R; Х24 выбран из группы, состоящей из нуля, А, Н, М, N, Q, Т и Y; Х25 выбран из группы, состоящей из нуля, Е, D, I, K, N, Q и R; (g) эта содержит последовательность формулы X26X27X28X29X30X31, где: X26 выбран из группы, состоящей из А, D, G, Н, K, N, Q и S; X27 выбран из группы, состоящей из А, Е, I, L, M и Q; X28 выбран из группы, состоящей из А, Н, K, Q, R и V; X29 выбран из группы, состоящей из А, Е, K, N, М и Q; X30 выбран из группы, состоящей из Н, K, N, Q и R; X31 выбран из группы, состоящей из A и K; (h) тета содержит последовательность формулы X32X33NX35X36X37X38X39X40X41, где: X32 выбран из группы, состоящей из A, E, H и T; X33 выбран из группы, состоящей из A, D, E, I, L, N, Q, R, S и T; X35 выбран из группы, состоящей из A и R; X36 выбран из группы, состоящей из E, H, I, K, L, N, Q и R; X37 выбран из группы, состоящей из F,I, L, M и Y; X38 выбран из группы, состоящей из L, F и M; X39 выбран из группы, состоящей из A, D, E, N и Q; X40 выбран из группы, состоящей из A, D, E, H, I, K, N, Q, R, S и T; X41 выбран из группы, состоящей из A, F, I и V; и их варианты. Все процитированные документы в соответствующей части включены в данное описание в виде ссылки; цитирование любого документа не следует рассматривать как признание того, что он представляет предшествующий уровень техники по отношению к данному изобретению. ОПИСАНИЕ СПИСКА ПОСЛЕДОВАТЕЛЬНОСТЕЙ В таблице 1 описаны различные последовательности белков и белковых фрагментов, которые связываются с рецепторами CRF. Указанные выбранные последовательности включены с соответствующим номером(ами) доступа в Genbank или Derwent и названием вида животного, для которого они опубликованы, а также номерами доступа для родственных нуклеотидных последовательностей, которые кодируют идентичные или почти идентичные аминокислотные последовательности. Указанные известные и новые последовательности согласно изобретению, кроме того, представлены в списке последовательностей.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ Глоссарий терминов Ниже следует список определений терминов, используемых в данном описании. «Агонист» означает любое соединение, включая, но не ограничиваясь указанным, антитело, которое активирует рецептор. Например, агонисты CRFR включают, но не ограничены указанным, CRF, урокортин, урокортин II, урокортин III, уротензин I, саувагин и родственные аналоги. «Антитело» в его различных грамматических формах означает молекулы иммуноглобулина и иммунологически активные части молекул иммуноглобулинов, т.е. молекулы, которые содержат антигенсвязывающий сайт, который специфично связывает антиген. В используемом в данном описании смысле «изолированное антитело» означает антитело, которое было частично или полностью отделено от белков и встречающихся в природе органических молекул, с которыми оно связано в природе. «Аффинность связывания» означает склонность лиганда взаимодействовать с рецептором и обратно пропорционально связана с константой диссоциации специфичного взаимодействия CRF-лиганд–CRFR. Константу диссоциации можно непосредственно измерить, используя стандартные способы насыщения, конкурентного связывания или определения кинетики связывания, или опосредованно, используя фармакологические способы, которые включают функциональные анализы и конечные результаты. «Химерное антитело» означает антитело, которое содержит структурные элементы из двух или более различных молекул антител, т.е. от разных видов животных. Химерные антитела включают, но не ограничены указанным, антитела, известные как «гуманизированные антитела», которые включают, но не ограничены указанным, химерные антитела, образованные способом, известным под названием прививка областей, определяющих комплементарность. «CRF» означает кортикотропин-рилизинг фактор, что значит то же самое, что и кортикотропин-рилизинг гормон (CRH). Примеры пептидов CRF включают r/h-CRF и овечий CRF (смотри патент США No. 4415558) и тому подобные. «Аналог CRF» означает вещества, которые действуют в качестве лигандов CRFR. Подходящие аналоги CRF можно получить из различных видов позвоночных, и они включают, но не ограничены указанным, такие вещества, как саувагин (смотри, например, патент США No. 4605642), уротензин (смотри, например, патенты США No. 4908352 и 4533654), урокортин II мыши, родственный урокортину пептид человека (Reyes, T. M. et al., Proc. Natl. Acad. Sci. 98: 2843-2848 (2001)), урокортин (смотри, например, WO 97/00063), урокортин II человека (родственный стресскопину пептид), урокортин III человека (стресскопин), URP 1 рыбы-собаки, URP II рыбы-собаки, уротензин I и аналоги CRF, описанные в патентах США No: 4415558; 4489163; 4594329; 4605642; 5109111; 5235036; 5278146; 5439885; 5493006; 5663292; 5824771; 5844074 и 5869450. Конкретные аналоги CRF включают hUcnI (урокортин I человека, AF038633 (GB)); hUroII (урокортин II человека или родственный стресскопину пептид) (AF320560); hUroIII (урокортин III человека или стресскопин, AF361943); hCRF (кортикотропин-рилизинг фактор человека) (V00571 (GB)); oCRF (кортикотропин-рилизинг фактор овцы E00212 (GB)); Svg (саувагин, P01144 (SP)). «Агонист CRFR» означает соединение или молекулу, которая обладает способностью активировать CRF1R, CRF2R или оба рецептора. «CRFR» означает CRF1R или CRF2R. Термин «CRFR» также включает укороченные и/или мутантные белки, в которых области молекулы рецептора, не требуемые для связывания лиганда или передачи сигнала, были делетированы или модифицированы. «CRF1R» означает любые изоформы CRF1R из любого вида животного. CRF1R ранее называли CRF-RA, PC-CRF, CRF (Perrin, M. H., et al. Endocrinology 133: 3058-3061 (1993), Chen, R., et al. Proc. Natl. Acad. Sci. USA 90: 8967-8971 (1993), Chang, C-P. et al., Neuron 11: 1187-1195 (1993), Kishimoto, T., et al., Proc. Natl. Acad. Sci. USA, 92: 1108-1112 (1995) и Vita, N. et al., FEBS Lett. 335: 1-5 (1993)) или рецептором CRH. Определение CRF1R включает, но не ограничено указанным, те рецепторы, для которых кДНК или геномная последовательность, кодирующая рецептор, была депонирована в базе данных последовательностей. Указанные последовательности включают последовательности с номерами доступа: X72304, E11431, L23332, I92584, T37068, T28968, Q81952, L23333, NM_004382, AF180301, T28970, L25438, L24096, I92586, Q81954, AH006791, NM_007762, X72305, AF054582, Y14036, AF229359, AF229361, AB055434 и L41563. Нуклеотидные и белковые последовательности указанных рецепторов доступны из GenBank или Derwent. «CRF2R» означает любую изоформу CRF2R из любого вида животного. CRF2R также названы HM-CRF, CRF-RB (Kishimoto, T., et al., Proc. Natl. Acad. Sci. USA, 92: 1108-1112 (1995) и Perrin, M. et al. Proc. Natl. Acad. Sci. USA 92: 2969-2973 (1995)). Определение рецептора CRF2R включает, но не ограничено указанным, те рецепторы, для которых последовательность ДНК, кодирующая рецептор, была депонирована в базе данных последовательностей. Указанные последовательности включают последовательности с номерами доступа: U34587, E12752, NM_001883, T12247, T66508, AF011406, AF019381, U16253, T12244, T28972, U17858, NM_009953, Y14037 и AF229360. Нуклеотидные и белковые последовательности указанных рецепторов доступны из GenBank или Derwent. «Ингибировать» означает частичное или полное блокирование конкретного процесса или активности. Например, соединение ингибирует атрофию скелетной мышцы, если оно либо полностью, либо частично предотвращает атрофию мышц. «Изолированный пептид» означает, что о молекуле пептида говорят, что она «изолирована», когда используют физические, механические или химические способы для извлечения пептида из клеточных компонентов, которые обычно связаны с белком. Специалист в данной области легко может использовать стандартные способы очистки, чтобы получить изолированный пептид. «Изолированная нуклеиновая кислота» означает, что молекула нуклеиновой кислоты по существу отделена от загрязняющих молекул нуклеиновых кислот, кодирующих другие полипептиды. Способы очистки и идентификации последовательностей хорошо известны в данной области. В используемом в данном описании смысле говорят, что две последовательности ДНК «функционально связаны», если природа связи между двумя последовательностями ДНК (1) не является результатом введения мутации со сдвигом рамки считывания, (2) не препятствует способности области промотора управлять транскрипцией кодирующих последовательностей, или (3) не препятствует способности соответствующего РНК-транскрипта транслироваться в белок. Например, кодирующая последовательность и регуляторные последовательности функционально связаны в том случае, когда они ковалентно связаны таким образом, чтобы поместить транскрипцию кодирующей последовательности под влияние или контроль регуляторных последовательностей. Таким образом, область промотора функционально связана с кодирующей последовательностью в том случае, когда область промотора способна к осуществлению транскрипции данной последовательности ДНК, так чтобы полученный в результате транскрипт обладал способностью транслироваться в требуемый пептид. «Избирательный агонист» означает, что агонист как правило обладает большей, предпочтительно обладает значительно большей активностью по отношению к определенному рецептору(рам) по сравнению с другими рецепторами, а не то, что он полностью неактивен по отношению к другим рецепторам. «Идентичность последовательностей» или «гомологию» на уровне аминокислотных или нуклеотидных последовательностей определяют с помощью анализа BLAST (Basic Local Alignment Search Tool), используя алгоритм, применяемый в программах blastp, blastn, blastx, tblastn и tblastx (Altschul et al. (1997) Nucleic Acids Res. 25, 3389-3402 и Karlin et al. (1990) Proc. Natl. Acad. Sci. USA 87, 2264- 2268), которые специально созданы для поиска сходства последовательностей. Подход, используемый в программе BLAST, состоит в том, что сначала рассматривают сходные участки с пробелами (прерывистые) и без пробелов (непрерывные), между запрашиваемой последовательностью и последовательностью в базе данных, затем оценивают статистическую значимость всех совпадений, которые идентифицированы, и, наконец, суммируют только те совпадения, которые удовлетворяют предварительно выбранному порогу значимости. Для обсуждения основных проблем при поиске сходства в базе данных последовательностей смотри Altschul et al. (1994) Nature Genetics 6, 119-129. Параметры поиска для гистограммы, описаний, выравниваний, ожидания (т.е. порога статистической значимости для указываемых совпадений с последовательностями в базе данных), отсечения, матрицы и фильтра (низкой сложности) представляют собой параметры, устанавливаемые по умолчанию. Используемая по умолчанию матрица подсчета очков, применяемая в blastp, blastx, tblastn и tblastx, представляет собой матрицу BLOSUM62 (Henikoff et al. (1992) Proc. Natl. Acad. Sci. USA 89, 10915-10919), рекомендованную для запрашиваемых последовательностей свыше 85 нуклеотидов или аминокислот в длину. В случае blastn матрицу для подсчета очков устанавливают на основе соотношения M (т.е. количества очков награды для пары совпадающих остатков) и N (т.е. количества штрафных очков за несовпадающие остатки), где значения по умолчанию M и N составляют +5 и -4 соответственно. Четыре параметра blastn корректировали следующим образом: Q=10 (штраф за образование пробела); R=10 (штраф за расширение пробела); wink=1 (генерирует попадания слов в каждом просматриваемом в данный момент положении вдоль запроса); и gapw=16 (устанавливает ширину окна, в котором создаются выравнивания с пробелами). Эквивалентные установки параметров Blastp представляли собой Q=9; R=2; wink=1 и gapw=32. Сравнение Bestfit между последовательностями, доступное в пакете GCG, версия 10.0, использует параметры для ДНК GAP=50 (штраф за создание пробела) и LEN=3 (штраф за расширение пробела), и эквивалентными установками для сравнений белков являются GAP=8 и LEN=2. «Гипертрофия скелетной мышцы» означает увеличение массы скелетной мышцы или функции скелетной мышцы или и того и другого. «Атрофия скелетной мышцы» означает то же самое, что и «истощение мышцы», и означает уменьшение массы скелетной мышцы или функции скелетной мышцы или и того и другого. При описании структуры и функции белков даны указания аминокислот, составляющие белок. Аминокислоты также могут быть указаны с помощью их обычных сокращений, как показано: A = Ala = аланин; T = Thr = треонин; V = Val = валин; C = Cys = цистеин; L = Leu = лейцин; Y = Tyr = тирозин; I = Ile = изолейцин; N = Asn = аспарагин; P = Pro = пролин; Q = Gln = глутамин; F = Phe = фенилаланин; D = Asp = аспарагиновая кислота; W = Trp = триптофан; E = Glu = глутаминовая кислота; M = Met = метионин; K = Lys = лизин; G = Gly = глицин; R = Arg = аргинин; S = Ser = серин; H = His = гистидин. Букву Z = Glx = пирролидонкарбоновая кислота используют для обозначения N-концевой глутаминовой кислоты или глутамина, который образовал внутренний циклический лактам. Это описано в списке последовательностей в виде признака «модифицированный остаток» там, где это уместно. Букву B используют в описании для обозначения нафтилаланина, модификации аланина в некоторых пептидах, и это указано в списке последовательностей в виде «прочий признак» в списке последовательностей в пептидных последовательностях, где это имеет место. Сокращение «Ac» использовано для обозначения модифицированного ацетилированного NH2-конца в описании и описано в виде признака «модифицированный остаток» там, где это уместно. Пептиды согласно изобретению также модифицируют для того, чтобы они имели амидную группу на карбоксильном конце. Это указано в списке последовательностей в виде признака «модифицированный остаток». Чтобы обозначить делецию или отсутствие аминокислоты в контексте природного гомолога, на протяжении заявки используют «-» или «ноль». Если не оговорено особо все технические и научные термины, используемые в данном описании, имеют такое же значение, как значение, обычно подразумеваемое специалистом в области химии белков, фармакологии или молекулярной биологии. Способы, вещества и примеры, описанные в данной заявке, не предназначены в качестве ограничивающих. Другие способы и вещества, сходные или эквивалентные способам и веществам, описанным в данной заявке, можно использовать в практике или при проверке данного изобретения. Пептиды Данное изобретение охватывает изолированные не нативные пептиды согласно формуле (I): альфа-бета-гамма-дельта-эпсилон-дзета-эта-тета (I) В формуле (I) альфа содержит последовательность формулы X1X2X3X4X5X6, где: каждый из X1, X2 и X3 выбран из группы, состоящей из нуля, A, E, D, G, N, P, Q, S, T и Z; X4 выбран из группы, состоящей из F, I, L, P, T и V; X5 выбран из группы, состоящей из A, I, P, S, T и V; и X6 выбран из группы, состоящей из I, L, M и N. В одном аспекте изобретения альфа содержит последовательность формулы X1X2X3X4X5X6, где X1 означает ноль, X2 выбран из группы, состоящей из D, E и Z; X3 выбран из группы, состоящей из D, G и N; X4 выбран из группы, состоящей из L и P; X5 выбран из группы, состоящей из P и S; и X6 выбран из группы, состоящей из I, L, M и N. В одном варианте альфа, кроме того, содержит последовательность, выбранную из группы, состоящей из -EDLPL (SEQ ID NO: 388), -DNPSL (SEQ ID NO: 389), -DDPPL (SEQ ID NO: 390), -ZGPPI (SEQ ID NO: 391), —PSL и —IVL, где «-» означает ноль. В другом варианте альфа содержит последовательность -ZGPPI. В другом варианте альфа содержит последовательность -DNPSL. В другом варианте альфа содержит последовательность —IVL. В другом варианте альфа содержит последовательность —PSL. В другом аспекте изобретения альфа содержит последовательность формулы X1X2X3X4X5X6; где X1 является нулем; X2 является нулем; X3 является нулем; X4 выбран из группы, состоящей из F, I, L, P и V; X5 выбран из группы, состоящей из A, I, S, T и V; X6 является L. В одном варианте альфа содержит последовательность, выбранную из группы, состоящей из —IVL, —FTL, —LTL, —FAL, —VIL и —PSL. В другом варианте, альфа содержит последовательность —IVL. В еще одном аспекте изобретения альфа содержит последовательность, выбранную из группы, состоящей из SQEPPI (SEQ ID NO: 392), SEEPPI (SEQ ID NO: 393), -DNPSL, —IVL, -TKFTL (SEQ ID NO: 394), -ZGPPI, SQEIVL (SEQ ID NO: 395), SEEIVL (SEQ ID NO: 396), DNPIVL (SEQ ID NO: 397), TKIVL (SEQ ID NO: 398), ZGIVL (SEQ ID NO: 399), SDNPSL (SEQ ID NO: 401), STKFTL (SEQ ID NO: 402), SZGPPI (SEQ ID NO: 403), и NDDPPI (SEQ ID NO: 404). В еще одном аспекте изобретения альфе может предшествовать полигистидин (HHHHHH, SEQ ID NO: 400) или другая пептидная метка, которую можно применять при очистке или детекции пептидов согласно изобретению. В формуле (I) бета содержит последовательность формулы SX8DX10, где каждый X8 и X10 выбран из группы, состоящей из I, L и V. В одном варианте бета содержит последовательность, выбранную из группы, состоящей из SIDL (SEQ ID NO: 405), SLDV (SEQ ID NO: 406), SLDL (SEQ ID NO: 407), SIDI (SEQ ID NO: 408) и SIDV (SEQ ID NO: 409). В другом варианте бета содержит последовательность, кроме того, выбранную из группы, состоящей из SIDL и SLDV. В еще одном варианте бета содержит последовательность SIDL. В еще одном варианте бета содержит последовательность SLDV. В еще одном варианте бета содержит последовательность SIDV. В формуле (I) гамма содержит последовательность формулы X11X12X13; где X11 означает P T, V или S и каждый X12 и X13 выбран из группы, состоящей из A, B (нафтилаланина), C, D, E, F, G, H, I, K, L, M, N, P, Q, R, S, T, V, W и Y. В одном варианте изобретения X11 является P. В другом варианте гамма содержит последовательность, выбранную из группы, состоящей из PAB, PAF, PAH, PAQ, PAY, PFB, PFE, PFF, PFG, PFH, PFI, PFL, PFQ, PFV, PFW, PFY, PGY, PHB, PHF, PHH, PHQ, PHW, PHY, PIA, PIB, PID, PIE, PIF, PIG, PIH, PII, PIL, PIQ, PIR, PIT, PIV, PIW, PIY, PKY, PLB, PLE, PLF, PLG, PLH, PLI, PLL, PLQ, PLV, PLW, PLY, PNY, PQB, PQF, PQH, PQI, PQL, PQQ, PQV, PQW, PQY, PRY, PSY, PTB, РТЕ, PTF, PTH, PTI, PTL, PTV, PTW, PTY, PVB, PVY, PWF, PWH, PWQ, PWW, PWY, PYB, PYF, PYH, PYI, PYL, PYQ, PYT, PYV, PYW, PYY, SLE, SLG, SIG, и VIG. В еще одном варианте изобретения гамма содержит последовательность, выбранную из группы, состоящей из PFE, PFG, PFH, PFQ, PFY, PLE, PLG, PLH, PLQ, PLY, PTE, PTH, PTY, PIE, PIH, PIQ, PIY, PIG, PTN и PTS. В еще одном варианте гамма содержит последовательность, выбранную из группы, состоящей из PFE, PFG, PFH, PFQ, PFY, PLE, PLG, PLH, PLQ, PLY, PTE, PTH, PTY, PIE, PIH, PIQ, PIY, PYY, PFE, PTW, PQY, PHY, PII, PIL, PTI, PTF, PTL, PIV, PIT, PTV и PIE. В еще одном варианте гамма содержит последовательность, выбранную из группы, состоящей из PIG, PTN, PTS и PIG. В еще одном варианте гамма содержит последовательность, выбранную из PFQ, PYW, PLQ, PIG, PLY, PUY, PTY, PIG, PLL, PLF и PFF. В еще одном варианте гамма содержит последовательность PIG. В еще одном варианте гамма содержит PFQ. В формуле (I) дельта содержит последовательность формулы X14X15X16, где X14 выбран из группы, состоящей из I, L и M; X15 выбран из группы, состоящей из L и M; и X16 выбран из группы, состоящей из S, N, Q и R. В одном варианте дельта содержит последовательность, выбранную из группы, состоящей из ILS, IMN, LLQ, LLR и MLR. В одном варианте дельта содержит последовательность LLQ или LLR. В формуле (I), эпсилон содержит последовательность формулы X17X18X19X20X21, где X17 выбран из группы, состоящей из V, I, L, T, K, E, N и Q; X18 выбран из группы, состоящей из L, M, V, A и T; X19 выбран из группы, состоящей из I, F, L и M; X20 выбран из группы, состоящей из D, E, N и H; и X21 выбран из группы, состоящей из L, V, I, Q, M и R. В одном варианте эпсилон содержит последовательность, выбранную из группы, состоящей из VLIDL (SEQ ID NO: 410), VLFDV (SEQ ID NO: 411), VLIEI (SEQ ID NO: 412), ILFNI (SEQ ID NO: 413), LLIEI (SEQ ID NO: 414), LLFNI (SEQ ID NO: 415), ILLEQ (SEQ ID NO: 416), ILIEI (SEQ ID NO: 417), ILLEI (SEQ ID NO: 418), TLLEL (SEQ ID NO: 419), KMIEI (SEQ ID NO: 420), KVIEI (SEQ ID NO: 421), EVLEM (SEQ ID NO: 422), EMIEI (SEQ ID NO: 423), EVIEI (SEQ ID NO: 424), EAIEI (SEQ ID NO: 425), ETIEI (SEQ ID NO: 426), EIIEI (SEQ ID NO: 427), ELIEI (SEQ ГО NO: 428), NMIEM (SEQ ID NO: 429), NMIHR (SEQ ID NO: 430), NMIHM (SEQ ID NO: 431), QMMEM (SEQ ID NO: 432), и LLFNI (SEQ ID NO: 433). В одном варианте изобретения эпсилон содержит последовательность, выбранную из группы, состоящей из VLIDL, VLFDV, ILFNI, LLFNI, ILLEQ, TLLEL и KMIEI. В другом варианте эпсилон содержит последовательность, выбранную из группы, состоящей из VLIDL, VLFDV, ILFNI и ILLEQ. В еще одном варианте эпсилон содержит последовательность, выбранную из группы, состоящей из KMIEI или ILLEQ. В еще одном варианте эпсилон содержит последовательность KVIEI, KMIEI, ILLEI, ILLEQ или TLLEL. В еще одном варианте эпсилон содержит последовательность KMIEI. В еще одном варианте эпсилон содержит последовательность ILLEQ. В формуле (I), дзета содержит последовательность формулы X22X23X24X25, где X22 выбран из группы, состоящей из нуля, A, D, E, S и T; X23 выбран из группы, состоящей из нуля, K и R; X24 выбран из группы, состоящей из нуля, A H, M, N, Q, T и Y; и X25 выбран из группы, состоящей из нуля, E, D, I, K, N, Q и R. В одном варианте изобретения дзета содержит последовательность формулы X22X23X24X25; где X22 выбран из группы, состоящей из нуля, D и E; X23 выбран из группы, состоящей из нуля, K и R; X24 выбран из группы, состоящей из нуля, A, H, M, N, Q, T и Y; X25 выбран из группы, состоящей из нуля, E, D, I, K, N, Q и R. В другом варианте дзета содержит последовательность, выбранную из группы, состоящей из SRAE (SEQ ID NO: 434), EKAR (SEQ ID NO: 435), ERAR (SEQ ID NO: 436), EKQE (SEQ ID NO: 437), TKDR (SEQ ID NO: 438), TKAD (SEQ ID NO: 439), AKAR (SEQ ID NO: 440), AKQR (SEQ ID NO: 441), ERQR (SEQ ID NO: 442), AKAE (SEQ ID NO: 443), ERAE (SEQ ID NO: 444), ARQR (SEQ ID NO: 445), EKQR (SEQ ID NO: 446), TKAN (SEQ ID NO: 447), TKAR (SEQ ID NO: 448), EAAR (SEQ ID NO: 449), ERQE (SEQ ID NO: 450), ARAD (SEQ ID NO: 451), EKTQ (SEQ ID NO: 452), ARAR (SEQ ID NO: 453), ARAE (SEQ ID NO: 454), ARQE (SEQ ID NO: 455), AKQE (SEQ ID NO: 456), TRAD (SEQ ID NO: 457), AKAD (SEQ ID NO: 458), TRAR (SEQ ID NO: 459), EKQQ (SEQ ID NO: 520), –RR, –AA, -AAR, —R, -RAR, —A, –AR, -ARA, -R-R, A-AR, A-A-, A—, ARA- и —-. В еще одном варианте дзета содержит последовательность, выбранную из группы, состоящей из EKAR, ERAR, EKQE и TKDR. В еще одном варианте дзета содержит EKQE, EKTQ, ARAR или EKAR. В формуле (I) эта содержит последовательность формулы X26X27X28X29X30X31, где: X26 выбран из группы, состоящей из A, D, G, H, K, N, Q и S; X27 выбран из группы, состоящей из A, E, I, L, M и Q; X28 выбран из группы, состоящей из A, H, K, Q, R и V; X29 выбран из группы, состоящей из A, E, K, M, N и Q; X30 выбран из группы, состоящей из H, K, N, Q и R; и X31 выбран из группы, состоящей из A и K. В одном варианте изобретения эта содержит последовательность, выбранную из группы, состоящей из AAREQA (SEQ ID NO: 460); KEKKRK (SEQ ID NO: 461); SQRERA (SEQ ID NO: 462), KEKQQA (SEQ ID NO: 463), и QLAQQA (SEQ ID NO: 464) AARNQA (SEQ ID NO: 521), KERNQA (SEQ ID NO: 522), KEKNQA (SEQ ID NO: 523), KQRERA (SEQ ID NO: 524), KERERA (SEQ ID NO: 525), KEKERA (SEQ ID NO: 526), KEKQRA (SEQ ID NO: 527), AEAAAK (SEQ ID NO: 528), AAHAAA (SEQ ID NO: 529), и HAHAHA (SEQ ID NO: 530). В еще одном варианте эта содержит последовательность, выбранную из группы, состоящей из AAREQA и KEKKRK. В еще одном варианте эта содержит последовательность AAREQA. В еще одном варианте эта содержит последовательность, выбранную из группы, состоящей из SQRERA и KEKQQA. В еще одном варианте эта содержит последовательность KEKQQA. В формуле (I) тета содержит последовательность формулы X32X33N34X35X36X37X38X39X40X41, где X32 выбран из группы, состоящей из A, E, H и T; X33 выбран из группы, состоящей из A, D, E, I, L, N, Q, R, S и T; X35 выбран из группы, состоящей из A и R; X36 выбран из группы, состоящей из E, H, I, K, L, N, Q и R; X37 выбран из группы, состоящей из F, I, L, M и Y; X38 выбран из группы, состоящей из L, F и M; X39 выбран из группы, состоящей из A, D, E, N и Q; X40 выбран из группы, состоящей из A, D, E, H, I, K, N, Q, R, S и T; X41 выбран из группы, состоящей из A, F, I и V. В одном варианте изобретения тета содержит последовательность формулы X32X33NX35X36X37X38X39X40X41, где X32 выбран из группы, состоящей из A, E и T; X33 выбран из группы, состоящей из A, D, E, N, Q, S и T; X35 выбран из группы, состоящей из A и R; X36 выбран из группы, состоящей из H, I, L, N, Q и R; X37 выбран из группы, состоящей из F, I, L, M и Y; X38 выбран из группы, состоящей из L, F и M; X39 выбран из группы, состоящей из A, D, E, N и Q; X40 выбран из группы, состоящей из нуля, A, D, H, Q, R, S и T; X41 выбран из группы, состоящей из I и V. В другом варианте тета содержит последовательность, выбранную из группы, состоящей из AANRLLLDTV (SEQ ID NO: 465), AAQEQILAHV (SEQ ID NO: 466), ANNAELLAEI (SEQ ID NO: 467), ANNAHLLAHI (SEQ ID NO: 468), ANNAKLLAKI (SEQ ID NO: 469), ANNALLLATI (SEQ ID NO: 470), ANNALLLDTI (SEQ ID NO: 471), ANNANLLANI (SEQ ID NO: 472), ANNAQLLAHI (SEQ ID NO: 473), ANNAQLLAQI (SEQ ID NO: 474), ANNARILARV (SEQ ID NO: 475), ANNARLLARI (SEQ ID NO: 476), ANNARLLDTI (SEQ ID NO: 477), ANNRLLLATI (SEQ ID NO: 478), ANNRLLLDTI (SEQ ID NO: 479), EQNAHIFAHV (SEQ ID NO: 480), EQNAQIFAHV (SEQ ID NO: 481), EQNARIFARV (SEQ ID NO: 482), EQNRIIFDSV (SEQ ID NO: 483), ETNARILARV (SEQ ID NO: 484), HAQAHILAHV (SEQ ID NO: 485), HSNRKIIDIA (SEQ ID NO: 486), HSNRKLLDIA (SEQ ID NO: 487), HSNRKLMEII (SEQ ID NO: 488), HTNARILARV (SEQ ID NO: 489), TNNRLLLATV (SEQ ID NO: 490), TNNRLLLDTI (SEQ ID NO: 491), TSNRKLMEII (SEQ ID NO: 492), TTNARILARN (SEQ ID NO: 493), TTNARILARV (SEQ ID NO: 494), TTNARLLATV (SEQ ID NO: 495), TTNARLLDRV (SEQ ID NO: 496), TTNARLLDTV (SEQ ID NO: 497), TTNRLLLARV (SEQ ID NO: 498), TTNRLLLATV (SEQ ID NO: 499), TTNRLLLDTV (SEQ ID NO: 500), TTQARILARV (SEQ ID NO: 501) и TTVARILARV (SEQ ID NO: 502). В еще одном варианте тета содержит последовательность, выбранную из группы, состоящей из TTNARILARV, ANNALLLDTI, ANNALLLATI, TTNARLLDTV и TTNARLLDRV. В еще одном варианте тета содержит последовательность ANNARLLDTI, ANNARLLARI, ANNALLLDTI, ANNALLLATI, TTNARLLDRV, TTNARILARV, ANNRLLLDTI, EQNARIFARV, EQNAHIFAHV и EQNAQIFAHV. Специалист в данной области легко поймет, что тета включает C-конец пептида. Пептиды согласно изобретению также были описаны в виде пептида из 41 аминокислоты с определенными предпочтительными последовательностями. Следующие цепочки пептидов приведены в качестве конкретных примеров: ZGPPISIDLP (SEQ ID NO: 503) для остатков X2-X11, LLRK (SEQ ID NO: 504) для остатков X14-X17, IEIEKQEKEKQQA (SEQ ID NO: 505) для остатков X19-X31, PSLSID (SEQ ID NO: 506) для остатков X4-X9 и LLRTLLELEKTQSQRERAEQNA (SEQ ID NO: 507) для остатков X14–35. Варианты описанных пептидов и кодирующих их нуклеотидных последовательностей также входят в объем данного изобретения. В используемом в данном описании смысле термин «варианты» означает те пептиды, полипептиды или белки или кодирующие их нуклеотидные последовательности, которые по существу сходны с пептидами, описанными формулой (I), и которые можно использовать в качестве агонистов CRF2R. Пептид формулы (I) можно изменить различными способами, чтобы получить вариант пептидов, входящих в объем данного изобретения, включая аминокислотные замены, делеции, укорочения, инсерции и модификации. Способы таких манипуляций широко известны в данной области. Например, варианты можно получить с помощью мутаций в кодирующих их нуклеотидных последовательностях. Способы мутагенеза и изменений нуклеотидных последовательностей хорошо известны в данной области. Смотри, например, Kunkel (1985) Proc. Natl. Acad. Sci. USA 82: 488-492; Kunkel et al. (1987) Methods in Enzymol. 154: 367-382; патент США No. 4873192; Walker and Gaastra, eds. (1983) Techniques in Molecular Biology (MacMillan Publishing Company, New York) и процитированные в указанных публикациях ссылки. В одном случае варианта замена(ны) в пептиде формулы (I) является консервативной, так как она минимально нарушает биохимические свойства варианта. Таким образом, в том случае, когда вводят мутации, чтобы заменить аминокислотные остатки, положительно заряженные остатки (H, K и R) предпочтительно заменяют положительно заряженными остатками; отрицательно заряженные остатки (D и E) предпочтительно заменяют отрицательно заряженными остатками; и нейтральные неполярные остатки (A, F, I, L, M, P, V и W) предпочтительно заменяют нейтральными неполярными остатками. В другом случае варианта общий заряд, структура или гидрофобные/гидрофильные свойства пептида могут быть изменены без существенного неблагоприятного влияния на агонизм CRF2R. В еще одном случае вариантом является активный фрагмент пептида формулы (I). В еще одном случае варианта пептиды формулы (I) модифицируют ацетилированием, карбоксилированием, фосфорилированием, гликозилированием, убихитинированием и мечением, осуществляемым с помощью ферментативной обработки белка либо in vivo, либо in vitro или с помощью синтеза пептида с использованием модифицированных аминокислот. Обычные неограничивающие примеры модификаций аминокислот включают фосфорилирование остатков тирозина, серина и треонина; метилирование остатка лизина; ацетилирование остатков лизина; гидроксилирование остатков пролина и лизина; карбоксилирование остатков глутаминовой кислоты; гликозилирование остатков серина, треонина или аспарагина; и убихитинирование остатков лизина. Вариант также может содержать другие домены, такие как эпитопные метки и His-метки (например, пептид может представлять собой слитый белок). В еще одном случае в понятие вариант входят пептидные миметики пептида формулы (I). В используемом в данном описании смысле «миметик» означает аминокислоту или аналог аминокислоты, который имеет такие же или сходные функциональные характеристики аминокислоты. Таким образом, например, аналог аргинина может быть миметиком аргинина, если аналог содержит боковую цепь, имеющую положительный заряд при физиологическом pH, который характерен для реакционной группы гуанидиния боковой цепи аргинина. Примеры органических молекул, которые могут быть подходящими миметиками, перечислены в таблице 1 патента США No. 5807819. Как правило, вариант или кодирующая его последовательность нуклеиновой кислоты согласно данному изобретению будет обладать, по меньшей мере, 70%, обычно 80%, предпочтительно до 90%, более предпочтительно 95%, еще более предпочтительно 97%, и еще более предпочтительно 98%, и наиболее предпочтительно 99% идентичностью последовательностей с соответствующей нативной аминокислотной последовательностью. Не следует считать, что слитые белки или N-концевые, C-концевые или внутренние удлинения, делеции или инсерции в пептидной последовательности влияют на гомологию. Применение пептидов согласно изобретению в качестве агонистов CRF2R Пептиды согласно изобретению применимы для лечения множества заболеваний, расстройств и состояний, которые модулируются CRF2R или активностью CRF2R. В используемом в данном описании смысле термины «заболевание», «расстройство» и «состояние» используются взаимозаменяемо. В используемом в данном описании смысле расстройство, описываемое терминами «модулируемое CRF2R» или «модулируемое активностью CRF2R», относится к расстройству, состоянию или заболеванию, при котором активность CRF2R является эффективным средством для ослабления расстройства или одного или нескольких биологических проявлений заболевания или расстройства; или влияет на одну или несколько точек в биологическом каскаде, либо приводящем к расстройству, либо ответственным за лежащее в основе нарушение; или ослабляет один или несколько симптомов расстройства. Таким образом, расстройства, подвергаемые «модулированию», включают такие расстройства, при которых: (1) отсутствие активности CRF2R является «причиной» данного расстройства или одного или нескольких биологических проявлений, при этом активность изменена генетически, в результате инфекции, раздражения, внутреннего стимула или по другим причинам; (2) заболевание или расстройство или наблюдаемое проявление или проявления заболевания или расстройства ослабляются посредством активности CRF2R (отсутствие активности CRF2R не обязательно причинно связано с заболеванием или расстройством или их наблюдаемыми проявлениями); (3) активность CRF2R влияет на часть биохимического или клеточного каскада, который приводит к заболеванию или расстройству или связан с заболеванием или расстройством. В этом отношении активность CRF2R изменяет каскад и, следовательно, контролирует заболевание, состояние или расстройство. В одном варианте изобретения пептиды согласно данному изобретению не имеют или имеют только слабую агонистическую активность по отношению к CRF1R. Таким образом, пептиды согласно данному изобретению особенно применимы для лечения расстройств, модулируемых CRF2R. Одним из таких модулируемых CRF2R расстройств является атрофия скелетных мышц. Атрофия скелетных мышц может быть индуцирована прекращением использования вследствие хирургического вмешательства, постельного режима или перелома костей; денервацией/повреждением нервов вследствие повреждения спинного мозга; аутоиммунным заболеванием; инфекционной болезнью; использованием глюкокортикоидов в случае несвязанных состояний; сепсисом в результате инфекции или по другим причинам; ограничением питательных веществ из-за болезни или голодания; кахексией при злокачественной опухоли, хроническим воспалением, синдромом приобретенного иммунодефицита (СПИДом), кахексией; хроническим обструктивным легочным заболеванием (COPD), застойной сердечной недостаточностью, саркопенией и генетическими нарушениями, например мышечной дистрофией, нейродегенеративными заболеваниями. В другом варианте лечение модулируемого CRF2R расстройства приводит к увеличению массы и функции скелетной мышцы. Заболевания и состояния, влияющие на массу и функцию скелетной мышцы, включают, но не ограничены указанным, атрофию или истощение скелетной мышцы, включая острую атрофию/истощение в результате прекращения использования вследствие болезни, хирургического вмешательства, постельного режима или несчастного случая; повреждение нервов вследствие повреждения спинного мозга, аутоиммунного заболевания или инфекционной болезни; использование глюкокортикоидов в случае несвязанных состояний; сепсис в результате инфекции или по другим причинам; ограничение питательных веществ из-за болезни или голодания и космический полет; и хроническую атрофию/истощение, включая кахексию при злокачественной опухоли, хроническое воспаление, кахексию, связанную со СПИдом; COPD, застойную сердечную недостаточность, генетические нарушения, например мышечную дистрофию, нейродегенеративные заболевания и саркопению (связанную с возрастом потерю мышечной массы). В еще одном варианте лечение модулируемого CRF2R расстройства включает лечение расстройств, поражающих кости. Заболевания и состояния, поражающие кости, включают, но не ограничены указанным, потерю костной массы в результате прекращения использования вследствие болезни, хирургического вмешательства, постельного режима или несчастного случая; повреждение нервов вследствие повреждения спинного мозга, аутоиммунного заболевания или инфекционной болезни; использование глюкокортикоидов в случае несвязанных состояний; сепсис в результате инфекции или по другим причинам; ограничение питательных веществ из-за болезни или голодания; и космический полет. Также включена связанная с возрастом или гормонами потеря костной массы (остеопороз). В еще одном варианте лечение модулируемого CRF2R расстройства включает лечение расстройств, поражающих сердце и кровеносную систему, включая, но не ограничиваясь указанным, гипертонию, застойную сердечную недостаточность, повреждение сердца в результате сердечного приступа, ишемическое реперфузионное повреждение, инсульт, мигрень, потерю памяти, болезнь Альцгеймера, деменцию и тому подобное. В еще одном варианте лечение модулируемого CRF2R расстройства включает лечение расстройства, поражающего суставы, включая, но не ограничиваясь указанным, артрит, в частности остеоартрит и ревматический артрит. В еще одном варианте лечение модулируемого CRF2R расстройства включает лечение метаболических болезней, включая ожирение и диабет. В еще одном варианте лечение модулируемого CRF2R расстройства включает: уменьшение боли; уменьшение опухоли; лечение аллергических реакций, аллергии; снижение температуры тела; подавление аппетита; лечение застойной сердечной недостаточности; стресса и тревоги; изменение нежелательно низких уровней секреции адренокортикотропного гормона («АКТГ»); контроль аппетита, возбуждения и познавательных функций; и предотвращение долговременного воздействия стресса, такого как расстройства в виде тревоги, нервная анорексия и меланхолическая депрессия. Термин «лечение» в данном описании должен означать как минимум введение пептида согласно данному изобретению, который облегчает модулируемое CRF2R расстройство у субъекта млекопитающего, предпочтительно у человека. Таким образом, термин «лечение» включает: предотвращение возникновения у млекопитающего модулируемого CRF2R расстройства, особенно когда млекопитающее предрасположено к возникновению модулируемого CRF2R расстройства, но у которого еще не диагностировано заболевание; ингибирование модулируемого CRF2R расстройства; и/или ослабление или ремиссию модулируемого CRF2R расстройства. Поскольку способы согласно данному изобретению направлены на профилактику модулируемого CRF2R расстройства, понятно, что термин «предотвращать» не требует, чтобы модулируемое CRF2R расстройство было полностью пресечено (смотри Webster’s Ninth Collegiate Dictionary). Точнее в используемом в данном описании смысле термин «профилактика» относится к способности специалиста в данной области идентифицировать популяцию, которая чувствительна к модулируемым CRF2R заболеваниям, так чтобы введение пептидов и наборов согласно данному изобретению могло происходить до начала симптомов модулируемого CRF2R расстройства. Популяцию, для которой существует риск конкретного модулируемого CRF2R расстройства, легко идентифицировать. Например, популяцию, в которой существует риск развития мышечной дистрофии, можно определить, идентифицируя мутации в генах, характерных для данного расстройства. Например обсуждавшиеся ранее дистрофии Дюшенна и Беккера возникают в результате наследования мутации в гене дистрофии, который локализован в локусе Xp21. Те индивидуумы в популяции, которые имеют указанные мутации, подвержены риску развития мышечной дистрофии. Таким образом, популяция пациентов может быть идентифицирована и может получать введение композиции или дозированной лекарственной формы из набора согласно данному изобретению до того, как болезнь будет прогрессировать. Таким образом, прогрессирование мышечной атрофии или истощения у таких людей может быть «предотвращено». Молекулы нуклеиновых кислот Данное изобретение, кроме того, относится к молекулам нуклеиновых кислот, которые кодируют пептиды формулы (I) и их варианты, предпочтительно в изолированной форме. В используемом в данном описании смысле «нуклеиновая кислота» определяется как РНК или ДНК, которая кодирует пептид согласно данному изобретению, который обсуждается выше, или является комплементарной последовательности нуклеиновой кислоты, кодирующей такие пептиды. В частности, рассматриваются молекулы геномной ДНК, кДНК, мРНК и антисмысловые молекулы, а также нуклеиновые кислоты, основанные на альтернативных остовах или содержащие альтернативные основания, полученные либо из природных источников, либо синтезированные. Данное изобретение, кроме того, относится к фрагменту кодирующей молекулы нуклеиновой кислоты. В используемом в данном описании смысле фрагмент кодирующей молекулы нуклеиновой кислоты относится к небольшой части полной кодирующей белок последовательности. Размер фрагмента будет определяться предполагаемым применением. Например, если фрагмент выбран так, чтобы он кодировал активную часть пептида согласно данному изобретению, необходимо, чтобы фрагмент был достаточно большим, чтобы кодировать функциональные области пептида. Фрагменты кодирующих молекул нуклеиновых кислот согласно данному изобретению (т.е. синтетические олигонуклеотиды), которые используют в качестве зондов или специфичных праймеров для полимеразной цепной реакции (ПЦР) или чтобы синтезировать последовательности генов, кодирующие пептиды согласно изобретению, легко можно синтезировать химическими способами, например, фосфотриэфирным способом Matteucci et al., J. Am. Chem. Soc., 103: 3185-3191 (1981) или используя способы автоматизированного синтеза. Кроме того, более крупные участки ДНК легко можно получить хорошо известными способами, такими как синтез группы олигонуклеотидов, которые определяют различные модульные участки гена, с последующим лигированием олигонуклеотидов, чтобы образовать полный модифицированный ген. Кодирующие молекулы нуклеиновых кислот согласно данному изобретению, кроме того, можно модифицировать так, чтобы они содержали детектируемую метку в целях диагностики и зондирования. В данной области известно множество таких меток, и их легко можно применять в случае кодирующих молекул, описанных в данной заявке. Подходящие метки включают, но не ограничены указанным, биотин, радиоактивно меченые нуклеотиды и тому подобное. Специалист в данной области легко может использовать любую такую метку, чтобы получить меченые варианты молекул нуклеиновых кислот согласно изобретению. Модификации самой первичной структуры путем делеции, присоединения или изменения аминокислот, входящих в последовательность белка, во время трансляции можно осуществить, не нарушая активность белка. Такие замены или другие изменения приводят к белкам, имеющим аминокислотную последовательность, кодируемую нуклеиновой кислотой, которая входит в рассматриваемый объем данного изобретения. Получение пептидов или линий клеток, экспрессирующих пептиды Пептиды согласно данному изобретению можно получить для различных применений, включая, но не ограничиваясь указанным, применение в качестве фармацевтических реагентов для лечения модулируемых CRF2R расстройств. Специалисту в данной области будет понятно, что в случае некоторых вариантов изобретения наиболее применимыми будут очищенные пептиды, тогда как для других вариантов наиболее применимыми будут линии клеток, экспрессирующих пептиды. Так как пептиды формулы (I) являются короткими полипептидами, специалисту в данной области будет понятно, что пептиды согласно данному изобретению можно синтезировать прямым синтезом вместо получения рекомбинантными способами, используя методики, хорошо известные в данной области. Смотри Bodanszky, Principles of Peptide Synthesis, Springer-Verlag, Heidelberg (1984); а именно с помощью твердофазного синтеза, смотри, например, Merrifield, J. Am. Chem. Soc., 85: 2149-54 (1963); Barany et al., Int. J. Peptide Protein Res., 30: 705-739 (1987); и патент США No. 5424398. Например, пептиды можно синтезировать либо с помощью автоматического синтезатора Applied Biosystem, Inc. (ABI), модель 433, либо с помощью многореакторного синтезатора (модель Symphonyтм) производства Protein Technology, Inc (PTI). Что касается пептидов, синтезируемых с помощью синтезатора ABI, то все реагенты приобретены в ABI (за исключением пиперидина, который приобретен из Aldrich). Fmoc-аминокислоты приобретены из ABI (за исключением Fmoc-L-Pyr, который приобретен из Chem-Impek). Амидные смолы Ринка приобретены из Nova Chemicals. Используют стандартную химию 0,1 ммоль FastMoc с одиночным связыванием. Общий протокол Fmoc-химии для SPPS (твердофазного синтеза пептидов) включает: 1) отщепление Fmoc-защитных групп с помощью пиперидина; 2) активацию карбоксильной группы аминокислот; и 3) связывание активированных аминокислот с аминоконцом связанной со смолой пептидной цепи, чтобы образовать пептидные связи. Аминокислоты активируют гексафторфосфатом 2-(1H-бензотриазол-1-ил)-1,1,3,3-тетраметилурония (HBTU). Сухую защищенную аминокислоту в картридже (1,0 ммоль) растворяют в растворе HBTU, N,N-диизопропилэтиламина (DIEA) и 1-гидроксибензотриазола (HOBt) в N,N-диметилформамиде (ДМФА) с добавлением дополнительно N-метилпирролидона (NMP). Активированная Fmoc-аминокислота образуется почти мгновенно, и раствор переносят непосредственно в реакционный сосуд. Стадию удаления Fmoc-защиты контролируют и регулируют посредством кондуктометрического измерения. Пептидную цепь строят на амидной смоле Ринка, так как необходим C-концевой амид. Конечный продукт обильно промывают NMP и дихлорметаном (ДХМ). Что касается пептидов, синтезированных с помощью множественного синтезатора PTI, то все Fmoc-аминокислоты приобретены из NovaBiochem (за исключением Fmoc-Pyr, который приобретен из Chem-Impex). Для синтеза используют стандартный протокол 0,05 ммоль Fmoc-синтеза. Fmoc-аминокислоты (0,4 ммоль) растворяют в растворе HBTU (200 мМ), N-метилморфолина (NMM; 0,4 М) и N,N-диметилформамида (ДМФА) с дополнительным добавлением N-метилпирролидона (NMP). Активированная Fmoc-аминокислота образуется почти мгновенно, и раствор переносят непосредственно в реакционный сосуд. Стадию удаления Fmoc-защиты проводят дважды. Пептидную цепь строят на амидной смоле Ринка, так как требуется C-концевой амид. Конечный продукт синтеза обильно промывают NMP и дихлорметаном (ДХМ). Удаляют защиту новосинтезированных пептидов. Смолы, содержащие синтезированные пептиды, выгружают из синтезатора и недолго сушат на воздухе. Используя 1,5-2,0 мл смеси для отщепления (содержащей 95% трифторуксусную кислоту (ТФУ), 2,5% этанодитиола, 2,5% тиоанизола, 2,5% фенола (мас./об.) в воде) в течение 4 часов при комнатной температуре, пептиды отщепляют от смолы и в то же время удаляют защитные группы боковых цепей [O-трет-бутил (OtBu) для Asp, Glu, Tyr, Thr и Ser; пентаметилхроман-6-сульфонил (Pmc) для Arg, трет-бутоксикарбонил (Boc) для Trp и Lys; тритил (Trt) для His, Asn и Gln] в условиях для снятия защиты. Раствор для отщепления отделяют от смолы фильтрованием. Затем фильтрат разбавляют 15 мл воды. Осуществляют шесть раундов экстракции эфиром, чтобы очистить пептидный продукт. Пептид подвергают лиофильной сушке и хранят при -20°С до очистки. Пептиды после удаления защиты очищают и характеризуют. Порошок пептида растворяют в 50% растворе уксусной кислоты и инъецируют на колонку C-8 Vydac с в.д. 1,0 см и длиной 25 см с размером частиц 5 мкм и размером пор 300 Å для очистки. Используют систему высокоэффективной жидкостной хроматографии (ВЭЖХ) Beckman System Gold с ультрафиолетовым детектором при двух длинах волн (220 нм и 280 нм). Программируют и вводят на колонку линейный градиент ацетонитрила, чтобы отделить пептидный продукт от других веществ. Элюат собирают с помощью коллектора фракций Pharmacia и отдельные фракции после разделения подвергают и аналитической ВЭЖХ и (времяпролетной масс-спектрометрии с лазерной десорбцией и ионизацией из матрицы) MALDI-TOF МС для характеристики, чтобы удостовериться в идентичности и чистоте. Также предполагается использование методики рекомбинантной ДНК для получения пептидов или линий клеток, экспрессирующих указанные пептиды. Такие рекомбинантные способы хорошо известны в данной области. Способы образования молекул rДНК хорошо известны в данной области, например, смотри Sambrook et al., Molecular Cloning-A Laboratory Manual, Cold Spring Harbor Laboratory Press (1989). Чтобы экспрессировать рекомбинантные пептиды согласно данному изобретению получают экспрессирующий вектор, который содержит нуклеиновую кислоту, которая кодирует представляющий интерес полипептид под контролем одного или нескольких регуляторных элементов. Последовательность нуклеиновых кислот, кодирующих пептиды согласно данному изобретению, можно рассчитать на основе пептидных последовательностей, обсуждаемых и заявленных в данном описании. Способами, хорошо известными в данной области, изолированную молекулу нуклеиновой кислоты, кодирующую представляющий интерес пептид, можно лигировать в подходящий экспрессирующий вектор. Системы хозяин-экспрессирующий вектор, которые можно использовать в целях изобретения, включают, но не ограничены указанным: микроорганизмы, такие как бактерии (например, E. coli, B. subtilis), трансформированные экспрессирующими векторами на основе рекомбинантной ДНК бактериофага, плазмидной ДНК или космидной ДНК, содержащими нуклеотидные последовательности, кодирующие пептиды согласно данному изобретению; дрожжи (например, Saccharomyces, Pichia), трансформированные рекомбинантными экспрессирующими векторами дрожжей, содержащими нуклеотидные последовательности, кодирующие пептиды согласно данному изобретению; системы клеток насекомых, инфицированные рекомбинантными вирусными экспрессирующими векторами (например, бакуловирусом), содержащими нуклеотидные последовательности, кодирующие пептиды согласно данному изобретению; системы растительных клеток, инфицированных рекомбинантными вирусными экспрессирующими векторами (например, вирусом мозаики цветной капусты, вирусом табачной мозаики) или трансформированных рекомбинантными плазмидными экспрессирующими векторами (например, Ti-плазмидой), содержащими нуклеотидные последовательности, кодирующие пептиды согласно данному изобретению; или системы клеток млекопитающих (например, COS, CHO, HEK293, NIH3T3), несущих рекомбинантные экспрессирующие конструкции, содержащие промоторы, полученные из генома клеток млекопитающих (например, промотор металлотионеина) или из вирусов млекопитающих (например, LTR ретровируса), а также содержащие нуклеотидные последовательности, кодирующие пептиды согласно данному изобретению. В бактериальных системах преимущественно может быть выбран ряд экспрессирующих векторов в зависимости от предполагаемого применения экспрессируемого пептида. Например, в том случае, когда необходимо большое количество такого белка, желательны векторы, которые обеспечивают экспрессию высоких уровней белковых продуктов. Специалист в данной области способен создать такие векторные конструкции и очистить белки с помощью множества методик, включая методики избирательной очистки, такие как использование избирательных по отношению к слитому белку колонок или колонок на основе антител, и методики неизбирательной очистки. В системах экспрессии белка насекомых в качестве вектора используют бакуловирус – вирус ядерного полиэдроза A. californica (AcNPV), чтобы экспрессировать чужеродные гены в клетках S. frugiperda. В данном случае нуклеотидные последовательности, кодирующие пептиды согласно данному изобретению, клонируют в несущественных областях вируса и помещают под контроль промотора AcNPV. Затем рекомбинантные вирусы используют для того, чтобы инфицировать клетки, в которых экспрессируется встроенный ген, и белок очищают одним из многих способов, известных специалисту в данной области. В клетках-хозяевах млекопитающих можно использовать ряд основанных на вирусах систем экспрессии. Применение указанных систем экспрессии часто требует создания в векторах специфичных сигналов инициации для эффективной трансляции встроенных нуклеотидных последовательностей. Это особенно важно в том случае, когда используемая часть нуклеотидной последовательности не содержит эндогенного сигнала инициации. Размещение указанного сигнала инициации в рамке с кодирующей областью встроенной нуклеотидной последовательности, а также добавление транскрипционных и трансляционных энхансерных элементов и очистку рекомбинантного белка осуществляют одним из многих способов, известных специалисту в данной области. Также важное значение в случае клеток-хозяев млекопитающих имеет подбор соответствующего типа клеток, которые способны осуществлять необходимые посттрансляционные модификации рекомбинантного белка. Такие модификации, например расщепление, фосфорилирование, гликозилирование, ацетилирование и т.д., требуют подбора соответствующей клетки-хозяина, которая содержит модифицирующие ферменты. Такие клетки-хозяева включают, но не ограничены указанным, CHO, HEK293, NIH3T3, COS и т.д. и известны специалистам в данной области. Для долговременной высокой экспрессии рекомбинантных белков предпочтительной является стабильная экспрессия. Например, могут быть сконструированы линии клеток, которые стабильно экспрессируют пептиды согласно данному изобретению. Специалист в данной области, следуя известным способам, таким как электропорация, трансфекция с помощью фосфата кальция или опосредованная липосомами трансфекция, может создать линию клеток, которые стабильно экспрессируют пептиды согласно данному изобретению. Обычно это осуществляют путем трансфекции клеток, используя экспрессирующие векторы, которые содержат соответствующие регуляторные элементы экспрессии (например, промоторные последовательности, энхансерные последовательности, последовательности терминации транскрипции, сайты полиаденилирования, сайты начала транскрипции, и т.д.), селектируемый маркер и представляющий интерес ген. Селектируемый маркер может либо находиться в том же самом векторе, что и представляющий интерес ген, либо в отдельном векторе, который трансфицируют совместно с вектором, содержащим кодирующую пептид последовательность. Селектируемый маркер в экспрессирующем векторе может придавать резистентность к селекции и позволяет клеткам стабильно интегрировать вектор в свои хромосомы и расти, образуя очаги, которые в свою очередь можно клонировать и размножить до получения линий клеток. Альтернативно экспрессирующий вектор может обеспечивать селекцию клетки, экспрессирующей селектируемый маркер, используя физическое свойство маркера, например, экспрессия белка с зеленой флуоресценцией (GFP) позволяет осуществлять селекцию клеток, экспрессирующих маркер, с использованием анализа на основе активируемой флуоресценцией сортировки клеток (FACS). Специалист в данной области может выбрать подходящий тип клеток для трансфекции, чтобы обеспечить селекцию клеток, в которые была успешно интегрирована представляющая интерес последовательность. Например, в том случае, когда селектируемым маркером является тимидинкиназа вируса простого герпеса, гипоксантингуанинфосфорибозилтрансфераза или аденинфосфорибозилтрансфераза, подходящим типом клеток могут быть клетки tk-, hgprt- или aprt- соответственно. Или можно использовать нормальные клетки в том случае, когда селектируемым маркером является dhfr, gpt, neo или hygro, которые придают резистентность к метотрексату, микофенольной кислоте, G-418 или гигромицину соответственно. Получение антител Антитела, которые избирательно распознают один или несколько эпитопов пептидов согласно данному изобретению, также входят в объем изобретения. Такие антитела включают, например, поликлональные антитела, моноклональные антитела, химерные антитела, человеческие антитела, одноцепочечные антитела, Fab-фрагменты, F(ab’)2-фрагменты, молекулы, получаемые с использованием библиотеки, экспрессирующей Fab, человеческие антитела (поликлональные или моноклональные), продуцируемые в трансгенных мышах, и связывающие эпитопы фрагменты любого из указанных выше антител. Антитела можно использовать вместе со способами генной терапии, чтобы оценить, например, экспрессию пептидов согласно данному изобретению либо в клетках, либо непосредственно в тканях пациента, в которые указанные гены были введены. Для получения антител можно иммунизировать множество животных-хозяев путем инъекции пептидов согласно данному изобретению, антипептидного антитела, антитела против аналога пептида или их иммуногенных фрагментов способами, хорошо известными в данной области. В случае получения антиидиотипического антитела иммуногеном является антитело к пептиду или антитело к аналогу пептида. Получение антиидиотипических антител описано, например, в патенте США No. 4699880. Подходящие животные-хозяева включают, но не ограничены указанным, кроликов, мышей, коз, овец и лошадей. Способы иммунизации хорошо известны в данной области. Из сыворотки иммунизированных животных можно очистить поликлональные антитела или можно получить моноклональные антитела способами, хорошо известными в данной области. Указанные способы включают, но не ограничены указанным, хорошо известные способы на основе гибридом Kohler и Milstein, способы на основе гибридом B-клеток человека и способ EBV-гибридомы. Моноклональные антитела могут быть любого класса иммуноглобулинов, включая IgG, IgE, IgM, IgA и IgD, содержащие легкие цепи либо каппа, либо лямбда. Способы получения и применения химерных антител известны в данной области и описаны, например, в патентах США No. 5807715, 4816397, 4816567, 5530101, 5585089, 5693761, 5693762, 6180370 и 5824307. Анализы для определения избирательности по отношению к CRF2R Фармакологическую активность и избирательность пептидов согласно данному изобретению можно определить, используя опубликованные способы тестирования. Смотри, например, заявку на выдачу патента США No.09/799978. Так как CRF2R и CRF1R являются гомологичными белками, предполагается, что некоторая часть агонистов CRF2R также будет функционировать в качестве агонистов CRF1R. Как обсуждалось выше, активация CRF1R индуцирует активацию HPA-оси, впоследствии повышенная продукция кортикостероидов приводит к атрофии скелетных мышц. В большинстве случаев, при которых требуется увеличение мышечной массы или функции, не желательно активировать HPA-ось. При выборе пептида, применимого для лечения модулируемого CRF2R расстройства, которое не связано с мышечной дистрофией, предпочтительно, чтобы пептид был избирательным по отношению к CRF2R. Предпочтительно пептид проявляет 10-кратную избирательность по отношению к CRF2R по сравнению с CRF1R (т.е. в 10 раз более активен в отношении CRF2R, чем в отношении CRF1R), более предпочтительно 100-кратную избирательность и наиболее предпочтительно 1000-кратную или большую избирательность. Так как в опубликованных исследованиях показана польза терапии кортикостероидами при лечении мышечных дистрофий, то может быть полезным, чтобы агонист CRF2R сохранял некоторый уровень агонизма по отношению к CRF1R при использовании для лечения мышечных дистрофий. Таким образом, для лечения мышечных дистрофий предпочтителен пептид с низкой избирательностью, который активирует CRF2R, а также CRF1R в сходных пределах концентрации. Предпочтительно пептид обладает 100-кратной избирательностью по отношению к CRF2R по сравнению с CRF1R, более предпочтительно 10-кратной избирательностью и наиболее предпочтительно не обладает избирательностью к CRF2R по сравнению с CRF1R (т.е. активность выбранного для исследования соединения по существу одинакова по отношению к CRF2R и CRF1R). Также в данном случае может быть более предпочтительным, чтобы пептид был полным агонистом CRF2R и при этом был частичным агонистом CRF1R. Такой пептид, следовательно, может иметь присущее ему ограничение по максимальной степени повышения уровня кортизола и возможности мышечной атрофии, тогда как действие, направленное против атрофии, модулируемой через CRF2R, может быть усилено при увеличении дозы. Специалист в данной области легко сможет определить, является ли пептид полным или частичным агонистом CRF1R или CRF2R, используя способы, известные в данной области. Поскольку желательно отличить связывание с CRF2R по сравнению с CRF1R можно проводить описанные выше анализы, используя клетку или мембрану клетки, которая экспрессирует только CRF2R, или можно проводить анализы с рекомбинантным источником CRF2R. Клетки, экспрессирующие обе формы CRFR, можно модифицировать, используя гомологичную рекомбинацию, чтобы инактивировать или иным образом отключить ген CRF1R. Альтернативно, если источник CRFR содержит более одного типа CRFR, фоновый сигнал, генерируемый рецептором, который не представляет интереса, необходимо вычесть из сигнала, полученного в анализе. Фоновый сигнал можно определить рядом способов, в том числе исключением сигнала от CRFR, который не представляет интерес, с использованием антисмысловой последовательности, антител или избирательных антагонистов. Известные антагонисты CRFR включают, но не ограничены указанным, анталармин (избирателен по отношению к CRF1R), антисаувагин-30 (избирателен по отношению к CRF2R) и астрессин (не избирателен в случае CRF1R/CRF2R). Чтобы определить активирует ли пептид CRF2R и/или CRF1R, анализы обычно основывают на клетках; однако известны бесклеточные системы, которые способны дифференцировать связывание агониста и антагониста, как описано выше. Основанные на клетках анализы включают стадии контактирования клеток, которые экспрессируют CRF1R или CRF2R, с пептидом согласно данному изобретению или контролем и измерения активации CRFR посредством измерения экспрессии или активности компонентов путей сигнальной трансдукции с участием CRFR. Как описано в разделе «Предпосылка» выше, CRFR, по-видимому, сопряжены посредством нескольких различных путей, включающих G Например, после осуществления контакта с пептидом согласно данному изобретению можно получить лизаты клеток и провести анализ индукции цАМФ. цАМФ индуцируется в ответ на активацию G В одном примере индукцию цАМФ измеряют с использованием конструкций ДНК, содержащих элемент ответа на цАМФ, связанный с любым из множества репортерных генов, которые могут быть введены в клетки, экспрессирующие CRFR. Такие репортерные гены включают, но не ограничены указанным, гены хлорамфениколацетилтрансферазы (CAT), люциферазы, глюкуронидсинтетазы, гормона роста, флуоресцентных белков (например, белок с зеленой флуоресценцией) или щелочной фосфатазы. После экспонирования клеток с пептидом можно количественно измерить уровень экспрессии репортерного гена, чтобы определить способность пептида увеличивать уровни цАМФ и таким образом определить способность пептида активировать CRFR. Клетки, применимые в данном анализе, являются такими же, как клетки для анализа связывания CRFR, описанного выше, за исключением того, что клетки, используемые в анализе активации, предпочтительно экспрессируют функциональный рецептор, который дает статистически значимый ответ на CRF или один или несколько аналогов CRF. Кроме использования клеток, экспрессирующих полноразмерные CRFR, могут быть сконструированы клетки, которые экспрессируют CRFR, содержащие связывающий лиганд домен рецептора, связанный с репортерными элементами или физически модифицированный так, чтобы он содержал репортерные элементы или чтобы взаимодействовал с передающими сигнал белками. Например, CRFR дикого типа или фрагмент CRFR может быть слит с G-белком, что приводит к активации слитого G-белка при связывании агониста с CRFR-частью слитого белка. Siefert, R. et al., Trends Pharmacol. Sci., 20: 383-389 (1999). Клетки также предпочтительно должны обладать рядом параметров в зависимости от индикаторной системы, чтобы сделать максимальным ответ, индуцируемый CRF или аналогом CRF, например, для детектирования сильной индукции репортерного гена CRE; предпочтительным может быть (a) низкий природный уровень цАМФ; (b) G-белки, способные взаимодействовать с CRFR; (c) высокий уровень аденилилциклазы; (d) высокий уровень протеинкиназы A; (e) низкий уровень фосфодиэстераз; и (f) высокий уровень белка, связывающего элемент ответа на цАМФ. Чтобы усилить ответ на CRF или аналог CRF, можно сконструировать клетки-хозяева так, чтобы они экспрессировали большее количество предпочтительных факторов или меньшее количество не предпочтительных факторов. Кроме того, альтернативные пути индукции репортера CRE могут быть элиминированы, чтобы уменьшить базальные уровни. Анализы для определения фармакологической активности Фармакологическую активность пептидов согласно данному изобретению можно определить, используя опубликованные способы тестирования. Например, модели атрофии или гипертрофии скелетных мышц включают как модели in vitro на культурах клеток, так и модели атрофии скелетных мышц in vivo на животных. Модели атрофии скелетных мышц in vitro известны в данной области. Такие модели описаны, например, в Vandenburgh, H. H., In Vitro, 24: 609-619 (1988), Vandenburgh, H. H. et al., J. Biomechanics, 24 Suppl. 1: 91-99 (1991), Vandenburgh, H. H et al., In Vitro Cell. Dev. Biol., 24 (3): 166-174 (1988), Chromiak, J. A., et al., In Vitro Cell. Dev. Biol. Anim., 34 (9): 694-703 (1998), Shansky, J., et al., In Vitro Cell. Dev. Biol. Anim., 33 (9): 659-661 (1997), Perrone, C. E. et al., J. Biol. Chem., 270 (5): 2099-2106 (1995), Chromiac, J. A. and Vandenburgh, H. H., J. Cell. Physiol., 159 (3): 407-414 (1994), и Vandenburgh, H. H. and Karlisch, P., In Vitro Cell. Dev. Biol., 25 (7): 607-616 (1989). В данной области известен ряд моделей атрофии скелетных мышц на животных, такие как модели, описанные в следующих публикациях: Herbison, G. J., et al. Arch. Phys. Med. Rehabil., 60: 401-404 (1979), Appell, H-J. Sports Medicine 10: 42-58 (1990), Hasselgren, P-O. and Fischer, J. E. World J. Surg., 22: 203-208 (1998), Agbenyega, E. T. and Wareham, A. C. Comp. Biochem. Physiol., 102A: 141-145 (1992), Thomason, D. B. and Booth, F. W. J. Appl. Physiol., 68: 1-12 (1990), Fitts, R. H., et al. J. Appl. Physiol., 60: 1946-1953 (1986), Bramanti, P., et al. Int. J. Anat. Embryol. 103: 45-64 (1998), Cartee, G. D. J. Gerontol. A Biol. Sci. Med. Sci., 50: 137-141 (1995), Cork, L. C., et al. Prog. Clin. Biol. Res., 229: 241-269 (1987), Booth, F. W. and Gollnick, P. D. Med. Sci. Sports Exerc., 15: 415-420 (1983), Bloomfield, S. A. Med. Sci. Sports Exerc., 29: 197-206 (1997). Предпочтительными животными для указанных моделей являются мыши и крысы. Указанные модели включают, например, модели атрофии, индуцированной прекращением использования, такие как накладывание шины или иммобилизация конечностей другим образом, подвешивание задней конечности, полная иммобилизация животного и состояния пониженной гравитации. Модели атрофии, индуцированной повреждением нервов, включают, например, раздавливание нерва, удаление участков нервов, которые иннервируют конкретные мышцы, нанесение токсина на нервы и инфекция нервов вирусными, бактериальными или эукариотическими инфекционными агентами. Модели атрофии, индуцированной глюкокортикоидами, включают применение индуцирующих атрофию доз экзогенного глюкокортикоида у животных и стимуляцию продукции эндогенного кортикостероида, например, применяя гормоны, которые активируют гипоталамо-гипофизарно-надпочечниковую (HPA) ось. Модели атрофии, индуцированной сепсисом, включают, например, инокуляцию индуцирующими сепсис организмами, такими как бактерии, обработку животного активирующими иммунную систему соединениями, такими как экстракт клеточной стенки бактерий или эндотоксин, и прокалывание кишечных стенок. Модели атрофии, индуцированной кахексией, включают, например, инокуляцию животного клетками, вызывающими опухоли, с формирующим кахексию потенциалом, инфецирование животного инфекционными агентами (такими как вирусы, которые вызывают СПИД), которые приводят к кахексии, и обработку животного гормонами или цитокинами, такими как CNTF, TNF, IL-6, IL-1 и т.д., которые индуцируют кахексию. Модели атрофии, индуцированной сердечной недостаточностью, включают обработку животного, так чтобы возникала сердечная недостаточность с сопутствующей атрофией скелетных мышц. Модели атрофии, индуцированной нейродегенеративным заболеванием, включают модели аутоиммунных заболеваний, такие как модели в результате иммунизации животного компонентами нейронов. Модели атрофии, индуцированной мышечной дистрофией, включают природные или искусственные генетически индуцированные модели мышечной дистрофии, такие как мутация гена дистрофина, которая встречается у мышей Mdx. Животные модели гипертрофии скелетных мышц включают, например, модели повышенной нагрузки на мышцы конечностей в результате инактивации противоположной конечности, повторная нагрузка после события, индуцирующего атрофию вследствие прекращения использования, повторное использование мышцы, которая атрофирована вследствие временного повреждения нерва, повышенное использование отдельных мышц вследствие инактивации мышцы-синергиста (например, компенсаторная гипертрофия), усиленное использование мышцы в результате увеличенной нагрузки, помещенной на мышцу, и гипертрофия в результате удаления глюкокортикоида после индуцированной глюкокортикоидом атрофии. Предпочтительные модели атрофии на животных включают модель атрофии при денервации седалищного нерва, модель атрофии, индуцированной глюкортикоидами, и модель атрофии при прекращении использования в результате накладывания шины на лапу, которые описаны более подробно ниже. Модель атрофии при денервации седалищного нерва заключается в анестезии животного с последующим хирургическим удалением короткого участка либо правого, либо левого седалищного нерва, например, у мышей седалищный нерв изолируют примерно в средней точке вдоль бедра и удаляют участок длиной примерно 3-5 мм. Это приводит к денервации нижней части мускулатуры задней конечности, результатом которой является атрофия указанных мышц. Обычно иннервацию двуглавой мышцы бедра оставляют интактной, чтобы обеспечить достаточное движение в колене для практически нормальной ходьбы. Обычно у не подвергаемых обработке животных мышечная масса денервированных мышц снижается на 30-50% через десять дней после денервации. После денервации вводят тестируемые пептиды, например, путем инъекции или непрерывной инфузии, например, посредством имплантации осмотического мининасоса (например, Alzet, Palo Alto, CA), чтобы определить их действие на индуцированную денервацией атрофию скелетных мышц. В различных временных точках после денервации животных умерщвляют и быстро вырезают нижнюю часть мышцы конечности как на денервированной, так и неденервированной лапах, мышцы, очищенные от сухожилий и соединительной ткани, взвешивают. Степень атрофии пораженных мышц анализируют, например, посредством измерения мышечной массы, площади поперечного сечения мышцы, площади поперечного сечения миофибрилл или содержания сократительного белка. Модель индуцированной глюкокортикоидами атрофии заключается во введении глюкокортикоида тестируемому животному, например, 1,2 мг/кг/сутки дексаметазона в питьевой воде. Обычно у не подвергаемых обработке животных мышечная масса скелетных мышц снижается на 30-50% через десять дней после введения дексаметазона. Вместе с введением глюкокортикоида или после его введения вводят тестируемые пептиды, например, путем инъекции или непрерывной инфузии, чтобы определить их действие на индуцированную глюкокортикоидом атрофию скелетных мышц. В различных временных точках после введения глюкокортикоида анализируют степень атрофии в пораженных мышцах, как описано выше для модели денервации. Модель атрофии в результате прекращения использования при наложении шины на лапу заключается в наложении шины на одну заднюю лапу животного от колена вниз через стопу. Обычно мышечная масса снижается на 20-40% через десять дней после наложения шины. После наложения шины вводят тестируемые пептиды путем инъекции или непрерывной инфузии посредством имплантации осмотического мининасоса (например, Alzet, Palo Alto, CA), чтобы определить их действие на атрофию скелетных мышц, индуцированную наложением шины на лапу. В различных временных точках после наложения шины на лапу анализируют степень атрофии пораженных мышц, как описано выше для модели денервации. Активность по отношению к кости исследуемых пептидов легко можно продемонстрировать, используя анализ, предназначенный для тестирования способности исследуемых соединений увеличивать объем, массу или плотность кости. Примером такого анализа является анализ на подвергаемых овариэктомии крысах. При анализе крыс, подвергаемых овариэктомии, у крыс шестимесячного возраста удаляют яичники, содержат еще 2 месяца и затем один раз в сутки подкожно вводят дозу тестируемого соединения. После завершения исследования можно измерить массу и/или плотность кости рентгеновской абсорбциометрией с двойной энергией (DXA) или периферической количественной компьютерной томографией (pQCT) или компьютерной микротомографией (mCT). Альтернативно можно использовать статическую и динамическую гистоморфометрию, чтобы измерить увеличение объема или формирования костей. Композиции Другим аспектом данного изобретения являются композиции, которые содержат: (a) безопасное и эффективное количество пептида согласно данному изобретению; и (b) фармацевтически приемлемый носитель. Используют стандартные способы приготовления фармацевтических композиций, такие как способы, описанные в Remington’s Pharmaceutical Sciences, Mack Publishing Company, Easton, Pa., последняя редакция. «Безопасное и эффективное количество» означает количество пептида согласно изобретению, достаточное для того, чтобы в значительной степени индуцировать положительную модификацию состояния, подвергаемого лечению, но достаточно небольшое, чтобы избежать серьезных побочных эффектов (таких как токсичность, раздражение или аллергическая реакция) у животного, предпочтительно млекопитающего, более предпочтительно человека, нуждающегося в этом, соответствующее разумному соотношению польза/риск при использовании согласно данному изобретению. Очевидно, что конкретное «безопасное и эффективное количество» будет варьироваться в зависимости от таких факторов, как конкретное состояние, подвергаемое лечению, физическое состояние субъекта, продолжительность лечения, природа сопутствующей терапии (если имеет место), конкретная используемая дозированная лекарственная форма, применяемый носитель, растворимость в нем пептида и схема дозирования, желательная для данной композиции. Специалист в данной области может использовать следующие руководства, чтобы определить «безопасное и эффективное количество» в соответствии с данным изобретением. Spilker B., Guide to Clinical Studies and Developing Protocols, Raven Press Books, Ltd., New York, 1984, pp. 7-13, 54-60; Spilker B., Guide to Clinical Trials, Raven Press, Ltd., New York, 1991, pp. 93-101; Craig C., and R. Stitzel, eds., Modern Pharmacology, 2d ed., Little, Brown and Co., Boston, 1986, pp. 127-33; T. Speight, ed., Avery’s Drug Treatment: Principles and Practice of Clinical Pharmacology and Therapeutics, 3d ed., Williams and Wilkins, Baltimore, 1987, pp. 50-56; R. Tallarida, R. Raffa and P. McGonigle, Principles in General Pharmacology, Springer-Verlag, New York, 1988, pp. 18-20. Кроме данного пептида композиции согласно данному изобретению содержат фармацевтически приемлемый носитель. Термин «фармацевтически приемлемый носитель» в используемом в данном описании смысле означает один или несколько совместимых твердых или жидких наполнителей, разбавителей или инкапсулирующих веществ, которые подходят для введения животному, предпочтительно млекопитающему, более предпочтительно человеку. Термин «совместимый» в используемом в данном описании смысле означает, что компоненты композиции можно смешивать с данным пептидом и друг с другом таким образом, что не происходит взаимодействия, которое может в значительной степени уменьшить фармацевтическую эффективность композиции в обычных случаях применения. Фармацевтически приемлемые носители конечно должны быть достаточно высокой степени чистоты и достаточно низкой токсичности, чтобы они были подходящими для введения животному, предпочтительно млекопитающему, более предпочтительно человеку, подвергаемому лечению. Некоторыми примерами веществ, которые могут служит в качестве фармацевтически приемлемых носителей или их компонентов, являются: сахара, такие как лактоза, глюкоза и сахароза; крахмалы, такие как кукурузный крахмал и картофельный крахмал; целлюлоза и ее производные, такие как натрий-карбоксиметилцеллюлоза, этилцеллюлоза и метилцеллюлоза; порошкообразная трагакантовая камедь; солод; желатин; тальк; твердые скользящие вещества, такие как стеариновая кислота и стеарат магния; сульфат кальция; растительные масла, такие как арахисовое масло, хлопковое масло, кунжутное масло, оливковое масло, кукурузное масло и масло какао; полиолы, такие как пропиленгликоль, глицерин, сорбит, маннит и полиэтиленгликоль; альгиновая кислота; эмульгаторы, такие как твины®; увлажнители, такие как лаурилсульфат натрия; красители; корригенты; таблетирующие агенты, стабилизаторы; антиоксиданты; консерванты; апирогенная вода; изотоничный раствор соли и растворы фосфатных буферов. Выбор фармацевтически приемлемого носителя, используемого вместе с данным соединением, в основном определяется тем, каким путем необходимо вводить пептид. Если данный пептид необходимо инъецировать, то предпочтительным фармацевтически приемлемым носителем является стерильный физиологический раствор с коллоидным суспендирующим агентом, совместимом с кровью, pH которого был доведен примерно до 7,4. В частности, фармацевтически приемлемые носители для системного введения включают сахара, крахмалы, целлюлозу и ее производные, солод, желатин, тальк, сульфат кальция, растительные масла, синтетические масла, полиолы, альгиновую кислоту, растворы фосфатного буфера, эмульгаторы, изотоничный раствор соли и апирогенную воду. Предпочтительные носители для парентерального введения включают пропиленгликоль, этилолеат, пирролидон, этанол и кунжутное масло. Предпочтительно фармацевтически приемлемый носитель в композициях для парентерального введения составляет, по меньшей мере, примерно 90% масс. суммарной композиции. Композиции согласно данному изобретению предпочтительно поставляются в дозированной лекарственной форме. В используемом в данном описании смысле «дозированная лекарственная форма» представляет собой композицию согласно данному изобретению, содержащую количество пептида формулы (I), которое подходит для введения животному, предпочтительно млекопитающему, более предпочтительно человеку в однократной дозе в соответствии с положительной медицинской практикой. Указанные композиции предпочтительно содержат примерно от 0,1 мг (миллиграмма) до 1000 мг, более предпочтительно примерно от 0,5 мг до 500 мг, более предпочтительно примерно от 1 мг до 30 мг пептида формулы (I). Композиции согласно данному изобретению могут иметь любую из множества форм, подходящих, например, для перорального, ректального, местного, назального, глазного или парентерального введения. В зависимости от конкретного требуемого пути введения можно использовать множество фармацевтически приемлемых носителей, хорошо известных в данной области. Указанные носители включают твердые или жидкие наполнители, разбавители, гидротропные вещества, поверхностно-активные вещества и инкапсулирующие вещества. Необязательно могут быть включены фармацевтически активные продукты, которые по существу не препятствуют агонистической активности пептидов формулы (I) по отношению к CRF2R. Количество носителя, используемого вместе с пептидом формулы (I), является достаточным, чтобы обеспечить рациональное количество продукта для введения на единицу дозы пептида формулы (I). Способы и композиции для получения дозированных форм, применимые в способах согласно данному изобретению, описаны в следующих публикациях: Modern Pharmaceutics, Chapters 9 and 10 (Banker & Rhodes, editors, 1979); Lieberman et al., Pharmaceutical Dosage Forms: Tablets (1981); и Ansel, Introduction to Pharmaceutical Dosage Forms 2d Edition (1976). Можно использовать различные пероральные дозированные формы, включая такие твердые формы, как таблетки, капсулы, гранулы и нерасфасованные порошки. Указанные пероральные формы содержат безопасное и эффективное количество пептида, обычно, по меньшей мере, примерно 5% и предпочтительно примерно от 25% до 50%. Таблетки могут быть прессованные, растертые в порошок таблетки, с энтеросолюбильным покрытием, покрытые сахаром, покрытые пленкой или сложные прессованные таблетки, содержащие подходящие связывающие вещества, скользящие вещества, разбавители, дезинтегрирующие агенты, красители, корригенты, агенты, индуцирующие прохождение, и агенты плавления. Жидкие пероральные дозированные формы включают водные растворы, эмульсии, суспензии, растворы и/или суспензии, перерастворяемые из нешипучих гранул, и шипучие препараты, перерастворяемые из шипучих гранул, и содержащие подходящие растворители, консерванты, эмульгаторы, суспендирующие агенты, разбавители, подсластители, агенты плавления, красители и корригенты. Фармацевтически приемлемые носители, подходящие для получения дозированных лекарственных форм для перорального введения, хорошо известны в данной области. Таблетки обычно содержат в качестве инертных разбавителей обычные фармацевтически совместимые адъюванты, такие как карбонат кальция, карбонат натрия, маннит, лактозу и целлюлозу; связывающие вещества, такие как крахмал, желатин и сахароза; дезинтегрирующие агенты, такие как крахмал, альгиновая кислота и кроскармелоза; смазывающие вещества, такие как стеарат магния, стеариновая кислота и тальк. Скользящие вещества, такие как диоксид кремния, можно использовать для того, чтобы улучшить характеристики прохождения порошковой смеси. Для внешнего вида можно добавлять красители, такие как красители FD&C. Подсластители и корригенты, такие как аспартам, сахарин, ментол, мята и фруктовые корригенты, применимы в качестве адъювантов для жевательных таблеток. Капсулы обычно содержат один или несколько твердых разбавителей, описанных выше. Подбор компонентов носителя зависит от вторичных критериев, подобных вкусу, стоимости и сроку хранения, которые не являются критически важными в целях данного изобретения и легко могут быть осуществлены специалистом в данной области. В общем, препарат будет содержать пептид и инертные ингредиенты, которые обеспечивают защиту от среды в желудке и высвобождение биологически активного продукта в кишечнике. Пептид формулы (I) можно химически модифицировать так, чтобы пероральная доставка производного была эффективной. В общем, предполагаемая химическая модификация заключается в связывании, по меньшей мере, одной составляющей с самой молекулой белка, при этом указанная составляющая обеспечивает (a) ингибирование протеолиза; и (b) всасывание в поток крови из желудка или кишечника. Также желательно увеличение общей стабильности белка и увеличение времени циркуляции в организме. Примеры таких составляющих включают: полиэтиленгликоль, сополимеры этиленгликоля и пропиленгликоля, карбоксиметилцеллюлозу, декстран, поливиниловый спирт, поливинилпирролидон и полипропилен. Newmark et al., J. Appl. Biochem., 4: 185-189 (1982). Другими полимерами, которые можно использовать, являются поли-1,3-диоксолан и поли-1,3,6-тиоксокан. Предпочтительными для фармацевтического применения, указанного выше, являются составляющие полиэтиленгликоля. Местом высвобождения может быть желудок, тонкий кишечник (двенадцатиперстная кишка, тощая кишка или подвздошная кишка) или толстый кишечник. Специалист в данной области имеет в распоряжении составы, которые не будут растворяться в желудке, однако будут высвобождать материал в двенадцатиперстной кишке или в другом месте кишечника. Предпочтительно на высвобождение не будет оказываться вредное воздействие среды в желудке за счет защиты пептида (или варианта) или высвобождения биологически активного материала вне среды желудка, а именно в кишечнике. Чтобы обеспечить полную устойчивость в желудке предпочтительно покрытие, непроницаемое, по меньшей мере, при pH 5,0. Примерами наиболее распространенных инертных ингредиентов, которые применяют в качестве энтеросолюбильных покрытий, являются тримеллитат ацетата целлюлозы (CAT), фталат гидроксипропилметилцеллюлозы (HPMCP), HPMCP 50, HPMCP 55, фталат поливинилацетата (PVAP), эудражит L30D, Aquateric, фталат ацетат целлюлозы (CAP), эудражит L, эудражит S и шеллак. Указанные покрытия можно использовать в качестве смешанных пленок. К пероральным композициям также относятся жидкие растворы, эмульсии, суспензии и тому подобное. Фармацевтически приемлемые носители, подходящие для получения таких композиций, хорошо известны в данной области. Обычные компоненты носителей для сиропов, эликсиров, эмульсий и суспензий включают этанол, глицерин, пропиленгликоль, полиэтиленгликоль, жидкую сахарозу, сорбит и воду. В случае суспензий обычные суспендирующие агенты включают метилцеллюлозу, натрий-карбоксиметилцеллюлозу, Avicel® RC-591, трагакантовую камедь и альгинат натрия; типичные увлажнители включают лецитин и полисорбат 80; и обычные консерванты включают метилпарабен и бензоат натрия. Пероральные жидкие композиции также могут содержать один или несколько таких компонентов, как подсластители, корригенты и красители, обсуждавшиеся выше. Композиции согласно данному изобретению необязательно могут содержать другие активные агенты. Неограничивающие примеры активных агентов перечислены в WO 99/15210. Другие композиции, применимые для достижения системной доставки данных соединений, включают подъязычные, буккальные формы, формы суппозиторий, назальные и легочные дозированные формы. Такие композиции обычно содержат один или несколько растворимых веществ-наполнителей, таких как сахароза, сорбит и маннит; и связывающие вещества, такие как аравийская камедь, микрокристаллическая целлюлоза, карбоксиметилцеллюлоза и гидроксипропилметилцеллюлоза. Также могут быть включены скользящие вещества, смазывающие вещества, подсластители, красители, антиоксиданты и корригенты, описанные выше. Композиции согласно данному изобретению также можно вводить субъекту местно, например, прямым нанесением или намазыванием композиции на эпидермальную или эпителиальную ткань субъекта или трансдермально с помощью «пластыря». Пример подходящего аппликатора-пластыря описан в заявке на выдачу патента США с регистрационным No. 10/054113. Такие композиции включают, например, примочки, кремы, растворы, гели и твердые вещества. Указанные местные композиции предпочтительно содержат безопасное и эффективное количество, обычно, по меньшей мере, примерно 0,1% и предпочтительно примерно от 1% до 5% пептида. Подходящие носители для местного введения предпочтительно сохраняются на коже в виде сплошной пленки и устойчивы к удалению с потом или при погружении в воду. Обычно носитель имеет органическую природу и в нем может быть диспергирован или растворен пептид. Носитель может содержать фармацевтически приемлемые смягчители, эмульгаторы, загустители, растворители и тому подобное. Способы введения Данное изобретение также относится к способам лечения модулируемых CRF2R расстройств у человека или другого субъекта животного путем введения безопасного и эффективного количества пептида указанному субъекту. Способы согласно изобретению применимы для профилактики или лечения расстройств, описанных выше. Композиции согласно данному изобретению можно вводить местно или системно. Системное применение включает способы введения пептида формулы (I) в ткани организма, например внутрь суставов (особенно при лечении ревматоидного артрита), интратекальное, эпидуральное, внутримышечное, трансдермальное, внутривенное, внутрибрюшинное, подкожное, назальное, легочное, подъязычное, ректальное и пероральное введение. Конкретная доза пептида, который необходимо ввести, а также продолжительность лечения и то, является ли лечение местным или системным, зависят друг от друга. Доза и схема лечения также будут зависеть от таких факторов, как конкретный используемый пептид, показание к лечению, способность пептида достигать минимальных ингибирующих концентраций в месте ткани, которое необходимо обработать, персональные характеристики субъекта (такие как вес), соответствие схеме лечения и наличие и тяжесть каких-либо побочных эффектов лечения. Топическое введение можно использовать для доставки пептида системно или для лечения субъекта местно. Количество пептида для топического введения зависит от таких факторов, как чувствительность кожи, тип и положение ткани, подвергаемой лечению, композиции и носителя (если он имеется), которые необходимо вводить, конкретного вводимого пептида, а также конкретного подвергаемого лечению расстройства и степени требуемых системных (которые отличны от местных) эффектов. Пептиды согласно данному изобретению могут быть направлены к конкретным местам-мишеням, где необходимо лечение, с использованием направляющих к мишени лигандов. Например, для того чтобы направить пептид на лечение мышечной дистрофии, пептид конъюгируют с антителом или его фрагментом, который иммунореактивен по отношению к маркеру скелетной мышцы, который обычно известен в данной области. Направляющим к мишени лигандом также может быть лиганд, подходящий для рецептора, который присутствует на скелетной мышце. Можно использовать любой направляющий к мишени лиганд, который специфично взаимодействует с маркером предназначенной в качестве мишени ткани. Способы связывания соединения согласно изобретению с направляющим к мишени лигандом хорошо известны и сходны со способами, описанными ниже для связывания с носителем. Пептид формулы (I) можно вводить посредством контролируемого высвобождения. Например, пептид можно вводить, используя внутривенную инфузию, имплантируемый осмотический насос, трансдермальный пластырь, липосомы, подкожную депонируемую инъекцию, содержащую биодеградируемый материал, или другие способы введения. В одном варианте можно использовать насос. Langer et al., eds., Medical Applications of Controlled Release, CRC Pres., Boca Raton, Fla. (1974); Sefton, CRC Crit. Ref. Biomed. Eng., 14: 201 (1987); Buchwald et al., Surgery, 88: 507 (1980); Saudek et al., N. Engl. J. Med., 321: 574 (1989). В другом варианте можно использовать полимерные материалы. Langer, 1974, выше; Sefton, 1987, выше; Smolen et al., eds., Controlled Drug Bioavailability, Drug Product Design and Performance, Wiley, N. Y. (1984); Ranger et al., J. Macromol. Sci. Rev. Macromol. Chem., 23: 61 (1983); смотри также Levy et al., Science, 228: 190 (1985); During et al., Ann. Neurol., 25: 351 (1989); Howard et al., J. Neurosurg., 71: 105 (1989). В еще одном варианте система контролируемого высвобождения может быть помещена вблизи терапевтической мишени, при этом требуется только часть системной дозы. Смотри, например, Goodson, в Medical Applications of Controlled Release, vol. 2, pp. 115-138 (1984). В еще одном варианте используют основанную на полимерах систему доставки лекарственного средства, в которой лекарственные средства доставляются из полимера или липидных систем. Указанные системы доставляют лекарственное средства тремя общими механизмами: (1) диффузия вида лекарственного средства из системы или через нее; (2) химическая или ферментативная реакция, приводящая к деградации системы, или отщепление лекарственного средства от системы; и (3) активация растворителя либо посредством осмоса, либо набухания системы. Подходящие системы описаны в обзорных статьях: Langer, Robert, «Drug delivery and targeting», Nature: 392 (Supp): 5-10 (1996); Kumar, Majeti N. V., «Nano and Microparticles as Controlled Drug Delivery Devices», J. Pharm. Pharmaceut. Sci., 3 (2): 234-258 (2000); Brannon-Peppas, «Polymers in Controlled Drug Delivery», Medical Plastics and Biomaterials, (Nov. 1997). Смотри также Langer, 1990, выше; Treat et al., в Liposomes in the Therapy of Infectious Disease and Cancer, Lopez-Berestein and Fidler (eds.), Liss, New York, pp. 353-365 (1989); Langer, Science, 249: 1527-1533 (1990). Подходящие системы могут содержать: систему доставки лекарственного средства AtrigelTM из Atrix Labs; DepoFoamTM из SkyPharma; основанные на полиэтиленгликоле гидрогели из Infimed Therapeutics, Inc.; солюбилизирующие системы доставки лекарственного средства ReGelTM, SQZGelTM пероральную, HySolvTM и ReSolvTM из MacroMed; ProGelzTM из ProGelz’ Products; и инъекционную ProLeaseTM из Alkermes. Конечно, во всех вышеуказанных случаях пептиды согласно изобретению можно вводить отдельно или в виде смесей, и композиции, кроме того, могут содержать дополнительные лекарственные средства или эксципиенты, которые соответствуют показанию. Генная терапия Можно использовать экспрессирующие векторы для введения нуклеиновых кислот согласно изобретению в клетку как часть генной терапии. Такие векторы обычно имеют подходящие сайты рестрикции, расположенные вблизи последовательности промотора, чтобы обеспечить инсерцию последовательностей нуклеиновых кислот. Могут быть получены транскрипционные кассеты, содержащие область инициации транскрипции, ген-мишень или его фрагмент и область терминации транскрипции. Транскрипционные кассеты можно ввести во множество векторов, например, плазмиду, ретровирус, лентивирус, аденовирус и тому подобное, поскольку векторы способны временно или стабильно сохраняться в клетках, обычно в течение периода времени, составляющего, по меньшей мере, один день, более обычно в течение периода времени, составляющего, по меньшей мере, от нескольких дней до нескольких недель. Белки и нуклеиновые кислоты согласно изобретению можно вводить в ткани или клетки-хозяева любым из ряда способов, включая вирусную инфекцию, микроинъекцию или слияние везикул. Также можно использовать безыгольную инъекцию для внутримышечного введения, как описано Furth et al., Anal. Biochem., 205: 365-368 (1992). Можно покрыть микрочастицы золота ДНК и доставить интрадермально с помощью устройства для бомбардировки частицами или «генной пушки», как описано в литературе. Смотри, например, Tang et al., Nature 356: 152-154 (1992), где микрочастицы золота покрывают ДНК, затем бомбардируют в клетки кожи. Наборы В объем данного изобретения входит набор для профилактики или лечения модулируемого CRF2R расстройства, содержащий: (a) пептид формулы (I) в дозированной лекарственной форме; и (b) инструкции по применению. Такой набор предпочтительно содержит некоторое количество единиц дозирования. Такие наборы могут содержать плату с дозами, расположенными в порядке их предписанного применения. Например, такой набор может представлять собой «блистерную упаковку». Блистерные упаковки хорошо известны в тароупаковочном производстве и широко используются для упаковки фармацевтических дозированных лекарственных форм. При желании может быть предоставлено средство для памяти, например, в форме цифр, букв или других меток или с календарной вставкой, где обозначены дни в схеме лечения, в которые можно вводить дозы. Пример набора описан в WO 01/45636. Схемы лечения находятся в компетенции специалистов в области медицины. Неограничивающие примеры включают прием один раз ежедневно, еженедельно, раз в две недели, ежемесячно или один раз в два месяца. ПРИМЕРЫ Пример 1 Саувагин и другие неизбирательные агонисты CRFR обычно неэффективны при лечении модулируемых CRF2R расстройств, так как указанные агонисты также активируют CRF1R, тем самым приводя к нежелательным побочным эффектам. В таблице 2 изображено сравнительное связывание CRF для фрагментов нативной последовательности урокортина I человека (hUcnI), урокортина II человека (hUroII), урокортина III человека (hUroIII), кортикотропин-рилизинг фактора человека (hCRF), кортикотропина овцы (oCRF) и саувагина (Svg), обозначенные в виде SEQ ID NO: 2, 4, 6, 8, 10 и 11 соответственно.
Пример 2 В таблице 3 изображено сравнительное связывание CRF для различных вариантов изобретения.
Пример 3 Повышенная эффективность in vivo Пептиды согласно данному изобретению демонстрируют повышенную биологическую доступность, особенно в условиях низких доз, по сравнению с известными нативными последовательностями, например фрагментом пептида UroII (SEQ ID NO: 4). Время полужизни пептида у субъекта можно определить, например, с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ) образцов сыворотки, собранной у субъекта в различных временных точках после введения пептида. Специалисту в данной области будет известно, как выбрать подходящие буферы для элюирования для ВЭЖХ на основе физико-химических свойств конкретного пептида. Неограничивающий пример исследования in vivo для определения эффективности приведен в данном описании. Мышам вводят дозу пептида формулы (I) внутривенным (в/в) (1000 мкг/кг) и подкожным (п/к) (1000 мкг/кг) путями. В различных временных точках после введения дозы (в/в = 0, 2, 10, 30 мин и 1, 2, 4 и 6 ч; и п/к = 0; 0,25; 0,5; 1; 2; 4 и 6 ч) получают образцы крови в микроцентрифужных пробирках, содержащих натрий-гепарин. Затем образцы крови обрабатывают, чтобы получить плазму, которую хранят при -70°C до проведения анализа. Получают стандарты плазмы. В день анализа готовят инъекционный раствор пептида формулы (I) в диапазоне концентраций от 50 нг/мл до 100 мкг/мл в метаноле путем серийного разведения предварительно приготовленного исходного метанольного раствора пептида формулы (I) в концентрации 1 мг/мл. Подобным образом в день анализа готовят инъекционный раствор внутреннего стандарта (ISTD), меченного стабильным изотопом h-Unc-II, путем серийного разведения хранившегося исходного раствора 1 мг/мл ISTD, чтобы получить конечную концентрацию 5 мкг/мл. Готовят рабочие стандарты плазмы в диапазоне массы от 0,5 до 100 нг, добавляя 10 мкл инъекционного раствора соответствующего пептида формулы (I) в пробирки, уже содержащие 10 мкл 5 мкг/мл раствора ISTD, 100 мкл дд-воды и 100 мкл контрольной плазмы крыс. Рабочие стандарты готовят для анализа, как описано ниже. Готовят образцы для контроля качества (QC). Исходный QC-раствор готовят на уровне концентрации 50 нг/мл добавлением 25 мкл инъекционного раствора пептида формулы (I) с концентрацией 1 мкг/мл в 475 мкл контрольной гепаринизированной плазмы крыс, находящейся в пластиковом флаконе. Рабочие QC-образцы готовят добавлением 100 мкл исходного QC-раствора (50 нг/мл) в пробирки, уже содержащие 10 мкл раствора ISTD с концентрацией 5 мкг/мл и 100 мкл дд-воды. Рабочий QC-образец готовят для анализа, как описано ниже. Готовят исследуемые образцы. В день анализа образцы размораживают при комнатной температуре и аликвоту образца добавляют в пробирку, уже содержащую 10 мкл 5 мкг/мл-раствора ISTD, 100 мкл дд-воды и аликвоту контрольной гепаринизированной плазмы крыс. Объем образца и контрольной плазмы крыс таков, что общий объем плазмы равен 100 мкл. Рабочие стандарты, рабочие QC-образцы и исследуемые образцы готовят для анализа добавлением 400 мкл ацетонитрила в пробирки, каждая из которых содержит указанные образцы, закрывают, встряхивают, центрифугируют и выделяют надосадок. Аликвоту (300 мкл) надосадка сушат в атмосфере N2 и перерастворяют в 50 мкл смеси метанол/воды (50/50). Приготовленные рабочие стандарты, рабочие QC-образцы и исследуемые образцы анализируют разделением с помощью градиентной обращенно-фазовой высокоэффективной жидкостной хроматографией (ОФ-ВЭЖХ) с последующим проведением ионизации образца электрораспылением (ESI) с детекцией посредством масс-спектроскопии/масс-спектроскопии (МС/МС), используя избирательный мониторинг реакции (SRM) в режиме положительных ионов. В случае h-Unc-II и ISTD контролируют SRM-канал. Растворы доз из фармакокинетического исследования разбавляют метанолом и анализируют с помощью ОФ-ВЭЖХ с регистрацией в ультрафиолете. Концентрации пептида формулы (I) в растворах доз рассчитывают путем интерполяции кривой линейной регрессии, полученной на основе известных стандартов. Хотя проиллюстрированы и описаны конкретные варианты данного изобретения, специалистам в данной области будет понятно, что могут быть осуществлены различные изменения и модификации, не отходя от сути и не выходя за рамки объема изобретения. Следовательно, подразумевается, что прилагаемая формула изобретения охватывает все такие изменения и модификации, которые входят в объем данного изобретения.
Формула изобретения
1. Ненативный пептид, обладающий активностью агониста рецептора кортикотропин-рилизинг фактора 2 (CRF2R), по существу соответствующий аминокислотной последовательности ZGPPISIDLPX11X12LLRKX17IEIEKQEKEKQQAX31X32NAX35X36LX38X39X40 где X11 выбран из F, Y, L, I и Т; X12 выбран из Q, W и Y; X17 выбран из V и М; Х31 выбран из Т и А; X32 выбран из N и Т; Х35 выбран из R и L; X36 выбран из L и I; Х38 выбран из D и А; Х39 выбран из Т и R; Х40 выбран из I и V; или его варианты с консервативными заменами аминокислот, имеющие аминокислотную последовательность, идентичную по меньшей мере на 95% указанной аминокислотной последовательности ненативного пептида и которые при этом сохраняют активность агониста CRF2R. 2. Пептид по п.1, где X11 выбран из F, L, Т и Y. 3. Пептид по п.1, где X11X12 выбраны из группы, включающей из FQ, YQ, YW, LQ, LY, IY и TY. 4. Пептид по п.1, где X31X32 выбраны из группы, включающей из AN и ТТ. 5. Пептид по п.1, где X35Х36 выбраны из группы, включающей из RL, LL и RI. 6. Пептид по п.1, где X38Х39Х40 выбраны из группы, включающей из DTI, ARI, ATI, DRV и ARV. 7. Пептид по п.3, где Х31Х32 выбраны из группы, включающей из AN и ТТ. 8. Пептид по п.3, где X35X36 выбраны из группы, включающей из RL, LL и RI. 9. Пептид по п.3, где X38Х39Х40 выбраны из группы, включающей из DTI, ARI, ATI, DRV и ARV. 10. Пептид по п.4, где Х35Х36 выбраны из группы, включающей из RL, LL и RI. 11. Пептид по п.4, где Х38Х39Х40 выбраны из группы, включающей из DTI, ARI, ATI, DRV и ARV. 12. Пептид по п.5, где Х38Х39Х40 выбраны из группы, включающей из DTI, ARI, ATI, DRV и ARV. 13. Пептид по п.7, где X35Х36 выбраны из группы, включающей из RL, LL и RI. 14. Пептид по п.7, где Х38Х39Х40 выбраны из группы, включающей из DTI, ARI, ATI, DRV и ARV. 15. Пептид по п.10, где Х38Х39Х40 выбраны из группы, включающей из DTI, ARI, ATI, DRV и ARV. 16. Пептид по п.1, выбранный из группы, включающей из SEQ ID NO: 22, 144, 148, 149, 151, 278, 279, 286, 288, 311, 349, 350, 351, 352 и 353. 17. Пептид, обладающий активностью агониста рецептора кортикотропин-рилизинг фактора 2 (CRF2R), соответствующий аминокислотной последовательности SEQ ID NO: 278. 18. Применение пептида по любому из пп.1-16 в соответствии с инструкцией по применению в способе для лечения заболевания, модулируемого CRF2R, у хозяина. 19. Применение пептида по любому из пп.1-16 для профилактики или лечения заболевания, модулируемого CRF2R. 20. Применение пептида по п.17 в соответствии с инструкцией по применению в способе для профилактики или лечения заболевания, модулируемого CRF2R, у хозяина. 21. Применение пептида по п.17 для профилактики или лечения заболевания, модулируемого CRF2R. 22. Выделенная нуклеиновая кислота, кодирующая пептид, обладающий активностью агониста CRF2R и характеризующаяся нуклеотидной последовательностью, которая определяет аминокислотную последовательность пептида по п.1. 23. Антитело, которое является специфичным в отношении пептида, обладающего активностью агониста CRF2R, и которое получают с помощью пептида по п.1. 24. Фармацевтическая композиция для профилактики или лечения заболевания, модулируемого CRF2R, содержащая а) безопасное и эффективное количество пептида по п.1; b) фармацевтически приемлемый носитель. 25. Фармацевтическая композиция для профилактики или лечения заболевания, модулируемого CRF2R, содержащая а) безопасное и эффективное количество пептида по п.17; b) фармацевтически приемлемый носитель.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

 s-активации аденилатциклазы. Аденилатциклаза катализирует образование цАМФ, который в свою очередь оказывает множественные действия, включая активацию протеинкиназы А, внутриклеточное высвобождение кальция и активацию активируемой митогенами протеинкиназы (МАР-киназы). Показанное в других исследованиях усиление синтеза внутриклеточного инозитолтрифосфата после активации агонистами рецепторов CRF свидетельствует о том, что CRFR также связаны с G
s-активации аденилатциклазы. Аденилатциклаза катализирует образование цАМФ, который в свою очередь оказывает множественные действия, включая активацию протеинкиназы А, внутриклеточное высвобождение кальция и активацию активируемой митогенами протеинкиназы (МАР-киназы). Показанное в других исследованиях усиление синтеза внутриклеточного инозитолтрифосфата после активации агонистами рецепторов CRF свидетельствует о том, что CRFR также связаны с G -саркогликана и
-саркогликана и  -саркогликана; лице-лопаточно-плечевую мышечную дистрофию (Ландузи-Дежерина), миотоническую дистрофию и мышечную дистрофию Эмери-Дрейфусса. Симптомы мышечной дистрофии Дюшенна, которая возникает почти исключительно у мужчин, включают утиную походку, хождение на цыпочках, лордоз, частые падениях и трудности при вставании и поднимании по лестнице. Симптомы начинаются примерно в 3-7-летнем возрасте, при этом большинство пациентов к 10-12 годам прикованы к инвалидной коляске и многие умирают примерно в 20-летнем возрасте вследствие респираторных осложнений. Современное лечение мышечной дистрофии Дюшенна заключается во введении преднизона (кортикостероидного лекарственного средства), которое хотя и не излечивает, но замедляет снижение мышечной силы и отсрочивает наступление нетрудоспособности. Полагают, что кортикостероиды, такие как преднизон, действуют путем блокирования активации иммунных клеток и инфильтрации, которые ускоряются при повреждении мышечных волокон, возникающем в результате заболевания. К сожалению, лечение кортикостероидами также приводит к атрофии скелетных мышц, что сводит на нет некоторую вероятную пользу блокирования иммунного ответа у данных пациентов. Таким образом, продолжает существовать необходимость в идентификации терапевтических средств, которые замедляют повреждение мышечных волокон и отсрочивают наступление нетрудоспособности у пациентов с мышечными дистрофиями, но в меньшей степени вызывают атрофию скелетных мышц, чем современные способы лечения.
-саркогликана; лице-лопаточно-плечевую мышечную дистрофию (Ландузи-Дежерина), миотоническую дистрофию и мышечную дистрофию Эмери-Дрейфусса. Симптомы мышечной дистрофии Дюшенна, которая возникает почти исключительно у мужчин, включают утиную походку, хождение на цыпочках, лордоз, частые падениях и трудности при вставании и поднимании по лестнице. Симптомы начинаются примерно в 3-7-летнем возрасте, при этом большинство пациентов к 10-12 годам прикованы к инвалидной коляске и многие умирают примерно в 20-летнем возрасте вследствие респираторных осложнений. Современное лечение мышечной дистрофии Дюшенна заключается во введении преднизона (кортикостероидного лекарственного средства), которое хотя и не излечивает, но замедляет снижение мышечной силы и отсрочивает наступление нетрудоспособности. Полагают, что кортикостероиды, такие как преднизон, действуют путем блокирования активации иммунных клеток и инфильтрации, которые ускоряются при повреждении мышечных волокон, возникающем в результате заболевания. К сожалению, лечение кортикостероидами также приводит к атрофии скелетных мышц, что сводит на нет некоторую вероятную пользу блокирования иммунного ответа у данных пациентов. Таким образом, продолжает существовать необходимость в идентификации терапевтических средств, которые замедляют повреждение мышечных волокон и отсрочивают наступление нетрудоспособности у пациентов с мышечными дистрофиями, но в меньшей степени вызывают атрофию скелетных мышц, чем современные способы лечения.