|
|
(21), (22) Заявка: 2005126992/14, 26.08.2005
(24) Дата начала отсчета срока действия патента:
26.08.2005
(43) Дата публикации заявки: 10.03.2007
(46) Опубликовано: 27.08.2007
(56) Список документов, цитированных в отчете о
поиске:
Адрес для переписки:
603005, г.Нижний Новгород, ул. Алексеевская, 1, НижГМА, патентно-лицензионный отдел
|
(72) Автор(ы):
Слугарев Виктор Владимирович (RU),
Пахомов Сергей Романович (RU),
Терентьев Игорь Георгиевич (RU)
(73) Патентообладатель(и):
Государственное образовательное учреждение высшего профессионального образования “Нижегородская государственная медицинская академия Федерального агентства по здравоохранению и социальному развитию” (ГОУ ВПО “НижГМА Росздрава”) (RU)
|
(54) СПОСОБ КОМБИНИРОВАННОГО ЛЕЧЕНИЯ ОПЕРАБЕЛЬНОГО РАКА ЖЕЛУДКА
(57) Реферат:
Изобретение относится к медицине, а именно к онкологии, и может быть использовано для комбинированного лечения операбельного рака желудка. Для этого на фоне предоперационного облучения в качестве радиомодификатора больному вводят капецитабин в дозе 1650 мг/м2, разделенной на 2 приема: за 2 часа до облучения и через 12 часов после облучения. Способ позволяет предотвратить возникновение локального рецидива и увеличить выживаемость после радикальной операции за счет увеличения лучевого повреждения опухоли при применении радиомодификатора с селективным действием и минимальными побочными проявлениями. 2 ил., 9 табл.
(56) (продолжение):
Предлагаемое изобретение относится к области медицины, а именно к онкологии, и может быть применимо в комбинированном лечении операбельного рака желудка при проведении лучевой терапии.
Во всем мире рак желудка по распространенности занимает II место. Наша страна занимает 4 место в мире по данному показателю. Ежегодно регистрируется 48,8 тыс. новых случаев рака желудка, 45,0 тыс. человек умирает от данного заболевания, у 42,6% больных выявляется IV стадия, а одногодичная летальность приближается к 56%. Отдаленные результаты лечения рака желудка остаются неудовлетворительными. Показатели 5-летней выживаемости больных после радикальной операции составляют 20-35% (Чиссов В.И., Стравинский В.В. Петрова Г.В. Злокачественные новообразования в России в 2001 году (заболеваемость и смертность). – М., 2003. – 263 с.).
В России больные с I-II стадиями заболевания составляют 10-15%. Программа скрининговой диагностики раннего рака желудка не работает ни в одной стране мира, кроме Японии, в связи с чем признано более перспективным направление усилий на лечение распространенных форм заболевания, так как они составляют подавляющую долю впервые выявленных случаев.
Не найдено схем химиотерапии, изолированное использование которых в послеоперационном периоде при комбинированном лечении рака желудка улучшает отдаленные результаты.
Учитывая высокую радиорезистентность злокачественных новообразований желудка, на сегодняшний день проводится поиск новых схем фракционирования дозы облучения и использование различных радиомодификаторов на фоне облучения.
Авторами данного изобретения при изучении степени лучевого повреждения опухоли при комбинированном лечении рака желудка с использованием предоперационного облучения по схеме динамического фракционирования дозы получены схожие результаты (табл.8).
Известен способ комбинированного лечения рака желудка с использованием предоперационной лучевой терапии по интенсивно-концентрированной схеме фракционирования (разовая доза облучения 4 Гр, суммарная очаговая доза 20 Гр, операция выполняется на 4-7 день после окончания курса) с применением метранидазола в дозе 4-6 мг/м2
Гипоксирадиотерапия является технически сложной и малодоступной процедурой, кроме того, временная гипоксия у больного на фоне облучения ограничивает применимость данного метода.
За прототип предлагаемого изобретения выбран известный способ комбинированного лечения операбельного рака желудка, включающий предоперационное облучение дробными фракциями в СОД 45 Гр, РОД 1,8 Гр с применением радиомодификатора 5-фторурацила (5-FU), в дозе 425 мг/м2 совместно с лейковарином в дозе 20 мг/м2
Эффективность данной схемы химиолучевой терапии изучалась в многоцентровом исследовании Intergroup-0116. При данном методе комбинированного лечения рака желудка 3-летняя выживаемость достигла 48%, тогда как при хирургическом лечении данный показатель составил 31%.
Вместе с тем был выявлен ряд существенных недостатков данного метода лечения. У большинства больных на фоне курса облучения встречались лучевые реакции II-III степени, в связи с чем у 17% пациентов курс комбинированного лечения полностью завершить не удалось. Встречались случаи смерти больных от осложнений химиолучевой терапии.
Задачей предлагаемого изобретения является увеличение лучевого повреждения опухоли при комбинированном лечении операбельного рака желудка без существенного возрастания частоты осложнений лечения, что позволяет предотвратить возникновение локального рецидива опухоли и тем самым увеличить результаты выживаемости.
Поставленная задача решается за счет того, что в предоперационном периоде больные проходят курс лучевой терапии по схеме динамического фракционирования дозы (облучение в суточной дозе 4 Гр с дневным дроблением в течение первых 3 дней курса и далее продолжают в суточной дозе 2 Гр с дневным дроблением в течение 9 дней, операция через 2 недели после окончания курса лучевой терапии) с использованием в качестве радиомодификатора капецитабина в дозе 1650 мг/м2 разделенной на 2 приема за 2 часа до облучения и через 12 часов после облучения.
Предлагаемое изобретение отвечает критерию “новизна” и критерию “изобретательский уровень”.
Авторами данного изобретения впервые предлагается использовать капецитабин в комбинированном лечении рака желудка в качестве радиомодификатора лучевой терапии по схеме динамического фракционирования дозы, что позволяет увеличить степень лучевого повреждения опухоли и не оказывает существенного влияния на частоту лучевых осложнений на фоне курса облучения в связи с селективностью действия препарата. Также впервые проведен анализ результатов клинического применения капецитабина как радиомодификатора в комбинированном лечении рака желудка, изучены морфологические проявления лучевого повреждения опухоли на фоне облучения.
Данное изобретение позволяет получить следующий положительный эффект:
– Увеличить лучевое повреждение опухоли и повысить абластичность операции за счет увеличения лучевого повреждения субклинических метастазов в зоне облучения, что предотвращает возникновение локального рецидива и приводит к улучшению выживаемости.
– Значительно улучшить переносимость курса облучения за счет снижения частоты и тяжести лучевых реакций и минимальных проявлений побочного действия химпрепарата капецитабина.
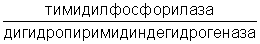
Особенности ферментативного статуса злокачественных новообразований желудка делают перспективным применение данного препарата в комбинированном лечении рака желудка на фоне предоперационного курса облучения по схеме динамического фракционирования дозы в качестве радиомодификатора для увеличения лучевого повреждения опухоли. При комбинированном лечении рака желудка в качестве радиомодификатора данный препарат ранее не использовался.
2
– Кровотечение или его угроза по данным ФГДС.
– Угроза перфорации опухоли по данным ФГДС.
– Стеноз выходного отдела.
– Кахексия II и выше.
– Выраженная сопутствующая патология (сердечно-сосудистая недостаточность II-III, дыхательная недостаточность II-III, печеночная или почечная недостаточность, низкая эффективность медикаментозного лечения сопутствующих заболеваний).
– Признаки неоперабельности процесса.
Проведено сравнение полученных результатов с аналогичными показателями при проведении предоперационного облучения по схеме динамического фракционирования дозы без использования радиомодификатора у 20 больных и при только хирургическом лечении у 48 больных.
Все больные проходили лечение на базе Нижегородского Областного Онкологического Диспансера с 2001 по 2005 годы. Группы больных отбирались случайным методом и были сопоставимы по полу, возрасту, характеру сопутствующей патологии, распространенности процесса и объему операции. Средний возраст пациентов составил 60 лет, преобладали лица мужского пола. У более чем 80% больных имелась та или иная хроническая сопутствующая патология.
Распределение больных по стадиям заболевания в соответствии с правилами международной классификации опухолей (2001 г.) представлено в табл.1. У всех пациентов преобладали распространенные формы заболевания (III-IV). Субтотальное и тотальное поражение желудка встречалось почти у трети всех больных. При гистологическом исследовании низко- и недифференцированная форма новообразования встречалась у 84% пациентов при комбинированном и у 54,1% при хирургическом лечении.
Таблица 1
Стадия заболевания. |
| Стадия заболевания |
Количество больных |
| Комбинированное лечение |
Хирургическое лечение |
| СДФ+капецитабин |
СДФ |
| II |
4 (13,3%) |
2 (10%) |
12 (25%) |
| IIIa |
14 (46,7%) |
10 (50%) |
18 (37,5%) |
| IIIb |
3 (10%) |
2 (10%) |
5 (10,4%) |
| IV |
9 (30%) |
6 (30%) |
13 (27,1%) |
Несмотря на широкий объем хирургического вмешательства по поводу удаления опухоли (табл.2) в 19 (38%) случаев при комбинированном и 20 (42%) – при хирургическом лечении, операция носила условно-радикальный характер (т.е. имелись метастазы в последнем полностью удаленном этапе лимфогенного метастазирования), что связано со значительной распространенность опухолевого процесса. В половине случаев при IV стадии заболевания опухоль удалось полностью удалить, причем у 2 пациентов при комбинированном и у 2 – при хирургическом лечении была выполнена атипичная резекция печени по поводу солитарных метастазов.
Таблица 2
Объем оперативного вмешательства |
| Объем операции |
Количество больных |
| Комбинированное лечение |
Хирургическое лечение |
| СДФ+капецитабин |
СДФ |
| Радикальная операция |
27 (90%) |
16 (80%) |
40 (83,3%) |
| Расширенная операция |
22 (81,5%) |
12 (75%) |
30 (75%) |
| Комбинированная операция |
17 (56,7%) |
9 (45%) |
24 (50%) |
| Пробные/симптоматические операции |
3 (10%) |
4 (20%) |
8 (16,7%) |
Для выяснения влияния капецитабина на переносимость комбинированного лечения, нами проведено сравнение осложнений на фоне курса предоперационной лучевой терапии по схеме динамического фракционирования дозы с использованием данного радиомодификатора в суточной дозе 1650 мг/м2 у 30 больных с характером осложнений на фоне курса облучения по той же схеме без использования радиомодификатора у 20 пациентов.
Частота и характер осложнений при проведении курса облучения по СДФ на фоне приема капецитабина и без его использования представлены в табл.3.
Таблица 3
Структура осложнений на фоне курса лучевой терапии по схеме СДФ на фоне приема капецитабина и при облучении по той же схеме без использования радиомодификатора |
| Осложнения |
Количество больных |
| СДФ+капецитабин |
СДФ |
| Общие вегетососудистые проявления |
15 (50%) |
12 (60%) |
| Желудочно-кишечные проявления |
27 (90%) |
17 (85%) |
| Обострение сопутствующей сердечно-сосудистой патологии |
3 (10%) |
3 (15%) |
| Усиление жалоб, связанных с основным заболеванием |
2 (6,7%) |
2 (10%) |
| Нейтропения |
9 (30%) |
6 (30%) |
| Лимфопения |
20 (66,7%) |
12 (60%) |
У обеих групп пациентов негативные проявления комбинированного лечения были схожие. Статистически значимых различий в частоте их возникновения также не выявлено. Все осложнения лучевого лечения имели преходящий характер и хорошо поддавались симптоматической терапии.
Степень тяжести осложнений лучевой терапии в соответствии с рекомендациями ВОЗ представлена в табл.4. Применение радиомодификатора не влияло на частоту и тяжесть негативных реакций на фоне облучения. Лучевые осложнения III-IV степени тяжести нам не встречались.
Таблица 4
Степень тяжести лучевых осложнений на фоне курса облучения. |
| Степень тяжести лучевых осложнений |
Количество больных |
| СДФ+Капецитабин |
СДФ |
| Нет |
3 (10%) |
2 (10%) |
| I |
19 (63,3%) |
14 (70%) |
| II |
8 (26,7%) |
4 (20%) |
| III-IV |
Нет |
нет |
Несмотря на снижение содержания нейтрофилов и лимфоцитов на фоне курса лучевой терапии через 10 дней после облучения пред оперативным вмешательством их содержание восстановилось. При сравнении показателей общего анализа крови непосредственно перед операцией у больных, проходящих комбинированное и только хирургическое лечение, статистически значимой разницы не найдено (табл.5).
Таблица 5
Показатели общего анализа крови перед операцией. |
| |
Результат общего анализа крови |
| Комбинированный |
Хирургический |
| Схема облучения |
СДФ+капецитабин |
СДФ |
– |
| Эритроциты |
3,95±0,5 |
3,91+0,46 |
3,92±0,4 |
| Гемоглобин |
125,1+9,1 |
124,7±9,6 |
126,1±6,9 |
| Тромбоциты |
238,9±45,3 |
230,1±51,4 |
245,8±32 |
| Лейкоциты |
6,7±0,79 |
6,5±0,82 |
7,15±0,72 |
| Нейтрофилы |
4,4±0,62 |
4,3±0,76 |
4,5±0,47 |
| Лимфоциты |
2,1+0,5 |
1,9±0,46 |
2,3±0,38 |
| Моноциты |
0,33±0,06 |
0,32±0,08 |
0,31±0,04 |
При сравнении биохимических показателей крови у больных, проходивших предоперационное облучение с использование капецитабина, и у больных, получавших только хирургическое лечение, не выявлено влияния препарата на содержание глюкозы, белка, мочевины, билирубина, фибриногена, АсАт, АлАт, амилаз крови и мочи. Средние значения данных показателей соответствовали норме.
Дополнительной применение капецитабина в суточной дозе 1650 мг/м2 на фоне курса лучевой терапии по схеме динамического фракционирования дозы не влияет на частоту и тяжесть по сравнению с курсом облучения без использования радиомодификатора. Большинство осложнений на фоне облучения представлено желудочно-кишечными проявлениями, хорошо поддающимися симптоматическому лечению. Все осложнения лучевой терапии носили преходящий характер и полностью регрессировали к моменту операции. Осложнений III-IV степени или прекращения курса облучения в связи с осложнениями при проведении лучевой терапии по схеме СДФ с использованием капецитабина как радимодификатора, не встречалось, что демонстрирует безопасность и хорошую переносимость метода.
Общая характеристика течения послеоперационного периода представлена в табл.6. Не выявлено влияния предоперационной лучевой терапии на продолжительность послеоперационного периода и длительность восстановления перистальтики.
Характер послеоперационных осложнений при проведении предоперационного курса лучевой терапии по схеме СДФ с использованием капецитабина как радиомодификатора и без него и после только хирургического лечения представлен в табл.7. В связи с отработкой операционной техники несмотря на большой объем операции по поводу рака желудка осложненное течение послеоперационного периода встречается относительно редко. Частота и структура осложнений при комбинированном лечении не отличалась от аналогичных показателей после только хирургического лечения. Негативного влияния использования радиомодификатора капецитабина на течение послеоперационного периода не найдено. Не отмечено более тяжелого течения возникавших послеоперационных осложнений при комбинированном лечении рака желудка по сравнению только с хирургическим.
Таблица 6
Общая характеристика течения послеоперационного периода. |
| |
Комбинированное лечение |
Хирургическое лечение |
| Схема облучения |
СДФ+капецитабин |
СДФ |
– |
| Восстановление перистальтики (день) |
3,22±0,29 |
3,1±0,34 |
3,25±0,22 |
| Послеоперационный койкодень |
13,9±1,12 |
14,1±1,3 |
13,5±0,86 |
| Общее количество больных с послеоперационными осложнениями |
7 (23,3%) |
4 (20%) |
10 (20,8%) |
Таблица 7
Структура послеоперационных осложнений. |
| |
Количество больных |
| Комбинированное лечение |
Хирургическое лечние |
| Схема облучения |
СДФ+капецитабин |
СДФ |
– |
| Кровотечение |
1 |
– |
– |
| Поддиафрагмальный абсцесс |
1 |
|
1 |
| Пневмония/Плеврит |
2 |
1 |
2 |
| Послеоперационный панкреатит |
3 |
3 |
5 |
| Острая задержка мочи |
– |
– |
1 |
| Длительная лимфоррея |
– |
– |
1 |
Степень лучевого патоморфоза на фоне облучения по схеме СДФ на фоне приема капецитабина и при лучевой терапии по той же схеме без использования радиомодификатора представлена в табл.8. У больных, которым на фоне облучения использовали капецитабин в качестве радиомодификатора, I степени выявлен у 5 пацентов (18,4%), II степени – у 15 (55,6%) и III степени – у 7 (26%). При проведении лучевой терапии по той же схеме без радиомодификатора I степень патоморфоза выявлена у 10 больных (75%), II – у 4 (25%). У 2 (12,5%) пациентов признаков патоморфоза не найдено. Таким образом, при использовании капецитабина как радиомодификатора на фоне предоперационного облучения по схеме динамического фракционирования дозы, получено достоверное увеличение частоты возникновения II-III степени лучевого патоморфоза, что свидетельствует об усилении лучевого повреждения опухоли.
Таблица 8
Степень лучевого патомороза в зависимости от использования радиомодификатора капецитабина. |
| Степень патоморфоза |
Количество больных |
| СДФ+капецитабин |
СДФ |
| Нет |
0 |
2 (12,5%) |
| I |
5 (18,4%) |
12 (75%) |
| II |
15 (55,6%) |
4 (25%) |
| III |
7 (26%) |
нет |
Основным показателем эффективности лечения в онкологии являются результаты выживаемости, которые представлены в табл.9. Учитывая небольшой срок применения метода, нами проведен анализ только одно- и двухгодичной выживаемости. Расчет проводился по методу моментов, предложенному Kaplan E. L. et Meier P.
Наилучшие показатели выживаемости достигнуты среди больных, получавших комбинированное лечение, несмотря на то что в данной группе пациентов чаще встречались прогностически неблагоприятные инфильтративно растущие и низкодифференцированные формы новообразований, больше было больных с распространенными стадиями заболевания. Общая одно- и двухгодичная выживаемость при комбинированном лечении с использованием капецитабина как радиомодификатора на фоне курса облучения составила 76±11% и 59±21% соответственно и превосходила аналогичные показатели у больных, проходивших курс лучевой терапии без использования радиомодификатора, и у пациентов, получавших только хирургическое лечение.
По данным литературы, максимальное превосходство комбинированного лечения над хирургическим достигнуто при местно-распространенных формах заболевания. В нашем материале больные с III-IV стадией рака желудка встречались в подавляющем большинстве случаев и составляли при комбинированном лечении – 88%, при хирургическом – 75%. В данной группе больных при отсутствии отдаленных метастазов и возможности полного удаления опухоли превосходство комбинированного лечения над хирургическим было наиболее выраженным.
Таблица 9
Показатели выживаемости после комбинированного лечения у радикально прооперированных больных. |
| |
Комбинированное лечение |
Хирургическое лечение |
| Схема облучения |
СДФ+капецитабин |
СДФ |
– |
| Всего радикально прооперированных больных |
27 |
16 |
40 |
| Прослежены результаты лечения после радикальной операции |
26 (96,3%) |
16 (100%) |
38 (95%) |
| Общая одногодичная выживаемость |
76±11% |
71±16% |
62±8,5% |
| Одногодичная выживаемость при III-IV стадии заболевания |
72±14% |
68±21% |
54±11% |
| Общая двухгодичная выживаемость |
59±21% |
55±33% |
45±19% |
| Двухгодичная выживаемость при III-IV стадии заболевания |
55±25% |
52±39% |
39±22% |
Доказана безопасность и хорошая переносимость использование капецитабина как радиомодификатора в дозе 1650 мг/м2 на фоне курса лучевой терапии по схеме динамического фракционирования. Не выявлено влияния препарата на характер и тяжесть лучевых реакций, частоту и течение послеоперационных осложнений. Прекращения облучения в связи с осложнениями не было. Специфичных для данного цитостатика негативных побочных эффектов, таких как ладонно-подошвенный синдром, стоматит, диарея, фибрильная нейтропения, не встречалось.
При использовании капецитабина как радиомодификатора на фоне предоперационного облучения по схеме динамического фракционирования дозы получено достоверное увеличение частоты возникновения II-III степени лучевого патоморфоза, что свидетельствует об усиление лучевого повреждения опухоли.
Получено улучшение показателей одно- и двухгодичной выживаемости при комбинированном лечении с проведением в предоперационном периоде курса лучевой терапии по схеме динамического фракционирования дозы на фоне использования капецитабина как радиомодификатора по сравнению с результатами при предоперационном облучении по той же схеме без радиомодификатора и только хирургическим лечением.
Основными преимуществами использование капецитабина как радиомодификатора в дозе 1650 мг/м2 на фоне курса лучевой терапии по схеме динамического фракционирования является: хорошая переносимость и безопасность метода, увеличение лучевого повреждения опухоли на фоне облучения, простота и доступность метода.
Предлагаемый способ комбинированного лечения рака желудка осуществляется следующим образом.
Данный способ лечения применим, если до операции не выявлено признаков неоперабельности или диссеминации процесса и отсутствуют противопоказания к проведению предоперационной лучевой терапии рака желудка, а именно:
– Кровотечение или его угроза по данным ФГДС.
– Угроза перфорации опухоли по данным ФГДС.
– Стеноз выходного отдела.
– Кахексия II и выше.
– Выраженная сопутствующая патология (сердечно-сосудистая недостаточность II-III, дыхательная недостаточность II-III, печеночная или почечная недостаточность, низкая эффективность медикаментозного лечения сопутствующих заболеваний).
Больному проводят курс предоперационной лучевой терапии по схеме динамического фракционирования дозы: в течение первых 3 фракций облучения доза составляет 4 Гр, далее продолжают лучевую терапию фракциями по 2 Гр в течение 9 дней. Облучение осуществляют с дневным дроблением дозы. На фоне всего курса лучевой терапии больные получают капецитабин в суточной дозе 1650 мг/м2 Суточная доза препарата разделяется на 2 приема утром за 2 часа до облучения и вечером, через 12 часов после лучевой терапии. На фоне всего курса лучевой терапии для раннего выявления осложнений лечения каждые 5 дней проводят общий анализ крови и биохимические анализы крови (содержание мочевины, глюкоза, АлАт, АсАт, билирубина). Операцию выполняют через 2 недели после окончания курса облучения.
Примеры конкретного исполнения предлагаемого метода даны в виде выписок из истории болезни.
Пример 1
Больной А., 53 года (история болезни №5018), находился на лечении в ГУЗ НООД по поводу рака антрального отдела желудка pT2N1M0, II стадия. С 05.11.03 г. по 21.11.03 г. проведен курс лучевой терапии по схеме СДФ с использованием капецитабина в суточной дозе 3000 мг, который перенес удовлетворительно. В течение первых 5 дней курса облучения беспокоило чувство тошноты, однократная рвота в первый день облучения, в связи с чем принимал противорвотные средства. 07.12.03 г. лапаротомия, обнаружена инфильтративно-язвенная опухоль дистальных 2/3 желудка, не прорастающая серозу, по поводу чего выполнена гастроспленэктомия с лимфодиссекцией D2. Послеоперационный период гладкий. При гистологическом исследовании №25835/50 выявлен перстневидноклеточный рак, рост в пределах мышечного слоя, в лимфоузлах по малой и большой кривизне метастазы опухоли аналогичного строения. В ткани новообразования выявлены участки некроза паренхимы опухоли, сливающиеся между собой, патологические митозы опухолевых клеток, расстройства микроциркуляции в виде венозного полнокровия и капиллярного стаза, фибринойдного некроза стенки сосудов микроциркуляторного русла, лейкоцитарная инфильтрация стромы. Лучевой патоморфоз III степени. При контрольном осмотре больного в апреле 2005 года каких-либо жалоб не предъявляет, признаков прогрессии заболевания нет.
Пример 2
Больной У., 66 лет (история болезни №5231), находился на лечении в ГУЗ НООД по поводу рака антрального отдела желудка pT3N2M0, II стадия. С 19.11.03 г. по 04.12.03 г. проведен курс лучевой терапии по схеме СДФ с использованием капецитабина в суточной дозе 3500 мг, который перенес удовлетворительно. В течение первых 7 дней курса облучения беспокоило чувство тошноты, однократная рвота во второй день облучения, в связи с чем принимал противорвотные средства. 20.12.03 г. лапаротомия, обнаружена инфильтративно-язвенная опухоль средней трети тела желудка, прорастающая серозу, по поводу чего выполнена гастроспленэктомия с лимфодиссекцией D2. Послеоперационный период гладкий. При гистологическом исследовании №26481/95 выявлена низкодифференцированная аденокарцинома, рост через все слои желудочной стенки, в лимфоузлах по малой и большой кривизне, в области чревного ствола и общей печеночной артерии метастазы опухоли аналогичного строения. Выявлены “мозаично” расположенные участки некроза, дистрофии и отека паренхимы опухоли, патологические митозы опухолевых клеток, расстройства кровообращения и лейкоцитарная инфильтрация стромы. Лучевой патоморфоз II степени. При контрольном осмотре больного в марте 2005 года, каких-либо жалоб не предъявляет, признаков прогрессии заболевания нет.
Формула изобретения
Способ комбинированного лечения операбельного рака желудка, включающий предоперационное облучение по схеме динамического фракционирования дозы с применением радиомодификатора, отличающийся тем, что на фоне предоперационного облучения в качестве радиомодификатора больному назначают капецитабин в дозе 1650 мг,м2 разделенной на 2 приема за 2 ч до облучения и через 12 ч после облучения.
РИСУНКИ
|
|