|
|
(21), (22) Заявка: 2005124996/15, 27.07.2005
(24) Дата начала отсчета срока действия патента:
27.07.2005
(43) Дата публикации заявки: 10.02.2007
(46) Опубликовано: 20.08.2007
(56) Список документов, цитированных в отчете о
поиске:
SAMBRUK J. et al. Molecular cloning a Laboratory manual., Cold Spring Harbor Laboratory Press, USA, 1989, с.5.3-5.31, 6.36-6.45, 9.14-9.23, 14.14-14.19. RU 2182175 С1, 10.05.2002. RU 2243558 C1, 27.12.2007. LECLERC D. et al. Molecular cloning, expressoin and phisical mapping of the human methionine synthase reductase gene. Gene, 1999, Nov. 15,
Адрес для переписки:
193232, Санкт-Петербург, ул. Народная, 18, кв.52, О.С. Глотову
|
(72) Автор(ы):
Глотов Олег Сергеевич (RU),
Глотов Андрей Сергеевич (RU),
Демин Григорий Сергеевич (RU),
Баранов Владислав Сергеевич (RU),
Иващенко Татьяна Эдуардовна (RU)
(73) Патентообладатель(и):
Глотов Олег Сергеевич (RU),
Демин Григорий Сергеевич (RU)
|
(54) СПОСОБ ДИАГНОСТИКИ СЕРДЕЧНО-СОСУДИСТЫХ ЗАБОЛЕВАНИЙ И ДИАГНОСТИЧЕСКИЙ НАБОР ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ
(57) Реферат:
Изобретение относится к медицине, в частности к молекулярно-генетическим исследованиям, например к области диагностики сердечно-сосудистых заболеваний. В основу изобретения положена задача создания диагностического набора (ДН) для проведения медико-генетического анализа предрасположенности к мультифакториальным, в том числе сердечно-сосудистым заболеваниям, универсального вследствие смешивания компонент и добавления в набор широкой группы олигопраймеров, и разработка способа диагностики, который вследствие оптимизации условий полимеразной цепной реакции и анализа полиморфизма длины рестрикционных фрагментов (ПДРФ) характеризуется: простотой и удобством в применении; высокой скоростью анализа: 2-3 дня (за счет стандартизации протокола анализа); снижением затрат на диагностические операции. Данное решение позволяет в короткие сроки проводить диагностику многофакторных заболеваний в короткие сроки, а также возможность применения диагностического набора как в специализированных клиниках, так и в лабораториях широкого спектра. 2 н. и 1 з.п. ф-лы, 1 ил., 1 табл.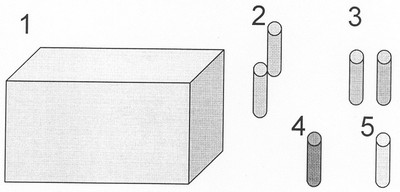
(56) (продолжение):
CLASS=”b560m”240(1), pp.75-88. MUSTAFINA O.E. et al. Endothelial nitric Oxide synthase gene minisatellite polymorphism: Study in populations in Volga-Ural region and analysis of associations with myocardial infarct and essential hypertension. Genetica, 2001, May, 37(5), p.668-674.
Изобретение относится к медицине, в частности к молекулярно-генетическим исследованиям, например к области диагностики сердечно-сосудистых заболеваний.
Одним из наиболее перспективных и успешно развивающихся направлений мировой и отечественной науки являются молекулярно-биологические технологии – основа для проведения медико-генетического анализа. Эти технологии представляют собой обширную и очень разнообразную группу методов, предназначенных для исследования и анализа генома организмов (от бактерии до человека), выявления и идентификации вариаций в структуре исследуемого участка нуклеиновой кислоты (ДНК или РНК) вплоть до расшифровки и установления первичной последовательности его оснований. Основой молекулярно-биологических методов диагностики являются различной степени сложности технологические манипуляции с нуклеиновыми кислотами, предварительно экстрагированными из клеток и тканей организма.
Большое значение в современной медицине имеет персонализированный подход к человеку. Он заключается, прежде всего, в выборе вполне определенных диагностических маркеров, необходимых для анализа конкретной патологии. Кроме того, не меньшее значение имеет совершенствование и упрощение методов анализа биологического материала, что выражается в создании целого ряда диагностических наборов, основанных на современных технологиях и направленных на упрощение работы по диагностике заболеваний без потери качества и точности полученного результата.
Известен способ исследования генетических маркеров, включающий выделение ДНК, постановку полимеразной цепной реакции (ПЦР), проведение энзиматической рестрикции и электрофореза в полиакриламидном геле (И.Е.Зазерская и др. Анализ ассоциации генов VDR3 и COLIA1 с постменуальным остеопорозом, Остеопороз и остеопатии, 2002, №2, с.3).
Недостатком этого способа является то, что анализ в этом случае осуществляется в несколько этапов, что усложняет и удорожает диагностику.
Известен способ диагностики мультифакториальных заболеваний, включающий выделение ДНК, проведение ПЦР для определения мутаций и/или полиморфизма гена, состоящей из первичной денатурации, цикла из денатурации, отжига и синтеза, заключительного синтеза, а также соответствующий диагностический набор, включающий 67 мМ трис-HCl, рН 8.8 при 25°С; 16.6 мМ (NH4)2SO4; 6.7 мМ MgCl2; 6.7 мкм ЭДТА; 10 мМ 2-меркаптоэтанола, 170 мкг БСА, смесь четырех основных dNTP в концентрации 1.0 мМ каждого и термостабильную ДНК-полимеразу 0,2 ед/мкл (Sambrook J., Fritsch E.F., Maniatis T. Molecular cloning: a laboratory manual. Cold Spring Harbor Laboratory Press, USA, 1989, с.5.3-5.31, с.6.36-6.45, 9.14-9.23, 14.14-14.19).
Недостатком этого способа и набора является то, что с их помощью невозможно осуществить мультиплексный анализ сразу нескольких генов, что приводит к замедлению процесса анализа, увеличению трудозатрат при проведении анализа, усложнению протокола диагностики заболеваний.
В основу изобретения положена задача создания диагностического набора (ДН) для проведения медико-генетического анализа предрасположенности к мультифакториальным заболеваниям, универсального вследствие смешивания компонент и добавления в набор широкой группы олигопраймеров; разработка способа диагностики, который вследствие оптимизации условий полимеразной цепной реакции и анализа полиморфизма длины рестрикционных фрагментов (ПДРФ) характеризуется простотой и удобством в применении, высокой скоростью анализа: 2-3 дня (за счет стандартизации протокола анализа), снижением затрат на диагностические операции, в результате чего создается методика проведения анализа, позволяющая использовать вышеуказанный диагностический набор как в специализированных клиниках, так и в лабораториях широкого спектра.
Достижение вышеупомянутой технической задачи обеспечивается тем, что в диагностическом наборе для определения предрасположенности к сердечно-сосудистым заболеваниям, включающем компоненты для проведения мультиплексной полимеразной цепной реакции и компоненты для проведения энзиматической рестрикции, компоненты для проведения мультиплексной полимеразной цепной реакции (67 мМ трис-HCl, рН 8.8 при 25°С; 16.6 мМ (NH4)2SO4; 6.7 мМ MgCl2; 6.7 мкм ЭДТА; 10 мМ 2-меркаптоэтанола, 170 мкг БСА, смесь четырех основных dNTP в концентрации 1.0 мМ каждого и термостабильная ДНК-полимераза 0,2 ед/мкл) смешаны в одном объеме, а компоненты для проведения энзиматической рестрикции (эндонуклеазы Msp I и Hinf I) смешаны в другом объеме, а в набор дополнительно включены крезол, набор из ДНК для проведения положительного контроля полимеразной цепной реакции и энзиматической рестрикции, вода ампулированная и олигопраймеры
5′-CTGGAGACCACTCCCATCCTTTCT-3′
5′-GATGTGGCCATCACATTCGTCAGAT-3′
5′-AGGCCCTATGGTAGTGCCTT-3′
5′-TCTCTTAGTGCTGTGGTCAC-3′
5′-TGAAGGAGAAGGTGTCTGCGGGA-3′
5′-AGGACGGTGCGGTGAGAGTG-3′
5′-AGGAGGTAGAGAGTCGCCAT-3′
5′-AAAGAGTCCCAGCCCTACCT-3′.
В способе диагностики предрасположенности к сердечно-сосудистым заболеваниям, включающем выделение ДНК, проведение полимеразной цепной реакции для определения мутаций и/или полиморфизма гена, состоящей из первичной денатурации, цикла из денатурации, отжига и синтеза, и заключительного синтеза, проведение гидролиза продуктов полимеразной цепной реакции эндонуклеазами рестрикции Msp I и Hinf I, и электрофорез в полиакриламидном геле, проводят мультиплексную полимеразную цепную реакцию с использованием n пар праймеров, где n 4, и диагностического набора по п.1, при этом первичную денатурацию проводят в течение 7 минут при температуре 94°С, далее проводят цикл от 28 до 32 раз, включающий денатурацию при 94-96°С в течение от 1 минуты до 1 минуты 10 секунд, отжиг при температуре от 58 до 60°С в течение от 1 минуты до 1 минуты 10 секунд, синтез при температуре 72°С в течение от 1 минуты до 1 минуты 20 секунд, заключительный синтез в течение 5 минут при температуре 72°С, гидролиз продуктов полимеразной цепной реакции проводят смесью эндонуклеаз рестрикции, а электрофорез продуктов гидролиза проводят в 7,5% полиакриламидном геле до выхода маркера из геля, а затем определяют полиморфизм генов АСЕ, eNOS, MTHFR, GPIIIa. В качестве маркера используют крезол, а электрофорез проводят до выхода маркера из лунок геля на расстояние 3-7 см. 4, и диагностического набора по п.1, при этом первичную денатурацию проводят в течение 7 минут при температуре 94°С, далее проводят цикл от 28 до 32 раз, включающий денатурацию при 94-96°С в течение от 1 минуты до 1 минуты 10 секунд, отжиг при температуре от 58 до 60°С в течение от 1 минуты до 1 минуты 10 секунд, синтез при температуре 72°С в течение от 1 минуты до 1 минуты 20 секунд, заключительный синтез в течение 5 минут при температуре 72°С, гидролиз продуктов полимеразной цепной реакции проводят смесью эндонуклеаз рестрикции, а электрофорез продуктов гидролиза проводят в 7,5% полиакриламидном геле до выхода маркера из геля, а затем определяют полиморфизм генов АСЕ, eNOS, MTHFR, GPIIIa. В качестве маркера используют крезол, а электрофорез проводят до выхода маркера из лунок геля на расстояние 3-7 см.
Наличие смеси компонент, дополнительное введение крезола, набора из ДНК для проведения положительного контроля полимеразной цепной реакции и энзиматической рестрикции, воды ампулированной и олигопраймеров в диагностический набор позволяет значительно ускорить процесс анализа, удешевить процедуру диагностики, сделать ее более доступной независимо от условий проведения.
Предложенные условия проведения анализа позволяют с помощью диагностического набора быстро, дешево и точно осуществить диагностику предрасположенности к сердечно-сосудистым заболеваниям.
Состав набора можно представить в виде следующей схемы, которая показана на чертеже. В набор входят следующие компоненты:
1 – упаковочная коробка для набора,
2 – комплект №1 для проведения ПЦР (смесь для
мультиплексной ПЦР с крезолом – 100 шт.(РС))-
состав и количество веществ в одном комплекте смеси:
67 мМ трис-HCl, рН 8.8 при 25°С; 16.6 мМ (NH4)2SO4; 6.7 мМ MgCl2; 6.7 мкм ЭДТА; 10 мМ 2-меркаптоэтанола, 170 мкг БСА, смесь четырех основных dNTP в концентрации 1.0 мМ каждого и олигопраймеры 0.001 оптической единицы каждого
TaqAHK полимераза -концентрация 0,2 ед/мкл (П)),
объем смеси для одной реакции – от 10 до 25 мкл,
3 – комплект №2 для проведения энзиматической рестрикции (буфер для эндонуклеазы рестрикции (БР) – это смесь 1:1 однократных буферов О и G (фирмы производителя эндонуклеаз – «Сибэнзим»), смесь(и) эндонуклеаз рестрикции (Р)) – это смесь эндонуклеаз рестрикции Hinf l и Msp l в конечных концентрациях 0,5 ед/мкл,
объем смеси для одной реакции – 5 мкл,
4 – положительный контроль для ПЦР и энзиматической рестрикции (К) – это образец(ы) ДНК с известными генотипами, например тетрагетерозигота
По гену АСЕ – I/D
По гену NOS3 – 4/5
По гену MTHFR – С/T
Погену Gpllla – А1/А2
5 – вода ампулированная (В).
В заявляемом изобретении предлагается новый модифицированный вариант идентификации аллелей генов путем использования набора олигопраймеров и, что особенно важно, температурного режима, позволяющих проводить мультиплексную полимеразную цепную реакцию.
Характеристика изученных полиморфных вариантов генов и последовательности олигопраймеров приведены в таблице 1.
Таблица 1.
Список олигонуклеотидных праймеров, использованных для проведения ПЦР. |
| Ген, локализация |
Полиморфизм |
Структура олигопраймеров |
| АСЕ |
del/ins Alu-повтора 287 п.н. в 16 интроне |
5′-CTGGAGACCACTCCCATCCTTTCT-3′ 5′-GATGTGGCCATCACATTCGTCAGAT-3′ |
| eNOS |
4 и 5 повторов по 27 п.н. в 5 интроне |
5′-AGGCCCTATGGTAGTGCCTT-3′
5′-TCTCTTAGTGCTGTGGTCAC-3′ |
| MTHFR |
677 С/T |
5′-TGAAGGAGAAGGTGTCTGCGGGA-3′ 5′-AGGACGGTGCGGTGAGAGTG-3′ |
| GPllla |
А1/А2 |
5′-AGGAGGTAGAGAGTCGCCAT-3′
5′-AAAGAGTCCCAGCCCTACCT-3′ |
Способ состоит их VI этапов и осуществляется следующим образом. Объясним это на примере осуществления способа с использованием заявляемого диагностического набора для четырех пар праймеров.
1) На первом этапе выделяют ДНК пациента по стандартному протоколу (Sambrook J., Fritsch E.F., Maniatis T. Molecular cloning: a laboratory manual. Cold Spring Harbor Laboratory Press, USA, 1989, с.9.14-9.23).
2) Далее проводят мультиплексную полимеразную цепную реакцию с использованием n пар праймеров, где n 4, и диагностического набора (добавляют комплект №1 и ампулированную воду к образцам: анализируемого ДНК и положительного контроля для ПЦР и энзиматической рестрикции), при этом первичную денатурацию проводят в течение 7 минут при температуре 94°С, далее проводят цикл от 28 до 32 раз, включающий денатурацию при 94-96°С в течение от 1 минуты до 1 минуты 10 секунд, отжиг при температуре от 58 до 60°С в течение от 1 минуты до 1 минуты 10 секунд, синтез при температуре 72°С в течение от 1 минуты до 1 минуты 20 секунд, заключительный синтез в течение 5 минут при температуре 72°С (таблица 2). Для амплификации использовали программируемый термоциклер фирмы «ДНК-технология» (Москва). 4, и диагностического набора (добавляют комплект №1 и ампулированную воду к образцам: анализируемого ДНК и положительного контроля для ПЦР и энзиматической рестрикции), при этом первичную денатурацию проводят в течение 7 минут при температуре 94°С, далее проводят цикл от 28 до 32 раз, включающий денатурацию при 94-96°С в течение от 1 минуты до 1 минуты 10 секунд, отжиг при температуре от 58 до 60°С в течение от 1 минуты до 1 минуты 10 секунд, синтез при температуре 72°С в течение от 1 минуты до 1 минуты 20 секунд, заключительный синтез в течение 5 минут при температуре 72°С (таблица 2). Для амплификации использовали программируемый термоциклер фирмы «ДНК-технология» (Москва).
Таблица 2
Условия проведения ПЦР |
| Денатурация |
28-32 цикла |
Синтез |
| Денатурация |
Отжиг |
Синтез |
| 94°С – 7 мин |
94 – 96°С
1 мин – 1 мин 10 сек |
58 – 60°С
1 мин – 1 мин 10 сек |
72°С 1 мин – 1 мин 20 сек |
72°С – 5 мин |
3) После окончания ПЦР специфичность амплификации и количество амплификата (анализируемого образца и положительного контроля) проверяли методом электрофореза в полиакриламидном геле (ПААГ) по стандартному протоколу (Sambrook J., Fritsch E.F., Maniatis T. Molecular cloning: a laboratory manual. Cold Spring Harbor Laboratory Press, USA, 1989, с.6.36-6.45).
4) Далее осуществляли гидролиз амплифицированных фрагментов ДНК (анализируемого образца и положительного контроля) эндонуклеазами рестрикции Msp I и Hinf I по стандартному протоколу (Sambrook J., Fritsch E.F., Maniatis T. Molecular cloning: a laboratory manual. Cold Spring Harbor Laboratory Press, USA, 1989, с.5.28-5.32), используя комплект №2 и ампулированную воду.
5) Продукты гидролиза (анализируемого образца и положительного контроля) разделяли в 7,5% неденатурирующем полиакриламидном геле, приготовленном на трис-боратном буфере (ТБЕ) в аппарате для вертикального электрофореза с длиной стекла 20 см. Для получения 30% раствора акриламида смешивали 29 г акриламида с 1 г N,N-метилен-бис-акриламида и растворяли смесь в 100 мл дистиллированной воды. 10-кратный раствор ТБЕ готовили, растворяя 54 г триса, 27,5 г борной кислоты и 20 мл 0,5М ЭДТА рН 8,0 в 0,5 л дистиллированной воды. Для приготовления 20 мл 7,5% полиакриламидного геля смешивали 5 мл 30% акриламида, 2 мл 10-кратного ТБЕ, 13 мл дистиллированной воды, 200 мкл 10% раствора персульфата аммония и 25 мкл тетраметилэтилендиамина. Перед заливкой раствор тщательно перемешивали. Пробы (образцы) наносили в гель в объеме 5 мкл каждого продукта гидролиза в свою лунку. Электрофорез проводили в 1-кратном ТБЕ при напряжении электрического поля 120 В, пока образцы не входили в гель и не проходили около 1 см от лунок. После этого напряжение увеличивали до 180-200 В. Останавливали электрофоретическое разделение, когда до выхода крезола из геля оставалось 3-7 см.
6) Гель с продуктами гидролиза (анализируемого образца и положительного контроля) окрашивали водным раствором бромистого этидия (0,5 мкг/мл), просматривали в ультрафиолетовом свете на трансиллюминаторе и фотографировали на системе видео-гель-документации. Сравнивали наличие «полос» анализируемого образца с таковыми у положительного контроля. Определяли генотип пациента. Выдавали заключение по результатам анализа.
Например, нами с помощью диагностического набора получены следующие результаты:
По гену АСЕ – D/D
По гену NOS3 – 4/4
По гену MTHFR – С/С
По гену Gpllla – А1/А1
На основании теста у пациента выявлен риск группы с-с заболеваний, связанных с регуляцией давления – ИБС, инфаркт миокарда, эссенциальная гипертензия (гипертоническая болезнь), атеросклероз.
Формула изобретения
1. Диагностический набор для определения предрасположенности к сердечно-сосудистым заболеваниям, включающий компоненты для проведения мультиплексной полимеразной цепной реакции и компоненты для проведения энзиматической рестрикции, отличающийся тем, что компоненты для проведения полимеразной цепной реакции: 67 мМ трис-HCl, рН 8,8 при 25°С; 16.6 мМ (NH4)2SO4, 6.7 мМ MgCl2, 6.7 мкм ЭДТА; 10 мМ 2-меркаптоэтанола, 170 мкг БСА, смесь четырех основных dNTP в концентрации 1.0 мМ каждого и термостабильная ДНК-полимераза в концентрации 0,2 ед/мкл смешаны в одном объеме, а компоненты для проведения энзиматической рестрикции – эндонуклеазы Msp I и Hinf I смешаны в другом объеме, а набор дополнительно включает крезол, набор из ДНК для проведения положительного контроля полимеразной цепной реакции и энзиматической рестрикции, вода ампулированная и олигопраймеры
5′-CTGGAGACCACTCCCATCCTTTCT-3′
5′-GATGTGGCCATCACATTCGTCAGAT-3′
5′-AGGCCCTATGGTAGTGCCTT-3′
5′-TCTCTTAGTGCTGTGGTCAC-3′
5′-TGAAGGAGAAGGTGTCTGCGGGA-3′
5′-AGGACGGTGCGGTGAGAGTG-3′
5′-AGGAGGTAGAGAGTCGCCAT-3′
5′-AAAGAGTCCCAGCCCTACCT-3′.
2. Способ определения предрасположенности к сердечно-сосудистым заболеваниям, включающий выделение ДНК, проведение полимеразной цепной реакции для определения мутаций и/или полиморфизма генов, состоящей из первичной денатурации, цикла из денатурации, отжига и синтеза и заключительного синтеза, проведение гидролиза продуктов полимеразной цепной реакции эндонуклеазами рестрикции Msp I и Hinf I, и электрофорез в полиакриламидном геле, отличающийся тем, что проводят полимеразную цепную реакцию с использованием диагностического набора по п.1, при этом первичную денатурацию проводят в течение 7 мин при температуре 94°С, далее проводят цикл от 28 до 32 раз, включающий денатурацию при 94-96°С в течение от 1 мин до 1 мин 10 с, отжиг при температуре от 58 до 60°С в течение от 1 мин до 1 мин 10 с, синтез при температуре 72°С в течение от 1 мин до 1 мин 20 с, заключительный синтез в течение 5 мин при температуре 72°С, гидролиз продуктов полимеразной цепной реакции проводят смесью эндонуклеаз рестрикции, а электрофорез продуктов гидролиза проводят в 7,5% полиакриламидном геле до выхода маркера из геля, а затем определяют полиморфизм генов АСЕ, eNOS, MTHFR, GPIIIa.
3. Способ по п.2, отличающийся тем, что в качестве маркера используют крезол, и электрофорез проводят до выхода маркера из лунок геля на расстояние 3-7 см.
РИСУНКИ
QB4A – Регистрация лицензионного договора на использование изобретения
Лицензиар(ы): Глотов Олег Сергеевич, Демин Григорий Сергеевич
Вид лицензии*: НИЛ
Лицензиат(ы): Общество с ограниченной ответственностью “ПреМед”
Договор № РД0047128 зарегистрирован 19.02.2009
Извещение опубликовано: 27.03.2009 БИ: 09/2009
* ИЛ – исключительная лицензия НИЛ – неисключительная лицензия
|
|