Патент на изобретение №2303995
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
(54) СРЕДСТВО, ОБЛАДАЮЩЕЕ ИММУНОРЕГУЛЯТОРНЫМ СВОЙСТВОМ И ЕГО ПРИМЕНЕНИЕ ДЛЯ ЛЕЧЕНИЯ АУТОИММУННЫХ ЗАБОЛЕВАНИЙ
(57) Реферат:
Изобретение относится к биофармакологии и медицине и касается разработки средства, обладающего иммунорегуляторным свойством, в частности свойством индуцировать супрессорную активность мононуклеарных клеток и секрецию ими цитокинов, указанное средство содержит трофобластический
Изобретения относятся к области медицины, в частности к новым биологически активным веществам (БАВ), обладающим иммунорегуляторным свойством, их применению и могут быть использованы в практической медицине для лечения аутоиммунных заболеваний, а также в экспериментальной биохимии и ветеринарии. Однако известное средство не предназначено для использования на стадии обострения аутоиммунного заболевания, а предназначено лишь для использования в стадии ремиссии. Кроме того, для достижения клинического эффекта необходимо постоянное введение огромных доз иммуноглобулинов на протяжении нескольких лет. По технической сущности наиболее близким к заявляемым изобретениям является трофобластический Однако известное средство при использовании его в стадии обострения аутоиммунного заболевания может проявлять свое действие лишь через 4-5 дней после его введения в организм больного. Техническим результатом является разработка средства, обладающего иммунорегуляторным свойством и ускоренным клиническим эффектом на стадии обострения преимущественно при лечении аутоиммунных заболеваний. Достигается это тем, что средство, обладающее иммунорегуляторным свойством, содержащее трофобластический Согласно второму изобретению для лечения аутоиммунных заболеваний применяют средство, содержащее ТБГ и Ig, причем в качестве иммуноглобулина используют иммуноглобулин класса G (Ig-G), а ТБГ и Ig-G взяты в равных долях или в долях, соотношение которых составляет 1:19, соответственно, кроме того, при лечении аутоиммунных заболеваний средство, содержащее ТБГ и Ig, вводят парэнтерально. Сущность изобретения заключается в том, что заявляемое средство, содержащее ТБГ и Ig, обладает способностью подавлять пролиферативную активность мононуклеарных клеток, индуцировать их супрессорную активность и секрецию ими цитокинов ТФР- ТБГ можно получать из отходов производства (фракция А) гамма-глобулина (а.с. №1341736, кл. А61К 35/16, 1985). Иммуноглобулин Ig может быть получен общеизвестным способом (см., например, В.В.Анастасиев, «Иммуноглобулин для внутривенного введения», Нижний Новгород, изд. НГМА, 2000 г.). Получение заявляемого средства может быть осуществлено путем смешивания в стеклянной посуде при температуре +1÷10°С исходных составляющих ТБГ и Ig в соотношениях 1:99; 1:19; 1:9; 1:1,5; 1:1. Лечебный эффект заявляемого средства заключается в том, что оно обладает способностью индуцировать супрессорную активность мононуклеарных клеток больных с аутоиммунными заболеваниями и секрецию мононуклеарными клетками цитокинов ТФР- Это позволяет утверждать, что заявляемое средство обладает иммунорегуляторным свойством. Следует отметить, что осуществляли приготовление средства из вышеуказанных составляющих – ТБГ и Ig-G в различных вышеуказанных долях. Однако значительных различий в результатах испытаний при получении средства из разных соотношений долей не было замечено. Однако, учитывая экономический подход, можно рекомендовать соотношение ТБГ и Ig-G, равное 1:19. Это соотношение является оптимальным и с точки зрения эффективности действия средства, и с точки зрения удобства в его приготовлении, хотя при исследовании положительный результат неоднократно был получен и при соотношении, равном 1:99. Следует отметить, что в качестве Ig использовали его разные классы (типы): Ig-G, Ig-A и Ig-M и получали примерно одинаковые результаты. Однако на практике предпочтение можно отдать классу Ig-G, так как его производство проще. Биологическая активность заявляемого средства, состоящего из ТБГ и Ig, определялась следующим образом. Пример 1. Исследовали действие средства, состоящего из ТБГ и Ig-G, на пролиферативную активность мононуклеарных клеток периферической крови, выделенных по методу Boyum, 1969 г. Диапазон используемых доз составлял 1 мкг/мл – 960 мкг/мл. Результаты исследований отражены в таблице 1.
Как видно из таблицы 1, средство, состоящее из ТБГ и Ig-G, подавляет пролиферативную активность мононуклеарных клеток периферической крови, вызванную фитогемагглютинином, в 2 раза сильнее, чем чистый ТБГ. Пример 2. Исследовали влияние заявляемого средства, состоящего из ТБГ и Ig-G, на способность индуцировать супрессорную активность мононуклеарных клеток периферической крови. На первом этапе получают суспензию МНК методом седиментации клеток в одноступенчатом градиенте фиколл-уротрасте (метод Boyum). Периферическую кровь берут у донора путем венопункции в одно и то же время и помещают в пробирки с раствором гепарина из расчета 1 мл крови – 20-30 ед. гепарина. Далее кровь разводят раствором Хенкса без Са++ и Mg++ в соотношении 1:2 и наслаивают на градиент фиколл-уротраст (плотность 1,078). Затем проводят центрифугирование в режиме 400 g в течение 30 мин. Взвесь МНК из интерфазы переносят в центрифужную пробирку, добавляют раствор Хенкса без Са++ и Mg++ и производят 3 последовательных центрифугирования по 10 мин для отмывания клеток от раствора фиколл-уротраст. После 3-го центрифугирования осадок МНК ресуспензируют в 1 мл среды 199 и подсчитывают количество мононуклеарных клеток с помощью камеры Горяева. На втором этапе МНК делят на две равные части, первую из которых культивируют без активатора супрессоров, вторую – с активатором супрессоров, в качестве которого используют исследуемое средство. МНК культивируют в пенициллиновых флаконах, закрытых резиновыми пробками №14,5 при температуре 37°С. Среда культивирования RPM-1640 с добавлением 20% сыворотки IV АВ группы крови и глютамина. В каждом флаконе культивируют 5×106 клеток в 2,0 мл полной среды. К культуре для индукции супрессоров добавляют средство, состоящее из ТБГ и Ig-G в дозах 1-960 мкг/мл. Культивирование клеток осуществляют 48 ч. После этого МНК отмывают от среды культивирования и осуществляют блокировку пролиферации путем обработки митомицином С – 40 мкг/мл в течение 30 мин при 37°С. Затем отмывают средой 199 с 5% сыворотки IV АВ (охлажденной) трижды. Осадок клеток ресуспензируют, подсчитывают количество ядросодержащих клеток, определяют процент жизнеспособности клеток с помощью 0,1%-ного трипанового синего раствора и разводят до необходимой концентрации. При этом все операции делают раздельно с контрольными клетками и со стимулированной композицией, а для отмывания клеток используют силиконированную посуду. На следующем этапе в каждую часть контрольных и стимулированных средством МНК добавляют свежевыделенные МНК, стимулированные фитогемагглютинином (ФГА), которые служат отвечающими тест-клетками в равных соотношениях (0,5×106 клеток/мл) для получения тест-культур. Культивирование их проводят в течение 72 ч. После этого с помощью Н3-тимидина оценивают пролиферацию тест-культур и о величине супрессии судят по степени снижения пролиферации в них. Индекс супрессии (ИС) определяют по формуле: Результаты исследований влияния средства, состоящего из ТБГ и Ig-G, на способность индуцировать супрессорную активность МНС отражены в таблице 2. Диапазон доз 1-960 мкг/мл.
Как видно из таблицы 2, средство, состоящее из ТБГ и Ig-G, индуцирует супрессорную активность мононуклеарных клеток периферической крови, в 2 раза сильнее, чем чистый ТБГ. Пример 3. Исследовали влияние средства, состоящего из ТБГ и Ig-G, на способность индуцировать продукцию цитокинов-трансформирующего фактора роста бета 1 (ТФР- На первом этапе получали суспензию МНК методом седиментации клеток в одноступенчатом градиенте фиколл – утротраста (метод Boyum). МНК делили на 2 равные части, первую из которых культивировали без заявляемого средства, вторую со средством. МНК культивируют в пенициллиновых флаконах, закрытых резиновыми пробками №14,5 при температуре 37°С. Среда культивирования RPVI-1640 с добавлением 20% сыворотки IV АВ группы крови и глютамина. В каждом флаконе культивировали 5×106 МНК в 1 мл полной среды. К культуре МНК для индукции выработки цитокинов ТФР- Культивирование клеток осуществляли 24 часа. После этого культуральную среду отделяли от клеток путем центрифугирования (1000g 10 минут и из нее забирали 500 мкл, необходимой для выполнения анализа). При определении количества ТФР- Для этого в полипропиленовую пробирку вносили 0,25 мл (250 мкл) культуральной среды и 0,05 (50 мкл) экстрагирующего раствора. Перемешивали содержимое на вортексе. Инкубировали 30 минут при 4°С. Добавляли в пробирку 250 мкл рабочего буферного раствора для разведения стандартов. На этом этапе происходит разбавление культуральной среды в 2,2 раза. Далее брали требуемое для проведения анализа число 8 луночных стрипов из разборного микропланшета, покрытого антителами к ТФР- Для повышения достоверности результатов анализа исследуемые и контрольные образцы ставили в дубликатах, используя для каждого образца две лунки. Вносили по 200 мкл каждого стандарта и экстрагированного образца или клотрона в соответствующие лунки. Добавляли по 500 мкл биотинилированных антител к ТФР- Вносили в каждую лунку по 100 мкл стоп раствора (раствор 1Н серной кислоты) для остановки ферментативной реакции. Перемешивали реагенты путем осторожного постукивания по держателю стрипов. Цвет раствора изменялся с голубого на желтый. Регистрацию результатов проводили фотометрически на фотометре для иммуноферментного анализа при длине волны 450 нм сразу после остановки ферментативной реакции. Для определения концентрации ТФР- По калибровочной кривой, исходя из полученного значения оптической плотности определяли концентрацию ТФР- Для определения количества ИЛ-10 в культуральной среде брали требуемое для проведения анализа число 8 луночных стрипов из разборного микропланшета, покрытого антителами к ИЛ-10. Для повышения достоверности результатов анализа исследуемые и контрольные образцы ставили в дубликатах, используя для каждого образца две лунки. Вносили 50 мкл каждого стандарта, испытуемого образца или контрольного образца в соответствующие лунки. Добавляли по 50 мкл инкубационного буфера для лунок, содержащих стандарты, и 50 мкл разбавляющего рабочего раствора в лунки, содержащие культуральную среду. Закрывали планшет пленкой и инкубировали 2 часа при комнатной температуре. Полностью удаляли содержимое лунок. Промывали все лунки 4 раза рабочим буферным раствором, добавляя его каждый раз по 400 мкл во все лунки. При этом каждый раз полностью заполняли и удаляли из лунок стрипов раствор. Добавляли по 100 мкл биотинилированных антител к ИЛ-10 во все лунки, перемешивали путем постукивания по планшету. Закрывали планшет пленкой и инкубировали 2 часа при комнатной температуре. Полностью удаляли содержимое лунок, промывали все лунки 4 раза рабочим буферным раствором. Добавляли 100 мкл рабочего раствора конъюгата стрептавидин-пероксидаза в каждую лунку за исключением хромогенного бланка. Закрывали планшет пленкой и инкубировали 30 минут при комнатной температуре. Полностью удаляли содержимое лунок. Промывали лунки 4 раза рабочим буферным раствором. Далее вносили во все лунки по 100 мкл хромогенного раствора тетраметилбензидина (ТМБ). Инкубировали 20-30 минут при комнатной температуре в темноте до появления голубой окраски в лунках с калибровочной пробой с максимальным содержанием ИЛ-10. Вносили в каждую лунку по 100 мкл стоп раствора (раствор 1Н серной кислоты) для остановки ферментативной реакции. Перемешивали реагенты путем осторожного постукивания по держателю стрипов. Цвет раствора изменялся с голубого на желтый. Регистрацию результатов также проводили фотометрически на фотометре для иммуноферментного анализа при длине волны 450 нм сразу после остановки ферментативной реакции. Для определения концентрации ИЛ-10 в исследуемых образцах строили калибровочную кривую в координатах: ось абсцисс – концентрация ИЛ-10 в калибровочных пробах (рг/мл); ось ординат – соответствующее значение оптической плотности. По калибровочной кривой, исходя из полученного значения оптической плотности, определяли концентрацию ИЛ-10 в исследуемых образцах. Если образцы были предварительно разбавлены, полученные значения концентраций должны быть умножены на коэффициент разведения (10, 100, 1000 и т.п.). В результате проведенных исследований было установлено, что средство, содержащее ТБГ и Ig-G, обладает способностью индуцировать продукцию одновременно 2-х цитокинов – ТФР- При этом уровень цитокинов ИЛ-10 и ТФР- Пример 4. Исследовали действие средства, состоящего из ТБГ и Ig-G, в соотношении ТБГ и Ig-G (1:99), на пролиферативную активность мононуклеарных клеток периферической крови, выделенных по методу Boyum, 1969 г. Диапазон используемых доз составлял 1 мкг/мл – 960 мкг/мл. Результаты исследований отражены в таблице 3.
Как видно из таблицы 3, средство, состоящее из ТБГ и Ig-G в соотношении 1:99, подавляет пролиферативную активность мононуклеарных клеток периферической крови, вызванную фитогемагглютинином, в такой степени, как и заявляемое средство, содержащее ТБГ и Ig-G в соотношении 1:19. Пример 5. Исследовали действие средства, состоящего из ТБГ и Ig-G, в соотношении ТБГ и Ig-G (1:1,5), на пролиферативную активность мононуклеарных клеток периферической крови, выделенных по методу Boyum, 1969 г. Диапазон используемых доз составлял 1 мкг/мл – 960 мкг/мл. Результаты исследований отражены в таблице 4.
Как видно из таблицы 4, средство, состоящее из ТБГ и Ig-G в соотношении 1:1,5, подавляет пролиферативную активность мононуклеарных клеток периферической крови, вызванную фитогемагглютинином, в такой степени, как и заявляемое средство, содержащее ТБГ и Ig-G в соотношениях 1:19 и 1:99. Пример 6. Исследовали действие средства, состоящего из ТБГ и Ig-G, в соотношении ТБГ и Ig-G (1:9), на пролиферативную активность мононуклеарных клеток периферической крови, выделенных по методу Boyum, 1969 г. Диапазон используемых доз составлял 1 мкг/мл – 960 мкг/мл. Результаты исследований отражены в таблице 5.
Как видно из таблицы 5, средство, состоящее из ТБГ и Ig-G в соотношении 1:9, подавляет пролиферативную активность мононуклеарных клеток периферической крови, вызванную фитогемагглютинином, в такой степени, как и заявляемое средство, содержащее ТБГ и Ig-G в соотношениях 1:19, 1:99 и 1:1,5. Пример 7. Исследовали действие средства, состоящего из ТБГ и Ig-G, в соотношении ТБГ и Ig-G (1:1), на пролиферативную активность мононуклеарных клеток периферической крови, выделенных по методу Boyum, 1969 г. Диапазон используемых доз составлял 1 мкг/мл – 960 мкг/мл. Результаты исследований отражены в таблице 6.
Как видно из таблицы 6, средство, состоящее из ТБГ и Ig-G в соотношении 1:9, подавляет пролиферативную активность мононуклеарных клеток периферической крови, вызванную фитогемагглютинином, в такой степени, как и заявляемое средство, содержащее ТБГ и Ig-G в соотношениях 1:19, 1:99, 1:9 и 1:1,5. Пример 8. Результаты исследований влияния средства, состоящего из ТБГ и Ig-G в соотношении 1:99, на способность индуцировать супрессорную активность МНС отражены в таблице 7. Диапазон доз 1-960 мкг/мл.
Как видно из таблицы 7, средство, состоящее из ТБГ и Ig-G в соотношении 1:99, индуцирует супрессорную активность мононуклеарных клеток периферической крови в такой же степени, как и средство, содержащее ТБГ и Ig-G в соотношении 1:19, и индуцировать продукцию цитокинов-трансформирующего фактора роста бета 1 ТФР- Пример 9. Результаты исследований влияния средства, состоящего из ТБГ и Ig-G в соотношении 1:9, на способность индуцировать супрессорную активность МНС отражены в таблице 8. Диапазон доз 1-960 мкг/мл.
Как видно из таблицы 8, средство, состоящее из ТБГ и Ig-G в соотношении 1:9, индуцирует супрессорную активность мононуклеарных клеток периферической крови в такой же степени, как и средство, содержащее ТБГ и Ig-G в соотношениях 1:19, 1:99, и индуцировать продукцию цитокинов-трансформирующего фактора роста бета 1 ТФР- Пример 10. Результаты исследований влияния средства, состоящего из ТБГ и Ig-G в соотношении 1:1,5, на способность индуцировать супрессорную активность МНС отражены в таблице 9. Диапазон доз 1-960 мкг/мл.
Как видно из таблицы 9, средство, состоящее из ТБГ и Ig-G в соотношении 1:1,5, индуцирует супрессорную активность мононуклеарных клеток периферической крови в такой же степени, как и средство, содержащее ТБГ и Ig-G в соотношениях 1:19, 1:99 и 1:9, и индуцировать продукцию цитокинов-трансформирующего фактора роста бета 1 ТФР- Пример 11. Результаты исследований влияния средства, состоящего из ТБГ и Ig-G в соотношении 1:1, на способность индуцировать супрессорную активность МНС отражены в таблице 10. Диапазон доз 1-960 мкг/мл.
Как видно из таблицы 10, средство, состоящее из ТБГ и Ig-G в соотношении 1:1, индуцирует супрессорную активность мононуклеарных клеток периферической крови в такой же степени, как и средство, содержащее ТБГ и Ig-G в соотношениях 1:19, 1:99, 1:9 и 1:1,5, и индуцировать продукцию цитокинов-трансформирующего фактора роста бета 1 ТФР- Пример 12. ВЫПИСКА из истории болезни. Больной О., 43 лет, находился на лечении в 5 терапевтическом отделении с диагнозом: Ревматоидный артрит-полиартрит, серопозитивный, с системными проявлениями (лихорадка, лимфаденопатия, анемия, амиотрофии, нейропатия, ревматоидные узелки), активность III ст., стадия III, недостаточность функции суставов III. При поступлении предъявлял жалобы на выраженные боли в мелких и крупных суставах конечностей (проксимальных межфаланговых кистей рук, пястнофаланговых, лучезапястных, локтевых, плечевых, коленных, голеностопных, плюснефаланговых, грудиноключичных), их припухлость, ограничение подвижности, выраженную скованность в суставах, продолжающуюся в течение всего дня, ощущение покалывания в кончиках пальцев рук и ног, повышение температуры до 38,6°С. В течение 7 лет отмечал артралгии, в течение 5 лет беспокоят умеренные боли в суставах с их припухлостью. Нерегулярно принимал нестероидные противовоспалительные препараты, для облегчения болей нередко употреблял алкоголь. Настоящее ухудшение состояния за 2 недели до госпитализации – после острой респираторной инфекции – повысилась температура до фебрильных цифр, развилась множественная припухлость суставов, появились вышеперечисленные жалобы. Амбулаторно получал антибиотики, нестероидные противововоспалительные препараты, в последние дни начал употреблять алкоголь. Госпитализирован. При поступлении состояние тяжелое. Температура тела 38,6°С. Полностью обездвижен из-за болей в суставах и их припухлости. Стонет из-за болей. Кожные покровы бледные. Пастозность голеней. Пальпируются увеличенные (1,5×1,5 см, 1,5×2 см) лимфоузлы (подчелюстные, аксиллярные, паховые). В легких жесткое дыхание (курильщик). Тоны сердца умеренно приглушены, тахикардия до 92 в минуту, пульс ритмичный, удовлетворительного наполнения, АД 130/80 мм рт. ст. Живот мягкий, безболезненный. Печень + 2 см. Селезенка не пальпируется. Симптом поколачивания (Пастернацкого) отрицательный. Выраженные амиотрофии конечностей. Выраженная припухлость, дефигурация суставов-проксимальных межфаланговых кистей рук, пястнофаланговых, лучезапястных, локтевых, коленных, голеностопных. Гипертермия кожи над суставами. Ограничение активных и пассивных движений в суставах. Ульнарная девиация кистей рук. Контрактуры лучезапястных и локтевых суставов. Ревматоидный узелок в области локтевого сустава слева. Рентгенография кистей рук – остеопороз, сужение межсуставных щелей, множественные эрозии, подвывихи. Анализ крови: Гемоглобин – 86 г/л, Л – 11200, СОЭ – 67 мм/ч, СРБ – 4+, РФ – 1:320, HBs-(-), АСТ – 74, АЛТ – 56, общий белок крови – 66 г/л. Супрессорная активность Т-лимфоцитов периферической крови при индукции заявляемого средства составила 16%. ЭКГ-ритм синусовый, диффузые изменения миокарда. Рентгенография органов грудной клетки – очаговых и инфильтративных изменений нет. Больному проводилось лечение – реопирин по 3 мл внутримышечно ежедневно, диклофенак по 50 мг 3 раза в день, инъекции анальгина с димедролом дважды в день. Состояние больного без существенной динамики в течение 10 дней. Сохраняются анемия, лихорадка до 37,9-38,8°С, выраженные экссудативные изменения в суставах. Больной обездвижен. Больному проведен курс ежедневных внутривенных инъекций заявляемого средства, содержащего ТБГ и Ig-G в долях 1:99. Состояние со значительным улучшением. Заметно уменьшились боли во всех суставах, их припухлость, увеличился объем движений. Температура тела нормализовалась. Исчезла скованность в суставах. Больной начал ходить, смог обслуживать себя. Повысился уровень гемоглобина крови до 125 г/л, снизилась СОЭ до 27 мм/ч, СРБ стал 1+, общий белок крови повысился до 84 г/л. При повторном анализе выявили повышение супрессорной активности Т-лимфоцитов периферической крови при индукции заявляемого средства – 64,2%. У больного в реакции Оухтерлони на 7, 14 и 28 дни антитела против заявляемого средства не выявлены. Больной выписан домой в удовлетворительном состоянии. Больному рекомендовано амбулаторно продолжить прием нестероидных противововспалительных препаратов (диклофенак), назначить базисные препараты (сульфасалазин). Пример 13. Больной М., 35 лет, находился на лечении с диагнозом: Ревматоидный артрит-полиартрит серопозитивный, с системными проявлениями (амиотрофия, анемия, нейропатия, лихорадка) активность II ст., стадия II, НФС II. При поступлении предъявлял жалобы на боли в суставах – проксимальных межфаланговых, пястнофаланговых кистей рук, лучезапястных, плечевых, коленных, голеностопных, припухлость указанных суставов, ограничение подвижности в них. Жалобы на выраженную скованность в суставах по утрам, продолжающуюся до обеда, онемение кончиков пальцев, повышение температуры тела до субфебрильных цифр. Считает себя больным в течение 5 лет. Начало заболевания с поражения голеностопных и коленных суставов, в последние 2 года присоединилась припухлость лучезапястных суставов и межфаланговых суставов кистей рук. С этого же времени стал отмечать скованность в суставах по утрам. Проводилось лечение нестероидными противовоспалительными препаратами с положительным эффектом. Настоящее ухудшение 3 недели назад – после острого респираторного заболевания – развилась выраженная припухлость суставов – проксимальных межфаланговых, пястнофаланговфых, лучезапястных, коленных, голеностопных, усилилась скованность по утрам (стала продолжаться до обеда), повысилась температура до 37,5°С. Проводимая терапия нестероидными противовоспалительными препаратами, антибиотиками (клацид) – без существенного эффекта, в связи с чем госпитализирован. При поступлении обездвижен, ходит с трудом, с палочкой. Дефигурация, припухлость проксимальных межфаланговых и пястнофаланговых суставов кистей рук, лучезапястных, коленных, голеностопных, ограничение активных и пассивных движений в суставах. Гипертермия коленных, лучезапястных и голеностопных суставов. Контрактуры лучезапястных суставов. Выраженные амиотрофии мышц бедер, плечевых. По органам без выраженной патологии. В анализах крови: Нв – 110 г/л, Л. – 10700, СОЭ – 45 мм/ч, СРБ 3+, РФ 1:160, общий белок 70 г/л, АСТ – 40, АЛТ – 34. Анализ мочи: уд. вес 1025, Л – 1-2 в поле зрения. Рентгенография суставов кистей рук: остеопороз, сужение межсуставных щелей, множественные эрозии. Больному проводилось лечение – нестероидные противовоспалительные препараты (диклофенак в инъекциях, реопирин в инъекциях), магнитолазерная терапия, физиотерапия. Состояние без выраженной положительной динамики. Сохранялись субфебрилитет, припухлость суставов, усилилась скованность в суставах. СОЭ повысилась до 48 мм/час, СРБ 3+. Супрессорная активность Т-лимфоцитов периферической крови при индукции заявляемого средства, содержащего ТБГ и Ig-G, составила 20%. Назначены инъекции заявляемого средства, содержащего ТБГ и Ig-G (1:19), ежедневно. Состояние больного со значительным улучшением. Исчезла скованность в суставах, нормализовалась температура тела. Существенно уменьшились боли в суставах, их припухлость, увеличился объем движений в суставах. Больной свободно ходит по отделению. Активен. Возросла сила сжатия кистей рук с 5 мм рт. ст. до 90 мм рт. ст. (левая рука) и до 110 мм рт. ст. (правая рука). Полностью исчезли припухлость голеностопных и коленных суставов. Повысился уровень гемоглобина крови до 140 г/л. СОЭ снизилась до 22 мм/ч, СРБ стал 1+. При повторном анализе выявили повышение супрессорной активности Т-лимфоцитов периферической крови при индукции заявляемого средства – 60,4%. У больного в реакции Оухтерлони на 7, 14 и 28 дни антитела против заявляемого средства не выявлены. Больной в удовлетворительном состоянии выписан на амбулаторное лечение. С целью изучения безопасности заявляемого средства, состоящего из ТБГ и Ig-G, до его клинического применения проводили изучение его острой токсичности. Изучение острой токсичности проводили в соответствии с Методическими рекомендациями Фармакологического комитета РФ «Требования к доклиническому изучению общетоксичного действия новых фармакологических веществ», Москва, 2001 г. Результаты исследования показали, что при внутрибрюшинном введении 1000-кратной дозы заявляемого средства не оказывалось острого токсичного действия и при этих дозах оказалось невозможным достигнуть его LD50. Таким образом, предлагаемое средство, состоящее из ТБГ и Ig-G, не является токсичным. Хотя приведенные выше изобретения были описаны довольно подробно, для среднего специалиста в данной области будет вполне понятно, в свете описания этих изобретений, что могут быть сделаны определенные изменения и модификации изобретений без отхода от идеи или сферы действия предлагаемых формул изобретений. Промышленная применимость Изложенные преимущества предлагаемого средства, содержащего ТБГ и Ig, обеспечивают возможность широкого применения, как в научных исследованиях, так и в практической медицине, ветеринарии, а также в экспериментальной биохимии. Пример 14 Больной Б., 35 лет, с диагнозом: рассеянный склероз, церебро-спинальная форма, ремитирующее течение, стадия обострения процесса. Длительность заболевания – 5 лет. В неврологическом статусе: горизонтальный нистагм при взгляде вправо, сухожильные рефлексы живые, на ногах D>S. Брюшные рефлексы – верхние низкие, средние и нижние отсутствуют. Симптом Бабинского с двух сторон. Клонусы стоп, грубее справа. Парезов конечностей нет, мышечный тонус не изменен. Походка атактическая. В позе Ромберга неустойчив. Атаксия при выполнении пяточно-коленной пробы. Задержка мочеиспускания. Спинно-мозговая жидкость: белок – 0,7% реакция Ланге 66644322 Осмотр окулиста: побледнение височных половин дисков зрительных нервов. Активность Т-супрессоров периферической крови при индукции ТБГ – 14%. После введения ТБГ с иммуноглобулином на 2-й день у больного наступили признаки ремиссии. Нормализовалась походка, мочеиспускание. В позе Ромберга устойчив. Пяточно-коленную пробу выполняет четко. Повторная оценка имунного статуса выявила повышение функциональной активности Т-супрессоров периферической крови при индукции ТБГ – 40%. У больного в реакции Оухтерлони на 7,14 и 28 дни антитела против ТБГ не обнаружены. Пример 15 Больной П., 28 лет, находился в стационаре с диагнозом: Аутоиммунная тромбоцитопеническая пурпура. Госпитализирован с жалобами на появление сыпи, кровоизлияний на коже, головокружение, слабость, повышение температуры до 37,6°С. Заболел 3 дня назад после ОР3 – повысилась температура до 37,6°С, появились боли при мочеиспускании, изменился цвет мочи (моча приобрела красный цвет), появились геморрагические высыпания на коже. Госпитализирован. У родственников больного подобные заболевания отсутствуют. При поступлении: кожные покровы бледные. Мелкоточечные и петехиальные высыпания на коже груди, живота, спины, конечностей, склерах. Умеренное (до 1-1,5 см) увеличение подчелюстных лимфоузлов. Щитовидная железа не пальпируется, периферических отеков нет. Симптом щипка, жгута (+). В легких хрипов нет. Тоны сердца умеренно приглушены, тахикардия до 100 в одну минуту. Пульс ритмичный, удовлетворительного наполнения. АД 105/70 mm Hg. Живот мягкий, безболезненный. Печень, селезенка не увеличены. Симптом Пастернацкого (-). В анализе крови: Hb 98%, Э – 2,6, ретикулоцитов 12%, Л – 10,2, n – 2, сегм. – 68, лимф. – 21, м – 5, ЭОЗ – 4, СОЭ – 39 мм/ч. Тромбоциты 23 тыс. Общий ан. мочи: уд. вес 1021, белок – следы, Э – сплошь покрывают поле зрения. Л – 2-4 в поле зрения. Биохимический анализ крови: трансаминаза ACT – 39, АЛТ – 28, билирубин 18, холестерин 4,26, глюкоза 5,2, мочевина 4,8, общий белок 80 г/л. Время свертываемости крови 5 мин (N), продолжительность кровотечения по Дюку – 30 мин (норма 5-10). Активированное время рекальцификации 60 с (N), фибриноген 4,2, протромбин 84%, ретракция кровяного сгустка 0,1′ (N – 0,3-0,5). HBS – антиген (-), LE-клетки (-), ревмофактор (-), АНФ (-). Стернальная пункция: в костном мозге признаки раздражения эритроидного ростка, количество мегакариоцитов увеличено. Рентгеноскопия органов грудной клетки: Легочные поля прозрачны. Cor – в N. R-графия костей таза, черепа – без патологических отклонений. УЗИ печени, почек, селезенки – размеры и текстура органов не изменена. Чашечно-лоханочная система без особенностей. Конкрементов нет. После введения ТБГ с иммуноглобулином на 2-й день у больного наступили признаки ремиссии. Состояние больного с улучшением – температура нормализовалась, артралгии исчезли, гепатуриии нет, геморрагии исчезли. Уровень гемоглобина повысился до 136 г/л, число тромбоцитов увеличилось до 200 тыс. Время кровотечения и ретракция кровяного сгустка нормализовались. Больной выписан домой в удовлетворительном состоянии. Пример 16 Больная К., 43 лет, находилась на стационарном лечении с диагнозом: Аутоиммунный тиреоидит, хронический гастрит типа А (аутоиммунный), В12-дефицитная анемия. Поступила с жалобами на общую слабость, похудание, сердцебиение, онемение пальцев ног, неприятные ощущения в эпигастральной области после употребления пищи, нарушение сна, артралгии. В анамнезе хронический гастрит, тиреоидит, ухудшение состояния в течение последнего месяца – появились вышеуказанные жалобы, потеряла в весе 4 кг. При поступлении: Кожные покровы бледные с желтушным оттенком. Периферических отеков нет. Пальпируются подчелюстные лимфоузлы размером 1×1,2 см, мягкие, подвижные, умеренно чувствительные. Увеличение щитовидной железы 2-3 степени – железа при пальпации умеренно плотная, подвижная, не спаяна с окружающими тканями, поверхность ее гладкая. В легких дыхание везикулярное, хрипов нет. Cor-тоны звучные, тахикардия до 100 в минуту, пульс ритмичный, удовлетворительного наполнения, АД 120/80. Живот мягкий, слегка чувствительный в эпигастрии при глубокой пальпации. Язык красный (малиновый), сосочки атрофированы. Печень, селезенка не увеличены. Симптом Пастернацкого (-). Определяется мелкий тремор пальцев вытянутых рук, слегка выражено пучеглазие. Положительны симптомы Мебиуса, Дельримпля. Анализ крови: Hb – 86 г/л, цветной показатель 1,6. Лейкоциты 4,1, n – 1, сегм. 62, лимф. – 32, моноц. – 5. Тельца Жолли и Кэбота. Выражен мегалоцитоз. Определяются полисегментоядерные нейтрофилы, СОЭ – 48 мм/г. Тромбоциты – 120 тыс. Анализ мочи – уд. вес 1017, белок – abs, А – 3-4 в п/зрения. Биохимический анализ крови: трансаминазы ACT – 36, АЛТ – 41, холестерин 2,6, билирубин – 21,5, непр. 18, мочевина 5,7, глюкоза 4,3, общий белок 84,7, сывороточное железо 18 (норма). Альбумины – 41%, Глоб.: Стериальная пункция: в костном мозге смешанное нормо- и мегалобластическое кроветворение; красный росток раздражен. Картина B12-дефицитной анемии. Биопсия щитовидной железы: диффузная инфильтрация ткани железы лимфоцитами и плазматическими клетками, поля фиброза – картина аутоиммунного тиреоидита. Гастродуоденоскопия – картина атрофического гастрита. Гастробиопсия: атрофия желез, снижено количество париетальных клеток, инфильтрация слизистой оболочки плазматическими клетками и нейтрофильными лейкоцитами. Учитывая вышеизложенные данные, больной поставлен диагноз: Аутоиммунный тиреоидит, хронический гастрит типа А (аутоиммунный), обострение, B12-дефицитная анемия. После введения ТБГ с иммуноглобулином на 2-й день у больного наступили признаки ремиссии. Состояние больной с улучшением. Температура нормализовалась. Тахикардии нет. Уровень гемоглобина повысился до 128 г/л. Размеры щитовидной железы уменьшились до 1-2 ст. Больная прибавила в весе 1,5 кг. Титр антител к тиреоглобулину снизился в 4 раза. Число лейкоцитов возросло до 6.8, тромбоцитов до 220 тыс. Больная выписана на амбулаторное лечение. Пример 17. Исследовали действие средства, состоящего из ТБГ и Ig-M, на пролиферативную активность мононуклеарных клеток периферической крови, выделенных по методу Boyum, 1969 г. Диапазон используемых доз составлял 1 мкг/мл – 960 мкг/мл. Результаты исследований отражены в таблице 11.
Как видно из таблицы 11, средство, состоящее из ТБГ и Ig-M, подавляет пролиферативную активность мононуклеарных клеток периферической крови, вызванную фитогемагглютинином, в 2 раза сильнее, чем чистый ТБГ. Пример 18. Исследовали влияние заявляемого средства, состоящего из ТБГ и Ig-M, на способность индуцировать супрессорную активность мононуклеарных клеток периферической крови (см. методику ранее). Результаты исследований влияния средства, состоящего из ТБГ и Ig-M, на способность индуцировать супрессорную активность МНС отражены в таблице 12. Диапазон доз 1-960 мкг/мл.
Как видно из таблицы 12, средство, состоящее из ТБГ и Ig-M, индуцирует супрессорную активность мононуклеарных клеток периферической крови, в 2 раза сильнее, чем чистый ТБГ. Пример 19. Исследовали влияние средства, состоящего из ТБГ и Ig-M, на способность индуцировать продукцию цитокинов-трансформирующего фактора роста бета 1 (ТФР – В результате проведенных исследований было установлено, что средство, содержащее ТБГ и Ig-M, обладает способностью индуцировать продукцию одновременно 2-х цитокинов – ТФР- При этом уровень цитокинов ИЛ-10 и ТФР- Пример 20. Исследовали действие средства, состоящего из ТБГ и Ig-M, в соотношении ТБГ и Ig-M (1:99), на пролиферативную активность мононуклеарных клеток периферической крови, выделенных по методу Boyum, 1969 г. Диапазон используемых доз составлял 1 мкг/мл – 960 мкг/мл. Результаты исследований отражены в таблице 13.
Как видно из таблицы 13, средство, состоящее из ТБГ и Ig-M в соотношении 1:99, подавляет пролиферативную активность мононуклеарных клеток периферической крови, вызванную фитогемагглютинином, в такой степени, как и заявляемое средство, содержащее ТБГ и Ig-M в соотношении 1:19. Пример 21. Исследовали действие средства, состоящего из ТБГ и Ig-M, в соотношении ТБГ и Ig-M (1:1,5), на пролиферативную активность мононуклеарных клеток периферической крови, выделенных по методу Boyum, 1969 г. Диапазон используемых доз составлял 1 мкг/мл – 960 мкг/мл. Результаты исследований отражены в таблице 14.
Как видно из таблицы 14, средство, состоящее из ТБГ и Ig-M в соотношении 1:1,5, подавляет пролиферативную активность мононуклеарных клеток периферической крови, вызванную фитогемагглютинином, в такой степени, как и заявляемое средство, содержащее ТБГ и Ig-M в соотношениях 1:19 и 1:99. Пример 22. Исследовали действие средства, состоящего из ТБГ и Ig-M, в соотношении ТБГ и Ig-M (1:9), на пролиферативную активность мононуклеарных клеток периферической крови, выделенных по методу Boyum, 1969 г. Диапазон используемых доз составлял 1 мкг/мл – 960 мкг/мл. Результаты исследований отражены в таблице 15.
Как видно из таблицы 15, средство, состоящее из ТБГ и Ig-M в соотношении 1:9, подавляет пролиферативную активность мононуклеарных клеток периферической крови, вызванную фитогемагглютинином, в такой степени, как и заявляемое средство, содержащее ТБГ и Ig-M в соотношениях 1:19, 1:99 и 1:1,5. Пример 23. Исследовали действие средства, состоящего из ТБГ и Ig-M, в соотношении ТБГ и Ig-M (1:1), на пролиферативную активность мононуклеарных клеток периферической крови, выделенных по методу Boyum, 1969 г. Диапазон используемых доз составлял 1 мкг/мл – 960 мкг/мл. Результаты исследований отражены в таблице 16.
Как видно из таблицы 16, средство, состоящее из ТБГ и Ig-M в соотношении 1:9, подавляет пролиферативную активность мононуклеарных клеток периферической крови, вызванную фитогемагглютинином, в такой степени, как и заявляемое средство, содержащее ТБГ и Ig-M в соотношениях 1:19, 1:99, 1:9 и 1:1,5. Пример 24. Результаты исследований влияния средства, состоящего из ТБГ и Ig-M в соотношении 1:99, на способность индуцировать супрессорную активность МНС отражены в таблице 17. Диапазон доз 1-960 мкг/мл.
Как видно из таблицы 17, средство, состоящее из ТБГ и Ig-M в соотношении 1:99, индуцирует супрессорную активность мононуклеарных клеток периферической крови в такой же степени, как и средство, содержащее ТБГ и Ig-M в соотношении 1:19, и индуцирует продукцию цитокинов-трансформирующего фактора роста бета 1 (ТФР- Пример 25. Результаты исследований влияния средства, состоящего из ТБГ и Ig-M в соотношении 1:9, на способность индуцировать супрессорную активность МНС отражены в таблице 18. Диапазон доз 1-960 мкг/мл.
Как видно из таблицы 18, средство, состоящее из ТБГ и Ig-M в соотношении 1:9, индуцирует супрессорную активность мононуклеарных клеток периферической крови в такой же степени, как и средство, содержащее ТБГ и Ig-M в соотношениях 1:19, 1:99, и индуцирует продукцию цитокинов-трансформирующего фактора роста бета 1 (ТФР- Пример 26. Результаты исследований влияния средства, состоящего из ТБГ и Ig-M в соотношении 1:1,5, на способность индуцировать супрессорную активность МНС отражены в таблице 19. Диапазон доз 1-960 мкг/мл.
Как видно из таблицы 19, средство, состоящее из ТБГ и Ig-M в соотношении 1:1,5, индуцирует супрессорную активность мононуклеарных клеток периферической крови в такой же степени, как и средство, содержащее ТБГ и Ig-M в соотношениях 1:19, 1:99 и 1:9, и индуцирует продукцию цитокинов-трансформирующего фактора роста бета 1 (ТФР- Пример 27. Результаты исследований влияния средства, состоящего из ТБГ и Ig-M в соотношении 1:1, на способность индуцировать супрессорную активность МНС отражены в таблице 20. Диапазон доз 1-960 мкг/мл.
Как видно из таблицы 20, средство, состоящее из ТБГ и Ig-M в соотношении 1:1, индуцирует супрессорную активность мононуклеарных клеток периферической крови в такой же степени, как и средство, содержащее ТБГ и Ig-M в соотношениях 1:19, 1:99, 1:9 и 1:1,5, и индуцирует продукцию цитокинов-трансформирующего фактора роста бета 1 (ТФР- Пример 28. Исследовали действие средства, состоящего из ТБГ и Ig-A, на пролиферативную активность мононуклеарных клеток периферической крови, выделенных по методу Boyum, 1969 г. Диапазон используемых доз составлял 1 мкг/мл – 960 мкг/мл. Результаты исследований отражены в таблице 21.
Как видно из таблицы 21, средство, состоящее из ТБГ и Ig-A, подавляет пролиферативную активность мононуклеарных клеток периферической крови, вызванную фитогемагглютинином, в 2 раза сильнее, чем чистый ТБГ. Пример 29. Исследовали влияние заявляемого средства, состоящего из ТБГ и Ig-A, на способность индуцировать супрессорную активность мононуклеарных клеток периферической крови (см. методику ранее). Результаты исследований влияния средства, состоящего из ТБГ и Ig-A, на способность индуцировать супрессорную активность МНС отражены в таблице 22. Диапазон доз 1-960 мкг/мл.
Как видно из таблицы 22, средство, состоящее из ТБГ и Ig-A, индуцирует супрессорную активность мононуклеарных клеток периферической крови в 2 раза сильнее, чем чистый ТБГ. Пример 30. Исследовали влияние средства, состоящего из ТБГ и Ig-A, на способность индуцировать продукцию цитокинов-трансформирующего фактора роста бета 1 (ТФР – В результате проведенных исследований было установлено, что средство, содержащее ТБГ и Ig-A, обладает способностью индуцировать продукцию одновременно 2-х цитокинов – ТФР- При этом уровень цитокинов ИЛ-10 и ТФР- Пример 31. Исследовали действие средства, состоящего из ТБГ и Ig-A, в соотношении ТБГ и Ig-A (1:99), на пролиферативную активность мононуклеарных клеток периферической крови, выделенных по методу Boyum, 1969 г. Диапазон используемых доз составлял 1 мкг/мл – 960 мкг/мл. Результаты исследований отражены в таблице 23.
Как видно из таблицы 23, средство, состоящее из ТБГ и Ig-A в соотношении 1:99, подавляет пролиферативную активность мононуклеарных клеток периферической крови, вызванную фитогемагглютинином, в такой степени, как и заявляемое средство, содержащее ТБГ и Ig-A в соотношении 1:19. Пример 32. Исследовали действие средства, состоящего из ТБГ и Ig-A, в соотношении ТБГ и Ig-A (1:1,5), на пролиферативную активность мононуклеарных клеток периферической крови, выделенных по методу Boyum, 1969 г. Диапазон используемых доз составлял 1 мкг/мл – 960 мкг/мл. Результаты исследований отражены в таблице 24.
Как видно из таблицы 24, средство, состоящее из ТБГ и Ig-A в соотношении 1:1,5, подавляет пролиферативную активность мононуклеарных клеток периферической крови, вызванную фитогемагглютинином, в такой степени, как и заявляемое средство, содержащее ТБГ и Ig-A в соотношениях 1:19 и 1:99. Пример 33. Исследовали действие средства, состоящего из ТБГ и Ig-A, в соотношении ТБГ и Ig-A (1:9), на пролиферативную активность мононуклеарных клеток периферической крови, выделенных по методу Boyum, 1969 г. Диапазон используемых доз составлял 1 мкг/мл – 960 мкг/мл. Результаты исследований отражены в таблице 25.
Как видно из таблицы 25, средство, состоящее из ТБГ и Ig-A в соотношении 1:9, подавляет пролиферативную активность мононуклеарных клеток периферической крови, вызванную фитогемагглютинином, в такой степени, как и заявляемое средство, содержащее ТБГ и Ig-A в соотношениях 1:19, 1:99 и 1:1,5. Пример 34. Исследовали действие средства, состоящего из ТБГ и Ig-A, в соотношении ТБГ и Ig-A (1:1), на пролиферативную активность мононуклеарных клеток периферической крови, выделенных по методу Boyum, 1969 г. Диапазон используемых доз составлял 1 мкг/мл – 960 мкг/мл. Результаты исследований отражены в таблице 26.
Как видно из таблицы 25, средство, состоящее из ТБГ и Ig-A в соотношении 1:9, подавляет пролиферативную активность мононуклеарных клеток периферической крови, вызванную фитогемагглютинином, в такой степени, как и заявляемое средство, содержащее ТБГ и Ig-A в соотношениях 1:19, 1:99, 1:9 и 1:1,5. Пример 35. Результаты исследований влияния средства, состоящего из ТБГ и Ig-A в соотношении 1:99, на способность индуцировать супрессорную активность МНС отражены в таблице 27. Диапазон доз 1-960 мкг/мл.
Как видно из таблицы 27, средство, состоящее из ТБГ и Ig-A в соотношении 1:99, индуцирует супрессорную активность мононуклеарных клеток периферической крови в такой же степени, как и средство, содержащее ТБГ и Ig-A в соотношении 1:19, и индуцирует продукцию цитокинов-трансформирующего фактора роста бета 1 (ТФР- Пример 36. Результаты исследований влияния средства, состоящего из ТБГ и Ig-A в соотношении 1:9, на способность индуцировать супрессорную активность МНС отражены в таблице 28. Диапазон доз 1-960 мкг/мл.
Как видно из таблицы 28, средство, состоящее из ТБГ и Ig-A в соотношении 1:9, индуцирует супрессорную активность мононуклеарных клеток периферической крови в такой же степени, как и средство, содержащее ТБГ и Ig-A в соотношениях 1:19, 1:99, и индуцирует продукцию цитокинов-трансформирующего фактора роста бета 1 (ТФР- Пример 37. Результаты исследований влияния средства, состоящего из ТБГ и Ig-G в соотношении 1:1,5, на способность индуцировать супрессорную активность МНС отражены в таблице 29. Диапазон доз 1-960 мкг/мл.
Как видно из таблицы 29, средство, состоящее из ТБГ и Ig-A в соотношении 1:1,5, индуцирует супрессорную активность мононуклеарных клеток периферической крови в такой же степени, как и средство, содержащее ТБГ и Ig-A в соотношениях 1:19, 1:99 и 1:9, и индуцирует продукцию цитокинов-трансформирующего фактора роста бета 1 (ТФР- Пример 38. Результаты исследований влияния средства, состоящего из ТБГ и Ig-A в соотношении 1:1, на способность индуцировать супрессорную активность МНС отражены в таблице 30. Диапазон доз 1-960 мкг/мл.
Как видно из таблицы 30, средство, состоящее из ТБГ и Ig-A в соотношении 1:1, индуцирует супрессорную активность мононуклеарных клеток периферической крови в такой же степени, как и средство, содержащее ТБГ и Ig-A в соотношениях 1:19, 1:99, 1:9 и 1:1,5, и индуцирует продукцию цитокинов-трансформирующего фактора роста бета 1 (ТФР-
Формула изобретения
1. Средство, обладающее свойством индуцировать супрессорную активность мононуклеарных клеток и секрецию ими цитокинов, содержащее трофобластический 2. Средство по п.1, отличающееся тем, что в качестве иммуноглобулина используют иммуноглобулин класса G (Ig-G) или класса А (Ig-А) или класса М (IG-M). 3. Средство по п.1, отличающееся тем, что ТБГ и Ig-G взяты в равных долях. 4. Средство по п.1, отличающееся тем, что ТБГ и Ig-G взяты в долях, соотношение которых составляет 1:19 соответственно. 5. Применение средства, обладающего свойством индуцировать супрессорную активность мононуклеарных клеток и секрецию ими цитокинов, содержащего ТБГ и иммуноглобулин (Ig), для лечения аутоиммунных заболеваний. 6. Применение средства по п.5, отличающееся тем, что в качестве иммуноглобулина используют иммуноглобулин класса G (Ig-G), или класса А (Ig-А), или класса М (IG-M). 7. Применение средства по п.6, отличающееся тем, что ТБГ и Ig-G взяты в равных долях. 8. Применение средства по п.6, отличающееся тем, что ТБГ и Ig-G взяты в долях, соотношение которых составляет 1:19 соответственно. 9. Применение средства по п.5, отличающееся тем, что его вводят парэнтерально.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

 -1-гликопротеин (ТБГ) и иммуноглобулин (Ig) класса G или А или М. Согласно второму изобретению для лечения аутоиммунных заболеваний применяют средство, содержащее ТБГ и Ig, класса G или А или М, которое вводят парэнтерально. Изобретение обеспечивает ускоренный клинический эффект на стадии обострения аутоиммунного заболевания. 2 н. и 7 з.п.ф-лы, 30 табл.
-1-гликопротеин (ТБГ) и иммуноглобулин (Ig) класса G или А или М. Согласно второму изобретению для лечения аутоиммунных заболеваний применяют средство, содержащее ТБГ и Ig, класса G или А или М, которое вводят парэнтерально. Изобретение обеспечивает ускоренный клинический эффект на стадии обострения аутоиммунного заболевания. 2 н. и 7 з.п.ф-лы, 30 табл.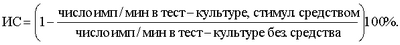
 1 – 3,6,
1 – 3,6,  – 28,2%, Ревмофактор (-), LE-клетки не определяются. Определяются антитела к тиреоглобулину в высоком титре. Уровень Т3 и Т4 умеренно повышены. HBS-антиген (-).
– 28,2%, Ревмофактор (-), LE-клетки не определяются. Определяются антитела к тиреоглобулину в высоком титре. Уровень Т3 и Т4 умеренно повышены. HBS-антиген (-).