|
|
(21), (22) Заявка: 2005128959/13, 19.09.2005
(24) Дата начала отсчета срока действия патента:
19.09.2005
(46) Опубликовано: 10.06.2007
(56) Список документов, цитированных в отчете о
поиске:
US 5411867, 02.05.1995. MACKENZIE et al. «Perfomance of the ImmunoCard STAT! E.coli O157:H7 Test for detection of Escherichia coli O157:H7 in stools», Journal of clinical microbiology, 2000, v.38, №5, с.1866-1868. ТЕРТОН М. и др. Новые методы иммуноанализа. – М.: Мир, 1991.
Адрес для переписки:
119991, Москва, ГСП-1, В-334, Ленинский пр-т, 32А, комн.707, ИПРИМ РАН
|
(72) Автор(ы):
Зарайский Евгений Ильич (RU),
Яновский Юрий Григорьевич (RU),
Карнет Юлия Николаевна (RU),
Ковалев Геннадий Николаевич (RU),
Снегирева Наталия Сергеевна (RU)
(73) Патентообладатель(и):
Институт прикладной механики Российской Академии Наук (ИПРИМ РАН) (RU)
|
(54) СПОСОБ ИММУНОХРОМАТОГРАФИЧЕСКОГО ОПРЕДЕЛЕНИЯ БАКТЕРИИ ESCHERICHIA COLI В ВОДЕ
(57) Реферат:
Изобретение относится к биотехнологии. Предложен способ иммунохроматографического определения Escherichia coli в воде с использованием тест-полоски. Тест-полоска состоит из частей А, В и С, монтируемых на подложке D таким образом, что часть А на 1-2 мм перекрывает часть В. При этом А представляет собой инертный пористый носитель из стекловолокна (ПЭД) с нанесенной на его поверхность реакционной зоной 1 (с нанесенным конъюгатом кроличьих моноспецифических антител против E.coli с пероксидазой хрена), и реакционной зоной 2 (с нанесенным конъюгатом мышиных моноклональных антител против пероксидазы хрена меченных коллоидным золотом). Конъюгаты нанесены в реакционной зоне параллельными полосами в центральной области ПЭД перпендикулярно току жидкости на расстоянии 2 мм друг от друга. Часть В тест-полоски представляет собой нитроцеллюлозу, иммобилизованную на лавсановое основание, на поверхность которой нанесена тест-зона 6 и контрольная зона 7. Тест-зона 6 представляет зону с нанесенными полосой параллельно длинной стороне тест-полоски в 2 мм от середины нитроцеллюлозы кроличьими моноспецифическими антителами против E.coli. Контрольная зона 7 представляет зону с нанесенными параллельной полосой на 3 мм от середины ближе с отсасывающему фильтру С кроличьими моноспецифическими антителами против иммуноглобулинов мыши. При этом В имеет капиллярную связь с реакционной зоной носителя А. С-отсасывающий фильтр для поглощения непрореагировавших реагентов. Решение о наличии Escherichia coli принимают по наличию окраски тест-зоны 6. Окраска контрольной зоны свидетельствует о работоспособности тест-полоски. Использование изобретения обеспечивает универсальность определения полоски на любые типы штаммов Escherichia coli с чувствительностью 1-10-8 г/мл. 3 ил.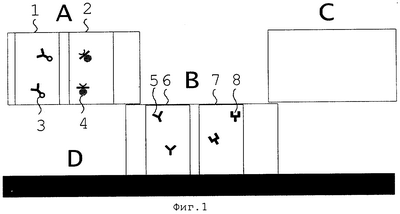
Изобретение относится к иммунологии, экологии и санитарии. Разработан метод экспресс-диагностики бактериального загрязнения окружающей среды, основанный на иммунохроматографическом (ИХ) определении наличия бактерии Escherichia coli (E.coli) в воде. Сущность изобретения состоит в использовании четырехслойного иммунохроматографического анализа с использованием моноспецифических и моноклональных антител. Моноспецифические антитела (МСАТ) к E.coli, иммобилизованные в тест-зоне ИХ-стрипа на нитроцеллюлозной мембране, реагируют с антигенами (АГ) E.coli в образце воды в процессе тангенциального перемещения материала образца по ИХ-стрипу. Одновременно происходит связывание конъюгата (КГ) МСАТ с пероксидазой хрена (ПХ) с АГ и конъюгата моноклональных антител (MAT) к пероксидазе хрена (ПХ) с коллоидными частицами (КЧ). В результате в тест-зоне иммунохроматографического стрипа образуется комплекс МСАТ-АГ-КГМСАТ ПХ-КГ MAT КЧ. Образовавшийся комплекс позволяет визуализировать наличие АГ E.coli в исследуемой пробе. Обнаружение E.coli таким методом, который относится к твердофазным реакциям типа «четырехслойный сэндвич», позволяет в течение нескольких минут оценить бактериальную загрязненность водоисточника.
УРОВЕНЬ ТЕХНИКИ
Стихийные бедствия и антропогенные катастрофы приводят как к локальным, так и обширным загрязнениям окружающей среды, в частности водоисточников. Для мониторинга состояния водоисточников, особенно питьевых, санитарными службами используется детекция санитарно значимых возбудителей инфекций или микроорганизмов, сопутствующих им. При повреждении под действием землетрясений, наводнений, цунами, а также при террористических актах, антропогенных катастрофах и халатном содержании очистных сооружений их содержимое может попадать в акваторию различных водоисточников, в том числе служащих для забора питьевой воды.
Общепризнанным маркером такого загрязнения водных ресурсов служит микроорганизм Е.coli (представитель нормальной микрофлоры кишечника человека и животных) иногда вызывающий заболевания.
Роль Е.coli в нормальной физиологии человека многообразна: участвует в пищеварении, является продуцентом витаминов группы В, К, Е; выполняет антагонистическую функцию по отношению к патогенным микроорганизмам, выделяют особые вещества – колицины.
Морфологически E.coli грам-палочки, имеют pili common для адгезии и sex для конъюгации. Спор и капсул нет. Факультативные анаэробы, очень биохимически активны, в классической микробиологии дифференцируются с помощью сред, содержащие лактозу. E.coli ферментируют лактозу среди многих enterobacterea, которые ее не ферментируют. Лактозу содержат среды – Эндо, Левена, Плоскирева. Роль E.coli в патологии человека: выделяют следующие патогенные варианты внутри вида:
энтеропатогенные кишечные палочки – вызывают заболевание coli-энтеротиты, чаще всего у новорожденных;
энтеротоксигенные кишечные палочки – вызывают холероподобные заболевания. Выделяют экзотоксин;
энтероинвазивные кишечные палочки – вызывают дизентериеподобные заболевания.
Оценка наличия E.coli на сегодня решается путем анализа в микробиологических лабораториях санэпидстанций (СЭС). Эти исследования занимают от одних до нескольких суток, они требуют специальных лабораторных условий (методические указания МУК 4.2.577-96) и обученного персонала и не могут быть применены в полевых условиях для экстренного мониторинга пострадавших водоисточников.
Также известен способ экспресс определения E.coli с помощью иммунопреципитации (Feldsine et all 1997. Escherichia coli O157:Н7 Visual Immunoprecipitation assay: a comparative validation study. J.AOAC 80:43-48). Недостатком данного метода является длительность постановки (несколько часов) и необходимость наличия лабораторных условий, а также невысокая чувствительность.
Значительно более чувствительным является флуоресцентный анализ (Feng, P.C.S., and P.A.Hartman. 1982. Fluorogenic assays for immediate confirmation of Escherichia coli. Appl. Environ. Microbiol. 43:1320-1329) и его экспресс модификации (Moberg, L.J. et all 1988. Fluorogenic assay for rapid detection of Escherichia coli in chilled and frozen foods: collaborative study. J. Assoc. Off. Anal. Chem. 71:589-602). Их недостатком также является необходимость наличия дорогостоящей лабораторной техники и обученного персонала. Те же недостатки присущи биохимическому (Hartman, P.A. 1989. The MUG (glucuronidase) test for Escherichia coli in food and water, pp.290-308. In: Rapid Methods and Automation in Microbiology and Immunology. A.Balows, R.C.Tilton, and A.Turano (eds). Brixia Academic Press, Brescia, Italy) и наиболее чувствительному ПЦР методу.
Наиболее близким к заявляемому является иммунохроматографический метод определения патогенного штамма E.coli O157:Н7 (Andrew Mackenzie at all. Performance of the ImmunoCard STAT! E.coli O157:H7 Test for Detection of Escherichia coli O157:H7 in Stools Journal of Clinical Microbiology, May 2000, p.1866-1868, Vol.38, №5), принятый в качестве прототипа.
Указанный способ иммунохроматографического определения Escherichia coli в воде состоит в том, что водную среду с обнаруживаемым в ней антигеном Escherichia coli наносят на входной конец тест-полоски, перемещают фронт водной среды за счет капиллярных сил через реакционную зону, обладающую маркерными свойствами и свойствами афинного соответствия с Escherichia coli, далее перемещают фронт водной среды через тест-зону к контрольной зоне с растворением в перемещаемой водной среде реагентов, отвечающих за связывание антигена и за его маркерные свойства, при этом комплекс, состоящий из антигена, афинно соответствующего ему реагента и маркера, иммобилизуют в тест-зоне, а комплекс, содержащий реагент, афинно соответствующий антигену, и маркерный реагент, иммобилизуют в контрольной зоне, а избыток реагентов за контрольной зоной поглощают пористым носителем, причем в качестве маркерного реагента используют конъюгат частиц коллоидного золота с моноклональным антителом, а по окраске тест-зоны либо контрольной зоны принимают решение о наличии Escherichia coli в исследуемой пробе либо, соответственно, о работоспособности тест-полоски, что совпадает с существенными признаками предлагаемого изобретения.
При этом в способе-прототипе для образования маркерного комплекса использовался конъюгат частиц коллоидного золота с моноклональным антителом к обнаруживаемому штамму Escherichia coli.
Таким образом, существо известного способа состоит в том, что искомая бактерия – антиген (АГ) переносится фронтом водной среды вдоль ИХ-полоски. В первой, т.н. реагентной зоне она сцепляется с маркером – частицей коллоидного (КЧ) золота, растворенного в водной среде, продольно перемещающейся вдоль ИХ-полоски за счет капиллярных сил. В следующей, т.н. индикаторной зоне образовавшийся конъюгат АГ-КЧ иммобилизуется за счет связывания с реагентом, афинно соответствующим АГ, окрашивая эту область и таким образом позволяя визуально определить наличие АГ в анализируемой пробе. Одновременно КЧ мигрируют из реагентной зоны в индикаторную, не связываются там и перемещаются далее в контрольную зону, где иммобилизуются, окрашивают контрольную зону, подтверждая работоспособность тест-полоски.
В данном способе-прототипе с помощью трехслойного ИХ анализа в течение 10 минут удавалось выявлять наличие штамма E.coli с высокой чувствительностью и специфичностью. Недостатком данного метода является невозможность выявления других серотипов Е. coli.
Итак, недостаток способа-прототипа [2] состоит в ухудшении следующих характеристик:
– панорамности анализа;
– эффективности анализа;
– надежности оценки эпидемиологической ситуации.
Соответственно, требуемый при реализации устройства технический результат состоит в устранении вышеуказанных недостатков.
Список чертежей
Фиг.1. Принципиальная схема устройства иммунохроматографического стрипа, реализующего предлагаемый способ иммунохроматографического определения Escherichia coli в воде (по п.1 формулы);
Фиг.2. Расположение реагентов и воды (показана заливкой серым цветом) в начале реакции;
Фиг.3. Расположение реагентов и воды (показана заливкой серым цветом) на конечной стадии реакции,
где использованы следующие обозначения составных элементов указанного устройства и обозначены основные этапы его функционирования:
А. ПЭД.
В. Нитроцеллюлозная мембрана.
С. Отсасывающий фильтр.
D. Монтирующая подложка.
1. Зона нанесения конъюгата (КГ) кроличьих моноспецифических антител против E.coli с пероксидазой хрена (ПХ).
2. Зона нанесения конъюгата мышиных моноклональных антител против пероксидазы хрена меченных коллоидным золотом.
3. Конъюгат кроличьих моноспецифических антител против E.coli с пероксидазой хрена.
4. Конъюгат мышиных моноклональных антител против пероксидазы хрена, меченный коллоидным золотом.
5. Кроличьи моноспецифические антитела против E.coli.
6. Тест-зона (опытная зона).
7. Контрольная зона.
8. Кроличьи моноспецифические антитела против иммуноглобулинов мыши.
Серым цветом обозначено заполнение участков иммунохроматографического стрипа жидкостью,
9. Антиген E.coli.
10. Образование комплекса: (Е.coli)-конъюгат (кроличьих моноспецифических антител против E.coli с пероксидазой хрена) – (моноклональные антитела против пероксидазы хрена, меченные коллоидным золотом).
11. Образование комплекса: (кроличьи моноспецифические антитела против Е.coli) – (Е.coli)-конъюгат (кроличьих моноспецифических антител против E.coli с пероксидазой хрена) – (моноклональные антитела против пероксидазы хрена, меченные коллоидным золотом).
12 Образование комплекса: конъюгат (мышиных моноклональных антител против пероксидазы хрена меченных коллоидным золотом) – (кроличьи моноспецифические антитела против иммуноглобулинов мыши).
13. Несвязавшиеся продукты реакции.
На фиг.1 схематично показана последовательность расположения реакционной зоны, состоящей из областей 1 и 2, а также тест-зоны, контрольной зоны и отсасывающего фильтра на поверхности монтирующей подложки D (подразумевается прилегание зон А, В, С, к D). Также показано распределение реагентов 3, 4, 5, 8 в областях 1, 2, 6 и 7. На фиг.2 показано образование комплекса из реагентов 9 и 3: (Е.coli)-конъюгат (кроличьих моноспецифических антител против E.coli с пероксидазой хрена), а также комплекса 10 из реагентов 3, 4, 9.
На фиг.3 показано образование комплекса 11 из реагентов 9, 3, 4 и 5, чем обеспечивается фиксация маркера 4 в тест-зоне. При этом в зоне 7 образуется комплекс 12 из реагентов 4, 8, либо из реагентов 3,4,8 (не показано).
Непрореагировавшие реагенты 13 (3 и 4) поглощаются в зоне С.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Для устранения недостатков известного технического решения, в связи с тем, что не существует универсального маркера для всех серотипов E.coli, нами был предложен четырехслойный двухконъюгатный ИХ-анализ для экспресс определения любых микроорганизмов данного вида в воде.
С учетом этого разработан способ иммунохроматографического определения Escherichia coli в воде, состоящий в том, что водную среду с обнаруживаемым в ней антигеном 9 Escherichia coli наносят на входной конец тест-полоски, перемещают фронт водной среды за счет капиллярных сил через реакционную зону, состоящую из областей 1 и 2, обладающую маркерными свойствами (зона 2) и свойствами афинного соответствия с Escherichia coli 9 (зона 1), далее перемещают фронт водной среды через тест-зону 6 к контрольной зоне 7 с растворением в перемещаемой водной среде реагентов, отвечающих за связывание антигена 9 и за его маркерные свойства, при этом комплекс 11, состоящий из антигена 9, афинно соответствующего ему реагента 3 и маркера 4 иммобилизуют в тест-зоне 6, а комплекс 12, содержащий реагент, афинно соответствующий антигену, и маркерный реагент 4, иммобилизуют в контрольной зоне 7, а избыток реагентов за контрольной зоной 7 поглощают отсасывающим фильтром С, причем в качестве маркерного реагента 4 используют конъюгат частиц коллоидного золота с моноклональным антителом, а по окраске тест-зоны 6 либо контрольной зоны 7 принимают решение о наличии Escherichia coli 9 в исследуемой пробе либо, соответственно, о работоспособности тест-полоски, что совпадает с существенными признаками способа-прототипа.
При этом в реакционной зоне (1, 2) выполняют последовательно операцию связывания антигена 9 Escherichia coli с конъюгатом моноспецифического антитела к Escherichia coli с пероксидазой хрена 3 и операцию связывания полученного комплекса с маркерным реагентом 4, содержащим моноклональные антитела к пероксидазе хрена.
Кроме того, в качестве биохимического реагента контрольной зоны 7 используют кроличьи антитела против иммуноглобулинов мыши.
Кроме того, в качестве пористого носителя реагентной зоны используют ПЭД А (инертный пористый носитель из стекловолокна), а в качестве пористого носителя тест-зоны 6 и контрольной зоны 7 используют слой В нитроцелюлозы, нанесенный на лавсановое основание и имеющий капиллярную связь с пористым носителем реагентной зоны (ПЭД). Все элементы А, В, С монтируются на подложке D внахлест, как показано на фиг.1-3.
Работа предлагаемого способа, как и прототипа, основана на связывании конъюгированных и неконъюгированных МСАТ с различными эпитопами комплексного антигена на поверхности E.coli, иммобилизации полученного комплекса в «тест-зоне» на нитроцеллюлозе и визуализации его конъюгатом антител к пероксидазе хрена (ПХ) с коллоидными частицами (КЧ).
В процессе реакции выявления исследуемого антигена водный образец наносят в зону ПЭДа А. Он растворяет конъюгаты и в процессе растворения образуется комплекс АГ-КГ(МСАТПХ)-КГ(МАТКЧ) конъюгатов с присутствующим в образце антигеном 9. Под действием капиллярных сил происходит тангенциальная миграция комплекса в тест-зону 6, где предварительно иммобилизируют МСАТ 5 к антигену 9 Е.coli. В этой зоне (в случае наличия в образце исследуемого антигена) образуется комплекс МСАТ-АГ-КГ(МСАТПХ)-КГ(МАТКЧ). Так как для реакции применяются окрашенные коллоидные частицы 4, этот комплекс визуализируется и дает возможность бесприборного обнаружения исследуемого антигена 9 в исследуемом образце воды. Комплексы, не содержащие АГ 9, но содержащие КЧ 4, мигрируют в контрольную зону 7, окрашивая ее и подтверждая тем самым работоспособность ИХ-полоски. Излишки несвязавшегося конъюгата и антигена мигрируют в отсасывающий фильтр С.
Для определения E.coli 9 оправдано добавление 4 слоя в реакции. Это связано с тем, что для конъюгации с коллоидными частицами 4 используют только моноклональные антитела, так как моноспецифические антитела обладают различными изоэлектрическими точками и поэтому непригодны для получения стабильных конъюгатов с КЧ 4. Получение же моноклональных антител против E.coli 9 невозможно в силу отсутствия видоспецифического антигена, общего для всех серотипов этого микроорганизма. Получение же стабильного конъюгата AT с ПХ 3 не является сложной задачей и широко используется в иммунологии.
ПРИМЕР Получение аффинных моноспецифических антител. Суспензионную культуру E.coli непатогенного штамма трижды отмывали в забуференном физрастворе рН 7,2-7,4 аликвотировали и замораживали при температуре -70°С. Готовили иммуносорбент из BrCN- сефарозы (Pfarmacia) и суспензии E.coli из расчета 20 мг суспензии на 1 мл сефарозы (Pharmacia) по инструкции к сефарозе. Гипериммунную сыворотку получали иммунизируя кроликов АГ E.coli по следующей схеме: 0,5 мг АГ Е.coli в полном адьюванте Фрейнда вводили внутримышечно в 5 точек, а затем дважды с интервалом в 2 недели иммунизацию повторяли из расчета 0,5 мг АГ в неполном адьюванте Фрейнда в четыре точки. Через месяц после третьей иммунизации из кроликов получали сыворотку трижды отбирая кровь из ушной вены с интервалом в три дня между заборами. Сыворотку, предварительно истощенную убитой нагреванием культурой Salmonella sp. из расчета 1 г культуры на 100 мл сыворотки наносили на аффинную колонку с полученным ранее иммуносорбентом из расчета 5 мл сыворотки на 1 мл сорбента, инкубировали в течение ночи и отмывали от несвязавшихся белков избытком фосфатно-солевого буфера рН 7,2-7,4 и снимали аффинные антитела 50 мМ глицин-HCl буфером рН 2,3 под контролем проточного спектрофотометра. Полученные антитела нейтрализовали сухим TRIS до рН 7,2-7,4 и диализовали против 50 мМ фосфатносолевого буфера рН 7,2-7,4. Конъюгацию моноспецифических антител с пероксидазой хрена проводили периодатным методом (Fuchs В.В. et all. Biotechnology and applied biochemistry, 1988, №10, p.273-286). Конъюгацию моноклональных антител к пероксидазе хрена с КЧ в качестве которых использовали коллоидное золото с диаметром частиц 30 нм (BioCell) проводили, как описано в патенте Fuchs et. all (US patent 5968758, Oct.19, 1999). Конъюгаты наносили параллельными полосами в центральной области ПЭДа перпендикулярно току жидкости на расстоянии 2 мм друг от друга и после высушивания монтировали на одной из клеящих зон ИХ-блока CNPF-PD31-L2-P25 (MDI Индия), включающего нитроцеллюлозу с диаметром пор 20 мкм таким образом, чтобы ПЭД на 1-2 мм перекрывал нитроцеллюлозу. На противоположную клеящую зону блока внахлест монтировали фильтровальную бумагу. В 2 мм от середины нитроцеллюлозы параллельно длинной стороне блока наносили полосу МСАТ к E.coli, а на 3 мм ближе к отсасывающему фильтру параллельно ей наносили полосу МСАТ к иммуноглобулинам мыши (контрольная зона) и высушивали. Поверх ПЭДа и отсасывающего фильтра монтировали защитную пленку, разрезали блок на стрипы шириной 5 мм и запаивали в водонепроницаемые пакеты с осушителем. Полученные стрипы использовали для анализа.
Технический результат. С помощью полученных стрипов проводили реакцию определения E.coli в воде. ПЭД погружали на 2 мм в исследуемые образцы. Вода образцов растворяла конъюгаты, высушенные в ПЭД, и образовавшийся комплекс КГ(МАТКЧ)-КГ(МСАТПХ)-АГ E.coli – мигрировал к тест-зоне, где образовывался комплекс КГ(МАТКЧ)-КГ(МСАТПХ)-АГ E.coli-МСАТ, который визуализировал наличие АГ E.coli в растворе. Не связавшийся КГ(МАТКЧ) мигрировал в контрольную зону, где образовывал комплекс КГ(МАТКЧ)-МСАТ против ИГ мыши. Этот комплекс визуализировал пригодность стрипа к работе. Все остальные не связавшиеся компоненты реакции поглощались отсасывающим фильтром. Чувствительность теста составляла 1-10×10-9 г/мл. Собирая образцы с помощью несорбирующих фильтров чувствительность можно повысить на 2-3 порядка.
Итак, существо предлагаемого способа состоит в том, что процесс переноса искомого реагента – АГ делают двухступенчатым, используя начальное объединение АГ с моноспецифическим AT связанного с ПХ, а затем, связывая полученный комплекс с маркерным реагентом, содержащим моноклональные антитела к пероксидазе хрена, чем обеспечивается универсальность реагирования ИХ-полоски на любые типы штаммов АГ E.coli.
Далее покажем, что именно благодаря существенным отличиям предлагаемого способа обеспечивается требуемый технический результат.
То, что в реакционной зоне выполняют последовательно операцию связывания антигена Escherichia coli с конъюгатом моноспецифического антитела к Escherichia coli с пероксидазой хрена, и операцию связывания полученного комплекса с маркерным реагентом, содержащим моноклональные антитела к пероксидазе хрена, обеспечивает универсальность проводимого анализа, повышает надежность оценки эпидемиалогического состояния водной среды.
То, что в качестве биохимического реагента контрольной зоны используют кроличьи антитела против иммуноглобулинов мыши, повышает экономичность способа, стабильность его работы.
То, что в качестве пористого носителя реагентной зоны используют ПЭД (инертный пористый носитель из стекловолокна), а в качестве пористого носителя контрольной зоны используют слой нитроцелюлозы, нанесенный на лавсановое основание и имеющий капиллярную связь с пористым носителем реагентной зоны (ПЭД), также позволяет обеспечить необходимый технический результат.
Достигаемый при этом технический результат также состоит в экономии дорогостоящих реагентов и снижении временных затрат по сравнению с традиционными способами аналогичного назначения, в улучшении его экономических параметров.
Таким образом, показано, что требуемый технический результат, действительно, достигается за счет существенных отличий предлагаемого способа. Проведенные эксперименты показали реализуемость предлагаемого изобретения.
Формула изобретения
Способ иммунохроматографического определения Escherichia coli, отличающийся тем, что Escherichia coli определяют в воде и при этом используют тест-полоску, которая состоит из частей А, В и С, монтируемых на подложке D так, как приведено на фиг.1, при этом часть А на 1-2 мм перекрывает часть В, где
А – инертный пористый носитель из стекловолокна (ПЭД) с нанесенной на его поверхность реакционной зоной 1 и 2 (см. фиг.1), где реакционная зона 1 представляет зону с нанесенным конъюгатом кроличьих моноспецифических антител против E.coli с пероксидазой хрена, обозначенным 3 на фиг.1, а зона 2 представляет зону с нанесенным конъюгатом мышиных моноклональных антител против пероксидазы хрена меченных коллоидным золотом, обозначенным 4 на фиг.1, где конъюгаты наносили параллельными полосами в центральной области ПЭД перпендикулярно току жидкости на расстоянии 2 мм друг от друга;
В – нитроцеллюлоза, иммобилизованная на лавсановое основание, с нанесенной на ее поверхность тест-зоной, обозначенной 6 на фиг.1 и контрольной зоной, обозначенной 7 на фиг.1, где тест-зона 6 представляет зону с нанесенными кроличьими моноспецифическими антителами против E.coli, обозначенными 5 на фиг.1, а контрольная зона 7 представляет зону с нанесенными кроличьими моноспецифическими антителами против иммуноглобулинов мыши, обозначенными 8 на фиг.1, где моноспецифические антитела против Е.coli нанесены полосой параллельно длинной стороне тест-полоски в 2 мм от середины нитроцеллюлозы, а моноспецифические антитела против иммуноглобулинов мыши нанесены параллельной полосой на 3 мм от середины ближе к отсасывающему фильтру, причем В имеет капиллярную связь с реакционной зоной носителя А;
С – отсасывающий фильтр для поглощения непрореагировавших реагентов, при этом решение о наличии Escherichia coli принимают по наличию окраски тест-зоны, тогда как окраска контрольной зоны свидетельствует о работоспособности тест-полоски.
РИСУНКИ
MM4A – Досрочное прекращение действия патента СССР или патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 20.09.2007
Извещение опубликовано: 27.02.2009 БИ: 06/2009
MM4A – Досрочное прекращение действия патента СССР или патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 20.09.2008
Извещение опубликовано: 27.07.2010 БИ: 21/2010
|
|