|
(21), (22) Заявка: 2005125857/28, 15.08.2005
(24) Дата начала отсчета срока действия патента:
15.08.2005
(43) Дата публикации заявки: 27.02.2007
(46) Опубликовано: 10.06.2007
(15) Информация о коррекции:
Версия коррекции № 1 (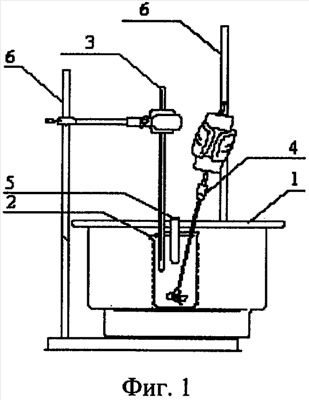
Изобретение относится к области физической химии, посвященной исследованию воздействия магнитного поля на воду и водные растворы.
Известно, что под действием магнитных полей происходят изменения свойств воды и водных растворов, эти эффекты объясняют изменение энергии взаимодействия молекул воды в жидком состоянии, т.е. изменение энергии водородной связи.
Известны косвенные спектроскопические способы определения этих изменений, когда исследуется не сама водородная связь как таковая, а ее влияние на свойства других связей. Информация о водородной связи в таких методах извлекается из характеристик полос валентных и деформационных колебаний O-Н, которые испытывают заметные изменения при димеризации. По относительной интенсивности полос мономерной и ассоциативной молекул, зависящей от температуры, меняя соотношение между числом мономеров и ассоциатов, оценивают из спектроскопических данных энергию водородных связей [Бахшиев Н.Г. Введение в молекулярную спектроскопию / Н.Г.Бахшиев. – Ленинград: Изд-во ЛГУ, 1987. – С.129].
Однако известные методы обладают следующими недостатками, заключающимися в сложности оборудования, длительности эксперимента.
Из известных технических решений наиболее близкими по назначению являются прямые спектроскопические методы, при помощи которых анализируют спектры, образующиеся в результате взаимодействия падающего излучения и взаимных колебаний молекул, связанных водородной связью. Один из методов основан на применении специальных длинноволновых ИК-спектрометров и спектрометров для комбинационного рассеяния с лазерным возбуждением (интервал частот 100-200 см-1) [Драго Р. Физические методы в химии / Р.Драго. – М.: МИР, 1981. – С.213].
Предлагаемое изобретение позволяет устранить недостатки прототипа, заключающиеся в сложности оборудования, длительности эксперимента, неоднозначности трактовки результатов.
Данное изобретение позволяет определить изменение энергии водородных связей по значениям температурного скачка при растворении соли-зонда в воде, подвергшейся магнитной обработке в течение определенного времени, и в необработанной воде с использованием зависимости изменения энергии водородных связей от времени магнитной обработки, для построения которой используют величину энергии, затраченной на изменение энергии водородных связей, рассчитанной на основе данных по теплоте растворения соли в воде.
На весах взвешивают х г соли. Затем мерным цилиндром отмеряют 50·х мл дистиллированной воды, выливают в стакан, который устанавливают в калориметре. После этого калориметр закрывают крышкой и через отверстие, имеющееся в ней, в стакан опускают термометр Бекмана, пробирку с солью и мешалку, принципиальная известная схема на Фиг.1 (1 – калориметр; 2 – внутренний стакан; 3 – термометр Бекмана; 4 – мешалка; 5 – пробирка с веществом; 6 – штатив). После этого включают мешалку и через каждую минуту (не менее пяти минут) записывают показания термометра Бекмана. По истечении пяти минут равномерного изменения температуры пробирку с солью вынимают из калориметра и через отверстие в крышке соль высыпается в воду при непрерывном перемешивании. Регистрация температуры продолжается до тех пор, пока не обнаруживается вновь установившийся продолжительный равномерный ход температуры.
Тепловой эффект растворения можно представить так:
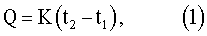
где Q – тепловой эффект растворения соли, Дж;
K – постоянная калориметра, Дж/K;
t2 – конечная температура, K;
t1 – начальная температура, K;
[Малахова А.Н. Практикум по физической и коллоидной химии / А.Н.Малахова. – Минск: Вышейшая школа, 1974. – С.10]. Для определения теплоты растворения соли в активированной воде проводится опыт по той же методике, что и для неактивированной воды, с той лишь разницей, что вода проходит активацию, например, в магнитном поле.
На основе полученных данных о температурном скачке  t=t2-t1 [K] подсчитывается теплота растворения Q [Дж] соли в водной системе при активации, принимая, что теплота растворения соли Q0 [Дж] в деактивированной водной системе соответствует справочной величине (теплота растворения KCl при 20°C в дистиллированной воде – 18,4 кДж/моль). t=t2-t1 [K] подсчитывается теплота растворения Q [Дж] соли в водной системе при активации, принимая, что теплота растворения соли Q0 [Дж] в деактивированной водной системе соответствует справочной величине (теплота растворения KCl при 20°C в дистиллированной воде – 18,4 кДж/моль).
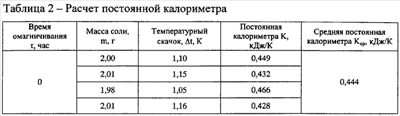
Обработку результатов эксперимента осуществляют следующим образом. Принимают, что активация воды не приводит к изменению постоянной калориметра (не изменяются ни массы, ни теплоемкости составляющих калориметрической системы), расчет теплоты растворения соли в активированной воде сводится в соответствии с формулой (1) к простой пропорции. Расчет энергии, пошедшей на изменение некоторого числа водородных связей, осуществляется по формуле:
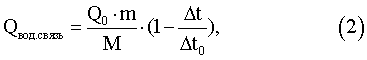
где Qвод.связь – энергия, затраченная на изменение энергии водородных связей, Дж;
Q0 – тепловой эффект растворения соли в неомагниченной воде, справочная величина Дж/моль;
 t – температурный скачок при растворении соли в омагниченной воде, K; t – температурный скачок при растворении соли в омагниченной воде, K;
 t0 – температурный скачок при растворении соли в неомагниченной воде, K; t0 – температурный скачок при растворении соли в неомагниченной воде, K;
m – масса соли, г;
М – молекулярная масса соли, г/моль.
В качестве возможной активации выступает магнитное поле, в качестве соли-зонда идеально подходит KCl, он проявляет себя наиболее индифферентно и не влияет на активацию дистиллированной воды.
Пример расчета.
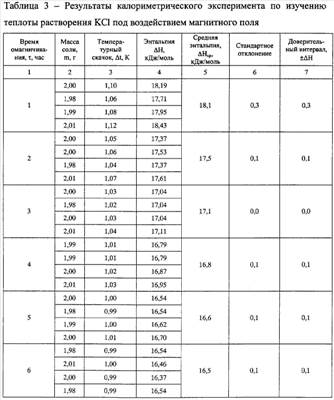
Проводят эксперимент по изучению зависимости изменения энергии водородных связей в дистиллированной воде от времени магнитной обработки. Энергия, затраченная на изменение некоторого числа водородных связей, рассчитывается по формуле (2) на основе данных по теплоте растворения 2 г хлористого калия в 100 мл воды, подвергшейся воздействию постоянного магнитного поля B=0,08 Тл при 20°С.
Для эксперимента используют дистиллированную воду и KCl марки х.ч. За теплоту растворения хлористого калия в неомагниченной воде Q0 принимается экспериментальная справочная величина  Н20°C=18,4 кДж/моль. Обработанные данные представлены в таблицах 1, 2 и 3. По данным таблицы 3 представлена графическая зависимость Фиг.2 (1 – экспериментальные точки, 2 – Н20°C=18,4 кДж/моль. Обработанные данные представлены в таблицах 1, 2 и 3. По данным таблицы 3 представлена графическая зависимость Фиг.2 (1 – экспериментальные точки, 2 –  Н=7,8+10,7·10-0,0962· Н=7,8+10,7·10-0,0962· +0,44· +0,44· ,r=0,991). Омагничивание больше шести часов не приводит к значительному уменьшению теплоты растворения по сравнению с шестью часами магнитной обработки. ,r=0,991). Омагничивание больше шести часов не приводит к значительному уменьшению теплоты растворения по сравнению с шестью часами магнитной обработки.
Изобретение позволяет определить энергию, затраченную на изменение энергии водородных связей в результате воздействия магнитного поля.
Таблица 1
Калориметрическое определение изменения энергии водородных связей после воздействия на водные системы магнитного поля |
Время омагничивания,  , час , час |
Масса соли, m, г |
Температурный скачок  t, K t, K |
Энергия, затраченная на изменение энергии водородных связей, Qвод.связь, Дж |
Средняя энергия, затраченная на изменение энергии водородных связей, 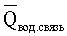 , Дж , Дж |
Стандартное отклонение, Дж |
Доверительный интервал, Дж |
| 0 |
2,00 |
1,10 |
– |
– |
– |
– |
| 1 |
2,00 |
1,10 |
0 |
4 |
12 |
11 |
| 1,98 |
1,06 |
18 |
| 1,99 |
1,08 |
9 |
| 2,01 |
1,12 |
-9 |
| 2 |
2,00 |
1,05 |
22 |
20 |
6 |
6 |
| 2,00 |
1,06 |
18 |
| 1,98 |
1,04 |
27 |
| 2,01 |
1,07 |
14 |
| 3 |
2,00 |
1,03 |
31 |
31 |
3 |
3 |
| 1,98 |
1,02 |
36 |
| 2,00 |
1,03 |
31 |
| 2,01 |
1,04 |
27 |
| 4 |
1,99 |
1,01 |
40 |
37 |
4 |
4 |
| 1,99 |
1,01 |
40 |
| 2,00 |
1,02 |
36 |
| 2,01 |
1,03 |
32 |
| 5 |
2,00 |
1,00 |
45 |
45 |
3 |
3 |
| 1,98 |
0,99 |
49 |
| 1,99 |
1,00 |
45 |
| 2,00 |
1,01 |
40 |
| 6 |
1,98 |
0,99 |
49 |
48 |
2 |
2 |
| 2,01 |
1,00 |
45 |
| 2,00 |
0,99 |
49 |
| 1,98 |
0,99 |
49 |
Формула изобретения
Способ калориметрического определения изменения энергии водородных связей после воздействия на водные системы магнитного поля, отличающийся тем, что определение изменения энергии водородных связей проводят по значениям температурного скачка при растворении соли-зонда в воде, подвергшейся магнитной обработке в течение определенного времени, и в необработанной воде, с использованием зависимости изменения энергии водородных связей от времени магнитной обработки, для построения которой используют величину энергии, затраченной на изменение энергии водородных связей, рассчитанной на основе данных по теплоте растворения соли в воде, по формуле
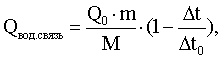
где Qвод. связь – энергия, затраченная на изменение энергии водородных связей, Дж;
Q0 – тепловой эффект растворения соли в неомагниченной воде, справочная величина Дж/моль;
 t – температурный скачок при растворении соли в омагниченной воде, К; t – температурный скачок при растворении соли в омагниченной воде, К;
 t0 – температурный скачок при растворении соли в неомагниченной воде, К; t0 – температурный скачок при растворении соли в неомагниченной воде, К;
m – масса соли, г;
М – молекулярная масса соли, г/моль.
РИСУНКИ
TH4A – Переиздание описания изобретения к патенту Российской Федерации
Причина переиздания: Коррекция названия изобретения
Извещение опубликовано: 10.10.2007 БИ: 28/2007
|
|