Патент на изобретение №2298544
|
||||||||||||||||||||||||||
(54) СПОСОБ ПОЛУЧЕНИЯ ЗАМЕЩЕННЫХ N-АДАМАНТИЛ-П-НИТРОЗОАРИЛАМИНОВ
(57) Реферат:
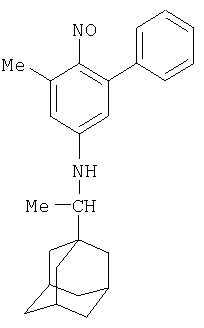
Изобретение относится к области органической химии, а именно к способу получения N-адамантил-п-нитрозоариламинов формулы
где R1=Me, Ph; R2=H, Ме; R3= которые могут найти применение как биологически активные вещества. Техническим результатом предлагаемого способа получения является получение ранее не описанных замещенных N-адамантил-п-нитрозоариламинов.
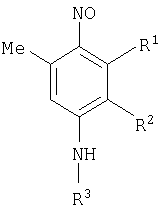
Изобретение относится к области органической химии, а именно к способам получения N-адамантил-п-нитрозоариламинов формулы
где R1=Me, Ph; R2=H, Ме; R3= которые могут найти применение в качестве биологически активных веществ. В настоящее время известно несколько способов получения N-адамантил-п-нитрозоариламинов. В них арилъное кольцо вводится в соединение без изменения углеродного скелета. Известен способ получения на основе бензальдегида. В этом способе из 1-аминоадамантана и бензальдегида получают аминоадамантил-N-бензилиден PhCH=N-Ad, гидрированием которого получают PhCH2-NH-Ad [пат. Австрал. Кл. 09.6, 87.1; 34.2, 09. 10. (С 07 с, A 61k, A 23k), №276243. Paulshock Marvm, Watts Yohn Conway. Aminoadamantanes with therapeutic activities and their prepation. заявл. 7.05.63., опубл. 29.06.67.] Известна реакция Лейкарта (взаимодействие альдегидов или кетонов с формиатом аммония, формамидом или их замещенными производными). Взаимодействием адамантан-2-она с бензамидом или с анилином в муравьиной кислоте получают N-2-адамантиланилин [Лаврова Л.Н., Климова Н.В. и др. ЖОрХ, вып.4, 1974, с.761-765]. Недостатками известных способов является то, что все описанные выше способы получения N-адамантилариламинов позволяют получить только простейшие представители соединений рассматриваемого класса. Связано это с тем, что все существующие способы получения основаны на использовании в качестве исходных продуктов ароматических соединений. Недостатками этого способа являются применение абсолютной муравьиной кислоты и возможность получения только простейших представителей соединений рассматриваемого класса. Изобретение решает задачу создания способа получения замещенных N-адамантил-п-нитрозоариламинов с более широким рядом заместителей. Техническим эффектом предлагаемого способа получения является получение ранее не описанных замещенных N-адамантил-п-нитрозоариламинов. Указанный технический результат при осуществлении изобретения достигается тем, что способ получения N-адамантил-п-нитрозоариламинов формулы
где R1=Me, Ph; R2=H, Ме; R3= из аминов, осуществляют в одну стадию циклоконденсацией изонит-розо- Способ получения N-адамантил-п-нитрозоариламинов осуществляют следующим образом. Изонитрозо- Этим способом получены не описанные ранее вещества: 3,5-диметил-N-адамантил-п-нитрозоанилин.
Кристаллы зеленого цвета растворимы в ацетоне, этаноле, хлороформе, Т.пл. 170°С. Электронный спектр, 2,3,5-триметил-N-адамантил-п-нитрозоанилин.
Кристаллы зеленого цвета растворимы в ацетоне, этаноле, хлороформе, Т.пл. 135°С. Электронный спектр, 3-метил-5-фенил-N-адамантил-п-нитрозоанилин.
Кристаллы зеленого цвета, растворимы в ацетоне, этаноле, хлороформе, Т.пл. 125°С. Электронный спектр, 3,5-диметил-N-(1-адамантил)этил-п-нитрозоанилин.
Кристаллы зеленого цвета, растворимы в ацетоне, этаноле, хлороформе, Т.пл. 145°С. Электронный спектр, 3-метил-5-фенил-N-(1-адамантил)этил-п-нитрозоанилин.
Кристаллы зеленого цвета, растворимы в ацетоне, этаноле, хлороформе, Т.пл. 120°С. Электронный спектр, Пример 1. Получение 3,5-диметил-N-адамантил-п-нитрозоанилина. Смесь 0.01 моль изонитрозоацетилацетона, 0.07 моль ацетона, 0.009 моль 1-аминоадамантана и 2-2.5 г цеолита в 20 мл циклогексанола выдерживают 168 часов при 20°С, затем выливают в 250 мл воды со льдом и экстрагируют диэтиловым эфиром (2×15 мл). Экстракт дважды промывают 15 мл 5% раствора HCl, затем дважды 15 мл 5% раствора NaOH, а затем 50 мл воды. Эфир упаривают, выделившийся маслянистый остаток промывают петролейным эфиром до образования зеленых кристаллов. Выход 60%. Т.пл. 170°С. Электронный спектр, Пример 2. Получение 2,3,5-триметил-N-адамантил-п-нитрозоанилина. Смесь 0.01 моль изонитрозоацетилацетона, 0.07 моль метилэтилкетона, 0.009 моль 1-аминоадамантана и 2-2.5 г цеолита в 20 мл этиленгликоля выдерживают 168 часов при 20°С, затем выливают в 250 мл воды со льдом и экстрагируют диэтиловым эфиром (2×15 мл). Экстракт дважды промывают 15 мл 5% раствора HCl, затем дважды 15 мл 5% раствора NaOH, а затем 50 мл воды. Эфир упаривают, выделившийся маслянистый остаток промывают петролейным эфиром до образования зеленых кристаллов. Выход 30%. Т.пл. 135°С. Электронный спектр, Пример 3. Получение 3-метил-5-фенил-N-адамантил-п-нитрозоанилина. Смесь 0.01 моль изонитрозобензоилацетона, 0,07 моль ацетона, 0.009 моль 1-аминоадамантана и 2-2,5 г цеолита в 30 мл пиридина выдерживают 240 часов при 20°С, затем выливают в 250 мл воды со льдом и экстрагируют диэтиловым эфиром (2×15 мл). Экстракт дважды промывают 15 мл 5% раствора HCl, затем дважды 15 мл 5% раствора NaOH, а затем 50 мл воды. Эфир упаривают, выделившийся маслянистый остаток промывают петролейным эфиром до образования зеленых кристаллов. Выход 20%. Т.пл. 125°С. Электронный спектр, Пример 4. Получение 3,5-диметил-N-(1-адамантил)этил-п-нитрозоанилина. Смесь 0,01 моль изонитрозоацетилацетона, 0.07 моль ацетона, 0.009 моль N-(1-адамантил)этиламина и 2-2.5 г цеолита в 20 мл циклогексанола выдерживают 240 часов при 20°С, затем выливают в 250 мл воды со льдом и экстрагируют диэтиловым эфиром (2×15 мл). Экстракт дважды промывают 15 мл 5% раствора HCl, затем дважды 15 мл 5% раствора NaOH, а затем 50 мл воды. Эфир упаривают, выделившийся маслянистый остаток промывают петролейным эфиром до образования зеленых кристаллов. Выход 20%. Т.пл. 145°С. Электронный спектр, Пример 5. Получение 3-метил-5-фенил-N-(1-адамантил)этил-п-нитрозоанилина. Смесь 0-01 моль изонитрозобензоилацетона, 0,07 моль ацетона, 0.009 моль N-(1-адамантил)этиламина и 2-2.5 г цеолита в 20 мл этиленгликоля выдерживают 240 часов при 20°С, затем выливают в 250 мл воды со льдом и экстрагируют диэтиловым эфиром (2×15 мл). Экстракт дважды промывают 15 мл 5% раствора НС1, затем дважды 15 мл 5% раствора NaOH, а затем 50 мл воды. Эфир упаривают, выделившийся маслянистый остаток промывают петролейным эфиром до образования зеленых кристаллов. Выход 15%. Т.пл. 120°С. Электронный спектр, Полученные авторами, не описанные ранее замещенные N-адамантил-п-нитрозоариламины могут найти применение в качестве биологически активных веществ в препаратах медицинского назначения.
Формула изобретения
Способ получения замещенных N-адамантил-п-нитрозоариламинов общей формулы
где R1=Me, Ph; R2=H, Ме; R3= из аминов, отличающийся тем, что изонитрозо-
MM4A – Досрочное прекращение действия патента СССР или патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 22.12.2007
Извещение опубликовано: 27.07.2009 БИ: 21/2009
|
||||||||||||||||||||||||||




 -дикетонов с кетонами и N-адамантиламинами H2NR, где а) R=Ad, б) R=CH(CH3)-Ad в присутствии органического растворителя при комнатной температуре.
-дикетонов с кетонами и N-адамантиламинами H2NR, где а) R=Ad, б) R=CH(CH3)-Ad в присутствии органического растворителя при комнатной температуре.

 макс, нм(
макс, нм( ), этанол: 410 (32000), 690 (75). Найдено, %: С 75,73; Н 9,29; N 9,55. С18H24N2. Вычислено, %: С 75,99; Н 8,44; N 9,85.
), этанол: 410 (32000), 690 (75). Найдено, %: С 75,73; Н 9,29; N 9,55. С18H24N2. Вычислено, %: С 75,99; Н 8,44; N 9,85.