Патент на изобретение №2298406
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
(54) СПОСОБ ПОЛУЧЕНИЯ КОНЪЮГАТОВ ГЕПАРИНА
(57) Реферат:
Изобретение относится к области химии и биохимии, в частности, к способу получения новых веществ, производных гепарина, которые могут быть использованы в медицине, фармакологии. Способ осуществляют путем взаимодействия его с аминосодержащими соединениями в присутствии конденсирующего реагента 1-этил-3-[3-(диметиламино)пропил]карбодиимида в водной среде при комнатной температуре, рН 4.7-4.8. В качестве аминосодержащих соединений используют ряд фармакологически значимых аминов: n-аминофенол, n-аминобензойную и антраниловую кислоты, 4- и 5-аминосалициловые кислоты, стрептоцид, сульфацил-натрий, анестезин, новокаин, таурин (тауфон), 7-аминоцефалоспориновую кислоту, а также изониазид (гидразид изоникотиновой кислоты). В зависимости от природы аминосодержащего соединения и соотношения реагентов получают водорастворимые модифицированные гепарины с различной конверсией карбоксильных групп. Преимуществами предлагаемого способа получения конъюгатов гепарина является осуществление реакции за короткий промежуток времени, позволяющий достигать высокой конверсии карбоксигрупп гепарина, использование при этом небольших избытков реагентов: гепарин: RNH2:EDC=1:(1-3):(0.75-3.00). Варьирование соотношения реагентов позволяет получать модифицированные гепарины с заданной степенью конверсии карбоксигрупп. Следует отметить легкость очистки конъюгатов от низкомолекулярных примесей и хорошую растворимость продуктов в воде. 1 табл.
Изобретение относится к области химии и биохимии, в частности, к способу получения новых веществ, производных гепарина, которые могут быть использованы в медицине, фармакологии. Фармакопейные препараты гепарина для внутривенного введения выпускаются в виде натриевой и кальциевой солей. Гепариновую мазь применяют наружно при поверхностных тромбофлебитах и язвах конечностей, тромбозе геморроидальных вен: при этом уменьшаются воспалительные процессы. Низкомолекулярный гепарин (Фраксипарин, Эндоксапарин Натрия, Сулодексид; Mn=3000-4500 Да) применяется в хирургической и ортопедической практике и является, в отличие от гепарина с Mn=14-18 тыс. Да, препаратом пролонгированного действия [Машковский М.Д. Лекарственные средства. – Харьков: Торсинг, 1997. – Т.1, 2. – 590 С.]. В последние годы проявляется большой интерес к получению и исследованию биологических свойств химически модифицированных аналогов гепарина. Функционализация гепарина позволяет изменить физико-химические и биологические свойства гепарина. Конъюгаты гепарина с лекарственными субстанциями могут обладать большей растворимостью или продолжительностью действия по сравнению с самими лекарствами, могут использоваться как препараты комбинированного действия. Амфифильные производные гепарина, способные абсорбироваться желудочно-кишечным трактом, были синтезированы с участием N-гидроксисукцинимидных эфиров некоторых стеролов, желчных и алифатических кислот [Amphiphilic polysaccharide derivatives, US 6245753]. Также были получены нитропроизводные низкомолекулярного гепарина [Nitro-derivatives of low molecular weight heparin, EP 1340771] и эпоксигепарина [Nitro-derivatives of epoxyheparin, EP 1340772 A1], которые могут применяться в лечении патологий, связанных с дисфункцией сердечно-сосудистой системы. Известны различные десульфатированные [Process for producing desulfated polysaccharide, and desulfated heparin, US 6, 545, 136 B1] и суперсульфатированные [Yates E.A., Santini F., Guerrini M., Naggi A., Torri G., Casu B. 1H and 13 Целью предлагаемого изобретения является способ получения фармакозначимых конъюгатов гепарина с соединениями, содержащими первичную аминогруппу, путем их взаимодействия с гепарином в водной среде (рН 4.7-4.8) в присутствии 1-этил-3-[3-(диметиламино)пропил]карбодиимида (EDC). В качестве аминосодержащих соединений были использованы фармакологически значимые n-аминофенол, 5- и 4-аминосалициловые, антраниловая и n-аминобензойная кислоты, этиловый эфир n-аминобензойной кислоты (анестезин), где R=С6Н4ОН (остаток п-аминофенола), С6Н4СООН (остатки п-аминобензойной и антраниловой кислот), С6Н3(ОН)СООН (остатки 4- и 5-аминосалициловых кислот), C6H4SO2NH2 (остаток п-бензолсульфамида), С6Н4SO2N(Na)СОСН3 (остаток п-аминобензолсульфацетамид-натрия), С6Н4СООС2Н5 (остаток этилового эфира п-аминобензойной кислоты), С6Н4COO(СН2)2N(С2Н5)2 (остаток бета-диэтиламиноэтилового эфира п-аминобензойной кислоты), C5H4NCONHNH2 (остаток гидразида изоникотиновой кислоты), Н2NCH2СН2SO3Н (остаток 2-аминоэтансульфоновой кислоты), C9O5NSH10 (остаток 7-аминоцефалоспориновой кислоты), R1=NHSO3 – или NHAc (20-30%) Пример 1. К смеси 91,8 мг (0.15 ммоль) гепарина (ГЕП) и 0.15 ммоль соответствующего амина в 15 мл Н2О добавляют 0.1 н. NaOH (или, если требуется, 0.1 н. HCl) до pH 4.7-4.8, затем при интенсивном перемешивании и температуре 20-22°С вносят 21.5 мг (0.11 ммоль) карбодиимида (соотношение реагентов ГЕП:амин:EDC=1:1:0.75), поддерживая pH 4.7-4.8 титрованием 0.1 н. HCl. Через 0.5 ч к охлажденной до 0°С реакционной смеси последовательно добавляют 0.1 н. NaOH (до pH 7), 2-3 мл насыщенного раствора NaCl и 60-65 мл охлажденного этанола, после чего оставляют на ночь при 0°С. Выпавший осадок отделяют центрифугированием, растворяют в 10 мл 6% NaCl, добавляют 40 мл этанола. Вновь выпавший осадок центрифугируют, промывают этанолом (10×3 мл), затем эфиром (10×3 мл) и сушат при температуре Пример 2. Реакцию гепарина с соответствующим амином проводят аналогично примеру 1, но при этом используют следующее соотношение реагентов: ГЕП:амин:EDC=1:1:1.5, т.е. к 91.3 мг (0.15 ммоль) гепарина прибавляют 0.15 ммоль соответствующего амина и 43 мг (0.22 ммоль) карбодиимида. Пример 3. Реакцию гепарина с соответствующим амином проводят аналогично примеру 1, но при этом используют следующее соотношение реагентов: ГЕП:амин:EDC=1:3:3, т.е. к 91.3 мг (0.15 ммоль) гепарина прибавляют 0.45 ммоль соответствующего амина и 86.3 мг (0.45 ммоль) карбодиимида. Конверсию карбоксильных групп гепарина определяют по данным 1Н-ЯМР-спектроскопии, используя в качестве внутреннего стандарта интенсивность сигналов аномерных протонов исследуемого образца модифицированного гепарина в области 5.3-5.5 м.д. Спектры 1Н-ЯМР регистрировали для растворов в D2О на спектрометре Bruker АМХ-300 (рабочая частота для 1Н-ЯМР-300.13 МГц), в качестве внутреннего стандарта использовали натриевую соль 3-(триметилсилил)-1-пропансульфоновой кислоты. УФ-спектры получали на спектрофотометре Specord M-40. Контроль рН растворов проводили с помощью рН-метра «рН-340». Характеристика конъюгатов гепарина с рядом фармакологически значимых аминосодержащих соединений: n-аминофенолом, n-аминобензойной, антраниловой, 5-аминосалициловой и 4-аминосалициловой кислотами, анестезином и новокаином, стрептоцидом, таурином, 7-аминоцефалоспориновой кислотой, изониазидом, сульфацил-натрием приводится в таблице.
Формула изобретения
Способ получения конъюгатов гепарина путем его взаимодействия с аминосодержащими соединениями в водной среде, рН 4,7-4,8, в присутствии конденсирующего реагента 1-этил-3-[3-(диметиламино)пропил]карбодиимида (EDC), отличающийся тем, что в качестве аминосодержащих соединений (RNH2) используют n-аминофенол, n-аминобензойную и антраниловую кислоты, 4- и 5-аминосалициловые кислоты, стрептоцид, сульфацил-натрий, анестезин, новокаин, изониазид, 2-аминоэтансульфоновую кислоту (таурин), 7-аминоцефалоспориновую кислоту при мольных соотношениях компонентов гепарин: RNH2:EDC=1:(1-3):(0.75-3.00), смесь интенсивно перемешивают при 20-22°С в течение 30 мин, затем охлаждают до 0°С, доводят рН до 7, насыщают NaCl, добавляют охлажденный этанол, оставляют на ночь при 0°С, выпавший осадок отделяют центрифугированием, промывают этанолом и эфиром и сушат при температуре не выше 60°С и пониженном давлении.
MM4A – Досрочное прекращение действия патента СССР или патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 01.03.2007
Извещение опубликовано: 10.04.2009 БИ: 10/2009
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

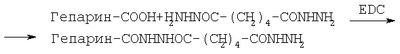
 -диэтиламиноэтиловый эфир n-аминобензойной кислоты (новокаин), гидразид изоникотиновой кислоты (изониазид), 2-аминоэтансульфоновая кислота (таурин), 7-аминоцефалоспориновая кислота, а также сульфаниламидные препараты, содержащие свободную аминогруппу, такие как n-аминобензолсульфамид (стрептоцид), n-аминобензолсульфацетамид-натрий (сульфацил-натрий). Конъюгация перечисленных аминосодержащих соединений с гепарином позволяет расширить арсенал производных гепарина, придать ему дополнительные медикаментозные свойства: противовоспалительные, антимикробные, анестезирующие. Преимуществами предлагаемого способа получения конъюгатов гепарина также является осуществление реакции за короткий промежуток времени, позволяющий достигать высокой конверсии карбоксигрупп гепарина (в некоторых случаях до 100% мольн. в расчете на дисахаридное звено), использование при этом небольших избытков регентов: гепарин:RNH2:EDC=1:(1-3):(0.75-3.00). Варьирование соотношения регентов позволяет получать модифицированные гепарины с заданной степенью конверсии карбоксигрупп. Следует отметить легкость очистки конъюгатов от низкомолекулярных примесей и хорошую растворимость продуктов в воде.
-диэтиламиноэтиловый эфир n-аминобензойной кислоты (новокаин), гидразид изоникотиновой кислоты (изониазид), 2-аминоэтансульфоновая кислота (таурин), 7-аминоцефалоспориновая кислота, а также сульфаниламидные препараты, содержащие свободную аминогруппу, такие как n-аминобензолсульфамид (стрептоцид), n-аминобензолсульфацетамид-натрий (сульфацил-натрий). Конъюгация перечисленных аминосодержащих соединений с гепарином позволяет расширить арсенал производных гепарина, придать ему дополнительные медикаментозные свойства: противовоспалительные, антимикробные, анестезирующие. Преимуществами предлагаемого способа получения конъюгатов гепарина также является осуществление реакции за короткий промежуток времени, позволяющий достигать высокой конверсии карбоксигрупп гепарина (в некоторых случаях до 100% мольн. в расчете на дисахаридное звено), использование при этом небольших избытков регентов: гепарин:RNH2:EDC=1:(1-3):(0.75-3.00). Варьирование соотношения регентов позволяет получать модифицированные гепарины с заданной степенью конверсии карбоксигрупп. Следует отметить легкость очистки конъюгатов от низкомолекулярных примесей и хорошую растворимость продуктов в воде.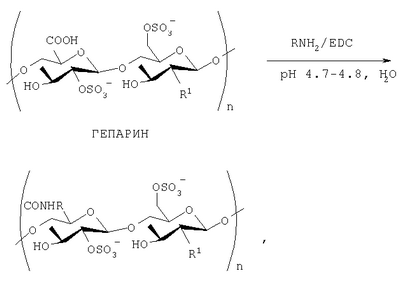
 60°С и пониженном давлении. Получают 100 мг соответствующих конъюгатов в виде белых порошков с розовым или желтым оттенком, растворимых в воде.
60°С и пониженном давлении. Получают 100 мг соответствующих конъюгатов в виде белых порошков с розовым или желтым оттенком, растворимых в воде. max, нм)
max, нм)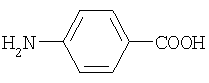 n-аминобензойная кислота
n-аминобензойная кислота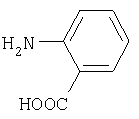 антраниловая кислота
антраниловая кислота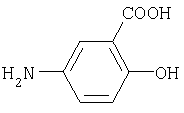 5-аминосалициловая кислота
5-аминосалициловая кислота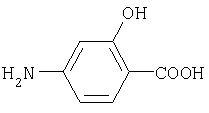 4-аминосалициловая кислота
4-аминосалициловая кислота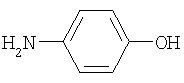 n-аминофенол
n-аминофенол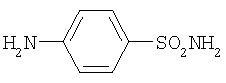 стрептоцид
стрептоцид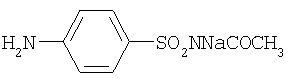 сульфацил-натрий
сульфацил-натрий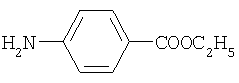 анестезин
анестезин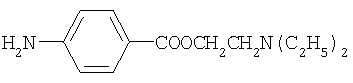 новокаин
новокаин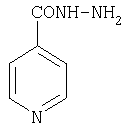 изониазид
изониазид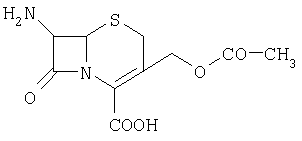 7-аминоцефалоспориновая кислота
7-аминоцефалоспориновая кислота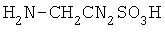 таурин
таурин