Патент на изобретение №2297215
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
(54) АНТИОКСИДАНТНОЕ СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ КАТАРАКТЫ
(57) Реферат:
Изобретение относится к области медицины. Антиоксидантное средство для лечения катаракты содержит 2,2% масляного раствора ионола. Средство позволяет добиться стабилизации и регресса помутнений хрусталика, значительно снизить активность перекисного окисления липидов хрусталика, несколько увеличить содержание восстановленного глутатиона, предотвратить окисление восстановленных белковых тиоловых групп и уменьшить емкости антиоксидантной защиты хрусталика. Применение раствора ионола предупреждает истощение активности глутатион-пероксидазы, способствует поддержанию активности фермента на высоком уровне; способствует определенному восстановлению активности глутатион-редуктазы после оксидативного стресса; увеличивает активность глутатион-8Н-трансферазы хрусталика, средство обеспечивает стабилизацию и регресс формирующейся катаракты. 5 табл.
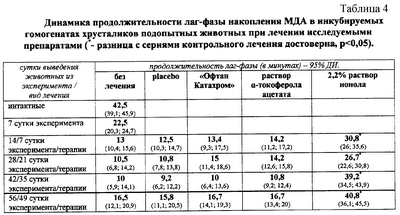
Изобретение относится к медицине, а именно к фармакотерапии глазных болезней, и может быть использовано для консервативного лечения катаракты, В этиопатогенезе катаракты одним из ведущих моментов является патологическая активация свободнорадикального окисления липидов мембран и других биополимеров хрусталика (1). В обеспечении прозрачности хрусталика большую роль играет восстановленная форма глутатаона, поддерживая белковые тиоловые группы в восстановленном состоянии (2). Для консервативного лечения катаракты используются капли “Офтан Катахром”. Препарат оказывает антиоксидантное действие, улучшает метаболизм и трофику тканей глаза (3). Однако ни один из компонентов препарата не является прямым антиоксидантом (4). По данным ряда исследований, препарат не обладает высоким антикатарактальным действием, а эффективен для тканей, расположенных впереди хрусталика (3, 5, 6). Состав препарата: цитохром С – 675 мкг, аденозин – 2 мг, никотинамид – 20 мг, натрия сукцинат – 1 мг, бензалкония хлорид – 40 мкг в 1 мл готового препарата. В глазной практике местно применяется масляный раствор классического фенольного антиоксиданта – Ионол (2,6-ди-трет-бутил-4-метилфенол) – синтетический пространственно затрудненный фенол – обладает доказанной высокой антирадикальной и антиоксидантной активностью в системах in vivo и in vitro, способен задерживать помутнение хрусталика и увеличивать активность глутатион-SH-трансферазы эпителия хрусталика в системе in vitro в условиях присутствия в инкубационной среде 4-гидроксиноненаля (7). Ионол применяется в клинической практике для уменьшения зоны некроза в острый период инфаркта миокарда, для ускорения рубцевания язв желудка, при раке мочевого пузыря в виде 10% суспензии местно. Цель изобретения – разработка местного глазного лекарственного препарата с высокими антиоксидантными свойствами, применение которого в эксперименте вызовет стабилизацию и регресс формирующейся катаракты. Сущность изобретения состоит в том, что для лечения катаракты в эксперименте применен 2,2% масляный раствор ионола в виде инсталляций в конъюнктивальную полость глаза 3 раза в день. Концентрация раствора была выбрана экспериментальным путем с учетом данных об эффективной антиоксидантной концентрации ионола в системах in vivo и in vitro, данных о фармакокинетике ионола и липотропных глазных лекарственных форм (7, 8). 25 кроликов были разбиты на 5 групп: 1) инсталляции растворителя; 2) инсталляции 22% раствора ионола; 3) инсталляции 10% раствора ионола; 4) инсталляции 2,2% раствора ионола; 5) инсталляции 0,22% раствора ионола. Подопытные животные получали инсталляции указанных растворов 3 раза в день с интервалом в 6 часов в оба глаза в течение 30 дней. Критерием выбора эффективной концентрации было достоверно значимое увеличение лаг-фазы накопления малонового диальдегида (что является мерой емкости антиоксидантной защиты ткани) в гомогенате хрусталика и позитивное изменение активности глутатион-зависимых антиоксидантных ферментов хрусталика. В результате проведенных биохимических анализов хрусталиков подопытных животных инстилляции 2,2% раствора ионола достоверно значимо увеличили продолжительность лаг-фазы накопления малонового диальдегида с 42,5 мин до 52,5 мин; увеличили активность глутатион-SH-трансферазы с 16 ЕД/г белка до 27,5 ЕД/г белка, глутатион-редуктазы с 9,4 ЕД/г белка до 13,2 ЕД/г белка. Основываясь на полученных данных, мы предположили получение достаточно выраженного антиоксидантного и антикатарактального эффекта 2,2% масляного раствора ионола на лабораторной модели катаракты, полученной путем химической индукции свободнорадикального окисления биополимеров тканей глаза. Предполагаемый результат. Получение достоверно значимого антикатарактального и антиоксидантного (для ткани хрусталика) эффектов при применении заявляемого препарата на лабораторной модели катаракты. 2,2% масляный раствор ионола готовился еженедельно путем растворения 110 мг ионола в 5,0 мл стерильного рафинированного, не обогащенного витамином Е оливкового масла. Между закапываниями препарат хранился в холодильнике при +2°С, непосредственно перед инсталляцией препарат нагревался до комнатной температуры. Сравнительное исследование антиоксидантной и антикатаракгальной эффективности 2,2% раствора ионола проведено на 54 кроликах-самцах средним весом 2 кг, породы “Шиншилла”. В каждой группе лечения (и группа без лечения) – по 12 животных, по 3 кролика (6 глаз) на каждый срок биохимических исследований. Группа интактных – 6 животных (12 глаз). У всех животных (кроме интактных) была вызвана катаракта путем химической инициации свободнорадикального окисления биополимеров тканей глаза (9). Контрольные методы лечения: placebo, “Офтан Катахром”, масляный раствор Динамику процесса формирования катаракты и эффективность проводимого лечения оценивали экспериментально-клиническими методами: бокового освещения, проходящего света и биомикроскопии. Для изучения активности свободнорадикального окисления липидов определяли содержание малонового диальдегида; для оценки состояния антиоксидантной защиты хрусталика определяли количество восстановленного глутатиона, суммарную емкости антиоксидантной защиты ткани хрусталика (по продолжительности лаг-фазы накопления малонового диальдегида в инкубируемом в присутствии кислорода гомогенате хрусталика), активность глутатионпероксидазы, глутатионредуктазы и глутатион-SH-трансферазы. Также определяли количество восстановленных тиоловых белковых групп. Выведение животных из опыта для проведения биохимических исследований хрусталиков осуществляли на 14, 28, 42 и 56 сутки от момента введения индуктора катарактогенеза. У животных всех групп начальные катаракгальные изменения хрусталиков появились к 3-7 суткам в коре и при отсутствии медикаментозного лечения имели тенденцию к неуклонному прогрессу, за исключением 1 случая стабилизации к 42 суткам, К 56 суткам у животных, не получавших лечения, наблюдались сливные очаги помутнения корковых отделов хрусталика. Лечение препаратами начинали со времени появления начальных катарактальных изменений хрусталиков у всех животных (с 7 суток от введения индуктора катарактогенеза). Эффект заявляемого препарат. Терапия 2,2% масляным раствором ионола более эффективна по проценту стабилизации и регресса помутнений уже к 14 суткам (табл.1).
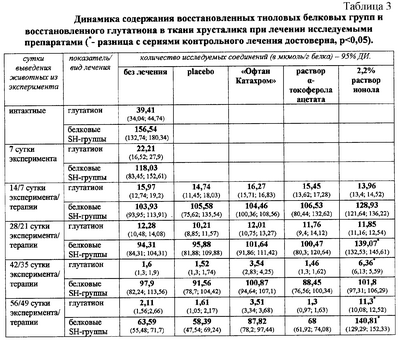
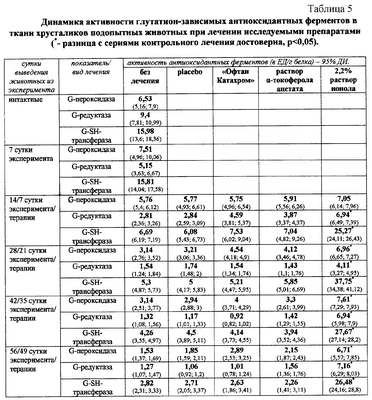
Лечение раствором ионола, в сравнении с контрольными методами лечения, достоверно значимо (р<0,05) снижало активность свободнорадикального окисления липидов хрусталика на 14, 28, 42 и 56 сутки; предотвращало окисление белковых восстановленных тиоловых групп на 28 и 56 сутки; увеличивало содержание восстановленного глутатиона на 42 и 56 сутки; более существенно предотвращало уменьшение продолжительность лаг-фазы накопления малонового диальдегида в инкубируемых гомогенатах хрусталиков подопытных животных на 14, 28, 42 и 56 сутки. Применение раствора ионола предотвратило истощение активности глутатион-пероксидазы и глутатион-редуктазы, способствовало поддержанию активности глутатион-пероксидазы на высоком уровне; способствовало увеличению и поддержанию в течение всего эксперимента высокой активности глутатион-SH-трансферазы. В цифровом выражении результаты представлены в таблицах 2, 3, 4 и 5.
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ. 2. Э.В.Мальцев. Хрусталик. М.: “Медицина”, 1988. 3. Справочник Видаль. Лекарственные препараты в России: Справочник. Изд. 9-е. М.: “АстраФармСервис”, 2003. 4. В.З.Ланкин, А.К.Тихазе, Ю.Н.Беленков. Свободнорадикальные процессы в норме и при патологических состояниях. Изд. 2-е. М.: РКНПК МЗ РФ, 2001. 7. Н.К.Зенков, Н.В.Кандалинцева, В.З.Ланкин, Е.Б.Меньшикова, А.Е.Просенко. Фенольные биоантиоксиданты. Новосибирск: СО РАМН, 2003. – прототип. 8. А.-Ю.А.Гендролис. Глазные лекарственные формы в фармации. М.: “Медицина”, 1988. Формула изобретения
Антиоксидантное средство для лечения катаракты, отличающееся тем, что в качестве антиоксиданта содержит 2,2%-ный масляный раствор ионола.
MM4A – Досрочное прекращение действия патента СССР или патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 22.02.2007
Извещение опубликовано: 20.06.2008 БИ: 17/2008
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

 -токоферола ацетата. Данных о влиянии этой лекарственной формы на метаболизм хрусталика нет. Эфир
-токоферола ацетата. Данных о влиянии этой лекарственной формы на метаболизм хрусталика нет. Эфир  – разница с сериями контрольного лечения достоверна, р<0,05)
– разница с сериями контрольного лечения достоверна, р<0,05)