|
|
(21), (22) Заявка: 2003118618/15, 20.06.2003
(24) Дата начала отсчета срока действия патента:
20.06.2003
(43) Дата публикации заявки: 10.12.2004
(46) Опубликовано: 10.04.2007
(56) Список документов, цитированных в отчете о
поиске:
Антитела 1. Методы. – М.: Мир, 1991, с.21-32. Иммуноферментный анализ под ред. Нго и Ленхоффа. – М.: Мир, 1988, 378-381. RU 2173347 С2, 10.09.2001. MONAGHAN D.A. et al. Sandwich enzyme immunoassay of osteocalcin in serum with use of an antibody against human osteocalcin. Clin. Chem. 1993, Jun; 39 (6), p.942-946. ICHIKAWA Т et al. A highly sensitive
Адрес для переписки:
630559, Новосибирская обл., Новосибирский р-н, пгт Кольцово, ГНЦ ВБ “Вектор”, патентный отдел, Ю.Н. Мистюрину
|
(72) Автор(ы):
Полтавченко Александр Георгиевич (RU),
Кривенчук Николай Андреевич (RU),
Серпинский Олег Игоревич (RU),
Тюнников Георгий Иванович (RU)
(73) Патентообладатель(и):
Федеральное государственное учреждение науки “Государственный научный центр вирусологии и биотехнологии “Вектор” Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (ФГУН ГНЦ ВБ “ВЕКТОР” Роспотребнадзора) (RU),
Закрытое акционерное общество “ИмДи” (RU)
|
(54) СПОСОБ МНОГОПРОФИЛЬНОГО ИММУНОХИМИЧЕСКОГО ВЫЯВЛЕНИЯ АНТИГЕНОВ В ЖИДКИХ ОБРАЗЦАХ
(57) Реферат:
Изобретение относится к области лабораторной диагностики и может быть использовано для одновременного выявления в исследуемых образцах специфических антигенов (АГ), являющихся маркерами инфекционных, паразитарных, аллергических и соматических заболеваний в медицине, ветеринарии, биотехнологии, эпидемиологических и экологических исследованиях и научных экспериментах. Сущность способа состоит в одновременном выявлении нескольких (по числу нанесенных на подложку антител) различных по специфичности антигенов. Учет результатов осуществляется визуально или посредством сканирования и последующего компьютерного анализа изображения. Техническим результатом является упрощение и значительное ускорение иммунохимического обследования за счет одновременного (в одном анализе) получения данных о наличии в исследуемом образце ряда антигенов. 6 з.п. ф-лы, 3 табл., 3 ил.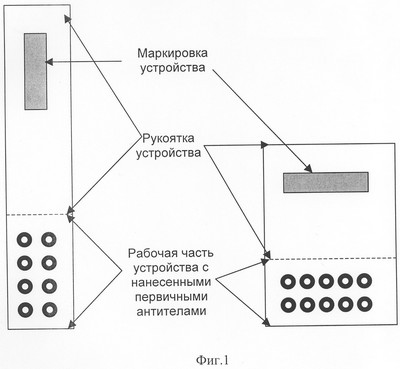
(56) (продолжение):
CLASS=”b560m”enzyme immunoassay for GCSF in human plasma. Exp. Hematol. 1995, Mar; 23 (3), p.192-195. US 5486452 A, 23.01.1996.
Изобретение относится к иммунохимическим методам анализа и может быть использовано для одновременного выявления в исследуемых образцах специфических антигенов (АГ) – маркеров различных инфекционных, паразитарных, аллергических, соматических и онкогенных заболеваний в медицине, ветеринарии, экологических исследованиях и научных экспериментах.
Сущность такого выявления заключается в специфической иммобилизации антигенов исследуемого образца набором известных антител (первичных иммунореагентов), в определенном порядке дискретно зафиксированных на плотной подложке аналитического устройства. Иммобилизованные антигены обрабатываются смесью антител, специфичных ко всему спектру анализируемых антигенов, (вторичный иммунореагент), в результате чего образуется тройной комплекс: первичный иммунореагент – антиген – вторичный иммунореагент. Образовавшиеся комплексы затем обнаруживаются с помощью конъюгата – антител, специфичных к вторичному иммунореагенту и связанных с легко выявляемой меткой.
Из многообразия методов иммунологического анализа, разработанных к настоящему времени, особой популярностью пользуются твердофазные системы, в которых один из компонентов связан с плотной подложкой (матрицей). Такой подход позволяет легко отделять образовавшиеся комплексы от несвязавшихся компонентов промывкой матрицы, что значительно сокращает время и упрощает процедуру анализа.
Известно множество вариантов реализации твердофазного иммуноанализа, однако все созданные к настоящему времени тест-системы для определения антигенов обладают моноспецифичностью, т.е. позволяют выявлять антигены одного или нескольких антигенно-близких агентов. Во многом это связано со свойствами антител, используемых в качестве первичных иммунореагентов.
Источниками антител могут быть сыворотки реконвалесцентов (людей и животных, получивших иммунитет в результате перенесенной инфекции), вакцинированных (людей и животных получивших иммунитет в результате введения в организм ослабленных или убитых инфекционных агентов, а также отдельных антигенов, выделенных из микроорганизмов или полученных искусственным путем (синтезом или путем рекомбинантных технологий)). Такие сыворотки являются поликлональными т.е. содержат большое количество антител различной специфичности. Уровни и спектр антител в них значительно варьируют в зависимости от многих факторов (вида и индивидуальных особенностей организма хозяина, анамнеза, способа введения антигена и т.п.). Использование поликлональных сывороток в иммуноанализе вызывало необходимость применения сложных, часто афинных, способов выделения нужных антител, тщательного подбора компонентов тест-системы и условий проведения анализа в каждом конкретном случае.
Успехи биотехнологии последних лет позволили создать гибридомные технологии, способные получать необходимые количества моноклональных (специфических к одной определенной антигенной детерминанте) антител, а также разработать более эффективные способы выделения и очистки антител из поликлональных сывороток. Это позволило, с одной стороны, существенно повысить специфичность анализа, а с другой стороны, добиться физико-химической унификации антител при их иммунологическом разнообразии, что делает их пригодными для использования в многопрофильном анализе. Однако до сих пор многопрофильный анализ не был реализован.
Известна тест – система “ImmunoComb HBs Ag 90” фирмы «Orgenics», Израиль [1], предназначенная для качественного выявления поверхностного антигена вируса гепатита В (HBs Ag). Ее рабочее устройство представлено в виде плоской пластиковой гребенки, на каждом зубце которой нанесены в виде отдельных пятен антитела к HBs Ag, а также биотинилированный бычий сывороточный альбумин-контроль для проверки работы конъюгата. Способ выявления антигена в этой тест-системе представляет собой один из вариантов дот – иммуноанализа (dot (blot, spot) overlay immunoassay) на поверхности непористого носителя, включающего последовательные инкубации устройства в: предварительно разведенном образце; отмывочном растворе; растворе вторичного иммунореагента, меченного биотином; отмывочном растворе; растворе конъюгата стрептавидина со щелочной фосфатазой; отмывочном растворе; растворе субстрата для проявления щелочной фосфатазы; отмывочном растворе. После окончания анализа устройство высушивают на воздухе и визуально учитывают результаты по наличию синих пятен в местах нанесения антигенов и контроля. Такие устройство и способ анализа пригодны для выполнения исследований во внелабораторных условиях, однако они позволяют выявлять только один антиген – маркер инфекции вирусного гепатита В.
Наиболее близким техническим решением является устройство и способ анализа, описанные в Патенте США №5486452 [2, прототип]. Устройство для иммунологического анализа представляет собой пористую подложку, содержащую множественные ограниченные области адсорбированных на ее поверхности различных антигенов, представленные в виде точек, микроточек или линий, расположенных в определенном геометрическом порядке, и полученные путем нанесения аликвот антигенов на подложку дозирующими устройствами. Свободные от антигенов участки подложки блокированы неспецифическим белком. Способ иммуноанализа представляет собой дот-иммуноанализ с использованием антител или белка комплемента, конъюгированных с изотопной, флюоресцентной или ферментной (пероксидаза хрена) меткой. Принципиальная схема иммуноанализа сходна со схемой, описанной в [1].
Приведенное в описании [2] устройство имеет следующие недостатки:
1. В качестве плотной подложки устройства используется пористая матрица, предпочтительно из нитроцеллюлозы, с толщиной листа предпочтительно 0,1 мм. Такие матрицы отличаются хрупкостью и малой механической прочностью, что значительно затрудняет их рутинное использование. Другим недостатком таких подложек является сложность удаления несвязавшихся компонентов реакции из мелких пор матрицы (длительная, многократная отмывка с активацией), что значительно усложняет методику и повышает вероятность фоновых явлений.
2. С целью миниатюризации описанного устройства зоны адсорбции антигенов представлены в виде пятен диаметром менее 2 мм или линиями с шириной менее 2 мм (получаемые нанесением аликвот антигенов в объеме менее 1 мкл), что предполагает использование специальных считывающих устройств, и не позволят проводить достоверный прямой визуальный учет результатов анализа.
Приведенный в описании [2] способ анализа имеет недостатки, связанные с использованием конъюгатов на основе изотопных, флюоресцентных или ферментной (пероксидаза хрена) меток. Работа с изотопами требует обеспечения специальных условий безопасности и не может широко использоваться в рутинных анализах. Использование флюоресцентных меток требует весьма дорогого и потому обычно недоступного для клинической практики оборудования для инструментального учета результатов анализа. Для анализов с применением в качестве метки пероксидазы хрена в сочетании с субстратами, дающими нерастворимые продукты (4-хлоро-1-нафтол или 3,3-диаминобензидин) характерна относительно невысокая чувствительность, примерно на порядок уступающая чувствительности планшетного варианта иммунопероксидазного теста с использованием субстратов, дающих растворимые окрашенные продукты [3].
Технической задачей настоящего изобретения является создание устройства и способа для осуществления многопрофильного, одновременного выявления нескольких (более трех) антигенов с высокой чувствительностью и визуальным учетом результатов, пригодного для рутинного использования в клинической практике.
Поставленная задача решается использованием предлагаемого устройства для иммунологического определения, представляющего собой плоскую непористую подложку, на которой дискретно нанесены первичные антитела к разным антигенам (маркерам инфекционной, паразитарной, соматической, аллергической или онкогенной патологии), способные эффективно связывать специфические антигены в одинаковых условиях анализа. Устройство может изготавливаться в виде отдельных стрипов или гребенки, каждый зуб которой является индивидуальным устройством.
В отличие от [1] каждое устройство содержит набор из нескольких (более 3) первичных антител. В отличие от [2] устройство изготавливается из непористого пластика (предпочтительно из полистирола). Такие материалы подложки прочно удерживают на своей поверхности первичные антитела, легко отмываются от несвязавшихся компонентов и обеспечивают механическую прочность устройства (см. Пример 3). В отличие от [2] первичные антитела на подложку предлагаемого устройства наносятся аликвотами от 2,5 до 3 мкл в виде точек (отдельных пятен), что позволяет проводить надежный визуальный результат анализа.
Оптимально использовать подложки белого цвета, на которых легче осуществлять визуальный учет цветных иммунологических сигналов. Форма и размеры устройства могут варьировать в зависимости от количества первичных иммунореагентов и дизайна их размещения (см. фиг.1). Важно, чтобы каждый из первичных иммунореагентов был строго позиционирован на устройстве, поскольку результаты многопрофильного анализа учитываются по расположению цветного иммунологического сигнала на подложке.
Антитела на подложку наносятся в насыщающей концентрации (5 мкг/мл). Набор антител на устройстве может быть различен в зависимости от задач иммунодиагностики. Он может включать подборку нескольких антител одного профиля (например, антител к возбудителям инфекций, передающихся половым путем; или антител к возбудителям инфекционных и паразитарных заболеваний животных; или антител, способных дифференцировать родовые или штаммовые различия какого-либо одного вида микроорганизмов) или быть относительно универсальным, включая ряд антител к антигенам медицинского или ветеринарного профиля.
В качестве первичного иммунореагента могут быть использованы моноклональные антитела или аффинно выделенные антитела из поликлональных сывороток. В качестве источника первичного иммунореагента могут использоваться сыворотки различных животных. Принципиально важно, чтобы эти источники отличались (по виду животных) от источника вторичного иммунореагента и первичные антитела не взаимодействовали с используемым конъюгатом. Подбор антител для такой системы может быть осуществлен в планшетном варианте иммуноферментного анализа (ИФА) с одинаковыми условиями сорбции антител и постановки анализа. Таким же образом может быть подобрана концентрация антител для сорбции на твердую подложку.
Наряду с первичными специфическими антителами на устройстве могут быть иммобилизованы контрольные образцы. В качестве положительного контроля (контроля работоспособности конъюгата) на подложку могут быть нанесены в определенном месте сыворотка или иммуноглобулины того вида животных, которое служит источником вторичных антител. В качестве отрицательного контроля (контроля специфичности работы устройства) на определенный участок подложки может быть дополнительно нанесена сыворотка крови животного, служащего источником первичных поликлональных антител, или асцитическая жидкость мыши (при использовании в качестве первичного иммунореагента мышиных моноклональных антител), не содержащая специфических антител к спектру определяемых антигенов. Другим отрицательным контролем служат участки, свободные от антигенов и контролей. Как и первичные иммунореагенты, контрольные образцы наносятся в виде строго позиционированных ограниченных пятен с диаметром от 2 до 5 мм. Порядок нанесения первичных антител и контролей маркируется на нерабочей части подложки и приводится в инструкции по применению.
После фиксации первичных иммунореагентов и контрольных образцов свободные участки подложки блокируются одним или несколькими природными или синтетическими полимерами, такими как: бычий сывороточный альбумин, казеин, полиэтиленгликоль и др., и при необходимости могут быть обработаны стабилизатором, замедляющим деградацию антител на подложке.
Предлагаемый способ анализа представляет дот-иммуноанализ, выполняемый по общей схеме, принципиально сходной с описанной в [1 и 2], включающей в себя последовательные инкубации устройства: (1) в разведении анализируемого образца; (2) в отмывочном растворе; (3) в растворе вторичного иммунореагента; (4) в отмывочном растворе; (5) в растворе конъюгата; (6) в отмывочном растворе; (7) в субстрате для проявления метки; (8) в отмывочном растворе.
В отличие от [1] предлагаемый способ иммуноанализа предполагает многопрофильное одновременное выявление наличия нескольких (более трех) специфических антигенов, соответствующих разным инфекционным, паразитарным, аутоиммунным или онкологическим заболеваниям. Многопрофильность анализа достигается применением предлагаемого устройства с несколькими первичными антителами и использованием в качестве вторичного иммунореагента реакционной смеси, содержащей избыток антител ко всему спектру определяемых устройством антигенов. Настоящее изобретение позволяет использовать в качестве вторичного иммунореагента поликлональную сыворотку, или смесь глобулиновых фракций или сывороток одного вида животных, или смесь моноклональных антител, содержащую избыток антител ко всей номенклатуре определяемых антигенов. Важно, чтобы источники вторичного иммунореагента отличались (по виду животных) от источника первичных антител и взаимодействовали с используемым конъюгатом.
В отличие от [1 и 2] предлагаемый способ иммуноанализа предполагает использование конъюгатов на основе третичных антител, связанных с каталитически активными золями золота или серебра, а также «физических проявителей» для усиления иммунологического сигнала золей. Применение таких конъюгатов и физических проявителей позволяют существенно повысить чувствительность анализа по сравнению с конъюгатами на основе ферментов (см. Примеры 1 и 2).В качестве третичных антител могут быть использованы моноклональные или поликлональные антитела, специфичные ко вторичным антителам, но не реагирующие с первичными антителами, используемыми на устройстве. Если в качестве третичных антител используются антивидовые антитела к Fc-фрагменту иммуноглобулинов вторичного иммунореагента, то 3 и 5 стадия в приведенной выше схеме могут быть объединены в одну, что существенно сокращает время анализа.
Настоящее изобретение позволяет использовать на третьей стадии приведенной выше схемы смеси зольных конъюгатов на основе поликлональных или моноклональных антител к отдельным антигенам с исключением 4 и 5 стадии.
Получение золей золота или серебра (средний диаметр частиц 15 нм) и связывание их с третичными антителами может быть осуществлено по известным методикам [4, 5].
Для усиления сигнала зольного конъюгата в предлагаемом способе анализа предполагается использовать физический проявитель, содержащий растворимую соль серебра и восстанавливающий агент (предпочтительно проявитель, содержащий: 0,2% метола и 0,2% нитрата серебра, растворенные в 0,02 М цитратном буферном растворе, рН 3,5). Проявитель готовят перед употреблением, он стабилен до 20 мин при комнатной температуре [5].
После выполнения анализа при наличии в исследуемом образце одного или нескольких антигенов в местах нанесения на подложку соответствующих им первичных антител образуются цветные пятна, учитываемые по их расположению на устройстве визуально или с помощью сканера и последующего компьютерного анализа изображения.
Предлагаемому многопрофильному анализу могут быть подвергнуты: клинические образцы мочи, сыворотки крови, мокроты, ликворов, трансудатов и экссудатов, экстрактов из тканевых образцов и кала, смывов и соскобов с кожи и слизистых оболочек и т.п.; смывы, экстракты и концентраты объектов окружающей среды, пищевых продуктов, предметов гигиены и т.п. Образцы, предназначенные для анализа, должны быть в жидкой фазе с нейтральным рН и не должны содержать грубых включений и мешающих проведению теста примесей.
Чувствительность предлагаемого многопрофильного анализа не уступает чувствительности серийно выпускающихся планшетных моноспецифических иммунопероксидазных тестов (см. примеры 1 и 2).
Предлагаемые устройство и способ иммуноанализа могут использоваться как для массового скрининга образцов, так и для индивидуальных анализов. Они могут использоваться не только в оснащенных лабораториях, но и (в медицине) у постели больного, в кабинете врача, для самодиагностики; (в экологии) в полевых экспериментах; (в ветеринарии) в животноводческих хозяйствах и на личном подворье. Изобретение позволяет за счет определения в одном анализе сразу ряда параметров значительно сократить время на обследование пациента. Кроме того, поскольку один анализ по предлагаемому способу эквивалентен нескольким анализам в моноспецифических системах и по стоимости эти анализы близки, внедрение изобретения в широкую практику может дать значительный экономический эффект. Экономия включает не только разницу себестоимости тест-систем, но и сокращение приборного обеспечения и трудозатрат на проведение анализа.
Описание фигур
Фиг.1 – Примеры общего дизайна устройства для многопрофильного анализа антигенов.
Фиг.2 – Схема нанесения первичных антител (5 мкг/мл, 3,0 мкл) на рабочую часть устройства: (а) асцитическая жидкость мыши, не содержащая специфических антител – отрицательный контроль (К-); (b) IgG человека – положительный контроль (К+); моноклональные антитела к возбудителям: (с) Trichomonas vaginalis, (d) Mycoplasma hominis, (e) Neisseria gonorrhoeae, (f) Chlamydia trachomatis, (g) Ureaplasma urealyticum, (h) Gardnerella vaginalis и результаты многопрофильного дот – иммуноанализа образцов вагинальных смывов, выполненного с применением золотых иммунозолей (к примеру 1, цифрами обозначены номера образцов по таблице 1).
Фиг.3 – Схема рабочей части устройства для оценки чувствительности способа многопрофильного анализа антигенов (к примеру 2). Объем нанесения антител 2,5 мкл, концентрация антител 5 мкг/мл.
Далее следуют примеры конкретного применения изобретения
В пробных экспериментах используют следующие растворы
1) ФСБ – 0.01 М натрий-фосфатный буфер, рН 7,2-7,4, с 0,15 М NaCl;
2) ФСБ-Т – ФСБ с 0,1% твин-20;
3) КБР – концентрат блокирующего раствора, содержащий лизат Е. coli, коммерческий препарат производства фирмы “Капель”, Москва;
4) КБ – 0,025 М Na-карбонатно-бикарбонатный буфер, рН 9,5;
5) ББ – 0,01 М боратный буфер, рН 8,0;
6) РБР-К – раствор для разведения конъюгата и иммунозоля – ФСБ-Т с 0,05% казеина, рН 7,2-7,4;
7) РБР-С – раствор для разведения сывороток – ФСБ-Т с 5% КБР и 0,05% казеина, рН 9,6;
8) субстрат для проявления пероксидазы – коммерческий препарат “Peroxidase substrate Kit DAB” (Cat. SK-4100), производства “Vector Lab. Inc.”, Burlingem, CA, США;
9) ПХ-a/IgG-Hum – конъюгат пероксидазы с моноклональными антителами против IgG человека – коммерческий препарат фирмы “Капель”, Москва;
10) Au-a/IgG-Hum – коллоидное золото (средний диаметр частиц 15 нм), сорбционно связанное с козьими антителами против IgG человека [4];
11) Ag-a/IgG-Hum – коллоидное серебро (средний диаметр частиц 12 нм), сорбционно связанное с козьими антителами против IgG человека;
12) “физический проявитель” для усиления сигнала иммунозолей золота и серебра – 0,2% метола и 0,2% нитрата серебра, 0,5% лимонной кислоты, рН 3,5 [5].
Пример 1. Изготовление и применение устройства для многопрофильного анализа вагинальных смывов на наличие возбудителей мочеполовых инфекций
Изготовление устройства
Промытую дистиллированной водой и высушенную синтетическую бумагу «Polylith» марки «G» нарезают полосками (стрипами) размером 6×60 мм. На поверхность пластика в два ряда вдоль стрипа с интервалами по 5 мм наносят моноклональные антитела к различным возбудителям мочеполовых инфекций (см. фиг.2), а также IgG из сыворотки человека (К+) и асцитическую жидкость мыши, не содержащую специфических антител (К-) в концентрации 5 мкг/мл на ББ, аликвотами по 3,0 мкл, и высушивают в течение 10 ч при комнатной температуре. Длина рабочей части стрипа (участка с нанесенными антителами) составляет около 20 мм, свободную часть стрипа используют как рукоятку. Стрипы на 2/3 длины рабочей частью погружают в 0,2%-ный раствор казеина на ФСБ и инкубируют 1 ч при 37°С. Ополаскивают стрипы ФСБ-Т и высушивают при комнатной температуре.
Применение устройства
Устройства рабочей частью погружают в образцы вагинальных смывов на физ. растворе, полученные от пациентов с различным спектром заболеваний, и инкубируют 60 мин при 37°С. Отмывают трехкратно погружением на 1 мин в ФСБ-Т, инкубируют 30 мин при 37°С в разведении 1/10 на РБР-С сыворотке (смеси сывороток) человека, содержащей (по данным ИФА) IgG к определяемым микроорганизмам в титрах от 1/160 до 1/640. Далее устройства отмывают по 1 мин в 3 сменах ФСБ-Т и инкубируют при 37°С 30 мин в иммунозоле Au-a/IgG-Hum или конъюгате ПХ-a/IgG-Hum (рабочие разведения на РБР-К). Отмывают трехкратно погружением на 1 мин в ФСБ-Т и ополаскивают дистиллированной водой. Проявляют связанный золь погружением стрипов на 10-15 мин в “физический проявитель”, а связанный конъюгат на 20 мин в субстрат для пероксидазы. Учет результатов анализа проводят визуально. Положительным результатом считают четко различимое цветное пятно в месте нанесения на устройство соответствующих антител. Параллельно в соответствии с инструкцией производителя проводят анализ тех же смывов в ИФА на моноспецифических тест-системах производства ЗАО «ИмДи-спектр», Новосибирск.
Полученные результаты приведены в таблице 1, а схема нанесения на устройство первичных антител и картина результатов, полученных в дот-анализе с использованием иммунозоля золота, приведены на фиг.2.
Пример 2. Сравнительная оценка чувствительности планшетного иммунопероксидазного теста и многопрофильного дот-анализа антигенов с использованием иммобилизации первичных моно и поликлональных антител на полистироле посредством бифункционального агента – глутарового альдегида.
Получение устройства.
Белый полистирол УПС-0801 (ТУ-24-27-90) толщиной 0,5 мм нарезают полосками (стрипами) размером 6×60 мм, верхний слой пластика соскабливают.
Стрипы инкубируют 2 ч при комнатной температуре в 2%-ном растворе глутарового альдегида на 0,01 М калий-фосфатном буфере, рН 5,0, трижды отмывают 0,01 М калий-фосфатным буфером, рН 7,0, с 0,1 М NCl и высушивают на воздухе. Наносят контроли, моноклональные антитела к Chlamidia trachomatis и поликлональные афинно очищенные антитела к вирусу Крымской-Конго геморрагической лихорадки (ВККГЛ) в концентрации 5 мкг/мл на КБ, аликвотами по 2,5 мкл, в два ряда вдоль стрипа с интервалами по 5 мм (фиг.3) и инкубируют стрипы 2 ч при 37°С во влажной камере. Дважды промывают стрипы ФСБ-Т. Дальнейшие операции по блокированию стрипа проводят аналогично операциям, описанным в примере 1.
Применение устройства
Приготавливают серии двукратных разведении на физ. растворе образцов: вагинального смыва №1 (см. пример 1) и культурального антигена ВККГЛ. Устройства помещают рабочей частью в пробирки с разведениями образцов и инкубируют 1 ч при 37°С. Отмывают трехкратно погружением на 1 мин в ФСБ-Т, инкубируют 30 мин при 37°С в разведении 1/10 на РБР-С сыворотке человека, содержащей (по данным ИФА) IgG к Chlamidia trachomatis в титре 1/320 и к ВККГЛ в титре 1/160. Далее устройства отмывают по 1 мин в 3 сменах ФСБ-Т и инкубируют 30 мин при 37°С в иммунозоле Ag-a/IgG-Hum или конъюгате ПХ-a/IgG-Hum (рабочие разведения на РБР-К). Отмывают трехкратно погружением на 1 мин в ФСБ-Т и ополаскивают дистиллированной водой. Проявляют связанный золь погружением стрипов на 10-15 мин в “физический проявитель”, а связанный конъюгат на 20 мин в субстрат для пероксидазы. Учет результатов осуществляют визуально. Положительным результатом считают четко различимое темное пятно в месте нанесения на устройство соответствующих антител. Параллельно в соответствии с инструкцией производителя проводят анализ тех же образцов в ИФА на моноспецифических тест-системах для определения антигенов Chlamidia trachomatis (производства фирмы «ИмДи», Новосибирск) и ВККГЛ (производства Института вирусологии РАМН, Москва).
Полученные результаты приведены в таблице 2.
Пример 3. Оценка пригодности листовых синтетических материалов для изготовления подложки устройства для многопрофильного выявления антигенов в жидких образцах.
Получение устройств
Образцы трех категорий листовых синтетических материалов (табл.3): пористых матриц на основе поливинилхлорида и эфиров целлюлозы, непористых органических полимеров (полистирола, поливинилхлорида и лавсана) и непористых комбинированных пластиков, сочетающих органические и минеральные компоненты (синтетическая бумага), отмывают дистиллированной водой и нарезают на стрипы. На основе стрипов, изготовленных из разных материалов, получают устройства для многопрофильного иммуноанализа антигенов так, как это описано в примере 1.
Применение устройств
На устройствах, изготовленных из разных материалов, параллельно осуществляют многопрофильный дот-иммуноанализ вагинального смыва 1 с использованием иммунозолей золота и «физического проявления» так, как это описано в примере 1. После выполнения анализа проводят визуальную сравнительную оценку интенсивности цветных сигналов на подложках из разных материалов. При этом оценивают два параметра:
– эффективность адсорбции материалом первичных иммунореагентов, о которой судят по интенсивности специфического сигнала в местах нанесения контроля (К+), а также первичных антител к Trichomonas vaginalis, Chlamidia trachomatis и Mycoplasma hominis;
– способность материала к неспецифическому связыванию компонентов или к спонтанному проявлению, о которых судят по наличию фонового сигнала на несенсибилизированных участках устройства.
Пригодными для изготовления подложки устройства считают материалы, обеспечивающие хорошую адсорбцию на себе первичных антител и не провоцирующие фоновых сигналов.
Полученные результаты приведены в таблице 3.
Источники информации
1. www.orgenics.com; www.biograd.ru
2. Патент США №5486452 “Devices and kits for immunological analysis”. G 01 N 033/548.
3. Егоров А.М., Осипов А.П., Дзантиев Б.Б. и др. Теория и практика иммуноферментного анализа. – М.: Высш. школа, 1991. – 360 с.
4. Raska I. Electron microscopic immunocytoshemistry with colloidal gold. – Laboratory manual of the practical course organised by the Institute of Experimental Medicine, Czechoslovak Academy of Sciences in collaboration with the Czeshoslovak Biochemical Society of me Czechoslovak Academy of Sciences, Prague, May 29th-Jine 3 rd, 1988.
| Таблица 1 |
| Сравнительные результаты выявления антигенов возбудителей мочеполовых инфекций в образцах вагинальных смывов моноспецифическим планшетным ИФА и многопрофильным дот-иммуноанализом с золотым (Au-SpA) и пероксидазным (ПХ-a/IgG} конъюгатами. |
| Тест-система |
Результаты моно-специфи-ческого ИФА |
Результаты многопрофильного дот-иммуноанализа |
| Конъюгат |
ПХ-a/IgG |
Au-SpA |
ПХ-a/IgG |
| Смыв |
1 |
2 |
3 |
4 |
5 |
6 |
1 |
2 |
3 |
4 |
5 |
6 |
1 |
2 |
3 |
4 |
5 |
6 |
| Т. vaginalis |
+ |
– |
– |
– |
– |
– |
+ |
– |
– |
– |
– |
– |
± |
– |
– |
– |
– |
– |
| С.trachomatis |
+ |
+ |
– |
– |
+ |
– |
+ |
+ |
– |
– |
+ |
– |
+ |
± |
– |
– |
± |
– |
| М. hominis |
+ |
– |
+ |
– |
– |
– |
+ |
– |
+ |
– |
– |
– |
– |
– |
± |
– |
– |
– |
| U. urealyticum |
– |
– |
+ |
– |
+ |
– |
– |
– |
+ |
– |
+ |
– |
– |
– |
+ |
– |
– |
– |
| N. gonorrhoeae |
– |
– |
– |
+ |
+ |
– |
– |
– |
– |
+ |
+ |
– |
– |
– |
– |
± |
+ |
– |
| G. vaginalis |
– |
+ |
+ |
+ |
– |
– |
– |
+ |
+ |
+ |
– |
– |
– |
– |
– |
+ |
– |
– |
| IgG Hum (K+) |
|
|
|
|
|
|
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
| Асцитическая жидкость без специфических антител (К-) |
|
|
|
|
|
|
– |
– |
– |
– |
– |
– |
– |
– |
– |
– |
– |
– |
| +отчетливо определяемое пятно в месте несения антител (положительный результат), ±слабо определяемое пятно в месте нанесения антител (слабо положительный результат), – чистый фон подложки в месте нанесения антител (отрицательный результат) |
| Таблица 2 |
| Сравнительные результаты оценки чувствительности выявления Chlamidia trachomatis (Chlamidia) в вагинальном смыве и вируса Крымской-Конго геморрагической лихорадки (ВККГЛ) в культуральной жидкости (КЖ) с использованием моноспецифических ИФА тест-систем и многопрофильного дот-иммуноанализа с золотым (Au-a/IgG) и пероксидазным (ПХ-a/IgG) конъюгатами. (схема устройства приведена на фиг.2). |
| Образец |
Разведение образца |
Результаты моноспецифического планшетного варианта ИФА |
Результаты многопараметрического дот – иммуноанализа |
| ПХ-a/IgG |
Ag-a/IgG |
ПХ-a/IgG |
| Chlamidia |
ВККГЛ |
Chlamidia |
ВККГЛ |
К- |
К+ |
Chlamidia |
ВККГЛ |
К- |
К+ |
| |
+ |
– |
+ |
– |
+ |
– |
+ |
– |
+ |
| К Ж |
1/50 |
|
+ |
– |
+ |
– |
+ |
– |
+ |
– |
+ |
| 1/100 |
|
+ |
– |
+ |
– |
+ |
– |
± |
– |
+ |
| 1/200 |
|
± |
– |
+ |
– |
+ |
– |
– |
– |
+ |
| 1/400 |
|
– |
– |
– |
– |
+ |
– |
– |
– |
+ |
| 1/800 |
+ |
|
+ |
– |
– |
+ |
+ |
– |
– |
+ |
| Смыв |
0 |
+ |
|
+ |
– |
– |
+ |
+ |
– |
– |
+ |
| 1/5 |
+ |
|
+ |
– |
– |
+ |
± |
– |
– |
+ |
| 1/10 |
– |
|
– |
– |
– |
+ |
– |
– |
– |
+ |
| +отчетливо определяемое пятно в месте нанесения антител (положительный результат),±слабо определяемое пятно в месте нанесения антител (слабоположительный результат), – чистый фон подложки в месте нанесения антител (отрицательный результат). |
| Таблица 3 |
Результаты оценки пригодности различных листовых синтетических материалов для изготовления подложки устройства для многопрофильного анализа антигенов (к примеру 3).
Число знаков «+» в таблице пропорционально уровню визуального сигнала после выполнения анализа. |
| Характеристики материала |
Результаты оценки |
| Категория |
Марка (ТУ) Источник (производитель) |
Цвет |
Сорбция |
Фон |
Пригодность |
| Пористые мембраны |
HAWP Millipore, США |
Белый |
++++ |
– |
Малопригоден из за ломкости материала и сложности отмывок |
| Trans-Blot 162-0114 Bio-Rad, США |
Белый |
++++ |
– |
ФПМ-Г1 ВХ
Пластопо. жмер С-Петербург |
Белый |
++ |
– |
Непригоден |
| Полистирол |
УППС-O.SOl (Ту-24-2 7-90) ЗАО «Кайрос», г.Омск |
Белый |
+++ |
– |
Пригоден |
| ПС (ТУ-10-24-27-90) ООО «Термахим» г.Новосибирск |
Белый |
+++ |
– |
Пригоден |
| Полиэтилен-терифталат (Лавсан) |
Химкомбинат г.Владимир |
Прозрачный |
+ |
+ |
Непригоден |
| 3R96002 Type С Rank Xerox, Великобритания |
Прозрачный |
+ |
– |
Непригоден |
| 3R96002 Type С Химически модифицир. НИИ ОХ, г.Новосибирск |
Прозрачный |
+++ |
– |
Пригоден |
| Синтетическая бумага “POLILITH” |
Марка «Р» Фирма «Берег», С-Петербург |
Белый |
++++ |
++ |
Непригоден |
| Марка «G» Фирма «Берег», С-Петербург |
Белый |
++++ |
– |
Лучший материал для изготовления подложки |
Формула изобретения
1. Способ иммунохимического анализа, включающий инкубацию стрипа с фиксированными антителами в жидком образце, отмывку, инкубацию в растворе вторичных антител к определяемому антигену, отмывку, инкубацию в конъюгате меченых антивидовых антител, отмывку, инкубацию в растворе субстрата для проявления метки, отмывку и учет результатов, отличающийся тем, что на поверхности подложки, выполненной из непористого пластика, иммобилизуют первичные антитела к различным антигенам в виде отдельных пятен, дополнительно в качестве контроля работы конъюгата наносят иммуноглобулины того вида животных, которое служит источником вторичных антител, в качестве отрицательного контроля наносят асцитическую жидкость мыши, антитела и контроль наносят в виде растворов с концентрацией белка 5 мкг/мл в объеме 2,5-3 мкл, в качестве вторичных антител применяют смесь поликлональных антител, специфичных ко всем определяемым антигенам и отличающихся по источнику получения от первичных антител, сорбированных на подложке, используют конъюгаты на основе каталитически активных золей золота или серебра с диаметром частиц 0,005-0,1 мкм, связанных с антителами к определяемым антигенам, и в качестве субстрата для проявления каталитической метки используют «физические проявители».
2. Способ по п.1, отличающийся тем, что в качестве конъюгата используют золи, связанные с антивидовыми иммуноглобулинами, специфичными к Fc-фрагменту вторичных антител.
3. Способ по п.1, отличающийся тем, что используют конъюгаты на основе каталитически активных золей золота или серебра со средним диаметром частиц 15 нм.
4. Способ по п.1, отличающийся тем, что в качестве физических проявителей применяют раствор, включающий 0,2% метола, 0,2% нитрата серебра и 0,5% лимонной кислоты.
5. Способ по п.1, отличающийся тем, что используют подложку, выполненную из белого полистирола.
6. Способ по п.1, отличающийся тем, что подложка выполнена в виде плоской «гребенки», на каждом зубце которой дискретно нанесены используемые в анализе антитела.
7. Способ по п.1, отличающийся тем, что иммобилизованные антитела представлены моноклональными антителами.
РИСУНКИ
|
|