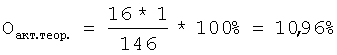Патент на изобретение №2296989
|
||||||||||||||||||||||||||
(54) СПОСОБ ОПРЕДЕЛЕНИЯ АЛКИЛПЕРОКСИДОВ
(57) Реферат:
Изобретение относится к аналитической химии, а именно к способу определения диалкилпероксидов и (СН3)3С-O-O-С(СН3)R1R2, где R1=R2=CH3; R1=H, R2=ОСН3, ОСН2-CH(СН3)2, O-цикло-С6Н11, ОС6Н5, ОСН2-(СН2-O-СН2)2-СН2OH, ОСН2-СН(ОН)-СН2OH, и может быть использовано на заводах и в лабораториях при производстве и применении диалкилпероксидов и их функциональных производных. Способ определения диалкилпероксидов и (СН3)3С-O-O-С(СН3)R1R2, где R1=R2=CH3; R1=H, R2=ОСН3, ОСН2-CH(СН3)2, O-цикло-С6Н11, ОС6Н5, ОСН2-(СН2-O-СН2)2-СН2OH, ОСН2-СН(ОН)-СН2OH, включает обработку пероксида йодистым калием в присутствии уксусной кислоты и бикарбоната натрия с последующим йодометрическим титрованием, добавление после обработки пробы йодистым калием 40%-ного водного раствора, бромистого водорода при массовом соотношении к анализируемому веществу, равном соответственно 70:1, а после обработки пробы выдерживают при температуре 70°С в течение 15 мин. Техническим результатом является возможность определения диалкилпероксидов и
Изобретение относится к аналитической химии, а именно к способу определения алкилпероксидов, в качестве которых используют диалкилпероксиды и (СН3)3С-O-O-С(СН3)R1R2, где R1=R2=CH3; R1=H, R2=ОСН3, ОСН2-CH(СН3)2, O-цикло-С6Н11, ОС6Н5 и ОСН2-(СН2-O-СН2)2-СН2OH, ОСН2-СН(ОН)-СН2OH, и может быть использовано на заводах и в лабораториях при производстве и применении диалкилпероксидов и их функциональных производных для оценки чистоты пероксидов и их конверсии в радикальных процессах, в том числе при полимеризации, вулканизации, отверждении и присоединении по кратным связям олефинов. Йодометрический метод определения пероксидных соединений основан на восстановлении пероксидной группы йодид-ионом [Антоновский В. Л., Бузланова М.М. Аналитическая химия органических пероксидных соединений. М.: Химия, 1978. – 309 с.]: Выделяющийся йод определяют титрованием водным раствором тиосульфата натрия Однако диалкилпероксиды и их алкоксипроизводные являются трудновосстанавливаемыми пероксидными соединениями и не выделяют йод даже при длительном нагревании в присутствии йодидов калия или натрия в среде уксусной кислоты [Антоновский В.Л., Бузланова М.М. Аналитическая химия органических пероксидных соединений. М.: Химия, 1978, с.14-46]. Таким образом, метод с использованием йодидов калия или натрия не пригоден для определения этого класса пероксидов. Известен способ определения пероксидов трет-алкилов путем обработки анализируемого вещества йодистым натрием в присутствии ледяной уксусной и концентрированной соляной кислот в атмосфере углекислого газа с последующим йодометрическим титрованием [Антоновский В. Л., Бузланова М. М. Аналитическая химия органических пероксидных соединений. М.: Химия, 1978, с.31-34, 45]. В литературе описаны два варианта проведения анализа пероксидов трет-алкилов на содержание активного кислорода данным способом. Недостатками первого варианта способа являются длительная продолжительность определения – в течение 1 часа при 40-45°С – и невозможность определения Во втором варианте способа йодистый натрий по частям постепенно растворяют в ледяной уксусной кислоте, вносят пробу, концентрированную соляную кислоту и выдерживают анализируемое пероксидное соединение 50 мин при 120°С [Mair R.D., Graupner A.I. Analyt. Chem., 1964, v.36, p.194-204; Wagner С., Smith R., Peters D. Analyt. Chem., 1947, v.19, p.976-979; Horner L., Jürgens E. Angew. Chem., 1958, bd.70, s.266-268]. Недостатками в этом случае по сравнению с первым вариантом способа являются увеличенное количество используемой уксусной кислоты (в два раза больше), йодистого натрия (в 1,5 раза больше), повышенная температура определения, что приводит к термораспаду пероксидов, и трудоемкость метода. Известен способ определения пероксидов алкилов с использованием 55-58%-ной йодистоводородной кислоты и ледяной уксусной кислоты в атмосфере углекислого газа [Критчфилд Ф. Анализ основных функциональных групп в органических соединениях. М.: Мир, 1965. – 207 с.; Dickey F. H. Ind. Eng. Chem., 1949, v.41, p.1673-1679]. Недостатками способа являются длительная продолжительность определения – 2 часа при 60°С – и невозможность определения Наиболее близким к предлагаемому изобретению является способ определения пероксидов алкилов путем обработки анализируемого пероксида йодистым калием в среде ледяной уксусной и концентрированной соляной кислот с добавлением бикарбоната натрия [А.с. №1049802, МКИ G 01 N 31/16. Б.И. 1983, №39]. Пробу ди-трет-бутилпероксиалкилпероксида выдерживали при 90°С в течение 15 мин. При этом бикарбонат натрия взаимодействует с соляной кислотой с образованием углекислого газа, то есть создаются условия инертной атмосферы, что благоприятствует более точному определению пероксида. Недостатком данного способа является невозможность количественного определения диалкилпероксидов и их Кроме того, указанная температура выдерживания пробы – 90°С – является повышенной для диалкил- и Задачей предлагаемого изобретения является разработка способа определения диалкилпероксидов и Техническим результатом является возможность определения диалкилпероксидов и Указанный технический результат достигается разработкой способа определения алкилпероксидов, включающего обработку анализируемой пробы и контрольной пробы без навески пероксида йодистым калием в присутствии уксусной кислоты и бикарбоната натрия с последующим йодометрическим титрованием каждой пробы и дальнейшим определением содержания пероксидов по разности двух титрований, причем в качестве алкилпероксидов используют диалкилпероксиды и
где R1=R2=СН3; R1=H, R2=ОСН3, ОСН2-CH(СН3)2, O-цикло-С6Н11, ОС6Н5 и ОСН2-(СН2-O-СН2)2-СН2OH, ОСН2-СН(ОН)-СН2OH, обработку каждой пробы осуществляют при добавлении 40%-ного водного раствора бромистого водорода при его массовом отношении к навеске пероксида, равном 70:1, а после обработки пробы выдерживают при температуре 70°С в течение 15 мин. Способ основан на взаимодействии 40%-ного водного раствора бромистого водорода с йодистым калием с образованием йодистоводородной кислоты
при действии которой на диалкил- и Более того, бромистый водород, взаимодействуя с бикарбонатом натрия, образует углекислый газ, что позволяет проводить определение диалкил- и Преимуществом предлагаемого способа является возможность получения йодистоводородной кислоты в результате взаимодействия по реакции (3) в ходе проведения анализа пероксида на содержание активного кислорода. Массовое соотношение 40%-ного раствора бромистого водорода к анализируемой пробе составляет 70:1. Избыток раствора бромистого водорода по отношению к пероксиду обусловлен его расходом по реакциям (3, 5), протекающим количественно. Использование 40%-ного водного раствора бромистого водорода в количестве, превышающем соотношение 70:1, может привести к реакциям побочного нуклеофильного замещения гидроксильных групп образующихся спиртов на бромид-анион, что искажает результаты определения содержания диалкил- и Условия проведения анализа пероксида – 15 мин при температуре 70°С – определяются полной завершенностью реакции (4), состоящей во взаимодействии бромистого водорода с диалкил- или Погрешность определения содержания диалкил- или Определение диалкил- и В коническую колбу на 250 мл вносят ледяную уксусную кислоту, йодистый калий, перемешивают и помещают стаканчик с навеской пероксида (0,15-0,2 г), взвешенной с точностью до 0,0002 г. Затем прибавляют бикарбонат натрия и 8,8-9 мл 40%-ного водного раствора бромистого водорода, закрывают колбу пробкой с гидрозатвором, встряхивают и опрокидывают стаканчик с навеской. Колбу выдерживают при 70°С в течение 15 мин. После этого колбу охлаждают до комнатной температуры, добавляют 100 мл дистиллированной воды и титруют 0,1 н. водным раствором тиосульфата натрия в присутствии крахмала до обесцвечивания. Аналогично проводят холостое определение, без навески пероксида. Содержание активного кислорода А (%) рассчитывают по формуле
Содержание диалкил- или
где a, b – количество 0,1 н. раствора тиосульфата натрия, затраченное на титрование анализируемой и контрольной проб, мл, К – поправочный коэффициент 0,1 н. раствора тиосульфата натрия, К=1, 0,0008 – количество кислорода, соответствующее 1 мл 0,1 н. раствора тиосульфата натрия, с – навеска анализируемой пробы, г, Оакт.теор. – теоретически рассчитанное содержание активного кислорода в диалкил- или Для лучшего понимания сущности изобретения приводим примеры конкретного выполнения. Пример 1. Определение активного кислорода в ди-трет-бутилпероксиде (СН3)3С-O-O-C(CH3)3. В коническую колбу на 250 мл вносят 10 мл ледяной уксусной кислоты, 1,5 г йодистого калия, перемешивают и помещают стаканчик с навеской пероксида в количестве 0,1715 г, затем прибавляют 4 г бикарбоната натрия и 9 мл 40%-ного водного раствора бромистого водорода, закрывают колбу пробкой с гидрозатвором, встряхивают и опрокидывают стаканчик с навеской. Колбу выдерживают при 70°С в течение 15 мин. После этого колбу охлаждают до комнатной температуры, добавляют 100 мл дистиллированной воды и титруют 0,1 н. водным раствором тиосульфата натрия в присутствии крахмала до обесцвечивания. В аналогичных условиях титруют контрольную пробу. При расчете содержания активного кислорода в пероксиде используют формулу, приведенную на стр.6, и данные результатов титрования выделившегося при обработке пероксида йода раствором тиосульфата натрия при этом на титрование анализируемой пробы пероксида затрачено 23,9 мл 0,1 н. раствора тиосульфата натрия, а на титрование контрольной пробы без навески пероксида затрачено 0,2 мл 0,1 н. раствора тиосульфата натрия. Теоретическое содержание активного кислорода в пероксидах рассчитывается по формуле [Антоновский В.Л., Бузланова М.М. Аналитическая химия органических пероксидных соединений. М.: Химия, 1978, с.35-42]
где 16 – атомная масса кислорода, n – количество пероксидных O-O групп, выделяющих атомарный кислород, м.м. – молекулярная масса пероксида. Так, теоретическое содержание активного кислорода в пероксиде (СН3)3С-O-O-C(CH3)3 рассчитывали следующим образом
Пример 2. Определение активного кислорода в 1-метокси-1-трет-бутилпероксиэтане (СН3)3С-O-O-CH(CH3)-OCH3 проводят аналогично примеру 1. А=10,90%, вычислено 10,81%. Пример 3. Определение активного кислорода в 1-изо-бутокси-1-трет-бутилпероксиэтане (СН3)3С-O-O-CH(CH3)-ОСН2-СН(СН3)2 проводят аналогично примеру 1. А=8,50%, вычислено 8,42%. Пример 4. Определение активного кислорода в 1-циклогексилокси-1-трет-бутилпероксиэтане (СН3)3С-O-O-CH(CH3)-O-цикло-С6Н11 проводят аналогично примеру 1. А=7,50%, вычислено 7,41%. Пример 5. Определение активного кислорода в 1-фенокси-1-трет-бутилпероксиэтане (СН3)3С-O-O-CH(CH3)-ОС6Н5 проводят аналогично примеру 1. А=7,70%, вычислено 7,62%. Пример 6. Определение активного кислорода в моно-трет-бутилперокси- Пример 7. Определение активного кислорода в моно-трет-бутилперокси- (СН3)3С-O-O-CH(CH3)-ОСН2-СН(ОН)-СН2OH проводят аналогично примеру 1. А=7,80%, вычислено 7,69%. Таким образом, разработан способ, позволяющий определять диалкилпероксиды и
Формула изобретения
Способ определения алкилпероксидов, включающий обработку анализируемой пробы и контрольной пробы без навески пероксида йодистым калием в присутствии уксусной кислоты и бикарбоната натрия с последующим йодометрическим титрованием каждой пробы и дальнейшим определением содержания пероксидов по разности двух титрований, отличающийся тем, что в качестве алкилпероксидов используют диалкилпероксиды и (СН3)3С-O-O-С(СН3)R1R2, где R1=R2=CH3; R1=H, R2=ОСН3, ОСН2-CH(СН3)2, O-цикло-С6Н11, ОС6Н5, ОСН2-(СН2-O-СН2)2-СН2OH, ОСН2-СН(ОН)-СН2OH, обработку каждой пробы осуществляют при добавлении 40%-ного водного раствора бромистого водорода при его массовом отношении к навеске пероксида, равном 70:1, а после обработки пробы выдерживают при температуре 70°С в течение 15 мин.
MM4A – Досрочное прекращение действия патента СССР или патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 11.01.2008
Извещение опубликовано: 20.10.2009 БИ: 29/2009
|
||||||||||||||||||||||||||

 -алкоксидиалкилпероксидов общей формулы
-алкоксидиалкилпероксидов общей формулы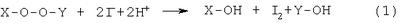
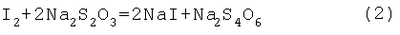
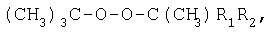
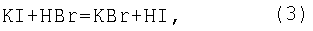
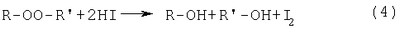
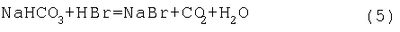
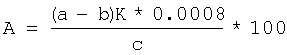
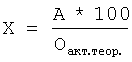 ,
,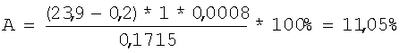
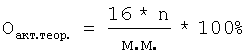 ,
,