|
|
(21), (22) Заявка: 2003132073/13, 25.03.2002
(24) Дата начала отсчета срока действия патента:
25.03.2002
(30) Конвенционный приоритет:
02.04.2001 GB 0108227.0
20.09.2001 GB 0122697.6
(43) Дата публикации заявки: 27.02.2005
(46) Опубликовано: 27.03.2007
(56) Список документов, цитированных в отчете о
поиске:
ZHENG D et al. Characterization of mitochondrial cytochrome b gene from Venturia inegualis. CURRENT GENETICS. Vol.32, November 1997, pages 361-66. DI RAGO J-P AT AL. Molecular basis for resistance to Myxothiazol, Mucidin (Strobilurin A), and Stigmatellin. THE JOURNAL OF BIOLOGICAL CHEMISTRY. Vol.264, no.24 AUGUST 1989, pages 14543-548. RU 2099426 C1, 20.12.1997. WO 0066773 09.11.2000.
(85) Дата перевода заявки PCT на национальную фазу:
03.11.2003
(86) Заявка PCT:
GB 02/01411 (25.03.2002)
(87) Публикация PCT:
WO 02/081742 (17.10.2002)
Адрес для переписки:
129010, Москва, ул. Б.Спасская, 25, стр.3, ООО “Юридическая фирма Городисский и Партнеры”, пат.пов. Е.Е.Назиной, рег. № 517
|
(72) Автор(ы):
БЕРБИДЖ Джудит Мэри (GB),
КЛИР Салли Мишель (GB),
СТАНГЕР Кэрол Патриция (GB),
УИНДЭСС Джон Дэвид (GB)
(73) Патентообладатель(и):
СИНДЖЕНТА ЛИМИТЕД (GB)
|
(54) СПОСОБ ОПРЕДЕЛЕНИЯ УСТОЙЧИВОСТИ ГРИБНОГО ФИТОПАТОГЕНА, АЛЛЕЛЬСПЕЦИФИЧЕСКИЙ ПРАЙМЕР И НАБОР
(57) Реферат:
Изобретение относится к биотехнологии, в частности к диагностическому способу определения одной или нескольких мутаций цитохрома b в грибах в положении, соответствующем остатку 129 цитохрома b Saccharomyces cerevisiae. Проводят ПЦР-реакцию, в результате которой определяют связывание олигонуклеотидного зонда с ампликоном, генерированном в процессе данной реакции, или обнаруживают присутствие ампликона, который генерировался в результате ПЦР-реакции с использованием указанных праймеров. Изобретение позволяет быстро и точно определить мутации, придающие устойчивость гриба к фунгициду. 3 н. и 14 з.п. ф-лы, 21 ил., 43 табл.
Область изобретения
Данное изобретение относится к диагностическим способам определения одной или нескольких мутаций цитохрома b в грибах в положении, соответствующем остатку 129 цитохрома b Saccharomyces cerevisiae, что ведет к устойчивости к аналогам стробилурина или соединениям из той же группы перекрестной устойчивости с использованием способов определения любого (или) единичного нуклеотидного полиморфизма, предпочтительно, с использованием способа амплификации специфического аллеля, такого как система мутаций, невосприимчивых к амплификации (ARMS), или, предпочтительно, с использованием способа аллельселективного гибридизационного зонда, такого как Molecular Beacons или TaqMan. Изобретение также относится к специфическим в отношении мутаций олигонуклеотидам для применения по способам изобретения и к диагностическим наборам, содержащим данные олигонуклеотиды.
Предпосылки изобретения
Широкое применение фунгицидов в сельском хозяйстве является относительно недавним явлением, и большая часть главных разработок в данной области имела место в течение последних 40 лет. До этого фермеры часто игнорировали или не различали эффектов, которые патогенные грибки оказывали на урожайность и качество культур. В настоящее время, однако, такие потери неприемлемы, и фермеры уверенно используют фунгицидные химикаты для борьбы с грибковыми заболеваниями. В результате коммерческие фунгициды стали важным компонентом сельскохозяйственной отрасли в целом, с мировым объемом продаж, составляющим в 1996 г. около $5,9 миллиарда, что эквивалентно 18,9% от всего агрохимического рынка (Wood Mackenzie, 1997a ‘Agchem products-The key agrochemical product groups’, in Agrochemical Service, Update of the Products Section, May 1997,1-74). Большое число фунгицидов уже доступны фермерам; в последнем издании Руководства по пестицидам (Tomlin, 1994 10th Edition, British Crop Protection Council, Farnham, UK, and the Royal Society of Chemistry, Cambridge, UK) описано 158 различных фунгицидных активных ингредиентов в настоящем использовании. Тем не менее, дальнейшие промышленные исследования, направленные на обнаружение и разработку новых соединений, исключительно интенсивны, и процедуры управления по продукту исключительно значимы для гарантии наилучшей и наиболее длительной производительности фунгицидов с конкретным способом действия и/или фунгицидов, принадлежащих к конкретной серии соединений. В частности, при введении фунгицидов с новыми способами действия жизненно важной является разработка эффективных стратегий по управлению устойчивостью (Fungicide Resistance Management: Into The Next Millenium (Russell) 1999, in Pesticide Outlook, October 1999 (213-215).
Аналоги стробилурина составляют большую новую серию сельскохозяйственных фунгицидов, которые, как предполагают, представляют собой наиболее впечатляющую разработку на рынке сельскохозяйственных фунгицидов с момента открытия 1,2,4-триазолов в 1970-х.
Фунгицидная активность аналогов стробилурина представляет собой результат их способности ингибировать митохондриальное дыхание в грибах. Более конкретно, было установлено, что данные соединения обладают новым однонаправленным способом действия, оказывая свое действие путем блокирования комплекса убихинон: оксидоредуктаза цитохрома с (цитохром bc1), снижая, таким образом, образование макроэргической АТФ в клетках грибов (Becker et al. 1981 FEBS Letts. 132: 329-33). Ингибиторы данного семейства предотвращают перенос электрона в редокс-участке Qo многосубъединичного белка цитохрома b (Esposti et al. 1993 Biochim. et Biophys Acta 1143 (3): 243-271). В отличие от многих митохондриальных белков, белок цитохром b кодируется в митохондриях.
Сообщения в литературе указывают на то, что конкретные аминокислотные замены в целевом участке цитохрома b могут влиять на активность аналогов стробилурина. Проведены тщательные исследования мутагенеза на Saccharomyces cerevisiae (здесь и далее обозначаемая S. cerevisiae) (JP Rago et al. 1989 J. Biol. Chem. 264: 14543-14548), мыши (Howell et al. 1988 J. Mol. Biol. 203: 607-618), Clamydomonas reinhardtii (Bennoun et al. 1991 Genetics 127: 335-343) и Rhodobacter spp (Daldal et al. 1989 EMBO J. 8 (13): 3951-3961). Относящаяся к делу информация также была собрана из исследования природных основ устойчивости к аналогам стробилурина у морского ежа Paracentrotus lividus (Esposti et al. 1990 FEBS 263: 245-247) и у относящихся к базидиомицетам грибов Mycene galopoda и Strobilurus tenacellus (Kraiczy et al. 1996 Eur. J. Biochem. 235: 54-63), которые оба продуцируют природные варианты аналогов стробилурина. Имеются две отдельных области гена цитохрома b, где аминокислотные замены имеют исключительно сильный эффект на активность аналогов стробилурина. Данные области покрывают аминокислотные остатки 125-148 и 250-295 (на основе системы исчисления по последовательности S. cerevisiae). Более точно, было показано, что замены аминокислотных остатков 126, 129, 132, 133, 137, 142, 143, 147, 148, 256, 257 и 295 обеспечивают устойчивость к аналогам стробилурина (Brasseur et al. 1996 Biochim. Biophys. Acta 1275: 61-69 и Esposti et al. (1993) Biochimica et Biophysica Acta, 1143: 243-271).
В опубликованной международной патентной заявке номер WO 00/66773 описана идентификация мутации в гене цитохрома b гриба, приводящая к замене глицина на аланин в положении, соответствующем остатку 143 цитохрома b S. cerevisiae, (G143A) в кодируемом белке. По настоящему изобретению впервые идентифицируется ключевая значимость дальнейшей(-их) мутации(-й) в гене цитохрома b полевых изолятов значимых фитопатогенных грибов, характеризующихся устойчивостью к аналогу стробилурина или соединения той же группы перекрестной устойчивости.
Сущность изобретения
Согласно первому аспекту изобретения авторами изобретения предоставлен способ определения наличия или отсутствия одной или нескольких мутаций в гене цитохрома b гриба, приводящих к аминокислотной замене в положении, соответствующем остатку 129 в последовательности цитохрома b S. cerevisiae, где присутствие указанной(-ых) мутации(-й) обеспечивает устойчивость грибов к аналогу стробилурина или соединению той же группы перекрестной устойчивости, причем указанный способ предусматривает определение наличия или отсутствия указанной(-ых) мутации(-й) в нуклеиновой кислоте грибов с использованием способа определения любого (или) единичного нуклеотидного полиморфизма.
По предпочтительному осуществлению первого аспекта по изобретению авторами изобретения предоставлен способ определения наличия или отсутствия одной или нескольких мутаций в гене цитохрома b гриба, приводящих к замене фенилаланина на лейцин в положении, соответствующем остатку 129 в последовательности цитохрома b S. cerevisiae, где присутствие указанной(-ых) мутации(-й) обеспечивает устойчивость грибов к аналогу стробилурина или соединению той же группы перекрестной устойчивости, причем указанный способ предусматривает определение наличия или отсутствия указанной(-ых) мутации(-й) в нуклеиновой кислоте грибов с использованием способа определения любого (или) единичного нуклеотидного полиморфизма.
По настоящему изобретению авторами изобретения разработаны диагностические способы определения одной или нескольких точковых мутаций в гене цитохрома b гриба, основанные на способах определения единичного нуклеотидного полиморфизма, предусматривающие аллельспецифическую амплификацию. Специалисту в данной области станет ясно, что имеется большое количество аналитических процедур, которые могут применяться для определения наличия или отсутствия изменчивых нуклеотидов в одной или нескольких полиморфных позициях по изобретению. В общем, для определения аллельной вариации требуется способ различения мутаций, необязательно, реакция амплификации и, необязательно, система генерации сигнала. Много существующих способов определения аллельной вариации описаны в обзоре Nollau et al., Clin. Chem. 43: 1114-1120, 1997, и в стандартных учебниках, например, ‘Laboratory Protocols for Mutation Detection’, Ed, by U. Landegren, Oxford University Press, 1996, и ‘PCR’ 2nd Edition by Newton and Graham, BIOS Scientific Publishers limited, 1997. Реакции аллельспецифической амплификации включают основанные на праймерах способы, такие как способы, основанные на ASPCR, и более конкретно, на продлении аллельспецифической полимеразной цепной реакции (ASPCR). Одним из таких основанных на PCR способов является ARMS (мутаций, невосприимчивых к амплификации). Способ ASPCR описан в патенте США №5639611, и способ ARMS полностью описан в Европейском патенте №EP 332435.
Все такие основанные на PCR способы подходят для применения в способах по настоящему изобретению, и применение способов, основанных на ARMS, является особенно предпочтительным. Способы по изобретению также предусматривают использование неразличающей PCR, с последующим специфическим зондированием генерированного ампликона.
Все данные способы подходят для определения специфичных аллелей, которые могут обеспечивать устойчивость к любому из аналогов стробилурина или соединению той же группы перекрестной устойчивости, и тесты Robust были разработаны для определения точечных мутаций, дающих такую устойчивость в некоторых фитопатогенных грибах. Можно считать, что соединения относятся к той же группе перекрестной устойчивости, если механизм устойчивости к одному соединению также обеспечивает устойчивость к другому, даже если способ их действия не один и тот же.
Способы определения единичного нуклеотидного полиморфизма (SNP), которые могут использоваться в любом описанном здесь аспекте изобретения с целью определения одной или нескольких мутаций, предусматривают, например, полиморфизм длин рестрикционных фрагментов (RFLP), полиморфизм однонитевой конформации, множественный клональный анализ, гибридизацию аллельспецифических олигонуклеотидов, продление праймера на один нуклеотид (Juvonen et al., (1994) Hum Genet 93 16-20; Huoponen et al., (1994) Hum Mutat 3 29-36; Mashima et al., (1995), Invest Opthelmol. Vision. Sci 36,1714-20; Howell et al., (1994) Am J Hum Genet. 55 203-206; Koyabashi et al.; (1994) Am. J. Hum. Genet. 55 206-209; Johns и Neufeld (1993) Am J Hum Genet 53 916-920; Chomyn et al., (1992) Proc. Natl. Acad. Sci USA 89 4221-4225) и технологию Invader (доступна от Third Wave Technologies Inc. 502 South Rosa Road, Madison, Висконсин 53719 США). (доступна от Third Wave Technologies Inc. 502 South Rosa Road, Madison, Висконсин 53719 США).
Применение основанных на PCR систем определения является предпочтительным для использования по всем аспектам и осуществлениям описанного здесь изобретения. Применение способов аллельселективных гибридизационных зондов, часто в комбинации с основанной на PCR амплификации фрагмента целевой ДНК является также предпочтительным для всех аспектов и осуществлений описанного здесь изобретения.
В предпочтительном осуществлении первого аспекта изобретения авторами изобретения в настоящее время предоставлен диагностический способ определения наличия или отсутствия одной или нескольких мутаций в гене цитохрома b гриба, приводящих к замене F129L в кодируемом белке, где присутствие указанной(-ых) мутации(-й) обеспечивает устойчивость грибов к аналогу стробилурина или соединению той же группы перекрестной устойчивости, причем указанный способ предусматривает определение наличия ампликона, генерированного во время реакции PCR, где указанная реакция PCR включает взаимодействие тестируемого образца, содержащего нуклеиновую кислоту гриба, с диагностическим праймером в присутствии подходящих нуклеотидтрифосфатов и средства для полимеризации, где определение указанного ампликона непосредственно относится к наличию или отсутствию указанной(-ых) мутации(-й) в указанной нуклеиновой кислоте.
Определение ампликона, генерированного во время реакции PCR, может непосредственно зависеть от продления праймера, специфичного для наличия мутации, т.е. в случае, когда продление праймера зависит от наличия мутации, и, следовательно, ампликон генерируется только при связывании праймера и/или его продлении, когда мутация присутствует (как в случае способа ARMS), сходным образом она может непосредственно зависеть от продления праймера, специфичного для отсутствия мутации, например, последовательности дикого типа, или может быть непосредственно связана с продуктом продления PCR, содержащем мутантную последовательность ДНК, т.е. в случае, где происходит определение ампликона, включающего мутантную последовательность ДНК. Первая альтернатива является особенно предпочтительной. В указанном выше способе изобретения, где применяется аллельселективная амплификация, указанный диагностический способ предусматривает определение наличия ампликона, генерированного во время реакции PCR, где указанная реакция PCR включает взаимодействие тестируемого образца, содержащего нуклеиновую кислоту гриба, с диагностическим праймером в присутствии подходящих нуклеотидтрифосфатов и средства для полимеризации, где генерирование указанного ампликона непосредственно относится к наличию или отсутствию указанной(-ых) мутации(-й) в указанной нуклеиновой кислоте.
Ампликон может происходить из любого цикла PCR, и он включает первый продукт продления аллельспецифического праймера.
В альтернативном предпочтительном примере по способу изобретения используется способ аллельселективного гибридизационного зонда, такого как Molecular Beacons или TaqMan (как описано здесь, см. пример 18).
В особенно предпочтительном осуществлении первого аспекта изобретения авторами изобретения в настоящее время предоставлен диагностический способ определения наличия или отсутствия одной или нескольких мутаций в гене цитохрома b гриба, приводящих к замене F129L в кодируемом белке, где присутствие указанной(-ых) мутации(-й) обеспечивает устойчивость грибов к аналогу стробилурина или соединению той же группы перекрестной устойчивости, причем указанный способ предусматривает взаимодействие тестируемого образца, включающего нуклеиновую кислоту гриба, с диагностическим праймером, подходящим для мутации(-й), приводящей(-им) к замене F129L в кодируемом белке, в присутствии подходящих нуклеотидтрифосфатов и средства для полимеризации, так что диагностический праймер продлевается при наличии в образце мутации(-ий), которые приводят к замене F129L в кодируемом белке, или при наличии последовательности дикого типа, и определение наличия или отсутствия указанной(-ых) мутации(-ий) путем ссылки на наличие или отсутствие продукта продления диагностического праймера.
В дальнейшем предпочтительном осуществлении изобретение относится к способу определения наличия или отсутствия одной или нескольких мутаций в гене цитохрома b гриба, приводящих к замене F129L в кодируемом белке, где присутствие указанной(-ых) мутации(-й) обеспечивает устойчивость грибов к аналогу стробилурина или соединению той же группы перекрестной устойчивости, причем указанный способ предусматривает взаимодействие тестируемого образца, включающего нуклеиновую кислоту гриба, с диагностическим праймером для конкретной(-ых) мутации(-й) в присутствии подходящих нуклеотидтрифосфатов и средства для полимеризации, так что диагностический праймер продлевается при наличии указанной(-ых) мутации(-ий) в образце, и определение наличия или отсутствия указанной(-ых) мутации(-ий) путем ссылки на наличие или отсутствие продукта продления диагностического праймера.
В особенно предпочтительном осуществлении первого аспекта изобретения авторами изобретения предоставлен диагностический способ определения наличия или отсутствия одной или нескольких мутаций в гене цитохрома b гриба, приводящих к замене F129L в кодируемом белке, где присутствие указанной(-ых) мутации(-й) обеспечивает устойчивость грибов к аналогу стробилурина или соединению той же группы перекрестной устойчивости, причем указанный способ предусматривает взаимодействие тестируемого образца, включающего нуклеиновую кислоту гриба, с диагностическим праймером для конкретной(-ых) мутации(-й) в присутствии подходящих нуклеотидтрифосфатов и средства для полимеризации, так что диагностический праймер продлевается только при наличии мутации(-ий) в образце; и определение наличия или отсутствия мутации(-ий) путем ссылки на наличие или отсутствие продукта продления диагностического праймера.
Используемый здесь термин «диагностический праймер» применяется для обозначения праймера, который используется специфично для идентификации наличия или отсутствия мутации или последовательности дикого типа, а термин «обычный праймер» используется для указания праймера, связывающегося с цепью ДНК, противоположной той, с которой связывается диагностический праймер и в 3′-направлении от области, распознаваемой тем диагностическим праймером, и который, действуя совместно с указанным диагностическим праймером, дает возможность для амплификации лежащего между ними отрезка ДНК во время PCR. Когда диагностический праймер представляет собой праймер для ARMS, он может содержать 3′-концевое несоответствие по сравнению с мутантной последовательностью или последовательностью дикого типа.
В данном и в дальнейших аспектах и осуществлениях изобретения предпочтительным является то, что продление продукта продления праймера определяется путем системы определения, которая представляет собой неотъемлемую часть диагностического праймера или обычного праймера на противоположной цепи. Альтернативно, при использовании зонда Taqman® или Taqman®MGB в связи с диагностическим праймером или обычным праймером, зонд Taqman® или Taqman®MGB будут содержать в себе средства определения. Это описано здесь более полно.
Можно считать, что соединения относятся к той же группе перекрестной устойчивости, если механизм устойчивости к одному соединению также обеспечивает устойчивость к другому, даже если способ их действия не один и тот же. Аналоги стробилурина и соединения той же группы перекрестной устойчивости включают, например, азоксистробин, пикоксистробин, крезоксим-метил, трифлоксистробин, пираклостробин, фамоксадон и фенамидон. (Подробности по пираклостробину были представлены на BCPC Conference в Брайтоне в ноябре 2000 г. – см. реферат 5A-2). Следует также заметить, что аналоги стробилурина и соединения той же группы перекрестной устойчивости в настоящее время часто обозначаются как ингибиторы участка Qo (QoIs) из-за их действия на комплекс III участка Qo.
Авторами изобретения обнаружено, что позиция в нуклеиновых кислотах грибов, кодирующих цитохром b, которая соответствует 129-му кодону/аминокислоте в последовательности цитохрома b S. cerevisiae, представляет собой ключевую детерминанту устойчивости грибов к аналогам стробилурина или любому другому соединению той же группы перекрестной устойчивости в полевых изолятах, устойчивых к аналогу стробилурина фитопатогенных грибов. Способы по изобретению, описанные здесь, особенно подходят для определения мутации в положении, соответствующем кодирующему 129 остатку в последовательности цитохрома b Saccharomyces cerevisiae, где кодируемый остаток фенилаланина замещается на другую аминокислоту, которая предотвращает действие аналогов стробилурина или любого другого соединения той же группы перекрестной устойчивости и приводит к устойчивому фенотипу в грибе, несущем мутантный ген цитохрома b, что вызывает таким образом устойчивость грибов к аналогам стробилурина или любого другого соединения той же группы перекрестной устойчивости.
Данный способ предпочтительно используется для определения мутации, приводящей к замене указанного остатка фенилаланина в положении, соответствующем кодирующему 129 остатку в последовательности цитохрома b Saccharomyces cerevisiae, на аминокислоту, выбранную из группы: изолейцин, лейцин, серин, цистеин, валин, тирозин. Наиболее предпочтительным является то, что мутация(-и), подлежащая(-ие) определения, приводит(-ят) к замене остатка фенилаланина на лейцин.
Мутация гена цитохрома b гриба, приводящая к замене F129L в кодируемом белке, обычно представляет собой замену основания тимина на цитозин в первом положении (основание) кодона, или замену основания тимина или цитозина на аденин или гуанин в третьем положении (основание) кодона, и определение данных единичных нуклеотидных полиморфизмов является предпочтительной для всех аспектов и осуществлений описанного здесь изобретения. Кроме того, возможно, что также может произойти редкая комбинация замены тимина на цитозин в первом положении и замены основания тимина или цитозина на аденин или гуанин в третьем положении (основание) кодона, и это будет охвачено всеми аспектами и осуществлениями изобретения.
Следует заметить, что в данной заявке на выдачу патента делаются частые ссылки на обе мутации и аллельные варианты (аллели) гена цитохрома b, которые обеспечивают устойчивость к аналогам стробилурина или соединениям той же группы перекрестной устойчивости. Такие ссылки по существу синонимичны, хотя термин «мутация» имеет тенденцию выражать новое или недавнее генетическое изменение, где аллельные варианты означают, что альтернативная и в данном случае обеспечивающая устойчивость форма гена может присутствовать в течение некоторого времени в анализируемой популяции. Данные альтернативы являются неотличимыми во время анализа природной популяции.
Также следует отметить, что природа различия в свойствах форм дикого типа и мутантного/аллельного варианта белка цитохрома b, кодируемого геном, обеспечивающим устойчивость к аналогам стробилурина или соединениям той же группы перекрестной устойчивости, требует аминокислотной замены внутри так называемого участка Qo соответствующего вида дыхательного комплекса III, который включают как составную часть белок цитохром b. Такие аминокислотные замены вызваны изменениями в кодоне для измененной аминокислоты. Обычно, как и в рассмотренных здесь конкретных примерах, интересующая аминокислотная замена бывает вызвана изменением только одного из трех нуклеотидных остатков в данном кодоне. Поэтому такие изменения могут быть описаны как единичные нуклеотидные полиморфизмы (SNP).
Иногда по причине вырожденности генетического кода аминокислотные замены, которые могут быть вызваны единичным нуклеотидным полиморфизмом, также могут быть вызваны двумя близко сцепленными заменами (в пределах 3 нуклеотидов). Такие ситуации обозначаются здесь как простые нуклеотидные полиморфизмы. Вследствие их природы предполагается, что такие полиморфизмы будут иметь место гораздо реже, чем SNP, поскольку изменение последовательности, необходимое для их осуществления, требует, по крайней мере, двух различных замен оснований в пределах одного и того же кодона, по сравнению всего лишь с одной.
Используемый здесь термин F129L применяется для обозначения замены остатка фенилаланина на остаток лейцина в последовательности цитохрома b гриба в положении, эквивалентному положению 129-го кодона/аминокислоты последовательности цитохрома b S. cerevisiae. Данная номенклатура применяется для всех других изменений остатков, на которые здесь имеются ссылки, т.е. все положения указываются по отношению к белковой последовательности цитохрома b S. cerevisiae. Генная и белковая последовательность цитохрома b S. cerevisiae доступны в базах данных EMBL и SWISSPROT (см. инвентарный номер EMBL X84042 и инвентарный номер SWISSPROT P00163). Специалисту будет ясно, что точная длина и регистрационный номер эквивалентных белков из других видов может варьировать в результате N- или С-концевых и/или одной или нескольких внутренних делеций или вставок. Однако поскольку аминокислотный отрезок, содержащий остаток, соответствующий F129 в S. cerevisiae, достаточно консервативен (Widger et al. Proc. Nat. Acad. Sci., U. S. A. 81 (1984) 674-678), в пределах способностей специалиста легко и просто идентифицировать точно соответствующий остаток в полученной впервые последовательности цитохрома b гриба путем визуального просмотра или с применением одного из нескольких программ для выравнивания последовательностей, включая Megalign или Macaw. Хотя эта позиция и обозначается в данной заявке как F129 (по причине позиционной и функциональной эквивалентности), точное местоположение данного фенилаланина в новом цитохроме b может не соответствовать 129-тому остатку от его N-конца. Консенсусная последовательность цитохрома b S. cerevisiae предоставлена под инвентарным номером SWISSPROT P00163. Во всех аспектах и осуществлениях описанного здесь изобретения положении последовательности цитохрома b предпочтительно соответствуют определенным относительно последовательности цитохрома b S. cerevisiae, предоставленной под инвентарным номером EMBL X84042. Альтернативно, во всех аспектах и осуществлениях описанного здесь изобретения положения последовательности цитохрома b предпочтительно таковы, как определено относительно консенсусной последовательности цитохрома b S. cerevisiae, предоставленной под инвентарным номером SWISSPROT P00163.
По одному из аспектов изобретения предоставляется способ диагностики одного или нескольких нуклеотидных полиморфизмов в гене цитохрома b гриба, причем данный способ предусматривает определение последовательности нуклеиновой кислоты гриба в положении, соответствующем одному или нескольким основаниям в триплете, кодирующем аминокислоту в положении, которое соответствует остатку 129 в цитохроме b S. cerevisiae, в белке цитохроме b, и определение состояния устойчивости данного гриба к аналогу стробилурина или соединению той же группы перекрестной устойчивости путем ссылки на один или несколько полиморфизмов гена цитохрома b.
Во всех аспектах и осуществлениях описанного здесь изобретения предпочтительным является, чтобы только одно основание в триплете, кодирующем аминокислоту в положении, соответствующем остатку 129 цитохрома b S. cerevisiae, в белке цитохроме b, характеризуется мутацией, т.е. имеется единичный нуклеотидный полиморфизм только в одном положении, и далее является предпочтительным то, что он происходит в первом или третьем основании триплета.
По предпочтительному осуществлению данного аспекта изобретения предоставляется способ диагностики единичного нуклеотидного полиморфизма в гене цитохрома b гриба, причем данный способ предусматривает определение последовательности нуклеиновой кислоты гриба в положении, соответствующем первому или третьему основанию в триплете, кодирующем аминокислоту в положении, которое соответствует остатку 129 в цитохроме b S. cerevisiae, в белке цитохроме b, и определение состояния устойчивости данного гриба к аналогу стробилурина или соединению той же группы перекрестной устойчивости путем ссылки на полиморфизм гена цитохрома b.
В осуществлении указанного выше аспекта изобретения описанный здесь способ диагностики представляет собой способ, в котором единичный нуклеотидный полиморфизм в положениях в ДНК, соответствующих первому или третьему основанию в триплете, кодирующем аминокислоту в положении, соответствующем остатку 129 цитохроме b S. cerevisiae, в белке цитохроме b, представляет собой T или C в первом основании кодона и T, C, A или G в третьем основания кодона.
| Таблица 1 |
| Последовательности кодонов, кодирующих фенилаланин и лейцин |
| Первая позиция |
Вторая позиция |
Третья позиция |
| |
T |
|
| T |
Phe |
T |
| Phe |
C |
| Leu |
A |
| Leu |
G |
| C |
Leu |
T |
| Leu |
C |
| Leu |
A |
| Leu |
G |
В цитохроме b дикого типа при кодировании остатка фенилаланина в положении 129 кодоном TTT или TTC мутация одного основания в первом положении кодона на C (цитозин) будет приводить к замене остатка фенилаланина в участке Qo, устойчивого к стробилурину мутанта. Сходным образом, при кодировании в цитохроме b дикого типа остатка фенилаланина в положении 129 кодоном TTT или TTC мутация одного основания в третьем положении кодона на A (аденин) или G (гуанин) будет приводить к замене остатка фенилаланина в участке Qo, устойчивого к стробилурину мутанта. Двойная замена в первом положении (T на C) вместе с заменой в третьем положении (T или C на A или G) также может вызывать такую аминокислотную замену фенилаланина на лейцин (см. таблицу 1).
Для определения того, является ли данный фитопатогенный организм устойчивым к фунгицидам-ингибиторам участка Qo или содержит значительный уровень аллелей устойчивости в результате наличия остатка лейцина в положении 129, необходимо просто установить и/или измерить, имеет ли данный патогенный организм или популяция остаток C в первом положении его родственного кодона и/или остаток A или G в его третьем положении. Одним из способов достижения такой оценки является применение технологии, основанной на диагностических праймерах, таких как праймеры ARMS (Концепция праймеров ARMS полностью описана Newton et al, Nucleic Acid Research 17 (7) 2503-2516 1989).
Вследствие указанных выше черт кодонов фенилаланина и лейцина (см. таблицу 1), в случае применения технологии ARMS для определения и/или измерения состояния остатка 129, возможно сконструировать подходящие праймеры PCR, способные определять индивидуальность и/или количества конкретных остатков или в первом, или в третьем положениях родственного кодона в гене цитохрома b патогенного организма. Для такого конструирования необходимо лишь знать последовательность дикого типа. Нет необходимости иметь доступ к устойчивому изоляту интересующего нового гриба в случае, когда устойчивость является результатом мутации F129L. Некоторые примеры относящихся к теме фитопатогенных грибов перечислены в таблице 2. Данный список никоим образом не подразумевает ограничения. Специалист в области фитопатологии сможет легко определить те грибы, к которым имеют отношение способы по данному изобретению.
| Таблица 2 |
| Пример видов, где может анализироваться F129L |
| |
Пример видов, где может анализироваться F129L |
| 1 |
Plasmopara viticola |
| 2 |
Erysiphe graminis f.sp. tritici/hordei |
| 3 |
Rhynchosporium secalis |
| 4 |
Pyrenophora teres |
| 5 |
Mycosphaerella graminicola |
| 6 |
Mycosphaerella fijiensis var. difformis |
| 7 |
Sphaerotheca fuliginea |
| 8 |
Uncinula necator |
| 9 |
Colletotrichum graminicola |
| 10 |
Pythium aphanidermatum |
| 11 |
Colletotrichum gloeosporioides |
| 12 |
Oidium lycopersicum |
| 13 |
Leveillula taurica |
| 14 |
Pseudoperonospora cubensis |
| 15 |
Alternaria solani |
| 16 |
Cercospora arachidola |
| 17 |
Rhizoctonia solani |
| 18 |
Venturia inaequalis |
| 19 |
Phytophthora infestans |
| 20 |
Mycosphaerella musicola |
| 21 |
Colletotrichum acutatum |
| 22 |
Wilsonomyces carpophillum |
| 23 |
Didymella bryoniae |
| 24 |
Didymella lycopersici |
| 25 |
Peronospora tabacina |
| 26 |
Puccinia recondite |
| 27 |
Puccinia horiana |
Способы по описанному здесь изобретению особенно применимы в связи с фитопатогенными грибами, и особенно с любым из следующих видов грибов: Plasmopara viticola, Erysiphe graminis f. sp. tritici/hordei, Rhynchosporium secalis, Pyrenophora teres, Mycosphaerella graminicola, Venturia inaequalis, Mycosphaerella fijiensis var. difformis, Sphaerotheca fuliginea, Uncinula necator, Colletotrichum graminicola, Pythium aphanidermatum, Colletotrichum gloeosporioides, Oidium lycopersicum, Phytophthora infestans, Leveillula taurica, Pseudoperonospora cubensis, Alternaria solani, Rhizoctonia solani, Mycosphaerella musicola, Cercospora arachidola, Colletotrichum acutatum, Wilsonomyces carpophillum, Didymella bryoniae, Didymella lycopersici, Peronospora tabacina, Puccinia recondita и Puccinia horiana, и в особенности с любым из следующих видов грибов: Plasmopara viticola, Erysiphe graminis f. sp. tritici/hordei, Rhynchosporium secalis, Pyrenophora teres, Mycosphaerella graminicola, Venturia inaequalis, Mycosphaerella fijiensis var. difformis, Sphaerotheca fuliginea, Uncinula necator, Colletotrichum graminicola, Pythium aphanidermatum, Colletotrichum gloeosporioides, Oidium lycopersicum, Phytophthora infestans, Leveillula taurica, Pseudoperonospora cubensis, Alternaria solani, Rhizoctonia solani, Didymella bryoniae, Didymella lycopersici, Mycosphaerella musicola и Cercospora arachidola.
В дальнейшем аспекте изобретение относится к способу определения устойчивости грибов к аналогу стробилурина или любому другому соединению той же группы перекрестной устойчивости, причем указанный способ предусматривает определение наличия или отсутствия одной или нескольких мутаций в нуклеиновой кислоте гриба, которая кодирует белок цитохром b гриба, где наличие указанной(-ых) мутации(-й) приводит к устойчивости к аналогу стробилурина или любому другому соединению той же группы перекрестной устойчивости, причем указанный способ предусматривает определение наличия или отсутствия единичного нуклеотидного полиморфизма, встречающегося в положениях, соответствующих одному или нескольким основаниям в триплете, кодирующем аминокислоту в положении, соответствующем остатку 129 цитохрома b S. cerevisiae, в белке цитохроме b гриба.
В дальнейшем предпочтительном осуществлении данного аспекта изобретение относится к способу определения устойчивости гриба к аналогу стробилурина или любому другому соединению той же группы перекрестной устойчивости, причем указанный способ предусматривает определение наличия или отсутствия мутации в нуклеиновой кислоте гриба, которая кодирует белок цитохром b гриба, где наличие указанной мутации приводит к устойчивости гриба к аналогу стробилурина или любому другому соединению той же группы перекрестной устойчивости, причем указанный способ предусматривает определение наличия или отсутствия единичного нуклеотидного полиморфизма, встречающегося в положении, соответствующем первому и/или третьему основанию в триплете, кодирующем аминокислоту в положении, соответствующем остатку 129 цитохрома b S. cerevisiae, в белке цитохроме b гриба.
В предпочтительном осуществлении данного аспекта изобретения наличие или отсутствие единичного нуклеотидного полиморфизма в положении, соответствующем первому и/или третьему основанию в триплете, кодирующем аминокислоту в положении, соответствующем остатку 129 цитохрома b S. cerevisiae, в гене цитохрома b нуклеиновой кислоты гриба, идентифицируют с использованием любого способа определения единичного нуклеотидного полиморфизма.
Далее изобретение относится к последовательности ДНК гриба, кодирующей всю последовательность белка цитохрома b дикого типа или ее часть, где указанная последовательность ДНК кодирует остаток фенилаланина в положении, соответствующем остатку 129 в последовательности цитохрома b S. cerevisiae в белке дикого типа, где указанная последовательность подлежит получению или получена из гриба, выбранного из группы, состоящей из Plasmopara viticola, Rhynchosporium secalis, Pyrenophora teres, Mycosphaerella graminicola, Mycosphaerella fijiensis var. difformis, Sphaerotheca fuliginea, Uncinula necator, Colletotrichum graminicola, Pythium aphanidermatum, Colletotrichum gloeosporioides, Oidium lycopersicum, Leveillula taurica, Pseudoperonospora cubensis, Alternaria solani, Rhizoctania solani, Mycosphaerella musicola, Cercospora arachidola, Colletotrichum acutatum, Wilsonomyces carpophillum, Didymella bryoniae, Didymella lycopersici, Peronospora tabacina, Puccinia recondita и Puccinia horiana, предпочтительно, из группы, состоящей из Plasmopara viticola, Rhynchosporium secalis, Pyrenophora teres, Mycosphaerella graminicola, Mycosphaerella fijiensis var. difformis, Sphaerotheca fuliginea, Uncinula necator, Colletotrichum graminicola, Pythium aphanidermatum, Colletotrichum gloeospbrioides, Oidium lycopersicum, Leveillula taurica, Pseudoperonospora cubensis, Alternaria solani, Rhizoctania solani, Didymella bryoniae, Didymella lycopersici, Mycosphaerella musicola и Cercospora arachidola.
Последовательность ДНК гриба по вышеуказанным аспектам изобретения предпочтительно включает около 30 нуклеотидов в одну или в обе стороны от положения в ДНК, которое соответствует одному или нескольким основаниям в триплете (предпочтительно, третьему основанию), кодирующем аминокислоту в положении, соответствующем остатку 129 цитохрома b S. cerevisiae в белке, поскольку избыток нуклеиновой кислоты обеспечит специалиста всей информацией, необходимой для конструирования видоспецифических и специфических для мутаций реагентов и/или способов для применения в/со всеми описанными здесь способами определения единичного нуклеотидного полиморфизма. Используемый здесь термин «около 30» означает, что последовательность может содержать до 30 нуклеотидов, например, 5, до 10, 15, 20 или 25 нуклеотидов, или может содержать более 30 нуклеотидов, например, около 50 нуклеотидов, т.е. до 35, 40, 45 или 50 или более нуклеотидов.
Используемый здесь в связи со всеми последовательностями ДНК и белка термин «вся или ее часть» применяется для обозначения последовательности ДНК или белковой последовательности или их фрагмента. Фрагмент ДНК или белка может, например, составлять 10%, 20%, 25%, 30%, 40%, 50%, 60%, 70%, 75%, 80%, 85%, 90%, или 95% от длины целой последовательности.
Изобретение также относится к новым белковым последовательностям, кодируемым последовательностями ДНК по настоящему изобретению.
Специалисту в данной области очевидно, что по изобретению могут анализироваться как образцы, содержащие геномную ДНК, так и образцы кДНК. Когда образец содержит геномную ДНК, при использовании информации о последовательности следует принимать во внимание организацию интронов. Примеры последовательностей дикого типа ДНК грибов, включающие часть генной последовательности цитохрома b дикого типа по указанному выше аспекту изобретения, предоставлены в таблице 3, и указанные последовательности образуют дальнейший аспект изобретения.
Таблица 3
Отрезки геномной и/или кДНК-последовательности цитохрома b дикого типа, фланкирующие кодон, соответствующий кодону 129 в последовательности цитохрома b S. cerevisiae (первый и последний остатки показаны жирным шрифтом и подчеркнуты) для серии значимых фитопатогенов

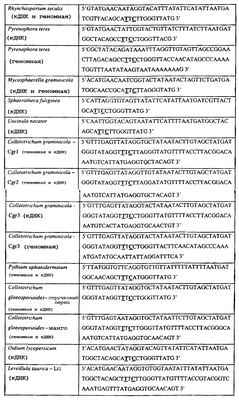
 
В указанной выше таблице первое и третье основания в триплете, кодирующем аминокислоту в положении, соответствующем остатку 129 цитохрома b S. Cerevisiae, которые, при их подходящей замене, приводят к замене обычного фенилаланина на альтернативную аминокислоту, где указанная замена вызывает устойчивость к аналогу стробилурина или соединению той же группы перекрестной устойчивости, показаны жирным шрифтом и подчеркнуты.
Изобретение также относится к последовательности ДНК гриба, характеризующейся гомологией или идентичностью по последовательности в отношении указанных в таблице 3 последовательностей ДНК, и, например, относится к вариациям в последовательностях ДНК, обнаруженных в различных образцах или изолятах одного вида. Данные вариации, например, могут быть следствием использования альтернативных кодонов, вариации экзонно-интронной организации в митохондрии и аминокислотной замены.
В дальнейшем аспекте изобретение относится к последовательности ДНК гриба, которая кодирует всю последовательность белка цитохрома b гриба или ее часть, где при выстраивании указанной последовательности ДНК гриба против соответствующей последовательности ДНК дикого типа, которая кодирует белок цитохром b, видно, что последовательность ДНК гриба содержит мутацию единичный нуклеотидный полиморфизм в положении в ДНК, которая соответствует одному или нескольким основаниям в триплете, кодирующем аминокислоту в положении, соответствующем остатку 129 цитохрома b S. cerevisiae в белке, которая приводит к замене обычного остатка фенилаланина на альтернативную аминокислоту.
В дальнейшем предпочтительном осуществлении данного аспекта изобретение относится к последовательности ДНК гриба, которая кодирует всю последовательность белка цитохрома b гриба или ее часть, где при выстраивании указанной последовательности ДНК гриба против соответствующей последовательности ДНК дикого типа, которая кодирует белок цитохром b, видно, что последовательность ДНК гриба содержит мутацию единичный нуклеотидный полиморфизм в положении в ДНК, которое соответствует первому или третьему основанию в триплете, кодирующем аминокислоту в положении, соответствующем остатку 129 цитохрома b S. cerevisiae в белке, которая приводит к замене обычного остатка фенилаланина на альтернативную аминокислоту.
Последовательность ДНК гриба по вышеуказанным аспектам изобретения предпочтительно включает около 30 нуклеотидов в одну или в обе стороны от положения в ДНК, которое соответствует одному или нескольким основаниям в триплете, предпочтительно, соответствуя третьему основанию в триплете, кодирующем аминокислоту в положении, соответствующем остатку 129 цитохрома b S. cerevisiae в белке, поскольку избыток нуклеиновой кислоты обеспечит специалиста всей информацией, необходимой для конструирования видоспецифических и специфических для мутаций реагентов и/или способов для применения во всех описанных здесь способах определения единичного нуклеотидного полиморфизма. Используемый здесь термин «около 30» означает, что последовательность может содержать до 30 нуклеотидов, например, 5, до 10, 15, 20 или 25 нуклеотидов, или может содержать более 30 нуклеотидов.
Далее изобретение относится к последовательности ДНК гриба, которая кодирует всю последовательность белка цитохрома b гриба или ее часть, где наличие одной или нескольких мутаций в указанной ДНК вызывает устойчивость к аналогу стробилурина или соединению той же группы перекрестной устойчивости, причем указанная(-ые) мутация(-и) происходит(-ят) в положении, которое соответствует первому или третьему основанию в триплете, кодирующем аминокислоту в положении, соответствующем остатку 129 цитохрома b S. cerevisiae в белке.
В указанных выше аспектах изобретения мутация, происходящая в положении, которое соответствует первому или третьему основанию в триплете, кодирующем аминокислоту в положении, соответствующем остатку 129 цитохрома b S. cerevisiae в белке, предпочтительно представляет собой замену тимина на цитозин и тимина или цитозина на аденин или гуанин, соответственно.
Последовательность ДНК гриба, кодирующая всю последовательность белка цитохрома b гриба или ее часть, где наличие одной или нескольких мутаций в указанной ДНК вызывает устойчивость к аналогу стробилурина или соединению той же группы перекрестной устойчивости, по указанным выше аспектам настоящего изобретения предпочтительно подлежит получению или получена из гриба, выбранного из группы, состоящей из Plasmopara viticola, Erysiphe graminis f. sp. tritici/hordei, Rhynchosporium secalis, Pyrenophora teres, Mycosphaerella graminicola, Venturia inaequalis, Mycosphaerella fijiensis var. difformis, Sphaerotheca fuliginea, Uncinula necator, Colletotrichum graminicola, Pythium aphanidermatum, Colletotrichum gloeosporioides, Oidium lycopersicum, Phytophthora infestans, Leveillula taurica, Pseudoperonospora cubensis, Alternaria solani, Rhizoctonia solani, Mycosphaerella musicola, Cercospora arachidola, Colletotrichum acutatum, Wilsonomyces carpophillum, Didymella bryoniae, Didymella lycopersici, Peronospora tabacina, Puccinia recondita и Puccinia horiana, предпочтительно, из группы, состоящей из Plasmopara viticola, Erysiphe graminis f. sp. tritici/hordei, Rhynchosporium secalis, Pyrenophora teres, Mycosphaerella graminicola, Venturia inaequalis, Mycosphaerella fijiensis var. difformis, Sphaerotheca fuliginea, Uncinula necator, Colletotrichum graminicola, Pythium aphanidermatum, Colletotrichum gloeosporioides, Oidium lycopersicum, Phytophthora infestans, Leveillula taurica, Pseudoperonospora cubensis, Alternaria solani, Rhizoctonia solani, Didymella bryoniae, Didymella lycopersici, Mycosphaerella musicola и Cercospora arachidola.
Изобретение далее относится к последовательностям ДНК, включающим все последовательности, предоставленные в таблице 4, или их часть, где остаток в положении ДНК, соответствующий первому основанию в триплете, кодирующим аминокислоту в положении, соответствующем остатку 129 цитохрома b S. cerevisiae в белке, представляет собой остаток цитозина. Такие последовательности, включая те, что включают последовательности, описанные в таблице 4, образуют дальнейший аспект изобретения.
Таблица 4
Отрезки генной последовательности цитохрома b фитопатогенов, где остаток (показанный жирным шрифтом), соответствующий первому основанию кодона, в положении, соответствующем остатку 129 цитохрома b S. cerevisiae в белке, представляет собой остаток цитозина, и в результате кодируется лейцин



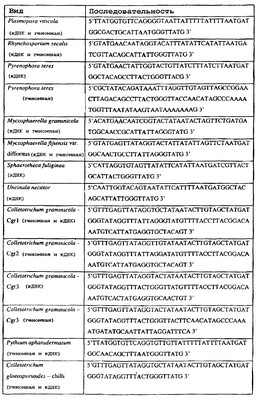
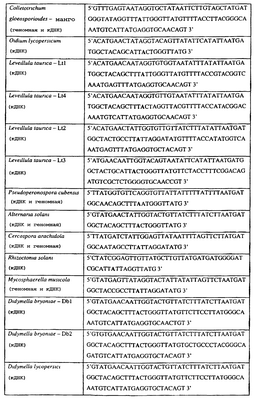
Изобретение также относится к последовательностям ДНК, включающим все последовательности, предоставленные в таблице 5, или их часть, где остаток в положении ДНК, соответствующий третьему основанию в триплете, кодирующим аминокислоту в положении, соответствующем остатку 129 цитохрома b S. cerevisiae в белке, представляет собой остаток аденина. Такие последовательности образуют дальнейший аспект изобретения.
Таблица 5
Отрезки генной последовательности цитохрома b фитопатогенов, где остаток (показанный жирным шрифтом), соответствующий третьему основанию кодона, в положении, соответствующем остатку 129 цитохрома b S. cerevisiae в белке, представляет собой остаток аденина, и в результате кодируется лейцин
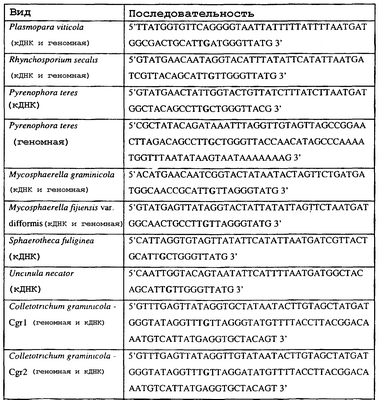
Изобретение также относится к последовательностям ДНК, включающим все последовательности, предоставленные в таблице 6, или их часть, где остаток в положении ДНК, соответствующий третьему основанию в триплете, кодирующим аминокислоту в положении, соответствующем остатку 129 цитохрома b S. cerevisiae в белке, представляет собой остаток гуанина. Такие последовательности образуют дальнейший аспект изобретения.
Таблица 6
Отрезки генной последовательности цитохрома b фитопатогенов, где остаток (показанный жирным шрифтом), соответствующий третьему основанию кодона, в положении, соответствующем остатку 129 цитохрома b S. cerevisiae в белке, представляет собой остаток гуанина, и в результате кодируется лейцин
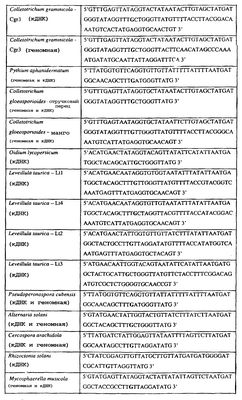
 
Изобретение также относится к последовательностям ДНК, включающим все последовательности, предоставленные в таблице 7, или их часть, где остаток в положении ДНК, соответствующий первому основанию в триплете, кодирующим аминокислоту в положении, соответствующем остатку 129 цитохрома b S. cerevisiae в белке, представляет собой остаток цитозина, а остаток в третьем основании соответствующего кодона представляет собой аденин. Такие последовательности образуют дальнейший аспект изобретения.
Таблица 7
Отрезки генной последовательности цитохрома b фитопатогенов, где остаток (показанный подчеркиванием), соответствующий первому основанию кодона, в положении, соответствующем остатку 129 цитохрома b S. cerevisiae в белке, представляет собой остаток цитозина, а остаток в третьем основании соответствующего кодона, показанном жирным шрифтом, представляет собой аденин, и в результате кодируется лейцин

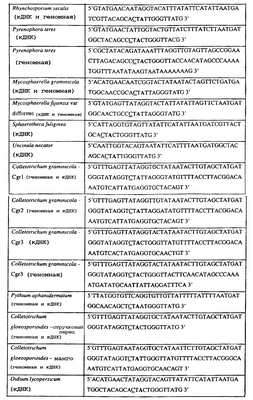
 
Изобретение также относится к последовательностям ДНК, включающим все последовательности, предоставленные в таблице 8, или их часть, где остаток в положении ДНК, соответствующий первому основанию в триплете, кодирующим аминокислоту в положении, соответствующем остатку 129 цитохрома b S. cerevisiae в белке, представляет собой остаток цитозина, а остаток в третьем основании соответствующего кодона представляет собой гуанин. Такие последовательности образуют дальнейший аспект изобретения.
Таблица 8
Отрезки генной последовательности цитохрома b фитопатогенов, где остаток (показанный подчеркиванием), соответствующий первому основанию кодона, в положении, соответствующем остатку 129 цитохрома b S. cerevisiae в белке, представляет собой остаток цитозина, а остаток в третьем основании соответствующего кодона, показанном жирным шрифтом, представляет собой гуанин, и в результате кодируется лейцин
 
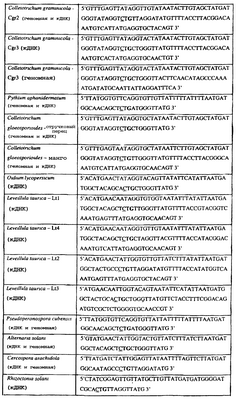

Изобретение также относится к последовательности ДНК гриба, характеризующейся гомологией или идентичностью последовательности в отношении указанных последовательностей ДНК, содержащих указанные полиморфизмы, и относится, например, к вариациям в последовательностях ДНК, обнаруженных в различных образцах или изолятах одного вида. Данные вариации, например, могут быть следствием использования альтернативных кодонов, вариации экзонно-интронной организации в митохондрии и аминокислотной замены.
Последовательности ДНК, кодирующие весь мутантный или относящийся к дикому типу белок цитохром b или его часть, как описано здесь, предпочтительно, находятся в выделенной форме. Например, путем частичной очистки от любого вещества, с которым они оказываются в природе. Последовательности ДНК подлежат выделению (получению) или выделены (получены) из описанных здесь грибов.
Дальнейшую информацию о последовательности ниже 3′-конца предоставленных здесь последовательностей дикого типа можно найти в опубликованной заявке на выдачу Международного патента номер WO 00/66773, сведения из которой включены сюда в качестве ссылки. Предоставленная информация о последовательности и предоставленные здесь сведения могут использоваться в комбинации с опубликованной заявке на выдачу Международного патента номер WO 00/66773 для разработки способа определения наличия и отсутствия мутации(-ий) в позициях, соответствующих остаткам 129 и/или 143 цитохрома b S. Cerevisiae, и изобретение относится к любому такому способу.
Изобретение далее относится к средству, считываемому компьютером, в которой хранится любая из последовательностей, описанных и заявленных здесь, и включающих все последовательности ДНК, кодирующие весь описанный здесь мутантный белок цитохром b или его часть, предпочтительно, последовательность белка цитохрома b, где аминокислотный остаток в положении, эквивалентном положению 129 S. cerevisiae, представляет собой лейцин, и наличие одной или нескольких мутаций вызывает устойчивость гриба к аналогу стробилурина или любому соединению той же группы перекрестной устойчивости, причем данная мутация(-и) происходит(-ят) в положении ДНК, соответствующем положению в ДНК, которое соответствует одному или нескольким основаниям в триплете, кодирующем аминокислоту в положении, соответствующем остатку 129 цитохрома b S. cerevisiae в белке; целое или часть кодирующей ДНК, или аминокислотной последовательности мутантного белка цитохрома b, причем указанная(-ые) мутация(-ии) происходят в положении ДНК, соответствующем одному или нескольким основаниям в триплете, кодирующем аминокислоту в положении, соответствующем остатку 129 цитохрома b S. cerevisiae в белке, где указанный белок вызывает устойчивость к аналогу стробилурина или соединению той же группы перекрестной устойчивости гриба, выбранного из группы Plasmopara viticola, Erysiphe graminis f. sp. tritici/hordei, Rhynchosporium secalis, Pyrenophora teres, Mycosphaerella graminicola, Venturia inaequalis, Mycosphaerella fijiensis var. difformis, Sphaerotheca fuliginea, Uncinula necator, Colletotrichum graminicola, Pythium aphanidermatum, Colletotrichum gloeosporioides, Oidium lycopersicum, Phytophthora infestans, Leveillula taurica, Pseudoperonospora cubensis, Alternaria solani, Rhizoctonia solani, Mycosphaerella musicola, Cercospora arachidola, Colletotrichum acutatum, Wilsonomyces carpophillum, Didymella bryoniae, Didymella lycopersici, Peronospora tabacina, Puccinia recondita и Puccinia horiana, предпочтительно, из группы, состоящей из Plasmopara viticola, Erysiphe graminis f. sp. tritici/hordei, Rhynchosporium secalis, Pyrenophora teres, Mycosphaerella graminicola, Venturia inaequalis, Mycosphaerella fijiensis var. difformis, Sphaerotheca fuliginea, Uncinula necator, Colletotrichum graminicola, Pythium aphanidermatum, Colletotrichum gloeosporioides, Oidium lycopersicum, Phytophthora infestans, Leveillula taurica, Pseudoperonospora cubensis, Alternaria solani, Rhizoctonia solani, Didymella bryoniae, Didymella lycopersici, Mycosphaerella musicola и Cercospora arachidola; целое или часть кодирующей ДНК, или аминокислотной последовательности цитохрома b дикого типа из гриба, выбранного из группы Plasmopara viticola, Rhynchosporium secalis, Pyrenophora teres, Mycosphaerella graminicola, Sphaero-theca fuliginea, Uncinula necator, Colletotrichum graminicola, Pythium aphanidermatum, Colletotrichum gloeosporioides, Oidium lycopersicum, Leveillula taurica, Pseudoperonospora cubensis, Alternaria solani, Rhizoctonia solani, Mycosphaerella musicola, Cercospora arachidola, Colletotrichum acutatum, Wilsonomyces carpophillum, Didymella bryoniae, Didymella lycopersici, Perono-spora tabacina, Puccinia recondita и Puccinia horiana, предпочтительно, которые вызывают устойчивость гриба к аналогу стробилурина или любому другому соединению той же группы перекрестной устойчивости и которые происходят из гриба, выбранного из группы, состоящей из Plasmopara viticola, Rhynchosporium secalis, Pyrenophora teres, Mycosphaerella graminicola, Venturia inaequalis, Mycosphaerella fijiensis var. difformis, Sphaerotheca fuliginea, Uncinula necator, Colletotrichum graminicola, Pythium aphanidermatum, Colletotrichum gloeosporioides, Oidium lycopersicum, Phytophthora infestans, Leveillula taurica, Pseudoperonospora cubensis, Alternaria solani, Rhizoctonia solani, Didymella bryoniae, Didymella lycopersici, Mycosphaerella musicola и Cercospora arachidola; или любой аллельспецифический олигонуклеотид; аллельспецифический олигонуклеотидный зонд, аллельспецифический праймер, обычный или диагностический праймер, описанный здесь.
Средство, считываемое компьютером, может использоваться, например, при поиске гомологии, картировании, гаплотипировании, генотипировании или любом другом биоинформатическом анализе. Может применяться любое средство, считываемое компьютером, например, компакт-диск, кассета, флоппи-диск, жесткий диск или компьютерные чипы.
Полинуклеотидные последовательности по изобретению или их части, особенно те, что относятся к идентифицированному здесь единичному нуклеотидному полиморфизму, и определяют его, особенно, к заменам T на C (первое основание) и/или T на A или G и C на A или G (третье основание) в цитохроме b гриба, вызывающим замену F129L в кодируемом белке, представляют собой ценный источник информации. Применение данного источника информации наиболее сильно упрощается за счет хранения информации по последовательностям в средстве, считываемом компьютером, и затем за счет применения данной информации в стандартных биоинформатических программах. Полинуклеотидные последовательности по изобретению особенно применимы в качестве компонентов в базах данных для определения идентичности по последовательности и других поисковых анализов. Применяемые здесь термины хранения информации по последовательностям в средстве, считываемом компьютером, и использование в базах данных последовательностей в отношении полинуклеотида или полинуклеотидной последовательности по изобретению охватывают любую подлежащую определению химическую или физическую характеристику полинуклеотида по изобретению, которая может быть редуцирована, преобразована или помещена для хранения на физическое средство, такое как компьютерный диск, предпочтительно в форме, считываемой компьютером. Например, данные хроматографического изображения или хроматографических пиков, данные фотографического изображения или фотографических пиков, масс-спектрографические данные, данные геля определения последовательности (или другого).
Также предоставлен основанный на компьютере способ для осуществления идентификации последовательности, причем указанный способ предусматривает стадии предоставления полинуклеотидной последовательности, включающей полиморфизм по изобретению, на средстве, считываемом компьютером, и сравнения указанной содержащей полиморфизм полинуклеотидной последовательности, по крайней мере, с одной другой полинуклеотидной или полипептидной последовательностью для определения идентичности (гомологии), т.е. скрининга наличия полиморфизма.
Изобретение далее относится к белку цитохрому b гриба, который обеспечивает устойчивость гриба к аналогу стробилурина или соединению той же группы перекрестной устойчивости, где в указанном белке обычный остаток фенилаланина изменен вследствие наличия одной или нескольких мутаций, происходящих в ДНК, кодирующей указанный белок, причем указанная(-ые) мутация(-ии) происходит(-ят) в положении ДНК, соответствующем первому и/или третьему основанию триплета, кодирующего аминокислоту в положении, соответствующем остатку 129 цитохрома b S. cerevisiae, в белке.
В предпочтительном осуществлении данного аспекта изобретение далее относится к белку цитохрому b гриба, который обеспечивает устойчивость гриба к аналогу стробилурина или соединению той же группы перекрестной устойчивости, где в указанном белке обычный остаток фенилаланина изменен вследствие наличия мутации, происходящей в ДНК, кодирующей указанный белок, причем указанная мутация происходит в положении ДНК, соответствующем первому или третьему основанию триплета, кодирующего аминокислоту в положении, соответствующем остатку 129 цитохрома b S. cerevisiae, в белке.
Остаток фенилаланина в белке, по указанному выше аспекту изобретения, предпочтительно замещается альтернативной аминокислотой, и указанная замена приводит к тому, что гриб проявляет устойчивость к аналогу стробилурина или любому другому соединению той же группы перекрестной устойчивости.
Мутация по указанному выше аспекту изобретения предпочтительно приводит к замене указанного остатка фенилаланина аминокислотой, выбранной из группы: изолейцин, лейцин, серин, цистеин, валин, тирозин, и, наиболее предпочтительно, лейцин.
В дальнейшем аспекте изобретение относится к антителу, способному распознавать указанный мутантный белок цитохром b.
В дальнейшем аспекте изобретение относится к способу определения наличия или отсутствия одной или нескольких мутаций в гене цитохрома b гриба, приводящих к замене в кодируемом белке остатка фенилаланина в положении, соответствующем остатку 129 цитохрома b S. cerevisiae, причем указанный способ предусматривает определение наличия или отсутствия указанной(-ых) мутации(-ий) в образце нуклеиновой кислоты гриба с использованием любого способа определения единичного нуклеотидного полиморфизма, где указанный способ определения единичного нуклеотидного полиморфизма основан на информации о последовательности, включающей примерно от 30 до 90 нуклеотидов выше и/или ниже положения, соответствующего одному или нескольким основаниям в триплете, кодирующем аминокислоту в положении, соответствующем остатку 129 цитохрома b S. Cerevisiae в белке дикого типа или мутантном белке.
В дальнейшем предпочтительном осуществлении данного аспекта изобретение относится к способу определения наличия или отсутствия одной или нескольких мутаций в гене цитохрома b гриба, приводящих к замене F129L в кодируемом белке, причем указанный способ предусматривает определение наличия или отсутствия указанной(-ых) мутации(-ий) в образце нуклеиновой кислоты гриба с использованием любого способа определения единичного нуклеотидного полиморфизма, где указанный способ определения единичного нуклеотидного полиморфизма основан на информации о последовательности, включающей примерно от 30 до 90 нуклеотидов выше и/или ниже положения, соответствующего первому или третьему основанию в триплете, кодирующем аминокислоту в положении, соответствующем остатку 129 цитохрома b S. cerevisiae, в белке дикого типа или мутантном белке.
В дальнейшем предпочтительном осуществлении данного аспекта изобретение относится к способу определения мутации тимина на цитозин в первом основании, и/или мутации тимина на аденин или гуанин, или цитозина на аденин или гуанин в третьем основании в гене цитохрома b гриба, приводящей к замене F129L в кодируемом белке, причем указанный способ предусматривает определение наличия или отсутствия указанной(-ых) мутации(-ий) в образце нуклеиновой кислоты гриба с использованием любого способа определения единичного нуклеотидного полиморфизма, где указанный способ определения единичного нуклеотидного полиморфизма основан на информации о последовательности, включающей примерно от 30 до 90 нуклеотидов выше и/или ниже положения, соответствующего первому или третьему основанию в триплете, кодирующем аминокислоту в положении, соответствующем остатку 129 цитохрома b S. cerevisiae, в белке дикого типа или мутантном белке.
В дальнейшем особенно предпочтительном осуществлении данного аспекта изобретение относится к способу определения мутации тимина на цитозин в первом основании, или мутации тимина на аденин или гуанин, или цитозина на аденин или гуанин в третьем основании в гене цитохрома b гриба, приводящей к замене F129L в кодируемом белке, причем указанный способ предусматривает определение наличия или отсутствия указанной(-ых) мутации(-ий) в образце нуклеиновой кислоты гриба с использованием любого способа определения единичного нуклеотидного полиморфизма, где указанный способ определения единичного нуклеотидного полиморфизма основан на информации о последовательности, включающей примерно от 30 до 90 нуклеотидов выше и/или ниже положения, соответствующего первому или третьему основанию в триплете, кодирующем аминокислоту в положении, соответствующем остатку 129 цитохрома b S. cerevisiae, в белке дикого типа или мутантном белке.
В дальнейшем особенно предпочтительном осуществлении данного аспекта изобретение относится к способу определения мутации цитозина на аденин или гуанин в третьем основании в гене цитохрома b гриба, приводящей к замене F129L в кодируемом белке, причем указанный способ предусматривает определение наличия или отсутствия указанной(-ых) мутации(-ий) в образце нуклеиновой кислоты гриба с использованием любого способа определения единичного нуклеотидного полиморфизма, где указанный способ определения единичного нуклеотидного полиморфизма основан на информации о последовательности, включающей примерно от 30 до 90 нуклеотидов выше и/или ниже положения, соответствующего первому или третьему основанию в триплете, кодирующем аминокислоту в положении, соответствующем остатку 129 цитохрома b S. cerevisiae, в белке дикого типа или мутантном белке.
В указанных выше аспектах изобретения способ определения единичного нуклеотидного полиморфизма предпочтительно основан на информации о последовательности, включающей примерно от 30 до 90 нуклеотидов выше и/или ниже положения, соответствующего третьему основанию в триплете, кодирующем аминокислоту в положении, соответствующем остатку 129 цитохрома b S. cerevisiae, в белке дикого типа или мутантном белке.
Применяемый здесь термин «выше» используется для обозначения последовательностей «в направлении 5′-конца», а термин «вниз» используется для обозначения последовательностей «в направлении 3′-конца».
Информация по последовательности по указанному выше аспекту изобретению предпочтительно происходит из гриба, выбранного из группы, включающей: Plasmopara viticola, Erysiphe graminis f. sp. tritici/hordei, Rhynchosporium secalis, Pyrenophora teres, Mycosphaerella graminicola, Venturia inaequalis, Mycosphaerella fijiensis var. difformis, Sphaerotheca fuliginea, Uncinula necator, Colletotrichum graminicola, Pythium aphanidermatum, Colletotrichum gloeosporioides, Oidium lycopersicum, Phytophthora infestans, Leveillula taurica, Pseudoperonospora cubensis, Alternaria solani, Rhizoctonia solani, Mycosphaerella musicola, Cercospora arachidola, Colletotrichum acutatum, Wilsonomyces carpophillum, Didymella bryoniae, Didymella lycopersici, Peronospora tabacina, Puccinia recondita and Puccinia horiana, предпочтительно, из группы, состоящей из Plasmopara viticola, Erysiphe graminis f. sp. tritici/hordei, Rhynchosporium secalis, Pyrenophora teres, Mycosphaerella graminicola, Venturia inaequalis, Mycosphaerella fijiensis var. difformis, Sphaerotheca fuliginea, Uncinula necator, Colletotrichum graminicola, Pythium aphanidermatum, Colletotrichum gloeosporioides, Oidium lycopersicum, Phytophthora infestans, Leveillula taurica, Pseudoperonospora cubensis, Alternaria solani, Rhizoctonia solani, Didymella bryoniae, Didymella lycopersicii Mycosphaerella musicola и Cercospora arachidola, и, более предпочтительно, из группы Plasmopara viticola, Erysiphe graminis f. sp. tritici/hordei, Rhynchosporium secalis, Pyrenophora teres, Mycosphaerella graminicola, Mycosphaerella fijiensis var. difformis, Sphaerotheca fuliginea, Uncinula necator, Colletotrichum graminicola, Pythium aphanidermatum, Colletotrichum gloeosporioides, Oidium lycopersicum, Leveillula taurica, Pseudoperonospora cubensis, Alternaria solani, Rhizoctania solani, Didymella bryoniae, Didymella lycopersici, Mycosphaerella musicola и Cercospora arachidola.
Используемый здесь термин «около 30» означает, что последовательность может содержать до 30 нуклеотидов, например, 5, до 10, 15, 20 или 25 нуклеотидов, или может содержать более 30 нуклеотидов. В указанных выше аспектах изобретения предпочтительно, что используемая информация по последовательности охватывает около 30, предпочтительно, 30 нуклеотидов выше и/или ниже положения, соответствующего первому или третьему основанию в триплете, кодирующем аминокислоту в положении, соответствующем остатку 129 цитохрома b S. cerevisiae, в белке дикого типа или мутантном белке.
Нуклеиновая кислота по изобретению предпочтительно представляет собой ДНК. Тестовый образец нуклеиновой кислоты обычно представляет собой препарат общей ДНК из материала гриба, препарат кДНК из материала гриба, или сам по себе материал гриба, или экстракт растения или семян, содержащий нуклеиновую кислоту гриба. В данной спецификации авторы изобретения описывают определение мутации F129L с использованием препаратов общей геномной ДНК или кДНК. Однако понятно, что тестовый образец может в равной степени представлять собой нуклеиновую кислоту, последовательность которой соответствует последовательности в тестовом образце. То есть, вся область в нуклеиновой кислоте образца или ее часть могут вначале быть выделены или амплифицированы с использованием любого общепринятого способа, такого как PCR, до использования по способу изобретения.
Настоящее изобретение относится к средству анализа мутаций в ДНК сельскохозяйственных полевых образцов, которые за счет своего происхождения обычно заметно менее хорошо определены по сравнению с аналогичными ситуациями с участием образцов от человека, с которыми чаще всего используются описанные здесь способы диагностики.
Работать с сельскохозяйственными полевыми образцами заметно труднее, и они характеризуются большими техническими требованиями для определения события мутации, происходящего с низкой частотой среди очень большого количества ДНК дикого типа и/или чужеродной ДНК из других организмов, которая(-ые) присутствует(-ют) в полевом изоляте по сравнению с образцом из человека, который часто содержит ДНК только одного субъекта.
Для полимеризации может применяться любой общепринятый фермент, если обеспечено то, что он не обладает внутренним свойством различения между нормальными и мутантными последовательностями матрицы в какой-либо значимой степени. Примеры общепринятых ферментов включают термостабильные ферменты, которые не обладают значимой 3′-5′-экзонуклеазной активностью, например, ДНК-полимеразу Taq, в частности, ДНК-полимеразу «Ampli Taq Gold» (Applied Biosystems), фрагмент Stoffel или другие подвергнутые подходящей делеции с N-конца модификации ДНК-полимераз Taq (Thermus aquaticus) или Tth (Thermus thermophilus). (Applied Biosystems), фрагмент Stoffel или другие подвергнутые подходящей делеции с N-конца модификации ДНК-полимераз Taq (Thermus aquaticus) или Tth (Thermus thermophilus).
В дальнейшем аспекте настоящее изобретение относится к аллельспецифическому олигонуклеотиду, способному связываться с последовательностью нуклеиновой кислоты гриба, кодирующей белок цитохром b дикого типа, где указанный олигонуклеотид включает последовательность, распознающую последовательность нуклеиновой кислоты, кодирующую остаток фенилаланина в положении, соответствующем остатку 129 цитохрома b S. cerevisiae.
В предпочтительном осуществлении указанная последовательность нуклеиновой кислоты гриба выбрана из гриба из группы, состоящей из Plasmopara viticola, Erysiphe graminis f sp. tritici/hordei, Rhynchosporium secalis, Pyrenophora teres, Mycosphaerella graminicola, Venturia inaequalis, Mycosphaerella fijiensis var. difformis, Sphaerotheca fuliginea, Uncinula necator, Colletotrichum graminicola, Pythium aphanidermatum, Colletotrichum gloeosporioides, Oidium lycopersicum, Phytophthora infestans, Leveillula taurica, Pseudoperonospora cubensis, Alternaria solani, Rhizoctonia solani, Mycosphaerella musicola, Cercospora arachidola, Colletotrichum acutatum, Wilsonomyces carpophillum, Didymella bryoniae, Didymella lycopersici, Peronospora tabacina, Puccinia recondita и Puccinia horiana.
В предпочтительном осуществлении данного аспекта изобретения указанная последовательность нуклеиновой кислоты гриба выбрана из группы, состоящей из Plasmopara viticola, Erysiphe graminis f. sp. tritici/hordei, Rhynchosporium secalis, Pyrenophora teres, Mycosphaerella graminicola, Venturia inaequalis, Mycosphaerella fijiensis var. difformis, Sphaerotheca fuliginea, Uncinula necator, Colletotrichum graminicola, Pythium aphanidermatum, Colletotrichum gloeosporioides, Oidium lycopersicum, Phytophthora infestans, Leveillula taurica, Pseudoperonospora cubensis, Alternaria solani, Rhizoctonia solani, Didymella bryoniae, Didymella lycopersici, Mycosphaerella musicola и Cercospora arachidola, и в особенно предпочтительном осуществлении нуклеиновая кислота гриба выбрана из группы, состоящей из Plasmopara viticola, Erysiphe graminis f. sp. tritici/hordei, Rhynchosporium secalis, Pyrenophora teres, Mycosphaerella graminicola, Mycosphaerella fijiensis var. difformis, Sphaerotheca fuliginea, Uncinula necator, Colletotrichum graminicola, Pythium aphanidermatum, Colletotrichum gloeosporioides, Oidium lycopersicum, Leveillula taurica, Pseudoperonospora cubensis, Alternaria solani, Rhizoctonia solani, Didymella bryoniae, Didymella lycopersici, Mycosphaerella musicola и Cercospora arachidola.
Нуклеиновая кислота гриба по указанным выше аспектам изобретения предпочтительно представляет собой ДНК.
В дальнейшем аспекте настоящего изобретения авторы изобретения предоставляют аллельспецифический олигонуклеотид, способный связываться с последовательностью нуклеиновой кислоты гриба, кодирующей мутантный белок цитохром b, где указанный олигонуклеотид включает последовательность, распознающую последовательность нуклеиновой кислоты, кодирующую аминокислоту, выбранную из группы: изолейцин, лейцин, серин, цистеин, валин, тирозин, и наиболее предпочтительно, лейцин, в положении, соответствующем остатку 129 цитохрома b S. cerevisiae.
В предпочтительном осуществлении данного аспекта изобретения авторы изобретения предоставляют аллельспецифический олигонуклеотид, способный связывать мутантную последовательность нуклеиновой кислоты, кодирующую мутантный белок цитохром b, гриба выбранного из группы, состоящей из Plasmopara viticola, Erysiphe graminis f sp. tritici/hordei, Rhynchosporium secalis, Pyrenophora teres, Mycosphaerella graminicola, Venturia inaequalis, Mycosphaerella fijiensis var. difformis, Sphaerotheca fuliginea, Uncinula necator, Colletotrichum graminicola, Pythium aphanidermatum, Colletotrichum gloeosporioides, Oidium lycopersicum, Phytophthora infestans, Leveillula taurica, Pseudoperonospora cubensis, Alternaria solani, Rhizoctonia solani, Mycosphaerella musicola, Cercospora arachidola, Colletotrichum acutatum, Wilsonomyces carpophillum, Didymella bryoniae, Didymella lycopersici, Peronospora tabacina, Puccinia recondita и Puccinia horiana, где указанный олигонуклеотид включает последовательность, которая распознает последовательность нуклеиновой кислоты, выбранную из группы: изолейцин, лейцин, серин, цистеин, валин, тирозин, и наиболее предпочтительно, лейцин, в положении, соответствующем остатку 129 цитохрома b S. cerevisiae.
В дальнейшем предпочтительном осуществлении данного аспекта изобретения авторы изобретения предоставляют аллельспецифический олигонуклеотид, способный связывать мутантную последовательность нуклеиновой кислоты, кодирующую мутантный белок цитохром b, гриба выбранного из группы, состоящей из Plasmopara viticola, Erysiphe graminis f. sp. tritici/hordei, Rhynchosporium secalis, Pyrenophora teres, Mycosphaerella graminicola, Venturia inaequalis, Mycosphaerella fijiensis var. difformis, Sphaerotheca fuliginea, Uncinula necator, Colletotrichum graminicola, Pythium aphanidermatum, Colletotrichum gloeosporioides, Oidium lycopersicum, Phytophthora infestans, Leveillula taurica, Pseudoperonospora cubensis, Alternaria solani, Rhizoctonia solani, Didymella bryoniae, Didymella lycopersici, Mycosphaerella musicola и Cercospora arachidola.
Нуклеиновая кислота гриба по указанным выше аспектам изобретения предпочтительно представляет собой ДНК.
В дальнейшем аспекте изобретение относится аллельспецифическому олигонуклеотидному зонду, способному определять генную последовательность цитохрома b дикого типа в положении ДНК, соответствующем одному или нескольким основаниям триплета, кодирующего аминокислоту в положении, соответствующем остатку 129 цитохрома b S. cerevisiae, в белке.
В дальнейшем аспекте изобретение относится к аллельспецифическому олигонуклеотидному зонду, способному определять полиморфизм гена цитохрома b гриба в положении ДНК, соответствующем одному или нескольким основаниям триплета, кодирующего аминокислоту в положении, соответствующем остатку 129 цитохрома b S. cerevisiae, в белке.
В дальнейшем предпочтительном осуществлении данного аспекта изобретение относится к аллельспецифическому олигонуклеотидному зонду, способному определять полиморфизм гена цитохрома b гриба в позициях ДНК, соответствующих первому и/или третьему основанию триплета, кодирующего аминокислоту в положении, соответствующем остатку 129 цитохрома b S. cerevisiae, в белке.
В дальнейшем предпочтительном осуществлении данного аспекта изобретение относится к аллельспецифическому олигонуклеотидному зонду, способному определять полиморфизм гена цитохрома b гриба в позициях ДНК, соответствующих первому или третьему основанию триплета, кодирующего аминокислоту в положении, соответствующем остатку 129 цитохрома b S. cerevisiae, в белке.
В дальнейшем предпочтительном осуществлении данного аспекта изобретение относится к аллельспецифическому олигонуклеотидному зонду, способному определять полиморфизм гена цитохрома b гриба в позициях ДНК, соответствующих третьему основанию триплета, кодирующего аминокислоту в положении, соответствующем остатку 129 цитохрома b S. cerevisiae, в белке.
В дальнейшем предпочтительном осуществлении данного аспекта изобретения указанный полиморфизм представляет собой замену основания тимина на цитозин в первом основании, замену тимина или цитозина на аденин или гуанин в третьем основании кодона, причем данная мутация происходит в грибе, выбранном из группы, состоящей из Plasmopara viticola, Erysiphe graminis f. sp. tritici/hordei, Rhynchosporium secalis, Pyrenophora teres, Mycosphaerella graminicola, Venturia inaequalis, Mycosphaerella fijiensis var. diffiormis, Sphaerotheca fuliginea, Uncinula necator, Colletotrichum graminicola, Pythium aphanidermatum, Colletotrichum gloeosporioides, Oidium lycopersicum, Phytophthora infestans, Leveillula taurica, Pseudoperonospora cubensis, Alternaria solani, Rhizoctonia solani, Mycosphaerella musicola, Cercospora arachidola, Colletotrichum acutatum, Wilsonomyces carpophillum, Didymella bryoniae, Didymella lycopersici, Peronospora tabacina, Puccinia recondita и Puccinia horiana.
В дальнейшем предпочтительном осуществлении данного аспекта изобретения указанный полиморфизм представляет собой замену основания тимина на цитозин в первом основании, замену тимина или цитозина на аденин или гуанин в третьем основании кодона, причем данная мутация происходит в грибе, выбранном из группы, состоящей из Plasmopara viticola, Erysiphe graminis f. sp. tritici/hordei, Rhynchosporium secalis, Pyrenophora teres, Mycosphaerella graminicola, Venturia inaequalis, Mycosphaerella fijiensis var. difformis, Sphaerotheca fuliginea, Uncinula necator, Colletotrichum graminicola, Pythium aphanidermatum, Colletotrichum gloeosporioides, Oidium lycopersicum, Phytophthora infestans, Leveillula taurica, Pseudoperonospora cubensis, Alternaria solani, Rhizoctonia solani, Didymella bryoniae, Didymella lycopersici, Mycosphaerella musicola and Cercospora arachidola.
Аллельспецифический олигонуклеотидный зонд предпочтительно составляет от 12 до 50 нуклеотидов в длину, более предпочтительно, примерно 12-35 нуклеотидов в длину и, наиболее предпочтительно, примерно 12-30 нуклеотидов в длину.
Конструирование таких зондов очевидно для рядового молекулярного биолога, и может быть основано на информации о последовательности ДНК или РНК. Такие зонды имеют любую общепринятую длину, такую как до 50 оснований, до 40 оснований, более обычно до 30 оснований в длину, как, например, 8-25 или 8-15 оснований в длину. В общем, такие зонды включают последовательности оснований, полностью комплементарные соответствующим локусу дикого типа или варианта в гене. Однако, если требуется, можно ввести одно или несколько несовпадений, если при этом обеспечено отсутствие чрезмерного влияния на дискриминирующую способность олигонуклеотидного зонда. Зонды по изобретению могут нести одну или несколько меток, облегчающих определение (например, флуоресцентные метки, включая, например, FAM и VIC).
Изобретение далее относится к нуклеотидным праймерам, которые могут определять нуклеотидные полиморфизмы по изобретениям.
Согласно еще одному аспекту изобретения предоставляется аллельспецифический праймер, способный определять полиморфизм гена цитохрома b в положении ДНК, соответствующем одному или нескольким основаниям триплета, кодирующего аминокислоту в положении, соответствующем остатку 129 цитохрома b S. cerevisiae, в белке.
Согласно предпочтительному осуществлению данного аспекта изобретения предоставляется аллельспецифический праймер, способный определять полиморфизм гена цитохрома b в положении ДНК, соответствующем первому и/или третьему основанию триплета, кодирующего аминокислоту в положении, соответствующем остатку 129 цитохрома b S. cerevisiae, в белке.
Согласно дальнейшему предпочтительному осуществлению данного аспекта изобретения предоставляется аллельспецифический праймер, способный определять полиморфизм гена цитохрома b в положении ДНК, соответствующем первому или третьему основанию триплета, кодирующего аминокислоту в положении, соответствующем остатку 129 цитохрома b S. cerevisiae, в белке.
Согласно дальнейшему предпочтительному осуществлению данного аспекта изобретения предоставляется аллельспецифический праймер, способный определять полиморфизм гена цитохрома b в положении ДНК, соответствующем третьему основанию триплета, кодирующего аминокислоту в положении, соответствующем остатку 129 цитохрома b S. cerevisiae, в белке.
В указанных выше аспектах указанная мутация в последовательности ДНК представляет собой замену основания тимина на цитозин в первом основании триплета и замену тимина или цитозина на аденин или гуанин в третьем основании триплета, наиболее предпочтительно, замену цитозина на аденин в третьем положении.
В дальнейшем аспекте изобретение относится к аллельспецифическому праймеру, способному определять последовательность ДНК, кодирующую белок цитохром b дикого типа, гриба, выбранного из группы, состоящей из Plasmopara viticola, Erysiphe graminis f. sp. tritici/hordei, Rhynchosporium secalis, Pyrenophora teres, Mycosphaerella graminicola, Venturia inaequalis, Mycosphaerella fijiensis var. difformis, Sphaerotheca fuliginea, Uncinula necator, Colletotrichum graminicola, Pythium aphanidermatum, Colletotrichum gloeosporioides, Oidium lycopersicum, Phytophthora infestans, Leveillula taurica, Pseudoperonospora cubensis, Alternaria solani, Rhizoctonia solani, Mycosphaerella musicola, Cercospora arachidola, Colletotrichum acutatum, Wilsonomyces carpophillum, Didymella bryoniae, Didymella lycopersici, Peronospora tabacina, Puccinia recondita и Puccinia horiana, где указанный праймер способен определять последовательность ДНК, кодирующую остаток фенилаланина в положении, соответствующем остатку 129 цитохрома b S. cerevisiae. В предпочтительном осуществлении данного аспекта изобретение относится к аллельспецифическому праймеру, способному определять последовательность ДНК, кодирующую белок цитохром b дикого типа, гриба, выбранного из группы, состоящей из Plasmopara viticola, Erysiphe graminis f. sp. tritici/hordei, Rhynchosporium secalis, Pyrenophora teres, Mycosphaerella graminicola, Venturia inaequalis, Mycosphaerella fijiensis var. difformes, Sphaerotheca fuliginea, Uncinula necator, Colletotrichum graminicola, Pythium aphanidermatum, Colletotrichum gloeosporioides, Oidium lycopersicum, Phytophthora infestans, Leveillula taurica, Pseudoperonospora cubensis, Alternaria solani, Rhizoctonia solani, Didymelia bryoniae, Didymella lycopersici, Mycosphaerella musicola и Cercospora arachidola horiana, где указанный праймер способен определять последовательность ДНК, кодирующую остаток фенилаланина в положении, соответствующем остатку 129 цитохрома b S. cerevisiae.
В предпочтительном осуществлении данного аспекта изобретения указанная ДНК гриба выбрана из группы, состоящей из Plasmopara viticola, Erysiphe graminis f. sp. tritici/hordei, Rhynchosporium secalis, Pyrenophora teres, Mycosphaerella graminicola, Mycosphaerella fijiensis var. difformis, Sphaerotheca fuliginea, Uncinula necator, Colletotrichum graminicola, Pythium aphanidermatum, Colletotrichum gloeosporioides, Oidium lycopersicum, Leveillula taurica, Pseudoperonospora cubensis, Alternaria solani, Rhizoctonia solani, Didymella bryoniae, Didymella lycopersici, Mycosphaerella musicola и Cercospora arachidola.
В дальнейшем аспекте изобретения авторы изобретения предоставляют аллельспецифический праймер, способный определять последовательность ДНК гриба, кодирующую часть мутантного белка цитохрома b, где указанный аллельспецифический праймер способен определять последовательность ДНК, кодирующую аминокислоту, выбранную из группы: изолейцин, лейцин, серин, цистеин, валин, тирозин, и наиболее предпочтительно, лейцин, в положении, соответствующем остатку 129 цитохрома b S. cerevisiae.
В дальнейшем осуществлении данного аспекта изобретения авторы изобретения предоставляют аллельспецифический праймер, способный определять последовательность ДНК гриба, кодирующую часть мутантного белка цитохрома b, где указанный аллельспецифический праймер способен определять последовательность ДНК, кодирующую аминокислоту, выбранную из группы: изолейцин, лейцин, серин, цистеин, валин, тирозин, и наиболее предпочтительно, лейцин, в положении, соответствующем остатку 129 цитохрома b S. cerevisiae.
В предпочтительном осуществлении данного аспекта изобретения авторы изобретения предоставляют аллельспецифический праймер, способный определять последовательность ДНК, кодирующую часть мутантного белка цитохрома b, гриба, выбранного из группы, состоящей из Plasmopara viticola, Erysiphe graminis f. sp. tritici/hordei, Rhynchosporium secalis, Pyrenophora teres, Mycosphaerella graminicola, Venturia inaequalis, Mycosphaerella fijiensis var. difformis, Sphaerotheca fuliginea, Uncinula necator, Colletotrichum graminicola, Pythium aphanidermatum, Colletotrichum gloeosporioides, Oidium lycopersicum, Phytophthora infestans, Leveillula taurica, Pseudoperonospora cubensis, Alternaria solani, Rhizoctonia solani, Mycosphaerella musicola, Cercospora arachidola, Colletotrichum acutatum, Wilsonomyces carpophillum, Didymella bryoniae, Didymella lycopersici, Peronospora tabacina, Puccinia recondita и Puccinia horiana, где указанный праймер способен определять последовательность ДНК, кодирующую аминокислоту, выбранную из группы: изолейцин, лейцин, серин, цистеин, валин, тирозин, и наиболее предпочтительно, лейцин, в положении, соответствующем остатку 129 цитохрома b S. cerevisiae.
В дальнейшем предпочтительном осуществлении данного аспекта изобретения авторы изобретения предоставляют аллельспецифический праймер, способный определять последовательность ДНК, кодирующую часть мутантного белка цитохрома b, гриба, выбранного из группы, состоящей из Plasmopara viticola, Erysiphe graminis f. sp. tritici/hordei, Rhynchosporium secalis, Pyrenophora teres, Mycosphaerella graminicola, Venturia inaequalis, Mycosphaerella fijiensis var. difformis, Sphaerotheca fuliginea, Uncinula necator, Colletotrichum graminicola, Pythium aphanidermatum, Colletotrichum gloeosporioides, Oidium lycopersicum, Phytophthora infestans, Leveillula taurica, Pseudoperonospora cubensis, Alternaria solani, Rhizoctonia solani, Didymella bryoniae, Didymella lycopersici, Mycosphaerella musicola и Cercospora arachidola, где указанный праймер способен определять последовательность ДНК, кодирующую аминокислоту, выбранную из группы: изолейцин, лейцин, серин, цистеин, валин, тирозин, и наиболее предпочтительно, лейцин, в положении, соответствующем остатку 129 цитохрома b S. cerevisiae.
Аллельспецифический праймер применяют главным образом с обычным праймером в реакции амплификации, такой как реакция PCR, которая обеспечивает различение между аллелями в конкретном положении последовательности, например, как это применяется при анализе ARMS.
Авторы изобретения в настоящее время могут разрабатывать праймеры для мутации F129L в перечисленных выше видах грибов, которые, как было показано, надежно и ясно определяют конкретные мутации. Данные праймеры определяют замену основания тимина на цитозин в положении ДНК, соответствующем первому основанию в триплете, кодирующем аминокислоту в положении, соответствующем остатку 129 цитохрома b S. cerevisiae, в данном белке, и/или замену основания тимина или цитозина на аденин или гуанин в положении ДНК, соответствующем третьему основанию в триплете, кодирующем аминокислоту в положении, соответствующем остатку 129 цитохрома b S. cerevisiae, в данном белке. Аллельспецифические праймеры обозначаются здесь как диагностические праймеры.
В дальнейшем аспекте изобретение, таким образом, относится к диагностическому праймеру, способному связывать матрицу, включающую нуклеотидную последовательность цитохрома b гриба мутантного типа в положении, соответствующем первому и/или третьему основанию в триплете, кодирующем аминокислоту в положении, соответствующем остатку 129 цитохрома b S. cerevisiae, в белке цитохроме b, где 3′-концевой нуклеотид праймера соответствует нуклеотиду, присутствующему в указанной мутантной форме гена цитохрома b гриба, и наличие указанного нуклеотида приводит к устойчивости гриба к аналогу стробилурина или любому другому соединению той же группы перекрестной устойчивости.
В дальнейшем осуществлении данного аспекта изобретение, таким образом, относится к диагностическому праймеру, способному связывать матрицу, включающую нуклеотидную последовательность цитохрома b гриба мутантного типа в положении, соответствующем первому или третьему основанию в триплете, кодирующем аминокислоту в положении, соответствующем остатку 129 цитохрома b S. cerevisiae, в белке цитохроме b, где 3′-концевой нуклеотид праймера соответствует нуклеотиду, присутствующему в указанной мутантной форме гена цитохрома b гриба, и наличие указанного нуклеотида приводит к устойчивости гриба к аналогу стробилурина или любому другому соединению той же группы перекрестной устойчивости.
В дальнейшем осуществлении данного аспекта изобретение, таким образом, относится к диагностическому праймеру, способному связывать матрицу, включающую нуклеотидную последовательность цитохрома b гриба мутантного типа в положении, соответствующем первому и/или третьему основанию в триплете, кодирующем аминокислоту в положении, соответствующем остатку 129 цитохрома b S. cerevisiae, в белке цитохроме b, где 3′-концевой нуклеотид праймера соответствует нуклеотиду, присутствующему в указанной мутантной форме гена цитохрома b гриба, и наличие указанного нуклеотида приводит к устойчивости гриба к аналогу стробилурина или любому другому соединению той же группы перекрестной устойчивости.
В дальнейшем предпочтительном осуществлении данного аспекта изобретение, таким образом, относится к диагностическому праймеру, способному связывать матрицу, включающую нуклеотидную последовательность цитохрома b гриба мутантного типа в положении, соответствующем первому или третьему основанию в триплете, кодирующем аминокислоту в положении, соответствующем остатку 129 цитохрома b S. cerevisiae, в белке цитохроме b, где 3′-концевой нуклеотид праймера соответствует нуклеотиду, присутствующему в указанной мутантной форме гена цитохрома b гриба, и наличие указанного нуклеотида приводит к устойчивости гриба к аналогу стробилурина или любому другому соединению той же группы перекрестной устойчивости.
В дальнейшем аспекте изобретение, таким образом, относится к диагностическому праймеру, способному связывать матрицу, включающую нуклеотидную последовательность цитохрома b гриба мутантного типа в положении, соответствующем третьему основанию в триплете, кодирующем аминокислоту в положении, соответствующем остатку 129 цитохрома b S. cerevisiae, в белке цитохроме b, где 3′-концевой нуклеотид праймера соответствует нуклеотиду, присутствующему в указанной мутантной форме гена цитохрома b гриба, и наличие указанного нуклеотида приводит к устойчивости гриба к аналогу стробилурина или любому другому соединению той же группы перекрестной устойчивости.
В дальнейшем аспекте изобретение, таким образом, относится к диагностическому праймеру, способному связывать матрицу, включающую нуклеотидную последовательность цитохрома b гриба мутантного типа в положении, соответствующем первому основанию в триплете, кодирующем аминокислоту в положении, соответствующем остатку 129 цитохрома b S. cerevisiae, в белке цитохроме b, где 3′-концевой нуклеотид праймера соответствует нуклеотиду, присутствующему в указанной мутантной форме гена цитохрома b гриба, и наличие указанного нуклеотида приводит к устойчивости гриба к аналогу стробилурина или любому другому соединению той же группы перекрестной устойчивости.
Диагностический праймер по изобретению предпочтительно составляет по крайней мере 20 нуклеотидов в длину, и, наиболее предпочтительно, около 26 нуклеотидов в длину. Однако диагностические праймеры по изобретению также могут по длине быть между 15 и 20 нуклеотидами. Специалисту ясно, что диагностические праймеры по изобретению могут быть такими, что они гибридизуются или со смысловой, или с антисмысловой нитью нуклеиновой кислоты, кодирующей белок цитохром b гриба.
В предпочтительном осуществлении указанного выше аспекта изобретения предпоследний нуклеотид (-2) праймера не такой же, как тот, что присутствует в соответствующем положении последовательности цитохрома b дикого типа.
В дальнейшем предпочтительном осуществлении еще и нуклеотид -3 праймера не такой же, как тот, что присутствует в соответствующем положении последовательности цитохрома b дикого типа.
Вместе с нуклеотидами -2 или -3 могут быть включены другие дестабилизирующие компоненты.
В дальнейшем особенно предпочтительном осуществлении указанного выше аспекта изобретения авторы изобретения предоставляют диагностические праймеры, способные связывать матрицу, включающую нуклеотидную последовательность цитохрома b гриба мутантного типа в положении, соответствующем первому и/или третьему основанию в триплете, кодирующем аминокислоту в положении, соответствующем остатку 129 цитохрома b S. cerevisiae, в белке цитохроме b, где 3′-концевой нуклеотид праймера соответствует нуклеотиду, присутствующему в указанной мутантной форме гена цитохрома b гриба, и где до 10, а также до 8, 6, 4, 2, 1 оставшихся нуклеотидов могут варьировать относительно последовательности дикого типа без значительного влияния на свойства диагностического праймера.
В дальнейшем особенно предпочтительном осуществлении указанного выше аспекта изобретения авторы изобретения предоставляют диагностические праймеры, способные связывать матрицу, включающую нуклеотидную последовательность цитохрома b гриба мутантного типа в положении, соответствующем первому или третьему основанию в триплете, кодирующем аминокислоту в положении, соответствующем остатку 129 цитохрома b S. cerevisiae, в белке цитохроме b, где 3′-концевой нуклеотид праймера соответствует нуклеотиду, присутствующему в указанной мутантной форме гена цитохрома b гриба, и где до 10, а также до 8, 6, 4, 2, 1 оставшихся нуклеотидов могут варьировать относительно последовательности дикого типа без значительного влияния на свойства диагностического праймера.
В дальнейшем особенно предпочтительном осуществлении указанного выше аспекта изобретения авторы изобретения предоставляют диагностические праймеры, способные связывать матрицу, включающую нуклеотидную последовательность цитохрома b гриба мутантного типа в положении, соответствующем третьему основанию в триплете, кодирующем аминокислоту в положении, соответствующем остатку 129 цитохрома b S. cerevisiae, в белке цитохроме b, где 3′-концевой нуклеотид праймера соответствует нуклеотиду, присутствующему в указанной мутантной форме гена цитохрома b гриба, и где до 10, а также до 8, 6, 4, 2, 1 оставшихся нуклеотидов могут варьировать относительно последовательности дикого типа без значительного влияния на свойства диагностического праймера.
В дальнейшем особенно предпочтительном осуществлении указанного выше аспекта изобретения авторы изобретения предоставляют диагностические праймеры, способные связывать матрицу, включающую нуклеотидную последовательность цитохрома b гриба мутантного типа в положении, соответствующем первому основанию в триплете, кодирующем аминокислоту в положении, соответствующем остатку 129 цитохрома b S. cerevisiae, в белке цитохроме b, где 3′-концевой нуклеотид праймера соответствует нуклеотиду, присутствующему в указанной мутантной форме гена цитохрома b гриба, и где до 10, а также до 8, 6, 4, 2, 1 оставшихся нуклеотидов могут варьировать относительно последовательности дикого типа без значительного влияния на свойства диагностического праймера.
В дальнейшем особенно предпочтительном осуществлении указанного выше аспекта изобретения авторы изобретения предоставляют диагностические праймеры, включающие приведенные ниже последовательности и их производные, где 3′-концевой нуклеотид праймера соответствует нуклеотиду, присутствующему в указанной мутантной форме гена цитохрома b гриба, и где до 10, а также до 8, 6, 4, 2, 1 оставшихся нуклеотидов могут варьировать без значительного влияния на свойства диагностического праймера.
Диагностические (например, относящиеся к ARMS) праймеры характеризуются высоким Tm, что понятно специалисту в данной области, и предпочтительным является то, что праймеры ARMS во всех аспектах изобретения составляют в длину около 26 нуклеотидов. Обычно последовательность диагностического праймера может точно совпадать с предоставленной ниже (см. таблицы с 9 по 13). Во всех перечисленных ниже в таблицах 9-13 праймерах предпоследний нуклеотид изменен по сравнению с последовательностью cyt b дикого типа с целью дестабилизации гибридной структуры матрица/праймер, чтобы сделать его более селективным в отношении требуемой матрицы, и данные праймеры особенно предпочтительно по изобретению. Специалисту в области конструирования праймеров ясно, что основания альтернативные обсуждаемым выше или добавленные к ним также могут быть изменены без неблагоприятного влияния на способность праймера связываться с матрицей.
Таблица 9
Конструирование праймеров ARMS для определения мутации F129L, где первое основание в триплете, кодирующем остаток лейцина, представляет собой цитозин
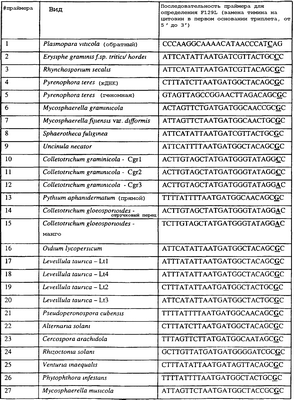

Таблица 10
Конструирование праймеров ARMS для определения мутации F129L, где третье основание в триплете, кодирующем остаток лейцина, представляет собой аденин

Таблица 11
Конструирование праймеров ARMS для определения мутации F129L, где третье основание в триплете, кодирующем остаток лейцина, представляет собой гуанин
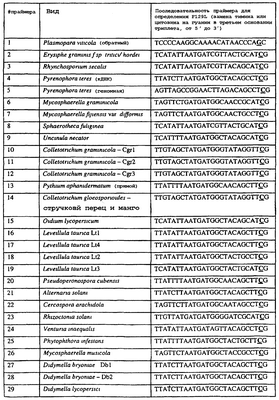
Таблица 12
Конструирование праймеров ARMS для определения мутации F129L, где первое основание в триплете, кодирующем остаток 129, представляет собой цитозин, и третье основание в триплете, кодирующем остаток 129, представляет собой аденин, так что кодируется лейцин
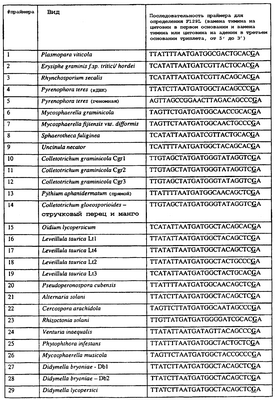
Таблица 13
Конструирование праймеров ARMS для определения мутации F129L, где первое основание в триплете, кодирующем остаток 129, представляет собой цитозин, и третье основание в триплете, кодирующем остаток 129, представляет собой гуанин, так что кодируется лейцин
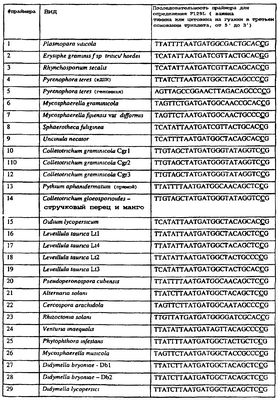
С иллюстративными целями праймеры в составе таблиц 9-13 включают:
– праймеры ARMS для P. teres, C. graminicola – Cgr3 и V. ineaqualis, которые могут эффективно использоваться на препаратах геномной ДНК или на биологических образцах, включающих изоляты грибов, культуры грибов, споры грибов или инфицированный растительный материал;
– праймеры ARMS для S. fulginea, O. lycopersicon, L taurica Lt1, Lt2, Lt3 и Lt4, U. necator, Phytopthora infestans, R. solani, D. bryoniae Dbl и Db2, и D. lycopersici, которые могут быть эффективны только на кДНК;
– праймеры ARMS для P. viticola, R. secalis, M. graminicola, M. fijiensis var. difformis, C. graminicola Cgr1 и Cgr2, P. aphanidermatum, C. gloesporoides – стручкового перца и манго, P. cubensis, C. arachidola, Mycosphaerella musicola и A. solani, которые могут эффективно использоваться с препаратами геномной ДНК, препаратами кДНК, препаратами кДНК или биологическими образцами, включающими изоляты грибов, культуры грибов, споры грибов или инфицированный растительный материал. Материал кДНК рекомендован для тех видов, в которых вблизи от интересующих нуклеотидных полиморфизмов пока не охарактеризована интронно-экзонная организация.
Праймеры ARMS, описанные выше в таблицах 9-13, представляют конкретные примеры диагностических праймеров по изобретению.
Для адаптации праймеров, показанных в приведенных выше таблицах, для применения в стандартной реакции ASPCR последнее основание с 3′-конца должно соответствовать точечной мутации без введения дестабилизирующего основания.
Такие праймеры могут производиться с использованием любого общепринятого способа синтеза. Примеры таких способов могут быть обнаружены в стандартных учебниках, например, в “Protocols For Oligonucleotides And Analogues: Synthesis And Properties;” Methods In Molecular Biology Series; Volume 20; Ed. Sudhir Agrawal, Humana ISBN: 0-89603-247-7; 1993; 1St Edition.
Очевидно, что диагностические праймеры могут быть сконструированы для выявления отсутствия одной или нескольких мутаций, приводящих к замене F129L в кодируемом белке (т.е., для определения последовательности дикого типа, кодирующей фенилаланин, или подтверждения наличия последовательности, кодирующей лейцин, в положении, соответствующем кодону 129 цитохрома b S. cerevisiae. Применение праймеров ARMS для определения отсутствия мутации (-ий), приводящих к замене F129L в кодируемом белке, является предпочтительным. Здесь описаны праймеры, сконструированные для такой цели.
Определение последовательности дикого типа может использоваться в качестве контроля в отношении определения мутации и также необходимо, когда требуется количественный анализ аллей дикого типа и мутантных аллелей, присутствующих в образце.
В дальнейшем аспекте изобретение, таким образом, относится к диагностическому праймеру, способному связывать матрицу, включающую нуклеотидную последовательность дикого типа цитохрома b гриба в положении, соответствующем первому и/или третьему основанию в триплете, кодирующем аминокислоту в положении, соответствующем остатку 129 цитохрома b S. cerevisiae, в белке цитохроме b, где 3′-концевой нуклеотид праймера соответствует нуклеотиду, присутствующему в диком типе гена цитохрома b гриба, причем указанный гриб дикого типа характеризуется чувствительностью к аналогу стробилурина или любому другому соединению той же группы перекрестной устойчивости.
В дальнейшем осуществлении данного аспекта изобретение, таким образом, относится к диагностическим праймерам, способным связывать матрицу, включающую нуклеотидную последовательность дикого типа цитохрома b гриба в положении, соответствующем первому или третьему основанию в триплете, кодирующем аминокислоту в положении, соответствующем остатку 129 цитохрома b S. cerevisiae, в белке цитохроме b, где 3′-концевой нуклеотид праймера соответствует нуклеотиду, присутствующему в диком типе гена цитохрома b гриба, причем указанный гриб дикого типа характеризуется чувствительностью к аналогу стробилурина или любому другому соединению той же группы перекрестной устойчивости.
В дальнейшем аспекте изобретение, таким образом, относится к диагностическому праймеру, способному связывать матрицу, включающую нуклеотидную последовательность дикого типа цитохрома b гриба в положении, соответствующем третьему основанию в триплете, кодирующем аминокислоту в положении, соответствующем остатку 129 цитохрома b S. cerevisiae, в белке цитохроме b, где 3′-концевой нуклеотид праймера соответствует нуклеотиду, присутствующему в диком типе гена цитохрома b гриба, причем указанный гриб дикого типа характеризуется чувствительностью к аналогу стробилурина или любому другому соединению той же группы перекрестной устойчивости.
В предпочтительном осуществлении указанного выше аспекта изобретения предпоследний нуклеотид (-2) праймера не такой же, как тот, что присутствует в соответствующем положении последовательности цитохрома b дикого типа.
В дальнейшем предпочтительном осуществлении нуклеотид -3 праймера не такой же, как тот, что присутствует в соответствующем положении последовательности цитохрома b дикого типа.
Вместе с нуклеотидами -2 или -3 могут быть включены другие дестабилизирующие компоненты.
Диагностический праймер по изобретению предпочтительно составляет, по крайней мере, 20 нуклеотидов в длину, наиболее предпочтительно, 26 нуклеотидов в длину, но может составлять в длину от 15 до 20 нуклеотидов.
В дальнейшем особенно предпочтительном осуществлении указанного выше аспекта изобретения авторы изобретения предоставляют диагностические праймеры, способные связывать матрицу, включающую нуклеотидную последовательность дикого типа цитохрома b гриба в положении, соответствующем первому и/или третьему основанию в триплете, кодирующем аминокислоту в положении, соответствующем остатку 129 цитохрома b S. cerevisiae, в белке цитохроме b, где 3′-концевой нуклеотид праймера соответствует нуклеотиду, присутствующему в диком типе гена цитохрома b гриба, и где до 10, а также до 8, 6, 4, 2, 1 оставшихся нуклеотидов могут варьировать относительно последовательности дикого типа без значительного влияния на свойства диагностического праймера.
В дальнейшем особенно предпочтительном осуществлении указанного выше аспекта изобретения авторы изобретения предоставляют диагностические праймеры, способные связывать матрицу, включающую нуклеотидную последовательность дикого типа цитохрома b гриба в положении, соответствующем первому или третьему основанию в триплете, кодирующем аминокислоту в положении, соответствующем остатку 129 цитохрома b S. cerevisiae, в белке цитохроме b, где 3′-концевой нуклеотид праймера соответствует нуклеотиду, присутствующему в диком типе гена цитохрома b гриба, и где до 10, а также до 8, 6, 4, 2, 1 оставшихся нуклеотидов могут варьировать относительно последовательности дикого типа без значительного влияния на свойства диагностического праймера.
В дальнейшем особенно предпочтительном осуществлении указанного выше аспекта изобретения авторы изобретения предоставляют диагностические праймеры, включающие приведенные ниже последовательности и их производные, где 3′-концевой нуклеотид праймера идентичен приведенным ниже последовательностям, и где до 10, а также до 8, 6, 4, 2, 1 оставшихся нуклеотидов могут варьировать относительно последовательности дикого типа без значительного влияния на свойства диагностического праймера. Обычно последовательность диагностического праймера может точно совпадать с предоставленной ниже (таблицы 14 и 15). В большинстве перечисленных ниже праймеров предпоследний нуклеотид изменен по сравнению с последовательностью цитохрома b дикого типа с целью дестабилизации гибридной структуры матрица/праймер, чтобы сделать его более селективным в отношении требуемой матрицы. Специалисту в области конструирования праймеров ясно, что основания альтернативные обсуждаемым выше или добавленные к ним также могут быть изменены без неблагоприятного влияния на способность праймера связываться с матрицей.
Таблица 14
Конструирование праймеров ARMS для определения последовательности дикого типа в положении 1 кодона 129 генов цитохрома b фитопатогенов

Таблица 15
Конструирование праймеров ARMS для определения последовательности дикого типа в положении 3 кодона 129 генов цитохрома b фитопатогенов
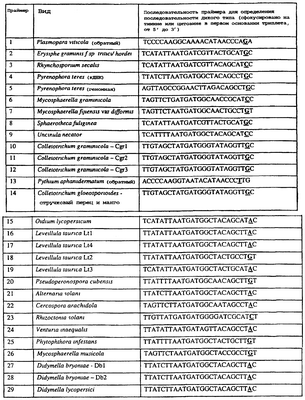
Для адаптации праймеров, показанных в приведенных выше таблицах, для применения в стандартной реакции ASPCR последнее основание с 3′-конца должно соответствовать последовательности дикого типа без введения дестабилизирующего основания.
Примеры, описанные выше, относятся к праймерам ARMS, основанным на прямой цепи ДНК. Применение праймеров ARMS, основанных на прямой цепи ДНК, является особенно предпочтительным. Однако праймеры ARMS, основанные на обратной (антисмысловой) цепи также могут использоваться.
Праймеры ARMS могут также быть основаны на обратной цепи ДНК, если это требуется. Такие праймеры обратной цепи конструируют по тем же принципам, указанным выше именно для праймеров прямой цепи, по которым праймеры могут составлять, по крайней мере, 20 нуклеотидов в длину, наиболее предпочтительно, 26 нуклеотидов в длину, но могут составлять от 15 до 20 нуклеотидов в длину, и конечный нуклеотид на 3′-конце праймера совпадает с относящейся к делу матрицей, т.е. мутантной или дикого типа, и, предпочтительно, предпоследний остаток необязательно изменен, так что он не совпадает с относящейся к делу матрицей. Дополнительно до 10, а также до 8, 6, 4, 2, 1 оставшихся нуклеотидов могут варьировать без значительного влияния на свойства диагностического праймера.
Во многих ситуациях бывает удобным применить диагностический праймер по изобретению с дальнейшим праймером для амплификации, обозначенным здесь как обычный праймер, в одном или нескольких циклах амплификации PCR. Подходящий пример данного аспекта изложен в Европейском патенте номер EP-B1-0332435. Дальнейший праймер для амплификации представляет собой обычный прямой или обратный праймер. Примеры таких обычных праймеров, которые могут использоваться с конкретными фитопатогенами, приведены в таблице 16.
Таблица 16
Примеры обычных прямых и обратных праймеров для применения с праймерами ARMS
 
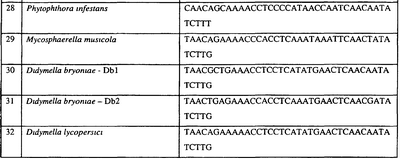
Обычные праймеры в таблице 16 для Rhyncosporium secalis, Mycosphaerella fijiensis var. difformis, Sphaerotheca fulginea (кДНК), Uncinula necator (кДНК), Colletotrichum graminicola Cgr1, Colletotrichum gloeosporioides стручкового перца, Oidium lycipersicum, Leveillula taurica Lt4, Pseudoperonospora cubensis, Alternaria solani, Cercospora arachidola, Rhizoctonia solani, Phytopthora infestans и Mycospharella musicola были описаны ранее в опубликованной заявке на выдачу Международного патента номер WO 00/66773.
В случае более длинных последовательностей, предоставленных в таблицах 3-8 и в опубликованной заявке на выдачу Международного патента номер WO 00/66773 специалист сможет использовать данную информацию для конструирования подходящих праймеров. Специалисту в данной области ясно, что обычный праймер может представлять собой любую подходящую специфичную для патогенного организма последовательность, которая распознает комплементарную цепь гена цитохрома b (или другого интересующего гена) и лежит в 3′-направлении от селективного для мутации праймера.
PCR-ампликон преимущественно составляет от 50 до 400 н.п. в длину, но может составлять от 30 до 2500 н.п. в длину, или потенциально от 30 до 10000 н.п. в длину.
Может использоваться подходящий контрольный праймер, который конструируется выше положения F129L. Специалисту в данной области ясно, что контрольный праймер может представлять собой любой праймер, который не специфичен для амплификации мутантной последовательности или последовательности дикого типа. При использовании данных праймеров вместе с соответствующим обратным («обычным») праймером, описанным выше, амплификация будет происходить независимо от того, присутствует ли точечная мутация F129L, или нет.
Таблица 17
Примеры контрольных праймеров, подходящих для применения по изобретению

 
Подразумевается, что изобретение охватывает все новые олигонуклеотиды (которые могут использоваться в качестве праймеров), которые описаны в приведенных выше таблицах.
Различные способы могут использоваться для определения наличия или отсутствия продуктов продления диагностических праймеров и/или продуктов амплификации. Они будут понятны специалисту в области процедур определения нуклеиновых кислот. В предпочтительных способах избегают применения радиоактивно меченных реагентов. Особенно предпочтительными способами определения являются те, что основаны на флуоресцентном определении наличия и/или отсутствия продуктов продления диагностических праймеров. Конкретные способы определения предусматривают анализ путем гель-электрофореза, определение продуктов «Scorpions» , как описано в заявке PCT номер PCT/GB98/03521, поданной от имени Zeneca Limited 25 ноября 1998 г., сведения из которой включены сюда в качестве ссылки. Дальнейшие предпочтительные способы определения предусматривают линейное продление ARMS (ALEX) и PCR с ALEX, как описано в опубликованной заявке PCT номер WO 99/04037. Подходящим образом применяется определение в реальном времени. Применение определения продуктов «Scorpions» , как описано в заявке PCT номер PCT/GB98/03521, поданной от имени Zeneca Limited 25 ноября 1998 г., сведения из которой включены сюда в качестве ссылки. Дальнейшие предпочтительные способы определения предусматривают линейное продление ARMS (ALEX) и PCR с ALEX, как описано в опубликованной заявке PCT номер WO 99/04037. Подходящим образом применяется определение в реальном времени. Применение определения продуктов «Scorpions» , описанной в заявке PCT номер PCT/GB98/03521 и опубликованной заявке на выдачу патента Великобритании №GB2338301, особенно предпочтительно для применения во всех аспектах описанного здесь изобретения. Описанная здесь комбинация ARMS и технологии Scorpion особенно предпочтительна для применения во всех аспектах описанного здесь изобретения, и предпочтительным способом определения является способ определения, основанный на флуоресценции. Многие из данных способов определения подходят для количественного анализа, с использованием всех указанных выше праймеров. Эти различные PCR могут проводиться в разных пробирках или могут объединяться в одной пробирке. С использованием таких способов могут быть сделаны оценки частоты молекул с точечной мутацией, присутствующих в предсуществующих молекулах дикого типа. , описанной в заявке PCT номер PCT/GB98/03521 и опубликованной заявке на выдачу патента Великобритании №GB2338301, особенно предпочтительно для применения во всех аспектах описанного здесь изобретения. Описанная здесь комбинация ARMS и технологии Scorpion особенно предпочтительна для применения во всех аспектах описанного здесь изобретения, и предпочтительным способом определения является способ определения, основанный на флуоресценции. Многие из данных способов определения подходят для количественного анализа, с использованием всех указанных выше праймеров. Эти различные PCR могут проводиться в разных пробирках или могут объединяться в одной пробирке. С использованием таких способов могут быть сделаны оценки частоты молекул с точечной мутацией, присутствующих в предсуществующих молекулах дикого типа.
Специалисту в данной области очевидно, что технология, основанная на праймерах ARMS, предоставляет возможность селективной затравки копирования примыкающей последовательности после гибридизации аллельселективного гибридизационного зонда, в котором 3′-концевой остаток точно соответствует тому или иному альтернативному SNP. Возможно, что праймер ARMS, способный, например, вызвать высоко селективную амплификацию, в случае, где, например, в первом положении кодона 129 находится остаток C, будет хорошо связываться с геном cyt b альтернативного дикого типа, содержащим остаток T, вследствие того, что в стороне от 3′-концевого и предпоследнего остатков, имеет место идеальное соответствие. Ключевое свойство ARMS в том, что здесь не происходит копирование прилегающей области по причине несоответствия ключевого 3′-концевого остатка.
Специалисту в данной области также понятно, что другие способы определения единичного нуклеотидного полиморфизма (SNP) или простого нуклеотидного полиморфизма могут также применяться для определения мутаций F129L с использованием данных по последовательностям цитохрома b фитопатогенных грибов, включенных в настоящую патентную заявку. Такие способы предусматривают аллельселективные способы гибридизации, такие как: определение продуктов «TaqMan », например, как описано в патентах с номерами US-A-5487972 и US-A5210015; зондов «TaqMan®MGB» и «turbo TaqMan®», описанных, например, в Applied Biosystems User Bulletin: Primer Express Version 1.5 and TaqMan MGB Probes for Allelic Discrimination” (май 2000 г.), доступном посредством Applied Biosystems (850 Lincoln Centre Drive, Foster City, Калифорния 94404, США), и описанные здесь (см. также примеры). Дальнейшие способы определения SNP или простого нуклеотидного полиморфизма, которые могут также быть использованы для определения мутации(-ий) F129L, предусматривают определение продуктов «Molecular Beacons»®, описанную в патенте номер WO 95/13399 и усиленную поверхностью спектроскопию комбинационного рассеяния (SERRS), описанную в заявке на выдачу патента WO 97/05280, причем оба источника включены сюда в качестве ссылки. Другие способы определения SNP и/или простого нуклеотидного полиморфизма, которые могут использоваться для определения аллелей, присутствующих в кодоне 129, предусматривают в качестве неограничивающих примеров «Pyrosequencing », например, как описано в патентах с номерами US-A-5487972 и US-A5210015; зондов «TaqMan®MGB» и «turbo TaqMan®», описанных, например, в Applied Biosystems User Bulletin: Primer Express Version 1.5 and TaqMan MGB Probes for Allelic Discrimination” (май 2000 г.), доступном посредством Applied Biosystems (850 Lincoln Centre Drive, Foster City, Калифорния 94404, США), и описанные здесь (см. также примеры). Дальнейшие способы определения SNP или простого нуклеотидного полиморфизма, которые могут также быть использованы для определения мутации(-ий) F129L, предусматривают определение продуктов «Molecular Beacons»®, описанную в патенте номер WO 95/13399 и усиленную поверхностью спектроскопию комбинационного рассеяния (SERRS), описанную в заявке на выдачу патента WO 97/05280, причем оба источника включены сюда в качестве ссылки. Другие способы определения SNP и/или простого нуклеотидного полиморфизма, которые могут использоваться для определения аллелей, присутствующих в кодоне 129, предусматривают в качестве неограничивающих примеров «Pyrosequencing » (Pyrosequencing AB, Уппсала, Швеция), технологию Locked Nucleic Acid (LNA) (Exiqon A/S, Bygstubben 9,2950 Vedbaek, Дания), специфическую для динамических аллелей гибридизацию (DASH) (Hybaid US, 8 East Forge Parkway, Franklin. Массачусетс 02038, США) и денатурирующую высокоэффективную жидкостную хроматографию (dHPLC) (Giordano M. et al. Genomics 56 (1999) 247253, Oefner P. J. J. Chromatogr., B: Biomed. Sci. Appl. 739 (2000) 345-355), которые также включены сюда в качестве ссылки. » (Pyrosequencing AB, Уппсала, Швеция), технологию Locked Nucleic Acid (LNA) (Exiqon A/S, Bygstubben 9,2950 Vedbaek, Дания), специфическую для динамических аллелей гибридизацию (DASH) (Hybaid US, 8 East Forge Parkway, Franklin. Массачусетс 02038, США) и денатурирующую высокоэффективную жидкостную хроматографию (dHPLC) (Giordano M. et al. Genomics 56 (1999) 247253, Oefner P. J. J. Chromatogr., B: Biomed. Sci. Appl. 739 (2000) 345-355), которые также включены сюда в качестве ссылки.
Пользователю-специалисту также ясно, что некоторые из способов распознавания последовательностей SNP и/или простого нуклеотидного полиморфизма могут быть легко адаптированы для определения аллелей, кодирующих лейцин в кодоне 129, который отличает от фенилаланинового кодона дикого типа 2 заменами (например, TTT  CTA), например, путем конструирования зонда TaqMan MGB, способного распознавать вариант последовательности, включающий обе замены или за счет того, что способ непосредственно определяет последовательность в нескольких близко сцепленных позициях, что имеет место в случае технологии «Pyrosequencing». В других случаях, особенно зависимых от способов аллельспецифической амплификации (например, ARMS, и т.д.) может потребоваться разработка некоторых способов определения, включая возможное действие праймеров на смысловые и антисмысловые последовательности с целью дифференцировки единичных и двойных нуклеотидных полиморфизмов. Также возможно комбинировать различные способы определения SNP (например, ARMS с Pyrosequencing) для достижения наиболее чувствительного и специфичного определения и различения между единичными и двойными нуклеотидными полиморфизмами. Изобретение охватывает комбинацию различных способов определения SNP для применения в подходящих аспектах и осуществлениях описанного здесь изобретения. Например, зонд Taqman® (или Taqman®MGB) может использоваться в комбинации с праймером ARMS и обычным праймером. Где имеет место такая ситуация, предпочтительным является то, что праймер ARMS предоставляет специфичность для определения мутации SNP и что зонд Taqman® (или Taqman®MGB) предоставляет меру определения (например, подлежащий определения флуорофор). CTA), например, путем конструирования зонда TaqMan MGB, способного распознавать вариант последовательности, включающий обе замены или за счет того, что способ непосредственно определяет последовательность в нескольких близко сцепленных позициях, что имеет место в случае технологии «Pyrosequencing». В других случаях, особенно зависимых от способов аллельспецифической амплификации (например, ARMS, и т.д.) может потребоваться разработка некоторых способов определения, включая возможное действие праймеров на смысловые и антисмысловые последовательности с целью дифференцировки единичных и двойных нуклеотидных полиморфизмов. Также возможно комбинировать различные способы определения SNP (например, ARMS с Pyrosequencing) для достижения наиболее чувствительного и специфичного определения и различения между единичными и двойными нуклеотидными полиморфизмами. Изобретение охватывает комбинацию различных способов определения SNP для применения в подходящих аспектах и осуществлениях описанного здесь изобретения. Например, зонд Taqman® (или Taqman®MGB) может использоваться в комбинации с праймером ARMS и обычным праймером. Где имеет место такая ситуация, предпочтительным является то, что праймер ARMS предоставляет специфичность для определения мутации SNP и что зонд Taqman® (или Taqman®MGB) предоставляет меру определения (например, подлежащий определения флуорофор).
Как проиллюстрировано здесь, авторы изобретения использовали праймеры ARMS, основанные на прямой цепи ДНК в комбинации с определением Scorpion, основанном на обратной цепи ДНК в качестве способа определения. Авторы изобретения также показывают здесь праймеры ARMS, основанные на обратной цепи ДНК, в комбинации с определением Scorpion, основанном на прямой нити ДНК в качестве способа определения. Специалисту в данной области хорошо понятно, что альтернативные комбинации праймеров ARMS и элементов определения Scorpion также могут использоваться. Например, праймер, основанный на прямой нити ДНК, может представлять собой комбинацию праймера ARMS с системой определения Scorpion, и он может использоваться с обычным праймером, основанным на обратной цепи ДНК или праймер, основанный на обратной цепи ДНК, может представлять собой комбинацию праймера ARMS с системой определения Scorpion, и он может использоваться с обычным праймером, основанным на прямой цепи ДНК.
В описанных здесь примерах элемент определения Scorpion представляет собой обычный праймер. Праймеры ARMS, специфичные в отношении мутации и последовательности дикого типа, используются в комбинации с обычным, флуоресцентно меченным праймером. Данные две реакции проводятся в различных пробирках для PCR, и флуоресценция испускается, когда зонд связывается с генерированным ампликоном. Элемент Scorpion может альтернативно быть включен в праймеры ARMS. В данном случае два праймера ARMS могут быть мечены различными флуорофорами и использоваться вместе с обычным праймером (в этом случае немеченым). Данные три праймера могут включаться в одну и ту же реакционную смесь, поскольку полученные в результате ампликоны мутанта и дикого типа вызовут испускание различной флуоресценции. Такие анализы обычно обозначаются как мультиплексные анализы.
Как описано в опубликованной заявке на выдачу патента Великобритании №GB2338301, технология Scorpion может использоваться некоторыми различными путями, такими как осуществление интеркаляции, где конец праймера Scorpion несет интеркалирующий краситель, который способен содержаться между основаниями двухцепочечной молекулы нуклеиновой кислоты, после чего она начинает сильно флуоресцировать; осуществление FRET, где красители, вовлеченные в праймер, образуют пару для переноса энергии; осуществление негашения (No-Quencher), где флуорофор привязан к концу праймера Scorpion; бимолекулярное осуществление, где флуорофор и гаситель могут вводиться на две различные, но комплементарные молекулы; осуществление захвата зонда, где ампликоны могут специфично захватываться и зондироваться с использованием того же неамплифицируемого конца и осуществление стебля, где конец праймера включает комплементарные самим себе стебли. Данные осуществления полностью описаны в опубликованной заявке на выдачу патента Великобритании №GB2338301, сведения из которой включены сюда в качестве ссылки.
Зонды TaqMan® или зонды TaqMan®MGB, ссылки на которые указаны выше, могут использоваться в качестве аллельспецифических гибридизационных зондов для определения наличия и/или отсутствия мутации. В данных обстоятельствах такие зонды применяют в комбинации с обычными прямыми и обратными праймерами, которые специфичны в отношении последовательностей ДНК выше и ниже мутации, соответственно. Конкретно, первый зонд TaqMan® (или первый зонд TaqMan MGB), который мечен первым флуоресцентным репортерным красителем (например, VIC ) сконструирован для гибридизации с последовательностью дикого типа. Второй зонд TaqMan® (или TaqMan®MGB), который мечен вторым, отличным от первого флуоресцентным репортерным красителем (например, FAM), сконструирован для гибридизации с мутацией. Оба зонда, первый и второй, также мечены молекулой гасителя. Каждый зонд специфично отжигается к комплементарной ему последовательности между участками прямого и обратного праймера, и когда отжиг зонда произошел, флуоресценция флуоресцентного репортерного красителя гасится в результате близкого соседства молекулы гасителя. Во время PCR ДНК-полимераза Taq, которая обладает экзонуклеазной активностью в направлении 5′-3′, расщепляет репортерный краситель только с зондов которые гибридизуются с специфичными им целевыми последовательностями. Это приводит к физическому отделению репортерного красителя от молекулы гасителя, результатом чего является усиление флуоресценции репортерного красителя. Поскольку зонды мечены различными флуоресцентными репортерными красителями, они могут использоваться в отдельных реакциях для определения последовательности дикого типа или мутантной последовательности, по ситуации, или, альтернативно, они могут использоваться одновременно в одной реакционной пробирке. При использовании в одной реакционной смеси, такие анализы могут обозначаться как мультиплексные анализы. Зонды TaqMan®MGB описаны в Applied Biosystems User Bulletin: Primer Express Version 1.5 and TaqMan MGB Probes for Allelic Discrimination” (май 2000 г.), доступном посредством Applied Biosystems (850 Lincoln Centre Drive, Foster City, Калифорния 94404, США). Анализы, основанные на TaqMan® особенно применимы для обеспечения относительно быстрого ответа «да/нет» на вопрос, присутствует или отсутствует в тестовом образце мутация. ) сконструирован для гибридизации с последовательностью дикого типа. Второй зонд TaqMan® (или TaqMan®MGB), который мечен вторым, отличным от первого флуоресцентным репортерным красителем (например, FAM), сконструирован для гибридизации с мутацией. Оба зонда, первый и второй, также мечены молекулой гасителя. Каждый зонд специфично отжигается к комплементарной ему последовательности между участками прямого и обратного праймера, и когда отжиг зонда произошел, флуоресценция флуоресцентного репортерного красителя гасится в результате близкого соседства молекулы гасителя. Во время PCR ДНК-полимераза Taq, которая обладает экзонуклеазной активностью в направлении 5′-3′, расщепляет репортерный краситель только с зондов которые гибридизуются с специфичными им целевыми последовательностями. Это приводит к физическому отделению репортерного красителя от молекулы гасителя, результатом чего является усиление флуоресценции репортерного красителя. Поскольку зонды мечены различными флуоресцентными репортерными красителями, они могут использоваться в отдельных реакциях для определения последовательности дикого типа или мутантной последовательности, по ситуации, или, альтернативно, они могут использоваться одновременно в одной реакционной пробирке. При использовании в одной реакционной смеси, такие анализы могут обозначаться как мультиплексные анализы. Зонды TaqMan®MGB описаны в Applied Biosystems User Bulletin: Primer Express Version 1.5 and TaqMan MGB Probes for Allelic Discrimination” (май 2000 г.), доступном посредством Applied Biosystems (850 Lincoln Centre Drive, Foster City, Калифорния 94404, США). Анализы, основанные на TaqMan® особенно применимы для обеспечения относительно быстрого ответа «да/нет» на вопрос, присутствует или отсутствует в тестовом образце мутация.
Способы по описанному здесь изобретению надежно определяют одну или несколько мутаций единичного нуклеотидного полиморфизма в гене грибного цитохрома b, приводящих к замене фенилаланина на лейцин в положении, соответствующем остатку 129 цитохрома b S. cerevisiae (F129L) в кодируемом белке, где присутствие указанной(-ых) мутации(-й) вызывает устойчивость грибов к аналогу стробилурина или любому другому соединению той же группы перекрестной устойчивости, на уровне определения в пределах от 1 мутированного аллеля 1000000 аллелей дикого типа до 1 мутированного аллеля на 10000 аллелей дикого типа, и предпочтительно в пределах от 1 мутированного аллеля 100000 аллелей дикого типа до 1 мутированного аллеля на 10000 аллелей дикого типа. Способ по изобретению также может определять мутации, происходящие с большей частотой, например, 1 мутированный аллель на 100 аллелей дикого типа, 1 мутированный аллель на 100 аллелей дикого типа, или в случае, где присутствуют только мутированные аллели. Сходным образом, способы по изобретению могут использоваться для определения частоты аллеля дикого типа на фоне мутированных аллелей.
Комбинация продления аллельспецифического праймера стала более чувствительной с применением технологии ARMS, и способы количественного определения, применяемые по настоящему изобретению, делают ее исключительно чувствительным способом для определения мутаций единичного и/или простого полинуклеотидного полиморфизма грибов, происходящих с низкой частотой.
Определение аллелей, ответственных за развитие устойчивости грибов к аналогу стробилурина или любому другому соединению той же группы перекрестной устойчивости, присутствующих в данных изолятах, связывают результаты фенотипических бианализов с профилем ДНК целевого гена. Открытие единичных точечных мутаций в качестве механизма устойчивости объясняет количественную природу устойчивости, и подтверждение последовательностей изолята, происходящего из одной споры, обеспечивает точность скрининга при определении частот устойчивых и чувствительных изолятов в тестируемых образцах.
Разработка способа, сочетающего продление аллельспецифического праймера, специфичность ARMS и флуоресцентное определение в реальном времени, примером которой здесь служит система Scorpion, позволяет осуществление анализа большого числа образцов на предмет наличия мутации устойчивости, чем могло быть проанализировано по программе биоанализа. Большие количества образцов обеспечивают идентификацию мутации устойчивости, встречающейся с более низкой процентной частотой, по сравнению с той, которая могла бы быть легко определена посредством биоанализа. Это позволяет идентифицировать устойчивость в популяции до того, как она будет выяснена из полевых данных. Высокопроизводительная сущность способа обеспечивает сбор и тестирование образцов из более широкой области и более различных географических участков, чем это возможно при биоанализе. Продление аллельспецифического праймера, такое как ARMS, связанное с флуоресцентным определением в реальном времени, позволяет выявлять наличие гена устойчивости в популяции до того, как действие данного гена может оцениваться фенотипически путем биоанализа на клетках гетероплазмы и/или гетерокариона, снижая, таким образом, ошибку классификации образцов как чувствительных при наличии в них устойчивого генотипа с низкой частотой. Посредством технологии множественного считывания в реальном времени результаты получают гораздо быстрее по сравнению с ожиданием развития заболевания на растениях, что обеспечивает быструю реакцию на полевые ситуации и ускоренное получение рекомендаций по управлению устойчивостью.
Один или несколько диагностических праймеров по изобретению могут быть удобно упакованы с инструкциями по применению по способам изобретения и подходящей упаковкой, и они могут продаваться в виде набора. Наборы подходящим образом включают один или несколько следующих составляющих: диагностические, относящиеся к дикому типу, контрольные и обычные олигонуклеотидные праймеры: подходящие нуклеотидтрифосфаты, например, dATP, dCTP, dGTP, dTTP, подходящая полимераза, как описано выше, и буферный раствор.
Один или несколько аллельселективных гибридизационных зондов по изобретению могут быть удобно упакованы с инструкциями по применению по способам изобретения и подходящей упаковкой, и они могут продаваться в виде набора. Наборы подходящим образом включают один или несколько следующих составляющих: олигонуклеотидные праймеры, которые обеспечивают селективную амплификацию сегмента ДНК, включающего область гена цитохрома b целевого патогенного организма, в состав которого входит кодон 129 из дикого типа и изолятов, устойчивых к аналогу стробилурина или любому другому соединению той же группы перекрестной устойчивости, диагностические относящиеся к дикому типу (F129) и к устойчивому организму (A129) селективные гибридизационные зонды, подходящие нуклеотидтрифосфаты, например, dATP, dCTP, dGTP, dTTP, подходящая полимераза, как описано выше, и буферный раствор.
В дальнейшем осуществлении изобретение относится к способу определения устойчивости фитопатогенных грибов к фунгициду, причем указанный способ предусматривает определение одной или нескольких мутаций в гене цитохрома b гриба, приводящих к замене фенилаланина на лейцин в положении, соответствующем остатку 129 цитохрома b S. cerevisiae, (F129L) в кодируемом белке, где наличие указанной(-ых) мутации(-ий) вызывает устойчивость гриба к аналогу стробилурина или любому другому соединению той же группы перекрестной устойчивости, причем указанный способ предусматривает определение наличия или отсутствия указанной(-ых) мутации(-й) в нуклеиновой кислоте гриба с использованием любого способа определения единичного нуклеотидного полиморфизма.
В дальнейшем осуществлении данного аспекта изобретение относится к способу определения устойчивости фитопатогенных грибов к фунгициду, причем указанный способ предусматривает определение гибридизации аллельспецифического гибридизационного зонда, где определение гибридизации указанного зонда непосредственно связана с наличием или отсутствием мутации(-й) в гене цитохрома b гриба, приводящих к замене фенилаланина на лейцин в положении, соответствующем остатку 129 цитохрома b S. cerevisiae, (F129L) в кодируемом белке, где наличие указанной(-ых) мутации(-ий) вызывает устойчивость гриба к фунгициду, целевой белок которого кодируется митохондриальным геном.
В дальнейшем осуществлении данного аспекта изобретение относится к способу определения устойчивости фитопатогенных грибов к фунгициду, причем указанный способ предусматривает определение наличия ампликона, генерированного в течение реакции PCR, где указанная реакция PCR включает взаимодействие тестируемого образца, включающего нуклеиновую кислоту гриба, с диагностическим праймером в присутствии подходящих нуклеотидтрифосфатов и средства полимеризации, где определение указанного ампликона непосредственно связана с наличием или отсутствием мутации(-й) в гене цитохрома b гриба, приводящих к замене фенилаланина на лейцин в положении, соответствующем остатку 129 цитохрома b S. cerevisiae, (F129L) в кодируемом белке, где наличие указанной(-ых) мутации(-ий) вызывает устойчивость гриба к фунгициду, целевой белок которого кодируется митохондриальным геном.
В предпочтительном осуществлении данного аспекта изобретение относится к способу определения устойчивости фитопатогенных грибов к фунгициду, целевой белок которого кодируется геном цитохрома b, предусматривающему взаимодействие тестируемого образца, включающего нуклеиновую кислоту гриба, с диагностическим праймером для одной или нескольких специфических мутаций в гене цитохрома b гриба, приводящих к замене фенилаланина на лейцин в положении, соответствующем остатку 129 цитохрома b S. cerevisiae, (F129L) в кодируемом белке, где наличие указанной(-ых) мутации(-ий) вызывает устойчивость гриба к указанному фунгициду, в присутствии подходящих нуклеотидтрифосфатов и средства полимеризации, так что диагностический праймер продлевается, когда в образце присутствует(-ют) указанная(-ые) мутация(-и); и определение наличия или отсутствия указанной мутации путем ссылки на наличие или отсутствие продукта продления диагностического праймера.
В дальнейшем предпочтительном осуществлении данного аспекта изобретение относится к способу определения устойчивости фитопатогенных грибов к фунгициду, целевой белок которого кодируется геном цитохрома b, предусматривающему взаимодействие тестируемого образца, включающего нуклеиновую кислоту гриба, с диагностическим праймером для одной или нескольких специфических мутаций в гене цитохрома b гриба, приводящих к замене фенилаланина на лейцин в положении, соответствующем остатку 129 цитохрома b S. cerevisiae, (F129L) в кодируемом белке, где наличие указанной(-ых) мутации(-й) вызывает устойчивость гриба к указанному фунгициду, в присутствии подходящих нуклеотидтрифосфатов и средства полимеризации, так что диагностический праймер продлевается, только когда в образце присутствует указанная мутация; и определение наличия или отсутствия указанной мутации путем ссылки на наличие или отсутствие продукта продления диагностического праймера.
Способы по изобретению, описанному в указанных выше аспектах и осуществлениях, особенно подходят для применения со штаммами фитопатогенных грибов, где наличие одной или нескольких мутаций в гене цитохрома b вызывает устойчивость к фунгициду, и наиболее конкретно, к устойчивости к аналогу стробилурина или соединению той же группы перекрестной устойчивости, где мутация в ДНК гриба вызывает замену остатка фенилаланина в положении, соответствующем остатку 129 цитохрома b S. cerevisiae, более конкретно, к замене F129L в кодируемом белке, и, особенно, где мутация представляет собой замену основания T на C в первом положении кодона, соответствующего остатку 129 цитохрома b S. cerevisiae, или мутация представляет собой замену основания T или С на A или G в третьем положении кодона, соответствующего остатку 129 цитохрома b S. cerevisiae.
В дальнейшем аспекте изобретение относится к способу определения и количественного анализа частоты одной или нескольких мутаций в гене цитохрома b гриба, приводящих к замене фенилаланина на лейцин в положении, соответствующем остатку 129 цитохрома b S. cerevisiae, (F129L) в кодируемом белке, где наличие указанной(-ых) мутации(-й) вызывает устойчивость гриба к аналогу стробилурина, причем указанный способ предусматривает определение наличия или отсутствия указанной(-ых) мутаций в гене гриба, где наличие указанной(-ых) мутации(-й) вызывает устойчивость гриба к указанному фунгициду, причем указанный способ предусматривает определение и количественную оценку наличия или отсутствия указанной(-ых) мутации(-й) в нуклеиновой кислоте гриба с использованием любого способа определения единичного нуклеотидного полиморфизма.
В дальнейшем предпочтительном осуществлении данного аспекта изобретение относится к способу определения и количественного анализа частоты одной или нескольких мутаций в гене цитохрома b гриба, приводящих к замене фенилаланина на лейцин в положении, соответствующем остатку 129 цитохрома b S. cerevisiae, (F129L) в кодируемом белке, где наличие указанной(-ых) мутации(-й) вызывает устойчивость гриба к фунгициду, целевой белок которого кодируется митохондриальным геном, причем указанный способ предусматривает определение наличия или отсутствия указанной(-ых) мутации(-й) в гене гриба, где наличие указанной(-ых) мутации(-й) вызывает устойчивость гриба к аналогу стробилурина или любому другому соединению той же группы перекрестной устойчивости, причем указанный способ предусматривает определение и количественный анализ наличия или отсутствия указанной(-ых) мутации(-й) в нуклеиновой кислоте гриба с использованием любого способа определения единичного нуклеотидного полиморфизма.
В дальнейшем осуществлении данного аспекта изобретение относится к способу определения и количественного анализа частоты одной или нескольких мутаций в гене цитохрома b гриба, приводящих к замене фенилаланина на лейцин в положении, соответствующем остатку 129 цитохрома b S. cerevisiae, (F129L) в кодируемом белке, где наличие указанной(-ых) мутации(-й) вызывает устойчивость гриба к фунгициду, целевой белок которого кодируется митохондриальным геном, причем указанный способ предусматривает определение гибридизации аллельспецифического зонда путем взаимодействия тестируемого образца, включающего нуклеиновую кислоту гриба с подходящими относящимися к дикому типу (F129) и к устойчивости (A129) селективными гибридизационным зондами, где определение гибридизации указанных аллельспецифических гибридизационных зондов непосредственно связана как с наличием, так и с отсутствием указанной мутации в указанной нуклеиновой кислоте, где наличие указанной(-ых) мутации(-й) вызывает устойчивость гриба к фунгициду, целевой белок которого кодируется митохондриальным геном, и определения и количественного анализа относительного наличия или отсутствия указанной(-ых) мутации(-й) путем ссылки на наличие или отсутствие ампликона, генерированного в течение реакции PCR.
В дальнейшем осуществлении данного аспекта изобретение относится к способу определения и количественного анализа частоты одной или нескольких мутаций в гене цитохрома b гриба, приводящих к замене фенилаланина на лейцин в положении, соответствующем остатку 129 цитохрома b S. cerevisiae, (F129L) в кодируемом белке, где наличие указанной(-ых) мутации(-й) вызывает устойчивость гриба к фунгициду, целевой белок которого кодируется митохондриальным геном, причем указанный способ предусматривает определение наличия ампликона, генерированного в течение реакции PCR, где указанная реакция PCR включает взаимодействие тестируемого образца, включающего нуклеиновую кислоту гриба, с подходящими праймерами в присутствии подходящих нуклеотидтрифосфатов и средства для полимеризации, где определение указанного ампликона непосредственно связана как с наличием, так и с отсутствием указанной мутации в указанной нуклеиновой кислоте, где наличие указанной(-ых) мутации(-й) вызывает устойчивость гриба к фунгициду, целевой белок которого кодируется митохондриальным геном, и определения и количественного анализа относительного наличия или отсутствия указанной(-ых) мутации(-й) путем ссылки на наличие или отсутствие ампликона, генерированного в течение реакции PCR.
В дальнейшем осуществлении данного аспекта изобретение относится к способу определения и количественного анализа частоты одной или нескольких мутаций в гене цитохрома b гриба, приводящих к замене фенилаланина на лейцин в положении, соответствующем остатку 129 цитохрома b S. cerevisiae, (F129L) в кодируемом белке, где наличие указанной(-ых) мутации(-й) вызывает устойчивость гриба к фунгициду, целевой белок которого кодируется митохондриальным геном, предусматривающему взаимодействие тестируемого образца с диагностическими праймерами с целью определения как наличия, так и отсутствия в указанной нуклеиновой кислоте специфической мутации, наличие которой вызывает устойчивость к указанному фунгициду, в присутствии подходящих нуклеотидтрифосфатов и средства для полимеризации, так что диагностические праймеры, относящиеся к наличию или отсутствию специфической(-их) мутации(-й), продлеваются, только когда в образце присутствует подходящая матрица гриба; и определения и количественного анализа относительного наличия или отсутствия указанной(-ых) мутации(-й) путем ссылки на наличие или отсутствие продуктов продления диагностического праймера.
Способы по изобретению, описанному в указанных выше аспектах и осуществлениях, особенно подходят для применения со штаммами фитопатогенных грибов, где наличие мутации в гене цитохрома b вызывает устойчивость к фунгициду, и, наиболее конкретно, к устойчивости к аналогу стробилурина или соединению той же группы перекрестной устойчивости, и, наиболее конкретно, где мутация в ДНК гриба вызывает замену остатка фенилаланина в положении, соответствующем остатку 129 цитохрома b S. cerevisiae, вследствие мутации, представляющей собой замену основания T на C в первом положении кодона, соответствующего остатку 129 цитохрома b S. cerevisiae, и/или мутации, представляющей собой замену основания T или С на A или G в третьем положении кодона, соответствующего остатку 129 цитохрома b S. cerevisiae, предпочтительно, в результате мутации в виде нуклеотидной замены Т на С в первом положении кодона в положении, соответствующем остатку 129 цитохрома b S. cerevisiae или, предпочтительно, мутации в виде нуклеотидной замены Т или С на А или G в третьем положении кодона в положении, соответствующем остатку 129 цитохрома b S. cerevisiae, наиболее предпочтительно, замену основания C на A в третьем положении кодона, соответствующего остатку 129 цитохрома b S. cerevisiae.
В еще одном аспекте изобретение относится к способу селекции активного фунгицида и оптимальных концентраций для его применения на сельскохозяйственной культуре, предусматривающему анализ образца гриба, способного инфицировать указанную сельскохозяйственную культуру, и определение и/или количественный анализ наличия и/или отсутствия одной или нескольких мутаций в гене цитохрома b из указанного гриба, приводящих к замене остатка фенилаланина в положении, соответствующем остатку 129 цитохрома b S. cerevisiae, (F129L) в кодируемом белке, где наличие указанной(-ых) мутации(-й) вызывает устойчивость гриба к фунгициду, целевой белок которого кодируется митохондриальным геном, и затем селекцию указанного фунгицида и оптимальных концентраций для его применения. Это может достигаться, например, путем начального тестирования частоты встречаемости мутации F129L в интересующем фитопатогенном грибе, с использованием способов по изобретению. После начальной оценки встречающейся в природе частоты появления мутации F129L могут тестироваться различные стратегии контроля. Например, фунгицид (предпочтительно, стробилуриновый фунгицид) может использоваться в отношении следующего тестируемого образца гриба в интервале различных норм и/или различного числа и/или различной частоты применений (предпочтительно, с заботой о поддержании постоянного давления селекции при заболевании), и для каждой стратегии может оцениваться частота встречаемости мутации F129L может оцениваться с использованием способа изобретения. Затем может быть построена корреляция между применяемой стратегией контроля гриба и частотой встречаемости устойчивости, опосредованной мутацией F129L. Специалист легко может из этой корреляции оценить, какова наилучшая стратегия контроля гриба для поддержания контроля гриба и низких уровней устойчивости к задействованному фунгицидному средству.
В особенно предпочтительном осуществлении данного аспекта изобретения способ определения предусматривает любой способ определения единичного нуклеотидного полиморфизма и, более предпочтительно, предусматривает взаимодействие тестируемого образца, включающего нуклеиновую кислоту гриба, с диагностическим праймером для специфической(-их) мутации(-й) в присутствии подходящих нуклеотидтрифосфатов и средства для полимеризации, так что диагностический праймер продлевается, когда указанная(-ые) мутация(-и) присутствует(-ют) в образце; и определение наличия или отсутствия указанной мутации(-ий) путем ссылки на наличие или отсутствие продукта продления диагностического праймера, и количественный анализ достигается путем взаимодействия тестируемого образца, включающего нуклеиновую кислоту гриба, с диагностическими праймерами с целью определения как наличия, так и отсутствия специфической(-их) мутации(-й) в указанной нуклеиновой кислоте, присутствие которой вызывает устойчивость к фунгициду, целевой белок которого кодируется митохондриальным геном, в присутствии подходящих нуклеотидтрифосфатов и средства для полимеризации, так что диагностические праймеры, относящиеся к наличию или отсутствию специфической(-их) мутации(-й) продлеваются, когда в образце присутствует подходящая матрица гриба; и определение и количественный анализ относительного наличия или отсутствия указанной(-ых) мутации(-й) путем ссылки на наличие или отсутствие продуктов продления диагностического праймера.
В дальнейшем особенно предпочтительном осуществлении данного аспекта изобретения способ определения предусматривает взаимодействие тестируемого образца, включающего нуклеиновую кислоту гриба с диагностическим праймером для специфической(-их) мутации(-й) в присутствии подходящих нуклеотидтрифосфатов и средства для полимеризации, так что диагностический праймер продлевается, только когда указанная(-ые) мутация(-и) присутствует(-ют) в образце; и определение наличия или отсутствия указанной мутации(-ий) путем ссылки на наличие или отсутствие продукта продления диагностического праймера, и количественный анализ достигается путем взаимодействия тестируемого образца, включающего нуклеиновую кислоту гриба с диагностическими праймерами с целью определения как наличия, так и отсутствия специфической(-их) мутации(-й) в указанной нуклеиновой кислоте, присутствие которой вызывает устойчивость к фунгициду, целевой белок которого кодируется митохондриальным геном, в присутствии подходящих нуклеотидтрифосфатов и средства для полимеризации, так что диагностические праймеры, относящиеся к наличию или отсутствию специфической(-их) мутации(-й) продлеваются, только когда в образце присутствует подходящая матрица гриба; и определение и количественный анализ относительного наличия или отсутствия указанной(-ых) мутации(-й) путем ссылки на наличие или отсутствие продуктов продления диагностического праймера.
В особенно предпочтительном осуществлении данного аспекта изобретения способ определения предусматривает любой способ определения единичного нуклеотидного полиморфизма и, более предпочтительно, предусматривает взаимодействие тестируемого образца, включающего нуклеиновую кислоту гриба с аллельспецифическим гибридизационным зондом для специфической(-их) мутаций(-й), так что данный гибридизационный зонд гибридизуется, когда в образце присутствует указанная(-ые) мутация(-и); и определение наличия или отсутствия указанной(-ых) мутаций(-и) путем определения и количественного анализа количества гена цитохрома b дикого типа (F129), причем количественный анализ тестируемого образца достигается путем взаимодействия тестируемого образца, включающего нуклеиновую кислоту гриба с аллельспецифическими гибридизационными зондами с целью определения наличия и отсутствия специфической(-их) мутаций(-й) в указанной нуклеиновой кислоте, наличие которых вызывает устойчивость к фунгициду, целевой белок которого кодируется митохондриальным геном, в присутствии подходящих нуклеотидтрифосфатов и средства для полимеризации, так что гибридизационные зонды, имеющие отношение к отсутствию и наличию специфической(-их) мутаций(-й), гибридизуются при наличии в образце подходящей матрицы гриба; и определение и количественный анализ относительного наличия или отсутствия указанной(-ых) мутации(-й) путем ссылки на наличие или отсутствие продуктов гибридизации.
Способы по описанному здесь изобретению особенно подходят для применения со штаммами фитопатогенных грибов, где наличие мутации в гене цитохрома b вызывает устойчивость к фунгициду, и, наиболее конкретно, к устойчивости к аналогу стробилурина или соединению той же группы перекрестной устойчивости, и где мутация в ДНК гриба вызывает замену остатка фенилаланина в положении, соответствующем остатку 129 цитохрома b S. cerevisiae, более конкретно, замену F129L, и особенно, где мутация представляет собой замену основания T на C в первом положении кодона, соответствующего остатку 129 цитохрома b S. cerevisiae, или мутация представляет собой замену основания T или С на A или G, предпочтительно, замену основания C на A в третьем положении кодона, соответствующего остатку 129 цитохрома b S. cerevisiae.
Еще в одном дальнейшем аспекте изобретение относится к способу контроля инфекции грибов сельскохозяйственной культуры, предусматривающему применение фунгицида в отношении сельскохозяйственной культуры, где указанный фунгицид выбран по любому из способов селекции по описанному здесь изобретению.
Способ по описанному выше изобретению особенно подходит для применения на штаммах фитопатогенных грибов, где наличие одной или нескольких мутаций в гене цитохрома b гриба приводит к замене F129L в кодируемом белке, где наличие указанной(-ых) мутации(-й) вызывает устойчивость к фунгициду, и наиболее конкретно, к устойчивости к аналогу стробилурина или соединению той же группы перекрестной устойчивости.
Еще в одном аспекте изобретение относится к анализу по выявлению соединений с фунгицидной активностью, включающему скрининг соединений против штаммов грибов, которые тестируют на наличие или отсутствие одной или нескольких мутаций в гене цитохрома b гриба, приводящих к замене F129L в кодируемом белке, вызывающей устойчивость к фунгициду, целевой белок которого кодируется митохондриальным геном, по способам описанного здесь изобретения, и последующее определение фунгицидной активности в отношении указанных штаммов грибов.
Способы по описанному здесь изобретению особенно подходят для применения со штаммами фитопатогенных грибов, где наличие одной или нескольких мутаций в гене цитохрома b вызывает устойчивость к фунгициду, и, наиболее конкретно, к устойчивости к аналогу стробилурина или соединению той же группы перекрестной устойчивости, где мутация в ДНК гриба вызывает замену остатка фенилаланина в положении, соответствующем остатку 129 цитохрома b S. cerevisiae, более конкретно, замену F129L в кодируемом белке, и особенно, где мутация представляет собой замену основания T на C в первом положении кодона, соответствующего остатку 143 цитохрома b S. cerevisiae, или где мутация представляет собой замену основания T или С на A или G в третьем положении кодона, соответствующего остатку 129 цитохрома b S. cerevisiae, предпочтительно, замену основания C на A в третьем положении кодона, соответствующего остатку 129 цитохрома b S. cerevisiae.
Путем применения способов по описанному здесь изобретению может определяться подходящая норма применения фунгицидов и/или подходящей комбинации фунгицидов, подлежащих употреблению в отношении сельскохозяйственной культуры.
Способы по описанному здесь изобретению особенно подходят для мониторинга устойчивости гриба к аналогу стробилурина или соединения той же группы перекрестной устойчивости в сельскохозяйственных культурах, таких как хлебные злаки, фрукты и овощи, такие как канола, подсолнечник, табак, сахарная свекла, хлопок, соя, кукуруза, пшеница, ячмень, рис, сорго, томаты, манго, персик, яблоня, груша, земляника, банан, дыня, картофель, морковь, латук, капуста, лук, виноград и газон.
Способы по описанному здесь изобретению являются особенно чувствительными при определении низких частот возникновения одной или нескольких мутаций в цитохроме b гриба, приводящих к замене F129L в кодируемом белке, где наличие указанной(-ых) мутации(-й) вызывает устойчивость гриба к аналогу стробилурина, что делает их особенно подходящим и коммерчески значимым путем скрининга фитопатогенных грибов при возникновении устойчивости к фунгицидам, где устойчивость является следствием идентифицированной выше мутации.
Ключевое различие между ARMS, и другими количественными PCR-системами, основанными на аллельселективной амплификации, и такими технологиями, как Taqman и Molecular Beacons в том, что последние способы зависят от способности избирательных в отношении аллелей гибридизационных зондов обеспечивать флуоресцентный сигнал, пропорционально относящийся к количеству продукта PCR, имеющегося в наличии в данный момент времени. Это значит, что единственная, неселективная и обычная пара праймеров может использоваться для амплификации как родительского/дикого типа, так и вариантного/мутантного аллелей целевого гена. Количество продукта PCR, полученного от каждого аллеля, и, в каждом цикле PCR, количество, непосредственно относящееся к количеству, присутствующему в начальном образце, затем считывается, исходя из флуоресцентного сигнала, полученного с избирательного в отношении аллелей гибридизационного зонда. Данный сигнал подается в случае анализов Taqman путем опосредованного 5′-экзонуклеазой, ассоциированной с ДНК-полимеразой, высвобождения флуорофора из гибридизованного аллельселективного зонда и в случае Molecular Beacons путем разделения 5′- и 3′-связанного флуорофора и гасителя некоторого рода при гибридизации Beacon с целевым аллелем.
В случае технологий аллельселективной амплификации, таких как ARMS, дифференциальные реакции PCR, основанные на специфичности праймеров, определяют количество специфического продукта PCR, присутствующего в любое время в реакционной смеси, и это, в свою очередь, непосредственно связано с количеством аллеля, присутствующим в начальном образце.
Количественное измерение количества присутствующего продукта PCR затем достигается либо путем неспецифических технологий, таких как интеркалирующие специфичные в отношении двухцепочечной ДНК метки типа SYBR® Green I (Molecular Probes Inc., 4849 Pitchford Ave., Eugene, Орегон, США), либо путем специфичных в отношении целевого гена, но неселективных в отношении аллелей зондов, таких как Scorpions.
Как понятно специалисту, данные различия и ассоциированные с ними качества предоставляют характерные преимущества и потенциальные недостатки, включая:
– необходимость конструирования и испытания только одной пары избирательных в отношении SNP зондов Taqman или Molecular Beacon, при наличии доступных селективных в отношении целевого гена праймеров для PCR;
– необходимость конструирования и испытания обоих пар аллельселективных праймеров (ARMS) и специфичных в отношении целевого гена гибридизационных зондов (Scorpions) для каждого из анализов, основанных на избирательных в отношении аллелей ARMS/Scorpion;
– большая интенсивность сигнала и скорость реакции при использовании зондов Scorpion по причине внутримолекулярного характера их гибридизации с продуктом целевого гена (Whitcombe D., Theaker J., Guy S. P., Brown T. & Little S. (1999) Nature Biotechnology 17 (1999), 804-807 Thelwell N., Millington S., Solinas A., Booth J., & Brown T. (2000) Nucleic Acids Research 28 (2000) 3752-3761);
– осложнения, которые могут происходить с неселективными в отношении последовательности технологиями определения двухцепочечной ДНК при событии любой неспецифической амплификации, вероятно, возникающие в результате контаминации ДНК в полевых образцах и образования димеров праймеров.
При многих условиях каждый из данных способов является, однако, вполне подходящим, например, для определения и измерения относительных количеств аллелей F129 и/или L129 генов цитохрома b, как описано в данной заявке. Это особенно верно, когда оцениваются генотипы относительно однородных изолятов конкретных фитопатогенов, например, индивидуальные образцы с патологией, заподозренные в неэффективности фунгицида стробилурин/QoI.
Однако эксперту ясно, что имеются важные обстоятельства, в которых технологии, основанные на аллельселективной амплификации, и, в частности, высоко эффективные и селективные возможности, предоставляемые технологиями, основанными на ARMS/Scorpions, имеют реальные преимущества. Частный случай непосредственной значимости данной заявки состоит в анализе препаратов нуклеиновой кислоты, происходящих из популяций, включающих смеси альтернативных SNP, таких как описанные здесь аллели F129 и L129. Более конкретно, это случай, в котором относительные частоты альтернативных SNP изменяются в широком интервале.
Понятно, что полевые образцы фитопатогенов обычно включают такие популяции и, что анализ репрезентативных популяций из конкретной географической области, плантации, виноградника, фермы, поля, фруктового сада или делянки, конечно, часто представляет собой наиболее значимый индикатор полезности агрохимического средства, на которую влияет наличие SNP, таких как те, что кодируются аллелями F129 и L129 в генах цитохрома b, в целевом паразитическом организме.
Также специалисту в данной области понятно, что гены, кодируемые в митохондриях, такие как гены цитохрома b, также составляют контекст, в котором особенно важной является возможность применения технологии для анализа популяций. В то время как организмы, такие как фитопатогены, которые почти неизменно гаплоидны или диплоидны в их фазу вегетативного роста, будут обладать 0, 1, 1 + 1 или 0 + 2 копиями альтернативных кодируемых в ядре аллелей интересующего гена, ситуация с кодируемыми в митохондриях генами может быть намного более сложной. Отдельные фитопатогены могут иметь десятки, иногда сотни митохондрий на ядро, и индивидуальные митохондрии также могут сами по себе обладать множественными митохондриальными геномами. В действительности, именно поэтому митохондриальные гены являются членами популяции, которая более обширная, более сложная и разнообразная, даже при взятии из образцов, которые номинально представляют индивидуальные, микробиологически очищенные изоляты, по сравнению с ядерными генами из того же образца.
Большая применимость технологий количественной PCR, основанных на аллельселективной амплификации, для анализа популяций, особенно тех, где значимые аллели присутствуют на относительно низком уровне, является результатом внутреннего свойства процесса PCR: он представляет собой технологию, основанную на экспоненциальной амплификации (см., например, Saiki et al. Science 230 (1985) 1350, PCR (Newton & Graham) pp 3-5 (1994) BIOS Scientific Publishers ISBN 1 872748 82 1 и The Encyclopedia of Molecular Biology (ed. Kendrew & Lawrence) pp 864-866 (1994) Blackwell Science Ltd. ISBN 0 632 02182 9).
Во-первых, это значит, что если две аллельные формы гена, способные амплифицироваться с обычной парой праймеров, присутствуют в образце в значительно отличающихся концентрациях (например, в 100 раз, 1000 раз или 10000 раз), то их относительное обилие на всем протяжении PCR будет сохраняться. Относительная интенсивность сигнала гибридизации, достигаемого путем отжига аллельспецифических зондов, таких как Taqman или Molecular Beacons всегда будет отражать эту разницу. Флуоресцентные сигналы в 100 раз, 1000 раз или 10000 раз более низкой интенсивности исключительно трудно определять среди фоновых уровней. Во-вторых, реакции PCR, тем не менее, обычно лимитированы полной утилизацией нуклеотидов, требуемых для синтеза продукта PCR. Экспоненциальная амплификация очень обильных видов молекул может поэтому сильно истощить или даже полностью израсходовать источник нуклеотидов до начала значимой амплификации малообильных видов. Кроме того, гибридизация представляет собой кинетический процесс и в бимолекулярных реакциях, таких как Taqman и Molecular Beacons, характеризуется скоростью, которая является функцией концентрации взаимодействующих видов молекул. Поэтому более высокая концентрация более обильного продукта PCR будет приводить к отжигу к связанному с ним зонду, происходящему с более высокой скоростью. Как следствие данных факторов, авторы изобретения обнаружили, что эффективный интервал анализов Molecular Beacons и Taqman покрывает только примерно 10-50-кратную, и, более конкретно, менее, чем 10-кратную разницу в смешанных популяциях.
Технологии аллельселективной амплификации, наоборот, не подвергаются влиянию такого конкурентного эффекта, возникающего из-за меняющихся концентраций аллелей/SNP. Цикл PCR, при котором становится видным сигнал, отражающий наличие данного аллеля/SNP в образце, представляет собой простую функцию начальной концентрации данного аллеля. Поскольку здесь не имеется в наличии конкурирующего продукта амплификации, здесь нет конкуренции для субстрата, и флуоресцентный сигнал всегда будет достигать максимума.
Как следствие, при анализе популяций ДНК, включающих смеси различных аллелей/SNP в параллельных реакциях с подходящими реагентами для аллельселективной амплификации может быть получена точная оценка относительных концентраций аллелей/SNP в начальном образце в пределах очень большого интервала. Обычно авторы изобретения обнаруживают, что при анализах, основанных на ARMS/Scorpions, легко достигаются интервалы, равные 0,01-99,99% (104), часто могут быть получены интервалы, равные 0,001-99,999% (105), и иногда могут достигаться интервалы, равные 0,0001-99,9999% (106).
Изобретение далее иллюстрируется со ссылкой на примеры и фигуры, в которых фигура 1: таблица, в которой описаны происхождение и чувствительность к азоксистробину изолятов Pythium aphanidermatum.
Фигура 2: таблица, в которой описано развитие заболевания на газоне, обработанном азоксистробином.
Фигура 3: краткое изложение молекулярной характеристики области cyt b P. aphanidermatum, соответствующего аминокислотам от 73 до 283.
Фигура 4: выравнивание пар оснований в двух консенсусных последовательностях K3758 с частью последовательности гена cyt b P. aphanidermatum дикого типа.
Фигура 5: выравнивание аминокислот в двух консенсусных последовательностях K3758 с частью последовательности гена cyt b P. aphanidermatum дикого типа.
Фигура 6: стебельчатопетлевая вторичная структура антисмыслового праймера Scorpion для применения в анализах F129L P. aphanidermatum в комбинации со смысловыми аллельселективными праймерами ARMS.
Фигура 7: график, на котором показаны амплификация плазмиды дикого типа (лунки A3 и A4) и амплификация мутантной плазмиды (лунки A1 и A2) с праймером Pt129-1.
Фигура 8: график, на котором показаны амплификация мутантной плазмиды (лунки A1 и A2) и амплификация плазмиды дикого типа (лунки A3 и A4) с праймером Pt129-4.
Фигура 9: стебельчатопетлевая вторичная структура смыслового праймера Scorpion для применения в анализах F129L P. aphanidermatum в комбинации с антисмысловыми аллельселективными праймерами ARMS.
Фигура 10: график значения Ct на подходящей матрице для праймеров ARMS Pt129-A14 и Pt129-C4.
Фигура 11: график  Ct между праймерами ARMS Pt129-A14 и Pt129-A14 в зависимости от концентрации матрицы. Ct между праймерами ARMS Pt129-A14 и Pt129-A14 в зависимости от концентрации матрицы.
Фигура 12: график, на котором показана амплификация аллеля L129 с праймером ARMS Pt129-A14 при добавлении 10-кратного разведения устойчивого аллеля (L129) в постоянный фон аллеля дикого типа (F129).
Фигура 13: график log10 концентрации ДНК в зависимости от  Ct для анализа F129L P. aphanidermatum. Ct для анализа F129L P. aphanidermatum.
Фигура 14: график последовательности операций, на котором показано получение образцов P. viticola I112 и I116b для анализа доза-ответ в растениях.
На фигуре 15 показано выравнивание ДНК для изолятов I112 и I116b.
На фигуре 16 показано аминокислотное выравнивание для изолятов I112 и I116b.
На фигуре 17 показан смысловой праймер Scorpion для P. viticola.
Фигура 18: график log10 концентрации ДНК в зависимости от  Ct для анализа F129L P. viticola. Ct для анализа F129L P. viticola.
На фигуре 19 показан антисмысловой праймер Scorpion для P. viticola.
На фигуре 20 показано нуклеотидное выравнивание для двух изолятов A. solani
На фигуре 21 показано аминокислотное выравнивание для двух изолятов A. solani
Подробное описание изобретения
Примеры
В приведенных ниже примерах 3, 4, 5, 6, 7, 8, 9, 12, 13, 14, 15, 16 и 17 в качестве системы определения продукта использовали систему Scorpion (AstraZeneca Diagnostics). Данная система определения описана полностью в заявке PCT номер PCT/GB98/03521, поданной от имени Zeneca Limited 25 ноября 1998 г., сведения из которой включены сюда в качестве ссылки. В данной новой системе определения использован хвостатый праймер и интегрированная сигнальная система. Данный праймер содержит область связывания матрицы и хвост, включающий линкер и область связывания мишени. При использовании хвостовая область связывания мишени гибридизуется с комплементарной последовательностью в продукте продления праймера. Данное событие специфической в отношении мишени гибридизации связано с сигнальной системой, где гибридизация приводит к определяемому изменению. Способ определения данной системы предоставляет некоторое количество значимых преимуществ над другими системами. Требуется только один вид пары праймер/детектор. Это обеспечивает большую простоту и усиленную специфичность, что основывается на легкой доступности связывающего мишень области для гибридизации с продуктом продления праймера. Вновь синтезированный продукт продления праймера представляет собой мишень, так что выходной сигнал, который может получиться, непосредственно связан с количеством продленного праймера. Он не зависит от дополнительных событий гибридизации или ферментных стадий. Внутри- и межцепочечная конкуренция за участок связывания зонда ограничена так, что конструирование зонда становится упрощенным. Поскольку взаимодействие является унимолекулярным, реакция передачи сигнала является очень быстрой, что способствует повышению циклической скорости, что является значимым свойством экспериментальной эффективности. Праймеры Scorpion, сконструированные в описанных ниже примерах, обычно имеют следующие модификации: (AstraZeneca Diagnostics). Данная система определения описана полностью в заявке PCT номер PCT/GB98/03521, поданной от имени Zeneca Limited 25 ноября 1998 г., сведения из которой включены сюда в качестве ссылки. В данной новой системе определения использован хвостатый праймер и интегрированная сигнальная система. Данный праймер содержит область связывания матрицы и хвост, включающий линкер и область связывания мишени. При использовании хвостовая область связывания мишени гибридизуется с комплементарной последовательностью в продукте продления праймера. Данное событие специфической в отношении мишени гибридизации связано с сигнальной системой, где гибридизация приводит к определяемому изменению. Способ определения данной системы предоставляет некоторое количество значимых преимуществ над другими системами. Требуется только один вид пары праймер/детектор. Это обеспечивает большую простоту и усиленную специфичность, что основывается на легкой доступности связывающего мишень области для гибридизации с продуктом продления праймера. Вновь синтезированный продукт продления праймера представляет собой мишень, так что выходной сигнал, который может получиться, непосредственно связан с количеством продленного праймера. Он не зависит от дополнительных событий гибридизации или ферментных стадий. Внутри- и межцепочечная конкуренция за участок связывания зонда ограничена так, что конструирование зонда становится упрощенным. Поскольку взаимодействие является унимолекулярным, реакция передачи сигнала является очень быстрой, что способствует повышению циклической скорости, что является значимым свойством экспериментальной эффективности. Праймеры Scorpion, сконструированные в описанных ниже примерах, обычно имеют следующие модификации:
– мономер гексетиленгликоля (HEG) в качестве блокирующей группы, которая расположена между связывающей матрицу областью праймера и хвостовой областью, причем данная группа препятствует опосредованное полимеразой копирование цепи в хвостовой области матрицы праймера;
– флуоресцентная молекула FAM добавлена к 5′-концу праймера. FAM представляет собой одну из флуоресцентных молекул, которая, например, может легко определяться лазером 488 нм прибора ABI PRISM 7700 (PE Biosystems);
– MR (метиловый красный) представляет собой нефлуоресцирующий гаситель, привязанный к остатку урацила.
Другие флуоресцентные молекулы и механизмы гашения также могут быть адаптированы к конструированию праймера Scorpion и могут подходить для применения по данному изобретению.
В примере 18 проиллюстрирован анализ, зависящий от системы анализа TaqMan.
Пример 1
Идентификация изолята P. aphanidermatum, характеризующегося высоким уровнем устойчивости к фунгицидам-ингибиторам участка Qo
Серия из 22 изолятов P. aphanidermatum была предоставлена Zeneca Agricultural Products (в настоящее время Syngenta Crop Protection) G. Peng, M. L. Gleason и F. W. Nutter из Iowa State University в 1999 г. для обеспечения профилирования чувствительности к азоксистробину, причем чувствительность изолятов к фунгициду мефеноксаму и скорость роста изолятов на агаровых чашках ранее была определена Guangbin Peng в Iowa State University (Peng, G. et al. Phytopathology 89 (1999) S59). Полученная ранее информация по данным изолятам и краткое изложение свойств их устойчивости к азоксистробину показаны на фигуре 1.
Для осуществления оценки устойчивости к азоксистробину (стробилурину) указанных выше изолятов райграс многолетний (Lolium perenne L.) выращивали в пластиковых горшках площадью 4×4 дюйма, содержащих песчаную почву. Для удержания семян и обеспечения высокого уровня влажности вокруг семян для их прорастания использовали адсорбентную почву Agsorb (сверхтонкую красную). Горшки увлажняли с использованием туманообразующей насадки и покрывали бумагой для снижения испарения. Туманообразующую насадку применяли 3-5 раз в сутки для полива горшков с газоном. После появления всходов, бумажное покрытие удаляли с горшков, чтобы препятствовать этиолированию, и снижали количество поливов до двух раз в сутки с использованием вентиляторной насадки. Горшки выдерживали в течение 12-16 суток в теплице (17-32°C; световой период 14 ч) перед обработкой. В течение этого времени газон дважды подстригали ручными электрическими ножницами Black and Decker.
Культуры изолятов Pythium aphanidermatum, суммарно описанные на фигуре 1 поддерживали на картофельном декстрозном агаре (PDA), дополненном стрептомицина сульфатом в концентрации 0,05 г/л. Зерна выращенной без удобрений ржи (50 г) насыщали в течение ночи 40 мл деионизованной воды, помещая в пластиковые (поливинилхлоридные) флаконы объемом 250 мл. Флаконы автоклавировали дважды в течение 45 мин каждый раз на следующие друг за другом сутки. После охлаждения зерен в каждый флакон добавляли десять пробок агара с P. aphanidermatum размером 1×1 см. Флаконы, содержащие инфицированные ржаные зерна, инкубировали в ростовой камере (26°C; световой период 14 ч) в течение семи суток для того, чтобы позволить грибкам колонизировать ржаные зерна. Колонизированные грибком ржаные зерна применяли затем для инокуляции газона путем помещения четырех зерен в центр поверхности каждого горшка.
Обработки азоксистробином осуществляли в автоматическом шкафу для распыления с использованием плоского вентиляторного сопла (8004E), расположенного в 18 дюймах над газоном, с объемом распыляемой жидкости, равным 3 американских галлона/1000 кв. футов. Для предотвращения переноса от обработки к обработке нанесение осуществляли, начиная с самой низкой концентрации и заканчивая самой высокой концентрацией. Распылительное сопло между обработками промывали один раз ацетоном и дважды деионизованной водой (100 мл/ополаскивание). На газон распыляли Heritage® (азоксистробин) в соотношениях 0,4, 0,133, 0,044, 0,015, 0,005 и 0 унций Heritage/1000 кв. футов. Во время нанесения газону давали просохнуть, и переносили его в ростовую камеру (25-28°C; световой период 14 ч) на ночь.
Газон инокулировали колонизированными грибком ржаными зернами через сутки после описанного ранее нанесения. Все обработанные горшки затем перемешивали случайным образом, и помещали во влажную камеру (25-28°C; световой период 14 ч) на четверо суток. Газон перемещали в ростовое помещение за 24 ч до оценки заболевания. Процент инфицированной Pythium площади газона в каждом горшке оценивали через пять суток после инокуляции. За исключением изолята 99-150, все изоляты P. aphanidermatum были чувствительными к азоксистробину (таблица 1). Значения ED80 чувствительных изолятов попадали в пределы значений ED80 фонового распределения, уже установленного для P. aphanidermatum (фиг.1). Было обнаружено, что изолят 99-150 является устойчивым к азоксистробину. Это первое сообщение об устойчивости к азоксистробину изолята фитопатогенного гриба P. aphanidermatum.
Затем чувствительность устойчивого изолята 99-150 и чувствительного изолята P32R подтверждали путем тестирования в двух отдельных экспериментах с использованием отношений, вплоть до девятикратно превышающих рекомендуемые коммерческие пропорции для Heritage® (азоксистробин): 3,6, 1,2, 0,4, 0,133, 0,044, 0,015, 0,005 и 0 унций/1000 кв. футов. Чувствительный изолят P32R реагировал на азоксистробин согласно применяемому отношению, и процент инфицированного газона разительно снижался при наивысшем отношении. Устойчивый изолят 99-150 не реагировал на азоксистробин даже в отношении, девятикратно превышающем рекомендуемое (фиг.2).
Информация о предыдущей обработке изолятов P. aphanidermatum, исследованных в данной работе, была ограниченной. Однако авторы изобретения полагают, что изоляты без информации о дате сбора, показанные на фиг.1, никогда не подвергались воздействию стробилуринов, поскольку некоторые из них были собраны более 6 лет назад, до коммерческого введения данных фунгицидов. Однако вероятно, что изоляты, собранные в 1998 г. (включая устойчивый изолят 99-150), подвергались воздействию стробилуринов. Число нанесений неизвестно.
Устойчивый изолят 99-150 отправляли на Syngenta Jealott’s Hill International Research Station в Великобритании для дальнейших исследований на молекулярном уровне с целью изучить механизм устойчивости. При поступлении в Jealott’s Hill изоляту 99-150 придавали коллекционный номер K3758.
Пример 2
Направленное клонирование и определение последовательности гена цитохрома b изолята P. aphanidermatum K3758 (99-150) в сравнении с таковым из дикого типа P. aphanidermatum
Характеристику гена cyt b из изолята P. aphanidermatum K3758 (99-150) проводили с использованием способа, описанного ниже и резюмированного на фиг.3.
K3758 получали для анализа вначале путем культивирования в течение 7 суток при 25°C при 12-часовом флуоресцентном облучении на картофельном декстрозном агаре (Oxoid), полученном по рекомендациям производителя. Затем отбирали аликвоту при росте мицелия в стерильных условиях и инокулировали в 100 мл глицеринового бульона, полученного следующим образом:
Глицерин 2 мл
Дрожжевой экстракт 1 г
MgSO4·7H20 0,05 г
NaNO3 0,6 г
KCl 0,05 г
KH2PO4 0,15 г H20 до 100 мл,
хорошо перемешать и автоклавировать при давлении 15 фунтов на кв. дюйм в течение 15 минут.
Культуру затем инкубировали при 25°С на орбитальном шейкере в течение 7 суток. Полученные в результате разрастания мицелия затем собирали путем центрифугирования в бутыли Richardson и хранили до анализа в виде замороженного осадка при -80°C. Затем проводили получение геномной ДНК из двух различных аликвот по 200 мг мицелия с использованием Qiagen DNeasy® Plant Mini Kits, в сущности, по протоколу производителя, за исключением стадии начальной экстракции.
В случае первого образца мицелия данную экстракцию проводили путем мацерации мицелия в 400 мкл буфера AP1 и 4 мкг РНКазы из набора Qiagen вместе с «комбинацией лизирующего матрикса 3» (1/4″ сфера + гранатовый матрикс) из набора BIO 101 FastDNA . Экстракцию как таковую проводили 4×40 секунд (всего 160 с) при положении скорости 5 на приборе FP120 Fastprep . Экстракцию как таковую проводили 4×40 секунд (всего 160 с) при положении скорости 5 на приборе FP120 Fastprep Instrument (Anachem Ltd., Anachem House, Charles Street, Luton, Bedfordshire LU20EB, Великобритания). Затем пробирку для экстракции центрифугировали в течение пяти минут при 13000 об/мин для осаждения обломков. Затем надосадочную жидкость переносили в микроцентрифужную пробирку объемом 1,5 мл, и завершали получение ДНК, следуя стадиям 3-13 протокола Qiagen DNeasy Plant Mini Kit, проводя элюции конечной геномной ДНК 2×100 мкл буфера AE. Instrument (Anachem Ltd., Anachem House, Charles Street, Luton, Bedfordshire LU20EB, Великобритания). Затем пробирку для экстракции центрифугировали в течение пяти минут при 13000 об/мин для осаждения обломков. Затем надосадочную жидкость переносили в микроцентрифужную пробирку объемом 1,5 мл, и завершали получение ДНК, следуя стадиям 3-13 протокола Qiagen DNeasy Plant Mini Kit, проводя элюции конечной геномной ДНК 2×100 мкл буфера AE.
Экстракции второго образца достигали путем добавления 400 мкл буфера AP1 и 4 мкл РНКазы к осадку мицелия в микроцентрифужной пробирке объемом 2 мл, вместе со стерильным стальным шариком. Данную пробирку затем встряхивали на мельнице Spex CertiPrep 8000 Mixer Mill (Glen Creston Ltd) в течение 10 минут. Как и перед этим, надосадочную жидкость переносили в микроцентрифужную пробирку объемом 1,5 мл, и завершали получение ДНК, следуя стадиям 3-13 протокола Qiagen DNeasy Plant Mini Kit, проводя элюции конечной геномной ДНК 2×100 мкл буфера AE.
Затем для PCR-амплификации гена цитохрома b проводили 10-кратное серийное разведение каждого препарата геномной ДНК с использованием стерильной бидистиллированной воды (чистый, 1:10 и 1:100). 10 мкл каждого разведения затем применяли в качестве матрицы для реакций PCR, которые каждый раз проводили в дубликате с использованием праймеров 17F и 15R, которые охватывают кодирующую область для аминокислот от 73 до 283 генов цитохрома b грибов (по системе нумерации S. cerevisiae).
17F: 5’AAATAACGGTTGGTTAATTCG 3′
15R: 5’TCTTAAAATTGCATAAAAAGG 3′)
Условия циклов PCR включали начальную инкубацию при 94°C в течение 3 минут, с последующими 30 циклами, включающими 94°C в течение 45 секунд, 42°C в течение 45 секунд и 72°C в течение 1 минуты 30 секунд. Для окончания PCR также включали стадию конечного продления при 72°C в течение 10 минут. Продукты реакции анализировали путем гель-электрофореза перед клонированием в pCR2.1-TOPO по протоколу производителя (Invitrogen). Затем 10 трансформантов из каждого результата клонирования вырезали и использовали для получения плазмидной ДНК Wizard Plus (Promega). Для подтверждения присутствия продукта PCR, плазмидные ДНК расщепляли ферментом рестрикции EcoRI и анализировали путем гель-электрофореза. Затем определяли последовательность вставок в пять отдельных плазмид правильного размера из каждого начального образца K3758 с использованием прямого и обратного праймеров M13 (автоматический секвенатор ABI377XL). Данные последовательности анализировали с использованием подходящих программ анализа (Seqman, Editseq и Macaw).
Предсказанные последовательности гена цитохрома b из обоих образцов изолята K3758 затем выравнивали с последовательностью P. aphanidermatum дикого типа, которая была определена ранее. Нуклеотидные и аминокислотные выравнивания показаны на фигурах 4 и 5, где аминокислотные последовательности предсказывали с использованием «Mold, Protozoan and Coelenterate Mitochondrial Code-Number 4» как описано в Genetic Codes (таксономия NCBI):
Заметные черты данного анализа включали следующее:
– высокий уровень идентичности последовательностей цитохрома b дикого типа и K3758, только с одной единичной нуклеотидной и, как следствие, аминокислотной заменой;
– идентичные последовательности, обнаруженные для изолятов дикого типа и K3758, в области, соответствующей остатку 143, где авторами изобретения и другими исследователями обнаруживались мутации для всех ранее изученных мутантов фитопатогенных грибов, устойчивых по целевому участку Qo (Windass et al:, WO 00/66773; Sierotzki et al., Pest Manag. Sci. 56 (2000) 833-841; Sierotzki et al., Pest Biochem. Physiol. 68 (2000) 107-1120);
– наличие единичной замены фенилаланина на лейцин в положении, соответствующем остатку 129 дрожжевого цитохрома b (F129L).
Рассмотрим результаты более подробно: все 10 вставок K3758 с определенной последовательностью имели A в качестве третьего основания кодона аминокислоты 129. Из 5 вставок, анализированных для первого образца 2, содержали другие отличия в последовательности (miniprep 2 содержал 3 отличия, и mp 3 содержал 2), которые, как предполагается, являются ошибками PCR, и из 5 вставок в консенсусной последовательности-2 3 содержали отличия последовательности (mp 1 содержал 2 отличия, mp 4 содержал 2, и mp 5 содержал 3), которые опять являются типичными ошибками PCR. Поэтому только наличие остатка A в положении, соответствующем третьему основанию кодона 129, является стойким различием между последовательностями цитохрома b P. aphanidermatum K3758 и дикого типа.
Интересно, что о замене F129L сообщали, что она дает устойчивость к миксотиазолу (другой ингибитор Qo) в S. cerevisiae, Rhodobacter capsulatus и Chlamydomonas reinhardtii (Esposti et al. Biochimica et Biophysica Acta, 1143 (1993) 243-271). Однако ранее не сообщалось о данной замене в фитопатогенных грибах.
Пример 3
Конструирование праймеров ARMS, способных отличать аллели F129 и L129 в P. aphanidermatum дикого типа и штамма K3758
С использованием последовательностей генов цитохрома b P. aphanidermatum дикого типа и изолята K3758, полученных по примеру 2, конструировали различные специфические праймеры ARMS для определения наличия или отсутствия данной точечной мутации F129L.
Три прямых праймера ARMS, основанных на последовательности дикого типа:
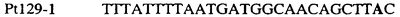 
Три прямых праймера ARMS, основанных на мутации F129L:
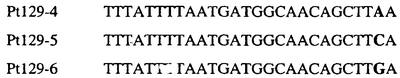
и контрольный праймер, сконструированный выше точечной мутации:
Pt129-S TATTTTTATTTTAATGATGGCAACAGC
В каждом из указанных выше праймеров ARMS основание -1 (3′-концевое основание последовательности праймера) соответствует участку целевой точечной мутации. Основания, показанные жирным шрифтом, отличаются от последовательности цитохрома b P. aphanidermatum дикого типа. В праймерах Pt129-1 и Pt129-4 позиция -2 была изменена с основания T на основание A. В праймерах Pt129-2 и Pt129-5 позиция -2 была изменена с основания T на основание С. В праймерах Pt129-3 и Pt129-6 позиция -2 была изменена с основания T на основание G. Данные изменения в последовательности были сделаны для дестабилизации гибридной молекулы матрица/праймер и достижения большей специфичности в отношении соответствующей матрицы любого продления праймера. Примеры из литературы показывают, что дестабилизация праймера ARMS снижает риск затравки праймером синтеза неправильной матрицы (Newton et al., Nucleic Acid Research 17 (7) 2503-2516 1989).
Все праймеры были синтезированы Oswel DNA Service (Lab 5005, Medical and Biological Sciences Building, Саутгемптон). Перед применением каждый праймер разбавляли до 5 мкМ в общем объеме, равном 500 мкл, бидистиллированной, не содержащей нуклеаз H2О. Затем праймеры далее разбавляли до конечной концентрации 500 нМ в реакционных смесях PCR.
Пример 4
Конструирование праймера Scorpion для применения при мониторинге аллельного статуса F129 и L129 P. aphanidermatum
Вновь используя последовательности генов цитохрома b P. aphanidermatum дикого типа и изолята K3758, полученных по примеру 2, конструировали олигонуклеотиды Scorpion для определения селективной амплификации аллелей дикого типа и L129 путем включения системы определения в обратный PCR-праймер, сконструированный для применения с ARMS-определением SNP и стандартными праймерами, описанными в примере 3. Полученный в результате ампликон составлял 172 н.п. в длину с праймерами ARMS, и 176 н.п. в длину с контрольным праймером. для определения селективной амплификации аллелей дикого типа и L129 путем включения системы определения в обратный PCR-праймер, сконструированный для применения с ARMS-определением SNP и стандартными праймерами, описанными в примере 3. Полученный в результате ампликон составлял 172 н.п. в длину с праймерами ARMS, и 176 н.п. в длину с контрольным праймером.
Конкретно, праймер Scorpion конструировали с использованием программ Oligo 5 и MFold (MFold предсказывает оптимальные и субоптимальные вторичные структуры для молекул РНК или ДНК с использованием способа минимизации энергии по Zucker (Zucker, M. (1989) Science 244,48-52; SantaLucia, J. Jr. (1998). Proc. Natl. Acad. Sci. USA 95, 1460-1465).
Последовательность полученного в результате праймера Scorpion P. aphanidermatum представляла собой: 5′ FAM-CCCGCCCGATATTGTTGATTGGTTATGGGGCGGG (SEQ NO 115) MR-HEG-TATTTAAAGTTGGATTATCTACAGC 3′ (SEQ ID NO 116), где подчеркнутые области представляют собой части, образующие шпильку (когда праймер Scorpion ни с чем не взаимодействует); FAM представляет собой флуоресцеиновый краситель; MR (метиловый красный) является не флуоресцирующим гасителем, привязанным к остатку урацила, и HEG представляет собой блокирующий репликацию мономер гексетиленгликоля. Последовательность, показанная курсивом, представляет собой последовательность обратного праймера, а последовательность, показанная жирным шрифтом, представляет собой последовательность Scorpion, которая связывается с аутентичным продуктом продления обратного праймера cyt b P. aphanidermatum.
Стебельчатопетлевая вторичная структура данного праймера Scorpion может быть визуализирована с помощью программы MFold (см. фигуру 6) и, как предсказано, обладает энергией, равной -1,9 ккал/моль, не будучи гибридизованной с целевым геном cyt b. Однако в присутствии продукта продления структура шпильки разделяется, поскольку зондовая последовательность праймера Scorpion связывается с продуктом продления с предсказанной энергией -4,9 ккал/моль. Это отделяет краситель FAM от его гасителя, вызывая флуоресцентное излучение, определяемое, например, прибором ABI Prism 7700. Поэтому отжиг элемента Scorpion на вновь синтезированную цепь является энергетически выгодным по сравнению с стебельчатопетлевой структурой Scorpion.
Праймер Scorpion был синтезирован Oswel DNA Service (Lab 5005, Medical and Biological Sciences Building, Саутгемптон). Перед применением данный праймер разбавляли до 5 мкМ в общем объеме, равном 500 мкл, бидистиллированной, не содержащей нуклеаз H2О. Затем праймеры далее разбавляли до конечной концентрации 500 нМ в реакционных смесях PCR.
Пример 5
Подтверждение применения праймеров ARMS и Scorpions для определения и количественного анализа SNP F129L, обнаруженного в штамме K3758
При всех анализах определения SNP F129L при помощи ARMS/Scorpion в реакционные смеси включали фермент AmpliTaq Gold (Applied Biosystems) в концентрации 1 единица/25 мкл реакционной смеси. Реакционная смесь также содержала 1× буфер (10 мМ Tris-HCl (pH 8,3), 50 мМ KCl, 3,5 мМ MgCl2, 0,01% желатина) и 100 мкМ dNTP (Amersham Pharmacia Biotech). Амплификации проводили в приборе ABI Prism 7700 с целью длительного мониторинга флуоресценции. Проводили предварительный цикл при 95°C в течение 10 минут, с последующими 50 циклами при 95°C в течение 15 с и при 60°C в течение 45 с. Флуоресценцию отслеживали во время стадии отжига/продления в течение всех циклов. в реакционные смеси включали фермент AmpliTaq Gold (Applied Biosystems) в концентрации 1 единица/25 мкл реакционной смеси. Реакционная смесь также содержала 1× буфер (10 мМ Tris-HCl (pH 8,3), 50 мМ KCl, 3,5 мМ MgCl2, 0,01% желатина) и 100 мкМ dNTP (Amersham Pharmacia Biotech). Амплификации проводили в приборе ABI Prism 7700 с целью длительного мониторинга флуоресценции. Проводили предварительный цикл при 95°C в течение 10 минут, с последующими 50 циклами при 95°C в течение 15 с и при 60°C в течение 45 с. Флуоресценцию отслеживали во время стадии отжига/продления в течение всех циклов.
Применение данных праймеров в таких анализах вначале проверяли с использованием в качестве матрицы плазмидной ДНК в различных концентрациях. Эту процедуру проводили для проверки специфичности и чувствительности конструирования праймеров. Часть последовательности гена цитохрома b дикого типа и соответствующий участок, содержащий мутацию F129L, амплифицированные от двух изолятов P. aphanidermatum, клонировали в вектор TA pCR2.1 (Invitrogen), как описано ранее в примере 2. 150 мкл бактериальной культуры от 10 трансформантов из каждого случая клонирования, отобранные для получения препаратов плазмидной ДНК Wizard Plus (Promega) (см. пример 2), сохраняли перед получением данных препаратов и хранили при 4°C. После анализа последовательности отмечали образцы плазмидной ДНК мутантов и дикого типа, которые не содержали различий по последовательности по сравнению с консенсусной последовательностью. Бактериальную культуру, из которой происходили данные последовательности плазмидной ДНК мутантов и дикого типа, собирали для максипрепаратов (maxiprep) плазмидной ДНК (Qiagen) по протоколу производителя. Полученную в результате плазмидную ДНК подвергали количественному анализу и разбавляли до концентрации 1 мкг/мкл (2×1011 молекул/мкл) с использованием стерильной бидистиллированной H2О.
Кассеты плазмидной ДНК дикого типа и мутантов далее разбавляли до концентрации 10 пг/мкл (или 2×106 молекул/мкл) в бидистиллированной H2O, и использовали в качестве матрицы для подтверждения специфичности праймеров ARMS. Каждый праймер ARMS тестировали на матрице дикого типа и мутантной матрице, а также на контроле без матрицы (только вода) при условиях PCR, описанных выше. Праймеры Pt129-1 и Pt129-4 имели предпочтение над Pt129-2 и Pt129-3, а праймеры Pt129-5 и Pt129-6, как парные PCR, давали более устойчивые результаты и были более специфичными. Праймер ARMS дикого типа Pt129-1 характеризовался интервалом из 15,27 циклов до того, как амплификация происходила на неподходящей (мутантной) матрице (фигура 7). Мутантный праймер ARMS Pt129-4 характеризовался интервалом из 16,96 циклов до того, как амплификация происходила на неподходящей (дикого типа) матрице (фигура 8).
После селекции подходящего праймера ARMS для определения точечной мутации способ анализа испытывали далее, так что чувствительность определения была полностью выявлена до ее применения для тестирования биологических образцов на предмет наличия мутации L129. Первая стадия испытания представляла собой подтверждение того, варьирует ли интервал специфичности для выбранных праймеров ARMS в пределах 6 порядков величины концентрации ДНК дикого типа и мутантной ДНК. Кассеты плазмидной ДНК дикого типа и мутантов, описанные ранее, разбавляли в растворе бычьего сывороточного альбумина (BSA) (порошок фракции V, минимум 96%, Sigma A9647) с концентрацией 1 мг/мл серией 10-кратных разведений. Концентрации матрицы покрывали интервал от 2×108 молекул/мкл до 2×102 молекул/мкл. Обе кассеты плазмидной ДНК и контроль без матрицы (только вода) тестировали в анализе ARMS/Scorpion с использованием праймеров Pt129-1, Pt129-4 и Pt129-5, как описано выше.
| Таблица 18 |
| Результаты эксперимента по определению интервала специфичности с использованием праймера ARMS 129-4 (L129-аллельселективного) |
| Концентрация плазмиды |
A Ct (мутант) |
C Ct (дикий тип) |
 Ct Ct |
| 2×108 |
19,68 |
43,17 (1 повтор.) |
23,49 |
| 2×107 |
21,96 |
40,74 |
18,78 |
| 2×106 |
26,71 |
нет С |
нет данных |
| 2×105 |
32,55 |
нет С |
нет данных |
| 2×104 |
36,46 |
нет С |
нет данных |
| 2×103 |
39,89 |
нет С |
нет данных |
| 2×102 |
43,45 |
нет С |
нет данных |
| Таблица 19 |
| Результаты эксперимента по определению интервала специфичности с использованием праймера ARMS 129-1 (L129-аллельселективного) |
| Концентрация плазмиды |
A Ct (мутант) |
C Ct (дикий тип) |
 Ct Ct |
| 2×108 |
41,68 |
19,73 |
21,95 |
| 2×107 |
42,56 |
22,25 |
20,31 |
| 2×106 |
44,24 |
25,86 |
18,38 |
| 2×105 |
47,0 |
29,56 |
17,44 |
| 2×104 |
46,12 (1 повтор) |
33,38 |
12,32 |
| 2×103 |
44,21 |
36,55 |
7,66 |
| 2×102 |
нет А |
40,39 |
нет данных |
Данные результаты показывают, что праймеры ARMS Pt129-1 и Pt129-4 амплифицируются с соответствующими им корректными матрицами не с одинаковым значением Ct (пороговый цикл, номер цикла PCR, при котором изменение флуоресценции возрастает над фоновыми значениями), и это различие оказывается зависимым от концентрации плазмидной ДНК. Также для праймера Pt129-1 Ct между амплификацией на правильной и неправильной матрице не остается постоянным в интервале концентраций ДНК матрицы, которые тестировали при данном анализе. Поскольку данные праймеры ARMS не характеризуются некоторыми из необходимых свойств, они не будут составлять основу для идеального анализа, и поэтому было решено реконструировать анализ с использованием прямого праймера Scorpion выше точечной мутации в комбинации с парой обратных праймеров ARMS.
Пример 6
Конструирование праймеров ARMS, способных отличать аллели F129 и L129, обнаруженные в P. aphanidermatum дикого типа и штамма K3758
С использованием последовательностей генов цитохрома b P. aphanidermatum дикого типа и изолята K3758, полученных по примеру 2, конструировали второй набор специфических праймеров ARMS для определения наличия или отсутствия данной точечной мутации F129L.
Шесть обратных праймеров ARMS, основанных на последовательности дикого типа:

Пятнадцать обратных праймеров ARMS, основанных на мутации F129L:

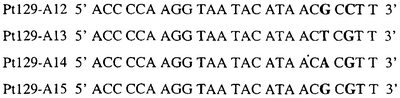
и конструировали два обратных контрольных праймера ниже точечной мутации:
Pt129-S4 5′ TTG ACC CCA AGG TAA TAC ATA ACC C 3′
Pt129-S6 5′ TTG ACC CCA AGG TAA TAC ATA ACT C 3′
В каждом из указанных выше праймеров ARMS основание -1 (3′-концевое основание последовательности праймера) соответствует участку целевой точечной мутации. Основания, показанные жирным шрифтом, отличаются от последовательности цитохрома b P. aphanidermatum дикого типа. В праймерах Pt129-C1 и Pt129-A1 позиция -2 была изменена с основания T на основание A (в обратной комплементарной цепи). В праймерах Pt129-C2 и Pt129-A2 позиция -2 была изменена с основания T на основание С (в обратной комплементарной цепи). В праймерах Pt129-C3 и Pt129-A3 позиция -2 была изменена с основания T на основание G (в обратной комплементарной цепи). В праймерах Pt129-C4 и Pt129-A4 позиция -3 была изменена с основания А на основание T (в обратной комплементарной цепи). В праймерах Pt129-C5 и Pt129-A5 позиция -3 была изменена с основания А на основание C (в обратной комплементарной цепи). В праймерах Pt129-C6 и Pt129-A6 позиция -3 была изменена с основания А на основание G (в обратной комплементарной цепи). В праймере Pt129-A7 позиция -5 была изменена с основания C на основание T, и позиция -2 была изменена с основания T на основание C (в обратной комплементарной цепи). В праймере Pt129-A8 позиция -5 была изменена с основания C на основание A, и позиция -2 была изменена с основания T на основание C (в обратной комплементарной цепи). В праймере Pt129-A9 позиция -5 была изменена с основания C на основание G, и позиция -2 была изменена с основания T на основание C (в обратной комплементарной цепи). В праймере Pt129-A10 позиция -5 была изменена с основания C на основание T, и позиция -3 была изменена с основания A на основание C (в обратной комплементарной цепи). В праймере Pt129-A11 позиция -5 была изменена с основания C на основание A, и позиция -3 была изменена с основания A на основание C (в обратной комплементарной цепи). В праймере Pt129-A12 позиция -5 была изменена с основания C на основание G, и позиция -3 была изменена с основания A на основание C (в обратной комплементарной цепи). В праймере Pt129-A13 позиция -5 была изменена с основания C на основание T, и позиция -3 была изменена с основания A на основание G (в обратной комплементарной цепи). В праймере Pt129-A14 позиция -5 была изменена с основания C на основание A, и позиция -3 была изменена с основания A на основание G (в обратной комплементарной цепи). В праймере Pt129-A15 позиция -5 была изменена с основания C на основание G, и позиция -3 была изменена с основания A на основание G (в обратной комплементарной цепи). Данные изменения в последовательности были сделаны для дестабилизации гибридной молекулы матрица/праймер и достижения большей специфичности в отношении соответствующей матрицы любого продления праймера. Примеры из литературы показывают, что дестабилизация праймера ARMS снижает риск затравки праймером синтеза неправильной матрицы (Newton et al, Nucleic Acid Research 17 (7) 2503-2516 1989).
Все праймеры были синтезированы Oswel DNA Service (Lab 5005, Medical and Biological Sciences Building, Саутгемптон). Перед применением каждый праймер разбавляли до 5 мкМ в общем объеме, равном 500 мкл, бидистиллированной, не содержащей нуклеаз H2О. Затем праймеры далее разбавляли до конечной концентрации 500 нМ в реакционных смесях PCR.
Пример 7
Конструирование дальнейшего праймера Scorpion для применения при мониторинге аллельного статуса F129 и L129 P. aphanidermatum
Вновь используя последовательности генов цитохрома b P. aphanidermatum дикого типа и изолята K3758, полученных по примеру 2, конструировали олигонуклеотиды Scorpion для определения селективной амплификации аллелей дикого типа и L129 путем включения системы определения в прямой PCR-праймер, сконструированный для применения с ARMS-определением SNP и стандартными праймерами, описанными в примере 3. Полученный в результате ампликон составлял 126 н.п. в длину с праймерами ARMS, и 129 н.п. в длину с контрольным праймером. для определения селективной амплификации аллелей дикого типа и L129 путем включения системы определения в прямой PCR-праймер, сконструированный для применения с ARMS-определением SNP и стандартными праймерами, описанными в примере 3. Полученный в результате ампликон составлял 126 н.п. в длину с праймерами ARMS, и 129 н.п. в длину с контрольным праймером.
Конкретно, праймер Scorpion конструировали с использованием программ Oligo 5 и MFold (MFold предсказывает оптимальные и субоптимальные вторичные структуры для молекул РНК или ДНК с использованием способа минимизации энергии по Zucker (Zucker, M. (1989) Science 244,48-52; SantaLucia, J. Jr. (1998). Proc. Natl. Acad. Sci. USA 95, 1460-1465).
Последовательность полученного в результате праймера Scorpion P. aphanidermatum представляла собой: 5′ FAM-CGGCCGCCAACACCTGAACACCATAAACCGCGGCCG MR-HEG- TATATTATGGTTCATATATTACTCCAAG 3′, где подчеркнутые области представляют собой части, образующие шпильку (когда праймер Scorpion ни с чем не взаимодействует); FAM представляет собой флуоресцеиновый краситель; MR (метиловый красный) является не флуоресцирующим гасителем, привязанным к остатку урацила, и HEG представляет собой блокирующий репликацию мономер гексетиленгликоля. Последовательность, показанная курсивом, представляет собой последовательность прямого праймера, а последовательность, показанная жирным шрифтом, представляет собой последовательность Scorpion, которая связывается с аутентичным продуктом продления прямого праймера cyt b P. aphanidermatum.
Стебельчатопетлевая вторичная структура данного праймера Scorpion может быть визуализирована с помощью программы MFold (см. фигуру 9) и, как предсказано, обладает энергией, равной -1,9 ккал/моль, не будучи гибридизованной с целевым геном cyt b. Однако в присутствии продукта продления структура шпильки разделяется, поскольку зондовая последовательность праймера Scorpion связывается с продуктом продления с предсказанной энергией -5,6 ккал/моль. Это отделяет краситель FAM от его гасителя, вызывая флуоресцентное излучение, определяемое, например, прибором ABI Prism 7700. Поэтому отжиг элемента Scorpion на вновь синтезированную цепь является энергетически выгодным по сравнению со стебельчатопетлевой структурой Scorpion.
Праймер Scorpion был синтезирован Oswel DNA Service (Lab 5005, Medical and Biological Sciences Building, Саутгемптон). Перед применением данный праймер разбавляли до 5 мкМ в общем объеме, равном 500 мкл, бидистиллированной, не содержащей нуклеаз H2О. Затем праймеры далее разбавляли до конечной концентрации 500 нМ в реакционных смесях PCR.
Пример 8
Подтверждение применения праймеров ARMS и Scorpions для определения и количественного анализа SNP F129L, обнаруженного в штамме K3758
При всех анализах определения SNP F129L при помощи ARMS/Scorpion в реакционные смеси включали фермент AmpliTaq Gold (Applied Biosystems) в концентрации 1 единица/25 мкл реакционной смеси. Реакционная смесь также содержала 1× буфер (10 мМ Tris-HCl (pH 8,3), 50 мМ KCl, 3,5 мМ MgCl2, 0,01% желатина) и 100 мкМ dNTP (Amersham Pharmacia Biotech). Амплификации проводили в приборе ABI Prism 7700 с целью длительного мониторинга флуоресценции. Проводили предварительный цикл при 95°C в течение 10 минут, с последующими 50 циклами при 95°C в течение 15 с и при 60°C в течение 45 с. Флуоресценцию отслеживали во время стадии отжига/продления в течение всех циклов. в реакционные смеси включали фермент AmpliTaq Gold (Applied Biosystems) в концентрации 1 единица/25 мкл реакционной смеси. Реакционная смесь также содержала 1× буфер (10 мМ Tris-HCl (pH 8,3), 50 мМ KCl, 3,5 мМ MgCl2, 0,01% желатина) и 100 мкМ dNTP (Amersham Pharmacia Biotech). Амплификации проводили в приборе ABI Prism 7700 с целью длительного мониторинга флуоресценции. Проводили предварительный цикл при 95°C в течение 10 минут, с последующими 50 циклами при 95°C в течение 15 с и при 60°C в течение 45 с. Флуоресценцию отслеживали во время стадии отжига/продления в течение всех циклов.
Первой стадией, предпринимаемой при испытании способа анализа, является тестирование праймеров ARMS на предмет их способности отличать аллели F129 (дикий тип) и L129 (мутант) во время амплификации. ДНК-конструкции cyt b P. aphanidermatum дикого и мутантного типа, описанные в примере 5, разбавляли до концентрации 10 пг/мкл (или 2×106 молекул/мкл) в бидистиллированной H2O, и использовали в качестве матрицы для подтверждения специфичности праймеров ARMS. Каждый праймер ARMS тестировали на матрице дикого типа и мутантной матрице, а также на контроле без матрицы (только вода) при условиях PCR, описанных выше. Результаты суммированы в таблице 20.
| Таблица 20 |
| Подтверждение селективности сконструированных праймеров ARMS |
| Праймер |
C Ct |
A Ct |
 Ct Ct |
Наблюдаемое отношение А:С |
Амплификация NTC |
| Pt129-C1 |
25,79 |
42,6 |
16,81 |
1:114898 |
отсутствует |
| Pt129-C2 |
20,42 |
43,57 |
23,15 |
1:9307743 |
отсутствует |
| Pt129-C3 |
29,7 |
нет А |
нет данных |
все С |
отсутствует |
| Pt129-C4 |
21,28 |
нет А |
нет данных |
все С |
отсутствует |
| Pt129-C5 |
20,1 |
42,36 |
22,26 |
1:5022589 |
отсутствует |
| Pt129-C6 |
19,63 |
44,17 |
24,54 |
1:24393610 |
отсутствует |
| Pt129-A1 |
32,33 |
26,54 |
5,79 |
55:1 |
отсутствует |
| Pt129-A2 |
34,01 |
20,87 |
13,14 |
9026:1 |
отсутствует |
| Pt129-A3 |
40,2 |
31,29 |
8,91 |
481:1 |
отсутствует |
| Pt129-A4 |
38,8 |
24,42 |
14,38 |
21321:1 |
отсутствует |
| Pt129-A5 |
32,51 |
21,42 |
11,09 |
2179:1 |
отсутствует |
| Pt129-A6 |
33,47 |
21,3 |
12,17 |
4608:1 |
отсутствует |
| Pt129-A7 |
22,28 |
36,33 |
14,05 |
16961:1 |
отсутствует |
| Pt129-A8 |
22,11 |
35,87 |
13,76 |
13873:1 |
отсутствует |
| Pt129-A9 |
22,14 |
37,1 |
14,98 |
31871:1 |
отсутствует |
| Pt129-A10 |
27,2 |
31,4 |
4,2 |
18,4:1 |
отсутствует |
| Pt129-A11 |
24,85 |
31,25 |
6,4 |
84,4:1 |
отсутствует |
| Pt129-A12 |
27,46 |
30,16 |
2,7 |
6,5:1 |
отсутствует |
| Pt129-A13 |
23,19 |
41,99 |
18,8 |
456419:1 |
отсутствует |
| Pt129-A14 |
23,1 |
43,5 |
20,4 |
1383604:1 |
отсутствует |
| Pt129-A15 |
30,05 |
нет С |
нет данных |
все А |
отсутствует |
| Pt129-S4 |
19,06 |
18,98 |
– |
– |
отсутствует |
| Pt129-S6 |
20,43 |
20,84 |
– |
– |
отсутствует |
Результаты показывают, что L129-аллельселективные (мутантные) праймеры Pt129-A14 и Pt129-A15 характеризовались наибольшим интервалом специфичности между амплификацией на подходящей матрице и неподходящей матрицей (20,4 циклов, и отсутствие амплификации на неподходящей матрице, соотвественно). Праймер Pt129-A15 не связывался с неподходящей матрицей, однако амплификация на правильной матрице была очень поздней, на цикле 30. Поэтому праймер Pt129-A14 является предпочтительным L129-аллельселективным (мутантным) праймером ARMS, поскольку он имеет меньшее значение Ct на правильной матрице. Праймер Pt129-C4 является предпочтительным F129-аллельселективным праймером (дикого типа), поскольку он не связывается с неподходящей матрицей. Праймер Pt129-S4 является предпочтительным стандартным праймером. Поэтому они применяются для окончания испытания способа анализа.
L129-аллельселективный (мутантный) праймер Pt129-A14, как оказалось, однако характеризуется значением Ct примерно на 5 большим, чем для F129-аллельселективного праймера (дикого типа) Pt129-C4, даже несмотря на то, что матрица находится в одинаковой концентрации. Этот вопрос исследовали далее путем проверки того, остается ли разница между праймерами в значении Ct постоянной в интервале концентраций матрицы.
После селекции подходящей пары праймеров ARMS для определения точечной мутации способ анализа испытывали далее для полного выявления чувствительности определения до ее применения для тестирования биологических образцов на предмет наличия мутации L129. Следующее предпринятое исследование представляло собой подтверждение того, варьирует ли интервал специфичности для выбранных праймеров ARMS Pt129-C4 и PT129-A14 в пределах 6 порядков величины концентрации ДНК матрицы, и также различие в значении Ct между F129- и L129-аллельселективными праймерами ARMS, когда оба праймера амплифицируют соответствующие им правильные матрицы. Конструкции плазмидной ДНК дикого типа и мутантного cyt b, описанные ранее, разбавляли в растворе бычьего сывороточного альбумина (BSA) (порошок фракции V, минимум 96%, Sigma A9647) с концентрацией 1 мг/мл серией 10-кратных разведений. Концентрации матрицы покрывали интервал от 2×108 молекул/мкл до 2×102 молекул/мкл. Праймеры ARMS Pt129-C4 и Pt129-A14, и стандартный праймер Pt129-S4 тестировали в анализе с использованием обеих кассет плазмидной ДНК в каждой концентрации матрицы и контроля без матрицы (только вода), как описано выше.
| Таблица 21 |
| Результаты по праймеру Pt129-A14 в пределах интервала разведений плазмидной ДНК-матрицы |
| Концентрация плазмиды |
A (L129) Ct |
C (F129) Ct |
 Ct Ct |
Наблюдаемое отношение А:С |
Амплификация NTC |
| 2×108 |
17,9 |
35,42 |
17,52 |
187951:1 |
нет |
| 2×107 |
20,56 |
38,75 |
18,19 |
299044:1 |
нет |
| 2×106 |
24,2 |
44,59 |
20,39 |
1374047:1 |
нет |
| 2×105 |
28,58 |
нет С |
нет данных |
все А |
нет |
| 2×104 |
31,56 |
нет С |
нет данных |
все А |
нет |
| 2×103 |
34,63 |
нет С |
нет данных |
все А |
нет |
| 2×102 |
36,97 |
нет С |
нет данных |
все А |
нет |
| Таблица 22 |
| Результаты по праймеру Pt129-С4 в пределах интервала разведений плазмидной ДНК-матрицы |
| Концентрация плазмиды |
A (L129) Ct |
C (F129) Ct |
 Ct Ct |
Наблюдаемое отношение А:С |
Амплификация NTC |
| 2×108 |
нет А |
13,91 |
нет данных |
все С |
отсутствует |
| 2×107 |
нет А |
15,51 |
нет данных |
все С |
отсутствует |
| 2×106 |
нет А |
19,67 |
нет данных |
все С |
отсутствует |
| 2×105 |
нет А |
23,23 |
нет данных |
все С |
отсутствует |
| 2×104 |
нет А |
26,15 |
нет данных |
все С |
отсутствует |
| 2×103 |
нет А |
29,64 |
нет данных |
все С |
отсутствует |
| 2×102 |
нет А |
33,58 |
нет данных |
все С |
отсутствует |
| Таблица 23 |
| Результаты по праймеру Pt129-S4 в пределах интервала разведений плазмидной ДНК-матрицы |
| Концентрация плазмиды |
A (L129) Ct |
C (F129) Ct |
Амплификация NTC |
| 2×108 |
13,86 |
14,08 |
отсутствует |
| 2×107 |
15,02 |
15,33 |
отсутствует |
| 2×106 |
18,85 |
19,77 |
отсутствует |
| 2×105 |
22,33 |
22,75 |
отсутствует |
| 2×104 |
25,44 |
25,46 |
отсутствует |
| 2×103 |
29,33 |
29,17 |
отсутствует |
| 2×102 |
32,15 |
33,31 |
отсутствует |
Данные результаты показывают, что при использовании L129-аллельселективного (мутантного) праймера Pt129-A14  Ct между амплификацией на подходящей и неподходящей матрице составляет примерно 18-20 циклов для наиболее концентрированных плазмидных ДНК-матриц, но когда концентрация плазмидной ДНК-матрицы снижается далее, амплификация на неподходящей матрице перестает наблюдаться. F129 аллельселективный праймер (дикого типа) Pt129-C4 связывается только с подходящей матрицей в пределах всего интервала концентраций матрицы. Поэтому интервал специфичности для L129- и F129-аллельселективных праймеров Pt129-A14 и Pt129-C4 был постоянным по всему интервалу концентраций матрицы. Ct между амплификацией на подходящей и неподходящей матрице составляет примерно 18-20 циклов для наиболее концентрированных плазмидных ДНК-матриц, но когда концентрация плазмидной ДНК-матрицы снижается далее, амплификация на неподходящей матрице перестает наблюдаться. F129 аллельселективный праймер (дикого типа) Pt129-C4 связывается только с подходящей матрицей в пределах всего интервала концентраций матрицы. Поэтому интервал специфичности для L129- и F129-аллельселективных праймеров Pt129-A14 и Pt129-C4 был постоянным по всему интервалу концентраций матрицы.
| Таблица 24 |
| Сравнение значений Ct на подходящей матрице для L129- и F129-аллельселективных праймеров |
| Концентрация плазмиды |
Pt129-A14 Ct (L129 матрица) |
Pt129-C4 Ct (F129 матрица) |
 Ct (L129-F129) Ct (L129-F129) |
| 2×108 |
17,9 |
13,91 |
3,99 |
| 2×107 |
20,56 |
15,51 |
5,05 |
| 2×106 |
24,2 |
19,67 |
4,53 |
| 2×105 |
28,58 |
23,23 |
5,35 |
| 2×104 |
31,56 |
26,15 |
5,41 |
| 2×103 |
34,63 |
29,64 |
4,99 |
| 2×102 |
36,97 |
33,58 |
3,39 |
Строили график зависимости значений Ct (пороговый цикл) для каждого аллельселективного праймера от концентрации плазмидной ДНК-матрицы (фигура 10). Угол наклона графиков для обоих праймеров был практически идентичным, и значения R2 (коэффициент корреляции) также примерно совпадали. Графики также были параллельными по всему интервалу концентраций матрицы, указывая на то, что различие между праймерами по значению Ct остается постоянным независимо от концентрации ДНК-матрицы.
Также строили график зависимости  Ct (разница между двумя значениями Ct) между L129- и F129-аллельселективными праймерами на подходящей матрице от концентрации плазмидной ДНК-матрицы (фигура 11). Наклон линии, составляющий менее 0,1, показывает, что Ct (разница между двумя значениями Ct) между L129- и F129-аллельселективными праймерами на подходящей матрице от концентрации плазмидной ДНК-матрицы (фигура 11). Наклон линии, составляющий менее 0,1, показывает, что  Ct между L129- и F129-аллельспецифичными праймерами на подходящей им матрице не изменяется в зависимости от концентрации ДНК-матрицы. Ct между L129- и F129-аллельспецифичными праймерами на подходящей им матрице не изменяется в зависимости от концентрации ДНК-матрицы.
Среднее  Ct между двумя праймерами, связывающимися с подходящей им матрицей, составляет 4,67. Поэтому для получения верного представления соотношения двух аллелей в образце требуется, чтобы данное значение было вычтено из Ct между двумя праймерами, связывающимися с подходящей им матрицей, составляет 4,67. Поэтому для получения верного представления соотношения двух аллелей в образце требуется, чтобы данное значение было вычтено из  Ct, вычисленного между L129-аллельселективным праймером и F129-аллельселективным праймером. Ct, вычисленного между L129-аллельселективным праймером и F129-аллельселективным праймером.
Таким образом, L129-аллельселективный праймер Pt129-A14 и F129-аллельселективный праймер Pt129-C4 могут использоваться в данном анализе для непосредственного сравнения уровня аллелей L129 и F129 в образце.
Во втором контрольном исследовании было задействовано тестирование чувствительности определения выбранными праймерами ARMS Pt129-C4 и Pt129-A14. Плазмидную ДНК с аллелем L129 в концентрации 2×107 молекул/мкл разбавляли фоновым количеством плазмидной ДНК с аллелем F129 в постоянной концентрации 2×107 молекул/мкл с образованием следующих отношений аллеля L129 и F129: 1:1, 1:10, 1:100, 1:1000, 1:10000 и 1:100000. Конечная концентрация плазмиды в реакционной смеси PCR составляла 1×108 молекул/мкл. Полученные препараты тестировали, наряду с плазмидой дикого типа, мутантной плазмидой и контролем, содержащим только воду, с праймерами Pt129-A14, Pt129-C4 и Ptl29-S4 в анализе, описанном выше.
| Таблица 25 |
| Результаты, полученные на контрольных ДНК-матрицах плазмиды дикого типа и мутантной плазмиды |
| Праймер |
Значение Ct – С-матрица (аллель F129) |
Значение Ct – A-матрица (аллель L129) |
 Ct Ct |
| Pt129-А14 |
43,16 |
27,33 |
15,83 |
| Pt129-C4 |
23,03 |
нет А |
нет данных |
| Pt129-S4 |
20,55 |
21,18 |
нет данных |
Праймеры Pt129-A14 и Pt129-C4 не характеризуются одинаковым значением Ct на их правильной матрице, как указано выше. Это различие в значении Ct составляло 27,33-23,03 = 4,3. Это значение необходимо вычитать из каждого  Ct, рассчитанного по дискретному эксперименту, для получения верного представления о соотношении каждого аллеля в образцах. Ct, рассчитанного по дискретному эксперименту, для получения верного представления о соотношении каждого аллеля в образцах.
| Таблица 26 |
| Результаты, показывающие чувствительность определения праймеров ARMS Pt129-A14 и Pt129-C4 |
| ДНК-матрица |
А праймер Ct |
C праймер Ct |
 Ct (Act-CCt) Ct (Act-CCt) |
Выверенное  Ct ( Ct ( Ct-4,3) Ct-4,3) |
Наблюдаемое отношение А:С |
Наблюдаемый %С |
| 1:1 |
22,1 |
18,3 |
3,8 |
-0,5 |
|
58,6 |
| 1:10 |
25,53 |
18,05 |
7,48 |
3,18 |
1:9,08 |
9,9 |
| 1:100 |
29,83 |
18,23 |
11,14 |
6,84 |
1:114 |
0,86 |
| 1:1000 |
33,47 |
18,33 |
15,14 |
10,84 |
1:1826 |
0,05 |
| 1:10000 |
36,09 |
18,41 |
17,68 |
13,38 |
1:10638 |
0,009 |
| 1:100000 |
38,95 |
18,12 |
20,83 |
16,53 |
1:94269 |
0,001 |
| С-матрица |
43,16 |
23,03 |
20,13 |
нет данных |
нет данных |
нет данных |
| NTC |
нет |
нет |
– |
– |
– |
– |
Таким образом, результаты показывают, что путем данного анализа можно определять уровни аллеля L129 (A-матрица) на фоне аллеля F129 (C-матрица), меньшие 1:100000, до того как A-праймер ARMS (L129-аллельселективный праймер) станет связываться с неподходящей матрицей (фигура 12).
Третье предпринятое контрольное исследование конструировали для тестирования того, амплифицируются ли праймеры ARMS Pt129-C4 и Pt129-A14 с одинаковой эффективностью. Для того чтобы анализ ARMS/Scorpion был надежен, важно, чтобы выбранные аллельселективные праймеры ARMS амплифицировались примерно с одинаковой эффективностью в интервале концентраций ДНК-матрицы, которые, вероятно, будут тестироваться при анализе. Причина этого в том, что различие между двумя праймерами в Ct непосредственно соответствует частоте аллеля устойчивости в образце. Одним из путей такого тестирования является сравнение того, как изменяется  Ct в зависимости от концентрации матрицы. Строят график логарифмической зависимости ДНК на входе от Ct в зависимости от концентрации матрицы. Строят график логарифмической зависимости ДНК на входе от  Ct, и полученный в результате наклон должен составлять менее 0,1. Ct, и полученный в результате наклон должен составлять менее 0,1.
Для проверки эффективности амплификации праймеров Pt129-A14 и Pt129-C4 смесь 1:10 плазмидной ДНК мутант: дикий тип (описанную ранее) разбавляли 2-кратными разведениями примерно в 100-кратном интервале. Все разведения проводили в BSA в концентрации 1 мг/мл. Следующие разведения матрицы (чистая, 1:2, 1:4, 1:8, 1:16, 1:32, 1:64 и 1:128), контроли плазмидной ДНК только дикого типа и только мутантной, и контроль, содержащий только воду, тестировали в анализе ARMS/Scorpion с праймерами Pt129-C4, Pt129-A14, Pt129-S4, как описано выше.
| Таблица 27 |
| Результаты, полученные на контрольных ДНК-матрицах плазмиды дикого типа и мутантной плазмиды |
| Праймер |
Значение Ct – С-матрица (аллель F129) |
Значение Ct – A-матрица (аллель L129) |
 Ct Ct |
| Pt129-A14 |
37,77 |
22,6 |
15,17 |
| Pt1C4-29 |
19,07 |
нет А |
нет данных |
| Pt129-S4 |
18,28 |
17,77 |
– |
Различие в значении Ct для праймеров Pt129-A14 и Pt129-C4 на их правильной матрице составляло 22,6-19,07 = 3,53. Это значение необходимо вычитать из каждого  Ct, рассчитанного по эксперименту по относительной эффективности, для получения верного представления о соотношении каждого аллеля в образцах. Ct, рассчитанного по эксперименту по относительной эффективности, для получения верного представления о соотношении каждого аллеля в образцах.
| Таблица 28 |
Результаты эксперимента по относительной эффективности, показывающие  Ct для каждой концентрации матрицы Ct для каждой концентрации матрицы |
| Концентрация ДНК |
Log концентрации ДНК |
C Ct |
A Ct |
 Ct Ct |
Выверенное  Ct Ct |
| 128 |
2,107 |
18,46 |
24,92 |
6,46 |
2,93 |
| 64 |
1,806 |
19,14 |
25,74 |
6,6 |
3,07 |
| 32 |
1,505 |
20,86 |
27,92 |
7,06 |
3,53 |
| 16 |
1,204 |
22,1 |
29,52 |
7,42 |
3,89 |
| 8 |
0,903 |
22,39 |
29,43 |
7,04 |
3,51 |
| 4 |
0,602 |
23,45 |
30,5 |
7,05 |
3,52 |
| 2 |
0,301 |
24,31 |
34,44 |
7,13 |
3,6 |
| 1 |
0 |
25,14 |
31,95 |
6,82 |
3,29 |
Строили график зависимости  Ct от log концентрации ДНК, и вычисляли линию тренда с использованием Microsoft Excel (фигура 13). На фигуре показано, что наклон линии составлял 0,05, что меньше 0,1, таким образом, праймеры Pt129-A14 и Pt129-C4 амплифицируются по существу с одинаковой относительной эффективностью. Ct от log концентрации ДНК, и вычисляли линию тренда с использованием Microsoft Excel (фигура 13). На фигуре показано, что наклон линии составлял 0,05, что меньше 0,1, таким образом, праймеры Pt129-A14 и Pt129-C4 амплифицируются по существу с одинаковой относительной эффективностью.
Четвертая стадия испытания способа анализа представляла собой исследование того, может ли влиять на анализ ДНК растения-хозяина (в данном случае, травы Lollium perenne), например, в результате наличия последовательностей, которые могут случайно действовать в качестве матрицы в данной PCR. ДНК L. perenne присутствует в образцах, где собирают и тестируют непосредственно инфицированный P. aphanidermatum материал листьев.
Для исследования экстрагировали геномную ДНК из образца L. perenne (100 мг) с использованием Qiagen DNeasy Plant Mini Kit (образец вначале размалывали в микроцентрифужной пробирке объемом 1,5 мл, содержащей стальной шарик путем встряхивания в течение 10 минут в мельнице Centriprep Mixer Mill), и разбавляли 5-кратными серийными разведениями в бидистиллированной H2О с получением следующих концентраций: «чистый» (полученный непосредственно из препарата mini kit), 1 к 5, 1 к 25 и 1 к 125 (маточный раствор растительной ДНК к H2О). Также получали две смеси плазмидной ДНК аллель L129: аллель F129, 1:100 и 1:10000 (см. выше). Данные маточные растворы смешивали со снижением фона растительного материала с получением следующих исходных PCR: 1:100 аллель L129: аллель F129 + чистая растительная ДНК, 1:100 аллель L129: аллель F129 + разведенная 1 к 5 растительная ДНК, 1:100 аллель L129: аллель F129 + разведенная 1 к 25 растительная ДНК, 1:100 аллель L129: аллель F129 + разведенная 1 к 125 растительная ДНК, 1:10000 аллель L129: аллель F129 + чистая растительная ДНК, 1: 10000 аллель L129: аллель F129 + разведенная 1 к 5 растительная ДНК, 1:10000 аллель L129: аллель F129 + разведенная 1 к 25 растительная ДНК, 1:10000 аллель L129: аллель F129 + разведенная 1 к 125 растительная ДНК. Все они тестировались в анализе с праймерами Pt129-C4, Pt129-A14 и Pt129-S4, вместе с разведениями ДНК L. perenne, одной плазмидной ДНК в отношениях аллель L129: аллель F129, плазмидной ДНК дикого типа и мутантной плазмидной ДНК в концентрации 2×107 молекул/мкл, и контролем, содержащим только воду, как описано выше.
| Таблица 29 |
| Контрольные плазмидные ДНК дикого типа и мутантные плазмидные ДНК |
| Праймер |
Значение Ct – С-матрица (аллель F129) |
Значение Ct – A-матрица (аллель L129) |
 Ct Ct |
| Pt129-A14 |
37,23 |
22,49 |
14,74 |
| Pt129-C4 |
19,95 |
нет А |
нет данных |
| Pt129-S4 |
19,36 |
18,61 |
нет данных |
Различие в значении Ct для праймеров Pt129-A14 и Pt129-C4 на их правильной матрице составляло 22,49-19,97=2,54. Это значение необходимо вычитать из каждого  Ct для получения верного представления о соотношении каждого аллеля в образцах. Ct для получения верного представления о соотношении каждого аллеля в образцах.
| Таблица 30 |
| Результаты контрольного эксперимента, в котором оценивался вклад ДНК растения-хозяина (L. perenne) в производительность анализа |
| Матрица |
C Ct |
A Ct |
S Ct |
 Ct Ct |
Выверенное  Ct Ct |
Наблюдаемое отношение А:С |
Наблюдаемый %А |
| 1:100 (L129:F129) |
18,61 |
29,27 |
– |
10,66 |
8,12 |
1:227 |
0,36 |
| 1:100+чистая растительная |
20,57 |
30,56 |
– |
9,98 |
7,44 |
1:173 |
0,57 |
| 1:100+1:5 растительная |
19,41 |
29,09 |
– |
9,69 |
7,15 |
1:142 |
0,7 |
| 1:100+1:25 растительная |
18,83 |
29,3 |
– |
10,47 |
7,93 |
1:243 |
0,41 |
| 1:100+1:125 растительная |
18,54 |
29,99 |
– |
9,45 |
6,91 |
1:120 |
0,82 |
| 1:10000(L129:F129) |
19,18 |
34,76 |
– |
15,58 |
13,05 |
1:8480 |
0,012 |
| 1:10000+чистая растительная |
21,99 |
36,74 |
– |
14,76 |
12,22 |
1:4764 |
0,02 |
| 1:10000+1:5 растительная |
20,49 |
34,62 |
– |
14,12 |
11,58 |
1:3069 |
0,03 |
| 1:10000+1:25 растительная |
19,78 |
36,45 |
– |
15,3 |
12,76 |
1:6936 |
0,014 |
| 1:10000+1:125 растительная |
20,68 |
35,74 |
– |
15,06 |
12,52 |
1:5877 |
0,017 |
| Чистая растительная |
– |
– |
35,36 |
– |
– |
– |
– |
| 1:5 растительная |
– |
– |
36,27 |
– |
– |
– |
– |
| 1:25 растительная |
– |
– |
38,07(1 повтор.) |
– |
– |
– |
– |
| 1:125 растительная |
– |
– |
нет |
– |
– |
– |
– |
Когда в анализе тестировали смеси плазмидной ДНК гриба и ДНК L. perenne, не было обнаружено устойчивых изменений в значениях Ct, и поэтому наблюдаемый % C сравнивали со случаем, когда тестировали одну плазмидную ДНК гриба. Таким образом, ДНК L. perenne не оказывает значимого влияния на чувствительность определения устойчивого аллеля в данном анализе.
Стандартный праймер Pt129-S4 и праймер Scorpion могут взаимодействовать с ДНК L. perenne с получением подлежащего определения продукта PCR. Однако ни L129-, ни F129-аллельспецифический праймер в комбинации с праймером Scorpion не могут взаимодействовать с ДНК L. perenne.
Наличие ДНК L. perenne в образце P. aphanidermatum не будет оказывать какое-либо влияние на амплификацию аллелей L129 или F129, и полученную в результате оценку уровня аллеля L129.
Конечной стадией испытания является тестирование праймеров Pt129-C4, Pt129-A14 и Pt129-S4 на биологических образцах. Имеются различные возможные формы биологических образцов, которые могут использоваться в качестве исходного материала для анализов по мониторингу устойчивости. Они включают разрастания мицелия с агаровых чашек и газон, инфицированный P. aphanidermatum (L. perenne). Для тестирования образцов P. aphanidermatum с агаровых чашек на чашку добавляли малое количество стерильной бидистиллированной H2О (примерно 1-2 мл), и соскребали с агара мицелий с использованием стерильного одноразового скребка. Раствор мицелия собирали в стерильную микроцентрифужную пробирку объемом 1,5 или 2 мл и центрифугировали. Надосадочную жидкость удаляли, полученный в результате образце мицелия перемалывали с использованием FP120 Fastprep Instrument (Anachem Ltd., Anachem House, Charles Street, Luton, Bedfordshire LU20EB, Великобритания) или мельницы Spex CertiPrep 8000 Mixer Mill (Glen Creston Ltd), как описано в примере 2, и затем проводили получение геномной ДНК с использованием Qiagen DNeasy plant mini kit, также описанного в примере 2. Альтернативно, можно собрать 100 мг газона из L. perenne, инфицированного P. aphanidermatum, в микроцентрифужную пробирку объемом 1,5 или 2 мл, и размолоть способом, сходным с размалыванием материала мицелия, описанным выше. Затем использовали Qiagen DNeasy plant mini kit для экстракции общей ДНК инфицированного растения по протоколу производителя. Instrument (Anachem Ltd., Anachem House, Charles Street, Luton, Bedfordshire LU20EB, Великобритания) или мельницы Spex CertiPrep 8000 Mixer Mill (Glen Creston Ltd), как описано в примере 2, и затем проводили получение геномной ДНК с использованием Qiagen DNeasy plant mini kit, также описанного в примере 2. Альтернативно, можно собрать 100 мг газона из L. perenne, инфицированного P. aphanidermatum, в микроцентрифужную пробирку объемом 1,5 или 2 мл, и размолоть способом, сходным с размалыванием материала мицелия, описанным выше. Затем использовали Qiagen DNeasy plant mini kit для экстракции общей ДНК инфицированного растения по протоколу производителя.
Полученные препараты ДНК P. aphanidermatum и/или P. aphanidermatum/L. perenne разбавляли 1:10 и 1:100 в стерильной бидистиллированной H2О, и данные растворы матрицы тестировали, как описано выше, в анализе ARMS/Scorpion. Каждое разведение матрицы тестировали с праймерами Pt129-A14, Pt129-C4 и Pt129-S4; также включали плазмидную ДНК дикого типа и мутантную плазмидную ДНК, и контроль, содержащий только воду, в качестве положительных и отрицательных контролей, соответственно.
Пример 9
Конструирование способов анализа ARMS/Scorpion, способных определять аллели F129 и L129 в любом изоляте P. aphanidermatum.
Для определения другого единичного нуклеотидного полиморфизма, способного преобразовывать F129 в L129, может использоваться комбинация пары смысловых олигонуклеотидов ARMS/антисмыслового Scorpion, посредством которой можно различить только позицию 1 в кодоне 129 (т.е., присутствует ли в положении 1 остаток тимина или цитозина). Сходным образом, комбинация пары антисмысловых олигонуклеотидов ARMS/смыслового Scorpion, посредством которой можно различить все возможные остатки в положении 3 кодона 129, т.е. остаток тимина, цитозина, аденина или гуанина, способна определять альтернативные замены в положении 3, которые могут приводить к опосредованной L129 устойчивости. В комбинации данные способы анализа позиций 1 и 3 также предоставляют средство оценки уровня двойных мутаций, которые могут приводить к преобразованию F129 в L129 (кодоны: CTA и CTG).
В комбинации пары смысловых олигонуклеотидов ARMS/антисмыслового Scorpion может задействоваться праймер Scorpion, сконструированный ранее, как подробно описано в примере 4, где система определения включена в обратный PCR-праймер, использованный в комбинации со следующим ARMS-праймером для определения SNP и контрольным праймером.
Три прямых праймера ARMS, основанных на остатке тимина в положении 1 кодона 129:
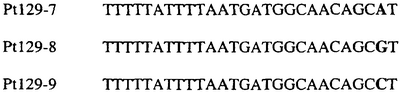
Три прямых праймера ARMS, основанных на остатке цитозина в положении 1 кодона 129:
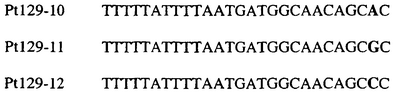
и контрольный праймер, сконструированный выше точечной мутации:
Pt129-S2 TATTTTTATTTTAATGATGGCAACAGC
В каждом из указанных выше праймеров ARMS основание -1 (3′-концевое основание последовательности праймера) соответствует участку целевой точечной мутации. Основания, показанные жирным шрифтом, отличаются от последовательности цитохрома b P. aphanidermatum дикого типа. В праймерах Pt129-7 и Pt129-10 позиция -2 была изменена с основания T на основание A. В праймерах Pt129-8 и Pt129-11 позиция -2 была изменена с основания T на основание G. В праймерах Pt129-9 и Pt129-12 позиция -2 была изменена с основания T на основание C. Данные изменения в последовательности были сделаны для дестабилизации гибридной молекулы матрица/праймер и достижения большей специфичности в отношении соответствующей матрицы любого продления праймера. При использовании с антисмысловым Scorpion, описанным в примере 4, полученный в результате ампликон составляет 174 н.п. в длину с праймерами ARMS и 176 н.п. в длину с контрольным праймером.
Для определения остатка тимина, цитозина, аденина или гуанина в третьем положении 129 кодона с использованием комбинации пары антисмысловых олигонуклеотидов ARMS/смыслового Scorpion смысловой праймер Scorpion, подробно описанный ранее в примере 6, где система определения включена в смысловой (прямой) PCR-праймер, может использоваться в комбинации со следующими антисмысловыми (обратными) ARMS-праймерами для определения SNP и контрольным праймером. Три обратных праймера ARMS, основанные на остатке тимина в положении 3 кодона 129:
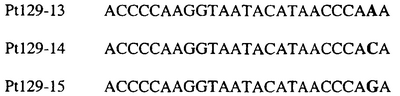
Следующий обратный праймер ARMS, основанный на остатке аденина в положении 3 кодона 129:
Pt129-A14 ACCCCAAGGTAATACATAACACGTT
Следующий обратный праймер ARMS, основанный на остатке цитозина в положении 3 кодона 129:
Pt129-C4 ACCCCAAGGTAATACATAACCCTTG
Три обратных праймера ARMS, основанные на остатке гуанина в положении 3 кодона 129:
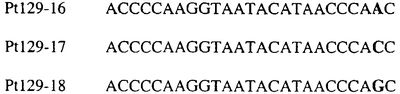
и контрольный праймер, сконструированный ниже точечной мутации:
Pt129-S4 TTGACCCCAAGGTAATACATAACCC
В каждом из указанных выше праймеров ARMS основание -1 (3′-концевое основание последовательности праймера) соответствует участку целевой точечной мутации. Основания, показанные жирным шрифтом, отличаются от последовательности цитохрома b P. aphanidermatum дикого типа. В праймерах Pt129-13 и Pt129-16 позиция -2 изменена с основания А на основание Т. В праймерах Pt129-14 и Pt129-17 позиция -2 изменена с основания А на основание G. В праймерах Pt129-15 и Pt129-18 позиция -2 изменена с основания А на основание C. В праймере Pt129-C4 позиция -3 изменена с основания T на основание A. В праймере Pt129-А14 позиция -3 изменена с основания T на основание С, и позиция -5 изменена с основания G на основание T. Данные изменения в последовательности были сделаны для дестабилизации гибридной молекулы матрица/праймер и достижения большей специфичности в отношении соответствующей матрицы любого продления праймера. Со смысловым праймером Scorpion полученный в результате ампликон составляет 110 н.п. в длину с праймерами ARMS и 113 н.п. в длину с контрольным праймером.
Все праймеры могут быть синтезированы Oswel DNA Service (Lab 5005, Medical and Biological Sciences Building, Саутгемптон). Перед применением праймеры разбавляли до 5 мкМ в общем объеме, равном 500 мкл, бидистиллированной, не содержащей нуклеаз H2О. Затем праймеры далее разбавляли до конечной концентрации 500 нМ в реакционных смесях PCR.
Пример 10
Идентификация двух новых образцов Plasmopara viticola, проявляющих сниженную чувствительность к фунгицидам-ингибиторам участка Qo
В течение 2000 г. собирали примерно 300 P. viticola из полевых местообитаний Европы. Их тестировали путем биоанализов селективной дозы на растениях с целью мониторинга сниженной чувствительности к фунгицидам-ингибиторам участка Qo, и также путем количественного PCR-анализа ARMS/Scorpion G143A (см. опубликованную заявку на выдачу Международного патента WO 00/66773). Устойчивость к QoI, как было показано, обычно ассоциируется с наличием аминокислоты аланина в положении 143 (по системе нумерации S. cerevisiae). Данная аминокислотная замена глицина на аланин в положении 143 в цитохроме b вызвана единицным нуклеотидным полиморфизмом с заменой гуанина на цитозин во второй положении кодона 143; причем в данном анализе происходит мониторинг уровня данного SNP. Во время программы мониторинга были обнаружены два образца, I 112 и I 116b, которые характеризовались сниженной чувствительностью к QoI при биоанализе селективной дозы на растениях, но имели в положении 143 только глицин, аминокислоту дикого типа. Их исследовали далее.
Для подтверждения сниженной чувствительности к QoI при биоанализе селективной дозы на данных образцах проводили биоанализ дозы-ответа in planta. Биоанализ дозы-ответа in planta проводили на саженцах виноградной лозы в возрасте 10-14 суток, выращенных в горшках размером 1,5″. Шесть отношений азоксистробина выбирали по подготовительным тестам, как наиболее подходящие для выявления каких-либо сдвигов в чувствительности к азоксистробину в биоанализе дозы-ответа (таблица 31).
| Таблица 31 |
| Отношения азоксистробина, использованные в биоанализе дозы-ответа in planta |
| Отношение |
Концентрация азоксистробина |
| 1 |
8,0 м.д. |
| 2 |
4,0 м.д. |
| 3 |
2,0 м.д. |
| 4 |
1,0 м.д. |
| 5 |
0,5 м.д. |
| 6 |
0,25 м.д. |
Препарат азоксистробина, использованный для всех тестов, представлял собой P53, порошок технического качества с чистотой азоксистробина > 97%. Его использовали постоянно для всех тестов для того, чтобы избежать любых вариаций, вызванных различиями в химической чистоте или физическом состоянии. На один образец и на одно отношение азоксистробина использовали пять саженцев, и 10 саженцев использовали для контроля без азоксистробина (опрыскивание только деионизованной водой).
Химикат распыляли пульверизатором Devilbiss с давлением 10 фунтов/кв. дюйм, с максимальным удерживанием препарата на приосевой поверхности 2-го истинного листа (тестовый лист) каждого саженца, следя, чтобы раствор постоянно испытывал в пульверизаторе круговое перемешивание для предотвращения локальных колебаний концентрации азоксистробина. Затем саженцы аккуратно помещали в ростовую камеру (День: 24°C, относительная влажность 60%, 4-5000 люкс; Ночь: 17°C, относительная влажность 95%; длина дня: 16 часов) на 24 часа.
После этого каждый тестовый лист инокулировали образцами I112 и I116b. Оба образца пассировали через 1 цикл субкультуры на виноградных лозах размером 3″ до перемещения на хранение при низкой температуре (фигура 14). Прививочный материал от каждого образца, полученный с виноградных лоз размером 3″, разводили до 5000 спорангиев на мл с использованием сухой счетной камеры (улучшенная Neubayer, глубина 0,1 мм, 1/400 мм2, Hawksley Crystallite, BS 748).
Образцы инокулировали пульверизатором Devilbiss с давлением 10 фунтов/кв. дюйм, с максимальным удерживанием препарата на приосевой поверхности тестируемого листа каждого саженца, с частым круговым перемешиванием раствора в пульверизаторе для удержания спорангиев от накопления на дне. Тестовые саженцы инкубировали при окружающей температуре в течение двадцати четырех часов. Затем саженцы перемешивали случайным образом и аккуратно помещали в ростовую камеру (День: 24°C, относительная влажность 60%, 4-5000 люкс; Ночь: 17°C, относительная влажность 95%; длина дня: 16 часов) на 6 суток перед возвращением в комнатную температуру на следующие 24 часа для стимулирования споруляции.
Саженцы оценивали непосредственно после их второго изъятия из помещения с окружающей температурой. Оценка заболевания основывалась на процентной площади листа, покрытой спорулирующими повреждениями и обесцвечиванием, и фиксировали с 5% приращением. Счет, равный 2%, придавали листьям с единственным, малым повреждением, что указывало на отсутствие полного контроля над патогенным организмом. Затем данные анализировали стандартной программой AGSTAT. В анализе использовали регрессию OLS и арксинус-преобразование, и рассчитывали значения EC50 и EC95 с соответствующими им 95%-ными доверительными интервалами, и их показанные в таблице 32.
| Таблица 32 |
| Значения EC50 и EC95 изолятов P. viticola I112 и I116b |
| Вариант |
ЕС50 |
95%-ный доверительный интервал |
ЕС95 |
95%-ный доверительный интервал |
| K2075 (чувствительный контрольный изолят) |
0,04 |
0,00-0,10 |
0,51 |
0,30-0,72 |
| 00I116B |
0,49 |
0,29-0,73 |
2,84 |
2,06-4,32 |
| 00I112 |
1,98 |
1,10-4,05 |
11,75 |
5,68-53,25 |
Оба образца I116B и I112 проявили сниженную чувствительность к азоксистробину с более высокими значениями EC50 и EC95 по сравнению с чувствительным контрольным изолятом. Оба этих образца затем исследовали далее на молекулярном уровне с целью изучения механизма сниженной чувствительности к азоксистробину.
Пример 11
Направленное клонирование и определение последовательности гена цитохрома b образцов P. viticola I112 и I116b по сравнению с таковым, относящимся к дикому типу и изоляту с ранее подтвержденной устойчивостью.
Характеристику гена cyt b из образцов P. viticola I112 и I116b проводили с использованием описанного ниже способа.
Образцы P. viticolaI112 и I116b для анализа получали следующим способом. Виноградные листья, характеризующиеся симптомами спорулирующей пушистой милдью, помещали в стеклянную мензурку. Затем к каждому образцу добавляли примерно 400 мл деионизованной воды, и листья перемалывали для высвобождения спорангиев. Полученную в результате суспензию спорангиев фильтровали через два слоя муслина, затем наливали в стерильные пластиковые универсальные пробирки объемом 50 мл и центрифугировали примерно в течение 2 мин при 4000 об/мин в настольной центрифуге (MSE, Centaur 2). Через 2 минуты на дне каждой пробирки был виден осадок спорангиев; надосадочные жидкости декантировали, и эквивалентные осадки объединяли и ресуспендировали в 1 мл стерильной деионизованной воды. Затем образец спорангиев переносили в стерильную микроцентрифужную пробирку объемом 1,5 мл, и центрифугировали в течение одной минуты при 13000 об/мин. Надосадочную жидкость удаляли, помещали образцы в температуру -80°C до необходимости использования.
Из указанных выше образцов выделяли геномную ДНК с использованием наборов Qiagen DNeasy Plant Mini Kit (каталожный номер 69014) по инструкции производителя со следующими модификациями. 400 мкл буфера AP1 и 4 мкл раствора РНКазы A добавляли к каждому образцу, и ресуспендировали осадок. Затем раствор спорангиев переносили в стерильную микроцентрифужную пробирку объемом 2 мл, добавляли стальной шарик, и встряхивали образцы в течение 10 минут на мельнице Spex Certiprep 8000 Mixer Mill (Glen Creston Ltd) для измельчения образца. Затем надосадочную жидкость переносили в микроцентрифужную пробирку объемом 1,5 мл, и завершали получение ДНК, следуя стадиям 3-13 протоколу набора Qiagen DNeasy Plant Mini Kit, с проведением конечной элюции геномной ДНК 2×100 мкл буфера AE.
Затем для PCR-амплификации гена cyt b проводили 10-кратное серийное разведение обоих препаратов геномной ДНК с использованием стерильной бидистиллированной H2О, с получением следующих разведений: 1:10, 1:100 и 1:1000, и применяли их в качестве матрицы в реакциях PCR.
Наиболее подверженная изменениям область гена цитохрома b амплифицировали путем PCR из изолятов I112 и I116b с использованием пары праймеров 17/15.
Праймер 17 = 5’AAA TAA CGG TTG GTT AAT TCG 3′
Праймер 15 = 5’TCT TAA AAT TGC ATA AAA AGG 3′
Данные праймеры специфичны в отношении гена cyt b P. viticola, и покрывают аминокислоты 73-283. Данная область включает все аминокислотные положения, за исключением положения 292, которые, как известно по литературе, придают устойчивость к QoI модельным организмам.
PCR проводили с использованием гранул для PCR с Taq-полимеразой Ready.To.Go® (Amersham Phamacia Biotech). К каждой грануле для PCR добавляли 10 мкл матрицы, 2,5 мкл прямого праймера 17, 2,5 мкл обратного праймера, где оба праймера были в концентрации 10 пмоль/мкл, с получением конечной концентрации 1 пмоль/мкл, и 10 мкл бидистиллированной H2О для достижения общего объема реакционной смеси, равного 25 мкл. Условия циклов PCR были следующими: начальная инкубация при 94°C в течение 10 минут, с последующими 30 циклами, включающими 94°С в течение 45 секунд, 52°C в течение 45 секунд и 72°C в течение 1 минуты 30 секунд. Для окончания PCR также включали стадию конечного продления при 72°C в течение 10 минут. Продукты PCR визуализировали в 1% TBE-агарозном геле, и продукты ожидаемого размера (-600 н.п.) присутствовали во всех полосах (кроме контроля, содержащего только воду).
Три продукта PCR от каждого образца, т.е. продукты от разведений ДНК-матрицы 1:10, 1:100 и 1: 1000, объединяли, и данные смеси клонировали в вектор pCR2. 1-TOPO с использованием TOPO TA Cloning kit от Invitrogen (K4500-01), следуя инструкциям производителя. 16 колоний из каждого образца отбирали для плазмидных минипрепаратов (miniprep). Минипрепараты выполняли на Qiagen Biorobot. Плазмидные ДНК затем расщепляли EcoRl, и продукты расщепления визуализировали в 1% TBE-агарозном геле для установления того, какие образцы содержали вставки правильного размера. Затем определяли последовательность 10 клонов со вставками ожидаемого размера с использованием прямых и обратных праймеров M13 (последовательность определяли с использованием автоматического секвенатора ABI377XL). Данные по последовательности анализировали с использованием подходящего биоинформатического программного обеспечения Seqman, Editseq и Macaw.
Предсказанную последовательность гена цитохрома b из каждого образца, I112 и I116b, сравнивали затем с известными последовательностями cyt b P. viticola дикого типа и относящимися к устойчивости, которые были определены ранее. Нуклеотидные и аминокислотные выравнивания показаны на фигурах 15 и 16, где аминокислотные последовательности предсказывали с использованием «Mold, Protozoan and Coelenterate Mitochondrial Code-Number 4» как описано в Genetic Codes (таксономия NCBI):
Ключевые точки данного анализа включали следующее:
– I112 – последовательность цитохрома b из всех 10 клонов характеризовалась единичным нуклеотидным полиморфизмом (SNP) с заменой T на C в первом положении кодона 129, по сравнению с последовательностью дикого типа. В результате кодировалась аминокислота лейцин в положении 129. Все клоны кодировали аминокислоту дикого типа в положении 143 и другие точечные мутации отсутствовали. Дикий тип 129 = TTT (фенилаланин, F). Мутант 129 = CTT (лейцин, L); – I116b – 4 клона из 10 клонов с определенной последовательностью были идентичными – они были идентичны известной последовательности P. viticola дикого типа, кодирующей глицин в положении 143 и фенилаланин в положении 129. Другие 6 клонов из 10 клонов с определенной последовательностью также были идентичными. Они кодировали аминокислоту лейцин в положении 129. Это опять было следствием SNP с заменой T на C в первом положении кодона 129. Данные 6 клонов все кодировали аминокислоту дикого типа глицин в положении 143, и другие точечные мутации отсутствовали;
– аминокислотная замена фенилаланина на лейцин в положении 129 в образцах I112 и I116b, вероятно, ассоциирована с устойчивостью к стробилуринам, как это показано наличием ответа на максимальную дозу азоксистробина в биоанализе in planta;
– данный единичный нуклеотидный полиморфизм (SNP), вызывающий аминокислотную замену F на L, является первым SNP такого рода, наблюдаемым у P. Viticola;
– аминокислотная замена F129L, однако, наблюдалась ранее в полевом изоляте P. aphanidermatum, и, как было показано, была ассоциирована с устойчивостью к фунгицидам-ингибиторам участка Qo (см. выше);
– в данных двух патогенных организмах аминокислотная замена F129L вызвана разными SNP.
P. viticola: TTT на CTT.
P. aphanidermatum: TTC на TTA.
При более подробном рассмотрении данных результатов для образца I112 9 из 10 клонов обладали идентичной последовательностью, и 1 клон характеризовался отличиями в последовательности, которая отличалась 2 основаниями. Это, по-видимому, опять является следствием ошибок, произошедших в PCR. Для образца I116b 1 из 4 клонов, которые дали идентичные последовательности, содержал другие ошибки в последовательности, которая отличалась 4 основаниями, и 1 из 6 клонов, которые дали идентичные последовательности, содержал другие ошибки в последовательности, которая отличалась 10 основаниями. Данное явление возникает по причине неясных последствий секвенирования. Это показано на фигуре f.
Пример 12
Конструирование праймеров ARMS, способных отличать аллели F129 и L129, обнаруженные в P. viticola дикого типа и образцах I112 и I116b
С использованием последовательностей генов цитохрома b P. viticola дикого типа и образцов I112 and I116b, полученных по примеру 11, конструировали различные специфические праймеры ARMS для определения наличия или отсутствия данной точечной мутации F129L.
Шесть обратных праймеров ARMS, основанных на последовательности дикого типа:
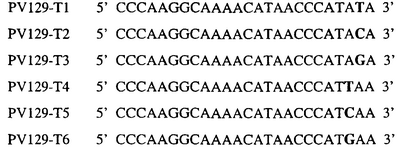
Шесть обратных праймеров ARMS, основанных на мутации F129L:
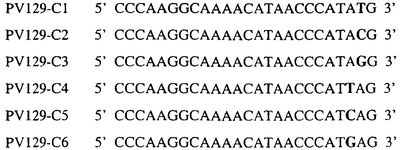
и контрольный обратный праймер, сконструированный ниже точечной мутации:
PV129-S 5′ GTCCCCAAGGCAAAACATAACCCAT 3′
В каждом из указанных выше праймеров ARMS основание -1 (3′-концевое основание последовательности праймера) соответствует участку целевой точечной мутации. Основания, показанные жирным шрифтом, отличаются от последовательности цитохрома b P. viticola дикого типа. В праймерах PV129-T1 и PV129-C1 позиция -2 была изменена с основания A на основание T (в обратной комплементарной цепи). В праймерах PV129-T2 и PV129-C2 позиция -2 была изменена с основания A на основание C (в обратной комплементарной цепи). В праймерах PV129-T3 и PV129-C3 позиция -2 была изменена с основания A на основание G (в обратной комплементарной цепи). В праймерах PV129-T4 и PV129-C4 позиция -2 была изменена с основания A на основание T (в обратной комплементарной цепи). В праймерах PV129-T5 и PV129-C5 позиция -3 была изменена с основания A на основание C (в обратной комплементарной цепи). В праймерах PV129-T6 и PV129-C6 позиция -3 была изменена с основания A на основание G (в обратной комплементарной цепи). Как и ранее, данные изменения в последовательности были сделаны для дестабилизации гибридной молекулы матрица/праймер и достижения большей специфичности в отношении соответствующей матрицы любого продления праймера. Примеры из литературы показывают, что дестабилизация праймера ARMS снижает риск затравки праймером синтеза неправильной матрицы (Newton et al, Nucleic Acid Research 17 (7) 2503-2516 1989).
Все праймеры были синтезированы Oswel DNA Service (Lab 5005, Medical and Biological Sciences Building, Саутгемптон). Перед применением каждый праймер разбавляли до 5 мкМ в общем объеме, равном 500 мкл, бидистиллированной, не содержащей нуклеаз H2О. Затем праймеры далее разбавляли до конечной концентрации 500 нМ в реакционных смесях PCR.
Пример 13
Конструирование праймера Scorpion для применения при мониторинге аллельного статуса F129 и L129 P. viticola
Вновь используя последовательности генов цитохрома b P. viticola дикого типа и образцов I112 и I116b, полученных по примеру 11, конструировали олигонуклеотиды Scorpion для определения селективной амплификации аллелей дикого типа и L129 путем включения системы определения в прямой PCR-праймер, сконструированный для применения с ARMS-определением SNP и стандартными праймерами, описанными в примере 12. Полученный в результате ампликон составлял 161 н.п. в длину с праймерами ARMS, и 164 н.п. в длину с контрольным праймером. для определения селективной амплификации аллелей дикого типа и L129 путем включения системы определения в прямой PCR-праймер, сконструированный для применения с ARMS-определением SNP и стандартными праймерами, описанными в примере 12. Полученный в результате ампликон составлял 161 н.п. в длину с праймерами ARMS, и 164 н.п. в длину с контрольным праймером.
Конкретно, праймер Scorpion конструировали с использованием программ Oligo 5 и MFold (MFold предсказывает оптимальные и субоптимальные вторичные структуры для молекул РНК или ДНК с использованием способа минимизации энергии по Zucker (Zucker, M. (1989) Science 244,48-52; SantaLucia, J. Jr. (1998). Proc. Natl. Acad. Sci. USA 95, 1460-1465)).
Последовательность полученного в результате праймера Scorpion P. viticola представляла собой: 5′ FAM-CCGCGCGCCATAAAGCTTCTCTAGGTGTAACGCGCGG MR-HEG-CATATTTTTAGGGGTTTGTATTACGG 3′, где подчеркнутые области представляют собой части, образующие шпильку (когда праймер Scorpion ни с чем не взаимодействует); FAM представляет собой флуоресцеиновый краситель; MR (метиловый красный) является не флуоресцирующим гасителем, привязанным к остатку урацила, и HEG представляет собой блокирующий репликацию мономер гексетиленгликоля. Последовательность, показанная курсивом, представляет собой последовательность обратного праймера, а последовательность, показанная жирным шрифтом, представляет собой последовательность Scorpion, которая связывается с аутентичным продуктом продления обратного праймера cyt b P. viticola.
Стебельчатопетлевая вторичная структура данного праймера Scorpion может быть визуализирована с помощью программы MFold (см. фигуру 6) и, как предсказано, обладает энергией, равной -2,3 ккал/моль, не будучи гибридизованной с целевым геном cyt b. Однако в присутствии продукта продления структура шпильки разделяется, поскольку зондовая последовательность праймера Scorpion связывается с продуктом продления с предсказанной энергией -5,1 ккал/моль. Это отделяет краситель FAM от его гасителя, вызывая флуоресцентное излучение, определяемое, например, прибором ABI Prism 7700. Поэтому отжиг элемента Scorpion на вновь синтезированную цепь является энергетически выгодным по сравнению со стебельчатопетлевой структурой Scorpion.
Праймер Scorpion был синтезирован Oswel DNA Service (Lab 5005, Medical and Biological Sciences Building, Саутгемптон). Перед применением данный праймер разбавляли до 5 мкМ в общем объеме, равном 500 мкл, бидистиллированной, не содержащей нуклеаз H2О. Затем праймер далее разбавляли до конечной концентрации 500 нМ в реакционных смесях PCR.
Пример 14
Подтверждение применения праймеров ARMS и Scorpions для определения и количественного анализа SNP F129L, обнаруженного в образцах I112 и I116b
При всех анализах определения SNP F129L при помощи ARMS/Scorpion в реакционные смеси включали фермент AmpliTaq Gold (Applied Biosystems) в концентрации 1 единица/25 мкл реакционной смеси. Реакционная смесь также содержала 1× буфер (10 мМ Tris-HCl (pH 8,3), 50 мМ KCl, 3,5 мМ MgCl2, 0,01% желатина) и 100 мкМ dNTP (Amersham Pharmacia Biotech). Амплификации проводили в приборе ABI 7700 с целью длительного мониторинга флуоресценции. Условия циклической реакции включали предварительный цикл при 95°C в течение 10 минут, с последующими 50 циклами при 95°C в течение 15 секунд и при 60°C в течение 45 секунд. Флуоресценцию отслеживали во время стадии отжига/продления в течение всех циклов.
Применение праймеров ARMS в таких анализах вначале проверяли с использованием в качестве матрицы плазмидной ДНК в различных концентрациях. Эту процедуру проводили для проверки специфичности и чувствительности конструирования праймеров. Часть последовательности гена цитохрома b дикого типа и соответствующий участок, содержащий мутацию F129L, амплифицированные от двух образцов P. viticola, клонировали в вектор TA pCR2.1 (Invitrogen), как описано ранее в примере 11. 150 мкл бактериальной культуры от 10 трансформантов из каждого случая клонирования, отобранные для получения препаратов плазмидной ДНК (Qiagen) (см. пример 11), сохраняли перед получением данных препаратов и хранили при 4°C. После анализа последовательности отмечали образцы плазмидной ДНК мутантов и дикого типа, которые не содержали различий по последовательности по сравнению с консенсусной последовательностью. Бактериальную культуру, из которой происходили данные последовательности плазмидной ДНК мутантов и дикого типа, собирали для максипрепаратов (maxiprep) плазмидной ДНК (Qiagen) по протоколу производителя. Полученную в результате плазмидную ДНК подвергали количественному анализу и разбавляли до концентрации 1 мкг/мкл (2×1011 молекул/мкл) с использованием стерильной бидистиллированной H2О.
Конструкции плазмидной ДНК дикого типа и мутантов cyt b далее разбавляли до концентрации 10 пг/мкл (или 2×106 молекул/мкл) в бидистиллированной H2O, и использовали в качестве матрицы для подтверждения специфичности праймеров ARMS. Каждый праймер ARMS тестировали на матрице дикого типа и мутантной матрице плазмид ДНК, а также на контроле без матрицы (только вода) при условиях PCR, описанных выше. Результаты приведены в таблице 33.
| Таблица 33 |
| Результаты контрольного эксперимента, в котором тестировали специфичность праймеров ARMS, сконструированных для амплификации аллелей F129 и L129 в P. viticola |
| Праймер |
WtCt |
MutCt |
 Ct Ct |
Наблюдаемое отношение Wt:Mut |
Амплификация NTC |
| Pv129-Wt1 |
17,72 |
32,31 |
14,59 |
24662:1 |
1 повтор |
| Pv129-Wt2 |
16,96 |
30,88 |
13,92 |
15500:1 |
нет |
| Pv129-Wt3 |
17,606 |
31,8 |
14,19 |
18690:1 |
1 повтор |
| Pv129-Wt4 |
17,10 |
27,26 |
10,16 |
1144:1 |
нет |
| Pv129-Wt5 |
16,32 |
28,39 |
12,07 |
4300:1 |
нет |
| Pv129-Wt6 |
18,24 |
32,99 |
14,75 |
27554:1 |
1 повтор |
| Pv129-Mut1 |
30,35 |
17,99 |
12,36 |
1:5257 |
1 повтор |
| Pv129-Mut2 |
29,56 |
16,45 |
13,11 |
1:8841 |
1 повтор |
| Pv129-Mut3 |
27,28 |
16,29 |
10,99 |
1:2034 |
нет |
| Pv129-Mut4 |
30,8 |
18,44 |
12,36 |
1:5257 |
2 повтора |
| Pv129-Mut5 |
28,97 |
16,14 |
12,83 |
1:7281 |
2 повтора |
| Pv129-Mut6 |
31,29 |
20,42 |
10,87 |
1:1872 |
нет |
| Pv129S |
17,0 |
17,22 |
– |
– |
нет |
F129-селективный праймер ARMS PV129-Wt6 характеризовался наибольшим интервалом ( Ct) между амплификацией на подходящей и неподходящей матрице, а L129-селективный праймер ARMS PV129-Mut5 характеризовался вторым по величине интервалом ( Ct) между амплификацией на подходящей и неподходящей матрице, а L129-селективный праймер ARMS PV129-Mut5 характеризовался вторым по величине интервалом ( Ct) между амплификацией на подходящей и неподходящей матрице, но наименьшие Ct на правильной матрицы выбирали для дальнейшего анализа. Ct) между амплификацией на подходящей и неподходящей матрице, но наименьшие Ct на правильной матрицы выбирали для дальнейшего анализа.
После селекции праймера ARMS дикого типа PV129-T6 и мутантного праймера ARMS PV129-C5 для определения точечной мутации требовалось дальнейшее испытание данного способа анализа для полного выявления чувствительности определения до ее применения для тестирования биологических образцов на предмет наличия мутации L129. Вначале пару выбранных праймеров ARMS PV129-T6 и PV129-C5 тестировали в пределах серии 10-кратных разведений плазмидной ДНК-матрицы дикого типа (F129) и мутантной ДНК-матрицы (L129) для выяснения того, как варьирует интервал специфичности в зависимости от концентрации матрицы. Кассеты плазмидной ДНК дикого типа и мутантной плазмидной ДНК, описанные ранее, разбавляли в растворе бычьего сывороточного альбумина (BSA) (порошок фракции V, минимум 96%, Sigma A9647) с концентрацией 1 мг/мл серией 10-кратных разведений в пределах 6 порядков величины, покрывающих интервал концентраций от 2×108 молекул/мкл до 2×102 молекул/мкл. Обе плазмидные ДНК-матрицы и контроль без матрицы (только вода) тестировали в анализе ARMS/Scorpion с использованием выбранных праймеров ARMS и контрольного праймера, как описано выше. Результаты суммированы в таблицах 34 и 35.
| Таблица 34 |
| Тестирование F129-селективного праймера ARMS PV129-Wt6 в пределах интервала разведений плазмидной ДНК-матрицы |
| Концентрация плазмиды |
Wt (L129) Ct |
Mut (F129) Ct |
 Ct Ct |
Наблюдаемое отношение Wt:Mut |
| 2×108 |
15,46 |
30,166 |
14,71 |
26801:1 |
| 2×107 |
16,88 |
32,66 |
15,78 |
56267:1 |
| 2×106 |
21,38 |
36,441 |
15,061 |
34183:1 |
| 2×105 |
23,042 |
– |
– |
– |
| 2×104 |
26,83 |
– |
– |
– |
| 2×103 |
30,938 |
– |
– |
– |
| 2×102 |
35,75 |
– |
– |
– |
| Таблица 35 |
| Тестирование L129-селективного праймера ARMS PV129-Mut5 в пределах интервала разведений плазмидной ДНК-матрицы |
| Концентрация плазмиды |
Wt (L129) Ct |
Mut (F129) Ct |
 Ct Ct |
Наблюдаемое отношение Wt:Mut |
| 2×108 |
29,96 |
14,90 |
15,06 |
1:34159 |
| 2×107 |
31,11 |
15,94 |
15,18 |
1:37122 |
| 2×106 |
32,76 |
17,79 |
14,97 |
1:32094 |
| 2×105 |
38,26 |
22,55 |
15,71 |
1:53602 |
| 2×104 |
39,47 |
24,83 |
14,64 |
1:25532 |
| 2×103 |
45,36 |
28,41 |
16,95 |
1:126607 |
| 2×102 |
|
32,927 |
– |
– |
Интервал специфичности был постоянным по всему интервалу концентраций матрицы для F129- и L129-аллельселективных праймеров PV129-Wt6 и PV129-Mut5.
Во втором контрольном исследовании было задействовано тестирование чувствительности определения выбранными F129- и L129-аллельселективными праймерами PV129-Wt6 и PV129-Mut5. Плазмидную ДНК с аллелем L129 в концентрации 2×107 молекул/мкл разбавляли фоновым количеством плазмидной ДНК с аллелем F129 в постоянной концентрации 2×107 молекул/мкл с образованием следующих отношений аллелей L129 и F129: 1:1, 1:10, 1:100, 1:1000, 1:10000 и 1:100000. Конечная концентрация плазмиды в реакционной смеси PCR составляла 1×108 молекул/мкл. Полученные препараты тестировали, наряду с плазмидой дикого типа, мутантной плазмидой и контролем, содержащим только воду, с праймерами PV129-Wt6, PV129-Mut5 в анализе, описанном выше. Результаты показаны в таблице 36.
| Таблица 36 |
| Результаты, показывающие чувствительность определения праймерами ARMS Pv129-wt6 и Pv129-mut5 |
| ДНК-матрица |
Ct мутантного аллеля |
Ct аллеля дикого типа |
 Ct Ct |
Выверенное  Ct (2,29) Ct (2,29) |
Наблюдаемое отношение С:Т |
% мутантного аллеля |
| 1:1 |
17,24 |
20,02 |
-2,81 |
0,11 |
1:1,08 |
48,09 |
| 1:10 |
20,16 |
20,66 |
-0,5 |
2,42 |
1:5,35 |
15,74 |
| 1:100 |
23,53 |
19,06 |
4,47 |
7,23 |
1:150 |
0,66 |
| 1:1000 |
25,45 |
18,87 |
6,58 |
9,5 |
1:724 |
0,14 |
| 1:10000 |
27,75 |
18,89 |
8,86 |
11,78 |
1:3516 |
0,028 |
| 1:100000 |
29,05 |
20,01 |
9,04 |
11,96 |
1:3984 |
0,025 |
Таким образом, результаты показывают, что путем данного анализа можно определять уровни аллеля L129 (мутантного) на фоне аллеля F129 (дикого типа), составляющие 1:10000, до того как праймер PV129-mut5 (L129-аллельселективный праймер) станет связываться с неподходящей матрицей.
Пример 15
Дальнейшая попытка конструирования праймера Scorpion для применения при мониторинге аллельного статуса F129 и L129 P. viticola
Все результаты анализа RMS/Scorpion до определения SNP F129L в P. viticola показали низкий уровень флуоресценции при определении продукта PCR даже при высоких концентрациях плазмидной ДНК. Это может приводить к ненадежному определению продукта PCR в анализе с низкими концентрациями ДНК-матрицы. Поэтому праймер Scorpion реконструировали, как описано выше.
Последовательность полученного в результате праймера Scorpion P. viticola представляла собой: 5’FAM-CCGGCCCCCATAAAGCTTCTCTAGGTGTAAGGGCCGG MR-HEG-CATATTTTTAGGGGTTTGTATTACGG, где подчеркнутые области представляют собой части, образующие шпильку (когда праймер Scorpion ни с чем не взаимодействует); FAM представляет собой флуоресцеиновый краситель; MR (метиловый красный) является не флуоресцирующим гасителем, привязанным к остатку урацила, и HEG представляет собой блокирующий репликацию мономер гексетиленгликоля. Последовательность, показанная курсивом, представляет собой последовательность прямого праймера, а последовательность, показанная жирным шрифтом, представляет собой последовательность Scorpion, которая связывается с аутентичным продуктом продления прямого праймера cyt b P. viticola.
Стебельчатопетлевая вторичная структура данного праймера Scorpion может быть визуализирована с помощью программы MFold и, как предсказано, обладает энергией, равной -1,3 ккал/моль, не будучи гибридизованной с целевым геном cyt b. Однако в присутствии продукта продления структура шпильки разделяется, поскольку зондовая последовательность праймера Scorpion связывается с продуктом продления с предсказанной энергией -4,5 ккал/моль. Это отделяет краситель FAM от его гасителя, вызывая флуоресцентное излучение, определяемое, например, прибором ABI Prism 7700. Поэтому отжиг элемента Scorpion на вновь синтезированную цепь является энергетически выгодным по сравнению с стебельчатопетлевой структурой Scorpion.
Праймер Scorpion был синтезирован Oswel DNA Service (Lab 5005, Medical and Biological Sciences Building, Саутгемптон). Перед применением данный праймер разбавляли до 5 мкМ в общем объеме, равном 500 мкл, бидистиллированной, не содержащей нуклеаз H2О. Затем праймеры далее разбавляли до конечной концентрации 500 нМ в реакционных смесях PCR.
Пример 16
Дальнейшее подтверждение применения праймеров ARMS и Scorpions для определения и количественного анализа SNP F129L в P. viticola
Праймер Scorpion, описанный в примере 15, использовали в комбинации с выбранными ранее праймерами ARMS, описанными в примере 14, в следующих контрольных исследованиях с целью выявления чувствительности определения. Вначале пару выбранных праймеров ARMS PV129-T6 и PV129-C5 тестировали в пределах серии 10-кратных разведений плазмидной ДНК-матрицы дикого типа (F129) и мутантной ДНК-матрицы (L-129) для выяснения того, как варьирует интервал специфичности в зависимости от концентрации матрицы. Кассеты плазмидной ДНК дикого типа и мутантной плазмидной ДНК, описанные ранее, разбавляли в растворе бычьего сывороточного альбумина (BSA) (порошок фракции V, минимум 96%, Sigma A9647) с концентрацией 1 мг/мл серией 10-кратных разведений в пределах 6 порядков величины, покрывающих интервал концентраций от 2×108 молекул/мкл до 2×102 молекул/мкл. Обе плазмидные ДНК-матрицы и контроль без матрицы (только вода) тестировали в анализе ARMS/Scorpion с использованием выбранных праймеров ARMS и контрольного праймера, как описано выше. Результаты суммированы в таблицах 37 и 38.
| Таблица 37 |
| Тестирование L129-праймера ARMS PV129-Mut5 в пределах интервала разведений плазмидной ДНК-матрицы с праймером Scorpion, сконструированном в примере 15 |
| Концентрация |
Ct мутанта |
Ct дикого типа |
Дельта Ct |
Наблюдаемое отношение Wt:Mut |
| 2×108 |
12,43 |
28,68 |
16,25 |
1:77936 |
| 2×107 |
16,87 |
30,33 |
13,46 |
1:11268 |
| 2×106 |
19,85 |
34,25 |
14,41 |
1:21769 |
| 2×105 |
22,84 |
37,44 |
14,60 |
1:24834 |
| 2×104 |
25,20 |
40,45 |
15,34 |
1:41476 |
| 2×103 |
28,17 |
39,65 |
11,48 |
1:2856 |
| 2×102 |
31,90 |
40,01 |
8,10 |
1:274 |
| Таблица 38 |
| Тестирование F129-праймера ARMS PV129-Wt6 в пределах интервала разведений плазмидной ДНК-матрицы с праймером Scorpion, сконструированном в примере 15 |
| Концентрация |
Ct мутанта |
Ct дикого типа |
Дельта Ct |
Наблюдаемое отношение Wt:Mut |
| 2×108 |
30,50 |
15,69 |
14,81 |
28725:1 |
| 2×107 |
33,95 |
18,45 |
15,50 |
46341:1 |
| 2×106 |
37,97 |
23,02 |
14,95 |
31652:1 |
| 2×105 |
39,57 |
25,76 |
13,81 |
14362:1 |
| 2×104 |
43,09 |
28,51 |
14,59 |
24662:1 |
| 2×103 |
45,04 |
32,56 |
12,48 |
5173:1 |
| 2×102 |
45,32 |
35,40 |
9,92 |
969:1 |
Интервал специфичности был постоянным по всему интервалу концентраций матрицы для F129- и L129-аллельселективных праймеров PV129-Wt6 и PV129-Mut5, за исключением самых низких концентраций матрицы.
Во втором контрольном исследовании было задействовано тестирование чувствительности определения выбранными F129- и L129-аллельселективными праймерами PV129-Wt6 и PV129-Mut5 с праймером Scorpion, сконструированном в примере 15. Эксперимент проводили, как описано в примере 14, а результаты показаны в таблице 39.
| Таблица 39 |
| Результаты, показывающие чувствительность определения праймерами ARMS Pv129-wt6 и Pv129-mut5 с праймером Scorpion, сконструированном в примере 15 |
| ДНК-матрица |
Ct мутантного аллеля |
Ct аллеля дикого типа |
 Ct Ct |
Выверенное  Ct (3,3) Ct (3,3) |
Наблюдаемое отношение С:Т |
% мутантного аллеля |
| 1:1 |
17,04 |
20,35 |
-3,32 |
-0,02 |
1,01:1 |
50,31 |
| 1:10 |
20,23 |
20,37 |
-0,14 |
3,16 |
1:3,74 |
10,08 |
| 1:100 |
24,29 |
18,93 |
5,37 |
8,66 |
1:404 |
0,25 |
| 1:1000 |
26,84 |
18,7 |
8,14 |
11,43 |
1:2759 |
0,036 |
| 1:10000 |
30,01 |
19,47 |
10,54 |
13,84 |
1:14664 |
0,007 |
| 1:100000 |
31,45 |
19,72 |
11,73 |
15,03 |
1:33456 |
0,003 |
Таким образом, результаты показывают, что путем данного анализа можно определять уровни аллеля L129 (мутантного) на фоне аллеля F129 (дикого типа), составляющие 1:10000, до того как праймер PV129-mut5 (L129-аллельселективный праймер) станет связываться с неподходящей матрицей.
Третий контрольный эксперимент конструировали для тестирования того, амплифицируются ли предпочтительные праймеры ARMS с одинаковой эффективностью. Важно убедиться, что эффективность амплификации является примерно равной, поскольку различие между двумя праймерами в Ct непосредственно соответствует частоте аллеля устойчивости в образце. Одним из путей такого тестирования является сравнение того, как изменяется  Ct в зависимости от концентрации матрицы. Строят график логарифмической зависимости ДНК на входе от Ct в зависимости от концентрации матрицы. Строят график логарифмической зависимости ДНК на входе от  Ct, и полученный в результате наклон должен составлять менее 0,1. Эту процедуру проводили, как описано в примере 8. Разведения матрицы с плазмидными ДНК дикого типа и мутанта и контроль без матрицы (только вода) тестировали с F129- и L129-аллельспецифическими праймерами Pv129-wt6 и Pv129-mut5 и праймером Scorpion, сконструированном в примере 15. Ct, и полученный в результате наклон должен составлять менее 0,1. Эту процедуру проводили, как описано в примере 8. Разведения матрицы с плазмидными ДНК дикого типа и мутанта и контроль без матрицы (только вода) тестировали с F129- и L129-аллельспецифическими праймерами Pv129-wt6 и Pv129-mut5 и праймером Scorpion, сконструированном в примере 15.
| Таблица 40 |
| Результаты эксперимента по относительной эффективности, проведенного с использованием ARMS-праймеров Pv129-wt6 и Pv129-mut5 и праймера Scorpion, сконструированного в примере 15 |
| ДНК-матрица |
Log концентрации ДНК |
Ct мутанта |
Ct дикого типа |
 Ct Ct |
Выверенное  Ct (2,54) Ct (2,54) |
| 128 |
2,107 |
17,78 |
18,58 |
-0,8 |
1,74 |
| 64 |
1,806 |
18,53 |
18,42 |
0,11 |
2,65 |
| 32 |
1,505 |
19,2 |
19,66 |
-0,45 |
2,09 |
| 16 |
1,204 |
20,7 |
21,23 |
-0,53 |
2,01 |
| 8 |
0,903 |
21,07 |
20,82 |
0,25 |
2,79 |
| 4 |
0,602 |
21,38 |
23,57 |
-2,2 |
0,34 |
| 2 |
0,301 |
23,24 |
22,63 |
0,61 |
3,15 |
| 1 |
0 |
24,21 |
24,22 |
0,0 |
2,54 |
Строили график зависимости  Ct от log концентрации ДНК, и вычисляли линию тренда с использованием Excel. Наклон линии составлял менее 0,1, таким образом, праймеры ARMS PV129-mut5 и PV129-wt6 амплифицируются по существу с одинаковой относительной эффективностью (фигура 18). Ct от log концентрации ДНК, и вычисляли линию тренда с использованием Excel. Наклон линии составлял менее 0,1, таким образом, праймеры ARMS PV129-mut5 и PV129-wt6 амплифицируются по существу с одинаковой относительной эффективностью (фигура 18).
Четвертый контрольный эксперимент конструировали для исследования того, может ли влиять на анализ ДНК растения-хозяина (в данном случае, ДНК виноградной лозы), например, путем действия в качестве матрицы в данной PCR. ДНК винограда присутствует в образцах, где собирают и тестируют непосредственно инфицированный материал листьев.
Для проведения данного исследования экстрагировали геномную ДНК из образца виноградных листьев с использованием Qiagen DNeasy Plant Mini Kit (100 г материала вначале размалывали в микроцентрифужной пробирке объемом 1,5 мл, содержащей стальной шарик путем встряхивания в течение 10 минут в мельнице Centriprep Mixer Mill). Полученную в результате ДНК разбавляли 5-кратными серийными разведениями в бидистиллированной H2О с получением следующих концентраций: «чистый» (полученный непосредственно из препарата mini kit), 1 к 5, 1 к 25 и 1 к 125 (растительная ДНК к H2О). Также получали две смеси плазмидной ДНК аллель L129: аллель F129, 1:100 и 1:10000 (как описано выше). Данные маточные растворы смешивали со снижением фона растительного материала с получением следующих исходных PCR: 1:100 аллель L129: аллель F129 + чистая растительная ДНК, 1:100 аллель L129: аллель F129 + разведенная 1 к 5 растительная ДНК, 1:100 аллель L129: аллель F129 + разведенная 1 к 25 растительная ДНК, 1:100 аллель L129: аллель F129 + разведенная 1 к 125 растительная ДНК, 1:10000 аллель L129: аллель F129 + чистая растительная ДНК, 1:10000 аллель L129: аллель F129 + разведенная 1 к 5 растительная ДНК, 1:10000 аллель L129: аллель F129 + разведенная 1 к 25 растительная ДНК, 1:10000 аллель L129: аллель F129 + разведенная 1 к 125 растительная ДНК. Все они тестировались в анализе с предпочтительными праймерами ARMS, вместе с разведениями растительной ДНК, одной плазмидной ДНК в отношениях аллель L129: аллель F129, плазмидной ДНК дикого типа и мутантной плазмидной ДНК в концентрации 2×107 молекул/мкл, и контролем, содержащим только воду, как описано выше. Данные результаты анализировали сходным образом с теми контрольными экспериментами, что описаны в данном примере.
Конечная стадия испытания включала тестирование праймеров ARMS Pv129-mut5 и Pv129-wt6, и контрольного праймера на биологических образцах. Биологический образец, использованный в данном исследовании, представлял собой осадок спорангиев. Спорангии смывали с образца 30 виноградных листьев с образованием суспензии спорангиев; образец центрифугировали, и удаляли надосадочную жидкость, оставляя осадок спорангиев. (В качестве исходного биологического материала также могут использоваться инфицированные P. viticola листья винограда). 100 мг биологического материала размалывали с использованием мельницы Spex CertiPrep 8000 Mixer Mill (Glen Creston Ltd), как описано в примере 11. Затем проводили получение геномной ДНК с использованием Qiagen DNeasy plant mini kit, по протоколу производителя, как также описано в примере 11.
Полученные препараты ДНК разбавляли 1:10 и 1:100 стерильной бидистиллированной H2О, и данные растворы матрицы тестировали, как описано выше, в анализе ARMS/Scorpion. Каждое разведение матрицы тестировали с праймерами Pv129-mut5 и Pv129-wt6, и контрольным праймером; также включали плазмидную ДНК дикого типа и мутантную плазмидную ДНК, и контроль, содержащий только воду, в качестве положительных и отрицательных контролей, соответственно. Результаты анализировали сходным образом с теми контрольными экспериментами, что описаны в данном примере.
Пример 17
Конструирование способов анализа ARMS/Scorpion, способных определять аллели F129 и L129 в любом изоляте P. viticola
Для определения другого единичного нуклеотидного полиморфизма, способного преобразовывать F129 в L129, может использоваться комбинация пары смысловых олигонуклеотидов ARMS/антисмыслового Scorpion, посредством которой можно различить только позицию 1 в кодоне 129 (т.е. присутствует ли в положении 1 остаток тимина или цитозина). Сходным образом, комбинация пары антисмысловых олигонуклеотидов ARMS/смыслового Scorpion, посредством которой можно различить все возможные остатки в положении 3 кодона 129, т.е. остаток тимина, цитозина, аденина или гуанина, способна определять альтернативные замены в положении 3, которые могут приводить к опосредованной L129 устойчивости. В комбинации данные способы анализа позиций 1 и 3 также предоставляют средство оценки уровня двойных мутаций, которые могут приводить к преобразованию F129 в L129 (кодоны: CTA и CTG).
В комбинации пары антисмысловых олигонуклеотидов ARMS/смыслового Scorpion может задействоваться праймер Scorpion, сконструированный ранее, как подробно описано в примере 13, где система определения включена в прямой PCR-праймер, использованный в комбинации со следующим ARMS-праймером для определения SNP и контрольным праймером.
Три обратных праймера ARMS, основанных на остатке тимина в положении 3 кодона 129:
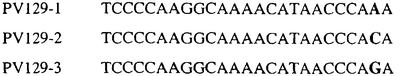
Три обратных праймера ARMS, основанные на остатке аденина в положении 3 кодона 129:
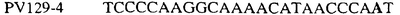
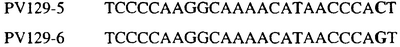
Три обратных праймера ARMS, основанных на остатке цитозина в положении 3 кодона 129:
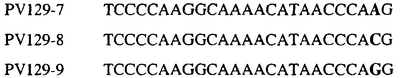
Три обратных праймера ARMS, основанных на остатке гуанина в положении 3 кодона 129:
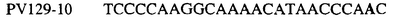
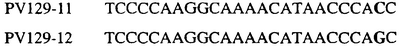
и контрольный праймер, сконструированный ниже точечной мутации:
PV129-S2 TTGTCCCCAAGGCAAAACATAACCC
В каждом из указанных выше праймеров ARMS основание -1 (3′-концевое основание последовательности праймера) соответствует участку целевой точечной мутации. Основания, показанные жирным шрифтом, отличаются от последовательности цитохрома b P. viticola дикого типа. В праймерах PV129-1, PV129-4, PV129-7 и PV129-10 позиция -2 изменена с основания A на основание T. В праймерах PV129-2, PV129-5, PV129-8 и PV129-11 позиция -2 изменена с основания A на основание G. В праймерах PV129-3, PV129-6, PV129-9 и PV129-12 позиция -2 изменена с основания A на основание C. Данные изменения в последовательности были сделаны для дестабилизации гибридной молекулы матрица/праймер и достижения большей специфичности в отношении соответствующей матрицы любого продления праймера. Полученный в результате ампликон составляет 126 н.п. в длину с праймерами ARMS и 129 н.п. в длину с контрольным праймером.
Все праймеры были синтезированы Oswel DNA Service (Lab 5005, Medical and Biological Sciences Building, Саутгемптон). Перед применением каждый праймер разбавляли до 5 мкМ в общем объеме, равном 500 мкл, бидистиллированной, не содержащей нуклеаз H2О. Затем праймеры далее разбавляли до конечной концентрации 500 нМ в реакционных смесях PCR.
Для определения остатка тимина или цитозина в первом положении 129 кодона с использованием комбинации пары смысловых олигонуклеотидов ARMS/антисмыслового Scorpion ниже подробно описано конструирование другого праймера Scorpion. Опять с использованием последовательностей генов цитохрома b P. viticola дикого типа и образцов I112 и I116b, полученных по примеру 11, могут быть конструируют олигонуклеотиды Scorpion с системой определения, включенной в обратный PCR-праймер; затем праймер Scorpion может использоваться с праймером ARMS для определения SNP и контрольными праймерами.
Конкретно, праймер Scorpion конструировали с использованием программ Oligo 5 и MFold (MFold предсказывает оптимальные и субоптимальные вторичные структуры для молекул РНК или ДНК с использованием способа минимизации энергии по Zucker (Zucker, M. (1989) Science 244,48-52; SantaLucia, J. Jr. (1998). Proc. Natl. Acad. Sci. USA 95, 1460-1465)).
Последовательность полученного в результате праймера Scorpion P. viticola представляла собой: 5′ FAM-CCCGCCGTAATTGTAGGGGCTGTACTAATACGGCGGG MR-HEG-GATACCTAATGGATTATTTGAACCTACCT 3′, где подчеркнутые области представляют собой части, образующие шпильку (когда праймер Scorpion ни с чем не взаимодействует); FAM представляет собой флуоресцеиновый краситель; MR (метиловый красный) является не флуоресцирующим гасителем, привязанным к остатку урацила, и HEG представляет собой блокирующий репликацию мономер гексетиленгликоля. Последовательность, показанная курсивом, представляет собой последовательность обратного праймера, а последовательность, показанная жирным шрифтом, представляет собой последовательность Scorpion, которая связывается с аутентичным продуктом продления обратного праймера cyt b P. viticola. Основания, подчеркнутые и также выделенные жирным шрифтом, участвуют в качестве частей в образовании стебля шпильки и последовательности Scorpion, которая связывается с продуктом продления обратного праймера.
Стебельчатопетлевая вторичная структура данного праймера Scorpion может быть визуализирована с помощью программы MFold (см. фигуру 19) и, как предсказано, обладает энергией, равной -2,2 ккал/моль, не будучи гибридизованной с целевым геном cyt b. Однако в присутствии продукта продления структура шпильки разделяется, поскольку зондовая последовательность праймера Scorpion связывается с продуктом продления с предсказанной энергией -6,1 ккал/моль. Это отделяет краситель FAM от его гасителя, вызывая флуоресцентное излучение, определяемое, например, прибором ABI Prism 7700. Поэтому отжиг элемента Scorpion на вновь синтезированную цепь является энергетически выгодным по сравнению со стебельчатопетлевой структурой Scorpion.
Антисмысловой праймер Scorpion может использоваться в комбинации со следующими смысловыми праймерами ARMS для определения остатка тимина или цитозина в положении 1 в кодоне 129.
Три прямых праймера ARMS, основанных на остатке тимина в положении 1 кодона 129:

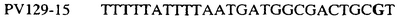
Три прямых праймера ARMS, основанных на остатке цитозина в положении 1 кодона 129:

и контрольный праймер, сконструированный выше точечной мутации:
PV129-S3 TATTTTTATTTTAATGATGGCGACTGC
В каждом из указанных выше праймеров ARMS основание -1 (3′-концевое основание последовательности праймера) соответствует участку целевой точечной мутации. Основания, показанные жирным шрифтом, отличаются от последовательности цитохрома b P. viticola дикого типа. В праймерах PV129-13 и PV129-16 позиция -2 изменена с основания A на основание T. В праймерах PV129-14 и PV129-17 позиция -2 изменена с основания A на основание C. В праймерах PV129-15 и PV129-18 позиция -2 изменена с основания A на основание G. Данные изменения в последовательности были сделаны для дестабилизации гибридной молекулы матрица/праймер и достижения большей специфичности в отношении соответствующей матрицы любого продления праймера. Полученный в результате ампликон составляет 278 н.п. в длину с праймерами ARMS и 280 н.п. в длину с контрольным праймером.
Все праймеры были синтезированы Oswel DNA Service (Lab 5005, Medical and Biological Sciences Building, Саутгемптон). Перед применением каждый праймер разбавляли до 5 мкМ в общем объеме, равном 500 мкл, бидистиллированной, не содержащей нуклеаз H2О. Затем праймеры далее разбавляли до конечной концентрации 500 нМ в реакционных смесях PCR.
Пример 18
Конструирование анализа гибридизации MGB (агента, связывающегося с малой бороздкой) для определения и количественного анализа аллелей F129 и L129 в P. viticola.
С использованием последовательностей генов цитохрома b P. viticola дикого типа и образцов I112 и I116b, полученных по примеру 11, конструировали анализ гибридизации MGB для определения точечной мутации T на C (SNP – единичный нуклеотидный полиморфизм) в первом положении кодона 129, которая кодирует замену аминокислоты фенилаланина на лейцин. В анализе задействуется обычный прямой праймер выше точечной мутации (SNP), обычный обратный праймер ниже точечной мутации (SNP) и два MGB-зонда, которые покрывают точечную мутацию (SNP), причем один совпадает с последовательностью дикого типа, а другой совпадает с мутантной последовательностью. Анализ конструировали с использованием программного обеспечения Primer Express версии 1.5, следуя критериям конструирования.
Последовательность праймеров и зондов была следующей:
прямой праймер: 5′ CGGATCTTATATTACACCTAGAGAAGCTTT 3′
обратный праймер: 5′ TTGTCCCCAAGGCAAAACAT 3′
мутантный зонд (L129-аллельспецифический): 5′ AACCCATAAGTGCAGTC 3′
зонд дикого типа (F129-аллельспецифический): 5′ ACCCATAAATGCAGTCG 3′
Зонды конструировали к комплементарной последовательности. Основание, выделенное жирным шрифтом и подчеркнутое, представляет собой точечную мутацию (SNP). Мутантный зонд метят с 5′-конца флуорофором FAM, а зонд дикого типа метят с 5′-конца флуорофором VIC. Оба зонда модифицированы с 3′-конца привязыванием MGB-единицы. Праймеры и зонды были синтезированы Applied Biosystems (Kelvin Close, Birchwood Science Park North, Warrington, Cheshire, WA3 7PB).
Пример 19
Подтверждение анализа гибридизации MGB для определения и количественного анализа SNP F129 P. viticola.
В первом контрольном эксперименте было задействовано тестирование специфичности гибридизации специфичных в отношении дикого типа и мутанта MGB-зондов с их правильными ДНК-матрицами по сравнению с их неправильной матрицей. Все анализы гибридизации MGB проводили с использованием следующих условий взаимодействия. Прямой и обратный праймеры находятся в конечной концентрации в реакционной смеси, равной 900 нМ, MGB-гибридизационные зонды дикого типа или мутанта находятся в конечной концентрации в реакционной смеси, равной 200 нМ, универсальную специализированную смесь для PCR Taqman подавали в 2× концентрации, применяли 5 мкл ДНК, и реакционную смесь доводили до общего объема, равного 25 мкл, свободной от нуклеаз H2O. Условия циклов PCR являются следующими: один цикл при 50°C в течение 2 минут, с последующим одним циклом при 95°C в течение 10 минут, с последующими 50 циклами при 95°C в течение 15 секунд и при 60°C в течение 1 минуты. Флуоресценцию отслеживали во время стадии отжига/продления по всем циклам.
Специфичность MGB-зонда дикого типа и мутантного MGB-зонда тестировали с использованием плазмидных ДНК-конструкций, содержащих часть гена cyt b, кодирующую или последовательность дикого типа (аллель F129) или мутантную последовательность (аллель L129) в положении 129. Они были приготовлены, как описано в примере 14. Плазмидная ДНК, содержащая последовательность гена cyt b дикого типа (аллель F129) или ту, что содержала мутантную (аллель L129) последовательность гена cyt b, разбавляли серией 10-кратных разведений от 2×108 молекул/мкл до 2×102 молекул/мкл. Все разведения тестировали в обоих анализах с MGB-зондом дикого типа и с мутантным MGB-зондом, как описано выше. Также включали контроль, содержащий только воду. Результаты приведены в таблицах 41 и 42.
| Таблица 41 |
| Анализ с применением мутантного MGB-зонда, который тестировали в интервале разведений плазмидной ДНК-матрицы |
| Разведение плазмидной ДНК-матрицы |
Ct мутантной матрицы |
Ct матрицы дикого типа |
 Ct Ct |
| 2×108 |
10,56 |
нет амплификации |
нет данных |
| 2×107 |
13,73 |
нет амплификации |
нет данных |
| 2×106 |
16,76 |
нет амплификации |
нет данных |
| 2×105 |
20,32 |
нет амплификации |
нет данных |
| 2×104 |
24,03 |
нет амплификации |
нет данных |
| 2×103 |
27,08 |
нет амплификации |
нет данных |
| 2×102 |
30,9 |
нет амплификации |
нет данных |
| Таблица 42 |
| Анализ с применением MGB-зонда дикого типа, который тестировали в интервале разведений плазмидной ДНК-матрицы |
| Разведение плазмидной ДНК-матрицы |
Ct мутантной матрицы |
Ct матрицы дикого типа |
 Ct Ct |
| 2×108 |
нет амплификации |
10,05 |
нет данных |
| 2×107 |
нет амплификации |
14,22 |
нет данных |
| 2×106 |
нет амплификации |
17,25 |
нет данных |
| 2×105 |
нет амплификации |
20,21 |
нет данных |
| 2×104 |
нет амплификации |
23,24 |
нет данных |
| 2×103 |
нет амплификации |
27,06 |
нет данных |
| 2×102 |
нет амплификации |
29,99 |
нет данных |
Данные результаты показывают, что ни относящийся к дикому типу, ни мутантный гибридизационный MGB-зонд не связывался со своей неправильной матрицей в пределах серии разведений по концентрации ДНК-матрицы.
Во втором контрольном исследовании была исследована чувствительность определения гибридизационным MGB-зондом дикого типа и мутантным гибридизационным MGB-зондом. Плазмидную ДНК с аллелем L129 (мутант) в концентрации 2×107 молекул/мкл разбавляли фоновым количеством плазмидной ДНК с аллелем F129 (дикий тип) в постоянной концентрации 2×107 молекул/мкл с образованием следующих отношений аллелей L129 и F129: 1:1, 1:10, 1:100, 1:1000, 1:10000 и 1:100000. Конечная концентрация плазмиды в реакционной смеси PCR составляла 1×108 молекул/мкл. Полученные препараты тестировали, наряду с плазмидой дикого типа, мутантной плазмидой и контролем, содержащим только воду, в обоих анализах с MGB-зондом дикого типа и с мутантным MGB-зондом.
| Результаты, в которых показана чувствительность определения в анализах с MGB-зондом дикого типа и с мутантным MGB-зондом |
| ДНК-матрица |
Ct мутантного аллеля |
Ct аллеля дикого типа |
 Ct Ct |
Наблюдаемое отношение Mut:wt |
% мутантного аллеля |
| 1:1 |
11,47 |
12,26 |
-0,79 |
1,72:1 |
63,4 |
| 1:10 |
14,47 |
12,77 |
1,7 |
1:3,25 |
23,5 |
| 1:100 |
нет амплификации |
13,01 |
нет данных |
нет данных |
нет данных |
| 1:1000 |
нет амплификации |
13,05 |
нет данных |
нет данных |
нет данных |
| 1:10000 |
нет амплификации |
12,97 |
нет данных |
нет данных |
нет данных |
| 1:100000 |
нет амплификации |
13,03 |
нет данных |
нет данных |
нет данных |
Чувствительность определения посредством данного анализа составляет всего лишь 1 мутантный (L129) аллель на фоне 10 аллелей дикого типа (F129). Анализы гибридизации с использованием для определения мутации зонда TaqMan или зонда TaqMan MGB в комбинации с парой обычных прямого и обратного праймеров способны определять мутантный аллель на уровне 5-10% в образце гриба. Когда требуется определить более низкие уровни мутантного аллеля, более предпочтительным является использованием праймера ARMS в комбинации с подходящей системой определения, т.е. праймером Scorpion.
Пример 20
Характеристика гена цитохрома b из изолятов Alternaria solani, характеризующихся сниженной чувствительностью к фунгицидам-ингибиторам участка QoI.
Также были охарактеризованы гены цитохрома b из двух изолятов A. solani, характеризующихся при их тестировании в биоанализе сниженной чувствительностью к фунгицидам-ингибиторам участка QoI. Из данных изолятов выделяли ДНК, и полученную в результате гДНК (геномную ДНК) использовали в качестве матрицы в реакциях PCR с целью амплификации ген цитохрома b. Реакции PCR проводили, как описано ранее с использованием следующих праймеров:
прямой праймер: 5’CTG TTA TCT TTA TCT TAA TGA TGG 3′
обратный праймер: 5’GGA ATA GAT CTT AAT ATA GCA TAG 3′
и при следующих условиях: один цикл при 94°С в течение 3 мин, с последующими 30 циклами по 45 с при 94°С, 45 с при 58°С и 1 мин 30 с при 72°С, с последующим 1 циклом в течение 10 мин при 72°С.
Продукты PCR визуализировали путем гель-электрофореза, и те, что обладали размером, соответствующим предсказанному, клонировали с использованием набора для клонирования TOPO TA от Invitrogen, и трансформировали ими E. coli. Трансформированные колонии E. coli подвергали селекции, субкультивировали их, и получали плазмидную ДНК с использованием минипрепаратов, как описано ранее.
Определяли последовательности плазмидных ДНК (см. пример 11), и данные по последовательностям анализировали с использованием подходящего биоинформатического программного обеспечения (например, Seqman, Editseq и Macaw). Предсказанную последовательность гена цитохрома b из двух изолятов сравнивали затем с известными последовательностями цитохрома b дикого типа (определенными ранее). Нуклеотидные и аминокислотные выравнивания показаны на фигурах 20 и 21, где аминокислотные последовательности предсказывали с использованием «Mold, Protozoan and Coelenterate Mitochondrial Code-Number 4» как описано в Genetic Codes (таксономия NCBI):
Наличие мутации T на С (SNP) наблюдали в первом положении кодона 129 в гене цитохрома b первого образца A. solani. Данная мутация по сравнению с фоновым/родительским образцом приводит к аминокислотной замене фенилаланина на лейцин в положении 129 по системе нумерации S. cerevisiae. Второй образец (образец 2) также характеризовался присутствием мутации (SNP) в кодоне 129, однако она представляла собой замену С на А в третьем положении кодона 129. Это также приводит к замене фенилаланина на лейцин в положении 129 по системе нумерации S. cerevisiae. Сниженная чувствительность к соединениям-ингибиторам участка QoI в каждом из данных двух образцов, наблюдаемая при биоанализе, по-видимому, ассоциирована с аминокислотной заменой фенилаланина (F) на лейцин (L) в положении 129. Это первый случай, в котором в A. solani наблюдаются единичные нуклеотидные полиморфизмы (SNP), вызывающие замену F на L. Также это первый случай для всех видов грибов, когда определяются два различных SNP в кодоне 129 цитохрома b, причем оба кодируют аминокислотную замену F на L.
Формула изобретения
1. Способ определения устойчивости грибного фитопатогена к фунгициду, выбранному из группы, состоящей из аналога стробилурина, крезоксим-метила, фамоксадона и фенамидона, где устойчивость к указанному фунгициду обусловлена мутацией единичного нуклеотида в гене цитохрома b указанного грибного фитопатогена, указанная мутация единичного нуклеотида приводит к аминокислотной замене F129L, где номер соответствует положению первой указанной аминокислоты в последовательности цитохрома b Saccharomyces cerevisiae дикого типа, и где первая указанная аминокислота заменяется второй указанной аминокислотой в положении гена грибного цитохрома b, которое при сравнении с последовательностью цитохрома b S.cerevisiae соответствует указанной аминокислоте S.cerevisiae, способ предусматривает определение наличия указанной(ых) мутации(ий) единичного нуклеотида проведением ПЦР исследуемого образца, содержащего нуклеиновую кислоту фитопатогенного гриба с использованием пары праймеров, специфичных к гену цитохрома b указанного грибного фитопатогена, и/или (i) генерацию и обнаружение присутствия ампликона, где один из указанных праймеров является специфичным к мутации единичного нуклеотида и присутствие указанного ампликона указывает на наличие мутации,
или (ii) генерацию ампликона и зондирование указанного ампликона с олигонуклеотидным зондом, специфичным к указанной мутации единичного нуклеотида, так что связывание олигонуклеотидного зонда с указанным ампликоном указывает на наличие указанной мутации; где наличие указанной мутации связано с устойчивостью указанного грибного фитопатогена к указанному фунгициду, причем указанная мутация единичного нуклеотида обусловлена либо (а) присутствием нуклеотида аденина в третьем основании триплета, кодирующего указанную аминокислоту, либо (b) присутствием нуклеотида цитозина в первом основании триплета, кодирующего указанную аминокислоту.
2. Способ по п.1, отличающийся тем, что мутация единичного нуклеотида приводит к наличию кодона ТТА или СТТ, кодирующего лейцин в положении белка цитохрома b грибного фитопатогена, которое соответствует остатку 129 цитохрома b S.cerevisiae.
3. Способ по п.1 или 2, отличающийся тем, что мутация единичного нуклеотида возникает вследствие замены основания цитозина аденином в третьем основании триплета, кодирующего указанную аминокислоту.
4. Способ по любому из пп.1-3, отличающийся тем, что указанный аналог стробилурина представляет собой азоксистробин, пикоксистробин, трифлоксистробин или пираклосробин.
5. Способ по любому из предшествующих пунктов, отличающийся тем, что грибной фитопатоген представляет собой выбранный из группы, состоящей из Plasmopara viticola, Erysiphe graminis f.sp.hordei, Erysiphe graminis f.sp.tritici, Rhynchosporium secalis, Pyrenophora teres, Mycosphaerella graminicola, Mycosphaerella fijiensis var. difformis, Sphaerotheca fuliginea, Uncinula necator, Colletotrichum graminicola, Pythium aphanidermatum, Colletotrichum gloeosporioides, Oidium lycopersicum, Leveillula taurica, Pseudoperonospora cubensis, Altemaria solani, Rhizoctonia solani, Venturia inaequalis, Phytopthora infestans, Mycosphaerella musicola, Cercospora arachidola, Didymella bryoniae, и Didymella lycopersici.
6. Способ по п.5, отличающийся тем, что грибной фитопатоген выбран из группы, состоящей из Pythium aphanidermatum, Plasmopara viticola и Alternaria solani.
7. Способ по п.1, отличающийся тем, что исследуемый образец содержит нуклеиновую кислоту фитопатогенного гриба, содержащую последовательность ДНК, выбранную из группы, состоящей из последовательностей ДНК в табл.4 и последовательностей ДНК в табл.5.
8. Способ по п.1 или 2, отличающийся тем, что ПЦР проводится как описано в подпункте (i) пункта 1 и праймер, специфичный к мутации, выбран из группы, состоящей из любого из тридцати праймеров, представленных в табл.9, праймера PV129-C1, имеющего последовательность CCCAAGGCAAAACATAACCCATATG, праймера PV129-C2, имеющего последовательность CCCAAGGCAAAACATAACCCATACG, праймера PV129-C3, имеющего последовательность CCCAAGGCAAAACATAACCCATAGG, праймера PV129-C4, имеющего последовательность CCCAAGGCAAAACATAACCCATTAG, праймера PV129-C5, имеющего последовательность CCCAAGGCAAAACATAACCCATCAG, праймера PV129-C6, имеющего последовательность CCCAAGGCAAAACATAACCCATGAG, праймера PV129-16, имеющего последовательность TTTTTATTTTAATGATGGCGACTGCTC, праймера PV129-17, имеющего последовательность TTTTTATTTTAATGATGGCGACTGCCC, праймера PV129-18, имеющего последовательность TTTTTATTTTAATGATGGCGACTGCGC.
9. Способ по п.8, отличающийся тем, что мутация единичного нуклеотида приводит к наличию кодона СТТ, праймер выбран из группы, состоящей из праймера PV129-C1, праймера PV129-C2, праймера PV129-C3, праймера PV129-C4, праймера PV129-C5, праймера PV129-C6, праймера PV129-16, праймера PV129-17, праймера PV129-18, и грибной фитопатоген представляет собой Plasmopara viticola.
10. Способ по любому из пп.1-3, отличающийся тем, что ПЦР проводится как описано в подпункте (i) пункта 1 и праймер, специфичный к мутации, выбран из группы, состоящей из любого праймера из 29 праймеров, приведенных в табл.10, праймера Pt129-4, имеющего последовательность TTTATTTTAATGATGGCAACAGCTTAA, праймера Pt129-5, имеющего последовательность TTTATTTTAATGATGGCAACAGCTTCA, праймера Pt129-6, имеющего последовательность TTTATTTTAATGATGGCAACAGCTTGA, праймера Pt129-A1, имеющего последовательность ACCCCAAGGTAATACATAACCCAAT, праймера Pt129-A2, имеющего последовательность ACCCCAAGGTAATACATAACCCACT, праймера Pt129-A3, имеющего последовательность ACCCCAAGGTAATACATAACCCAGT, праймера Pt129-A4, имеющего последовательность ACCCCAAGGTAATACATAACCCTTT, праймера Pt129-A5, имеющего последовательность ACCCCAAGGTAATACATAACCCCTT, праймера Pt129-А6, имеющего последовательность ACCCCAAGGTAATACATAACCCGTT, праймера Pt129-A7, имеющего последовательность ACCCCAAGGTAATACATAACTCACT, праймера Pt129-A8, имеющего последовательность ACCCCAAGGTAATACATAACACACT, праймера Pt129-A9, имеющего последовательность ACCCCAAGGTAATACATAACGCACT, праймера Pt129-A10, имеющего последовательность ACCCCAAGGTAATACATAACTCCTT, праймера Pt129-А11, имеющего последовательность ACCCCAAGGTAATACATAACACCTT, праймера Pt129-A12, имеющего последовательность ACCCCAAGGTAATACATAACGCCTT, праймера Pt129-A13, имеющего последовательность ACCCCAAGGTAATACATAACTCGTT, праймера Pt129-А14, имеющего последовательность ACCCCAAGGTAATACATAACACGTT, праймера Pt129-A15, имеющего последовательность ACCCCAAGGTAATACATAACGCGTT, праймера PV129-4, имеющего последовательность TCCCCAAGGCAAAACATAACCCAAT, праймера PV129-5, имеющего последовательность TCCCCAAGGCAAAACATAACCCACT и праймера PV129-6, имеющего последовательность TCCCCAAGGCAAAACATAACCCAGT.
11. Способ по п.10, отличающийся тем, что мутация единичного нуклеотида приводит к наличию кодона ТТА, праймер выбран из группы, состоящей из Pt129-4, Pt129-5, Pt129-6, Pt129-A1, Pt129-A2, Pt129-A3, Pt129-A4, Pt129-A5, Pt129-A6, Pt129-A7, Pt129-A8, Pt129-A9, Pt129-A10, Pt129-A11, Pt129-A12, Pt129-A13, Pt129-A14 и грибной фитопатоген представляет собой Pythium aphanidermatum.
12. Способ по п.10, отличающийся тем, что мутация единичного нуклеотида приводит к наличию кодона ТТА, праймер выбран из группы, состоящей из PV129-4, PV129-5 и PV129-6, и грибной фитопатоген представляет собой Plasmopara viticola.
13. Способ по п.1 или 2, отличающийся тем, что ПЦР проводится как описано в подпункте (i) пункта 1, мутация единичного нуклеотида приводит к наличию кодона СТТ, олигонуклеотидный зонд, специфичный к мутации единичного нуклеотида, имеет последовательность AACCCATAAGTGCAGTC, и грибной фитопатоген представляет собой Plasmopara viticola.
14. Способ по любому из предшествующих пунктов, отличающийся тем, что частота мутации, обнаруживаемая в исследуемом образце, находится в диапазоне от 1 мутированного аллеля на 1000000 аллелей дикого типа до 1 мутированного аллеля на 10000 аллелей дикого типа включительно.
15. Способ по п.14, отличающийся тем, что частота мутации, обнаруживаемая в исследуемом образце, находится в диапазоне от 1 мутированного аллеля на 100000 аллелей дикого типа до 1 мутированного аллеля на 10000 аллелей дикого типа включительно.
16. Аллельспецифический праймер для применения в способе согласно любому из предшествующих пунктов, где указанный аллельспецифический праймер выбран из группы, состоящей из одного из 30 праймеров, приведенных в таблице 9, праймера PV129-C1, имеющего последовательность CCCAAGGCAAAACATAACCCATATG, праймера PV129-C2, имеющего последовательность CCCAAGGCAAAACATAACCCATACG, праймера PV129-C3, имеющего последовательность CCCAAGGCAAAACATAACCCATAGG, праймера PV129-C4, имеющего последовательность CCCAAGGCAAAACATAACCCATTAG, праймера PV129-C5, имеющего последовательность CCCAAGGCAAAACATAACCCATCAG, праймера PV129-C6, имеющего последовательность CCCAAGGCAAAACATAACCCATGAG, праймера PV129-16, имеющего последовательность TTTTTATTTTAATGATGGCGACTGCTC, праймера PV129-17, имеющего последовательность PV129-17, имеющего последовательность TTTTTATTTTAATGATGGCGACTGCCC, праймера PV129-18, имеющего последовательность TTTTTATTTTAATGATGGCGACTGCGC, любого из двадцати девяти праймеров, приведенных в табл.10, праймера Pt129-4, имеющего последовательность TTTATTTTAATGATGGCAACAGCTTAA, праймера Pt129-5, имеющего последовательность TTTATTTTAATGATGGCAACAGCTTCA, праймера Pt129-6, имеющего последовательность TTTATTTTAATGATGGCAACAGCTTGA, праймера Pt129-A1, имеющего последовательность ACCCCAAGGTAATACATAACCCAAT, праймера РП29-А2, имеющего последовательность ACCCCAAGGTAATACATAACCCACT, праймера Pt129-А3, имеющего последовательность ACCCCAAGGTAATACATAACCCAGT, праймера Pt129-A4, имеющего последовательность ACCCCAAGGTAATACATAACCCTTT, праймера PU29-A5, имеющего последовательность ACCCCAAGGTAATACATAACCCCTT, праймера Pt129-А6, имеющего последовательность ACCCCAAGGTAATACATAACCCGTT, праймера Pt129-A7, имеющего последовательность ACCCCAAGGTAATACATAACTCACT, праймера Pt129-A8, имеющего последовательность ACCCCAAGGTAATACATAACACACT, праймера Pt129-A9, имеющего последовательность ACCCCAAGGTAATACATAACGCACT, праймера Pt129-A10, имеющего последовательность ACCCCAAGGTAATACATAACTCCTT, праймера Pt129-А11, имеющего последовательность ACCCCAAGGTAATACATAACACCTT, праймера Pt129-A12, имеющего последовательность ACCCCAAGGTAATACATAACGCCTT, праймера Pt129-A13, имеющего последовательность ACCCCAAGGTAATACATAACTCGTT, праймера Pt129-A14, имеющего последовательность ACCCCAAGGTAATACATAACACGTT, праймера Pt129-A15, имеющего последовательность ACCCCAAGGTAATACATAACGCGTT, праймера PV129-4, имеющего последовательность TCCCCAAGGCAAAACATAACCCAAT, праймера PV129-5, имеющего последовательность TCCCCAAGGCAAAACATAACCCACT, праймера PV129-6, имеющего последовательность TCCCCAAGGCAAAACATAACCCAGT.
17. Набор для применения в способе по любому из пп.1-15, где указанный набор содержит аллельспецифический праймер по п.16, контрольный праймер, выбранный из группы, состоящей из тридцати праймеров, приведенных в табл.17, обычный праймер, выбранный из группы, состоящей из тридцати двух праймеров, приведенных в табл.16, нуклеотидтрифосфаты, ДНК-полимеразу и буферный раствор.
Приоритет по пунктам:
02.04.2001 – 1-8, 10, 11, 14-17;
20.09.2001 – 9, 12;
25.03.2002 – 13.
РИСУНКИ
MM4A – Досрочное прекращение действия патента СССР или патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 26.03.2008
Извещение опубликовано: 27.07.2010 БИ: 21/2010
|
|