|
|
(21), (22) Заявка: 2004123627/13, 20.12.2002
(24) Дата начала отсчета срока действия патента:
20.12.2002
(30) Конвенционный приоритет:
31.12.2001 (пп.1-48) ES P 0102925
(43) Дата публикации заявки: 10.04.2005
(46) Опубликовано: 27.03.2007
(56) Список документов, цитированных в отчете о
поиске:
ES 2156735 A1, 01.07.2001. US 6235315 А, 22.05.2001. RU 2126806 C1, 27.02.1999.
(85) Дата перевода заявки PCT на национальную фазу:
02.08.2004
(86) Заявка PCT:
ES 02/00610 (20.12.2002)
(87) Публикация PCT:
WO 03/056028 (10.07.2003)
Адрес для переписки:
129010, Москва, ул. Б.Спасская, 25, стр.3, ООО “Юридическая фирма Городисский и Партнеры”, пат.пов. Е.Е.Назиной, рег. № 517
|
(72) Автор(ы):
МАРКОС РОДРИГЕС Ана Тереса (ES),
ЭСТРЕЛЬЯ ДЕ КАСТРО Антонио (ES),
КОСТА ПЕРЕС Хавьер (ES),
ОЛИВЕР РУИС Мануэль Антонио (ES),
ФРАЙЛЕ ЕКОРА Ньевес (ES),
ДЕ ЛА ФУЕНТЕ МОРЕНО Хуан Луис (ES),
РОДРИГЕС САИС Марта (ES),
ДЬЕС ГАРСИЯ Бруно (ES),
ПЬЕРО СЕСОН Энрике (ES),
МУНЬОС РУИС Анхель (ES),
КАБРИ Вальтер (ES),
ЛОПЕС ОРТИС Хуан Франциско (ES),
БАРРЕДО ФУЕНТЕ Хосе Луис (ES)
(73) Патентообладатель(и):
ВИТАТЕНЕ, С.А. (ES)
|
(54) УЛУЧШЕННЫЙ СПОСОБ ПОЛУЧЕНИЯ ЛИКОПЕНА ПУТЕМ ФЕРМЕНТАЦИИ ВЫБРАННЫХ ШТАММОВ Blakeslea trispora, КОМПОЗИЦИИ И ПРИМЕНЕНИЯ ПОЛУЧЕННОГО ЛИКОПЕНА
(57) Реферат:
Предложена группа изобретений (способ получения ликопена, кристаллический ликопен, композиции ликопена, применение кристаллического ликопена и композиций на его основе в пищевой, фармацевтической, косметической отраслях, а также в качестве диетической добавки), которая относится к биотехнологии. Способ получения ликопена основан на использовании (+) и (-) штаммов гриба Blakeslea trispora, где (+) штамм представляет собой СРА1(+), а (-) штамм выбирается из группы, состоящей из L25(-), CMA1(-), СМА2(-), СМА3(-), СМА4(-), СМВ1(-), СМВ2(-), LMA1(-) или их комбинаций. Способ также предусматривает экстракцию ликопена, содержащегося в очищенной биомассе, органическим растворителем и дает возможность упрощения процесса выделения и повышения чистоты продукта. Преимущество предлагаемого способа заключается в достижении более высоких выходов ликопена. Получаемый ликопен является основой композиции, состоящей из масляной суспензии кристаллического ликопена, и композиции диспергируемого в холодной воде ликопена. Способы получения композиции дают возможность получения стабилизированных композиций ликопена для непосредственного применения в пищевой и фармацевтической областях, а также в качестве диетической добавки. 12 н. и 36 з.п. ф-лы, 2 ил.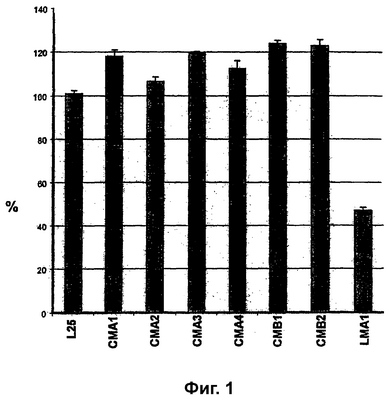
Область техники
Способ ферментации выбранных штаммов B. trispora, описанный в настоящем изобретении, дает возможность для достижения более высоких уровней продукции ликопена, чем описанные в настоящее время. Способы выделения, очистки и получения композиций (препаратов) применимы к любому природному источнику ликопена и особенно к глубинным культурам плесневых грибов родов Blakeslea, Choanephora, Phycomyces и Mucor. Способ экстракции предоставляет упрощение процесса получения и увеличение чистоты продукта по сравнению с ранее описанными способами. Способы получения дают высокую прибавочную стоимость, а также они дают возможность получать стабилизированные препараты ликопена для непосредственного применения в областях пищевых продуктов и фармации.
Уровень техники
Каротиноиды широко распространены в природе, придавая свой характерный цвет, от желтого до темно-красного, многим природным веществам, таким как морковь, перец, томаты, цветы или определенные микроорганизмы, включающие в себя некоторые бактерии, грибы и фотосинтезирующие организмы. Каротиноиды можно разделить на два типа: (i) чистые углеводороды, называемые каротинами, включая такие соединения, как  -каротин, -каротин,  -каротин, -каротин,  -каротин или ликопен, и (ii) молекулы, называемые ксантофиллами, которые содержат кислород в различных формах (гидроксильные группы, эпоксигруппы, и т.д.), включая астаксантин, зеаксантин, капсантин, кантаксантин, лютеин и т.д. Эти две группы соединений характеризуются различным поведением в плане их физико-химических свойств и растворимости в органических растворителях. Все эти соединения играют важную роль в диете человека, интенсивно исследовались их свойства в качестве антиоксидантов для предотвращения злокачественных опухолей и других заболеваний человека и в качестве предшественников для витамина А. Недавно на крысах было продемонстрировано, что ликопен ингибирует вредное воздействие нитрилацетата железа на ДНК и предотвращает некроз печени [Matos H.R. et al. (2001) Arch. Biochem. Biophys. vol. 396]. Кроме того, благодаря их окраске от желтого до красного каротиноиды очень коммерчески значимы в качестве красителей и пищевых добавок с учетом их полезного для здоровья действия и их привлекательных цветов [Ninet L. y Renaut J. (1979) In: Peppler HJ., Perlman D. (eds). Microbial Technology. 2nd. Edition. vol. 1 Academic Press, NY, pp. 529-544]. -каротин или ликопен, и (ii) молекулы, называемые ксантофиллами, которые содержат кислород в различных формах (гидроксильные группы, эпоксигруппы, и т.д.), включая астаксантин, зеаксантин, капсантин, кантаксантин, лютеин и т.д. Эти две группы соединений характеризуются различным поведением в плане их физико-химических свойств и растворимости в органических растворителях. Все эти соединения играют важную роль в диете человека, интенсивно исследовались их свойства в качестве антиоксидантов для предотвращения злокачественных опухолей и других заболеваний человека и в качестве предшественников для витамина А. Недавно на крысах было продемонстрировано, что ликопен ингибирует вредное воздействие нитрилацетата железа на ДНК и предотвращает некроз печени [Matos H.R. et al. (2001) Arch. Biochem. Biophys. vol. 396]. Кроме того, благодаря их окраске от желтого до красного каротиноиды очень коммерчески значимы в качестве красителей и пищевых добавок с учетом их полезного для здоровья действия и их привлекательных цветов [Ninet L. y Renaut J. (1979) In: Peppler HJ., Perlman D. (eds). Microbial Technology. 2nd. Edition. vol. 1 Academic Press, NY, pp. 529-544].
Ликопен (C40H56) является промежуточным продуктом пути биосинтеза  -каротина и ксантофиллов. Он характеризуется молекулярной массой, равной 536,85, и следующей молекулярной формулой: -каротина и ксантофиллов. Он характеризуется молекулярной массой, равной 536,85, и следующей молекулярной формулой:
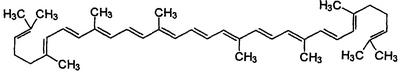
Ликопен
Ликопен
Действуя также как антиоксидант, ликопен предотвращает сердечно-сосудистые заболевания и некоторые типы злокачественных опухолей, и он активен при контроле роста [Giovannucci et al (1995) J Nat. Cancer Inst. 87: 1767-1776; Stahl W. and Sies, H. (1996) Arch. Biochem. Biophys. 336: 1-9; Clinton, SK. (1998) Nutr. Rev. 56: 35-51]. Это приводит к повышенной потребности в нем у некоторых потребителей. Получения ликопена в виде высокочистого соединения в прошлом было связано с химическим синтезом [US 5208381; US 5166445; US 4105855; US 2842599]. Однако теперь существуют альтернативные пути, основанные на источниках ликопена природного происхождения и специальных способах экстракции.
Продуцирование каротиноидов путем микробного биосинтеза является классическим примером конкуренции между химическими и биологическими способами. Препараты ликопена биологического происхождения получают из томатов [PCT WO 97/48287, EP 608027] или путем ферментации плесневых грибов родов Phycomyces, Blakeslea и Choanephora [GB 1008469, US 3097146, US 3369974, JP 73016189, JP 73016190, RU 2102416, WO 00/77234]. Для получения максимального выхода каротиноидов из B. trispora необходимо ферментировать вместе (+) и (-) штаммы [Ciegler, A. (1965) Advances in Applied Microbiology 7: 1-34: Plempel, M. (1965) Planta 65: 225-231; Sutter, RP. and Rafelson. ME. (1968) J. Bacteriology 95: 426-432]. Увеличение выхода каротиноидов в смешанных культурах связано с продукцией семейства кислотных соединений, названных фактором  или триспоровыми кислотами [WO 00/77234, Caglioti L. et al. (1966) Tetrahedron Supplement 7: 175-187]. При биосинтезе триспоровых кислот или триспоровыми кислотами [WO 00/77234, Caglioti L. et al. (1966) Tetrahedron Supplement 7: 175-187]. При биосинтезе триспоровых кислот  -каротин, продуцируемый (+) и (-) штаммами, метаболизируется до ретиналя и впоследствии до 4-дигидротриспорола. (+) штамм утилизирует 4-дигидротриспорол в качестве субстрата для образования дигидротриспоровой кислоты и ее метилового сложного эфира (метил-4-дигидротриспорат). Со своей стороны, (-) штамм метаболизирует 4-дигидротриспорол до триспорола. Наконец, метил-4-дигидротриспорат преобразуется в триспоровую кислоту (-) штаммом, а триспорол преобразуется в триспоровую кислоту (+) штаммом. Данное описание биосинтеза триспоровых кислот представляет собой упрощение, поскольку в течение данного процесса генерируется много совместных метаболитов, некоторые из которых обычны для (+) и (-) штаммов, но другие специфичны для одного из них. Относительные количества данных совместных метаболитов изменяются в зависимости от штаммов. -каротин, продуцируемый (+) и (-) штаммами, метаболизируется до ретиналя и впоследствии до 4-дигидротриспорола. (+) штамм утилизирует 4-дигидротриспорол в качестве субстрата для образования дигидротриспоровой кислоты и ее метилового сложного эфира (метил-4-дигидротриспорат). Со своей стороны, (-) штамм метаболизирует 4-дигидротриспорол до триспорола. Наконец, метил-4-дигидротриспорат преобразуется в триспоровую кислоту (-) штаммом, а триспорол преобразуется в триспоровую кислоту (+) штаммом. Данное описание биосинтеза триспоровых кислот представляет собой упрощение, поскольку в течение данного процесса генерируется много совместных метаболитов, некоторые из которых обычны для (+) и (-) штаммов, но другие специфичны для одного из них. Относительные количества данных совместных метаболитов изменяются в зависимости от штаммов.
Путь биосинтеза  -каротина (см. схему 1) описан для грибов, филогенетически родственных B. trispora, таких как Phycomyces blakesleeanus и Mucor circinelloides [Arrach N. et al. (2001) Proceedings of the National Academic of Sciences USA 98: 1687-1692; Velayos A. et al. (2000) European Journal of Biochemistry 267: 5509-5519]. По меньшей мере, три фермента необходимы для указанного биосинтеза: (i) фитоенсинтаза, которая объединяет вместе две молекулы геранилгеранилпирофосфата с образованием фитоена, (ii) фитоендегидрогеназа, которая вводит четыре двойные связи в молекулу фитоена для синтеза ликопена, и (iii) ликопенциклаза, которая с использованием в качестве субстрата ликопена образует кольца, находящиеся на двух концах молекулы -каротина (см. схему 1) описан для грибов, филогенетически родственных B. trispora, таких как Phycomyces blakesleeanus и Mucor circinelloides [Arrach N. et al. (2001) Proceedings of the National Academic of Sciences USA 98: 1687-1692; Velayos A. et al. (2000) European Journal of Biochemistry 267: 5509-5519]. По меньшей мере, три фермента необходимы для указанного биосинтеза: (i) фитоенсинтаза, которая объединяет вместе две молекулы геранилгеранилпирофосфата с образованием фитоена, (ii) фитоендегидрогеназа, которая вводит четыре двойные связи в молекулу фитоена для синтеза ликопена, и (iii) ликопенциклаза, которая с использованием в качестве субстрата ликопена образует кольца, находящиеся на двух концах молекулы  -каротина. На основе анализа мутантов B. trispora было сделано заключение, что путь биосинтеза -каротина. На основе анализа мутантов B. trispora было сделано заключение, что путь биосинтеза  -каротина для данного гриба сходен с описанным для P. blakesleeanus [Metha B.J. and Cerdá-Olmedo E. (1995) Applied Microbiology and Biotechnology 42: 836-838]. В случае P. blakesleeanus желтый цвет его мицелия может быть изменен путем мутации с получением штаммов с мицелием, окрашенным в красный, белый цвет и различные оттенки желтого. Красные мутанты накапливают ликопен, в то время как в белых отсутствует продукция каротиноидов или накопление фитоена. Для продукции ликопена необходимо располагать штаммами B. trispora, лишенными активности ликопенциклазы, или, альтернативно, в среду ферментации следует добавить химические средства, ингибирующие указанную ферментную активность. -каротина для данного гриба сходен с описанным для P. blakesleeanus [Metha B.J. and Cerdá-Olmedo E. (1995) Applied Microbiology and Biotechnology 42: 836-838]. В случае P. blakesleeanus желтый цвет его мицелия может быть изменен путем мутации с получением штаммов с мицелием, окрашенным в красный, белый цвет и различные оттенки желтого. Красные мутанты накапливают ликопен, в то время как в белых отсутствует продукция каротиноидов или накопление фитоена. Для продукции ликопена необходимо располагать штаммами B. trispora, лишенными активности ликопенциклазы, или, альтернативно, в среду ферментации следует добавить химические средства, ингибирующие указанную ферментную активность.
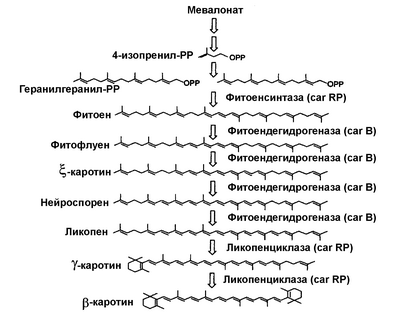
Схема 1
В патентах GB 1008469, US 3097146, US 3369974, JP 73016189, JP 73016190, RU 2102416 и WO 00/77234 описана продукция ликопена посредством ферментации плесневых грибов, таких как Phycomyces, Blakeslea и Choanephora. В патентах GB 1008469 и US 3097146 описаны способы ферментации B. trispora, основанные на контроле рН в интервале значений от 7,0 до 9,5, с получением выходов ликопена 99,7 мг/л через 7 суток ферментации. В патентах JP 73016189 и JP 73016190 описаны способы продукции ликопена плесневыми грибами, основанные на добавлении третичных аминов. В патенте RU 2102416 описано добавление аминометилпиридинов и настоев табака для индукции накопления ликопена. Помимо веществ, описанных в указанных патентах, опубликовано применение других азотосодержащих оснований для блокирования синтеза каротиноидов на уровне ликопена: никотин (JP09313167), имидазол, пиридин, морфолин, хинолин и некоторые замещенные производные [US 3369974; Ninet L., Renaut J. (1979) In: Peppler HJ., Perlman D (eds). Microbial Technology, 2nd. Edition, vol. 1 Academic Press. NY. pp. 529-544]. Более того, описаны мутанты B. trispora, которые накапливают ликопен без необходимости добавления третичных аминов [Metha B.J. and Cerdá-Olmedo E. (1995) Appl. Microbiol. Biotechnol. 42:836-838].
В дополнение к указанным выше плесневым грибам описана продукция ликопена в водорослях [JP 09313167 и JP 2000152778] путем ферментации Streptomyces chrestomycelicus var. rubescens [US 3467579] и путем модификации пути биосинтеза каротиноидов в Flavobacterium sp. R1534 [US 6124113].
Ликопен можно получать из растительных продуктов, таких как: томаты, морковь, перец, растительные масла и т.д. Так, в патенте WO 97/48287 описан способ получения обогащенных ликопеном смол из томатов путем сдавливания томатов до получения мякоти, экстракцию ликопена из мякоти органическими растворителями и последующей элиминацией растворителя путем упаривания, с получением смолы с содержанием ликопена в интервале 2-10%. Сходные способы получения смол, богатых каротиноидами в общем и ликопеном в частности, из растений и масел описаны в различных патентах, таких как US 5245095 и EP 580745, путем осаждения солями кальция, US 5019668, путем использования способа трансэтерификации маслами с последующей перегонкой, в WO 95/16363, где описано фракционирование томатов на различные фракции, которые содержат смолы, богатые каротиноидами, и в заявке PCT WO 90/08584, где описана экстракция ликопенов путем использования жидкостей в сверхкритическом состоянии, хотя полученный экстракт представляет собой смесь различных каротиноидов, и выходы экстракции были очень низкими из-за их низкой растворимости.
Во всех этих случаях за счет низкой концентрации ликопена в данных природных продуктах и внутриклеточном расположении данного соединения в некоторых органеллах, таких как хлоропласты и хромопласты, выходы экстракции и чистота продукта являются низкими, с получением смол, богатых ликопеном или обезвоженного сырья вместе с различными концентрациями других каротиноидных и некаротиноидных соединений. В большинстве случаев описанные способы экстракции требуют обработки плодов путем измельчения или давления для облегчения экстракции растворителя и освобождения таким образом богатого ликопеном внутриклеточного содержимого. Наконец, большая часть способов, описанных в данных патентах, требует применения органических растворителей, которые присутствуют в виде следов в полученных смолах. Более того, в патенте IL 107999 описано получение смол, очень богатых ликопеном, из мякоти томатов, хотя, как и ранее, полученный продукт не состоит из кристаллов ликопена высокой частоты, но из богатых ликопеном липидных концентратов.
С другой стороны, в патенте WO 97/15554 описана экстракция каротиноидов растительного происхождения из моркови и томатов, которые включают в себя ликопен, путем выделения хлоропластов и хромопластов, с последующим расщеплением указанных органелл белками-ферментами гидролиза, такими как пектины и/или протеазы, что делает возможным высвобождение ликопена, связанного с различными структурными белками. Путем последующей щелочной обработкой и экстракции смесями низкомолекулярных спиртов возможно получить экстракты ликопена с обогащением и чистотой, превышающими таковые для смол, хотя и без получения очищенных кристаллов ликопена, но богатых ликопеном грубых экстрактов. Сходным образом, концентрированные экстракты ликопена получают в патенте EP 608027 A2 путем выделения хромопластов томата, в которых ликопен присутствует в кристаллической форме. Данные экстракты из богатых ликопеном хромопластов томата используют непосредственно в качестве красителя без последующей экстракции кристаллов ликопена, избегая при этом изменения цвета ликопена во время экстракции и избавляясь от необходимости использования органических растворителей. В соответствии с описанным в данном патенте способом невозможно получить чистый ликопен в кристаллической форме, подходящей для применения в пищевой продукции или фармацевтических композициях, но применяемой только в качестве пищевого красителя в обезвоженной, высушенной вымораживанием или замороженной форме. Некоторые богатые каротиноидами микроскопические водоросли типа Dunaliella являются другим важным источником ликопена. Имеются различные способы экстракции каротиноидов, в частности ликопена, из данных организмов, как описано в патентах US 5378369, US 4713398 и US 4680314, путем экстракции органическими растворителями (хлоруглеродами, углеводородами, и т.д.) или пищевыми маслами (DE 4342798). Другой способ описан в заявке PCT WO 98/08584, в которой экстракт ликопена получают с использованием CO2 в сверхкритическом состоянии, хотя экстракт, полученный таким образом, также слабо очищен в плане ликопена.
Ликопен также может быть получен из некоторых плесневых грибов, таких как Blakeslea, Choanephora, Phycomyces или Mucor, путем ферментации в жидкой среде, что предоставляет преимущество по сравнению с продукцией ликопена из растительных продуктов или водорослей в повышенной концентрации данного соединения, равной в некоторых случаях примерно 5 мас. % относительно количества сухой биомассы, причем эти концентрации выше полученных из лучших разновидностей растений, а также в возможности биотехнологической разработки штаммов-гиперпродуцентов данных микроорганизмов, способом классического мутагенеза или с применением новых технологий молекулярной биологии, позволяющих проведение генетических манипуляций с данными микроорганизмами, с увеличением концентрации и выхода ликопена и устранения продукции других структурно родственных каротиноидов.
Как уже указывалось, получение кристаллического ликопена высокой чистоты из природных источников требует стадии экстракции органическими растворителями или жидкостями в сверхкритическом состоянии, и затем различных стадий очистки, таких как хроматография, способы адсорбции и элюции, и стадий преципитации и кристаллизации, как, например, описано в патентах US 3369974, EP 818255 и EP 242148. В большинстве случаев, в которых не используются данные стадии последующей очистки, и кристаллизация проводится прямо из экстракта путем упаривания растворителя до преодоления растворимости, чистота полученного продукта является очень низкой, и впоследствии необходимо осуществлять способы перекристаллизации полученного ликопена, с дополнительной сложностью, состоящей в том, что низкая растворимость продукта означает то, что должно использоваться большое количество растворителя для достижения стадии перекристаллизации, что далее приводит к снижению выхода (NL 6411184, US 4439629).
В патентной заявке WO 96/13178 описано получение концентратов стабилизированного кристаллического ликопена в совместимой с пищевым продуктом жидкой среде, в которой ликопен нерастворим, такой как этиленгликоль, этанол или глицерин, с получением, путем перемалывания, малых кристаллов (1-3 микрон) ликопена, суспендированных в жидкой среде. Более того, в патентной заявке WO 98/43620 описан способ выделения кристаллов ликопена из смолы путем омыления различных триглицеридов и фосфонатов при высокой температуре и последующем разбавлении водой с получением кристаллов ликопена с чистотой от 75 до 95%. Сходный способ недавно описан в WO 98/03480 для получения кристаллов  -каротина высокой чистоты путем промывки водой, низкомолекулярными спиртами или ацетоном, хотя это применение не описано для получения кристаллов ликопена высокой чистоты. -каротина высокой чистоты путем промывки водой, низкомолекулярными спиртами или ацетоном, хотя это применение не описано для получения кристаллов ликопена высокой чистоты.
Нестабильность каротиноидов в кристаллической форме хорошо известна, и одним из способов их стабилизации является получение масляных дисперсий. Более того, полагают, что каротиноиды, диспергированные в масле, легче всасываются организмом. Альтернативный способ стабилизации нестабильных соединений представляет собой их микроинкапсулирование в крахмальные матриксы. Так, в патентах US 2876160, US 2827452, US 4276312 и US 5976575 описано заметное повышение стабильности различных соединений, включая каротиноиды, путем их инкапсулирования в крахмальный матрикс.
Одной из основных сложностей применения каротиноидов в области красителей является их нулевая растворимость в воде, поскольку многие их применения осуществляются в водных средах. Данная проблема растворимости указана в документе US 3998753 и решена путем получения растворов каротиноидов в летучих органических растворителях, таких как галогенированные углеводороды, и эмульгирования их водным раствором лаурилсульфата натрия.
В патенте US 5364563 описан способ получения препарата каротиноидов в порошковой форме, который включает образование суспензии каротиноидов в масле с высокой точкой кипения. Суспензию сильно нагревают паром в течение периода, максимально равного 30 секундам, для образования раствора каротиноидов в масле. Затем данный раствор эмульгируют в водном растворе коллоида и затем эмульсию сушат распылением.
Подробное описание изобретения
Настоящее изобретение относится к серии способов получения ликопена с высокими выходами из гриба B. trispora, а также к способам его выделения и получения его препарата. Изобретение состоит из (i) планирования способов получения и отбора мутантов B. trispora, гиперпродуцирующих ликопен, (ii) разработки улучшенных условий ферментации, (iii) создания способов выделения ликопена из мицелия и (iv) получения препаратов, в которых преодолена проблема стабильности и растворимости в различных средах, существующая в данной области в настоящее время. B. trispora представляет собой гриб с высокой промышленной значимостью для биотехнологической продукции ликопена. Фактически, указанный способ демонстрирует конкурентоспособность по отношению к способу синтеза, используемому в настоящее время в промышленности.
С целью получения штаммов, которые являются гиперпродуцентами ликопена, во-первых разработан способ мутагенеза (+) и (-) штаммов B. trispora мутагенными средствами этилметансульфонатом (EMS) и N-метил-N’-нитро-N-нитрозогуанидином (NTG). Суспензии спор для мутации получали со скошенной среды YpSs. Споры ресуспендировали путем добавления 10 мл 0,1% раствора Triton X-100 на каждую скошенную среду. Остатки мицелия удаляли путем фильтрации через нейлоновый фильтр с размером пор 20 мкм. Концентрацию спор в суспензии доводили до 106 спор/мл. Способ мутации EMS состоял в инкубировании 106 спор/мл в 3%-ном растворе EMS в 0,1 М натрий-фосфатном буфере, рН 7,0, при комнатной температуре в течение 60 мин, достигая уровня смертности, равной примерно 99%. Мутированные споры промывали трижды 0,1%-ным Triton X-100 и центрифугировали при 3000 об./мин в течение 2 мин при 15°С. Способ мутации NTG состоял в инкубировании 106 спор/мл в растворе, содержащем 250 мкг/мл NTG и 0,1 М буфера цитрата натрия, рН 5,0, при комнатной температуре в течение 30 мин, достигая уровня смертности, равной примерно 95%. Мутированные споры промывали трижды 0,1%-ным Triton X-100 и центрифугировали при 3000 об./мин в течение 2 мин при 15°С. Чашки Петри, содержащие твердую среду Sutter IV, дополненную 0,1% Triton X-100, засеивали мутированными спорами и инкубировали при 25°С в течение 4 суток для получения выделенных колоний.
Стратегии, использованные для выбора (-) штаммов B. trispora – гиперпродуцентов ликопена, были следующими: (i) применение триспоровых кислот и (ii) интенсивность цвета колонии. Отбор продуцирующих ликопен мутантов путем добавления триспоровых кислот состоял из помещения фильтров, пропитанных триспоровыми кислотами, на колонии, полученные из мутированных спор. Триспоровые кислоты получали из смешанной культуры (+) и (-) штаммов B. trispora. Колонии и фильтры инкубировали при 25°С, и наблюдалось, что мутанты, продуцирующие ликопен, приобретали темно-красный цвет, по сравнению с продуцентами  -каротина, которые были окрашены оранжевым. Применяя данный способ в отношении штамма CMA3 (-), был отобран штамм LMA1 (-) (схема 2). Отбор продуцирующих ликопен мутантов как функцию интенсивности окраски колонии проводили следующим путем: штамм CMA1 (-) (продуцент -каротина, которые были окрашены оранжевым. Применяя данный способ в отношении штамма CMA3 (-), был отобран штамм LMA1 (-) (схема 2). Отбор продуцирующих ликопен мутантов как функцию интенсивности окраски колонии проводили следующим путем: штамм CMA1 (-) (продуцент  -каротина; см. схему 2) подвергали мутации и мутированные споры выращивали на чашках с твердой средой YEDPA. Затем отбирали те колонии, которые обладали более насыщенным желто-оранжевым цветом, чем родительский штамм CMA1 (-). Данным путем выделяли 2 колонии с насыщенным желто-оранжевым цветом (обозначенные CBM1 (-) и CBM2 (-)). -каротина; см. схему 2) подвергали мутации и мутированные споры выращивали на чашках с твердой средой YEDPA. Затем отбирали те колонии, которые обладали более насыщенным желто-оранжевым цветом, чем родительский штамм CMA1 (-). Данным путем выделяли 2 колонии с насыщенным желто-оранжевым цветом (обозначенные CBM1 (-) и CBM2 (-)).
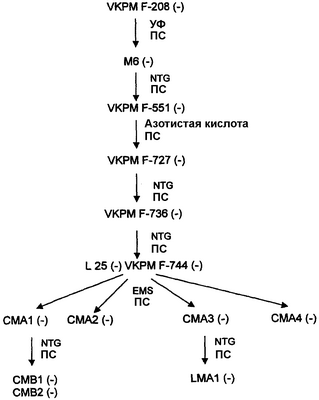
Схема 2
Филогения (-) штаммов B. trispora, полученных от B. trispora VKPN F-208 (-), с использованием способов мутации и селекции. УФ: ультрафиолет; ПС: природная селекция; NTG: N-метил-N’-нитро-N-нитрозогуанидин; EMS: этилметансульфонат.
Отбор мутантов B. trispora (+) – гиперпродуцентов ликопена осуществляли путем выращивания мутированных спор на чашках Петри, содержащих твердую среду Sutter IV, дополненную 0,1% имидазола. Далее часть каждой колонии переносили на чашку с PDA, на которую была ранее высеяна B. trispora (-). Уровень продукции ликопена в твердой среде определяли как функцию интенсивности окрашивания зоны пересечения колонии (+) штамма с таковой (-) штамма. Таким путем отбирали штамм B. trispora CPA1 (+) (схема 3), который обеспечивал высокий выход ликопена в смешанных твердых культурах с серией (-) штаммов. Уровень продукции штамма B. trispora CPA1 (+) затем анализировали в смешанных структурах в жидкой среде.
Система символов, используемых для обозначения выбранных штаммов, является следующей:
СМ: Каротин, минус (-).
LM: Ликопен, минус (-).
CP: Каротин, плюс (+).
LP: Ликопен, плюс (+).
Отношение родительских поколений следует алфавитному порядку: А является родительским для В, В является родительским для С, и так далее. Число после букв соответствует номеру мутанта. Например, обозначение CMA1 (-) означает, что это продуцирующий каротин штамм (С), минус (M), родительский для СМВ, и мутант номер 1. Сходным образом, CMA1 (-),CMA2 (-),CMA3 (-) и CMA4 (-) соответствуют мутантам 1, 2, 3 и 4 того же поколения.
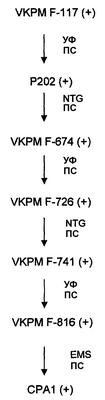
Схема 3
Филогения (+) штаммов B. trispora, полученных от B. trispora VKPN F-117 (+), с использованием способов мутации и селекции. УФ: ультрафиолет; ПС: природная селекция; NTG: N-метил-N’-нитро-N-нитрозогуанидин; EMS: этилметансульфонат.
(+) и (-) штаммы B. trispora, отобранные на твердой среде, ферментировали во флаконе с целью определения уровня продукции ликопена в твердой среде и смешанной культуре. Для этого отдельные флаконы инокулированного материала высевали с штаммами B. trispora CPA1 (+) и B. trispora CMB2 (-), и затем смешанные ферментации обоих штаммов осуществляли во флаконе. В начале ферментации (0-50 часов) добавляли ингибитор фермента ликопенциклазы с целью блокирования пути биосинтеза на уровне ликопена (например, имидазол в концентрации 0,7-0,8 г/л). В конце ферментации (примерно 6 суток) мицелий B. trispora лизировали путем встряхивания на вортексе, ликопен экстрагировали органическими растворителями (например, ацетоном) и определяли его концентрацию и чистоту путем HPLC. Тот же тип ферментации осуществляли с штаммами B. trispora CPA1 (+) и B. trispora LMA1 (-), за исключением того, что в данном случае не было необходимости добавлять ингибитор фермента ликопенциклазы. Выходы, полученные с данными штаммами в смешанной культуре, составляли 1,2 г/л.
Штаммы CPA1 (+) и CMB2 (-) культивировали в полукоммерческом ферментере с целью определения выхода ликопена. Для этого их отдельно выращивали во флаконах, отдельно переносили в промежуточные резервуары для роста, и наконец, их ферментировали вместе. Между 25 и 35 часами ферментации добавляли имидазол в качестве ингибитора ликопенциклазы. Ферментацию инкубировали в течение 100-140 часов. Среднее значение выхода ликопена, полученное в серии различных ферментаций штаммов CPA1 (+) и CMB2 (-), составляло 3,4 г/л.
Штаммы CPA1 (+) и LMA1 (-) культивировали в полукоммерческом ферментере с целью определения выхода ликопена без добавления ингибиторов фермента ликопенциклазы. Ферментацию проводили, как указывалось ранее для штаммов CPA1 (+) и CMB2 (-), но без добавления имидазола. Среднее значение выхода ликопена, полученное в серии различных ферментаций штаммов CPA1 (+) и LMA1 (-), составляло 1,6 г/л.
Более высокий выход на данной стадии ферментации получали путем контроля возраста вегетативных стадий роста штаммов B. trispora. Так, используемые для инокуляции культуры имеют возраст 30-60 часов, предпочтительно 48 часов, как для (+), так и для (-) штаммов, но с различием в количестве высеянных спор: 800-1000 спор/мл и 40000-60000 спор/мл соответственно. Инкубацию проводили примерно при 25°С с 0,1% об./об. каждого материала инокуляции, засеянного в фазе первичной культуры. Возраст указанных первичных культур варьирует в интервале 30-60 часов, предпочтительно 36-48 часов, при температурах в интервале 26-28°С. Затем первичные фазы (+)/(-) смешивают в отношении 1/10 об./об. и ферментеры засевают 10-20% об./об. смесью указанных фаз.
В свете внутриклеточных характеристик каротиноидного компонента, биологически синтезируемого при ферментации, способ выделения из культуральной среды, полученной, как заявлено в обычных способах, в качестве первой стадии включает отделение биомассы от культуральной среды. Данное отделение может осуществляться обычными способами фильтрации, с использованием обычных технологий с фильтрами, будь то ленточные фильтры, барабанные фильтры, пресс-фильтры, и т.д., в которых барьер, состоящий из ткани фильтра, отделяет биомассу и позволяет жидкой фазе проходить без биомассы, или центрифугирования, при котором за счет использования разницы плотности между культуральной средой и биомассой (обычно более плотной) применяется прибор, такой как центрифужный разделитель, отстойник и тому подобное, где более тяжелая фаза становится концентрированной и отделяется от жидкой фазы вместе с максимально возможным количеством биомассы. Одной из целей данной стадии является снижение потерь и оптимизация характеристик каждой фазы с достижением наибольшего количества биомассы с наивысшим содержанием сухого остатка и удаления большей части среды ферментации с минимальным количеством активного вещества.
Полученный в результате влажный мицелий содержит более 95% каротиноидов, продуцированных при ферментации, предпочтительно более 97% и более предпочтительно более 99%. Содержание каротиноидов в водной фазе поэтому составляет менее 5%, предпочтительно менее 3% и более предпочтительно менее 1%. Из этого влажного мицелия будет возможно на последующих стадиях выделить ликопен. Однако было обнаружено, что в сочетании с ферментациями данный мицелий все же характеризуется относительно высоким содержанием липофильных компонентов от 15 до 20% (жирные кислоты и масла), которые вызывают проблемы очистки на более поздних стадиях, так что становится необходимым введение в этом месте стадии очистки биомассы. Стадия очистки включает в себя ресуспендирование биомассы в спирте: метаноле, этаноле, пропаноле, изопропаноле, или любом другом спирте, в котором растворимость ликопена является очень низкой, до степени, достаточной для достижения максимальной очистки липидных компонентов. Таким образом, влажный мицелий ресуспендируют количеством спирта, изменяющимся от 1 мл/г до 10 мл/г влажного мицелия. Температура ресуспендирования варьирует от 0°С и до точки кипения спирта, предпочтительно от 10 до 50°С. Время контакта находится в интервале от 5 минут до 24 часов. Суспензию в спирте, полученную таким образом, фильтруют или центрифугируют, так что содержание твердых веществ в фильтрате или осветленной жидкости практически равно нулю. Полученный в результате влажный мицелий, который содержит спирт и воду в различных пропорциях, содержит более 93% каротиноидов, продуцированных при ферментации, предпочтительно более 95% и более предпочтительно более 97%.
В надосадочной жидкости или фильтрате, который содержит остатки культуральной среды или спирта, содержание каротиноидов составляет менее 2%, предпочтительно менее 1%, относительно изначальной культуральной среды. Данная обработка спиртом дает возможность для удаления некоторого количества растворимых в спирте липофильных веществ, в варьирующих количествах, зависящих от характеристик используемой культуральной среды, с осуществлением предварительной очистки, дающей возможность получения кристаллического конечного продукта высокой очистки. Более того, за счет удаления варьирующей части воды из начального влажного мицелия значительно облегчается последующий процесс сушки. Путем смешивания культуральной среды непосредственно со спиртом и поддержания минимального времени контакта достигается эффект очистки, эквивалентный тому, что описан ранее, так что процесс упрощается путем элиминации одной операции разделения твердой и жидкой фаз. Отношение культуральная среда/спирт может меняться от 1/0,5 до 1/5 и предпочтительно находится от 1/1 до 1/3. Температура смеси меняется от комнатной температуры до точки кипения смеси, и предпочтительно от комнатной температуры и 60°С.
Обезвоженный/очищенный мицелий сушат. Сушка может проводиться обычными периодическими или непрерывными способами. Температура сушки варьирует от комнатной температуры до 150°С, предпочтительно она не должна превышать 60°С и более предпочтительно она должна быть ниже 50°С. Время сушки зависит от используемой температуры и варьирует от 1 часа до 72 часов. Из-за возможного разложения данных каротиноидов окислением атмосферным кислородом лучше всего осуществлять данную операцию сушки в отсутствие кислорода, или в атмосфере азота, или, по меньшей мере, в вакууме. Тот факт, что каротиноидный продукт является внутриклеточным, означает, что требуется создание соответствующих условий обработки очищенной биомассы, путем сушки и перемалывания, сушки и дезинтеграции или дезинтеграции биомассы, что способствует смешиванию с растворителями и облегчает экстракцию растворителем. Чтобы растворитель имел хороший доступ к подлежащим экстракции каротиноидам, необходима предварительная операция разрушения мицелия для максимизации области контакта. Оптимальный размер частиц сухого разрушенного мицелия должен составлять менее 3 мм, предпочтительно менее 1 мм и более предпочтительно менее 0,5 мм.
Перемалывание может проводиться на сухом продукте посредством механических систем с шарнирными или фиксированными частями: молотками, ситами и т.д., путем пропускания через вращающиеся цилиндры, давящие один на другой (сдавливание или экструзия). Также возможно осуществлять сушку и перемалывание за одну стадию посредством систем мгновенной (немедленной) сушки в струйной мельнице, где влажный продукт подается в рециркулирующий поток газа при высокой температуре таким образом, что время пребывания является минимальным, для упаривания содержимого жидких компонентов, и продукт транспортируется с изменением плотности в циклон, откуда он извлекается. Во время сушки и по пути сушки также имеет место эффект гомогенизации, поскольку частицы сталкиваются со стенками.
Для экстракции ликопена из подготовленного описанным способом мицелия могут использоваться различные органические растворители. Данное изобретение относится к применению растворителей пищевой марки, рассматриваемых как натуральные, таких как сложные эфиры кислот, предпочтительно этил-, пропил-, изопропил-, бутил- или изобутилацетаты, которые сочетают довольно высокую растворимость для каротиноидных компонентов с их совместимостью как растворителей, входящих в группу класса III ICH. Данные растворители допустимы к применению как на национальном уровне, так и на уровне Сообщества в области фармакологии и пищевой области (RDL12/04/90 и RDL16/10/96). Как заявлено в ICH, содержание остаточного растворителя должно быть ниже 5000 м.д., предпочтительно ниже 1000 м.д. и более предпочтительно ниже 100 м.д., из расчета для каждого случая по сухому веществу в жидкой смеси. Температура экстракции варьирует от комнатной температуры до точки кипения растворителя, предпочтительно от 50°С до 80°С. Время экстракции является минимальным, необходимым для достижения растворения, от 1 секунды до 1 часа, предпочтительно от 1 минуты до 15 минут. Количество используемого растворителя зависит от температуры и от содержания каротиноидов в мицелии, варьируя от 5 мл/г до 30 мл/г биомассы. Число экстракций варьирует от 1 до 3. Количество экстрагированных каротиноидов составляет более 85%, предпочтительно более 90% и более предпочтительно более 95%.
После получения богатый каротиноидами экстракт должен концентрироваться до определенного объема. Конечная концентрация каротиноидов в растворе после концентрирования предпочтительно составляет от 10 до 50 г/л. Температура концентрирования должна быть ниже 80°С, предпочтительно ниже 70°С, и более предпочтительно ниже 50°С. После концентрирования экстракта до конечного объема необходимо добавлять вещество, не растворяющее каротиноиды, в частности спирт и более конкретно метанол, этанол, пропанол, изопропанол или любой другой спирт, в котором растворимость ликопена очень низка, так что выход кристаллического ликопена заметно возрастает. Добавление спирта также имеет эффект очистки. Время кристаллизации варьирует от 15 мин до 24 часов, предпочтительно от 1 ч до 12 ч и более предпочтительно от 3 до 8 часов. Температура кристаллизации должна быть ниже 25°С, предпочтительно ниже 5°С.
Отделение кристаллов от жидкости кристаллизации может осуществляться путем фильтрации или центрифугирования, при замене жидкости кристаллизации, в которую погружены кристаллы, промывкой тем же спиртом, который использовался в качестве нерастворяющей жидкости. Полученные кристаллы сушат в вакууме при комнатной температуре, по меньшей мере, в течение 1 часа до получения содержания остаточного растворителя, которое соответствует нормам, установленным законами, указанными ранее, и в случае ликопена потери при сушке составляют менее 0,5%.
Чистота полученных кристаллов соответствует титру, равному примерно 95%, определенному посредством спектрофотометрии путем считывания поглощения при 472 нм раствора кристаллов в н-гексане (EI%/1 см = 3450) с содержанием других каротиноидов ниже 3%. Содержание цис-ликопена составляет ниже 3%.
Способ по данному изобретению особенно подходит для получения кристаллического ликопена из микробного источника, предпочтительно из водорослей, грибов или дрожжей, более предпочтительно из грибов порядка Mucorales и более предпочтительно B. trispora. Исключительная чистота, достигнутая для полученных посредством указанной методологии кристаллов, и применение растворителей, которые считаются натуральными, означает, что данные кристаллы могут использоваться в пищевой, фармацевтической или косметической промышленности.
Кристаллический продукт, полученный посредством методологии, описанной в данном изобретении, может упаковываться в непрозрачные контейнеры, которые предотвращают фотодеградацию продуктов, в отсутствие кислорода (инертная атмосфера или вакуум) для предотвращения окисления и при температурах от 0 до 5°С. Упакованный надлежащим образом продукт может использоваться и продаваться «как есть». Однако целесообразно увеличить его стабильность последующими стадиями композиции и усовершенствования, где используется добавление антиоксидантов, что дает возможность для получения конечного продукта со сроком хранения выше 6 месяцев при надлежащей упаковке.
Другой важной целью настоящего изобретения является способ получения ликопена, который охватывает его композицию в различных представлениях, в зависимости от характеристик применения, для которого надлежит использовать этот ликопен. Первое применение, называемое микрокристаллической суспензией ликопена в растительном масле, состоит из предварительного смешивания указанного выше количества кристаллического ликопена с различными количествами растительного масла. Тип растительного масла может сильно варьировать, причем наиболее обычными, хотя и не единственными, являются подсолнечное масло, оливковое масло, кукурузное масло, соевое масло, масло хлопчатника и т.д. Дозировка ликопена является функцией требуемой конечной силы действия, причем наиболее обычными количествами являются суспензии с содержанием ликопена от 5 до 60%, предпочтительно от 10 и 30%. Для увеличения стабильности смеси добавляют обычные жирорастворимые антиоксиданты, такие как природные токоферолы, и предпочтительно D,L-альфа-токоферол. Доля данного компонента изменяется от 0,2 до 15% относительно массы ликопена, предпочтительно 0,5 до 5%. Чтобы композиция, которая содержит ликопен, обладала удовлетворительной биологической активностью, необходимо уменьшить размер кристаллов ликопена. Это достигается в обычных системах перемалывания, которые подходят для жидких смесей. Конкретным объектом данного изобретения являются шаровые мельницы, которые обеспечивают уменьшение размера кристаллов ниже 10 микрон, предпочтительно ниже 5 микрон и даже более предпочтительно ниже 2 микрон, с использованием микросфер с диаметром от 0,5 до 0,75 мм. Тем не менее размер кристаллов может изменяться, как заявлено в конкретном применении суспензии, с использованием подходящих сфер и условий перемалывания в каждом случае. Данные размеры кристаллов также будет определять реологические свойства смеси, особенно ее вязкость, которые также могут доводиться, как указано в требованиях. Данные микрокристаллические суспензии ликопена в масле подходят для применения ликопена в липофильных средах: маргарине, сливочном масле, кремах и т.д.
Второе применение, называемое диспергируемой в холодной воде (CWD) композицией ликопена, основано на растворении ликопена в органическом растворителе и его последующем микроинкапсулировании в модифицированных крахмалах. Растворители, более подходящие для осуществления данного растворения, представляют собой хлороформ, бензол, толуол, и т.д., поскольку в них данная молекула характеризуется высокой растворимостью. Особенно подходящим является метиленхлорид. Однако из-за галогенированного характера последнего возможно использовать растворители пищевой марки, которые считаются природными, такие как сложные эфиры кислот, предпочтительно этил-, пропил-, изопропил-, бутил-, изобутилацетат или другие ацетаты, которые сочетают довольно высокую растворимость для каротиноидных компонентов с их совместимостью как растворителей, входящих в группу класса III ICH. Концентрация ликопена в органическом растворителе может изменяться от 1 до 50 г/л, предпочтительно от 10 до 30 г/л. Температура растворения может варьировать от комнатной температуры до точки кипения растворителя, предпочтительно от 20 до 130°С. Тот факт, что процентное содержание цис-ликопена является функцией отношения температура/время процесса растворения ликопена в органическом растворителе, означает, что если есть потребность получения продукта с низким содержанием данного изомера, используют низкую температуру растворения или, иначе, очень короткое время растворения. Так, для достижения низких уровней цис при использовании в качестве растворителя метиленхлорида растворение можно проводить при 20-35°С в течение времени от 1 до 15 минут. Если, с другой стороны, растворитель представляет собой изобутилацетат, растворение предпочтительно может проводиться при температуре от 70 до 130°С в течение нескольких секунд. Однако, если уровень цис-изомера не имеет отношения к проблеме, растворение можно проводить без ограничения его условий, кроме достижения полной растворимости молекулярного уровня ликопена в используемом растворителе. Для увеличения стабильности конечного препарата (композиции) один или смесь нескольких антиоксидантов растворяют вместе с ликопеном в органическом растворителе; данные антиоксиданты предпочтительно включают в себя такие, как токоферол, аскорбилпальмитат и т.д., каждый из них в отношении от 1 до 30%, предпочтительно от 10 до 20% относительно массы ликопена. Также возможно вводить в смесь растительное масло: подсолнечное масло, оливковое масло, соевое масло, масло хлопчатника и т.д., с целью облегчения растворения ликопена и придания препарату дополнительной стабильности. Отношение ликопен/масло может изменяться от 10/1 до 1/10.
Полученный таким образом раствор ликопена смешивают и эмульгируют с водным раствором, который содержит эмульгирующее средство, например модифицированный крахмал, более конкретно сложные эфиры-производные крахмала, предпочтительно октенилсукцинаты-производные крахмала различных молекулярных масс и особенно, но не исключительно, Purity Gum 2000® от National Starch или Cleargum CO 01® от Roquette, и средство микроинкапсулирования, состоящее, например, из модифицированного крахмала, более конкретно сложных эфиров-производных крахмала, предпочтительно, октенилсукцинатов-производных крахмала различных молекулярных масс и особенно, хотя не исключительно, из HiCap 100® или Capsul® от National Starch. Пропорции, в которых смешиваются эмульгирующее средство и средство микроинкапсулирования, могут изменяться от 5/95 до 95/5, предпочтительно от 25/75 до 75/25, более предпочтительно от 40/60 до 60/40. Содержание воды в каждом из компонентов смеси эмульгирующего средства и средства микроинкапсулирования вариабельно и может быть от 1 до 30%, предпочтительно от 5 и 20% и более предпочтительно 10%. Смесь водной и органической фаз эмульгируют и полученную эмульсию гомогенизируют с использованием систем гомогенизации с дифференциальным давлением типа Manton Gaulin или Microfluidizer, как обычно используется, и предпочтительно путем гомогенизации тангенциальным трением, например, в эмульсификаторе типа Ultraturrax, в течение времени, которое изменяется как функция энергии, подаваемой оборудованием, и объема подлежащей эмульгированию смеси, с целью получения среднего размера мицелл менее 10 микрон, предпочтительно менее 2 микрон и более предпочтительно от 0,1 до 1 микрон.
Как только образуется эмульсия, осуществляется упаривание органического растворителя предпочтительно путем вакуумной перегонки при температуре ниже 50°С. Как только происходит упаривание растворителя, имеет место микрокристаллизация ликопена в матриксе из крахмала. Как только растворитель упаривается, испарение продолжается с последовательным добавлением воды до получения остаточного содержания растворителя, согласующегося с нормами по максимальной концентрации, установленными законодательством, и сухого остатка, подходящего для того типа сушки, который надлежит применять к данной жидкой смеси. Подходящие значения количества сухого вещества в суспензии микроинкапсулированного ликопена составляют от 1 до 30% и предпочтительно от 10 до 20%.
По настоящему изобретению обнаружено, что способ сушки высокотемпературным распылением (атомизация) и способ распыления в псевдоожиженном слое (гранулирование) подходят для сушки водной суспензии полученного ликопена. Другой альтернативой может быть сушка замораживанием. Как заявлено для способа сушки путем распыления, подходящие входные температуры воздуха для сушки составляют от 100 до 200°С, тогда как подходящие выходные температуры составляют от 60 до 120°С. Распыленный продукт имеет размер частиц от 10 до 200 микрон. С целью увеличения размера частиц и снижения доступной площади, и усиления таким образом сопротивляемости продукта окислению, распыленный продукт может агломерироваться путем пульверизации раствора одного из модифицированных крахмалов, использованных в препарате, или суспензии самого микроинкапсулированного ликопена в псевдоожиженном слое указанного распыленного продукта, что делает возможным достижение размеров частиц, изменяющихся от 50 до 500 микрон, предпочтительно от 200 до 300 микрон.
Способ гранулирования включает в себя применение гранулятора с псевдоожиженным слоем, в который помещается начальный материал, который может быть обычным инертным материалом, таким как частицы сахара, или тонким порошком интересующего материала для сушки, полученного предшествующими способами гранулирования или в процессе сушки распылением. Частицы сохраняют движение за счет воздуха, и температура слоя изменяется от 30 до 90°С, предпочтительно от 50 до 80°С. Суспензию микроинкапсулированного ликопена распыляли посредством воздуха, перед этим нагретого до температуры от 20 до 140°С в псевдоожиженном слое, при скорости, которая гарантирует, что частицы, которые будут покрываться, не станут слишком влажными и не образуют комков. Гранулированный продукт имеет размер частиц от 100 до 2000 микрон, предпочтительно от 100 до 800 микрон и более предпочтительно от 100 до 300 микрон. По выполнении пульверизации тем или иным способом частицы могут быть покрыты. Это покрытие может осуществляться водными растворами с содержанием примерно 0,5-10% по сухой массе различных сахаров или даже одного или смеси крахмалов, которые составляют формулу, являющуюся объектом настоящего изобретения.
Внесение микроорганизмов в банк в соответствии с Будапештским соглашением
Штаммы Blakeslea trispora внесены согласно Будапештскому соглашению в Всероссийскую коллекцию промышленных микроорганизмов (VKPM), ГосНИИ Генетика, Дорожный проезд 1, Москва 113545 (Россия), со следующими номерами и датами: VKPM F-117 21.12.1979, VKPM F-208 20.12.1979, VKPM F-551 19.11.1992, VKPM F-674 19.11.1992, VKPM F-726 21.01.1997, VKPM F-727 21.01.1997, VKPM F-736 07.10.1997, VKPM F-741 28.01.1998, VKPM F-744 28.01.1998 и VKPM F-816 13.12.2000.
Следующие примеры описывают настоящее изобретение подробно и без ограничений.
Пример 1
Стратегии мутации (+) и (-) штаммов B. trispora
Вначале способ мутации был разработан для (+) и (-) штаммов B. trispora, для которых анализировали следующее: (i) различные типы мутагенных средств, (ii) концентрация мутагена, (iii) концентрация спор, (iv) рН инкубации, и (v) время обработки. Таким образом в качестве мутагенных средств были выбраны этиленметансульфонат (EMS) и N-метил-N’-нитро-N-нитрозогуанидин (NTG).
Суспензии спор, подлежащих мутации, получали из скошенных культур со средой YpSs, которая характеризовалась следующей композицией: дрожжевой экстракт 4 г/л, растворимый крахмал 15 г/л, K2HPO4 1 г/л, MgSO4·7H2O 0,5 г/л и агар 15 г/л, с конечным рН, равным 5,8. Споры ресуспендировали добавлением 10 мл 0,1% раствора Triton X-100 к каждой скошенной культуре. Остатки мицелия удаляли фильтрацией через нейлоновый фильтр с размерами пор 20 мкм. Концентрация спор в суспензии составляла около 106 спор/мл.
Способ мутации EMS состоял в инкубации 106 спор/мл в 3%-ном растворе EMS в 0,1 М натрийфосфатном буфере, рН 7,0, при комнатной температуре в течение 60 мин с достижением коэффициента смертности около 99%. Мутированные споры промывали 3 раза 0,1%-ным Triton X-100, центрифугировали при 15°С и 3000 об./мин в течение 2 мин.
Способ мутации NTG состоял в инкубации 106 спор/мл в растворе, содержащем 250 мкг/мл NTG и 0,1 М натрийцитратный буфер, рН 5,0, при комнатной температуре в течение 30 мин с достижением коэффициента смертности около 95%. Мутированные споры промывали 3 раза 0,1%-ным Triton X-100, центрифугировали при 15°С и 3000 об./мин в течение 2 мин.
Мутированные споры использовали для засева чашек Петри, содержащих твердую среду Sutter IV, дополненную 0,1% Triton X-100. Композиция на литр среды Sutter IV была следующей: 40 г глюкозы, 4 г L-аспарагина, 10 г KH2PO4, 40 мл 50× раствора микроэлементов и 30 г агара. 50× раствор микроэлементов состоит из: 25 г/л× MgSO4·7H2O, 1,82 г/л CaCl2·2H2O, 0,05 г/л тиамина, 0,1 г/л лимонной кислоты, 0,075 г/л Fe(NO3)3·9H2O, 0,05 г/л ZnSO4·7H2O, 0,17 г/л MnSO4·H2O, 0,025 г/л CuSO4·5H2O и 0,025 г/л NaMoO4·2H2O. Засеянные чашки инкубировали при 25°С в течение 4 суток для получения выделенных колоний.
Пример 2
Стратегии отбора мутантов B. trispora (-), которые являются гиперпродуцентами ликопена
В данном примере описываются стратегии отбора (-) штаммов B. trispora, которые являются гиперпродуцентами ликопена, основанные на (i) применении триспоровых кислот и (ii) интенсивности цвета колонии. На фиг.1 показана филогения (-) штаммов B. trispora, используемых по настоящему изобретению.
Отбор продуцирующих ликопен мутантов путем добавления триспоровых кислот осуществляется путем помещения стерильных фильтров диаметром примерно 0,6 мм, пропитанных триспоровыми кислотами, на колонии, полученные из мутированных спор. Триспоровые кислоты получают путем экстракции надосадочной жидкости из смешанной культуры (+) и (-) штаммов B. trispora одним объемом хлороформа после подкисления образца до рН 2. Органическую фракцию экстрагировали одним объемом 4% раствора бикарбоната натрия, собирали водную фазу, которую снова подкисляли и экстрагировали хлороформом. Далее хлороформ испаряли до сухости и остаток, обогащенный триспоровыми кислотами, растворяли в этаноле. Триспоровые кислоты подвергали количественному анализу путем измерения поглощения при 325 нм и принятия коэффициента поглощения равным 70 мл·мг-1·см-1 (Sutter P.R., Capage D.A., Harrison T.L., Keen W.A. 1973. J. Bacteriology 114: 1074-1082).
Стерильные фильтры инкубировали в растворе 1,2 мг/мл триспоровых кислот в этаноле и затем оставляли высыхать при комнатной температуре в стерильных условиях. Затем фильтры помещали на мутантные колонии, ранее выращиваемые в течение 4 суток при 25°С. Чашки инкубировали при 25°С в течение следующих 3 суток и наблюдали, что продуцирующие ликопен мутанты становились темно-красного цвета по сравнению с продуцентами  -каротина, цвет которых был оранжевым. -каротина, цвет которых был оранжевым.
Применяя данный способ к штамму CMA3 (-), получали мутант LMA1(-) (фиг.1), который может содержать мутацию гена caRP, кодирующего фермент ликопенциклазу, и поэтому вместо продукции  -каротина должен накапливать промежуточный продукт ликопена во время процесса ферментации каротиноидов. Поэтому штамм LMA1 способен продуцировать ликопен без необходимости добавления специфичных ингибиторов активности ликопенциклазы (пример 5). -каротина должен накапливать промежуточный продукт ликопена во время процесса ферментации каротиноидов. Поэтому штамм LMA1 способен продуцировать ликопен без необходимости добавления специфичных ингибиторов активности ликопенциклазы (пример 5).
Отбор продуцирующих ликопен мутантов относительно интенсивности цвета колонии осуществляли следующим образом. Штамм CMA1 (продуцент  -каротина; см. фиг.1) мутировали, как описано в примере 1. Мутированные споры высевали на чашки с твердой средой YEPDA (бактопептон 20 г/л, экстракт дрожжей 10 г/л, глюкоза 20 г/л и агар 20 г/л, до конечного рН 6,0) и инкубировали при 25°С в течение 24 часов, и затем при 20°С в течение 48-72 часов. Наконец, отбирали колонии более темного желто-оранжевого цвета, чем у родительского штамма CMA1 (-). Таким путем выделяли 2 колонии темного желто-оранжевого цвета (обозначенные CMB1(-) и CMB2(-)). Штаммы CMB1 и CMB2 могут представлять собой гиперпродуценты ликопена в смешанных ферментациях с добавлением специфичных ингибиторов активности ликопенциклазы (например, имидазола; пример 4). -каротина; см. фиг.1) мутировали, как описано в примере 1. Мутированные споры высевали на чашки с твердой средой YEPDA (бактопептон 20 г/л, экстракт дрожжей 10 г/л, глюкоза 20 г/л и агар 20 г/л, до конечного рН 6,0) и инкубировали при 25°С в течение 24 часов, и затем при 20°С в течение 48-72 часов. Наконец, отбирали колонии более темного желто-оранжевого цвета, чем у родительского штамма CMA1 (-). Таким путем выделяли 2 колонии темного желто-оранжевого цвета (обозначенные CMB1(-) и CMB2(-)). Штаммы CMB1 и CMB2 могут представлять собой гиперпродуценты ликопена в смешанных ферментациях с добавлением специфичных ингибиторов активности ликопенциклазы (например, имидазола; пример 4).
Пример 3
Стратегии отбора мутантов B. trispora (+), которые являются гиперпродуцентами ликопена
Отбор мутантов – гиперпродуцентов ликопена B. trispora (+) осуществляли с использованием мутированных спор способом, описанным в примере 1. Данные споры высевали на чашках Петри, которые содержали твердую среду Sutter IV, дополненную 0,1% имидазола и инкубировали при 25°С в течение 7 суток для получения выделенных колоний. Затем часть каждой колонии переносили на чашку PDA, куда перед эти была высеяна B. trispora (-). Расстояние между точками высева (+) и (-) штаммов должно составлять примерно 2 см. Уровень продукции ликопена в твердой среде оценивается по интенсивности окрашивания зоны пересечения колонии (+) штамма с таковой (-) штамма. Таким образом отбирали штамм B. trispora CPA1 (+), и это обеспечивало более высокий выход ликопена в смешанных твердых культурах с серией (-) штаммов. Уровень продукции штамма B. trispora CPA1 (+) затем анализировали в смешанной культуре в жидкой среде, как описано в примерах 4 и 5. На схеме 3 показана филогения штаммов B. trispora (+), использованных по настоящему изобретению.
Пример 4
Способ получения ликопена во флаконе посредством смешанной культуры (+) и (-) штаммов B. trispora с добавлением ингибиторов фермента ликопенциклазы
(+) и (-) штаммы B. trispora, выбранные как описано в примерах 1, 2 и 3, ферментировали во флаконе с целью определения уровня продукции ликопена в жидкой среде и смешанной культуре. Для этого получали среду инокуляции со следующим составом на литр: 23 г соевой муки, 47 г маисовой муки, 0,5 г KH2PO4, 0,002 г тиамина гидрохлорида и рН доводили до 6,3. Штамм B. trispora CPA1 (+) высевали во флакон объемом 500 мл, содержащий 67 мл среды, в отношении 103 спор на мл. Штамм B. trispora CMB2 (-) высевали во флакон объемом 500 мл, содержащий 100 мл среды, в отношении 104 спор на мл. Оба типа инокулятов инкубировали при 25°С и 250 об./мин в течение 44 часов.
По окончании инкубации инокуляты (+) и (-) штаммов смешивали в отношении 1/10 (об./об.) и смесь использовали для инокуляции флаконов объемом 250 мл, содержащих 20 мл среды ферментации в отношении, равном 4 мл смеси штаммов на флакон. Данные флаконы инкубировали при 25°С и 250 об./мин в течение 5-6 суток. Используемая среда ферментации характеризовалась следующим составом на литр: 44 г соевой муки, 19 г маисовой муки, 5,5 г KH2PO4, 0,002 г тиамина гидрохлорида, 100 мл растительного масла, и рН доводили до 7,5. Среду распределяли по флаконам объемом 250 мл, которые инокулировали 20% смесью (+) и (-) штаммов B. trispora. От 0-го до 36-го часа ферментации добавляли ингибитор фермента ликопенциклазы с целью блокирования пути биосинтеза на уровне ликопена (например, 0,75 мг/мл имидазола). Флаконы инкубировали при 25°С и 250 об./мин в течение 6 суток. В конце ферментации получали смесь среды ферментации, стеклянных шариков и метиленхлорида/метанола (1/1). Мицелий B. trispora лизировали путем встряхивания на вортексе с высвобождением внутриклеточного ликопена. Ликопен, экстрагированный смесью метиленхлорид/метанол (отношение 1:1), разводили ацетоном. Концентрацию и чистоту ликопена определяли с использованием обращенно-фазовой HPLC.
Выход, полученный в смешанных ферментациях штаммов B. trispora CPA1 (+) и B. trispora CMB2 (-), составлял 3 г/л ликопена в присутствии имидазола (фиг. 1).
Пример 5
Способ получения ликопена во флаконе посредством смешанной культуры штаммов B. trispora CPA1 (+) и B. trispora LMA1 (-) без добавления ингибиторов фермента ликопенциклазы
Штаммы B. trispora CPA1 (+) и LMA1 (-), выбранные, как описано в примерах 1, 2 и 3, ферментировали во флаконе с целью определения уровня продукции ликопена в жидкой среде и смешанной культуре. Для этого получали инокулят из данных (+) и (-) штаммов и проводили ферментацию во флаконе, как описано в примере 4. Различие состоит в том, что в данном случае не добавляли химический ингибитор активности ликопенциклазы. В конце ферментации оценивали продукцию ликопена, как описано в примере 4.
Выходы, полученные путем смешанной ферментации штаммов B. trispora CPA1 (+) и LMA1 (-), составляли 1,2 г/л ликопена в отсутствие имидазола (фиг. 2).
Пример 6
Способ получения ликопена в полукоммерческом ферментере посредством смешанной культуры (+) и (-) штаммов B. trispora с добавлением ингибиторов фермента ликопенциклазы
Штаммы B. trispora CPA1 (+) и CMB2 (-), выбранные, как описано в примерах 2 и 3, культивировали в полукоммерческом ферментере с целью определения выхода ликопена. Для этого получали среду инокуляции со следующим составом на литр: 23 г соевой муки, 47 г маисовой муки, 0,5 г KH2PO4, 0,002 г тиамина гидрохлорида, при рН, доведенном до 6,3. (+) и (-) штаммы высевали раздельно во флаконы объемом 2000 мл, содержащие 500 мл среды, и инкубировали при 25°С и 250 об./мин в течение 44-48 часов.
Каждый штамм переносили в резервуар промежуточного роста, содержащий культуральную среду со следующей композицией на литр: 29 г среды Pharmamedia, 47 г маисовой муки, 0,5 г KH2PO4, 0,002 г тиамина гидрохлорида и 1 г антивспенивателя, при рН, доведенном до 6,0. После инкубации в течение 36-48 ч (+) и (-) штаммы смешивали в отношении 1/10 и 20% смеси использовали для засева основной среды ферментации, которая характеризовалась следующим составом на литр: 44 г соевой муки, 19,5 г маисовой муки, 0,55 г KH2PO4, 3,36 г Na2HPO4, 0,184 г NaH2PO4, 0,0022 г тиамина гидрохлорида, 100 мл растительного масла и 0,175 г антивспенивателя, и начальное рН доводили до 7,5. Среду ферментации инкубировали в течение 100-140 часов при температуре 25-28°С при перемешивании в интервале от 150 и 250 об./мин и аэрации 1-1,5 об./об./м. Между 25-тым и 35-тым часами ферментации добавляли стерильный имидазол до конечной концентрации 0,75 г/л.
Оценку концентрации и чистоты ликопена в конце ферментации проводили, как описано в примере 4. Среднее значение выхода ликопена, полученное в серии различных ферментаций штаммов CPA1 (+) и CMB2 (-), составляло 3,4 г/л (фиг. 2).
Пример 7
Способ получения ликопена в полукоммерческом ферментере посредством смешанной культуры (+) и (-) штаммов B. trispora без добавления ингибиторов фермента ликопенциклазы
Штаммы B. trispora CPA1 (+) и LMA1 (-), выбранные, как описано в примерах 2 и 3, культивировали в полукоммерческом ферментере с целью определения уровня продукции ликопена без добавления ингибиторов фермента ликопенциклазы. Для этого получали среду инокуляции со следующим составом на литр: 23 г соевой муки, 47 г маисовой муки, 0,5 г KH2PO4, 0,002 г тиамина гидрохлорида, при рН, доведенном до 6,3. (+) и (-) штаммы высевали раздельно во флаконы объемом 2000 мл, содержащие 500 мл среды, и инкубировали при 25°С и 250 об./мин в течение 44-48 часов.
Каждый штамм переносили в резервуар промежуточного роста, содержащий культуральную среду со следующим составом на литр: 29 г среды Pharmamedia, 47 г маисовой муки, 0,5 г KH2PO4, 0,002 г тиамина гидрохлорида и 1 г антивспенивателя, при рН, доведенном до 6,0. После инкубации в течение 36-48 ч (+) и (-) штаммы смешивали в отношении 1/10 и 20% смеси использовали для засева основной среды ферментации, которая характеризовалась следующим составом на литр: 44 г соевой муки, 19,25 г кукурузной муки, 0,55 г KH2PO4, 3,36 г Na2HPO4, 0,184 г NaH2PO4, 0,0022 г тиамина гидрохлорида, 100 мл растительного масла и 0,175 г антипенного средства, и ее начальную рН доводили до 7,5. Ферментацию инкубировали в течение 100-140 часов при температуре 25-28°С при перемешивании в интервале от 150 и 250 об./мин и аэрации 1-1,5 об./об./м.
Оценку концентрации и чистоты ликопена в конце ферментации проводили, как описано в примере 4. Среднее значение выхода ликопена, полученное без добавления имидазола в серии различных ферментаций штаммов CPA1 (+) и LMA1 (-), составляло 1,6 г/л (фиг. 2).
Пример 8
Способ получения ликопена путем ресуспендирования биомассы в спирте
Три литра среды ферментации собирали соответственно способу биосинтеза, в котором путь биосинтеза прерван на уровне ликопена. Титр среды составлял 3 г ликопена на литр. Биомассу данной культуральной среды выделяли путем фильтрации через воронку Бюхнера (фарфоровая фильтровальная воронка, которая поддерживает диск бумаги или картона, который действует в качестве фильтровального листа), с получением 750 г влажной биомассы. Влажную биомассу ресуспендировали в 5,2 л азеотропного изопропанола 85/15 и перемешивали в течение 30 минут при 45±5°С. Повторяли получение очищенной биомассы с использованием воронки Бюхнера. Данную биомассу сушили в вакууме в сушильной камере при температуре ниже 45±5°С в течение 18 часов до уменьшения содержания остаточных растворителей/воды ниже 8%. Получали 150 г сухой очищенной биомассы с содержанием ликопена, эквивалентным значению при анализе, равному 5,5%. Сухую биомассу перемалывали в шаровой мельнице и пропускали через сито с размером отверстий 1 мм с получением твердого вещества с таким процентным содержанием, которое обеспечивает экстракцию растворителем.
Экстракцию осуществляли путем смешивания 150 г перемолотой биомассы с 2500 мл изобутилацетата при 70±5°С с длительностью перемешивания, равной 5 минутам. Оставшуюся биомассу отделяли от богатого ликопеном растворителя путем фильтрации на фильтровальной пластине. Оставшуюся биомассу промывали 300 мл горячего изобутилацетата на том же фильтре, смешивая промывочный растворитель с фильтратом. Весь богатый ликопеном изобутилацетат концентрировали в вакууме при поддержании температуры ниже 45±5°С, пока объем не сокращался до 300 мл, после чего некоторая часть ликопена кристаллизовалась. Для выполнения кристаллизации и получения более чистого ликопена добавляли 900 мл изопропанола. Продолжали перемешивание смеси в атмосфере азота в интервале температур 0-5°С в течение 3 часов. Смесь фильтровали на воронке Бюхнера, промывая кристаллы 25 мл изопропанола на воронке Бюхнера. Кристаллы собирали и затем высушивали в вакууме с получением 6,5 г кристаллов ликопена с чистотой 95%, определенной путем спектрофотометрии. Путем HPLC не выявляли присутствия ни других каротиноидов, ни цис-ликопена.
Пример 9
Способ получения композиции ликопена в масляной суспензии
Лабораторную шаровую мельницу типа Minizeta 003 от Netzsch снаряжали в следующем порядке: микросферы с диаметром 0,5-0,75 мм, 23,5 г подсолнечного масла (Koipe), 0,065 г D,L-альфа-токоферола (Merck) и 6,5 г кристаллического ликопена, полученного в примере 8. Смесь перемалывали при 3000 об./мин в течение 5 минут с получением 25 г вязкой жидкости темного красновато-фиолетового цвета. Спектрофотометрический анализ масляной суспензии выявлял содержание ликопена, равное 21%. Путем HPLC не выявляли присутствия ни других каротиноидов, ни цис-ликопена. Кристаллы были менее 10 микрон.
Пример 10
Способ получения ликопена путем прямой обработки среды ферментации спиртом
1500 л среды ферментации ликопена (концентрация ликопена 2,3 г/л) смешивали непосредственно с 4500 литрами азеотропа изопропанол/вода 85/15. После перемешивания в течение 30 мин при 45±5°С биомассу отделяли от жидкости с использованием декантирующей центрифуги. Собирали около 250 кг влажной очищенной биомассы.
Данную биомассу, пропитанную водой и изопропанолом, высушивали в барабанной сушилке в вакууме до достижения остаточного содержания растворитель/вода ниже 8%. Температура сушки составляла 45±5°С, и среднее время нахождения в сушилке составляло 14 часов. Получали 85 кг сухой биомассы с содержанием ликопена, эквивалентным конкретной концентрации, равной 3,75%.
Сухую биомассу подвергали экструзии в компакторе Hutt-Compactor от BEPEX с получением твердого вещества с той же конкретной концентрацией, которая обеспечивает экстракцию растворителем.
Экстракцию осуществляли путем смешивания 85 кг перемолотого твердого вещества с 1650 л изобутилацетата. Смесь нагревали в потоке при 60±5°С в течение примерного среднего времени контакта, равного 2 минутам, и оставшуюся биомассу отделяли от богатого ликопеном растворителя с использованием декантирующей центрифуги. Весь богатый ликопеном изобутилацет концентрировали в вакууме с поддержанием температуры ниже 45±5°С до достижения объема 100 л, после чего часть ликопена кристаллизовалась.
Для выполнения кристаллизации ликопена добавляли 300 л изопропанола. Смесь перемешивали в течение 3 ч при 0-5°С. Ее фильтровали на воронке Бюхнера, собирая кристаллы ликопена, которые высушивали в вакууме при комнатной температуре. Получали 2 кг продукта с чистотой 96%, определенной путем спектрофотометрии. Путем HPLC не выявляли присутствия ни других каротиноидов, ни цис-ликопена.
Пример 11
Способ получения композиции диспергируемого в воде ликопена с использованием в качестве растворителя изобутилацетата
3,5 г ликопена, полученного, как описано в примере 10, ресуспендировали в 410 мл изобутилацетата, и добавляли 0,35 г D,L-альфа-токоферола (Merck). Смесь нагревали до кипения (114°С) в течение 5 мин, обеспечивая полное растворение ликопена. В это же время в 325 мл деминерализованной воды растворяли 12 г Hi-Cap 100 (National Starch) и 12 г Purity Gum 2000® (National Starch). Горячую органическую фазу эмульгировали в течение 5 минут в одну стадию в водной фазе с использованием эмульсификатора Ultraturrax от IKA, с получением среднего размера мицелл 1,2 микрон, измеренного на анализаторе Coulter LS230. Эмульсию переносили в вакуумную систему перегонки, добавляли 600 мл воды, так что 410 мл изобутилацетата упаривалось примерно с 700 мл воды. Получали 203 г жидкого препарата (12,75% сухого вещества) с содержанием ликопена, равным 1,25% (9,8% на основе сухой массы). С использованием HPLC выявляли содержание цис-ликопена, равное 23,3%, но не выявляли других каротиноидов. Данный жидкий препарат диспергировали в лабораторном распылителе Büchi 190 с использованием температуры газа 190°С на входе и 90°С на выходе, с получением порошка темно-красного цвета с содержанием ликопена 8,4% и содержанием воды 6,5%. С использованием HPLC выявляли содержание цис-ликопена, равное 23,3%, но не выявляли других каротиноидов.
Пример 12
Способ получения композиции диспергируемого в воде ликопена с использованием в качестве растворителя изобутилацетата
3,5 г ликопена, полученного, как описано в примере 10, ресуспендировали в 410 мл изобутилацетата, и добавляли 0,35 г D,L-альфа-токоферола (Merck), 0,7 г аскорбилпальмитата (Merck) и 3,5 г подсолнечного масла (Koipe). Смесь нагревали до кипения (114°С) в течение 5 мин, обеспечивая полное растворение ликопена. В это же время в 325 мл деминерализованной воды растворяли 10 г Hi-Cap 100 (National Starch) и 10 г Purity Gum 2000® (National Starch). Горячую органическую фазу эмульгировали в течение 5 минут в одну стадию в водной фазе с использованием эмульсификатора Ultraturrax от IKA, с получением среднего размера мицелл 1,4 микрон, измеренного на анализаторе Coulter LS230. Эмульсию переносили в вакуумную систему перегонки, добавляли 600 мл воды, так что 410 мл изобутилацетата упаривалось примерно с 700 мл воды. Получали 195 г жидкого препарата (13,25% сухого вещества) с содержанием ликопена, равным 1,3% (9,8% на основе сухой массы). С использованием HPLC выявляли содержание цис-ликопена, равное 25%, но не выявляли других каротиноидов. Данный жидкий препарат диспергировали в лабораторном распылителе Büchi 190 с использованием температуры газа 190°С на входе и 90°С на выходе, с получением порошка темно-красного цвета с содержанием ликопена 8,5% и содержанием воды 6,0%. С использованием HPLC выявляли содержание цис-ликопена, равное 24,5%, но не выявляли других каротиноидов.
Пример 13
Способ получения композиции диспергируемого в воде ликопена с использованием в качестве растворителя дихлорметана
7,5 мг кристаллического ликопена, полученного, как описано в примере 10, ресуспендировали в 500 мл дихлорметана, добавляя 0,75 г D,L-альфа-токоферола (Merck) и нагревая смесь при 35°С в течение 5 минут. В это же время в 400 мл дистиллированной воды растворяли 27 г Hi-Cap 100 (National Starch) и 27 г Purity Gum 2000® (National Starch). Органическую фазу эмульгировали в течение 15 минут в одну стадию в водной фазе с использованием эмульсификатора Ultraturrax от IKA, с получением среднего размера мицелл 0,4 микрон, измеренного на анализаторе Coulter LS230. Эмульсию переносили в вакуумную систему перегонки, добавляли 600 мл воды, так что 500 мл изобутилацетата упаривалось примерно с 600 мл воды. Получали 400 г жидкого препарата (13,1% сухого вещества) с содержанием ликопена, равным 1,5% (11,5% на основе сухой массы). С использованием HPLC выявляли содержание цис-ликопена, равное 6,5%, но не выявляли других каротиноидов. Данный жидкий препарат диспергировали в лабораторном распылителе Büchi 190 с использованием температуры газа 190°С на входе и 90°С на выходе, с получением порошка темно-красного цвета с содержанием ликопена 10,6% и содержанием воды 5,3%. С использованием HPLC выявляли содержание цис-ликопена, равное 6,4%, но не выявляли других каротиноидов.
Пример 14
Способ получения композиции диспергируемого в воде ликопена с использованием в качестве растворителя дихлорметана
7,5 мг кристаллического ликопена, полученного, как описано в примере 10, ресуспендировали в 500 мл дихлорметана, добавляя 0,75 г D,L-альфа-токоферола (Merck) и нагревая смесь при 35°С в течение 5 минут. В это же время в 400 мл дистиллированной воды растворяли 27 г Hi-Cap 100 (National Starch) и 27 г Purity Gum 2000® (National Starch). Органическую фазу эмульгировали в течение 60 минут в одну стадию в водной фазе с использованием эмульсификатора Ultraturrax от IKA, с получением среднего размера мицелл 0,23 микрон, измеренного на анализаторе Coulter LS230. Эмульсию переносили в вакуумную систему перегонки, добавляли 600 мл воды, так что 500 мл изобутилацетата упаривалось примерно с 600 мл воды. Получали 350 г жидкого препарата (14,4% сухого вещества) с содержанием ликопена, равным 1,6% (11,4% на основе сухой массы). С использованием HPLC выявляли содержание цис-ликопена, равное 20%, но не выявляли других каротиноидов. Данный жидкий препарат сушили вымораживанием в лабораторном приборе в течение 24 часов, с получением рыхлого порошка темно-красного цвета с содержанием ликопена 10,7% и содержанием воды 7,4%. С использованием HPLC выявляли содержание цис-ликопена, равное 15%, но не выявляли других каротиноидов.
Подробное описание диаграмм
Фиг. 1. Продуцирование ликопена смешанной ферментацией штамма B. trispora CPA1 (+) во флаконе с каждым из следующих штаммов B. trispora (-): L25, CMA1, CMA2, CMA3, CMA4, CMB1, CMB2 и LMA1. Кроме смешанной ферментации CPA1 (+) / LMA1 (-) в качестве ингибитора фермента ликопенциклазы добавляли имидазол. Ордината: % продукции относительно контрольного штамма L25 (-) (VKPM F-744).
Фиг. 2. Продуцирование ликопена смешанной ферментацией штамма B. trispora CPA1 (+) в ферментере с каждым из следующих штаммов B. trispora (-): L25, CMA1, CMA2, CMA3, CMB1, CMB2 и LMA1. Кроме смешанной ферментации CPA1 (+) / LMA1 (-) в качестве ингибитора фермента ликопенциклазы добавляли имидазол. Ордината: % продукции относительно контрольного штамма L25 (-) (VKPM F-744).
Формула изобретения
1. Способ получения ликопена из биосинтетических источников, отличающийся тем, что он включает следующие стадии:
a) смешивание (+) и (-) штаммов-гиперпродуцентов ликопена Blakeslea trispora, возраст вегетативной стадии роста которых контролируется, в биомассу культуральной среды при подходящих условиях ферментации для продукции ликопена, где (+) штамм представляет собой СРА1(+), а (-) штамм выбирается из группы, состоящей из L25(-), CMA1(-), СМА2(-), СМА3(-), СМА4(-), СМВ1(-), СМВ2(-), LMA1(-) или их комбинаций;
b) обработка биомассы культуральной среды со стадии а) спиртом и отделение влажной очищенной биомассы;
c) обработка влажной очищенной биомассы путем сушки и дезинтеграции или разрушения;
d) твердофазная экстракция ликопена, содержащегося в очищенной биомассе, органическим растворителем при контроле температуры и времени растворения в зависимости от используемого органического растворителя;
e) концентрирование обогащенного экстракта ликопена;
f) осаждение/кристаллизация ликопена из концентрированного экстракта путем добавления спирта;
g) фильтрация и сушка;
h) получение препарата.
2. Способ по п.1, где используемые для инокуляции штаммы имеют возраст, равный 30-60 ч, предпочтительно 48 ч, с числом высеваемых спор, равным 800-1000 спор/мл для (+) штаммов и 40000-60000 спор/мл для (-) штаммов, при посеве 0,1% об./об. каждой среды инокуляции в фазу первичной культуры.
3. Способ по п.2, в котором возраст первичных культур изменяется от 30 до 60 ч, предпочтительно от 36-48 ч.
4. Способ по п.1, в которых (-) и (+) штаммы Blakeslea trispora, смешанные в биомассе культуральной среды, представляют собой соответственно VKPM F-744 и VKPM F-816 или полученные от них путем селекции штаммы-гиперпродуценты.
5. Способ по п.1, отличающийся тем, что на стадии а) смешанные культуры (-) и (+) штаммов Blakeslea trispora, которые продуцируют ликопен, используют в отсутствие соединений, которые являются ингибиторами активности ликопенциклазы.
6. Способ по п.1, отличающийся тем, что на стадии а) смешанные культуры (-) и (+) штаммов Blakeslea trispora, которые продуцируют ликопен, используют в присутствии соединений, которые являются ингибиторами активности ликопенциклазы.
7. Способ по п.6, характеризующийся добавлением имидазола во время процесса ферментации в качестве ингибитора активности ликопенциклазы.
8. Способ по п.7, отличающийся тем, что имидазол добавляют между 0-вым и 50-тым часами ферментации, предпочтительно, между 25-тым и 35-тым часами.
9. Способ по п.7 или 8, отличающийся тем, что поддерживается концентрация имидазола от 0,7 до 0,8 г/л, предпочтительно на уровне 0,75 г/л.
10. Способ по п.6, отличающийся тем, что, по меньшей мере, 3,4 г/л ликопена продуцируется на 5-6 сутки культивирования в полукоммерческом или пилотном ферментере.
11. Способ по п.4, отличающийся тем, что, по меньшей мере, 1,6 г/л ликопена продуцируется на 5-6 сутки культивирования в полукоммерческом или пилотном ферментере.
12. Способ по п.1, отличающийся тем, что
i) инокулят (+) штамма В. trispora высеивают из расчета 800-1000 спор/мл.
ii) инокулят (-) штамма В. trispora высеивают из расчета 10000-60000 спор/мл.
iii) инокулят (+) и (-) штаммов В. trispora культивируют, по меньшей мере, в течение 48 ч при 25°С.
iv) фазы первичной культуры (+) штамма В. trispora высевают, по меньшей мере, при 0,1% (об./об.) фазы инокуляции.
v) фазы первичной культуры (-) штамма В. trispora высевают, по меньшей мере, при 0,1% (об./об.) фазы инокуляции.
vi) первичные фазы (+) штамма В. trispora культивируют в течение 36-48 ч при 26°С.
vii) первичные фазы (-) штамма В. trispora культивируют в течение 36-48 ч при 28°С.
viii) первичные фазы (+) и (-) штаммов В. trispora смешивают в отношениях 1(+)/10(-) (об./об.).
ix) каждый ферментер засевают 10-20%-ной (об./об.) смесью (+) и (-) штаммов В. trispora, описанной в параграфе viii.
х) смешанную культуру инкубируют в течение 5-6 суток при 26°С.
13. Способ по п.12, отличающийся тем, что, по меньшей мере, 3,6 г/л ликопена продуцируется на 5-6 сутки культивирования.
14. Способ по п.13, отличающийся тем, что, по меньшей мере, 30 мг ликопена продуцируется на грамм сухой массы мицелия на 5-6 сутки культивирования.
15. Способ по п.1, отличающийся тем, что стадия b) проводится путем предварительного отделения биомассы от культуральной среды и ресуспендирования указанной биомассы в спирте, при соотношении спирт/биомасса в интервале 1 мл/г – 10 мл/г.
16. Способ по п.1, отличающийся тем, что на стадии b) спирт используют при температуре от 0°С до той, что соответствует точке его кипения, предпочтительно от 10 до 50°С.
17. Способ по п.1, отличающийся тем, что стадия b) проводится непосредственно путем смешивания культуральной среды ферментации, содержащей биомассу, без предварительного отделения указанной биомассы, со спиртом при отношении среда/спирт между 1/0,5 и 1/5, предпочтительно при отношении между 1/1 до 1/3, при температуре от комнатной температуры до точки кипения смеси, предпочтительно от комнатной температуры до 60°С.
18. Способ по п.1, отличающийся тем, что растворитель сложноэфирного типа, предпочтительно этилацетат, пропилацетат, изопропилацетат, н-бутилацетат или изобутилацетат, используют на стадии d) твердофазной экстракции.
19. Способ по п.18, отличающийся тем, что используемое количество растворителя находится в интервале 5-30 мл на г биомассы, полученной на стадии с).
20. Способ по п.18 или 19, отличающийся тем, что, когда используемый растворитель представляет собой изобутилацетат, экстракцию проводят при температурах в интервале 60-70±5°С.
21. Способ по п.20, отличающийся тем, что растворитель используют таким образом, что время контакта с ликопеном составляет менее 15 мин, предпочтительно 2-5 мин.
22. Способ по п.1, отличающийся тем, что на стадии f) преципитация/кристаллизация концентрированного продукта после экстракции осуществляется путем добавления растворителя, в котором ликопен обладает низкой растворимостью, такого как метанол, этанол, пропанол или изопропанол, и который обеспечивает то, что вещества липофильного характера, присутствующие совместно с ликопеном, останутся растворенными.
23. Способ по п.1, в котором стадия h) получения препарата состоит из образования микрокристаллической суспензии ликопена путем предварительного смешивания кристаллов ликопена, антиоксидантов и масел в подходящих отношениях, с последующим перемалыванием.
24. Способ по п.23, в котором используемое масло имеет растительное происхождение, предпочтительно, из подсолнечника, оливы, маиса, хлопкового семени или сои.
25. Способ по п.23, отличающийся тем, что перемалывание осуществляется в шаровой мельнице.
26. Способ по пп.23-25, отличающийся тем, что используются жирорастворимые антиоксиданты, предпочтительно природные токоферолы, в количестве от 0,2 до 15%, предпочтительно 0,5-5% относительно массы ликопена в смеси.
27. Способ по п.1, в котором стадия h) получения препарата включает получение диспергируемого в холодной воде (CWD) ликопена посредством способа, который включает следующие стадии:
i) растворение кристаллического ликопена в присутствии соединений-антиоксидантов в органическом растворителе,
ii) эмульгирование и/или микроинкапсулирование указанной выше органической фазы в водном растворе модифицированных крахмалов,
iii) удаление растворителя и некоторой части воды путем испарения с получением жидкого препарата,
iv) сушка и окончательная обработка.
28. Способ по п.27, отличающийся тем, что в качестве растворителя на стадии i) растворения ликопена используют метиленхлорид.
29. Способ по п.27, отличающийся тем, что в качестве растворителя на стадии i) растворения ликопена используют сложные эфиры кислот, в частности этил-, пропил-, изопропил-, н-бутил- или изобутилацетат.
30. Способ по п.27, отличающийся тем, что на стадии i) растворения ликопена используют один или смесь антиоксидантов, предпочтительно антиоксиданты типа токоферола или аскорбилпальмитата, в количестве 1-30%, предпочтительно 10-20% относительно массы ликопена.
31. Способ по п.27, отличающийся тем, что на стадии i) растворения ликопена в органическом растворителе дополнительно используют растительные масла.
32. Способ по п.27, отличающийся тем, что на стадии ii) в качестве эмульгирующих средств и/или средств микроинкапсулирования используют модифицированные крахмалы предпочтительно в виде сложных эфиров и более предпочтительно сложных эфиров октенилсукцинатов.
33. Способ по п.27, отличающийся тем, что стадия iv) сушки жидкого препарата осуществляется способом, выбранным из распыления путем высокотемпературного диспергирования, гранулирования путем распыления в псевдоожиженном слое при относительно низкой температуре или сушки вымораживанием.
34. Способ по п.33, в котором сушка путем гранулирования, выполняемая на стадии iv), проводится путем распыления, и диспергированный продукт, полученный при этом, дополнительно агломерируют в процессе с псевдоожиженным слоем путем распыления раствора одного из модифицированных крахмалов или суспендирования самого микроинкапсулированного ликопена, с получением таким образом гранулированного продукта с увеличенным размером частиц.
35. Способ по п.33, в котором гранулирование включает распыление суспензии микроинкапсулированного ликопена через начальный материал, предпочтительно инертный материал и более предпочтительно частицы сахара или тонкий порошок ранее гранулированного материала.
36. Способ по п.27, отличающийся тем, что на стадии iv) окончательная обработка состоит в покрытии частиц водными растворами сахаров или модифицированных крахмалов в количестве 0,5-10%.
37. Кристаллический ликопен, получаемый способом по пп.1-22, обладающий кристаллической чистотой, определяемой спектрофотометрическим поглощением кристаллов в н-гексане при 472 нм (EI%/1 см =3450), большим, чем 95%, причем содержание других каротиноидов составляет менее 3% и содержание цис-ликопена также составляет менее 3%.
38. Композиция ликопена, состоящая из масляной суспензии кристаллического ликопена по п.37, имеющая размер кристаллов ликопена менее 10 мкм, предпочтительно менее 5 мкм и более предпочтительно менее 2 мкм, применяемая в качестве красителя в пищевой, фармацевтической и косметической отраслях.
39. Композиция ликопена, состоящая из масляной суспензии кристаллического ликопена по п.37, имеющая размер кристаллов ликопена менее 10 мкм, предпочтительно менее 5 мкм и более предпочтительно менее 2 мкм, применяемая в качестве диетической добавки.
40. Композиция диспергируемого в холодной воде ликопена, полученная способом по пп.1-22 и 27-36, состоящая из микрокристаллов распыленного ликопена со средним размером частиц от 10 до 100 мкм, применяемая в качестве красителя в пищевой, фармацевтической и косметической отраслях.
41. Композиция диспергируемого в холодной воде ликопена, полученная способом по пп.1-22 и 27-36, состоящая из агломератов микрокристаллов распыленного ликопена, со средним размером частиц в интервале 50-500 мкм, предпочтительно в интервале 200-300 мкм, применяемая в качестве красителя в пищевой, фармацевтической и косметической отраслях.
42. Композиция диспергируемого в холодной воде ликопена, полученная способом по пп.1-22 и 27-36, состоящая из гранул микрокристаллов ликопена со средним размером частиц от 100 до 2000 мкм, предпочтительно от 100 до 800 мкм и более предпочтительно от 100 до 300 мкм, применяемая в качестве красителя в пищевой, фармацевтической и косметической отраслях.
43. Композиция диспергируемого в холодной воде ликопена, полученная способом по пп.1-22 и 27-36, состоящая из микрокристаллов распыленного ликопена со средним размером частиц от 10 до 100 мкм, применяемая в качестве диетической добавки.
44. Композиция диспергируемого в холодной воде ликопена, полученная способом по пп.1-22 и 27-36, состоящая из агломератов микрокристаллов распыленного ликопена со средним размером частиц в интервале 50-500 мкм, предпочтительно в интервале 200-300 мкм, применяемая в качестве диетической добавки.
45. Композиция диспергируемого в холодной воде ликопена, полученная способом по пп.1-22 и 27-36, состоящая из гранул микрокристаллов ликопена со средним размером частиц от 100 до 2000 мкм, предпочтительно от 100 до 800 мкм и более предпочтительно от 100 до 300 мкм, применяемая в качестве диетической добавки.
46. Композиция диспергируемого в холодной воде ликопена по пп.40-45, состоящая из покрытых частиц, в которых покрытие составляет 0,5-10% по сухой массе водных растворов сахаров или модифицированных крахмалов.
47. Применение кристаллического ликопена по п.37 в качестве красителя, в частности в пищевой, фармацевтической и косметической отраслях.
48. Применение кристаллического ликопена по п.37 в качестве диетической добавки.
РИСУНКИ
|
|